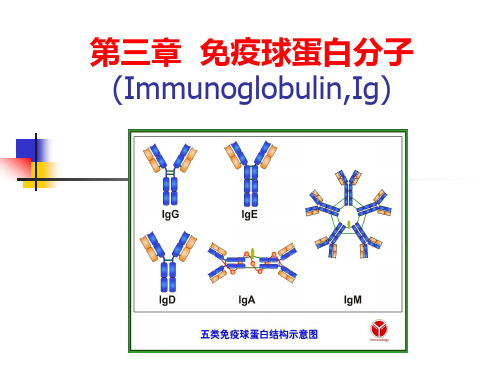
免疫球蛋白分子ImmunoglobulinIg
简述免疫球蛋白的主要生物学功能

免疫球蛋白的主要生物学功能
免疫球蛋白(Immunoglobulin,简称Ig)是在机体的免疫系统作用下产生的一类高分子蛋白质,具有重要的生物学功能。
主要包括以下功能:
1. 抗原结合和识别:免疫球蛋白可以与各种抗原结合,从而识别和分离出体内外的病原微生物和其他异物。
2. 中和作用:IgM可以通过识别抗原与之结合,形成大量的团聚物质,进而失去其活性,使细菌不能定植于宿主细胞表面,以致对人体组织的破坏被最小化;IgG抗体与病毒互相作用而产生中和作用,病毒就变得无法攻击宿主细胞。
3. 激活补体系统:通过IgG、IgM与抗原的结合,可以激活补体系统,促进细胞溶解,这是身体的一种特殊的免疫反应。
4. 促进细胞媒介的清除作用:如,IgE是重要的变态反应抗体,驱动果胶酵素等介质的释放,导致免疫细胞如嗜酸粒细胞等在局部聚集活动,破坏病原体。
5. 传递母体免疫力:胎盘、母乳等正常情况下可以吸收母亲对多种病原体所产生的抗体为胎儿或婴儿抵抗感染提供基础免疫。
总之,免疫球蛋白在机体免疫中扮演着非常重要的角色,能够识别和清除病原微生物和其他异物,从而保障人体的健康和免疫系统不受到破坏。
免疫球蛋白的主要功能

免疫球蛋白的主要功能免疫球蛋白(Immunoglobulin,Ig)是人体免疫系统中重要的组成部分,主要由B淋巴细胞分泌。
它是一种特殊的蛋白质,具有广泛的功能,包括抗体的形成、抗原结合和修饰、抗微生物活性以及调节免疫反应等。
以下将详细介绍免疫球蛋白的主要功能。
1.抗体形成:免疫球蛋白在人体免疫系统中的主要功能是作为抗体。
当机体受到外来抗原(如细菌、病毒等)的侵入时,免疫球蛋白可以识别并结合抗原,形成特异性抗体,从而参与抗原的清除和消灭。
2.抗原结合和修饰:免疫球蛋白具有强大的结合能力,可以特异性地结合抗原,包括微生物表面的蛋白质、糖蛋白和脂质等分子。
通过结合和修饰抗原,免疫球蛋白能够改变抗原的特性,使之更易于被免疫系统识别和清除。
3.抗微生物活性:免疫球蛋白不仅可以帮助机体清除侵入的抗原,还可以直接对微生物产生抗菌、抗病毒和抗真菌的作用。
例如,IgG和IgA可以中和病毒和细菌的毒力,阻止其入侵机体细胞;IgM和IgG能够激活补体系统,引起微生物的溶解。
4.修饰免疫反应:免疫球蛋白能够调节机体的免疫反应。
它可以与其他免疫细胞相互作用,通过信号传导调节细胞免疫反应和体液免疫反应。
此外,免疫球蛋白还能够抑制炎症反应,减轻免疫系统对自身组织的损伤。
5.输运和保护:免疫球蛋白可以在体内输送各种物质,如激素、营养物质、药物和细菌毒素等。
同时,免疫球蛋白能够保护胎儿的免疫系统,通过胎盘传递母体的免疫球蛋白,为婴儿提供初期的免疫保护。
总的来说,免疫球蛋白在免疫系统中具有多种功能,包括作为抗体的形成、抗原结合和修饰、抗微生物活性、修饰免疫反应以及输运和保护等。
这些功能共同作用,保护机体免受外界病原微生物的侵害,并维持机体的免疫平衡和稳态。
第二章 免疫分子 1 2 Ig和补体系统

第五章 免疫分子第一节 免疫球蛋白( Immunoglobulin, Ig )免疫球蛋白(immunoglobulin,Ig)包括成熟B 细胞的膜表面Ig(SmIg)和某个B 细胞克隆受抗原刺激、激活、分化、转化为浆细胞后分泌的Ig 。
由于Ig 具有与相应抗原发生特异结合的功能,故称为抗体(antibody,Ab)。
在人体内约有1×107个B 细胞克隆,各个B 细胞克隆的SmIg 分子的VL 、VH 结构都不一样,能识别差异极其微小的各种抗原决定簇,产生相应的Ig 分子。
分泌于血清中的Ig 分子结构极不均一,与抗原结合的特异性千差万别,Ig 自身表现的抗原性(血清型)也多种多样。
关于Ig 产生的遗传控制及多样性的起源,遗传学家们一直在进行研究,并存在分歧,提出的学说主要有胚系学说、体细胞突变学说和基因重排学说。
随着分子生物学技术的发展,基因重排学说不断被实验证实和完善,受到普遍赞同。
一、免疫球蛋白分子的基本结构Ig 分子的基本结构为,两条相同的轻链(light chain, L 链)在两条相同的重链(heavy chain, H 链)外侧,L 链和H 链之间,H 链与H 链之间,由二硫键连接成一个“Y ”字型。
每条L 链由210~230氨基酸组成,分子量约23ku ,每条H 链由420~446个氨基酸组成,分子量50~70ku 。
所有Ig 的L 链和H 链从氨基端起的100多个氨基酸的组成和顺序多变,称为可变区(variable region, V 区),L 链的V 区(VL)由108个氨基酸组成,H 链的V 区(VH)由107~130个氨基酸组成,VL 和VH 共同组成与相应抗原决定簇结合的部位。
在VL 和VH 中氨基酸组成的变化仅集中3个区域(占氨基酸总量的15%~20%),称为超变区(hypervariable region, HV)。
超变区是Ig 与抗原结定簇结合的互补决定区(complementarity-determining region,CDR)。
蛋白防御功能之免疫球蛋白

蛋白防御功能之免疫球蛋白免疫球蛋白(英文:immunoglobulin,ig)是一组具有抗体活性的蛋白质,ig由浆细胞产生,主要存在于生物体血液和和其他体液(包括组织液和外分泌液)中,约占血浆蛋白总量的20%;还可分布在b细胞表面。
免疫球蛋白分子的功能Ig是体液免疫应答中发挥免疫功能最主要的免疫分子,免疫球蛋白所具有的功能是由其分子中不同功能区的特点所决定的。
(一)特异性结合抗原Ig最显著的生物学特点是能够特异性地与相应的抗原结合,如细菌、病毒、寄生虫、某些药物或侵入机体的其他异物。
Ig的这种特异性结合抗原特性是由其V区(尤其是V区中的高变区)的空间构成所决定的。
Ig的抗原结合点由L链和H链超变区组成,与相应抗原上的表位互补,借助静电力、氢键以及范德华力等次级键相结合,这种结合是可逆的,并受到pH、温度和电解浓度的影响。
在某些情况下,由于不同抗原分子上有相同的抗原决定簇,或有相似的抗原决定簇,一种抗体可与两种以上的抗原发生反应,此称为交叉反应(cross reaction)。
抗体分子可有单体、双体和五聚体,因此结合抗原决定簇的数目(结合价)也不相同。
Fab段为单价,不能产生凝集反应和沉淀反应。
F(ab')2和单体Ig(如IgG、IgD、IgE)为双价。
双体分泌型IgA有4价。
五聚体IgM理论上应为10价,但实际上由于立体构型的空间位阻,一般只有5个结合点可结合抗原。
B细胞表面Ig(SmIg)是特异性识别抗原的受体,成熟B细胞主要表达SmIgM和SmIgD,同一B细胞克隆表达不同类SmIg其识别抗原的特异性是相同的。
(二)活化补体1.IgM、IgG1、IgG2和IgG3可通过经典途径活化补体。
当抗体与相应抗原结合后,IgG 的CH2和IgM的CH3暴露出结合C lq的补体结合点,开始活化补体。
由于Clq6个亚单位中一般需要2个C端的球与补体结合点结合后才能依次活化Clr和Cls,因此IgG活化补体需要一定的浓度,以保证两个相邻的IgG单体同时与1个Clq分子的两个亚单位结合。
免疫球蛋白的种类及其生物学活性

免疫球蛋白的种类及其生物学活性免疫球蛋白(Immunoglobulin,简称Ig)是一类在哺乳动物体内产生的抗体分子,可与外来的抗原结合。
人体内的免疫球蛋白有五种类型:IgG、IgA、IgM、IgD和IgE。
每一种免疫球蛋白都有其特定的生物学作用。
IgG是人体内数量最多的免疫球蛋白,约占总免疫球蛋白的70-80%。
IgG是一种重链为γ的免疫球蛋白,其生物学活性主要集中在中和作用、增强效应和免疫调节等方面。
IgG可与特定的抗原结合并中和其生物活性,从而抑制病原体的生长和繁殖。
此外,IgG还可以在白细胞的表面意义到免疫细胞和病原体之间的信号传递,从而增强人体的免疫响应。
IgG还参与了抗体依赖性细胞介导的细胞毒作用(Antibody-Dependent Cell-Mediated Cytotoxicity,ADCC),这种作用可以启动细胞免疫反应、消灭感染细胞和抗肿瘤细胞。
IgA是体液免疫中重要的成分之一,它的重链为α,主要位于人体表面的黏膜组织的分泌物和排泄物中。
IgA的主要生物学活性是限制和预防病原体在进入黏膜表面或上皮细胞的过程中引发感染,保持黏膜间隙的清洁和和健康状态。
IgA通过凝集、沉淀和中和等手段清除病原体,同时激活了分泌液和表皮细胞的免疫反应,促进组织修复。
IgM是第一个产生的抗体,其重链为μ,它是一种多聚体免疫球蛋白,由五个单元组成,总分子量约为900kD。
IgM具有高度的亲和力和复制能力,使其能够识别不同的抗原,增强人体对病原体的清除能力。
IgM也可以在血液中隔离和结合免疫元素,诱导一系列复杂的响应,从而加强人体的免疫反应。
IgD的生物学活性不够清楚,仍在研究中。
IgD的重链为δ,IgD存在于B细胞的表面,并参与了B细胞的抗原识别和分化过程中,为B细胞维持其正常状态。
IgE的重链为ε,IgE存在于组织细胞表面和体液中,是参与免疫学反应中神经递质释放和炎症反应的重要组分。
IgE可以结合到体内有害抗原上,激活肥大细胞和嗜酸性粒细胞产生过敏性反应,从而引发变态反应和过敏症状。
五种免疫球蛋白的特点

五种免疫球蛋白的特点
免疫球蛋白(Immunoglobulin,Ig)是一类在机体免疫应答中起关键作用的蛋白质。
在人体中,主要有五种免疫球蛋白,即IgG、IgM、IgA、IgD和IgE。
每种免疫球蛋白都具备一些独特的特点,下面是它们的主要特点:
1. IgG:
- IgG是最常见的免疫球蛋白,约占全部免疫球蛋白的75%。
- IgG在全身循环中起到保护机体免受感染的作用,可以穿过胎盘进入胎儿体内。
- IgG能够识别病原体、中和毒素以及增强其他免疫细胞的功能。
2. IgM:
- IgM是首次出现在免疫应答中的免疫球蛋白。
- IgM以多聚体形式存在,具有很高的亲和力和中和力,起到早期清除病原体的作用。
- IgM可以激活补体系统,促进炎症反应。
3. IgA:
- IgA主要存在于黏膜表面和体液中,是黏膜免疫的主要免疫球蛋白。
- IgA能够阻止病原体侵入黏膜表面,起到抵抗感染的作用。
- IgA还能够通过凝集病毒和细菌来清除它们。
4. IgD:
- IgD只存在于B淋巴细胞表面,具体功能尚不明确。
- IgD可能在B细胞的活化和调节过程中起到一定的作用。
- IgD的浓度很低,在循环血液中很少见。
5. IgE:
- IgE是与过敏和变态反应密切相关的免疫球蛋白。
- IgE参与免疫细胞对害虫(如寄生虫)的防御。
- IgE还参与过敏反应,如过敏性鼻炎、哮喘和荨麻疹等。
3 免疫球蛋白分子(Immunoglobulin,Ig)
二 、 基因重排与转录:一种V区基因可与多 种不同C基因连接,一种C 区基因可与多种不 同V基因连接(RSS: 5’ 7-12-9; 3’ 7-23-9)
三 类别转换:类别转换重组酶, CD40+CD40L/启动类别转换 IL4/IgM--IgE TGF/IgG--IgA 四 遗传特点:等位基因排斥,多基因 控制一条多肽链合成。 五 抗体多样性及其机制 1 外因:抗原多样性 2 内因:胚系基因多样性,连接多样性, 体细胞突变,组装多样性。
1.识别抗原(TCR/BCR,MHCI/MHCII) 2.信号转导(CD4/CD8) 3.活化细胞(CKR) 4.粘附细胞(AM) 5.参与抗体转运(FcR)
第三节 Ig基因的遗传控制:
一 、基因定位及基因库:
K--2 λ—22号染色体 基因库:H-VDJC K/λ-VJC H:V/51--D/30--J/6 Cμα1.2γ1.2.3.4δε/9 Mu;Delta;Alpha;Gamma;Epsilon IgM IgD IgA IgG IgE K:v/50 J/5 C/1 λ:V/50 J/7 C/7
2 制备过程(preparation) : 五步
Immune B cell+myeloma→hybridoma →clonal →positive clones expand →get antibody
免疫脾细胞+瘤细胞→杂交瘤细胞→克隆化 →阳性克隆筛选→转感度。 4 应用:诊断治疗及科研工作。
第三章 免疫球蛋白分子 (Immunoglobulin,Ig)
内容简介
Ig概述 2. IgSF概念、组成及功能 3. Ig基因遗传控制 4. 抗体的人工制备 5. Ig异常与疾病
免疫球蛋白吸收方式

免疫球蛋白吸收方式
免疫球蛋白(Immunoglobulin,简称Ig)是一种具有免疫作用的蛋白质,可通过多种方式进行吸收。
口服吸收:目前已有口服免疫球蛋白的制剂上市。
口服免疫球蛋白需要经过胃肠道屏障的消化吸收,但由于Ig分子较大,口服吸收效率较低。
皮下注射吸收:皮下注射免疫球蛋白可直接进入血液循环,但需要多次注射,且注射后可能出现疼痛和肿胀等不良反应。
静脉注射吸收:静脉注射免疫球蛋白可快速进入血液循环,但需要在医院进行,费用较高,且注射后可能出现过敏反应等不良反应。
肌肉注射吸收:肌肉注射免疫球蛋白需要多次注射,但相比皮下注射,注射剂量较大,效果更好。
但同样需要注意不良反应。
总的来说,不同的吸收方式各有优缺点,需要根据病情和医生建议选择合适的吸收方式。
同时,需要注意不良反应和剂量等问题。
- 1 -。
免疫球蛋白

mAb结构高度均一,其Ag结合部位和同种型都相同。
因此具有以下特点: ①结构均一、纯度高; ②特异性强; ③交叉反应少;
④效价高;
⑤制备成本低,可大量生产。 在疾病的预防、诊断和治疗上有广泛的用途。 缺点是①对人具有较强的免疫原性;②体外抗原抗体 结合试验不易出现可见反应。
总结:
针对不同抗原的IgG,V区不同,C区相同; 针对同一抗原的抗体,有不同类别,如 IgG、IgM、IgA,它们V区相同,H链C区不同。
(四)铰链区(hinge region) 位于H链CH1和CH2之间,由2-5个链内二硫键、CH1尾部和CH2 头部的小段肽链构成,约含30个氨基酸残基(209-240) 脯氨酸残基含量较多,不易构成氢键;富含半胱氨酸,参与 形成重链间的二硫键,重链间二硫键多集中在铰链区;这些 均妨碍螺旋结构的形成,肽链比较舒展,容易弯曲 有利于Ab的两个Ag结合部位能与不同距离的Ag表位结合 有利于Ig分子变构,暴露补体结合位点 是各种蛋白酶的敏感部位 无铰链区的Ig:IgM、IgE
(二)可变区和恒定区
1. 可变区(variable region,V区):免疫球蛋白轻链和 重链中靠近N端氨基酸序列变化较大的区域称为可变区。
由110个左右氨基酸残基组成
分别占重链和轻链的1/4和1/2 H链和L链的V区分别称为VH和VL
γ
不同Ig的V区序列不同,决定抗体与抗原 结合的特异性
κ λ
基本结构
* 由两条相同的重链和两条相同的轻链通过二硫键连接而成 的四肽链分子。
免疫球蛋白的结构特点

免疫球蛋白的结构特点免疫球蛋白(Immunoglobulin,Ig)是一类高度特异性的抗体分子,是机体免疫系统中的重要组成部分。
它具有多种结构特点,这些特点使得免疫球蛋白在抗原识别和免疫应答中发挥重要作用。
免疫球蛋白的结构由四个多肽链组成,分为两对相同的重链和轻链。
重链是较大的多肽链,分为五个不同的类别:IgM、IgD、IgG、IgA和IgE。
轻链是较小的多肽链,分为两个亚型:κ型和λ型。
这种四肽链的结构决定了免疫球蛋白的特异性和功能。
免疫球蛋白的重链和轻链都具有相似的结构特点。
每条链由一系列的可变区(variable region)和恒定区(constant region)组成。
可变区决定了免疫球蛋白的特异性,它包含了与抗原结合的位点。
恒定区则决定了免疫球蛋白的功能,如与免疫细胞的相互作用等。
免疫球蛋白的可变区具有高度的多样性。
可变区由一系列的互补决定区(complementarity-determining region,CDR)和框架区(framework region)组成。
CDR位于框架区内,是决定抗原结合位点的关键区域。
由于CDR的高度多样性,免疫球蛋白能够识别和结合各种不同的抗原。
免疫球蛋白的重链和轻链通过二硫键连接在一起,形成抗体的完整结构。
这种连接方式使得免疫球蛋白具有较高的稳定性和抗变性,能够抵抗外界环境的影响。
此外,免疫球蛋白的重链和轻链还通过非共价相互作用力(如氢键、离子键等)稳定地结合在一起。
免疫球蛋白具有两个重要的功能区域:Fc区和Fab区。
Fc区位于免疫球蛋白的恒定区,它决定了免疫球蛋白的效应功能,如与免疫细胞的结合、激活补体系统等。
Fab区位于免疫球蛋白的可变区,它决定了免疫球蛋白的抗原结合能力。
Fab区可以与抗原特异性结合,从而介导免疫球蛋白的抗原识别和中和作用。
总结起来,免疫球蛋白的结构特点包括:由四个多肽链组成、重链和轻链具有可变区和恒定区、可变区具有高度的多样性、重链和轻链通过二硫键连接、具有Fc区和Fab区等。
免疫球蛋白G(IgG)

④ 连接多样性理论。编码κ轻链的第3可变区中第96位氨基酸的核苷酸,可因V,J片段结合时顺序的不同而产生多样性。这种连接顺序的多样性也存在于重链中。
⑤ 多框架中D基因翻译的多样性。D基因编码Ig多样性时,按照三种框架进行翻译。首先是最合适的框架,其次为向前框架或向后框架。每一种翻译形式都可指导一个D片段翻译成多种氨基酸的顺序。具体到一个B细胞究竟采取哪一种形式,多取决于产生抗体的特异性。
② IgM。IgM在Ig中分子量最大,通常称为巨球蛋白,占血清Ig总量的10%。在电子显微镜下观察,IgM由五个基本结构相同的单体组成。各单位间由一条连结链(J链)连结成“星状”的五聚体。IgM是在个体发育过程中最早产生的抗体,也是经抗原刺激的动物体内最先出现的抗体,因此检查IgM的含量,有助于传染病的早期诊断。IgM在胎儿3个月后即开始合成,但水平很低,1~2岁时血清中IgM含量达到成人水平。通过结合补体,IgM有溶解细菌和溶解血细胞的作用,并能中和病毒,其效能比IgG高100倍以上。很多抗微生物的天然抗体、同族血凝素(抗A型与抗B型血)、类风湿病中的类风湿因子以及梅毒的补体结合抗体都属于IgM。
免疫球蛋白分子的生物功能 Ig分子具有结合抗原和刺激抗体生成的双重功能(表2)。首先,它能与抗原结合,产生多种生物效应,包括:①与病原微生物或它分泌的毒素结合,产生抗感染免疫;②活化体液的一类正常组分,即补体分子,起到杀伤病原体或靶细胞的作用;③加强吞噬细胞等免疫细胞的吞噬或杀伤效应;④与组织中的肥大细胞或嗜碱性粒细胞结合,产生过敏反应;⑤封闭移植的脏器,增强对它的保护,减缓排斥;⑥封闭肿瘤细胞,降低免疫保护。免疫球蛋白还能穿过胎盘输送给胎儿。此外,由于Ig分子由糖蛋白组成,所以除了上述抗体活性,还有抗原性,可活化自身免疫细胞,使之产生针对抗体的抗体──抗独特型抗体(Id抗体),从而形成自身调节的功能。 各类免疫球蛋白的特性 五类Ig在理化及生物学特性上各有不同。
免疫球蛋白的结构与功能THESTRUCTUREANDFUNCTION.

二、 Ig 与浆细胞疾病
浆细胞是B淋巴细胞增殖分化的最终细胞,它 具有分泌Ig功能.浆细胞疾病有多发性骨髓瘤,巨 球蛋白血症和重链症等. 多发性骨髓瘤是浆细胞的一种恶性肿瘤,它是 单细胞株在无抗原刺激下的无限增生所致. 巨球蛋白血症是一种B淋巴细胞肿瘤增殖,史 血中单克隆IgM增多的疾病. 重链病是生成一不完整的重链分子,无轻链存 在.
三、Ig分子的酶解碎片
•木瓜蛋白酶酶解片断 •胃蛋白酶酶解片断
四、Ig中糖的结合
•Ig中的聚糖类型 •Ig中的聚糖数目和连接位置
人各类Ig的糖含量(g/100g)
单糖
岩藻糖 甘露糖 半乳糖 N-乙酰基葡萄糖 N-乙酰基半乳糖 唾液酸
IgG
0.2 1.0 0.5 1.0 0 0.2
IgA1
0.2 1.7 1.3 1.6 0.7 1.3
三、 Ig 与免疫缺陷性疾病
免疫缺陷性疾病是由于免疫系统的先天 发育不全或后天受到损伤而是免疫功能抵 下,缺损或异常,在临床上表现为反复感染.
第五节 免疫球蛋白的糖链与糖链 异常引起的自身免疫疾病
一、免役球蛋白的糖链
Ig是体液免疫的主力军,体内的抗体也属此类, 它们可特异识别并结合抗原异物,对机体起防御 和保护作用。Ig包括IgG、IgM、IgA、IgD和IgE 五类。各类Ig均是糖蛋白。其中以IgG含糖最少, 为2%~3%,IgA为8%,其它各型为7%~15%。 寡糖链可连接在Ig的Fab、Fc及绞链区。
第一节 免疫球蛋白的结构概况
一、Ig分子的基本结构----四链结构单位
二、免疫球蛋白的结构区和功能区
轻链 (light chain,L) 重链 (heavy chain,H) 可变区 (variable region,V) 恒定区 (constant region,C) 功能区 L链可变区(VL) L链恒定区(CL) 铰链区 (hinge region))
4第四章 免疫球蛋白

第三章免疫球蛋白(immunoglobulin,Ig)1.免疫球蛋白Ig:具有抗体活性或化学结构与抗体相似的球蛋白统称为免疫球蛋白。
分为分泌型免疫球蛋白sIg、膜型免疫球蛋白mIg2.抗体(antibody,Ab)①概念:B细胞在抗原的刺激下分化为浆细胞,产生具有与相应抗原发生特异性结合反应的免疫球蛋白,称为抗体。
②存在部位:血清、其他体液或外分泌液中。
将抗体介导的免疫称为体液免疫。
将含有抗体的血清称为抗血清或免疫血清。
③电泳区带:抗体活性大部分在γ区带,故抗体曾有γ球蛋白(或丙种球蛋白)之称。
第一节免疫球蛋白的分子结构一、免疫球蛋白的基本结构:由二硫键相连的四条对称的多肽链构成的单体。
形成一“Y”字形结构。
重链、轻链四肽链结构:所有Ig的基本单位都是四条肽链的对称结构。
两条重链(H)和两条轻链(L)。
每条重链和轻链分为氨基端和羧基端。
(一)重链与轻链(天然的Ig单体结构中,两条重链同类,两条轻链同型。
)1.重链(heavy chain,H链)450~550个氨基酸残基,分子量约55~75kD。
根据Ig重链恒定区的分子结构和抗原特异性的不同,Ig可分为五类:即IgG、IgM、IgA、IgD、IgE,相应H链为γ、μ、α、δ及ε链。
2. 轻链轻链为重链的1/2,约由214个氨基酸组成。
根据轻链的不同,分为κ、λ两型。
正常人血清Ig的κ:λ=2 :1(二)可变区和恒定区1.可变区(variable region,V区)近N端的1/2 L链和1/4(或1/5)H链,氨基酸的组成及序列变化较大,而得名。
⑴超变区(hypervariable region,HVR):V区内变化最为剧烈的特定部位。
L链3个,H链3个。
因其在空间结构上可与抗原决定簇形成精密的互补,故又称互补性决定区(complementarity determing region,CDR)。
不同Ig分子在超变区结构上各自具有独特的氨基酸排序和构型特点,也称为Ig分子的独特型或独特型决定簇。
免疫球蛋白的结构与功能

免疫球蛋白的结构与功能作为免疫系统的重要组成部分,免疫球蛋白(Immunoglobulin,Ig)一直是研究人员关注的热点。
Ig是一种多肽分子,由四个多肽链(两个重链和两个轻链)组成,它们结合成Y形分子,其中两个短臂是轻链组成的 Fab 片段,长臂则由重链组成,被称为 Fc片段。
Ig的结构多样性和其在免疫反应中的重要作用,成为许多研究的重点。
Ig的空间结构Ig的空间结构是由多肽链的氨基酸序列、二级结构和三级结构组成的。
Ig的氨基酸序列决定了其特定的氨基酸残基相互作用和空间排列方式,二级结构则包括α-螺旋、β-折叠和随机卷曲这三种。
三级结构则是由蛋白质的空间构象组成的,主要由蛋白质的两种对折(折叠)结构α-螺旋和β-片层组成。
Ig抗原结合部位(antigen-binding site,ABS)的位置,随着Ig的各种结构的变化而不同。
Ig分子的结构是很复杂的,这些复杂结构的形成是由于多个基本的结构模块的相互组合和折叠而实现的。
Ig分子的结构不仅能够决定其在体内的生物学功能,还能直接影响着其在疾病发生、治疗和药物设计中的应用。
Ig的功能Ig是体内重要的免疫排异分子,它可以抵御外来病原体的侵袭。
Ig不仅在体外中可以与抗原相结合,而且在体内外都能够与其他分子发生相互作用。
Ig在特异性免疫反应中起着至关重要的作用,即通过特异性的抗体结合相应的抗原保护机体免于病原体的侵袭,从而起到保护机体免疫的作用。
Ig-M的特点和功能Ig-M是第一个天然形成的Ig,它由五个Ig单体聚合而成。
Ig-M的结构独特,其重链和轻链在 Fab 片段上都拥有了两个等同的结构域,因此它可以通过多个抗原表位相互作用,从而增强其亲和力。
Ig-M广泛存在于体内和体外再生障碍性贫血、恶性肿瘤等多种疾病中,起到了重要的作用。
由于其多个 Fab 片段的结合特性,Ig-M对小分子的抗原如细菌多糖或人造聚合物十分有效。
在M线上的间隙中,Ig-M具有非常高的亲和力和附着力,这种性质有助于Ig-M在血液中形成小团块,从而对更大的过敏原形成更有效的阻挡和保护。
名词解释免疫球蛋白

名词解释免疫球蛋白免疫球蛋白(Immunoglobulin,简称Ig)是一类在脊椎动物的免疫系统中起着重要作用的蛋白质。
免疫球蛋白具有多样性、特异性和记忆性,可以识别和结合到抗原分子上,从而发挥抗原特异性免疫应答的关键角色。
免疫球蛋白是由免疫细胞,如B淋巴细胞,分泌的抗体分子。
它由两个重链和两个轻链组成,通过二硫键连接形成“Y”字形的结构。
在人类中,免疫球蛋白可以分为五个亚型:IgG、IgA、IgM、IgD和IgE。
每种亚型都有不同的结构和功能。
IgG是最常见的免疫球蛋白亚型,占血浆中免疫球蛋白的75-80%。
它可以通过胎盘传递给胎儿,提供被动免疫保护。
IgG参与体液免疫,对细菌、病毒和其他微生物产生中和作用,增强细胞毒性效应,并激活其他免疫细胞。
IgA是存在于体液中的主要免疫球蛋白,占血浆中免疫球蛋白的15-20%。
它在黏膜表面和分泌物中起着保护作用,抵御细菌和病毒的侵袭。
IgA可以通过乳汁、唾液、泪液等分泌物传递给新生儿,提供局部被动免疫保护。
IgM是第一种被合成和分泌的免疫球蛋白,占血浆中免疫球蛋白的5-10%。
它作为早期免疫应答的标志物,在感染初期扮演着重要角色。
IgM以聚合物的形式存在,具有很强的结合力和激活补体的能力。
IgD是免疫球蛋白家族中最少见的亚型,占血浆中免疫球蛋白的0.2-0.5%。
IgD的功能尚不明确,但它被认为参与B淋巴细胞的激活和调节。
IgE是免疫球蛋白家族中最少见的亚型,在免疫应答中起到重要作用。
IgE主要参与过敏反应,与细胞表面的肥大细胞和嗜碱性粒细胞结合,引发组织过敏炎症反应。
免疫球蛋白通过与抗原结合,可以触发多种免疫应答机制。
它可以中和病原体,阻止其入侵宿主细胞;通过激活补体系统,诱导炎症反应和细胞溶解;促进巨噬细胞和自然杀伤细胞的体外杀伤作用;参与调节T细胞和B细胞的活化、增殖和分化等。
在免疫学研究和临床应用中,免疫球蛋白具有多种用途。
例如,通过测量免疫球蛋白的浓度和亚型比例,可以评估免疫功能状态;通过单克隆抗体技术,可以制备特异性抗体来治疗某些疾病;通过免疫球蛋白的结构研究,可以揭示免疫应答的机制,为药物研发提供指导。
免疫球蛋白的种类、特点和作用

免疫球蛋白的种类、特点和作用1.引言1.1 概述免疫球蛋白是一类重要的免疫蛋白,在机体的免疫系统中起着至关重要的作用。
它们由免疫细胞分泌,并可识别和结合特定的抗原物质,从而调节和增强机体的免疫反应。
免疫球蛋白分为不同的种类,包括IgG、IgM、IgA、IgD和IgE等。
每种免疫球蛋白具有独特的特点和功能,对机体的抵抗力和免疫效应起着不同的作用。
在本文中,我们将重点探讨免疫球蛋白的种类、特点和作用。
首先,我们将介绍免疫球蛋白的种类,包括其结构、生成方式和分布情况。
然后,我们将详细讨论每种免疫球蛋白的特点,如其抗原识别能力、半衰期和免疫效应等。
最后,我们将探讨免疫球蛋白在免疫系统中的作用,包括免疫应答过程中的调节作用以及在疾病防控中的应用前景。
通过对免疫球蛋白的深入了解,我们可以更好地认识其在机体免疫系统中的重要性和作用机制,为免疫学和临床医学领域的研究提供有益的参考。
接下来,我们将详细介绍免疫球蛋白的种类、特点和作用,以期能够为读者提供更全面、系统的知识。
1.2文章结构文章结构部分的内容应该包括文章的主要分节和各个分节的主题。
在这种情况下,可以简要介绍正文部分的三个主要分节,即免疫球蛋白的种类、特点和作用。
每个分节可以根据其主题进行详细的描述和解释。
以下是一个可能的示例:2. 正文2.1 免疫球蛋白的种类- IgG- IgM- IgA- IgD- IgE- 其他免疫球蛋白- 每种免疫球蛋白的特点和在免疫系统中的作用2.2 免疫球蛋白的特点- 结构特点- 多样性- 亲和力- 分子量- 稳定性- 各种免疫球蛋白的特点对比2.3 免疫球蛋白的作用- 抗体的特异性结合作用- 中和活性- 与免疫细胞的相互作用- 作为诊断和治疗工具的应用- 免疫球蛋白在免疫应答中的重要性在文章结构部分,可以简要介绍每个分节的主题,以概括整个文章的内容。
然后,在正文中,可以逐个详细讨论每个分节的内容。
1.3 目的目的:本文旨在介绍免疫球蛋白的种类、特点和作用,以增加读者对免疫球蛋白的认识和了解。
免疫球蛋白分子中保守区域的功能分析

免疫球蛋白分子中保守区域的功能分析免疫球蛋白分子(Immunoglobulin,简称Ig)是由B淋巴细胞分泌的一类大分子蛋白质,具有特异性识别和结合抗原分子的能力。
在Ig分子中,保守区域(Constant Region,简称C区)对Ig的结构稳定性和功能发挥起着重要的作用。
因此,对免疫球蛋白分子中保守区域的功能分析具有非常重要的意义。
Ig分子的结构Ig分子由两个重链和两个轻链组成,其中每条重链和每条轻链都含有一个可变区域(Variable Region,简称V区)和一个保守区域(C区)。
Ig分子的V区域具有高度的可变性,可以识别和结合各种不同结构的抗原分子,从而启动免疫反应。
而 Ig分子中C区域的结构比较保守,其主要作用是增强Ig分子的稳定性,调节Ig的寿命和促进Ig的作用效果。
Ig分子中保守区域的功能Ig分子的C区域分为五个不同的亚类,分别是IgM、IgG、IgA、IgD和IgE。
不同的Ig亚类在Ig分子的结构和功能上具有不同的特点。
而在每个Ig亚类中,C区域的结构和序列都有很高的保守性,其主要功能有以下几个方面。
1. 增强Ig的稳定性Ig分子中的C区域具有一个螺旋桥连接的结构,称为Disulfide Bridge。
这种桥连接能够稳定Ig分子的空间结构,从而使Ig具有较强的耐热性和耐酸碱性。
同时,C区域还能够通过与多糖和多肽相互作用等机制增强Ig分子的稳定性,从而保证Ig的抗原结合能力和生物学活性。
2. 调节Ig的寿命Ig分子的生命周期受多种因素的影响,包括合成速度、分解速度、抗原结合能力和IgG的Fc部分与Fc受体的亲和力等。
而C区域对Ig的寿命也具有重要的调控作用。
研究表明,Ig分子中的C区域可以与Ig重链结合,从而形成Ig分子的稳定结构,抑制Ig酶解酶的降解作用,延长Ig的寿命。
3. 促进Ig的作用效果除了增强Ig的稳定性和调节Ig的寿命外,C区域还能够通过与免疫系统其他分子的相互作用,促进Ig的作用效果。
免疫球蛋白分子四条多肽链之间的连接形式为

免疫球蛋白分子四条多肽链之间的连接形式为
在免疫学领域中,免疫球蛋白(Immunoglobulin, Ig)作为一种针对特定抗原的抗体分子,在抗病毒、抗菌、抗癌等方面发挥着重要作用。
免疫球蛋白分子由四条多肽链组成,分别为两条重链和两条轻链。
它们通过不同的连接方式来形成完整的免疫球蛋白分子,其连接形式主要有以下几种方式。
1. 成对连接
Ig分子中两条重链之间是通过成对连接的方式进行的。
在成对连接的过程中,两条重链之间通过二硫键连接,共同形成IgM、IgG和IgA类的Ig分子。
2. 分子连接
Ig分子中两条轻链之间是通过分子连接的方式进行的。
分子连接所依赖的是两条轻链之间的可变区域(VL)及常量区域(CL)所形成的交互结构,通过非共价作用力将两条轻链结合在一起,形成完整的Ig分子。
3. 同源连接
IgA类的Ig分子是一种特殊的连接方式,其两条重链通过同源连接的
方式组成。
同源连接指的是IgA分子中的两条重链具有相似或者相同
的序列,通过这种方式形成IgA分子的稳定结构。
4. 交联连接
一些Ig类分子,如IgE和IgM,会通过不同程度的交联连接来形成如
二聚体和五聚体等大型蛋白质分子。
这些分子中的不同分子链之间通
过非共价作用力(如氢键、范德华力等)交联形成高分子量的Ig分子。
总的来说,Ig分子的连接形式因其在抗体调节功能中的重要作用而备
受关注。
不同的连接方式也对Ig分子的结构和功能产生了影响。
通过
对其连接方式的深入了解,可以更好地理解其在免疫调节过程中的重
要作用。
免疫球蛋白在疾病中激活和抑制方面的研究

免疫球蛋白在疾病中激活和抑制方面的研究免疫球蛋白(Immunoglobulin, Ig)是一种重要的免疫系统分子,其主要作用是和抗原结合,从而诱导免疫反应,参与人体对抗病原体的过程。
Ig分为五种亚型:IgM、IgG、IgA、IgD、IgE,它们在体内具有不同的生物学效应。
除了对病原体的免疫作用,Ig在疾病中的激活和抑制方面的研究也备受关注。
一、免疫球蛋白在免疫反应中的作用在免疫系统中,Ig主要通过与B细胞表面的抗原结合来诱导免疫反应,其作用机制被认为是通过致敏B细胞,从而诱导B细胞增殖和分化成浆细胞,产生抗体。
此外,Ig还参与了抗体介导的免疫反应,例如通过与Fcg受体结合激活巨噬细胞和NK细胞,从而增加其杀伤肿瘤细胞和病原体的能力,同时还参与了身体的免疫记忆。
二、免疫球蛋白在自身免疫性疾病中的作用在自身免疫性疾病中,Ig也扮演着重要的角色。
对于自身抗体介导的疾病,例如系统性红斑狼疮(SLE),IgG和IgM等自身抗体可以和自身受体结合、激活补体系统或介导细胞间毒性,从而导致组织和器官的损害。
在多发性硬化症(MS)中,IgM等自身抗体还可以通过激活T细胞的成分,从而加剧神经系统的损害。
除此之外,Ig还参与了自身抗原处理和呈递过程,从而影响机体对自身抗原的免疫应答。
三、免疫球蛋白在肿瘤治疗中的作用关于Ig在肿瘤治疗中的作用,近年来也有一些研究表明,Ig还能拥有肿瘤治疗的潜力。
IgM和IgG等多种类型的Ig可通过直接识别肿瘤细胞表面分子,从而诱导免疫天然杀伤(ADCC)和补体介导的细胞溶解(CCDC)等细胞毒性效应,从而抑制肿瘤生长和扩散。
此外,还有针对肿瘤的嵌合Ig制剂已经被广泛应用于临床肿瘤治疗中,例如利用嵌合的抗甲状腺球蛋白(IgG)抗体来治疗基底细胞癌等肿瘤。
四、免疫球蛋白在免疫调节中的作用除了直接参与免疫反应和免疫介导的疾病中,Ig还对免疫系统的调节起到了重要的作用。
例如IgG和IgM等Ig可通过诱导T细胞进行分化、激活或抑制作用,参与机体的免疫T调节网络控制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫球蛋白分子 ImmunoglobulinIg
免疫球蛋白分子 ImmunoglobulinIg
二.Ig生物学功能 (biology function of Ig): :
1.抗体特异性结合抗原(bonding antigen) • 特点: • (1)抗原抗体构型互补:抗体可变区中的互补区
(CDR1 2 3)与抗原表位结合.抗原嵌入抗体CDR形 成的口袋中.两种不同抗原带有共同抗原表位时 可与同一种抗体结合造成交叉反应.
•.
免疫球蛋白分子 ImmunoglobulinIg
免疫球蛋白分子 ImmunoglobulinIg
• (2)抗体以表面互补的方式结合抗原:
• 可逆性结合,解离常数与抗体亲合力呈 反比
Placenta ④CH3 : binding cell FcR。
免疫球蛋白分子 ImmunoglobulinIg
绞链区(hinge region)—含大量脯氨酸, 赋予Ig柔性,便于结合两个同种不同距离抗
原表位
免疫球蛋白分子 ImmunoglobulinIg
(四) 水解片段:
• 木瓜蛋白酶--Fab2+Fc1(有抗原性) • 胃蛋白酶—Fab2+pFc(无功能) • 精制破抗及丙种球蛋白即由胃蛋白酶处
Mu Delta Alpha; Gamma; Epsilon
IgM IgD IgA IgG IgE
Ig
IgM
IgG
IgA
IgE
IgD
μγαε δ
Ab
免疫球蛋白分子 ImmunoglobulinIg
(二) 特殊结构(special structure):
分泌片(secretory component,SC)-上皮细胞产生,抗蛋白酶, sIgA
• (3)多种作用力参与抗原抗体结合反应
• 抗原抗体以非共价键结合,包括静电引力、 范德华力、疏水键、氢键等。和共价键 相比,参与抗原抗体结合的力的键均较 弱,不过由于多个基团参与,它们之间 的总作用力较强,故可将整个巨大抗原 吸住。抗原抗体在构型互补,电荷相吸,温 度适宜(37ċ),PH7.2可结合.
连接链(joining chain,J)-浆细胞产生,连接,IgM,sIgA
免疫球蛋白分子 ImmunoglobulinIg
(三). 功能区(function region):
可变区(variable region,V) VH VL 内含超变区(CDR123) 结合抗原 稳定区(constant region,C) CH1 CL 遗传标记 CH2 激活补体,通过胎盘 CH3 结合细胞
immunoglobulin) (一)免疫球蛋白的基本结构
重链 (heavy chain,H) 440/550aa γαuδε-IgG IgA IgM IgD IgE
轻链 (light chain,L)214aa κ:λ=2:1 二硫键(S - S)20-25个人类共有1011种Ig
免疫球蛋白分子 ImmunoglobulinIg
免疫球蛋白分子 ImmunoglobulinIg
免疫球蛋白分子 ImmunoglobulinIg
2.激活补体系统:经典途经
免疫球蛋白分子 ImmunoglobulinIg
3.结合细胞Fc受体.
(1)依赖抗体的调理吞噬作用
免疫球蛋白分子 ImmunoglobulinIg
(2)抗体依赖细胞介导细胞毒作用(ADCC)
免疫球蛋白分子 ImmunoglobulinIg
免疫球蛋白分子 ImmunoglobulinIg
免疫球蛋白分子 ImmunoglobulinIg
Function region:
①VH and VL:antigen-binding site. ②CH1 and CL:gene mark ③CH2 : bind complent and Penetrating
as a result by an antigen inducing and which has the ability to combine with the antigen that stimulated its production.
免疫球蛋白分子 ImmunoglobulinIg
Ag→APC →Th → B→ Plasma cell(浆细 胞) →Ig/ antibody(抗体)
三.抗体抗原性(antigenicity):
• 亦称不均一性,异质性 • 同种型(isotype):同ห้องสมุดไป่ตู้动物共有的Ig抗原特异
目前不仅对抗体结构、功能、基因、 超家族已十分清楚,而且可用人工方 法制备单克隆抗体及基因工程抗体, 并广泛应用于临床疾病的诊断、防治 及科研工作。
免疫球蛋白分子 ImmunoglobulinIg
• Immunoglobulin,Ig/antibody,Ab • Ag→B cell→plasma cell→antibody • Antibody---A protein that is produced
第三章 免疫球蛋白分子 (Immunoglobulin,Ig)
免疫球蛋白分子ImmunoglobulinIg
内容简介
1.Ig概述 2. IgSF概念、组成及功能 3. Ig基因遗传控制 4. 抗体的人工制备 5. Ig异常与疾病 •
免疫球蛋白分子 ImmunoglobulinIg
1890年Behring与北里发现抗毒素抗体 1901年获诺贝尔奖。
免疫球蛋白分子 ImmunoglobulinIg
(3)介导I型超敏反应
免疫球蛋白分子 ImmunoglobulinIg
4.通过胎盘与粘膜:母体IgG+特异性输送蛋 白(FCRn)或母乳SIgA—胎儿被动免疫.
免疫球蛋白分子 ImmunoglobulinIg
免疫球蛋白分子 ImmunoglobulinIg
免疫球蛋白分子 ImmunoglobulinIg
抗体主要丙种球蛋白,亦称为γ 球蛋白。
免疫球蛋白分子 ImmunoglobulinIg
抗体以膜型与分泌型两种形式存 在,主要发挥体液免疫及识别功能。
免疫球蛋白分子 ImmunoglobulinIg
第一节 免疫球蛋白概述
• 一、免疫球蛋白的结构(structure of
