免疫球蛋白分子断片Fab
3-第三章 第一节-免疫球蛋白

2019/10/10
浙中大 微免教研室 刘文洪
免疫球蛋白的结构
2019/10/10
浙中大 微免教研室 刘文洪
8
2. 轻链(light chain, L链)
•根据恒定区氨基酸组成和排列顺序不同分为两型:(type) κ、λ (不同物种,比例有差异)
•正常人血清免疫球蛋白κ:λ =2:1 •小鼠κ:λ =20:1
构的差异,抗原表位亦不同,成为免疫球蛋白的异质性。
2. 异质性表现方面:
(1)同种型:异种诱导免疫应答 (2)同种异型:异种、同种不同个体间诱导免疫应答 (3)独特型:异种、同种不同个体、自身体内间诱导免疫应答
2019/10/10
浙中大 微免教研室 刘文洪
26
三、免疫球蛋白的生物学活性
(一)中和效应
免疫球蛋白(immunoglobulin, Ig): 具有抗体活
性或化学结构与抗体相似的球蛋白。
抗体(antibody, Ab):是B淋巴细胞或记忆B细胞接
受抗原激活后增殖分化为浆细胞所产生的能与相应抗原特 异性结合的免疫球蛋白。
Ig
Ig
B
P
特异性结合( Ig活性)
分布:血清、组织液、外分泌液及某些细胞膜表面
轻链包括VL和CL两个结构域,重链含有1个VH和34个CH结构域。
2019/10/10
浙中大 微免教研室 刘文洪
结构域(功能区—图)
2019/10/10
浙中大 微免教研室 刘文洪
(四)多聚体及其辅助结构
1.连接链(joining chain,J链):富含半胱氨酸的多肽链,
免疫球蛋白分子的结构与功能

免疫球蛋白分子的结构与功能一、免疫球蛋白分子的基本结构Porter等对血清IgG抗体的研究证明,Ig分子的基本结构是由四肽链组成的。
即由二条相同的分子量较小的肽链称为轻链和二条相同的分子量较大的肽链称为重链组成的。
轻链与重链是由二硫键连接形成一个四肽链分子称为Ig分子的单体,是构成免疫球蛋白分子的基本结构。
Ig单体中四条肽链两端游离的氨基或羧基的方向是一致的,分别命名为氨基端(N端)和羧基端(C端)。
图2-3 免疫球蛋白分子的基本结构示意图(一)轻链和重链由于骨髓瘤蛋白(M蛋白)是均一性球蛋白分子,并证明本周蛋白(BJ)是Ig分子的L链,很容易从患者血液和尿液中分离纯化这种蛋白,并可对来自不同患者的标本进行比较分析,从而为Ig分子氨基酸序列分析提供了良好的材料。
1.轻链(light chain,L)轻链大约由214个氨基酸残基组成,通常不含碳水化合物,分子量约为24kD。
每条轻链含有两个由链内二硫键内二硫所组成的环肽。
L链共有两型:kappa(κ)与lambda(λ),同一个天然Ig分子上L链的型总是相同的。
正常人血清中的κ:λ约为2:1。
2.重链(heavy chain,H链)重链大小约为轻链的2倍,含450~550个氨基酸残基,分子量约为55或75kD。
每条H链含有4~5个链内二硫键所组成的环肽。
不同的H链由于氨基酸组成的排列顺序、二硫键的数目和们置、含的种类和数量不同,其抗原性也不相同,根据H链抗原性的差异可将其分为5类:μ链、γ链、α链、δ链和ε链,不同H链与L链(κ或λ链)组成完整Ig的分子分别称之为IgM、IgG、IgA、IgD和IgE。
γ、α和δ链上含有4个肽,μ和ε链含有5个环肽。
(二)可变区和恒定区通过对不同骨髓蛋白或本周蛋白H链或L链的氨基酸序列比较分析,发现其氨基端(N-末端)氨基酸序列变化很大,称此区为可变区(V),而羧基末端(C-末端)则相对稳定,变化很小,称此区为恒定区。
人免疫球蛋白G酶解制备Fab和Fc片段及其分离纯化_唐思远

hIgG) 是人体 受 外 来 抗 原 刺 激 后 由 B 淋 巴 细 胞 产 生的一类球 蛋 白, 目 前 免 疫 球 蛋 白/抗 体 类 产 品 制 备受到 普 遍 关 注 。 [1-5] 木 瓜 蛋 白 酶 (papain) 可 以
2012-09-05 收 到 初 稿 ,2012-12-05 收 到 修 改 稿 。 联系人:林东 强。 第 一 作 者: 唐 思 远 (1987—), 男, 硕 士 研
(化学工程联合国家重点实验室,浙江大学化学工程与生物工程学系,浙江 杭州 310027)
摘要:为了制备抗体 Fab和 Fc片段,采用木瓜蛋白酶酶解人免疫球蛋白 G (IgG),通 过 优 化 酶 解 条 件 和 色 谱 法
分离过程,得到了纯度较高的 Fab片段和 Fc片段。考 察 了 酶 解 pH、 酶 加 入 量、 添 加 半 胱 氨 酸 和 酶 解 时 间 等 对
1.2 hIgG 的酶解 酶解步骤参考文献[10],采用1ml反应 体系,
酶解产物 置 于 超 纯 水 中 透 析 过 夜 后,SDS-PAGE 电泳分析。
1.2.1 酶解pH 称取4份10mg hIgG 和0.5mg 木瓜 蛋 白 酶 粉, 分 别 加 入 40 μl 半 胱 氨 酸 溶 液 (0.5mol·L-1) 和20μl EDTA 溶 液 (0.1 mol· L-1,pH 7.0), 并 分 别 加 入 1 ml pH 6.0、pH 7.0、pH7.6、pH 8.0 的0.1mol·L-1磷 酸 盐 缓 冲 液,置于37℃、250r·min-1恒 温 金 属 浴 中 酶 解 2 h。酶 解 结 束 后 加 入 100 μl碘 乙 酰 胺 溶 液 (0.2 mol·L-1) 冰浴半小时以终止反应。 1.2.2 酶加入量影响 称取 4 份10 mg hIgG, 分 别加入40μl半 胱 氨 酸 溶 液 (0.5 mol·L-1)、20 μl EDTA 溶液 (0.1 mol·L-1,pH 7.0) 和 1 ml pH 7.6的0.1mol·L-1磷 酸 盐 缓 冲 液, 并 分 别 加 入 0.1、0.2、0.5、1 mg 的 木 瓜 蛋 白 酶, 置 于 37℃、250r·min-1 恒 温 金 属 浴 中 酶 解 2h。 酶 解 结束后加入100μl碘乙 酰 胺 溶 液 (0.2 mol·L-1) 冰浴半小时以终止反应。
金黄色葡萄球菌蛋白A(SPA)介绍

金黄色葡萄球菌A蛋白百科内容来自于:金黄色葡萄球菌A蛋白(Staphylococal Protein A,SPA)是一种从金黄色葡萄球菌细胞壁分离的蛋白质。
早在1940年,Vevwey发现在某些金黄色葡萄球菌中,含有一种物质,在双向扩散试验中能与正常人血清形成沉淀。
Jensen也发现类似现象,并将其命名为A抗原。
直到1963年Lofkvist等分离了该抗原,并证明它是一种蛋白质。
为与A与糖相区别,Grov将其命名为金黄色葡萄球菌A蛋白,简称SPA或蛋白A。
由于SPA的一些免疫特性,它已引起广大免疫学者的兴趣,并发展成为免疫学上一种极为有用的工具。
研究概述金黄色葡萄球菌A蛋白分析:金黄色葡萄球菌A蛋白胶体金(SPA-CG)分子的特征性构象特点,探讨其作为原子力显微镜观测原位标记物的可行性。
方法:应用原子力显微镜扫描生理状态下分布在云母表面的金黄色葡萄球菌A蛋白胶体金分子,并进行结构分析及理论计算。
结果:极少数平卧的SPA-CG呈中部球形隆起,两端长短不一的弯曲棒状肽链环抱球形隆起的独特结构,形成反“C”字形结构,球形隆起直径为单个胶体金直径的3~4倍;极少数SPA-CG呈逗号样;绝大多数SPA-CG呈一侧面稍凹的椭球形结构,结构稳定、均一,长径为(40.88±1.58)nm,宽径为(20.82±0.68)n,高度(Z 轴)为(10.51±0.28)nm。
结论:单个胶体金标记的金黄色葡萄球菌A蛋白分子具有独特、稳定、均一的特征性构象,可作为原子力显微术观测的原位标记物。
性质特点临床常见葡萄球菌菌种(1)SPA存在于大多数金黄色葡萄球菌中,而不存在于表皮葡萄球菌中。
并且主要存在于血浆凝固酶阳性菌株,而不存在于阴性菌株中。
前者是致病的,后者是非致病的,但在体内研究中尚未发现SPA和菌株致病性之间有任何肯定的关系。
不同菌株间的SPA含量有明显差异,以I株金黄色葡萄球菌含SPA量最高,SPA和细胞壁的肽聚糖呈共价结合。
金黄色葡萄球菌蛋白A(SPA)介绍

金黄色葡萄球菌A蛋白百科内容来自于:金黄色葡萄球菌A蛋白(Staphylococal Protein A,SPA)是一种从金黄色葡萄球菌细胞壁分离的蛋白质。
早在1940年,Vevwey发现在某些金黄色葡萄球菌中,含有一种物质,在双向扩散试验中能与正常人血清形成沉淀。
Jensen也发现类似现象,并将其命名为A抗原。
直到1963年Lofkvist等分离了该抗原,并证明它是一种蛋白质。
为与A与糖相区别,Grov将其命名为金黄色葡萄球菌A蛋白,简称SPA或蛋白A。
由于SPA的一些免疫特性,它已引起广大免疫学者的兴趣,并发展成为免疫学上一种极为有用的工具。
研究概述金黄色葡萄球菌A蛋白分析:金黄色葡萄球菌A蛋白胶体金(SPA-CG)分子的特征性构象特点,探讨其作为原子力显微镜观测原位标记物的可行性。
方法:应用原子力显微镜扫描生理状态下分布在云母表面的金黄色葡萄球菌A蛋白胶体金分子,并进行结构分析及理论计算。
结果:极少数平卧的SPA-CG呈中部球形隆起,两端长短不一的弯曲棒状肽链环抱球形隆起的独特结构,形成反“C”字形结构,球形隆起直径为单个胶体金直径的3~4倍;极少数SPA-CG呈逗号样;绝大多数SPA-CG呈一侧面稍凹的椭球形结构,结构稳定、均一,长径为(40.88±1.58)nm,宽径为(20.82±0.68)n,高度(Z 轴)为(10.51±0.28)nm。
结论:单个胶体金标记的金黄色葡萄球菌A蛋白分子具有独特、稳定、均一的特征性构象,可作为原子力显微术观测的原位标记物。
性质特点临床常见葡萄球菌菌种(1)SPA存在于大多数金黄色葡萄球菌中,而不存在于表皮葡萄球菌中。
并且主要存在于血浆凝固酶阳性菌株,而不存在于阴性菌株中。
前者是致病的,后者是非致病的,但在体内研究中尚未发现SPA和菌株致病性之间有任何肯定的关系。
不同菌株间的SPA含量有明显差异,以I株金黄色葡萄球菌含SPA量最高,SPA和细胞壁的肽聚糖呈共价结合。
免疫学重点

免疫球蛋白1.免疫球蛋白的基本结构是怎样的?何为Fab、F(ab’)2、Fc?免疫球蛋白分子的基本结构是一个“Y”字形的四肽结构,由两条完全相同的重链和两条完全相同的轻链以二硫键连接而成。
Fab即抗原结合片段,由一条完整的轻链和部分重链(V H和C H1)组成。
一个Fab片段为单价,可以与抗原结合但不形成凝集反应和沉淀反应。
F(ab’)2 是由两个Fab及铰链区组成,为双价,可同时结合两个抗原表位,故能形成凝集反应或沉淀反应。
Fc即可结晶片段,相当于IgG的C H2和C H3功能区,无抗原结合活性,是Ig与效应分子或细胞相互作用的部位。
2.五类免疫球蛋白的生物学特性各是什么?(一)IgM:由J链连接成五聚体,体积最大,作用较强,出现最早(先锋免疫作用),结合补体,单体膜结合型IgM(mIgM)表达于B细胞为BCR 。
(二)IgG:单体,含量最多(主力免疫作用),继IgM之后产生,体内维持时间长,结合补体,是唯一能通过胎盘的Ig。
(三)IgA:分血清型(多为单体)和分泌型(由J链连接双体加分泌片组成),分泌型IgA主要分布在粘膜局部(粘膜免疫作用),不能结合补体。
(四)IgD:单体,血清IgD含量很低,对蛋白酶敏感,不能结合补体,功能不清;B细胞表达膜结合型IgD(mIgD)为成熟的标志。
(五)IgE:单体,含量极低,不能结合补体,与Ⅰ型过敏反应密切相关。
3.抗体有何功能?(一)免疫球蛋白V区的功能;(二)免疫球蛋白C区的功能;1.激活补体;2.细胞亲嗜性;3.调理作用;4.抗体依赖细胞介导的细胞毒作用(ADCC)5.介导I型超敏反应。
4.何为单克隆抗体?其基本制备原理是什么?单克隆抗体是由单一B细胞杂交瘤细胞克隆产生的、抗单一抗原决定基的、具有高度特异性的均一抗体。
基本原理:书P50页小字补体系统1.补体系统由哪些成分组成?补体固有成分;补体调节蛋白;补体受体。
2.补体系统的生物学活性有哪些?(一)细胞毒溶解、溶解病毒作用;(二)调理作用;(三)免疫黏附作用;(四)炎症介导作用;(五)免疫调节作用。
公卫医师指导:免疫球蛋白结构

1.免疫球蛋白的基本结构及其基因天然免疫球蛋白分子均含有四条异源性多肽链,其中,分子量较大的称为重链,而分子量较小的为轻链。
同一天然Ig分子中的两条H链和两条L链的氨基酸组成完全相同。
人的Ig分子是由三个不连锁的Igκ、Igλ和IgH基因所编码。
Igκ、Igλ和IgH基因定位于2号、22号和14号染色体上。
2.免疫球蛋白的功能区免疫球蛋白多肽链内的二硫键连接形成的110个氨基酸残基组成的环状结构称为免疫球蛋白的结构域或功能区。
重链和轻链靠近N端的约110个氨基酸的序列变化很大,称为可变区(V区),靠近C端氨基酸序列相对稳定的区域,称为恒定区(C区)。
重链和轻链的V区分别称为VH和VL.VH和VL各有3个区域的氨基酸组成和排列顺序高度可变,称为高变区(HVR)或互补决定区(CDR),一般CDR3变化程度更高。
3.免疫球蛋白的酶解片段在一定条件下,免疫球蛋白分子肽链的某些部分易被蛋白酶水解为不同片段。
木瓜蛋白酶水解IgG的部位是在铰链区二硫键连接的2条重链的近N端,可将Ig裂解为两个完全相同的Fab段和一个Fc段。
一个Fab片段为单价,可与抗原结合但不形成凝集反应或沉淀反应,Fc段无抗原结合活性,是Ig与效应分子或细胞相互作用的部位。
胃蛋白酶作用于铰链区二硫键所连接的两条重链的近C端,水解Ig后可获得一个F(ab‘)2片段和一些小片段pFc’。
F(ab‘)2是可同时结合两个抗原表位,故与抗原结合可发生凝集反应和沉淀反应。
pFc’最终可被降解,无生物学作用。
4.免疫球蛋白的其他成分Ig轻链和重链除上述基本结构外,某些类别的Ig还含有其他辅助成分,分别是J链和分泌片。
J链的主要功能是将单体Ig分子连接为多聚体。
2个IgA 单体由J链相互连接形成二聚体,5个IgM单体由二硫键相互连接,并通过二硫键与J链连接形成五聚体。
IgG、IgD和IgE常为单体,无J链。
分泌片又称为分泌成分,以非共价形式结合于IgA二聚体上,使其成为分泌型IgA(SIgA)。
免疫球蛋白的结构
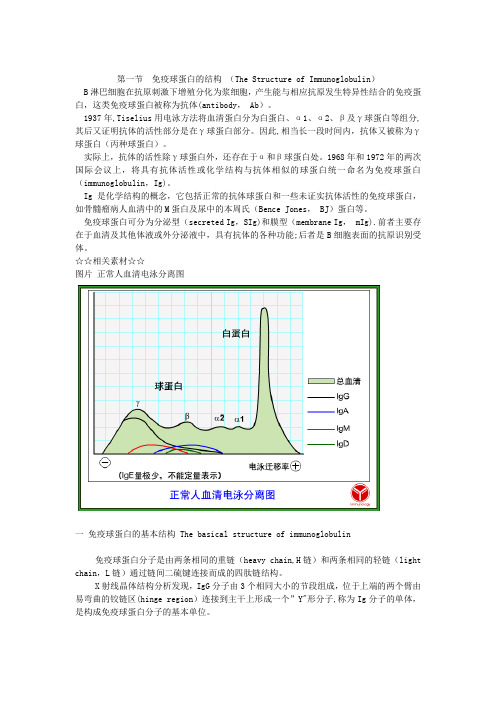
第一节免疫球蛋白的结构(The Structure of Immunoglobulin)B淋巴细胞在抗原刺激下增殖分化为浆细胞,产生能与相应抗原发生特异性结合的免疫蛋白,这类免疫球蛋白被称为抗体(antibody, Ab)。
1937年,Tiselius用电泳方法将血清蛋白分为白蛋白、α1、α2、β及γ球蛋白等组分,其后又证明抗体的活性部分是在γ球蛋白部分。
因此,相当长一段时间内,抗体又被称为γ球蛋白(丙种球蛋白)。
实际上,抗体的活性除γ球蛋白外,还存在于α和β球蛋白处。
1968年和1972年的两次国际会议上,将具有抗体活性或化学结构与抗体相似的球蛋白统一命名为免疫球蛋白(immunoglobulin,Ig)。
Ig是化学结构的概念,它包括正常的抗体球蛋白和一些未证实抗体活性的免疫球蛋白,如骨髓瘤病人血清中的M蛋白及尿中的本周氏(Bence Jones, BJ)蛋白等。
免疫球蛋白可分为分泌型(secreted Ig,SIg)和膜型(membrane Ig, mIg).前者主要存在于血清及其他体液或外分泌液中,具有抗体的各种功能;后者是B细胞表面的抗原识别受体。
☆☆相关素材☆☆图片正常人血清电泳分离图一免疫球蛋白的基本结构 The basical structure of immunoglobulin免疫球蛋白分子是由两条相同的重链(heavy chain,H链)和两条相同的轻链(light chain,L链)通过链间二硫键连接而成的四肽链结构。
X射线晶体结构分析发现,IgG分子由3个相同大小的节段组成,位于上端的两个臂由易弯曲的铰链区(hinge region)连接到主干上形成一个”Y"形分子,称为Ig分子的单体,是构成免疫球蛋白分子的基本单位。
☆☆相关素材☆☆图片免疫球蛋白分子的基本结构图片 IgG分子结构示意图(一)重链和轻链免疫球蛋白重链的分子量约为50~75kD,由450~550个氨基酸残基组成。
医考蓝宝书:临床执业医师《医学免疫学》复习讲义(1)

/zt/lanbaoshu/医考蓝宝书:临床执业医师《医学免疫学》复习讲义(1)第五节免疫球蛋白Ig=抗体+mIg1、免疫球蛋白指具有抗体活性并具有抗体化学结构的球蛋白,免疫球蛋白分为分泌型(sIg)和膜型(mIg)抗体都是免疫球蛋白,而免疫球蛋白不一定都是抗体。
2、抗体是介导体液免疫的重要效应分子,是B细胞接受抗原刺激后增殖分化为浆细胞所产生的糖蛋白,主要存在于血清等体液中,通过与相应抗原特异性结合,发挥体液免疫功能。
3、木瓜蛋白酶水解IgG分子为两个Fab和一个Fc,IgG介导ADCC。
4、免疫球蛋白分类的主要依据是H链(重链)。
5、集中免疫球蛋白的特性、功能IgG:血液中含量最高,惟一能够通过胎盘进入胎儿的Ig,刺激机体产生的抗体是IgG。
IgM:分子量最大的Ig,最早出现的Ig。
“M当劳的巨无霸”IgA:参与黏膜局部免疫,婴儿可从母体初乳中获取Siga。
IgE:为亲细胞抗体,可引发I型超敏反应。
第六节补体系统1、补体固有成分中C3含量最高,C1分子量最高,D因子含量最低且分子量最小。
2、补体三条途径/zt/lanbaoshu/途径经典途径替代途径MBL途径激活物质IgM、IgG3、IgG1、IgG2IgA、IgG4(为了爱情当小4,就是替代)相关的丝氨酸蛋白酶CMASPC3转化酶C4b2a C3bBb C4b2aC5转化酶C4b2a3b C3bBb3b C4b2a3b记忆:经典美宝莲,C3转化酶中无C3;没钱了用C3,即替代途径。
3、具有调节吞噬作用的补体裂解产物是C3b/C4b(原配发威把小3、小4都干掉)。
4、C3a和C5a被称为过敏毒素。
免疫球蛋白
(四)功能区
1、L链可分为可变区(VL)和恒定区(CL )两个功能区。
2、H链功能区:IgG、IgA和IgD的H链各有 一个可变区(VH)和三个恒定区(CH1、CH2、 CH3)共四个功能区;IgM和IgE则多有一个CH4 共五个功能区。
19
CH4
CH4
20
二、Ig的其它结构
1、接合链(J链):是连接两个或两个 以上Ig单体的成分,存在于二聚体sIgA和五聚 体IgM中,IgG、IgD、IgE为单体,无J链。
1、 IgG是血清中含量最高的Ig。 2、 IgG是唯一能通过胎盘的抗体, 对防 止新生儿感染起重要作用。
37
二、IgM
1 、 IgM 由 5 个 单 体通过一个J链和二 硫键连接成五聚体, 分子量最大,故又称 巨球蛋白。
2、在个体发育 过程中, IgM是最早 出现的Ig。
38
三、IgA
IgA分血清型和分泌型两种类型。 ㈠ 血清型IgA
分泌型Ig
B淋巴细胞
记忆性 B淋巴细胞
五种类型: IgG、IgM、IgE、IgA、IgD 两种轻链:κ链和λ链
第一节 免疫球蛋白的结构
5
N端 重链
轻链
二硫键
C端
一、基本结构
Ig是由1000个以上 的氨基酸组成的大分子 ,所有的Ig的基本单位 都是由两条轻链和两条 重链组成的对称结构, Ig单体中四条肽链两端 游离的氨基端(N端) 或羧基端(C端)的方 向是一致的。
2
Ig可分为分泌型(sIg)和膜型(mIg) 。前者主要存在于血清及其他体液(组织液 和外分泌液)中,具有抗体的各种功能,后 者分布在B细胞表面,是B细胞表面的抗原识 别受体。
血清电泳时,Ig主要分布于γ区,所以 习惯上称为γ球蛋白或丙种球蛋白。
第三讲 免疫球蛋白

2.恒定区(constant region,C区) 近C端的1/2 L链及3/4(或4/5)H链。 氨基酸组成在同一物种的同一类Ig中相 对稳定。
(三)其他结构 1.J链(jioning chain,J链)
由浆细胞合成。 主要作用:在H链的羧基端将Ig单体连接成双体 或多聚体,起稳定多聚体结构及参与体内运转 的作用。
一、IgG
1.单体。血清中含量最高。可分为四个
亚类,各亚类的生物学活性有差异。 2.主要的抗感染抗体。具有抗菌、抗病 毒、中和毒素、免疫调理及ADCC作用。 3.唯一通过胎盘的抗体(有自然自动免 疫作用)。
4.半衰期约16~24天,故临床应用以2~
3重复为宜。治疗用的丙球的主要成分为 IgG(有人工被动免疫作用)。 5.可结合SPA,以纯化抗体,用于免疫诊 断。 6.某些自身抗体和引起ⅡⅢ型超敏反应 的抗体属此类。
2. 轻链
轻链为重链的1/2,约由214个氨基酸组成 根据轻链的不同,分为κ、λ两型。 正常人血清Ig的κ:λ=2
:1
(二)可变区和恒定区
1.可变区(variable region,V区) 近N端的1/2 L链和1/4(或1/5)H链,氨基 酸的组成及序列变化较大,而得名。 ⑴ 高变区(hypervariable region,HVR) V区内变化最为剧烈的特定部位。L链3个, H链3个。 因其在空间结构上可与抗原决定簇形成精 密的互补,故又称互补性决定区
(三)绞链区(hinge region)
位于CH1~CH2之间。富含脯氨酸,对蛋 白酶敏感,易伸展弯曲。 作用: 1.弯曲利于V区与不同距离的抗原表位结合。 2.使Ig分子发生“T” “Y”的构型改变,暴 露补体结合位点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5免疫球蛋白分子断片Fab
1958年波特氏首先用木瓜酶(papain)将IgG分子断裂为3个大小相似的断片,其中能与抗原结合的2个断片叫做Fab,每一Fab断片的分子量为45,000。
Fab段是由木瓜蛋白酶彻底消化IgG分子去除Fc段和铰链区后留下来的独臂片段,是一价的,只有一个抗原结合部位,分子量在50KD左右,由于缺少Fc段,它不能沉淀抗原,也不能被活体的免疫细胞所识别;但拥有小分子量和交叉反应小的优点,因此常用于放免中的功能研究,也用于阻断细胞、组织内源性的免疫球蛋白及在多重免疫标记中,一抗来源于同一种属时,阻断已经暴露的IgG抗原决定簇。
双向免疫扩散试验
一、目的要求1 复习巩固免疫化学的基本知识2 熟练掌握免疫扩散法的操作步骤3 掌握其在抗血清效价的测定和特异性抗体的分析中的应用二实验原理琼脂糖的疏散网状结构有利于大分子的自由迁移合适比例的抗原抗体结合后聚集形成沉淀;沉淀的产生阻止抗原抗体复合物的自由运动;…
一、目的要求
1.复习巩固免疫化学的基本知识
2.熟练掌握免疫扩散法的操作步骤
3.掌握其在抗血清效价的测定和特异性抗体的分析中的应用
二实验原理
琼脂糖的疏散网状结构有利于大分子的自由迁移
合适比例的抗原抗体结合后聚集形成沉淀;
沉淀的产生阻止抗原抗体复合物的自由运动;
沉淀带形成一种特异性的半渗透性屏障,阻滞相同抗原抗体复合物,而允许不同的分子通过。
沉淀线的特征与位置:
1 抗原、抗体的特异性和浓度,
2 抗原、抗体分子的大小
3 扩散率
当抗原体存在多种成分时,将呈现多条沉淀线以至交叉反应线,因此可用来检查抗原和免疫血清的特异性、纯度或浓度比较抗原之间的异同点,因而应用范围较广。
二、。
