《高分子化学第二章》PPT课件
合集下载
高分子课件第二章 逐步聚合反应

五、线型缩聚机理
许多缩聚物都是通过逐步聚合的机理聚合得到的。
单体(一聚体)
二聚体
三聚体
......
低聚体 + 低聚体
高聚体
低聚体 + 高聚体
高聚体
大多数缩聚反应都是可逆平衡反应
OH +
k1 COOH k-1
OCO
+ H2O
平衡常数
K
k1 k1
OCO H2O OH COOH
酯化反应的K=4。在实际生产中,为使反应尽量 向生成高聚物的方向移动,通常要采取措施将副产 物小分子尽量排除。如:通入惰性气体或抽真空。
a
a
AA
n
+n
A
如: a
b
b
BB
B b
AA A
B B BA A
A
B B BA
B AB B
A
B BB
3、按照热力学特征分 ⑴ 平衡缩聚
具有可逆变化特性的缩聚反应
如:
nHOROH + nHOOCR'COOH
H
OROOCR'CO n OH + (2n-1)H 2O
⑵ 不平衡缩聚反应
在缩聚反应的条件下不发生逆反应的缩聚反应
NH2(CH2)3COOH
成环—单分子反应 缩聚—双分子反应
O
( 内
C
CH3 CH
O
交 酯
/
O
H2C H2C
CH CH3
内
C
环
O
酯 )(
CH2
环
C O +H2O 酰
N
胺
H
)
故增加单体浓度,有利于缩聚反应
高分子化学2.3 线性缩聚反应平衡2.3.1 课件

高分子化学 第二章 逐步聚合
_ N0 / N = Xn
p Nw
=
N0 N2
N02
_
= p nw Xn2
√ Xn =
K p nw
高分子化学 第二章 逐步聚合
密闭体系:
生成的小分子完全存留在反应器中, 小分子存留率即等于其 实际生成率,即等于反应程度。
实际生成的小分子摩尔数 nw == 理论上能够生成的小分子摩尔数
== Nw / N0 == p
Nw == 体系中H2O的摩尔数
高分子化学 第二章 逐步聚合
K = [[__COOCOOH_]][[_HO2OH]]
= (N0 _ N) 2 N2
封闭体系中生成的酯键与水相等时
= (N0_ N)Nw
NN
非封闭体系中生成的酯键与水不相等时
将上式分子分母同除以N02 ? (N0 _N) / N0 = p,
单官能团化合物分子链达到一定长度后,官能团的活性与分 子链长无关。
表2-1 反应速率常数k (104 L/mol.s)与反应物分子链长的关系
n 值 1 2 3 4 5 8 11 13 15
反 应 1 ) 22.1 15.3.6
7.5
7.7
反应2) 26.6 2.37 0.92 0.67
聚合物 单 体
酚醛树 脂
聚酰胺
苯酚甲醛 二酸二胺
K 1 000 ~305
温度 ℃
100
260
nw
~10% 3%
压力 Pa 常压
2700
聚合 度
~100
~100
涤纶
双β羟乙酯 ~5
280 0.5% < 100 ~200
高分子化学 第二章 逐步聚合
_ N0 / N = Xn
p Nw
=
N0 N2
N02
_
= p nw Xn2
√ Xn =
K p nw
高分子化学 第二章 逐步聚合
密闭体系:
生成的小分子完全存留在反应器中, 小分子存留率即等于其 实际生成率,即等于反应程度。
实际生成的小分子摩尔数 nw == 理论上能够生成的小分子摩尔数
== Nw / N0 == p
Nw == 体系中H2O的摩尔数
高分子化学 第二章 逐步聚合
K = [[__COOCOOH_]][[_HO2OH]]
= (N0 _ N) 2 N2
封闭体系中生成的酯键与水相等时
= (N0_ N)Nw
NN
非封闭体系中生成的酯键与水不相等时
将上式分子分母同除以N02 ? (N0 _N) / N0 = p,
单官能团化合物分子链达到一定长度后,官能团的活性与分 子链长无关。
表2-1 反应速率常数k (104 L/mol.s)与反应物分子链长的关系
n 值 1 2 3 4 5 8 11 13 15
反 应 1 ) 22.1 15.3.6
7.5
7.7
反应2) 26.6 2.37 0.92 0.67
聚合物 单 体
酚醛树 脂
聚酰胺
苯酚甲醛 二酸二胺
K 1 000 ~305
温度 ℃
100
260
nw
~10% 3%
压力 Pa 常压
2700
聚合 度
~100
~100
涤纶
双β羟乙酯 ~5
280 0.5% < 100 ~200
高分子化学 第二章 逐步聚合
高分子化学-第二章 缩聚和逐步聚合
N0
N0
反应程度与转化率的区别
转化率:参加反应的单体量占起始单体量的分数,是指已 经参加反应的单体的数目
反应程度:则是指已经反应的官能团的数目
例如: 一种缩聚反应,单体间双双反应很快全部变成二聚体,就 单体转化率而言,转化率达100%;而官能团的反应程度 仅50%
反应程度与平均聚合度的关系
聚合度是指高分子中含有的结构单元的数目
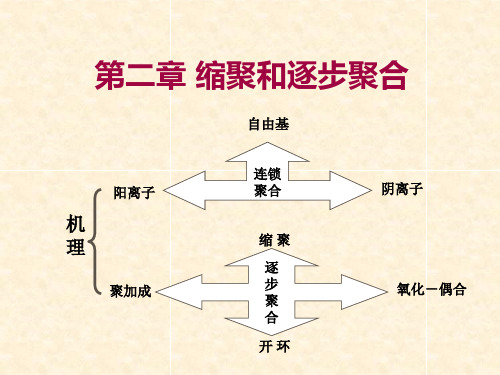
聚加成:形式上是加成反应,但反应机理是逐步反应。 如聚氨酯的合成(p17)。
开环反应:部分开环反应为逐步反应,如水、酸引发的己内 酰胺的开环反应。
氧化-偶合:单体与氧气的缩合反应, 如 2,6-二甲基苯酚和氧 气形成聚苯撑氧,也称聚苯醚。
2 逐步聚合反应的特点
官能团间的反应,无特定的活性中心;无所谓的引发、 增长、终止等基元反应;反应逐步进行,每一步的反 应速率和活化能大致相同;
[ H + ][ A- ] KHA =
[ HA ]
[ HA ] [ H + ] [ A- ] = KHA
代入式
-d [ COOH ] = k1k3[ COOH ][OH ][ H+]
dt
k 2KHA
催化用酸HA:可以是二元酸本身,但反应较慢,也可以是 外加酸,如H2SO4,大大加速
自催化缩聚反应
无外加酸,二元酸单体催化剂,[HA] = [COOH]
Flory对此进行了解释:
官能团等活性理论是近似的,不是绝对的,这一理论大大简化了研 究处理,可用同一平衡常数表示,整个缩聚过程可以用两种官 能团之间的反应来表征
COOH + HO
k1
OCO
k1
2. 线型缩聚动力学
不可逆条件下的缩聚动力学
高分子化学-第二章 自由基聚合

均增加,由于链转移速率常数值较小,对应的活化能 较大,受温度的影响比较显著,这可通过Arrhenius方 程可看出:
(4)
对于氯乙烯单体的聚合,向氯乙烯链转移常数CM与温 度有如下指数关系:
(5) 转移活化能和增长活化能的差值30.5kJ/mol,为正值,表明 温度升高,CM值增加,聚合度降低。
由于氯乙烯的CM值较大,聚氯乙烯的分子量可由温度控制, 与引发剂的用量基本无关;聚合速率由引发剂浓度控制。
阻聚剂会导致聚合反应存在诱导期,但在诱导期过后, 不会改变聚合速率。
缓聚剂并不会使聚合反应完全停止,不会导致诱导期, 只会减慢聚合反应速率。
但有些化合物兼有阻聚作用与缓聚作用,即在一定的反 应阶段充当阻聚剂,产生诱导期,反应一段时间后其阻 聚作用消失,转而成为缓聚剂,使聚合反应速率减慢。
单
I II
(i) O2
R + O2
ROO
RH R
(低活性) 高温
ROOH
ROOR 高温
RO + OH 2RO
引发聚合
(20)
因此氧在低温时(<100oC)为阻聚剂。高温时则可作引发剂。
ii、链转移型阻聚剂
主要有1,1-二苯基-2-三硝基苯肼(DPPH)、芳 胺、酚类等。
• DPPH
DPPH分子能够化学计量地消灭一个自由基,素有 自由基扑捉剂之称。
i、引发剂转移常数CI的第一种求法: 对式(6) 进行一定的重排,可得到下式:
(7)
以上式左边对Rp作图,可由直线斜率求出CI 。 i i 、引发剂转移常数CI的第二种求法:
将式(6)改写为下式: (8)
以上式左边对[I]/[M]作图,从直线斜率可求出CI,由截距 求出CM 。
(4)
对于氯乙烯单体的聚合,向氯乙烯链转移常数CM与温 度有如下指数关系:
(5) 转移活化能和增长活化能的差值30.5kJ/mol,为正值,表明 温度升高,CM值增加,聚合度降低。
由于氯乙烯的CM值较大,聚氯乙烯的分子量可由温度控制, 与引发剂的用量基本无关;聚合速率由引发剂浓度控制。
阻聚剂会导致聚合反应存在诱导期,但在诱导期过后, 不会改变聚合速率。
缓聚剂并不会使聚合反应完全停止,不会导致诱导期, 只会减慢聚合反应速率。
但有些化合物兼有阻聚作用与缓聚作用,即在一定的反 应阶段充当阻聚剂,产生诱导期,反应一段时间后其阻 聚作用消失,转而成为缓聚剂,使聚合反应速率减慢。
单
I II
(i) O2
R + O2
ROO
RH R
(低活性) 高温
ROOH
ROOR 高温
RO + OH 2RO
引发聚合
(20)
因此氧在低温时(<100oC)为阻聚剂。高温时则可作引发剂。
ii、链转移型阻聚剂
主要有1,1-二苯基-2-三硝基苯肼(DPPH)、芳 胺、酚类等。
• DPPH
DPPH分子能够化学计量地消灭一个自由基,素有 自由基扑捉剂之称。
i、引发剂转移常数CI的第一种求法: 对式(6) 进行一定的重排,可得到下式:
(7)
以上式左边对Rp作图,可由直线斜率求出CI 。 i i 、引发剂转移常数CI的第二种求法:
将式(6)改写为下式: (8)
以上式左边对[I]/[M]作图,从直线斜率可求出CI,由截距 求出CM 。
高分子化学第二章-缩聚及逐步聚合

2.2.2 缩聚反应分类
l 按反应热力学的特征分类 平衡缩聚反应 指平衡常数小于 103 的缩聚反应 不平衡缩聚反应 平衡常数大于 103
l按生成聚合物的结构分类 线型缩聚 体型缩聚
2.2.3 特点
缩聚反应是缩合聚合反应的简称,是缩合反应多 次重复结果形成缩聚物的过程。 1、典型缩合反应——形成低分子化合物
3 、反应程度与数均聚合度的关系
数均聚合度是指高分子中含有的结构单元的数目。
Xn
起始单体数目
=
达到平衡时同系物数目(大分子数)
N0 N
代入反应程度关系式
P = N0-N = 1- N
N0
N0
P = 1- 1 Xn
1 Xn = 1-P
一般 Xn 100~200 P提高到
0.99~0.995
300 250 200
a. 密闭体系中,nw=P
Xn
1 P
K=
1 nw
K
当M n 104 , P 1, X n
K nw
平衡缩聚中数均聚合度与平衡常数
及小分子副产物浓度三者关系
Xn只与温度有关,与其他无关。(因为nw平衡时为定值)
b. 敞开体系,水排出,则 nw为体系中剩余的。
说明:X
的影响因素
n
密闭体系,只与T有关 敞开体系,与排出的水有关
3、缩聚中的副反应 副反应
消去反应 化学降解 链交换反应
消去反应
HOOC(CH2)nCOOH
HOOC(CH2)nH + CO2
二元酸脱羧温度(℃)
己二酸 300~320 庚二酸 290~310 辛二酸 340~360 壬二酸 320~340 癸二酸 350~370
l 按反应热力学的特征分类 平衡缩聚反应 指平衡常数小于 103 的缩聚反应 不平衡缩聚反应 平衡常数大于 103
l按生成聚合物的结构分类 线型缩聚 体型缩聚
2.2.3 特点
缩聚反应是缩合聚合反应的简称,是缩合反应多 次重复结果形成缩聚物的过程。 1、典型缩合反应——形成低分子化合物
3 、反应程度与数均聚合度的关系
数均聚合度是指高分子中含有的结构单元的数目。
Xn
起始单体数目
=
达到平衡时同系物数目(大分子数)
N0 N
代入反应程度关系式
P = N0-N = 1- N
N0
N0
P = 1- 1 Xn
1 Xn = 1-P
一般 Xn 100~200 P提高到
0.99~0.995
300 250 200
a. 密闭体系中,nw=P
Xn
1 P
K=
1 nw
K
当M n 104 , P 1, X n
K nw
平衡缩聚中数均聚合度与平衡常数
及小分子副产物浓度三者关系
Xn只与温度有关,与其他无关。(因为nw平衡时为定值)
b. 敞开体系,水排出,则 nw为体系中剩余的。
说明:X
的影响因素
n
密闭体系,只与T有关 敞开体系,与排出的水有关
3、缩聚中的副反应 副反应
消去反应 化学降解 链交换反应
消去反应
HOOC(CH2)nCOOH
HOOC(CH2)nH + CO2
二元酸脱羧温度(℃)
己二酸 300~320 庚二酸 290~310 辛二酸 340~360 壬二酸 320~340 癸二酸 350~370
第二章 高分子化学2

产物的分子量与单体浓度成正比,与引 发剂浓度成反比。 通过计算准确投料单体与引发剂的量, 可得到需要的聚合度和产量的高分子。 此外阴离子型聚合反应产物的分子量分 布非常窄,其原因是阴离子型聚合中引 发反应很快,每个活性链有相同的机会 分享全部单体。
4.影响阴离子型聚合反应的因素
1.溶剂:对链增长活性中心离子对解离 状态有影响。 2.温度:机理比较复杂,影响比较大, 一般来说,升高温度聚合速率下降。
逐步反应
它反映大分子形成过程中的逐步性。反应初期 单体很快消失,形成二聚体、三聚体、四聚体 等低聚物,然后这些低聚物之间进行反应,分 子量随反应时间逐步增加。绝大多数缩聚反应 属于逐步反应。
第一节 聚合反应
一、自由基聚合反应
本反应突出特点是反应开始时必须首先 产生自由基活性中心。
(一)自由基的产生与活性
聚合反应:由低分子单体合成高分子化合物的化 学反应。 加聚反应:聚乙烯、聚氯乙烯 聚合反应: 缩聚反应:酚醛树脂
第二章 高分子化学
链锁聚合 聚合反应: 逐步聚合 (聚合机理的不同)
链锁聚合
链锁聚合:由链引发,链增长,链终止等反应组 成,其特征是瞬间形成高分子聚合物,分子量随 反应时间的变化不大,反应需要活性中心。 链锁聚合根据反应中心的不同分为:自由基聚合, 阳离子聚合和阴离子聚合,它们的反应活性中心 分别为自由基、阳离子和阴离子。一些烯类单体 的加聚反应大多数属于链锁聚合反应。
(1)链引发反应
A、碱金属引发反应: 金属钠引发苯乙烯。
+ + +
2Na +2CH2=CH 2NaCH CH2 NaCHCH2 CH2CHNa C6H5 C6H5 C6H5 C6H5 B、金属烷基化合物引发反应:丁基锂引发苯乙烯。 H C4H9Li + CH2=CH C4H9CH2 C Li C6H5 C6H5
4.影响阴离子型聚合反应的因素
1.溶剂:对链增长活性中心离子对解离 状态有影响。 2.温度:机理比较复杂,影响比较大, 一般来说,升高温度聚合速率下降。
逐步反应
它反映大分子形成过程中的逐步性。反应初期 单体很快消失,形成二聚体、三聚体、四聚体 等低聚物,然后这些低聚物之间进行反应,分 子量随反应时间逐步增加。绝大多数缩聚反应 属于逐步反应。
第一节 聚合反应
一、自由基聚合反应
本反应突出特点是反应开始时必须首先 产生自由基活性中心。
(一)自由基的产生与活性
聚合反应:由低分子单体合成高分子化合物的化 学反应。 加聚反应:聚乙烯、聚氯乙烯 聚合反应: 缩聚反应:酚醛树脂
第二章 高分子化学
链锁聚合 聚合反应: 逐步聚合 (聚合机理的不同)
链锁聚合
链锁聚合:由链引发,链增长,链终止等反应组 成,其特征是瞬间形成高分子聚合物,分子量随 反应时间的变化不大,反应需要活性中心。 链锁聚合根据反应中心的不同分为:自由基聚合, 阳离子聚合和阴离子聚合,它们的反应活性中心 分别为自由基、阳离子和阴离子。一些烯类单体 的加聚反应大多数属于链锁聚合反应。
(1)链引发反应
A、碱金属引发反应: 金属钠引发苯乙烯。
+ + +
2Na +2CH2=CH 2NaCH CH2 NaCHCH2 CH2CHNa C6H5 C6H5 C6H5 C6H5 B、金属烷基化合物引发反应:丁基锂引发苯乙烯。 H C4H9Li + CH2=CH C4H9CH2 C Li C6H5 C6H5
高分子化学02自由基聚合

自由基聚合是最重要的高分子合成反应之一
4
2.2 连锁聚合的单体
连锁聚合的单体包括单烯类、共轭二烯类、炔类、羰基 和环状化合物。 不同单体对聚合机理的选择性受共价键断裂后的电子结 构控制。 醛、酮中羰基双键上C和O的电负性差别较大,断裂后具 有离子的特性,因此只能由阴离子或阳离子引发聚合,不能 进行自由基聚合。环状单体一般也按阴离子或阳离子机理进 行聚合。
21
(2)以头—尾方式结合时,空间位阻要比头—头方式结合 时的小,故有利于头尾结合。 虽然电子效应和空间位阻效应都有利于生成头尾结构聚 合物,但还不能做到序列结构上的绝对规整。从立体结构来 看,自由基聚合物分子链上取代基在空间的排布是无规的, 因此聚合物往往是无定型的。
22
3)链终止反应 链自由基失去活性形成稳定聚合物的反应。可以 分为偶合终止和歧化终止。 偶合终止:两个链自由基头部的独电子相互结合 成共价键,生成饱和高分子的反应。生成的高分 子两端都有引发剂碎片,聚合度为链自由基重复 单元数的两倍。
δ
CH2
CH
Y
例如丙烯腈中的腈基能使负电荷在碳—氮两个原 子上离域共振而稳定。
H CH2 C C N CH2 H C C N
9
卤素原子既有诱导效应(吸电子),又有共轭效应(推 电子),但两者均较弱,因此既不能进行阴离子聚合,也不 能进行阳离子聚合,只能进行自由基聚合。如氯乙烯、氟乙 烯、四氟乙烯均只能按自由基聚合机理进行。 除了少数含有很强吸电子基团的单体(如偏二腈乙烯、 硝基乙烯)只能进行阴离子聚合外,大部分含吸电子基团的 单体均可进行自由基聚合。 含有共轭双键的烯类单体,如苯乙烯、α-苯乙烯、丁二 烯、异戊二烯等,因电子云流动性大,容易诱导极化,因此 既可进行自由基聚合,也可进行阴、阳离子聚合。
高分子化学与物理第二章

逐步聚合反应的分类:
逐步聚合反应
缩合聚合 逐步加成 开环聚合 氧化偶合 Diels-Alder加成聚合
✓ 缩聚:
✓聚加成:形式上是加成,机理是逐步的。
聚氨基酸酯,简称聚氨酯
✓开环反应:部分为逐步反应。 ✓氧化偶合:单体与氧气的缩合反应。
✓ Diels-Alder加成聚合:单体含一对共轭双键,如:
2.3.2 线形缩聚机理特征:逐步的、可逆平衡 1、逐步性:以二元酸和二元醇为例:
通式为:
缩聚反应的单体转化率、产物聚 合度与反应时间关系示意图
反应程度p: 参加反应的基团数占起始基团数的分率。 N0:起始的基团数
N:反应到 t 时体系中残留的基团数
以等摩尔的二元酸和二元醇缩聚为例: N0:体系中的羧基数或羟基数,等于二元酸与二元醇的分子总数, 也等于反应时间 t 时的二元酸和二元醇的结构单元总数。 N:反应到 t 时体系中残留的羧基数或羟基数 ,等于聚酯的分子数, 因为一个聚酯分子平均带有一个端羧基和1个端羟基。
1)不可逆的缩聚动力学
在及时脱水的条件下,k4=0;k1、k2、k5都比k3大,聚酯化速率 或羧基消失速率由第三步反应控制。
质子化种的浓度[C+(OH)2]难以测定, 引入平衡常数K’消去
考虑到HA的离解平衡
上式中氢离子[H+]可来自羧酸本身,进行自催化,但因为酯 化反应为慢反应,一般采用外加无机酸催化加速。
1-2官能度体系 例:辛醇与邻苯二甲酸酐(官能度为2)反应形成邻苯 二甲酸二辛酯(DOP)。
二元反应体系中若有一原料的官能度为1,则缩合后只能 得到低分子化合物,称为缩合反应。
2-2官能度体系
2官能度体系 2-2或2官能度体系的单体进行缩聚,形成线形缩聚物。
高分子化学第二章自由基聚合

第二章 自由基聚合
按反应机理 连锁聚合 自由基聚合 阳离子聚合 阴离子聚合
聚合反应
逐步聚合
自由基聚合的产物占聚合物总产量60%以上
自由基聚合的理论研究比较成熟完善
根据活性中心不同,连锁聚合反应又分为:
自由基聚合:活性中心为自由基 阳离子聚合:活性中心为阳离子 阴离子聚合:活性中心为阴离子 配位离子聚合:活性中心为配位离子
C=O C O
• 碳碳双键: 既可均裂也可异裂,可以进行自由基聚合或离子 聚合(ionic polymerization)
C
C
C= C
C
C
1. 电子效应(electron effect)
可分为诱导效应(induction effect)和共轭效应 共轭效应是指两个以上双键(或三键)以单 (resonance effect) 1)诱导效应—取代基的推、吸电子性 a
• 若基团的吸电子倾向过强,如硝基乙烯
(nitroethylene)等,只能阴离子聚合而难
以进行自由基聚合。
不少单体既能阴离子聚合,又能自由基聚合,但如果 取代基吸电性太强,δ+ 过大,则只能阴离子聚合
CN
e.g:
CH2 C
CH2 CH NO2
CN ,
只能阴离子聚合
卤原子,它的诱导效应是吸电
子,但P — π 共轭效应却有供 电性,但两者均较弱,所以 VC(vinyl chloride)只能自由 基聚合。 总之:当诱导效应与共轭效应共存时, 且作用方向相反时,往往是共轭效应起 主导作用,决定单体的聚合方式。
从诱导效应: 烷氧基具有吸电子性,但氧上未共用电子对能和 双键形成 P-π共轭,却使双键电子云密度增加。
共轭效应占主导地位,所以可以进行阳离子聚合。
按反应机理 连锁聚合 自由基聚合 阳离子聚合 阴离子聚合
聚合反应
逐步聚合
自由基聚合的产物占聚合物总产量60%以上
自由基聚合的理论研究比较成熟完善
根据活性中心不同,连锁聚合反应又分为:
自由基聚合:活性中心为自由基 阳离子聚合:活性中心为阳离子 阴离子聚合:活性中心为阴离子 配位离子聚合:活性中心为配位离子
C=O C O
• 碳碳双键: 既可均裂也可异裂,可以进行自由基聚合或离子 聚合(ionic polymerization)
C
C
C= C
C
C
1. 电子效应(electron effect)
可分为诱导效应(induction effect)和共轭效应 共轭效应是指两个以上双键(或三键)以单 (resonance effect) 1)诱导效应—取代基的推、吸电子性 a
• 若基团的吸电子倾向过强,如硝基乙烯
(nitroethylene)等,只能阴离子聚合而难
以进行自由基聚合。
不少单体既能阴离子聚合,又能自由基聚合,但如果 取代基吸电性太强,δ+ 过大,则只能阴离子聚合
CN
e.g:
CH2 C
CH2 CH NO2
CN ,
只能阴离子聚合
卤原子,它的诱导效应是吸电
子,但P — π 共轭效应却有供 电性,但两者均较弱,所以 VC(vinyl chloride)只能自由 基聚合。 总之:当诱导效应与共轭效应共存时, 且作用方向相反时,往往是共轭效应起 主导作用,决定单体的聚合方式。
从诱导效应: 烷氧基具有吸电子性,但氧上未共用电子对能和 双键形成 P-π共轭,却使双键电子云密度增加。
共轭效应占主导地位,所以可以进行阳离子聚合。
高分子化学-2(自由基聚合)

.
( 1)
水溶性氧化还原引发体系
常用的氧化剂:过氧化氢、过硫酸盐、氢过氧化物、Cu2+,Ag+, Fe3+ 无机还原剂:Fe2+,HSO3-,SO32常用的还原剂 有机还原剂:醇、胺、草酸、葡萄糖 如:无机-无机氧化还原引发体系
HO-OH + Fe2+
RO-OH + Fe2+
-.
Fe3+ +
Fe3+ +
温度升高,H-H连接形式的结构增加
怎样来合成H-H结构的聚合物?
-(CH2-CH=CH-CH2)- Cl2
n
Cl Cl -(CH2-CH-CH-CH2)n
H-H结构PVC
H2 -(CH2-C=C-CH2)n
-(CH2-CH-CH-CH2)n
H-H结构PS
(3) 链转移 ( Chain transfer) 在自由基聚合反应中,链自由基可能从单体、溶剂、 引发剂等低分子或大分子上夺取一个原子而终止,并使这 些失去原子的分子成为自由基,继续新链的增长,使聚合 反应继续下去,这一反应称链转移反应 可分为三种情况 a. 向单体的链转移
单体 转化率 聚合物
时间
(5) 少量阻聚剂(0.01-0.1%)足以使自由基聚合反应 终止
四、 链引发反应
1、引发剂和引发作用
(一)怎样的物质才能被选用作引发剂 分子结构上有弱键,易分解成自由基化合物
在聚合温度下(40-100º C),键离解能100-170KJ/mol,仅具有O-O, S-S,N-O键的一些化合物具备这一要求。 热分解型引发剂 引发剂类型 氧化还原型引发剂 低温游离基型引发剂:有机过氧化物和烷基金属 化物组合
高分子化学-2

H CH2 CH + R R X CH2 C R + R X
特点: 自由基数目未减少,但损失了一个引发剂分子; 聚合物分子量降低,引发剂效率下降。 (3)向溶剂或链转移剂转移
H CH2 CH + S Y X CH2 C S + Y X
高分子化学
南京航空航天大学材料科学与技术学院
21
第二章 自由基聚合
n CH
O
CH O
O
+ n CH2
CH
O
CH O
CH
O
CH2
CH
n
高分子化学
南京航空航天大学材料科学与技术学院
13
第二章 自由基聚合
3)三取代和四取代乙烯:
由于位阻效应,一般不能聚合。 特例:氟代乙烯,不论氟代的位置和数量,均能 聚合。原因是F的原子半径较小,且电负性最强。
二、羰基化合物
由于极性较强,一般不能进行自由基聚合,只能进行 离子型聚合。 例如:甲醛,既可以进行阴离子聚合,也可进行阳离子 聚合。
18
高分子化学
第二章 自由基聚合
特征: 大分子聚合度与链自由基单元数相同; 大分子一端为引发剂残基,另一端为饱和或不饱和。 可以采用带标记原子的引发剂结合分子量的测定,计算出偶合与 歧化终止的比例。 链终止反应特征: 活化能低, 8-21kJ/mol。 Kt 约106-108 l/mol-s,速率非常快。 链终止方式与温度、压力、气氛有关。 例如:MMA,60℃以上,歧化终止为主;60 ℃以下,两种均有。
1)无取代基:
CH 2 CH 2
结构对称,偶极矩为零,难诱导聚合,须在高温高 压或特殊的引发剂如TiCl4-三乙基铝等络合体系中才能 进行自由基聚合或配位聚合。
特点: 自由基数目未减少,但损失了一个引发剂分子; 聚合物分子量降低,引发剂效率下降。 (3)向溶剂或链转移剂转移
H CH2 CH + S Y X CH2 C S + Y X
高分子化学
南京航空航天大学材料科学与技术学院
21
第二章 自由基聚合
n CH
O
CH O
O
+ n CH2
CH
O
CH O
CH
O
CH2
CH
n
高分子化学
南京航空航天大学材料科学与技术学院
13
第二章 自由基聚合
3)三取代和四取代乙烯:
由于位阻效应,一般不能聚合。 特例:氟代乙烯,不论氟代的位置和数量,均能 聚合。原因是F的原子半径较小,且电负性最强。
二、羰基化合物
由于极性较强,一般不能进行自由基聚合,只能进行 离子型聚合。 例如:甲醛,既可以进行阴离子聚合,也可进行阳离子 聚合。
18
高分子化学
第二章 自由基聚合
特征: 大分子聚合度与链自由基单元数相同; 大分子一端为引发剂残基,另一端为饱和或不饱和。 可以采用带标记原子的引发剂结合分子量的测定,计算出偶合与 歧化终止的比例。 链终止反应特征: 活化能低, 8-21kJ/mol。 Kt 约106-108 l/mol-s,速率非常快。 链终止方式与温度、压力、气氛有关。 例如:MMA,60℃以上,歧化终止为主;60 ℃以下,两种均有。
1)无取代基:
CH 2 CH 2
结构对称,偶极矩为零,难诱导聚合,须在高温高 压或特殊的引发剂如TiCl4-三乙基铝等络合体系中才能 进行自由基聚合或配位聚合。
高分子化学课件;第二章自由基聚合

• 动力学链长(ν):每个活性种从引发阶段 到终止阶段所消耗的单体分子数。
• 无链转移时,ν= Rp/ Ri 因为稳态时Rt =Ri
n 得到 = kp[Байду номын сангаас]/2(fktkd[I])1/2
对比
• 速率方程 R p = kp[M] (fkd/kt)1/2[I]1/2 • 动力学链长 n = kp[M]/2(fktkd[I])1/2
CM CI CS分别表示向单体,向引发剂,向溶剂的链转移常数。
其中,转化率= [M]0 /[M]
PS:凝胶效应的动力学解释
• 自动加速作用:随着反应进行,kt下降明显; Kp不变,Kd不变,因此(kp/kt1/2)显著增大, 聚合反应速率不降反升。
• 影响:1.使聚合反应速率显著上升外 2.聚合产物分子量显著增加
• 减缓自动加速作用:提高温度,使用良溶剂
动力学链长(ν)和聚合度
速率方程
根据假设 3、稳态,有Ri = Rt 代入链增长速率方程得
Rp = kp[M] (fkd/kt)1/2[I]1/2
“平方根定则”:聚合反应速率与引发剂浓 度[I]的平方根成正比,与单体浓度[M]一次 方成正比,可作为自由基聚合的判据。
聚合总速率
上式积分得: ln [M]0 /[M] =kp (fkd/kt)1/2[I]1/2 t
• 无链转移反应时, ν=平均每条增长链所含 的单体单元数
• 当发生歧化终止时, Xn = n • 当发生偶合终止时, Xn = 2n
•
兼有两种方式终止时,
n
Xn C D
2
链转移反应对聚合度的影响
得到:
1
[I]
[S]
= CM + CI + CS +
• 无链转移时,ν= Rp/ Ri 因为稳态时Rt =Ri
n 得到 = kp[Байду номын сангаас]/2(fktkd[I])1/2
对比
• 速率方程 R p = kp[M] (fkd/kt)1/2[I]1/2 • 动力学链长 n = kp[M]/2(fktkd[I])1/2
CM CI CS分别表示向单体,向引发剂,向溶剂的链转移常数。
其中,转化率= [M]0 /[M]
PS:凝胶效应的动力学解释
• 自动加速作用:随着反应进行,kt下降明显; Kp不变,Kd不变,因此(kp/kt1/2)显著增大, 聚合反应速率不降反升。
• 影响:1.使聚合反应速率显著上升外 2.聚合产物分子量显著增加
• 减缓自动加速作用:提高温度,使用良溶剂
动力学链长(ν)和聚合度
速率方程
根据假设 3、稳态,有Ri = Rt 代入链增长速率方程得
Rp = kp[M] (fkd/kt)1/2[I]1/2
“平方根定则”:聚合反应速率与引发剂浓 度[I]的平方根成正比,与单体浓度[M]一次 方成正比,可作为自由基聚合的判据。
聚合总速率
上式积分得: ln [M]0 /[M] =kp (fkd/kt)1/2[I]1/2 t
• 无链转移反应时, ν=平均每条增长链所含 的单体单元数
• 当发生歧化终止时, Xn = n • 当发生偶合终止时, Xn = 2n
•
兼有两种方式终止时,
n
Xn C D
2
链转移反应对聚合度的影响
得到:
1
[I]
[S]
= CM + CI + CS +
高分子化学导论第2章线性缩聚和逐步聚合

尽可能提高反应程度 温度控制、催化剂、后期减压排除小分子、惰 性气体保护、反应足够时间
2.7 体形缩聚和凝胶化作用
一. 体形缩聚 1. 定义
在缩聚反应中,参加反应的单体只要有一种单体具有 两个以上官能团( f >2),缩聚反应将向三个方向发展, 生成支化或交联结构的体形大分子,称为体形缩聚。 体形缩聚的最终产物称为体形缩聚物。
r
=
Na
Na+2Nc
2表示1个分子Cb中的1个基 团b相当于一个过量的bBb 分子双官能团的作用
q=
Nc Na
=
2Nc Na
2
推导过程同上
r
=
1
q+1
1+r
q+2
Xn = 1+r-2rP = q+2( 1-P )
和前一种情况相同,只是 r 和 q 表达式不同
3)aRb 加少量单官能团物质Cb(分子数为Nc) 基团数比和分子过量分率如下:
Polymer Chemistry
高分子化学
缩聚和逐步聚合
2.1 发展历史
按聚合机理或动力学分类:
• 逐步聚合(stepwise polymerization) 无活性中心,单体官能团间相互反应而逐步增长
• 连锁聚合(chain polymerization) 活性中心(active center)引发单体,迅速连锁增长
( Na+Nb ) / 2
1+r
q+2
Xn = ( Na+Nb-2NaP ) / 2 = 1+r-2rP = q+2( 1-P )
( Na+Nb ) / 2
1+r
q+2
Xn = ( Na+Nb-2NaP ) / 2 = 1+r-2rP = q+2( 1-P )
若q很小
2.7 体形缩聚和凝胶化作用
一. 体形缩聚 1. 定义
在缩聚反应中,参加反应的单体只要有一种单体具有 两个以上官能团( f >2),缩聚反应将向三个方向发展, 生成支化或交联结构的体形大分子,称为体形缩聚。 体形缩聚的最终产物称为体形缩聚物。
r
=
Na
Na+2Nc
2表示1个分子Cb中的1个基 团b相当于一个过量的bBb 分子双官能团的作用
q=
Nc Na
=
2Nc Na
2
推导过程同上
r
=
1
q+1
1+r
q+2
Xn = 1+r-2rP = q+2( 1-P )
和前一种情况相同,只是 r 和 q 表达式不同
3)aRb 加少量单官能团物质Cb(分子数为Nc) 基团数比和分子过量分率如下:
Polymer Chemistry
高分子化学
缩聚和逐步聚合
2.1 发展历史
按聚合机理或动力学分类:
• 逐步聚合(stepwise polymerization) 无活性中心,单体官能团间相互反应而逐步增长
• 连锁聚合(chain polymerization) 活性中心(active center)引发单体,迅速连锁增长
( Na+Nb ) / 2
1+r
q+2
Xn = ( Na+Nb-2NaP ) / 2 = 1+r-2rP = q+2( 1-P )
( Na+Nb ) / 2
1+r
q+2
Xn = ( Na+Nb-2NaP ) / 2 = 1+r-2rP = q+2( 1-P )
若q很小
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3
4
侧基也能缩合先形成支链
进一步可形成体形结构 体形缩聚
官能团体系不同 可以区分出
缩合反应 1-1,1-2,1-3 线形缩聚 2-2,2 体形缩聚 2-3,2-4
本章
线形缩聚 核心问题 体形缩聚
聚合速率、分子量控制 凝胶点 的控制
产生交联的临界反应程度
可供缩聚的官能团类型,如:
—OH,—NH2,—COOH,>(CO)2O —COOR,—COCl,—H,—Cl, —SO3H,—SO2Cl(氧硫酰氯)
第二章 缩聚和逐步聚合 (Condensation polymerization & step growth polymerization)
2.1 引言
哪些反应是属于逐步聚合机理的,哪些像 又不是。
1. 典型的逐步聚合反应—绝大多数缩聚 1)常见的类型
电木
polyamide
聚酰胺 酚醛树脂 phenol-formaldehyde
alkyd resin phenol-formaldehyde
urea-formaldehyde
2)带芳环耐高温聚合物
聚酰亚胺 polyimide
梯形聚合物
有机硅树脂(硅醇的缩聚物)
3)天然生物高分子—通过缩聚反应合成
氨基酸 酶催化 蛋白质 缩聚
单糖
糊精、淀粉、纤维素
缩聚
核酸(DNA、RNA)的合成
4)无机缩聚物
硅酸盐玻璃,聚磷酸盐
2. 非缩聚型的逐步聚合反应
polyurethane
芳核取代
polysulfone
氧化偶合
Poly(phenylene oxide)
Polyamide-6
2. 非缩聚型的逐步聚合反应
制梯形聚合物
芳族亲电取代
3. 一些缩聚反应具有连锁机理的特征
对二甲苯热解氧化脱氢偶合成聚(对二次甲基苯)
2CH
2OH
H2O
己二酸
酯化
乙二醇
分子柔性大,Tg较低,实用价值不大
对苯二甲酸(涤纶)
线形缩聚:聚酯 聚酰胺-66
二元醇
二元酯
二元胺 二酰氯
线形缩聚物通式为:
2
2
a、b:官能团,A、B代表残基。
2) 2官能度体系
羟(氨)基酸自身缩聚
线形缩聚物通式为:
2
3) 2—3,2—4官能度体系
+
2
除按线形方向缩聚外
5.0
9
664
5.9
10
664
5.0
11
662
4.2
12
660
1.3
2
正烷烃
660
0.0
1. 线形缩聚与成环倾向
1)环大小与稳定性 3,4,8~11 <7,12< 5,6
如:羟基酸HO(CH2)nCOOH合成聚酯
n=1,经双分子缩合后易形成六元环
n=2,-羟基酸易失水成丙烯酸
HOCH2CH2COOH
HH+OROOCR'COOH HOROH
HOROOCR 'COOROH
trimer
H2O
HOH+OCR'COOH HOROOCR'COOH
HOOCR 'COOROOCR 'COOH H2O
trimer
二聚体又可相互反应
重氮甲烷制聚乙烯
2.2 缩(合)聚(合)反应 1. 缩合反应
[官能度f]:一个分子中能参加反应的官能团数。
均苯三甲酸三丁酯
1—1、1—2、1—3官能度体系
邻苯二甲酸二辛酯(增塑剂)
2. 缩聚反应
1)2—2官能度体系
HHO+ OC
CH 2
4
COOH
HOCH
2CH 2OH
HOOC
CH
2
4
COOCH
由两种皆不能独自缩聚的单体进行的缩聚
3)共缩聚(co-condensation polymerization)
由两种或两种以上单体进行的能形成两 种或两种以上重复单元的缩聚
无规共缩聚物(m、n是较小整数)
嵌段共缩聚物(m、n是几十至几百的整数)
使性能改变的一个重要方向是: 分子链柔性 结晶度 从而 Tg、Tm
如合成涤纶:以少量丁二醇代替乙二醇 可 柔性和溶解性能
合成不饱和聚酯:以饱和酸酐代替马来酸酐混用 可 交联密度 柔性
2.3 线形缩聚反应的机理
合成纤维:涤纶、聚酰胺-66、聚酰胺-6
工程塑料:PC、PSF(聚砜)、PPO(聚苯醚)、聚氨酯
缩聚速率 线形缩聚两大重要指标 分子量
不同类型线形缩聚物要求M不一样 同类缩聚物用途不同,对M要求也不一样
—H2O CH2=CH2COOH
n=3,4,易分子内缩合成(较稳定5、6)环内酯 HOCH2CH2CH2COOH HOCH2CH2CH2CH2COOH
n≥5,(主要)生成线形缩聚物 氨基酸也有类似情况
2)环上取代基对环稳定性影响
环上取代基或环上元素改变时,环的 稳定性也相应改变。
聚硅氧烷以八元环较稳定
2.1~2.3 0.7 0.45 0.5±0.3
1. 线形缩聚与成环倾向 从热力学角度来看环的张力大小
环烷烃中每个—CH2—的燃烧热与张力
—(CH2)n— 燃烧热(kJ/mol) 张力(kJ/mol) 稳定性类别
3
697
38.5
3
4
686
27.6
5
664
5.4
6
659
0.0
1
7
662
3.8
8
664
相互反应后形成
醚(—O—),酯(—OCO—),酰胺(—NHCO—) 氨酯(—NHCOO—),砜(—SO2—)
3. 共缩聚反应
1)均缩聚(home-condensation polymerization)
由一种单体进行的缩聚
2)混(杂)缩聚(mixing polycondensation)
polyester
聚酯
脲醛树脂 urea-formaldehyde
polycarbonate 聚碳酸酯 醇酸树脂 alkyd resin
电玉
多数是杂链聚合物
己二胺
己二酸
乙二醇 对苯二甲酸
尼龙(nylon-66) 涤纶(dacron)
双酚A
光气
聚碳酸酯(polycarbonate)
杂链和元素有机聚合物
3)单体浓度影响
成环是单分子反应 缩聚是双分子反应
低浓度有利于成环 高浓度有利于线形缩聚
2. 线形缩聚机理——逐步和平衡
1)逐步特点和平衡
以二元醇和二元酸合成聚酯为例
HOROH HOOCR'COOH
H + monomer
monomer
HOROOCR 'COOH H2O
dimer
二聚体可与二元醇、二元酸进一步反应
作纤维和工程塑料
线形逐步聚合物分子量示例
聚合物 平均分子量,万
涤纶
2.1~2.3
Hale Waihona Puke 聚酰胺-66 1.2~1.8
聚酰胺-6 1.5~2.3
聚碳酸酯 2~8
聚砜
2.2~3.5
聚苯醚
2.5
重复单元数 110~120 50~90 130~200 70~280 50~80 200
特性粘度[η] 0.69~0.72
