化工工艺学3章 硝酸(参考)
3化工工艺学-第三章 硫酸与硝酸
《化工工艺学》第3章 硫酸与硝酸
(3) 生产硫酸的原料
生产硫酸的原料有三类:硫、金属硫化物、和硫酸盐。 专为生产硫酸开采的有硫矿、硫铁矿、和磁硫铁矿;作为副 生的硫资源有天然气和石油回收硫、含煤硫铁矿、有色金属 冶炼气、硫化氢等;作为工业废弃物的硫资源磷石膏、废脱 硫剂、工业废酸、硫酸亚铁等。 硫铁矿:硫化铁矿物的总称,主要成份是FeS2。 磁硫铁矿:主要成份为Fe7S8。含S量越高,锻烧时放热越 多。两种矿含S量相同时,磁硫铁矿锻烧放热量比普通硫铁矿 高30%左右。 硫磺:天然硫磺生产硫酸最好,但我国硫磺矿极少。 其它原料:硫酸盐、冶炼烟气、含硫工业废料等。
Sulfuric Acid and Nitric Acid
《化工工艺学》第3章 硫酸与硝酸
3.1 硫酸 (Sulfuric Acid)
硫酸(H2SO4,分子量98.078)为无色透明油状液体。 三氧化硫(SO3,分子量80.062)有多种聚合体,液体(常压 下温度低于27℃冷凝)三氧化硫也为无色透明油状液体。 在化学意义上,H2SO4是指SO3与H2O在摩尔比为1的化合 物,即100%硫酸,故有时称100%硫酸为SO3的一水合物。 通常指硫酸为SO3与H2O摩尔比小于1的任意比例混合物,当 SO3与H2O摩尔比大于1时,称为发烟硫酸。 在自然界中,游离硫酸存在与某些火山地带的温泉中、 硫化金属矿山的泉水、以及酸雨中。 硫酸是重要的基本化学工业原料。在大宗生产的化学品 中,硫酸的产量居于首位。在化肥、冶金、国防、有机合成、 石油炼制等工业都有广泛用途。
2FeO 0.5O2 Fe2O3 291.2 kJ mol
2FeS2 5.5O2 Fe2O3 2SO2 1655 .8 kJ mol 总反应式为: 可见,硫铁矿焙烧是强烈放热反应,除可供反应自热进 行外,还需要移出反应余热。
化学工艺学(第3章)

煅烧
工业应用:
制备气\固原料 制碱工业.煅烧石灰石 CaO、CO2 生成产品 制碱工业.煅烧NaHCO3 Na2CO3 工业催化剂制造 使催化剂的组分转化为氧化物
煅烧物化基础
不可逆化学反应过程。
A(s)= S(s)+G(g)
分解反应的自由能表达为温度的函数,最
低分解温度产物的分压力达0.1MPa的分解 温度.
焙烧
分类与工业应用 氧化焙烧:硫铁矿、硫化铜、硫化锌 4FeS2+11O2=Fe2O3+8SO2
空气过剩系 数大
3FeS2+8O2=Fe3O4+6SO2
温度 高
硫酸化焙烧:
2MeS+3O2 == 2MeO+2SO2 2MeO+SO2+O2 == MeO.MeSO4 MeO. MeSO4+SO2+O2 == 2MeSO4 挥发焙烧:
BaSO4+ZnS
硝酸钾的生产
硝酸钾的生产
HNO3+KHCO3 KNO3 NaNO3+KCl KNO3+NaCl
贵
经剂效益差
NH4NO3+KCl
便宜
KNO3+NH4Cl
农用化肥
HNO3+KCl
KNO3+HCl
90
CaF2 H 2 SO4 2HF CaSO4
200 250
Na2Cr2O7 H 2 SO4 (浓) 2CrO3
190
BaCl2生产 BaSO (重晶石) BaS 热水 BaS(ag) HCl BaCl2 4
硼砂生产
第三章硫酸与硝酸

27
化工及物化教研室
炉气除尘设备
(一)旋风分离器
气体排出管(不 含矿尘)
进气管(含 尘气体)
筒形外壳
锥体
储灰斗
星形阀
灰尘
29
化工及物化教研室
化工工艺学
(二)文丘里管洗涤器
含尘气体
净化气体
喷水嘴
扩张管
收缩管
洗涤水 喉管 旋风分离器 污水
(三)泡沫洗涤塔
气体出口
视镜 水喷头 筛板 气体进口
化工工艺学
46
化工及物化教研室
47
化工及物化教研室
化工工艺学
3.1.3.3 炉气的干燥 1)干燥的原理和工艺条件 (1)吸收酸的浓度
硫酸浓度越高,水蒸 气平衡分压越小。越 有利于干燥。
48
化工及物化教研室
化工工艺学
3.1.3.3 炉气的干燥
1)干燥的原理和工艺条件
(1)吸收酸的浓度
同一温度下,硫酸浓度越高越利于干燥。但三氧化硫分压大,易形成酸雾。 同一浓度下,温度低,酸雾少。
49
化工及物化教研室
化工工艺学
硫酸浓度高、温度低,二氧化硫损失大。
综上所述,干燥酸质量分数以93%一95%较为适宜, 这种酸还具有结晶温度较低的优点可避免冬季低温下 ,因硫酸结晶而带来操作和贮运上的麻烦。
50
化工及物化教研室
化工工艺学
(2)气流速度:0.7~0.9m/s
气速高,增大传质系数,利于干燥,但塔压降增大。
3.1.2.1 硫铁矿的焙烧
(1)硫铁矿的焙烧反应
14
化工及物化教研室
硝酸工业制法

硝酸工业制法硝酸概述硝酸(HNO3)是一种广泛应用于化工、农业和医药等领域的重要化工原料。
它是一种无色液体,具有强烈的腐蚀性和氧化性。
硝酸可用于生产肥料、爆炸物、染料、药品等多种化工产品。
硝酸的制备方法有多种,其中最常用的是硝酸工业制法。
硝酸工业制法的原理硝酸工业制法采用氧化反应将氨转化为硝酸。
其主要原理如下:1. 氨氧化反应在氨氧化反应中,氨气(NH3)与氧气(O2)在催化剂的作用下发生反应,生成一氧化氮(NO)和水(H2O)。
反应方程式如下:2NH3 + 2O2 → 2H2O + 2NO该反应是一个放热反应,在高温条件下进行。
催化剂通常采用铂或铑。
2. 一氧化氮的进一步氧化一氧化氮通过与氧气反应进一步氧化生成二氧化氮(NO2)。
反应方程式如下:2NO + O2 → 2NO2该反应也是放热反应,在高温条件下进行。
3. 氮酸化反应二氧化氮与水反应生成硝酸(HNO3)。
反应方程式如下:3NO2 + H2O → 2HNO3 + NO由于氮酸化反应的放热性质,硝酸产生的同时,反应体系会产生大量的热量。
硝酸工业制法的工艺流程硝酸工业制法的工艺流程大致分为氨氧化反应、氧化反应和吸收冷凝等几个步骤。
1. 氨氧化反应在反应器中,将氨气(NH3)与氧气(O2)在铂或铑催化剂的作用下进行氧化反应,生成一氧化氮(NO)和水(H2O)。
这一步需要控制反应温度、催化剂的使用量和氨气和氧气的流量比例,以保证反应的高效进行。
2. 氧化反应一氧化氮通过与氧气反应进一步氧化生成二氧化氮(NO2)。
这一步需要调节氧气的流量和反应温度,以保证反应的有效进行。
3. 吸收冷凝二氧化氮和水在吸收器中发生反应,生成硝酸(HNO3)。
反应过程中产生的热量通过冷却器冷凝,生成液态硝酸。
4. 分离纯化将生成的液态硝酸进行分离和纯化,得到符合要求的工业级硝酸产品。
硝酸工业制法的优势和挑战硝酸工业制法具有以下优势:1. 高效产率硝酸工业制法具有高效的反应过程,能够在较短的时间内得到大量的硝酸产品。
硝酸的生产工艺

硝酸的生产工艺硝酸是一种重要的无机化学品,广泛应用于化工行业和农业生产中。
硝酸的生产工艺主要有亚硝酸氧化法、铵盐法和硝基氧化法等。
1. 亚硝酸氧化法:亚硝酸氧化法是硝酸工业生产中最常用的方法。
该方法以氨为原料,通过两步反应生成硝酸。
首先,通过合成氨制取亚硝酸,然后将亚硝酸氧化为硝酸。
具体工艺如下:(1)合成氨制备亚硝酸反应。
在催化剂存在下,将氨与氧气在高温下反应得到亚硝酸:NH3 + O2 → HNO2 + H2O(2)亚硝酸氧化为硝酸反应。
在催化剂存在下,将亚硝酸与氧气反应得到硝酸:2HNO2 + O2 → 2HNO32. 铵盐法:铵盐法是通过铵盐来制备硝酸的方法。
这种方法主要有铵硫酸法和铵硝酸法两种。
具体工艺如下:(1)铵硫酸法。
将硫酸与氨反应得到硫酸铵,然后将硫酸铵在高温下脱水,生成硝酸:2NH3 + H2SO4 → (NH4)2SO4(NH4)2SO4 → 2NH3 + H2SO4 + H2O2NH3 + H2SO4 + H2O + 1/2O2 → 2HNO3 + (NH4)2SO4(2)铵硝酸法。
将铵硫酸和硝酸反应得到硝酸铵,然后经过脱水处理,生成硝酸:HNO3 + NH4OH → NH4NO3 + H2ONH4NO3 → N2O + 2H2O2NH4NO3 → 2N2O + O2 + 4H2ON2O + 3O2 → 2N2O52N2O5 + H2O → 2HNO33. 硝基氧化法:硝基氧化法是将有机化合物中的氨基或羟基氧化为硝基的方法,然后生成硝酸。
这种方法适用于有机合成过程中的硝化反应。
具体工艺如下:R-NH2 + 2HNO3 → R-NO2 + 2H2O + H2OR-OH + HNO3 → R-ONO2 + H2O以上是硝酸的主要生产工艺,不同的工艺适用于不同情况下的生产需求。
在实际生产中,还需要考虑反应条件、催化剂的选择、产品纯度的控制等因素,以提高生产效率和产品质量。
同时,硝酸的生产过程涉及一些化学反应和氧化,所以在操作过程中需要注意安全措施,以防止事故发生。
《化工工艺学》简答题含答案

第一章 合成氨1.合成氨的主要生产工序,各工序的作用和任务?答:1.原料气制备,制备含有氢、氮的原料气。
用煤、原油或天然气作原料,制备含氮、氢气的原料气。
2.净化,因为无论用何种方法造气,原料气中都含有对合成氨反应过程有害的各种杂质,必须采取适当的方法除去这些杂质,主要包括变换过程、脱硫脱碳过程以及气体精制过程。
3.压缩和合成,将纯净的氢、氮混合气压缩到高压,在铁催化剂的作用下合成氨。
2.写出烃类蒸汽转化的主要反应。
CH 4+H 2O(g)=CO+3H 2,CH 4=2 H 2+C3.简述常用脱硫方法及技术特点以及适用流程。
答:干法脱硫(氧化锌法脱硫;钴钼加氢脱硫法)是用固体吸收剂吸收原料气体中的硫化物一般只有当原料气中硫化氢质量浓度不高标准状态下在3-5g/m 3才适用。
特点:能脱除有机硫和无机硫而且可以把脱得很精细,但脱硫剂不能再生而且设备庞大占地多,不适用于脱除大量无机硫,只有天然气、油田气等含硫低时才使用;湿法脱硫(化学吸收法,物理吸收法,化学-物理综合吸收法)特点:脱硫剂是便于运输的液体物料,脱硫剂是可以再生并且能回收的硫磺,适用于脱除大量无机硫。
4.改良ADA 法脱硫的主要化学反应和脱硫原理是什么?ADA 法脱硫主要化学反应及脱硫原理:在脱硫塔中用PH 为8.5--9.2的稀碱溶液吸收硫化氢并生成硫化氢物: 液相中的硫化氢物进一步与偏钒酸钠反应,生成还原性焦性偏钒酸钠盐并析出无素硫 还原性焦性偏钒酸钠盐接着与氧化态ADA 反应,生成还原态的ADA 和偏钒酸盐 还原态的ADA 被空气中的氧气氧化成氧化态的ADA ,其后溶液循环使用 4.少量 CO 的脱除方法有哪些?答:铜氨液洗涤法、甲烷化法、液氮洗涤法。
5.以天然气为原料生产合成气过程有哪些主要反应?答:主反应:CO+H 2O(g)=H 2+CO 2 ,CH 4+H 2O(g)=CO+3H 2副反应:CH 4=2 H 2+C ,2CO=C+CO 2,CO+H 2=H 2O+C6.简述一段转化炉的炉型结构。
硝酸的各种制备方法

硝酸的各种制备方法硝酸是一种常用的无机化合物,广泛用于化学工业和实验室。
下面将介绍几种常见的硝酸制备方法。
1. 非催化硝化法非催化硝化法是制备硝酸的一种简单方法。
该方法基于硫酸和硝酸铵的反应,具体步骤如下:1. 将硫酸和硝酸铵按一定比例混合。
2. 在冷却条件下加热反应液。
3. 反应进行时,观察是否生成硝酸。
4. 硝酸生成后,停止加热并冷却反应液。
5. 用水将反应液稀释。
2. 有催化剂的硝化法使用催化剂的硝化法是另一种常见的硝酸制备方法。
这种方法需要使用铂、铂黑或铜作为催化剂,具体步骤如下:1. 准备硝酸铜溶液和硝酸铜密封。
2. 将硝酸铜溶液加入到密封中。
3. 将催化剂添加到溶液中。
4. 密封,以维持反应的高温和高压。
5. 反应一段时间后,打开,取出含硝酸的液体。
6. 将液体进行纯化和浓缩。
3. 电解法电解法是一种利用电解过程制备硝酸的方法。
具体步骤如下:1. 准备一个电解槽和两个电极(阳极和阴极)。
2. 将硫酸溶液注入电解槽中。
3. 将阳极和阴极分别连接到电源。
4. 在电解槽中施加适当的电压。
5. 通过电解过程,硫酸会分解产生硝酸和氢气。
6. 将生成的硝酸收集起来。
4. 硝酸的其他制备方法除了以上几种方法外,还有一些其他的硝酸制备方法,如气相硝化法和硝酸银分解法等。
这些方法在实验室和特定的工业领域中有一定的应用。
总结起来,硝酸的制备方法有非催化硝化法、有催化剂的硝化法、电解法以及其他一些特定的制备方法。
在选择制备方法时,应根据具体需求和实际情况来决定使用哪种方法。
化工工艺与设备硝酸

解金和铂。
Chemical Process and Equipment
生产浓硝酸的中间物-液体N2O4是火箭、导弹发射的高能 燃料; 硝酸将苯硝化,并经过还原制成的苯胺,为染料生产中
的主要中间体之一。
此外,制药、塑料、有色金属冶炼等方面都需要用到硝 酸。
Chemical Process and Equipment
§3.1 性质及用途
§3 硝 酸
硝酸是一种重要的化工原料,在各种酸中,产量仅次于硫酸,
主要消耗部门为化肥工业和国防工业。
稀硝酸大部分用于制造硝酸铵、硝酸磷肥和各种硝酸盐。 浓硝酸用于炸药、有机合成工业,是生产TNT(2,4,6-三 硝基甲苯)、硝化甘油等烈性炸药和硝化纤维素的原料;
Chemical Process and Equipment
Chemical Process and Equipment
欲获得所要求的产物NO,不可能从热力学去改变化学平衡
来达到目的,而只能从反应动力学方面去努力。
铂系催化剂是最适宜的选择性良好的催化剂。
Chemical Process and Equipment
2.氨氧化催化剂
(1) 化学组成 纯铂具有催化能力,但易受损失。一般采用铂
具有弹性,活性较小。为了提高铂网的活性,在
使用之前需进行“活化”处理,其方法是用氢气 火焰进行烘烤,使之变得松疏,粗糙,从而增大 接触表面积。铂与其他催化剂一样,气体中许多 杂质会降低其活性。因而一般在使用3~6个月后
就应进行再生处理。
空气中的灰尘(各种金属氧化物)和氨气中可能夹
带的铁粉和油污等杂质及 H2S气体。
Chemical Process and Equipment
硝酸
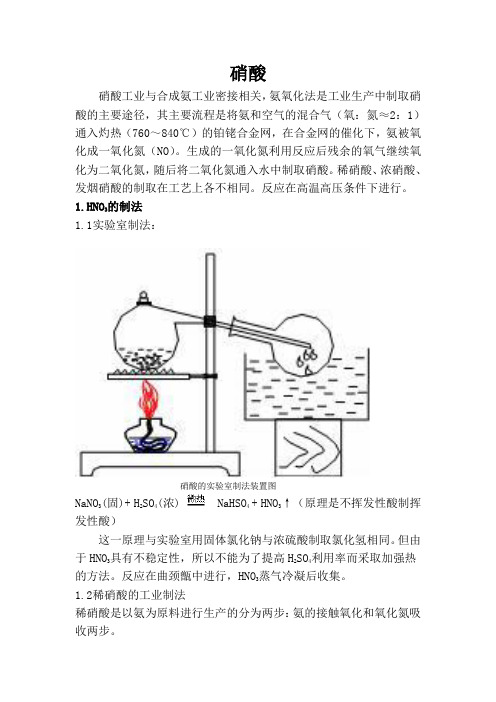
硝酸硝酸工业与合成氨工业密接相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程是将氨和空气的混合气(氧:氮≈2:1)通入灼热(760~840℃)的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。
生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸。
稀硝酸、浓硝酸、发烟硝酸的制取在工艺上各不相同。
反应在高温高压条件下进行。
1.HNO3的制法1.1实验室制法:硝酸的实验室制法装置图NaNO3(固)+ H2SO4(浓) NaHSO4 + HNO3↑(原理是不挥发性酸制挥发性酸)这一原理与实验室用固体氯化钠与浓硫酸制取氯化氢相同。
但由于HNO3具有不稳定性,所以不能为了提高H2SO4利用率而采取加强热的方法。
反应在曲颈甑中进行,HNO3蒸气冷凝后收集。
1.2稀硝酸的工业制法稀硝酸是以氨为原料进行生产的分为两步:氨的接触氧化和氧化氮吸收两步。
用氨催化氧化的方法制硝酸,主要有三步。
(l)氨的氧化从氨合成工段来的氨气和空气按一定比例混合,在铂网催化剂的作用下生成一氧化氨,其反应式为4NH3+5O2催化剂、高温4N0+6H20 △H = - 907.3 kj/mol(2) 一氧化氨继续氧化生成二氧化氨氨催化氧化后的气体中主要是NO、H20以及没有参加反应的N2、02将该气体冷却降温到150-180℃,NO继续氧化便可得到二氧化氨,反应式为2NO + O2 =2NO2△HR = - 112.6 kj/mol(3)二氧化氨气体的吸收水吸收二氧化氨气体生成硝酸和一氧化氨,反应式如下:3NO2 + H20 = 2HNO3 + NO △H= -136.2 kj/mol从式可以看出,用水吸收的NO2,只有2/3生成硝酸,还有1/3转化为NO。
耍利用这部分NO,必须使其氧化为NO2,氧化后的NO2仍只有2/3被吸收,因此吸收后的尾气必有一部分NO排空,需要治理,否则污染环境。
尾气处理,生产过程中NO循环使用,可以最大程度利用原料,并且减少尾气中的NO X的排放。
化工工艺学第3章 硫酸与硝酸

含硫原料 原料气的制备 含二氧化硫炉气 炉气净制 净化炉气 二氧化硫转化 炉气净制 二氧化硫转化 含三氧化硫气体 吸收成酸 吸收成酸 硫酸 生产硫酸的原料 硫铁矿:主要成份是FeS2。磁硫铁矿:主要成份 为Fe7S8。含S量越高,锻烧时放热越多。两种矿 含S量相同时,磁硫铁矿锻烧放热量比普通硫铁矿 高30%左右。自然开采的硫铁矿都含有很多杂质, 使矿呈灰、褐、黄铜等不同颜色。通常含硫量只 有30%~50%。 • 硫磺:使用天然硫磺生产硫酸最好,但我国矿少。 • 其它原料:硫酸盐、冶炼烟气、含硫工业废料等。 • • • • •
•
• • • • • • •
As2O3 ,SeO2在气体中的饱和浓度
温度 /°C 50 70 100 125 150
临 界4 过 饱2 和 度0
100 150
As2O3饱和 浓度/mg/Nm3 0.016 0.310 4.200 37.000 280.0 6
SeO2 饱和 浓度/mg/Nm3 0.044 0.880 1.000 82.000 530.0
化工工艺学 Chemical engineering technics
化学工程与工艺专业
第3章 硫酸与硝酸 Vitriolic acid and nitric acid
3.1 硫酸
• • • • • • 3.1.1 3.1.2 3.1.3 3.1.4 3.1.5 3.1.6 概述 从硫铁矿制二氧化硫炉气 炉气的净化与干燥 二氧化硫的催化氧化 三氧化硫的吸收 三废治理与综合利用
酸洗流程中酸可循环使用,多余酸排出系统他用。 可利用炉气中的SO3,提高了S的利用率。酸泥中 的砷硒也可回收。最大优点是排污量少,约为水 洗流程的1/200~1/300。
目前投产的工厂一般都不允许采用水洗流程。
化工工艺学3章 硝酸(参考)

4.氨氧化工艺条件的选择
• 主要因素有氨氧化率,生产强度和铂损失。
• (1)温度
• 温度越高,催化剂的活性也越高。生产实践证明, 要达到96% 以上的氨氧化率,温度不得低于780℃。 温度太高,铂的损失和副反应加剧。常压下氨氧化 温度取780~840℃。压力增高时,操作温度可相应提 高,但不应超过900℃。
氧化率可保证在98.5%左右。
图3.29
在900℃时,氧化率与催化剂生产 强度、混合气中氨含量的关系
• (4)混合气体组成
• 氧和氨比值(v=O2/NH3)是影响氨氧化率的重要因素 之一。增加混合气中氧浓度,有利于增加氨氧化率;
增加混合气中的氨浓度,则可提高铂催化剂的生产 强度。在选择v时,还要考虑后工序NO氧化需要的 氧气。为此,考虑总反应式:
Ka 2 P 2
r
NO
11
NO
r
1
12
ln
r1 NO
r NO
此图是上 述方程的 算图,可 便捷计算 NO的氧化 时间见 P332-333
3.一氧化氮氧化的工艺过程
• 氨氧化后经余热利用,还需继续冷却。此时, NO会不断氧化,当其与冷凝的水蒸气接触时, 就会生成一部分稀硝酸,从而降低气体中氮氧 化物的浓度,不利于后续吸收操作。
• (2)压力
• 氨氧化反应实际上可视为不可逆反应,压力对于 NO产率影响不大,但加压有助于反应速度的提高。 一般加压氧化压力0.3~0.5MPa,综合法流程中氨氧 化为常压,NO2吸收为加压,以兼顾两者之优点。
• (3)接触时间
• 接触时间应适当。时间太短,氨来不及氧化,使 氧化率降低;时间太长,氨在铂网前高温区停留 过久,容易分解,也会降低氨氧化率。
硝酸生产工艺

硝酸生产工艺硝酸是一种重要的化学原料,广泛应用于农业、燃料、化工等领域。
硝酸生产工艺可以分为氨氧化法和硝化法两种。
1. 氨氧化法氨氧化法是利用氨与氧气反应制备硝酸的方法。
其反应方程式为:4NH3 + 5O2 →4NO + 6H2O2NO + O2 →2NO23NO2 + H2O →2HNO3 + NO该反应需要高温高压条件下进行,通常在800-1000℃和8-10 MPa的条件下进行。
反应产物还需经过吸收和脱水等步骤,最终得到浓硝酸。
氨氧化法的优点是能够在单一反应器内完成反应和吸收等多个步骤,生产过程较为简单。
但它需要高温高压,能耗大,设备成本高,对原料氨与氧气的纯度要求也较高。
2. 硝化法硝化法是利用硝石或硝酸盐与酸反应制备硝酸的方法。
硝化法可分为两种:一种是直接硝化法,一种是间接硝化法。
①直接硝化法直接硝化法是指将硝酸盐与浓硫酸反应,生成硝酸的过程。
其反应方程式为:NaNO3 + H2SO4 →NaHSO4 + HNO3该反应需要在较低的温度下进行,通常在20-30℃左右,生产过程简单,能源消耗较低。
但生产过程中需要处理酸性废水和废气,环境压力较大。
②间接硝化法间接硝化法是指将硝石或硫酸铵与浓硫酸反应,生成混合酸的过程,进而生成硝酸。
其反应方程式为:KNO3 + H2SO4 →KHSO4 + HNO3(NH4)2SO4 + 2H2SO4 →2NH4HSO4NH4HSO4 + HNO3 →(NH4)NO3 + H2SO4该方法需要多个反应器和分离装置,生产过程复杂,但它具有高效节能、环保等优点。
总体来说,硝酸的生产工艺各有优劣,可以选择根据实际情况选择合适的方法。
未来,随着科技的不断进步和环保要求的提高,硝酸生产工艺也将更加绿色、高效和可持续。
硝酸

硝酸的品种、生产和用途
工业硝酸浓度在50%-70%之间的为稀硝酸,在96%-98%之间的为浓硝酸。
稀硝酸的生产是以氨为原料,分两步完成。
首先对氨进行接触氧化,生成一氧化氮。
再进一步氧化成二氧化氮,最后被氧吸收生成稀硝酸。
硝酸与水混合,在浓度为68.4%时形成共沸混合物(共沸酸),故浓硝酸不能用简单蒸馏制得。
生产浓硝酸的方法有:
1、利用脱水剂萃取蒸馏稀硝酸。
2、在一定温度和压力下,先将二氧化氮制成液态四氧化二氮,再和氧、水直接反应。
3、蒸馏超共沸酸。
硝酸是重要的化工原料,其产量仅次于硫酸。
稀硝酸大部份用于制备硝酸铵、硝酸磷肥,浓硝酸主要用于制造火药和硝化纤维。
浓硫酸:常用质量分数98%,密度1.84g/ml,(无色的,一般不说有什么颜色)浓硝酸:常用质量分数65%,密度1.4g/mol,由于分解生成NO2使溶液呈黄色。
浓盐酸:常用质量分数37%,密度1.17g/ml,由于含Fe3+(设备铁锈溶解)溶液黄色。
纯硝酸为无色、容易挥发的液体,沸点约为83 °C,凝固点约为-42 °C,密度为1.51g/ml。
可以与水以任意比混溶。
浓硝酸因溶有NO2而显棕红色,也会挥发出棕红色的NO2。
一般的浓硝酸指的是16mol/L的HNO3水溶液,密度为1.42g/ml。
∙HNO3 + H2O → H3O+ + NO3-(水中)
∙HO-NO2 + 2H2SO4→ NO2+ + 2HSO4- + H3O+(浓硫酸中)
∙4HNO3→ 4NO2 + O2 + 2H2O。
硝酸工艺——精选推荐

摘要:硝酸是基本化学工业的重要产品之一,也是一种重要的化工原料,产量在各类酸中仅次于硫酸。
工业上制取浓硝酸(HNO3浓度高于96%)的方法有三种:一是在有脱水剂的情况下,用稀硝酸蒸馏制取的间接法,习惯上称“间硝";二是由氮氧化物、氧及水直接合成浓硝酸,称为’直硝’;三是包括:氨氧化、超共沸酸(75%—80%HNO3)生产和精馏的直接法。
关键词:浓硝酸、氨氧化、超共沸精馏法前言硝酸是基本化学工业的重要产品之一,也是一种重要的化工原料广泛用于生产化肥、炸药、无机盐,也可用于贵金属分离、机械刻蚀等。
目前,我国有浓硝酸厂家20多家,年生产能力在80万吨以上。
1999年产量在73万~75万吨,到2005年稀硝酸生产能力达544.7万吨,2004年浓硝酸产量130.5万吨,2005年产量157万吨,2006年新增产能达300万吨。
稀硝酸是合成氨的下游产品,与化肥生产紧密相关。
浓硝酸最主要用于国防工业,是生产三硝基甲苯(TNT)、硝化纤维、硝化甘油等的主要原料。
生产硝酸的中间产物——液体四氧化二氮是火箭、导弹发射的高能燃料。
硝酸还广泛用于有机合成工业;用硝酸将苯硝化并经还原制得苯胺,用硝酸氧化,苯可制造邻苯二甲酸,均用于染料生产。
此外,制药、塑料、有色金属冶炼等方面都需要用到硝酸。
我国硝酸的消费结构大致为:化学工业占65%左右,冶金行业占20%,医药行业占5%,其他行业占10%。
在化学工业中生产浓硝酸的工艺主要有多种大同小异的工艺流程,生产中是根据氨氧化和氮氧化物吸收操作压力的不同分为间接法、直硝法和直接法三种类型。
1 硝酸的性质、用途及生产方法1.1 硝酸的性质纯硝酸为带有窒息性与刺激性的无色液体,其相对密度1.522,沸点83.4℃,熔点‐41.5℃,分为浓硝酸和稀硝酸。
无水硝酸极不稳定,一旦受热见光就会分解,生成二氧化氮和水。
硝酸能与任意比例的水混合,形成浓硝酸(96%~98%HNO3)和稀硝酸(45%~70% HNO3)。
硝酸生产工艺流程

硝酸生产工艺流程
硝酸是一种重要的化学物质,广泛用于农业、医药、冶金等领域。
下面将介绍一种常见的硝酸生产工艺流程。
硝酸的生产通常采用硝化法,该法是通过将氨气与空气中的氧气在高温下反应生成焦亚硝酸,然后与水反应生成硝酸。
具体的工艺流程如下:
首先,将空气通过压缩机压缩到一定的压力,去除其中的水分和杂质,然后经冷凝器冷却,得到干燥的压缩空气。
其次,将压缩空气与氨气按一定比例混合,并加热至700℃以上,送入催化剂床层进行反应。
在催化剂的作用下,氨气与空气中的氧气发生氧化反应生成焦亚硝酸(NO2)。
然后,将产生的焦亚硝酸与进一步的空气进行反应,得到一氧化氮(NO)。
接下来,要将一氧化氮与水反应生成硝酸。
具体的反应可以采用两种方法,一是将一氧化氮直接通入水中进行反应,生成硝酸液;另一种方法是将一氧化氮先与空气中的氧气反应生成二氧化氮(NO2),再与水反应生成硝酸。
这两种方法都需要进行冷却和加热处理。
最后,将生成的硝酸进行脱碳、浓缩、过滤等一系列后续处理。
脱碳是为了去除其中的一氧化碳和二氧化氮等有害气体,浓缩是为了提高硝酸的浓度,过滤是为了去除其中的不溶性杂质。
值得注意的是,硝酸生产过程中产生的废气和废水要经过处理后排放,以减少对环境的污染。
废气处理可以采用洗涤吸收法和焚烧法等方法,废水处理则要进行中和、脱盐、沉淀等工序,以确保排放达到环保标准。
以上就是一种常见的硝酸生产工艺流程。
随着科技的不断进步,硝酸生产工艺也在不断改进和创新,以提高生产效率、减少能源消耗,并尽量减少对环境的影响。
化工工艺与设备3硝酸

加热时不会分解;不与硝酸发生反应,且易与硝
酸分离,以便于循环使用;对设备腐蚀性小;来
源广泛,价格便宜。
工业上常用的脱水剂有浓硫酸和碱土金属的
硝酸盐。其中以硝酸镁的使用最为普通。
Chemical Process and Equipment
(4) 混合气体的组成
选择混合气体的组成时,最
主要是氨的初始含量。从提高催化剂生产强度出
发,增加氨浓度是有利的,但由于空气中氧含量
的限制,限制了氨浓度的提高。
研究结果表明,当氧氨比比值在1.7~2.0范 围内,氨氧化率最高,此时混合气体中氨浓度为 9.5%~11.5%。
2NO O2 2NO2 112.6kJ / mol
NO NO2 N2O3 40.2kJ / mol
2 NO2 N2O4 56.9kJ / mol
上述三个反应都是气体体积数减少的可逆放热反应。所以, 从平衡角度上,降低反应温度,提高操作压力,有利于一 氧化氮氧化反应的进行。
纯铂具有催化能力,但易受损失。一般采用
例:铂铑钯三元合金,其常见的组成为铂93%、铑3%、 钯4%。 (2) 形状 铂系催化剂不用载体,因为用了载体后,铂难以
回收。为了使催化剂具有更大的接触面积,工业上将其做
成丝网状。
Chemical Process and Equipment
(3) 铂网的活化、中毒和再生
新铂网表面光滑而
且具有弹性,活性较小。为了提高铂网的活性,
在使用之前需进行“活化”处理,其方法是用氢 气火焰进行烘烤,使之变得松疏,粗糙,从而增 大接触表面积。铂与其他催化剂一样,气体中许 多杂质会降低其活性。因而一般在使用3~6个月
后就应进行再生处理。
硝酸工艺流程

硝酸工艺流程硝酸是一种广泛应用于化学工业生产和实验室研究中的重要化学物质。
下面是一种常用的硝酸工艺流程。
硝酸的生产可以通过两种方法进行,一种是氧化法,另一种是吸收法。
下面我们来介绍氧化法的硝酸工艺流程。
首先,原料准备。
氧化法生产硝酸的原料主要有铵硝酸(NH4NO3)和浓硫酸(H2SO4)。
铵硝酸一般通过氨气和浓硝酸反应得到,浓硝酸则通过硝酸加热蒸馏得到。
第二步,反应器装置。
氧化法生产硝酸的反应器一般为反应塔。
反应塔内部通常有一系列的泡板,泡板上装有横向流动的溢流槽或喷淋装置,用于促进反应的进行。
第三步,反应过程。
在反应塔中,铵硝酸和浓硫酸按一定比例加入反应器。
反应塔内部的温度要保持在适宜的范围内,一般为70-80℃。
在反应过程中,铵硝酸被硫酸氧化分解为硝酸和水,并伴随着大量的热量释放。
第四步,硝酸分离。
在反应塔中,硝酸和水蒸汽从顶部溢流出来,进入冷凝器冷却。
冷却后的液体通过分离器分离出硝酸和水两个组分。
硝酸被提取出来,经过进一步的浓缩和处理后,就得到了纯度较高的硝酸产物。
第五步,尾气处理。
在硝酸生产过程中,会产生大量的尾气。
尾气中含有硝酸蒸汽、硫酸蒸汽和其他有害气体。
通过采用各种尾气处理设备,如冷凝器、吸收塔等,对尾气进行处理,以回收硝酸和硫酸,避免对环境的污染。
以上就是一种常用的氧化法硝酸生产的工艺流程。
在实际生产中,还需要根据具体情况进行调整和改进。
硝酸的制备过程需要严格控制各种工艺参数,如反应温度、反应时间等,以保证硝酸的产量和质量。
硝酸作为一种强氧化剂和腐蚀剂,具有广泛的应用领域,包括肥料制造、爆炸药制备、金属腐蚀等。
因此,有关硝酸的工艺流程的研究和改进非常重要,以提高生产效率、减少能耗和污染,保障生产安全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亚硝酸 (HNO2) 含量/% ≤ 0.15
硫酸 (H2SO4) 含量/% ≤ 0.08
灼烧残渣含量/%
≤ 0.02
二级品 97.2 0.20 0.10 0.04
• 硝酸具有广泛的用途:制造化肥,大部分用于生 产硝酸铵和硝酸磷肥;制造硝酸盐,如钠、镁、 锂、铷等金属的硝酸盐;作有机合成原料,浓硝 酸可将苯、蒽、萘和其它芳香族化合物硝化制取 有机原料;制造草酸;用于军火工业,制取TNT 炸药,或精制提取核原料;用于合成香料;硝酸 还用于化学试剂及有色金属酸洗。
4.氨氧化工艺条件的选择
• 主要因素有氨氧化率,生产强度和铂损失。
• (1)温度
• 温度越高,催化剂的活性也越高。生产实践证明, 要达到96% 以上的氨氧化率,温度不得低于780℃。 温度太高,铂的损失和副反应加剧。常压下氨氧化 温度取780~840℃。压力增高时,操作温度可相应提 高,但不应超过900℃。
氧化率可保证在98.5%左右。
图3.29
在900℃时,氧化率与催化剂生产 强度、混合气中氨含量的关系
• (4)混合气体组成
化工工艺学 Chemical engineering
technics
化学工程与工艺专业
3.2 硝 酸 (Nitric acid)
3.2.1 概 述
息纯,硝有酸刺(激1性00气%味H,NO常3温)下为能无分色解液:体,可使动物窒
4HNO3 4NO2 + O2 + H2O
(1)
释放出的NO2溶于硝酸而呈黄色。
(3.2.4)
• 在其它条件一定时,铂催化剂的生产强度与接触
时间成反比(即与气流速度成正比)。在900℃
及O2/NH3 =2的条件下,不同初始氨含量co时, 氨的氧化率与生产强度的关系见图3-29。由图
可看出,对应于某一个氨含量co,有一个氧化率 最大时的催化剂生产强度A。工业生产中催化剂
的生产强度可达900~1000 kg NH3/(m2·d),氨
• 2.氨氧化催化剂
• 氨氧化催化剂有两大类:一类是铂系催化剂;另一类是 非铂系催化剂。
• (1) 铂系催化剂
• 铂系催化剂以金属铂为主体,价格昂贵,催化活性最好, 机械性能和化学稳定性良好,易再生,容易点燃,操作 方便,在硝酸生产中得到广泛应用。
• 因铂难以回收,铂系催化剂不用载体。工业上 将其做成丝网状。新铂网表面光滑、有弹性, 但活性不好,在使用前需要进行“活化”处理, 即用氢火焰进行烘烤,使之疏松、粗糙,以增 大接触面积。
硝酸能以任意比例溶解于水,并放出稀释热,稀释
热可用下式计算:
•
Q m 37.41n 1.737 n
(3.2.1)
• 式中 Q: 稀释热,J/mol; m : 纯硝酸的物质
的量,mol;n : 水与纯硝酸的摩尔比。
表3-10 浓硝酸标准(GB337—84)
指标名称
一级品
硝酸 (HNO3) 含量/% ≥ 98.2
lg c0 c1
Sm 0.951
dV0
0.45 0.288dV0 0.56
• 式中 C0——氨空气混合气中氨的浓度,%; • C1——通过铂网后氮氧化物气体中氨的浓度,%; • S——铂网的比表面积,活性表面积cm2/铂网截面
积cm2;
• m——铂网层数;d——铂丝直径,cm;
• V0——标准状态下的气体流量,l/h.cm2铂网面积。
• 2NH3 N2 + 3H2 ΔH4 = 91.69kJ/mol
(5)
• 2NO N2 + O2 ΔH5 = 180.6kJ/mol
(6)
4NH3 + 6NO 5N2 + 6H2O ΔH6 = 1810.8kJ/mol (7)
• 一定温度下,氨氧化和氨分解反应的平衡常数很大。如 果对反应不加控制,氨和氧反应的最终产物必然是氮气。 欲得到NO,不能从热力学去改变化学平衡来达到目的, 只能从反应动力学方面去着手。即寻找一种选择性催化 剂,抑制不希望的反应。目前最好的选择性催化剂是铂。
• ① 铂吸附氧的能力极强,吸附的氧分子发生原 子间的键断裂。
• ② 铂催化剂表面从气体中吸附氨分子,随之氨 分子中氮和氢原子分别与氧原子结合。
• ③ 在铂催化剂活性中心进行电子重排,生成一 氧化氮和水蒸气。
• ④ 铂催化剂对一氧化氮和水蒸气吸附能力较弱, 因此它们会离开铂催化剂表面进入气相。
• M.N.捷姆金导出了800~900℃间在Pt-Rh网上氨氧 化反应的动力学方程
• 考虑到铂网的弯曲因素,接触时间可由下式计算:
0
3
fSdmp V0Tk
k
• 式中 Pk —— 操作压力; • Tk—— 操作温度; • f —— 铂网自由空间体积百分率。
• 其余符号意义同动力学方程。
(3ቤተ መጻሕፍቲ ባይዱ2.3)
• 催化剂的生产强度与接触时间有关
A 1.97 105 c0 fdpk
S 0Tk
• (2)压力
• 氨氧化反应实际上可视为不可逆反应,压力对于 NO产率影响不大,但加压有助于反应速度的提高。 一般加压氧化压力0.3~0.5MPa,综合法流程中氨氧 化为常压,NO2吸收为加压,以兼顾两者之优点。
• (3)接触时间
• 接触时间应适当。时间太短,氨来不及氧化,使 氧化率降低;时间太长,氨在铂网前高温区停留 过久,容易分解,也会降低氨氧化率。
• (2) 非铂系催化剂
• 为替代价格昂贵的铂,长期以来,对铁系及钴 系催化剂进行了许多研究。因铁系催化剂氧化 率不及铂网高,目前难以完全替代铂网,一般 是将两者联合使用。
• 非铂催化剂价廉易得,新制备的非铂催化剂活 性往往也较高,所以研制这类新催化剂仍是很 有前景的。
3.氨催化氧化反应动力学
一个反应机理是:
• 目前,工业硝酸皆采用氨氧化法生产。该工艺包 括氨的接触氧化,一氧化氮的氧化和氮氧化物的 吸收。此工艺可生产浓度为45%~60%的稀硝酸。
3.2.2 稀硝酸生产过程
• 1.氨氧化反应
• 氨和氧可进行下面三个反应:
4NH3 + 5O2 4NO + 6H2O ΔH1 = -907.28kJ/mol (2) 4NH3 + 4O2 2N2O + 6H2O ΔH2 = -1104.9kJ/mol (3) 4NH3 + 3O2 2N2 + 6H2O ΔH3 = -1269.02kJ/mol (4) 另外,还能发生下列三个反应:
