成都理工大学2010年分析化学考研真题试卷
分析化学考试试卷及答案

分析化学试卷一、填空题〔每空1分,共20分〕1.在分析过程中,以下情况将引起何种〔系统、随机〕误差。
使用没有校正的砝码引起系统误差;用局部风化的H2C2O4·H2O标定NaOH引起系统误差;滴定管读数最后一位不一致为随机。
2.万分之一天平的每次称量误差为,其相对误差为%100001.0⨯±m假设要求称量的相对误差为0.2%,称量时至少要称取质量0.1 g。
3.配制标准溶液的方法有直接配制法和间接配制法。
4.用溶液滴定和H3BO3混合溶液时,在滴定曲线上出现 1 个突跃。
〔H3BO3的p Ka1〕5.写出NH4Ac在水溶液中的质子条件:[HAc]+[H+]=[OH—]+[NH3]6.乙酸钠〔p Ka〕的pH=8.87 。
7.3·H2O和4Cl水溶液的pH= 。
8.六次甲基四胺的p K b ,用它配制缓冲溶液时的pH范围是5.15±19.某一弱酸型的指示剂和离解常数为K HIn=1.0×10-5,该指示剂的理论变色范围是pH=5±1 。
10.用3滴定同浓度的NaOH的pH突跃范围为。
假设HNO3和NaOH的浓度均减小10倍,那么pH突跃范围为8.7~5.3 。
11.用KMnO4滴定-242OC时,红色的消失由慢到快是属于自动催化反响。
12.于2+(1mol/L H2SO4)溶液中分别滴入和20.028mL Ce4+溶液,平衡时,体系的电位分别0.86 为和 1.26 ;化学计量点的电位为 1.06〔VVFeFeCeCe68.0;44.1'0/'0/2334==++++ϕϕ〕。
13.某有色物的浓度为1.0×10-4mol/L,以1cm吸收池在最大吸收波长下的吸光度为,在此波长下该有色物的ε= 4.8×103L·mol-1·cm-1,T%= 0.33=33%。
二、选择题〔在此题的每一小题的备选答案中,只有一个答案是正确的,请把你认为正确答案的题号,填入题干的括号内。
871分析化学2010初试科目试题

(6 分) 2. 实验室测定某样品中 A 组分的质量分数,平行测定 6 次的平均值为 35.05%, s = 0.50%,请计算:(1)置信度为 90%时 µ 的置信区间;(2)若上述数据为 3 次测定的平均值,µ 的置信区间又为多少?比较两次计算结果可得出什么结 论?(8 分) 附:tP, f 值表(双边)
第 4 页,共 6 页
五.计算题(共 8 小题,共 60 分) 计算题 1. 欲将 100.00 mL 0.2500 mol·L–1HCl 标准溶液调节成对 CaCO3 的滴定度
THCl / CaCO3 =0.01001 g·mL–1,问需加多少 mL 纯水。 M CaCO3 = 100.09g ⋅ mol ) (
)
C. 氙灯
19.在直接电位法中的指示电极,其电位与被测离子的活度的关系为 A. 符合能斯特公式 B. 成正比 D. 无关 )
(
)
C. 与其对数成正比
20.库仑分析与一般滴定分析相比 ( A. 需要标准物进行滴定剂的校准 B. 很难使用不稳定的滴定剂 C.测量精度相近
D.不需要制备标准溶液,不稳定试剂可以就地产生 二、填空题(共 30 空格,每空格 0.5 分,共 15 分) 填空题 1. 根据酸碱质子理论, 决定酸碱强度的因素是物质对 写出 HAc 在水溶液中的共轭酸碱对 (1) 的相对大小和 (2) ; (4) 。
Ka 3 Kw
A. K b = 1
K b1 = Kw Ka 2
B. K b = 1
Kw Ka 3
C. K b = 1
Kw K a1
D.
4. EDTA 络合滴定用二甲酚橙作指示剂,测定 Pb2+、Bi3+混合溶液中 Pb2+浓度, 控制酸度用( A. NH3 – NH4Cl )。 B. HAc – NaAc C. HNO3 D. (CH2)6N4
成都理工大学(已有10试题)

成都理工大学地球科学学院高等数学(一)2002——2005高等数学(二)2000——2005自然地理学2004——2005旅游资源学2004——2005城市规划原理2004——2005普通地质学2004——2005测量学2004——2005地理信息系统概论2004——2005,2010(2010为回忆版)C语言及程序设计2004——2006遥感地质学2004遥感导论2005微机原理及应用2001——2002,2004——2006(2005有答案)沉积岩石学2004——2005地球科学概论2004——2005找矿勘探地质学2004——2005环境化学2004——2005普通化学2004——2005地质学基础2004——2005油藏工程2004——2005石油地质学2004——2005(注:2005年试卷共6页,缺第5页和第6页)渗流力学2004——2005油层物理学2004——2005普通生物学2004——2005结晶学与矿物学2005能源学院普通地质学2004——2005油层物理学2004——2005沉积岩石学2004——2005石油地质学2004——2005(注:2005年试卷共6页,缺第5页和第6页)找矿勘探地质学2004——2005渗流力学2004——2005油藏工程2004——2005机械原理2004——2005环境与土木工程学院混凝土结构2004——2005工程岩土学2004岩土力学2004——2005结构力学2004——2005工程力学2004——2005环境化学2004——2005水力学2004——2005建筑设计原理2004——2005城市规划原理2004——2005普通生物学2004——2005机械原理2004——2005信息工程学院普通物理2004物理2005地球科学概论2004——2005地质学基础2004——2005信号与系统2004——2006通信原理2004——2006微机原理及应用2001——2002,2004——2006(2005有答案)C语言及程序设计2004——2006数据结构2004——2006数字电子技术2004,2006计算数学2004线性代数2004——2005概率论2004计算方法2004——2005高等数学(一)2002——2005高等数学(二)2000——2005核技术与自动化工程学院高等数学(一)2002——2005高等数学(二)2000——2005普通地质学2004——2005分析化学2004——2005无机化学2004——2005普通化学2004——2005电子测量与仪器2005微机原理及应用2001——2002,2004——2006(2005有答案)核电子学基础2005普通物理2004物理2005机械原理2004——2005材料与化学化工学院高等数学(一)2002——2005高等数学(二)2000——2005无机化学2004——2005分析化学2004——2005有机化学2004——2005无机材料物理化学2004——2005 材料科学基础2004——2005材料科学概论2004——2005化工原理2004——2005结晶学与矿物学2005信息管理学院高等数学(一)2002——2005数据结构2004——2006计算数学2004线性代数2004——2005概率论2004最优化方法2004——2005计算方法2004——2005管理学研究2005现代管理学原理2004微观经济学2004——2005西方经济学2004——2005文法学院马克思主义哲学原理2004——2005 科学技术史2004——2005社会学原理2004——2005外国语学院综合英语2004——2006英语语言基础理论2004——2005 二外俄语2003二外法语2004——2006二外日语2004——2006沉积地质研究院高等数学(一)2002——2005高等数学(二)2000——2005普通地质学2004——2005地球科学概论2004——2005沉积岩石学2004——2005普通生物学2004——2005传播科学与艺术学院(无此试卷)。
分析化学习题册(试题).doc

《分析化学》试题(一)一、选择题(共30分)(一)单选题(每题1分,共10分。
)1 .测定样品含量时,样品的称量量为0.1600g,测定结果表示正确的是()A.75%B.75.0%C.75.00%D.75.0000%2.下列能直接配制的标准溶液是()A.NaOHB.HCIC.AgNO3D.KMnO43.酸碱指示剂的理论变色范围是()A.PH = PK±1B.PH = PK+1C.PH = PK-1D.PH = PK4.为减小试剂误差,可通过做()A.对照试验B.空白试验C.多次测定,取平均值D.Q检验5.用铭酸钾指示剂法测CI-含量的介质条件是()A.强酸B.强碱(:.弱酸D.中性及弱碱6.某样品中磷的测定时,使磷以MgNH4PO4形式沉淀,再灼烧为Mg2P2O7形式称重,以求P2O5的含量,则化学因数的表达式为()A.2P/Mg2P2O7B.2P2O5/Mg2P2O7C.P2O5/Mg2P2O7D.P2O5/MgNH4PO47.重氮化滴定可用于测定()A.CH3-CH2-CH2-NH2B.CH3-CH2-NH-CH3C.=ZD.8.若用配位滴定法测定下列离了的含鬲,必须采用I可滴法测定的是()A.AI34-B.Mg2+C.Ca2+D.Zn2+9.用宜接碘量法测定Vc含量时,溶液显碱性,分析结果将()A.偏高B.偏低C.无影响D.无法到终点10.用HCI滴定NH3・H2O时,若选用酚帔作指示剂,贝U山此产生的误差属于()A.方法误差B.滴定误差C.仪器误差D.操作误差(二)多选题(每题2分,共20分。
)1.用蒸循水洗后,必须用所装溶液润洗后才能使用的是()()()()()A.滴定管B.移液管C.量筒D.锥形瓶巳容量瓶2.标定KMnO4标准溶液可选用的物质有()()()()()A.H2C2O4 基准物B.Na2C2O4 基准物C.Na2S2O3D.K2Cr2O7 基准物E. (NH4) 2Fe (SO4) 2 基准物3.影响配位平衡的主要因索是()()()()()A.酸效应B.配位效应C.盐效应D.同离K效应巳水解效应4.测Cu2+的含量,可选择的分析方法有()()()()()A.酸碱直接滴定B.Mohr法C.配位滴定D.P1滴碘量法E.置换碘量法5.配位滴定中,金属指示剂(In)应具备的条件有()()()()()A.是配位剂B.In的颜色与M-In不同C.KM-Y>KM-InD.KM-Y<KM-InE.M-In 溶于水6.两样本均值的t检验,可检验()()()()()是否存在显著差异。
2010年全国普通高等学校招生考试化学四川卷

理科综合能力测试(四川卷)相对原子质量: H 1 C 12N 14O 16S 32 Fe 56Cu 64第Ⅰ卷6.节能减排对发展经济、保护环境有重要意义。
下列措施不能减少二氧化碳排放的是A .利用太阳能制氢B.关停小火电企业C.举行“地球一小时”熄灯活动D.推广使用煤液化技术7. N A表示阿伏加德罗常数的值,下列说法正确的是A .标准状况下, 22.4 L 二氯甲烷的分子数约为N A个B.盛有SO2的密闭容器中含有N A个氧原子,则SO2的物质的量为 0.5 molC. 17.6 g 丙烷中所含的极性共价键为4N A个D.电解精炼铜时,若阴极得到电子数为 2 N A个,则阳极质量减少64 g8.下列说法正确的是 A .原子最外层电子数为 2 的元素一定处于周期表 IIA族B.主族元素X、Y能形成 XY 2型化合物,则 X 与 Y 的原子序数之差可能为 2 或 5 C.氯化氢的沸点比氟化氢的沸点高D.同主族元素形成的氧化物的晶体类型均相同9.下列离子方程式书写正确的是A.向明矾溶液中加入过量的氢氧化钡溶液:Al 3+ + 2 SO 42―+ 2 Ba2+ + 4 OH ―== 2 BaSO 4↓ + AlO 2―+ 2 H2OB.向氢氧化亚铁中加入足量的稀硝酸:+2+Fe(OH) 2 + 2 H== Fe+2H2OC.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4+OH ―== NH 3·H 2OD.向 CH2 BrCOOH 中加入足量的氢氧化钠溶液并加热:―CH2BrCOO ―CH 2BrCOOH + OH+ H2O10.有关① 100 mL 0.1 mol/L NaHCO3、②100 mL 0.1 mol/L Na 2CO3两种溶液的叙述不正确的是A .溶液中水电离出的H+个数:② >①B.溶液中阴离子的物质的量浓度之和:②>①2) >c( H 2D.②溶液中: c(HCO 3) >c( H23)C.①溶液中:c(CO3CO)CO11.中药狼把草的成分之一 M 具有清炎杀菌作用,M 的结构如图所示:下列叙述正确的是A . M 的相对分子质量是 180B. 1 mol M 最多能与 2 mol Br 2发生反应C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4D. 1 mol M 与足量 NaHCO 3反应能生成 2 mol CO 212.标准状况下 V L 氨气溶解在 1 L 水中(水的密度近似为 1 g/ml ),所得溶液的密度为 p g/ml,质量分数为ω,物质浓度为 c mol/L ,则下列关系中不正确的是...A.p == (17V + 22400) /(22.4 + 22.4 V)B.ω == 17c / (1000 p)C.ω == 17V / (17V + 22400) D .c == 1000Vp / (17V + 22400)13.反应 a M(g) + b N(g) c P(g) + d Q(g) 达到平衡时。
华南理工大学_880分析化学2010--2017年_考研真题

880华南理工大学2010年攻读硕士学位研究生入学考试试卷(请在答题纸上做答,试卷上做答无效,试后本卷必须与答题纸一同交回)科目名称:分析化学适用专业:分析化学共页一.单项选择题(共25题,每空1.5分,共计37.5分)1. 在下列分析过程中,不会出现系统误差的是()A. 过滤时使用了定性滤纸,因而使最后的灰分加大B. 使用分析天平时,天平的零点稍有变动C. 试剂中含有少量的被测组分D. 以含量为99%的邻苯二甲酸氢钾作基准物标定碱溶液2. 下列数据不是四位有效数字的是()=0.1020 C.=10.26 D.Cu%[H+]B.pHA.=11.26[Pb2+]=12.28×10-43. 从精密度就可以判断分析结果可靠的前提是()平均偏差小 D.相对偏差系统误差小 C.A. 随机误差小B.小4. 通常定量分析中使用的试剂应为分析纯,其试剂瓶标签的颜色为()蓝色A. 绿色B. 红色C. 咖啡色D.5. 在下类洗干净的玻璃仪器中,使用时必须用待装的标准溶液或试液润洗的是()容量瓶A. 量筒B.锥形瓶C. 滴定管D.6. 下述情况,使分析结果产生负误差的是()A. 以盐酸标准溶液测定某碱样品,所用的滴定管未洗干净,滴定时内壁挂水珠;B. 测定H2C2O4⋅2H2O的摩尔质量时,草酸失去部分结晶水;C. 用于标定标准溶液的基准物质在称量时吸潮;D. 滴定速度过快,并在到达终点时立即读数7. H 3PO 4的pKa 1~pKa 3分别为2.12,7.20,12.4。
当H 3PO 4溶pH =7.5时溶液中的主要存在形式是( )A. [][]−−>2442HPO PO H B. [][]−−<2442HPO PO HC. D . [][−−=2442HPO PO H ][][]−−>2434HPO PO8. 酸碱滴定中选择指示剂的原则是( ) A. Ka=KHIn ;B. 指示剂的变色范围与等当点完全符合;C. 指示剂的变色范围全部或部分落入滴定的pH 突跃范围之内;D. 指示剂的变色范围应完全落在滴定的pH 突跃范围之内9. 在pH=10时,以铬黑T 为指示剂,用EDTA 滴定Ca 2+、Ma 2+总量时,Al 3+、Fe 3+等的存在会使得指示剂失效,这种现象称为指示剂的( ) A. 僵化 B. 封闭 C. 变质 D. 变性10. 已知某金属指示剂(HR )的pKa=3.5,其共轭酸型体为紫红色,其共轭碱型体为亮黄色。
成都理工大学现代化学基础考试试题

成都理工大学现代化学基础考试试题一、填空题1.恒温恒压可逆过程系统吉布斯自由能的减少等于。
2. 25C时1mol理想气体等温可逆膨胀,压力从10atm变化为1atm, A G = A S = A H = A U =A F = (已知)。
3. 在25C标准状态下2H2(g)+O2(g)A H0 12H2O(g)A H0 22H2Q1)则氢的标准摩尔为燃烧焓为。
4. 一封闭系统当始态、终态确定后,下列各项Q、Q+W、W,有确定值。
5. 298K、101、325KPa下Imolc (石墨)完全燃烧所放出的热量为393.5kJ、mol —1,试写出热化学方程式:6. 2mol理想气体在300K下,体积从50dm3膨胀到100dm3,膨胀时实际做功等于最大功的50%,此过程A U= A H= Q=W= A S= 。
7. 用AS作为自发性判据条件是,用AG作为自发性判据条件是,用AF作为自发性判据条件是。
8. H[PtCl3NH3] 的名称是,内界是,外界是 ,中心离子是,配位体是,配位原子是,配位数是9. 微观粒子的特征是、、。
10. [Fe(NH3)6]SO4 的名称是;配合物的中心离子是,配位体是,配位原子是;中心离子的配位数是。
11. 比较下列各组物质的熔点高低:NaCl MgO;CaCl2 ZnCl2;FeCl2 FeCl3;NH3 PH3。
12. 原子核外电子层结构为4f75S25P65d16S2的原子序数是,该元素位于周期表第周期,第族。
13. BaCl2晶体中晶格结点上的粒子是;粒子间的作用力是;其晶体类型是。
14. 0(入,Z是描述电子在空间的波函数。
Y(e,碣表示0(r, eB),R(r)是表示0 (r, e的而三者的关系是15.填充下表1.BeCl2NCl3CCl4[Fe(CN)6]3-中心原子杂化类型分子(离子)几何构型2.NaFCuSiO2H2O(s)粒子间结合力晶体类型16. NaCl与KNO3 —起溶解于水中形成水溶液,则系统的独立组分数为如果没有气相,则此系统的自由度为。
成都理工大学历年考研真题04-13

成都理工大学历年考研真题04-13成都理工大学历年考研真题04年一名词解释:1、土的压缩系数:土体在侧限条件下孔隙比减小量与竖向有效压力增量的比值。
土的压缩指数:土体在侧限条件下孔隙比减小量与竖向有效压应力常用对数值增量的比值。
2、临塑荷载:是指基础边缘地基刚要出现塑性区时基底单位面积上所承担的荷载,它相当于地基土应力状态从压缩阶段过渡到剪切阶段时的界限荷。
临界荷载:是指允许地基产生一定范围塑性区所对应的荷载。
3、液限:土由可塑状态到流动状态的界限含水量称为液限,用符号WL表示。
塑限:土由半固状态转到可塑状态的界限含水量称为塑限,用符号Wp表示。
缩限:土由半固体状态不断蒸发水分,则体积继续逐渐缩小,直到体积不再收缩时,对应的极限含水量叫缩限,用符号Ws表示。
4、砂土液化:当饱和松砂受到动荷载作用,由于孔隙水来不及排出,孔隙水压力不断增加,就有可能使有效应力降到零,因而使砂土像流体那样完全失去抗剪强度。
5、前期固结压力:天然土层在历史上受过最大的固结压力(指土体在固结过程中所受的最大有效应力)。
6、有效应力原理:饱和土中任意点的总应力总是等于有效应力加上孔隙水压力;或有效应力总是等于总应力减去孔隙水压力。
此即饱和土的有效应力原理。
二简答1、简要说明郎肯土压力和库伦土压力理论的基本假定和适用范围?答:郎肯土压力理论是根据半空间的应力状态和土单元体的极限平衡条件而得出的土压力理论。
假定以墙背光滑、直立、填土面水平的挡土墙代替半空间的土,则墙背与土的接触面上满足剪应力为零的边界应力条件以及产生主动或被动郎肯状态的边界变形条件,由此推导出土压力计算理论。
适用于挡土墙的墙背竖直、光滑;挡土墙后的土表面水平;墙后填土粘性土和无粘性土均可。
库伦土压力理论是根据墙后土体处于极限平衡状态并形成以滑动楔体时,从楔体的静力平衡条件得出的土压力计算理论。
其基本假设为:1.墙后的填土时理想的散粒土(粘聚力c=0);2.滑动破坏面为一平面;3.滑动土楔体视为刚体。
全国硕士研究生入学考试试题(分析化学)

全国硕士研究生入学考试试题药学专业《分析化学》经典习题总结第二章误差和分析数据处理1.标定浓度约为0.1mol²L-1的NaOH,欲消耗NaOH溶液20mL左右,应称取基准物质H2C2O4²2H2O多少克?其称量的相对误差能否达到0.1%?若不能,可用什么方法予以改善?解:根据方程2NaOH+H2C2O4²H2O==Na2C2O4+3H2O可知,需称取H2C2O4²H2O的质量m1为:则称量的相对误差大于0.1% ,不能用H2C2O4²H2O标定0.1mol²L-1的NaOH ,可以选用相对分子质量大的基准物进行标定。
若改用KHC8H4O4为基准物,则有:KHC8H4O4+ NaOH== KNaC8H4O4+H2O,需称取KHC8H4O4的质量为m2,则m2=0.1³0.020³204.22=0.41g由此可见,选用相对分子质量大的邻苯二甲酸氢钾标定NaOH,由于其称样量较大,称量的相对误差较小(<0.1%),故测定的准确度较高。
2.用基准K2Cr2O7对Na2S2O3溶液浓度进行标定,平行测定六次,测得其浓度为0.1033、0.1060、0.1035、0.1031、0.1022和0.1037 mol/L,问上述六次测定值中,0.1060是否应舍弃?它们的平均值、标准偏差、置信度为95%和99%时的置信限及置信区间各为多少?解:(1)(2)(3)查G临界值表,当n=6和置信度为95%时,G6,0.05=1.89,即G﹤G6,0.05,故0.1060不应舍弃。
(4)求平均值的置信限及置信区间。
根据题意,此题应求双侧置信区间,即查t检验临界值表中双侧检验的α对应的t值:①P=0.95:α=1-P=0.05;f=6-1=5;t0.05,5=2.571,则置信度为95%时的置信限为±0.0014, 置信区间为0.1036±0.0014。
2010高考化学试题汇编(化学计算)
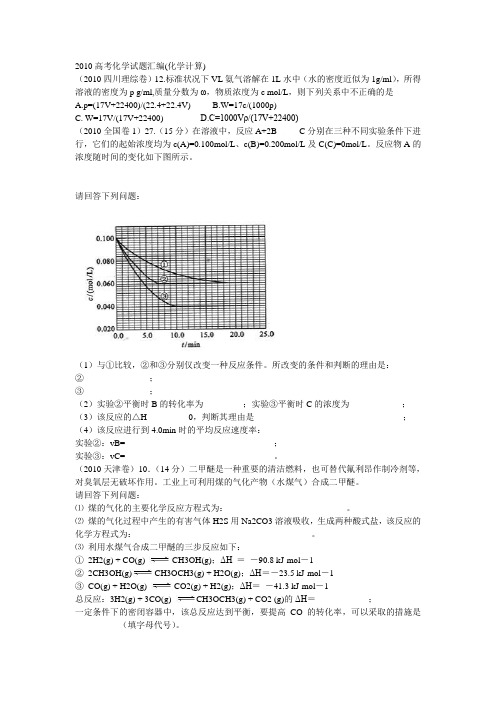
2010高考化学试题汇编(化学计算)(2010四川理综卷)12.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是A.p=(17V+22400)/(22.4+22.4V)B.W=17c/(1000p)C. W=17V/(17V+22400)D.C=1000Vρ/(17V+22400)(2010全国卷1)27.(15分)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及C(C)=0mol/L。
反应物A的浓度随时间的变化如下图所示。
请回答下列问题:(1)与①比较,②和③分别仅改变一种反应条件。
所改变的条件和判断的理由是:②_______________;③_______________;(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;(3)该反应的△H _________0,判断其理由是__________________________________;(4)该反应进行到4.0min时的平均反应速度率:实验②:vB=__________________________________;实验③:vC=__________________________________。
(2010天津卷)10.(14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。
工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:⑴煤的气化的主要化学反应方程式为:___________________________。
⑵煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
2010分析化学回忆版

2010年华东理工大学分析化学考研真题(回忆)选择题16*1=16分填空题每空1分,共40分简答:每题10分或8分;共计70分计算4个题,共计24分,氧化还原反应。
络合滴定反应中误差的计算填空中有一题是:CH3CH2COOH,核磁共振中,哪个H位于高场,哪个H位于低场,出现多重峰的原因是什么?简答题有;1.电位滴定法的原理是什么?与直接电位法相比有什么优点?2.高效液相色谱仪由哪些构成?其作用是什么3.气相色谱固定相的选取原则是什么?为什么升高温度会影响分离效果?4.分离度的定义是什么?R与k,@(注:不带圆圈)的关系是什么?5.紫外(红外)分光光度法的原理是什么?试举例说明6.傅里叶变换红外光谱仪与以往红外分析仪器有什么不同?填空和选择有一些是02,03年的真题2010年和大东理工大学物理化学考研真题(回忆)总体题型没有变化。
第一大题填空24分,共计12小题。
不太难,是基础第二大题是证明,18分,分两小题,是有关范德华气体的,我个人觉得难,不知其他同学感觉如何然后就是热力学,是求400摄氏度下一个化学反应的反应焓。
已知标准摩尔反应焓,及CPM.有一个题印象深刻,是25摄氏度时?KPa有气体密闭在瓶中,抽出瓶塞,经可逆绝热过程缓慢放出一定量的气体至瓶内气体?KPa,再加热到25摄氏度,?千帕。
求气体的CPm.气体可看成理想气体。
(提示:取瓶内剩余气体为系统)8.已知0.001moi.dm-3的Na2SO4溶液的k=?,现把CuSO4溶于上述溶液中,测得k=?,已知∧m,Na+(无穷)=? ∧m,Ca2+(无穷)=?.求Ksp(caso4)南京理工大学2002年研究生入学考试试题一、单选题1.1py,100℃下,水与100℃大热源接触,使水向真空容器中蒸发变为101.325kPa的水蒸汽,设此过程做功为W,吸热Q,终态压力为p,体积为V,用他们分别表示。
下列答案哪个是正确的1 Q Q-pV (Q-pV)/373 0 -pV2 Q-pV Q Q/373 0 -pV3 Q-pV Q Q/100 -pV 04 Q Q-pV (Q-pV)/100 pV 02.某气体状态方程为 , 仅为体积的函数,恒温下该气体的熵随体积V 增加而( )。
分析化学试卷及答案 ()

分析化学试题(四)一.填空题(每空 1 分,共30 分)1.根据分析的对象可将分析化学分为,。
2.误差按其性质的不同可分为两类和。
3.97.31ml 0.05480mol/L 碘溶液和97.27ml 0.1098mol/L Na2S2O3 溶液混合,加几滴淀粉溶液,混合液是色。
4.定量分析中常用的分离方法有,,。
5.无机物试样的分解常用的方法有,和半熔法。
6.摩尔法确定终点的指示剂是,佛尔哈德法用的指示剂是,法扬司法用的指示剂是。
效应,使沉淀的溶解度减小。
在实际工作中,氧化还原指示剂In 变色的电位范围为V。
符合吸收定律的有色溶液,在不同波长测定的摩尔吸光系数(指出相同或不同),在波长下,数值最大。
10.电位法是利用电池与试液中之间一定量的数量关系,从而测得离子活度的。
11.在电位滴定中常用的指示电位是和。
12.在通常的原子吸收条件下,吸收线轮廓主要受和变宽的影响。
13.柱温度直接影响色谱分离和分析时间,柱温度升高会使变差。
14. 某化合物能溶于乙腈, 也能溶于庚烷中, 且两种溶剂在测定该化合物的红外光谱区间都有适当的透过区间, 则选用溶剂较,因为。
15.色谱法按固定相的固定方式分类, 除柱色谱法以外, 还有和。
16. 试比较CH3COHO和CH 3CHO分子的红外光谱情况,乙酸中的羰基的吸收波数比乙醛中的羰基。
17. 用紫外- 可见分光光度计测定时, 用试剂空白作参比溶液测得某试液的透射比为10%,如果更改参比溶液, 用一般分光光度法测得透射比20%的标准溶液作参比溶液, 则该试液的透射比应等于。
二.选择题(每空 1 分,共25 分,打“* ”者为多选)1.为标定硫代硫酸钠溶液的浓度,宜选择的基准物是()A 分析纯的双氧水B 分析纯高锰酸钾C 分析纯重铬酸钾D 分析纯铬酸钾-10 -2.已知HCN 的K a=6.2×10,则CN的pK b 为()A 3.21B 4.79C 3.79D 9.213.pH=1 和pH=3 的两种强电解(互不反应)溶液等体积混合后,溶液的pH 值为)A 1.0B 1.5C 2.0D 1.34.E DTA 相当于几元酸?()A 3B 4C 5D 65.在下列电对中,条件电位随离子强度增高而增高的是()4+ A Ce3+/Ce4+B Sn2+/Sn3+C Fe2+/Fe3-D Fe(CN)64-/Fe(CN)66.为获得纯净易过滤和洗涤的晶形沉淀,要求()A 沉淀时聚集速度大而定向速度小B 溶液的相对过饱和度大C 以沉淀时聚集速度小,而定向速度大D 沉淀的溶解度要小。
2010-2011分析化学考题A111

4.用递减法称量试样时,第一次读数时使用了磨损的砝码;称量结果产生何种影响( )A.正误差B.负误差C.无影响D.结果混乱5.用含少量NaHCO 3的基准Na 2CO 3标定盐酸溶液时(甲基橙指示剂),结果将( )。
A. 偏低B. 不确定C. 无误差D. 偏高 6.碘量法测定漂白粉中有效氯时,其主要成分CaCl (ClO )与Na 2S 2O 3的物质的量比为( )A. 2:1B. 1: 2C. 1: 1D. 3: 17.在无配位效应发生时,下列有关条件平衡常数的叙述,正确的是( )。
A. 酸效应系数越大,条件平衡常数越大B. 配合物的条件平衡常数总是大于其平衡常数C. 溶液的pH 值越低,条件平衡常数越小D. 络合滴定曲线的pM 突跃大小与条件平衡常数无关8.在Ca 2+ ,Mg 2+的混合液中,用EDTA 法测定Ca 2+要消除Mg 2+的干扰,宜用:( ) A 、控制酸度法 B 、络合掩蔽法 C 、氧化还原掩蔽法 D 、沉淀掩蔽法9.下列关于副反应系数的定义,正确的是( )。
A. ][][ ;][][M )(M M Y Y H Y '='=ααB. ][][ ;][][M )(M M Y Y H Y '='=ααC. ][][ ;][][M )(M M Y Y H Y '='=αα D. ][][ ;][][M )(M M Y Y H Y '='=αα 10.用K 2Cr 2O 7基准物以置换碘量法标定Na 2S 2O 3溶液浓度,常以淀粉液为指示剂,其加入的适宜时间是滴定至近终点时加入,若滴定开始时加入则会发生( )。
A. 标定结果偏高B. 标定结果偏低C. 对标定结果无影响D. 指示剂不变色,无法指示滴定终点。
(第2页 共 7 页)11.下列叙述中,哪个不是重量分析对称量形式的要求( )。
A. 称量形式必须有确定的化学组成 B. 称量形式必须稳定 C. 称量形式的颗粒要大 D. 称量形式的摩尔质量要大 12. 今有某溶液,酚酞在里面是无色的,甲基橙在里面是黄色的,它可能含有( )A.OH -B.CO 32-C.HCO 3- D .OH -+ CO 32-13. 将2.5491修约为两位有效数字,正确的结果是 ( ) A. 2.4 B. 2.5 C. 2.6 D. 2.014. 1,10-邻二氮菲用于在pH=5—6时掩蔽Cu 2+、N i 2+、Zn 2+、Cd 2+等离子, 这属于下列哪一种掩蔽方法 ( ) A. 氧化还原掩蔽法 B.沉淀掩蔽法 C.络合掩蔽法 D.调节酸度掩蔽法 15.AgCl 在1mol/LKNO 3中比在纯水中的溶解度大,原因是( )A 、盐效应B 、酸效应C 、配位效应D 、同离子效应二、填空题(每空题1分,共20分)1. HCN (c 1 mol/L) + Na 3PO 4 (c 2 mol/L) 水溶液的质子条件式为: 。
分析化学习题及答案

分析化学习题及答案一、分析化学概论一、选择题 1下列数据中有效数字为四位的是 ( D ) (A)0.060 (B)0.0600 (C)pH = 6.009 (D)0.6000 2 下列数据中有效数字不是三位的是(C ) (A)4.00×10-5(B)0.400 (C)0.004 (D)p K a = 4.008 3 为了消除0.0002000 kg 中的非有效数字,应正确地表示为(D ) (A)0.2g (B)0.20g (C)0.200g (D)0.2000g 4下列数据中有效数字不是四位的是(B ) (A)0.2500 (B)0.0025 (C)2.005 (D)20.50 5 下面数据中含有非有效数字的是(A ) (1) 0.02537 (2) 0.2009 (3) 1.000 (4) 20.00 (A)1,2 (B)3,4 (C)1,3 (D)2,4 6 下列数据中为四位有效数字的是(C ) (1) 0.068 (2) 0.06068 (3) 0.6008 (4) 0.680 (A)1,2 (B)3,4 (C)2,3 (D)1,4 7在下列数据中,两位有效数字的是(B ) (2) 0.140 (3) 1.40 (3) K a =1.40×10-4(4) pH=1.40 (A)1,2 (B)3,4 (C)1,4 (D)2,3 如果是等式,有效数字就是从小数点开始的(前提是小数点前面不是零),如多是单纯的数字,就不需要考虑上述情况。
8 用50 mL 滴定管滴定,终点时正好消耗25 mL 滴定剂,正确的记录应为(C ) (A) 25 mL (B) 25.0 mL (C) 25.00 mL (D) 25.000mL这个是精确度的问题 9 用25 mL 移液管移取溶液,其有效数字应为(C ) (A) 二位 (B) 三位 (C) 四位 (D) 五位 10 用分析天平准确称取0.2g 试样,正确的记录应是(D ) (A)0.2g (B)0.20g (C) 0.200g (D)0.2000g 1分析天平的精确度是0.0001 11 用分析天平称量试样时,在下列结果中不正确的表达是(A ) (A)0.312g (B )0.0963g (C )0.2587g (D )0.3010g 12 已知某溶液的pH 值为10.90,其氢离子浓度的正确值为(D ) (A) 1×10-11 mol ·L -1 (B) 1.259×10-11 mol ·L -1(C) 1.26×10-11 mol ·L -1 (D) 1.3×10-11 mol ·L -1这个是精确度的问题 13 醋酸的p K a = 4.74,则K a 值为(A )(A) 1.8×10-5 (B) 1.82×10-5 (C) 2×10-5(D) 2.0×10-514 下列数据中有效数字为二位的是(D )(A) [H +]=10-7.0(B) pH=7.0 (1) (C) lg K =27.9 (1) (D) lg K =27.94(2) 15 按四舍六入五成双规则将下列数据修约为四位有效数字(0.2546)的是(C ) (A)0.25454 (0.2545) (B)0.254549 (0.25455) (C)0.25465 (D)0.254651 (0.2547)16 下列四个数据中修改为四位有效数字后为0.2134的是(D ) (1) 0.21334(0.2133) (2) 0.21335(0.2134) (3) 0.21336(0.2134) (4) 0.213346(0.2133) (A) 1,2 (B) 3,4 (C) 1,4 (D) 2,3 “四舍六入五成双”,等于五时要看五前面的数字,若是奇数则进位,如是偶数则舍去,若五后面还有不是零的任何数,都要进位。
