酸碱盐知识导图
酸碱盐氧化物知识小结—八圈图学法指导
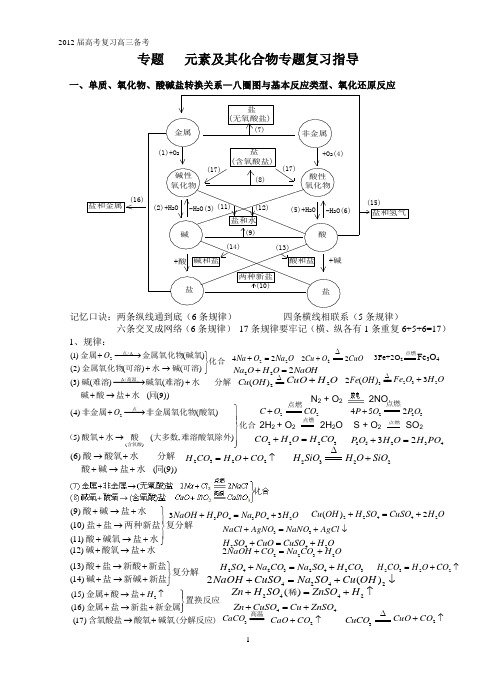
2012届高考复习高三备考13434233N aO H H PON a PO H O +=+22442()2C u O H H SO C uSO H O +=+33N aC l AgN O N aN O AgC l +=+↓2442H SO C uO C uSO H O +=+3C aC O ====高温2C aO C O +↑2C uO C O +↑3C uC O ∆专题 元素及其化合物专题复习指导化合可溶碱水可溶金属氧化物碱氧金属氧化物金属点⎭⎬⎫→+−−→−+∆)()()2()()1(/2OO Na O Na 2224=+ CuOO Cu 222∆+ 3Fe+2O 2点燃Fe 3O 4))9(()()()3(/同水盐酸碱分解水难溶碱氧难溶碱高温+→++−−→−∆2()(4)()5)(,)O ⎫+−−→⎪⎪⎬⎪+→⎪⎭点含氧酸非金属非金属氧化物酸氧化(酸氧水酸大多数难溶酸氧除外))9(()6(同水盐碱酸分解水酸氧酸+→++→NaOHO H O Na 222=+∆Cu 2223C O H O H C O +=2523432P O H O H PO +=2322H C O H O C O =+↑2322H SiO H O SiO ∆+2()Fe OH ∆==2323F e O H O+(9)(10)(11)+→+⎫⎪+→⎬⎪+→+⎭酸碱盐水盐盐两种新盐复分解酸碱氧盐水(12)+→+碱酸氧盐水22322N aO H C O N a C O H O+=+42422()N aO H C uSO N a SO C u O H +=+↓(13)(14)+→+⎫⎬+→+⎭酸盐新酸新盐复分解碱盐新碱新盐24232423H SO N a C O N a SO H C O +=+2322H C O H O C O =+↑2442()Z n H SO Z nSO H +=+↑稀44Zn C uSO C u ZnSO +=+2(15)(16)H ⎫+→+↑⎪⎬+→+⎪⎭金属酸盐置换反应金属盐新盐新金属(17)→+含氧酸盐酸氧碱氧(分解反应)。
化学 酸碱盐氧化物关系图整理简洁版 ppt课件
碱
非金属
非金属氧 化物
酸
盐
盐
化学 酸碱盐氧化物关系图整理简
1
洁版
金属
非金属
+O2 +C/CO/H2
金属氧化 物
+O2
非金属氧 化物
+H2O
碱
△ +H2O
酸
+酸 +盐
+盐 +碱
盐
盐 化学 酸碱盐氧化物关系图整理简
2
洁版
精品资料
• 你怎么称呼老师? • 如果老师最后没有总结一节课的重点的难点,你
化学 酸碱盐氧化物关系图整理简
9
洁版
点燃
非金属+氧气
非金属氧化物
4P+5O2 点燃 2P2O5
点燃
C+O2
CO2
S+O2 点燃 SO2
2H2+O2 点燃 2H2O
化学 酸碱盐氧化物关系图整理简
10
洁版
酸 +碱 盐 酸 +盐 盐
HNO3+NaOH=NaNO3+H2O
H2SO4+2KOH=K2SO4+2H2O
是否会认为老师的教学方法需要改进? • 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭 • “不怕太阳晒,也不怕那风雨狂,只怕先生骂我
笨,没有学问无颜见爹娘 ……” • “太阳当空照,花儿对我笑,小鸟说早早早……”
4
方程式举例
化学 酸碱盐氧化物关系图整理简
5
洁版
金属
非金属
+O2 +C/CO/H2 金属氧化
16
洁版
《酸和碱》知识网络图

返回
溶液的酸碱度的表示方法——pH 范围通常在0~14之间, 用pH试纸可以测定溶液的酸碱性。 pH<7,溶液呈酸性 pH=7,溶液呈中性 pH>7,溶液呈碱性
返回
酸
酸 和碱 碱
pH
常见的酸
盐酸 硫酸
酸: H+ +酸根离子 酸
与酸碱指 紫色石蕊溶液:变红色 示剂作用 无色酚酞溶液:不变色 性质 与活泼金属反应生成盐和氢气
与某些金属氧化物反应生成盐和水 与碱发生中和反应生成盐和水
返回
常见的碱 氢氧化钠 氢氧化钙
碱 碱:金属离子 (或NH4+)+OH与酸碱指 紫色石蕊溶液:变蓝色
第十单元《酸和碱》思维导图-年级化学课件

NaOH NH3·H2O Ca(OH)2 KOH
相似原因 化学性质
与指示剂 与非金属氧化物 与酸反应
与盐反应
探究 概念 实质 应用 注意
中和反应
图像
俗名 色态 溶解性 特性 腐蚀性 用途 变质
硝酸 醋酸
腐蚀性
化学式 浓盐酸 浓硫酸 吸水性 干燥剂
色、态 气味 瓶口
挥发性
稀释
定义 酸
常见
碱
用途
酸5 性 碱4
意外
强弱
与指示剂 与活泼金属
相似原因
酸碱度
与金属氧化物
化学性质
表示 测定 意义
与碱反应 与盐反应
范围 改变pH的方法
方法Байду номын сангаас注意 加水
酸碱性相同,pH不同的溶液
酸碱性相反的溶液
定义
常见 意外
化学 酸碱盐氧化物关系图(整理简洁版)ppt课件

(4)碱+酸==盐+H2O
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O23
酸(不稳定)
H2CO3
非金属氧化物+水
CO2↑+H2O
24
ቤተ መጻሕፍቲ ባይዱ温
2CuO+C 2Cu+CO2↑
古代炼铜的△方法之一
CuO+H2 Cu+H2O
非复分解反应,没有交换成分
13
碱+酸==盐+H2O NaOH+HCl=NaCl+H2O 2NaOH+H2SO4=Na2SO4+2H2O Cu(OH)2+2HCl=CuCl2+2H2O 2Fe(OH)3+3H2SO4=Fe2(SO4)3+
2H2O
复分解反应,生成物有水 14
酸 +盐=盐+酸
H2SO4+BaCl2=2HCl +BaSO4 ↓
Al(OH)3+FeCl3≠
解释:因为反应物有沉 淀存在,不能进行
18
盐 + 盐 = 新盐 + 新盐
AgNO3+NaCl=AgCl↓ +NaNO3
CaCl2+Na2CO3=CaCO3↓+2NaCl
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO
BaCl2+Na2SO4=BaSO4↓+2NaCl
HNO3+NaOH=NaNO3+H2O
H2SO4+2KOH=K2SO4+2H2O
初中化学《【酸碱盐的知识】趣谈》单元教学设计以及思维导图

【酸碱盐的知识】趣谈适用年级九年级所需时间课内7课时,每周4课时,课外1课时主题单元学习概述(说明:简述主题单元在课程中的地位和作用、单元的组成情况,单元的学习重点和难点、解释专题的划分和专题之间的关系,单元的主要的学习方式和预期的学习成果,字数300-500)酸碱盐知识是初中学习的重点也是难点,也是中考的考点,也是学生后续学习的起点。
酸碱盐是三类非常重要的化合物,知识有相同的地方又有不同之处,所以本单元分四个专题,主题一:几种常见酸的主要性质和用途,专题二:几种常见碱的主要性质和用途,专题三:几种常见盐的主要性质和用途,专题四:中和反响,复分解反响的实质和应用。
酸碱盐的化学性质,化学方程式的书写,实验现象的记忆,中和反响,复分解反响的实质和应用都是学习的重点,化学方程式的书写,运用复分解反响发生的条件判断常见的酸碱盐能否发生反响是学习的难点。
本单元主要采取自主探究,合作学习的学习方法,学生自主总结归纳知识,有利于提高学生归纳概括能力,交流表达能力,观察总结能力。
使学生能正准确描述酸碱盐的主要性质和用途,能正确书写化学方程式,描述实验现象,理科中和反响,复分解反响的实质和应用。
主题单元规划思维导图〔说明:将主题单元规划的思维导图导出为jpeg文件后,粘贴在这里;如果提交到平台,那么需要使用图片导入的功能,具体操作见?2021学员教师远程研修手册?。
〕主题单元学习目标〔说明:依据新课程标准要求描述学生在本主题单元学习中所要到达的主要目标〕知识与技能:1、知道几种常见的酸碱盐的主要性质和用途。
2、知道中和反映的实质,以及在实际生产中的应用。
3、知道酸碱性对生命活动和农作物生长的影响,会用酸碱指示剂和PH试纸检验溶液的酸碱性,了解溶液的酸碱度在实际应用中的意义。
4、初步认识复分解反响及其发生的条件,能根据复分解反响发生的条件判断酸、碱、盐之间的反响能否发生。
掌握碳酸根离子的检验方法。
过程与方法:1、通过对酸碱盐主要性质的探究体验实验探究的操作标准性,准确性,以及严谨的科学方法。
化学 酸碱盐氧化物关系图(整理简洁版)ppt课件

(4)碱+酸==盐+H2O
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O23
酸(不稳定)
H2CO3
非金属氧化物+水
CO2↑+H2O
24
高温
2CuO+C 2Cu+CO2↑
古代炼铜的△方法之一
CuO+H2 Cu+H2O
HNO3+NaOH=NaNO3+H2O
H2SO4+2KOH=K2SO4+2H2O
H2SO4+BaCl2=BaSO4 ↓ +2HCl
HCl+AgNO3=AgCl↓ +2HNO3
9
碱+盐= 盐+ 碱
3 NaOH + FeCl3 = 3NaCl+Fe(OH)3↓
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
金属+氧气 或△ 金属氧化物
点燃
2Mg+O2 2MgO
4Al +3O2 点燃 2Al2O3
3Fe+2O2 点燃 Fe3O4
2Cu +O2 △ 2CuO 5
金属氧化物+水
CaO+H2O Na2O+H2O
碱(可溶)
Ca(OH)2 2NaOH
6
碱 +酸 盐 碱 +盐 盐
NaOH+HCl=NaCl+H2O
复分解反应,生成物有水 11
非金属氧化物+水
初三化学第十单元知识框架图:酸 碱 盐

初三化学第十单元知识框架图:酸碱盐这篇初三化学第十单元知识框架图:酸碱盐是特地为大家整理的,希望对大家有所帮助! 一、化学用语 1、电离方程式 2、物质的俗称和主要成分: 生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4.5H2O;碳酸钠晶体Na2CO3.10H2O;氨水NH3.H2O; 二、金属活动性 1、金属活动性顺序:K大于Ca大于Na大于Mg大于Al大于Zn大于Fe 大于Sn大于Pb(H)Cu大于Hg大于Ag大于Pt大于Au 2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用: (1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
四、酸、碱、盐的溶解性 1、常见盐与碱的溶解性: 钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁 3、四微溶物: Ca(OH)2(石灰水注明澄清”的原因)、CaSO4(实验室制二氧化碳时不用稀硫酸的原因) Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)、MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因) 4、三个不存在的物质:氢氧化银、碳酸铝、碳酸铁 五、复分解反应发生的条件反应:有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质) (1)不溶性碱只能与酸性发生中和反应 (2)不溶性盐,只有碳酸盐能与酸反应(3)KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物 六、溶液的酸碱性与酸碱度的测定 1、指示剂---溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝 无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用;碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性) 2、pH值---溶液的酸碱度:pH小于7溶液为酸性(越小酸性越强);pH=7溶液为中性;pH大于7溶液为碱性(越大碱性越强) 七、离子的检验 Cl-(在溶液中)---在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
【推荐】初三化学第十单元知识框架图:酸 碱 盐-实用word文档 (4页)

本文部分内容来自网络整理,本司不为其真实性负责,如有异议或侵权请及时联系,本司将立即删除!== 本文为word格式,下载后可方便编辑和修改! == 初三化学第十单元知识框架图:酸碱盐一、化学用语1、电离方程式2、物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4.5H2O;碳酸钠晶体Na2CO3.10H2O;氨水NH3.H2O;二、金属活动性1、金属活动性顺序:KNaAlFePb(H)CuAgAu2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
三、酸、碱、盐的溶解性1、常见盐与碱的溶解性:钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2(石灰水注明澄清的原因)、CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)、MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:氢氧化银、碳酸铝、碳酸铁四、复分解反应发生的条件反应:有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)(1)不溶性碱只能与酸性发生中和反应(2)不溶性盐,只有碳酸盐能与酸反应(3)KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物五、溶液的酸碱性与酸碱度的测定1、指示剂溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用;碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)2、pH值溶液的酸碱度:pH7溶液为酸性(越小酸性越强);pH=7溶液为中性;pH7溶液为碱性(越大碱性越强)六、离子的检验Cl-(在溶液中)在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
九年级科学酸碱盐4(PPT)5-4

中和反应——酸跟碱作用生成盐和水的 反应叫做中和反应。
象来寻找正确的解答;猜测:~谜语|你~谁来了?|他的心思我~不透。②起疑心:~忌|两小无~。 【猜测】动推测;凭想象估计:这件事复杂,又没 有线索,叫人很难~。 【猜度】动猜测;揣度:心里暗自~,来人会是谁呢? 【猜忌】动猜疑别人对自己不利而心怀不满:互相~。 【猜料】动猜测;估 计:事情的结果,现在还很难~。 【猜谜儿】∥〈方〉动;清远房产网 / ;猜谜()。 【猜谜】∥动①猜谜底;捉摸谜语的答 案。②比喻猜测说话的真意或事情的真相:你有什么话就说出来,别让人家~。 【猜摸】?动猜测;估摸:他的心思叫人~不透。 【猜拳】∥动划()拳。 【猜嫌】〈书〉动猜忌:两无~。 【猜想】动猜测:我~他同这件事有关。 【猜疑】动无中生有地起疑心;对人对事不放心:根本没有这种事儿,你们不要 胡乱~。 【才】①名才能:德~兼备|多~多艺|这人很有~。②有才能的人:干~|奇~。③()名姓。 【才】(纔)副①表示以前不久:你怎么~来就
酸 + 活泼金属 = 盐 + 氢气。
铁跟稀盐酸反应: Fe + 2HCl = FeCl2 + H2 ↑ 有气泡产生,铁逐渐减少,
铁跟稀硫酸反应: Fe + H2SO4 =FeSO4 + H2 ↑ 溶液变成浅绿色。
要走?②表示事情发生得晚或结束得晚:他说星期三动身,到星期五~走|大风到晚上~住了。③表示只有在某种条件下然后怎样(前面常常用“只有、必 须”或含有这类意思):只有依靠群众,~能把工作做好。④表示发生新情况,本来并不如此:经他解释之后,我~明白是怎么回事。⑤表示数量小,次数 少,能力差,程度低等等:这个工厂开办时~几十个工人|别人一天干的活儿,他三天~干完。⑥表示强调所说的事(句尾常用“呢”字):麦子长得~好 呢|我~不信呢! 【才分】名才能;才智。 【才干】名办事的能力:增长~|他既年轻,又有~。 【才刚】〈方〉名刚才:他~还在这里,这会儿出去了。 【才高八斗】形容文才非常高。参看页〖八斗才〗 【才华】名表现于外的才能(多指文艺方面):~横溢|~出众。 【才具】〈书〉名才能:~有限。 【才力】名才能;能力:~超群。 【才略】ü名政治或军事上的才能和智谋:~过人。 【才能】名知识和能力:施展~。 【才女】ǚ名有才华的女子。 【才 气】名才华:他是一位很有~的诗人。 【才情】名才华;才思:卖弄~。 【才识】名才能和见识:~卓异。 【才疏学浅】才能低,学识浅(多用于自谦)。 【才思】ī名写作诗文的能力:~敏捷。 【才学】名才能和学问。 【才艺】名才能和技艺:~超绝。 【才智】名才能和智慧:充分发挥每个人的聪明~。 【才子】名指有才华的人。 【材】①木料,泛指材料①:木~|钢~|~|就地取~。②名棺材:寿~|一口~。③资料:教~|题~|素~。④
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氮肥 钾肥 磷肥 复合肥
种类 鉴别
合理使用化肥
盐 化肥
化肥及其 鉴别
盐及盐的化 学性质
氯化钠
常见的盐
碳酸钠 碳酸氢钠
粗盐提纯
碳酸钙 与某些金属反应
盐的通性
与某些酸反应 与某些碱反应
与某些盐反应 复分解反应
实质
应用
(浓)盐酸 常 见
(浓)硫酸 的 酸
中和反应 及其应用
常 见
氢氧化钠
的 碱
氢氧化钙
与指示剂作用 酸
与碱反应 酸
酸和 碱 碱
与指示剂作用 碱 与酸反应
与活泼金属反应 的
与某些金属 氧化物反应
通 性
溶液的酸 碱性与酸
碱度
的
通 与某些非金属
性反应
酸碱性
酸碱度
的检验
(定量)
