17:离子不能共存的类型
离子不能大量共存的几种情况

离子不能大量共存的几种情况离子不能大量共存的情况主要有以下几种:1.复分解反应生成难溶性物质:如果离子之间发生复分解反应,生成了难溶性的物质,这些物质就会沉淀下来,导致离子不能大量共存。
例如,钡离子和硫酸根离子会生成硫酸钡沉淀,铜离子和氢氧根离子会生成氢氧化铜沉淀等。
2.复分解反应生成气体:如果离子之间发生复分解反应,生成了气体,这些气体就会逸出溶液,导致离子不能大量共存。
例如,碳酸根离子和氢离子会生成二氧化碳气体,铵根离子和氢氧根离子会生成氨气等。
3.复分解反应生成弱电解质:如果离子之间发生复分解反应,生成了弱电解质,这些弱电解质在水溶液中不能完全电离,导致离子不能大量共存。
例如,醋酸根离子和氢离子会生成醋酸弱电解质,磷酸根离子和氢离子会生成磷酸弱电解质等。
4.氧化还原反应:如果离子之间发生氧化还原反应,导致电子转移,使某些离子失去电子而某些离子得到电子,这些离子不能共存。
例如,亚铁离子和硝酸根离子会发生氧化还原反应,三价铁离子和碘离子会发生氧化还原反应等。
5.络合反应:如果离子之间发生络合反应,生成了络合物,这些络合物在水溶液中不能完全电离,导致离子不能大量共存。
例如,银离子和硫氰根离子会生成硫氰化银络合物,铜离子和氨分子会生成铜氨络合物等。
6.发生双水解反应:某些离子之间会发生双水解反应,即这些离子在水中会结合成水解反应的产物,导致离子不能大量共存。
例如,铝离子和碳酸根离子、偏铝酸根离子和铵根离子等会发生双水解反应。
7.形成沉淀或聚合:某些离子之间可以形成沉淀或聚合,导致离子不能大量共存。
例如,银离子和氯离子会形成氯化银沉淀,亚铁离子和氢氧根离子会形成氢氧化亚铁沉淀等。
8.存在隐蔽的限制条件:有时在题目中可能存在隐蔽的限制条件,如pH值、温度等的影响,也会导致某些离子不能大量共存。
例如,在酸性条件下,硝酸根离子具有氧化性,能够氧化碘离子、亚铁离子等;在碱性条件下,氢氧根离子能够与铜离子、铁离子等形成沉淀等。
离子不能大量共存

离子不能大量共存的判断依据1生成气体不能大量共存如:硫离子,硫酸根离子,亚硫酸根离子,亚硫酸氢根,碳酸根,碳酸氢根等离子都能和氢离子反应生成气体,故均不能和氢离子大量共存;而铵根和氢氧根易产生氨气,故二者也不能大量共存。
2 生成沉淀不能大量共存溶解性表中不溶或微溶物质的阴阳离子不能大量共存。
如:a 氢氧根和铁离子,亚铁离子,铜离子,锌离子,铝离子,镁离子,银离子,汞离子易发生难容的氢氧化物或氧化物而不能大量共存。
b 硫离子和亚铁离子,锌离子,铜离子,汞离子,银离子等易结合成难容的硫化物沉淀,不能共存c 银离子和氯离子,溴离子,碘离子会形成卤化银沉淀,不能共存。
d 镁离子,钙离子,钡离子,铅离子易和碳酸根,亚硫酸根,硫酸根,磷酸根生成难溶盐(硫酸镁除外)而不能共存;钙离子与氟离子,四氧化二镉不能共存;镁离子,钙离子与C17H35COO- 不能共存;镁离子,钙离子,钡离子与磷酸氢根等不能大量共存。
e 氢离子与硅酸根,硫代硫酸根,偏铝酸易发生沉淀不能共存。
f 两种离子相遇能结合生成微溶物时,也不能大量共存。
如:钙离子与氢氧根离子,硫酸根;银离子与硫酸根;铅离子与氯离子;镁离子与碳酸根离子,亚硫酸根离子;汞离子与硫酸根离子等均不能大量共存。
3 生成难电离物质不能大量共存如:氢离子与氢氧根离子,氟离子,次氯酸根,碳酸根,硫离子,硫氢根离子,亚硫酸根离子,偏铝酸根离子,磷酸根,氢青根,硫青根,醋酸根,甲酸根,四氧化二镉等易结合成难电离弱电解质,因而不能大量共存。
4 发生双水解反应不能大量共存溶解性表中“—"符号对应的阴离子和阳离子绝大多数因发生双水解而不能大量共存。
因弱碱的阳离子水解呈酸性,弱酸阴离子水解呈碱性,两类离子在溶液中相遇因中和反应促进双水解强烈进行或不能共存。
如:铝离子与碳酸根,碳酸氢根,硫离子,硫氢根,偏铝酸根;铁离子与碳酸根,碳酸氢根,硫离子(注意铁离子溶液中滴加硫离子主要反应为氧化还原);铵根与硅酸根均因双水解而不能共存。
离子能否共存的原因与判断方法

离子能否共存的原因与判断方法河北省宣化县第一中学栾春武判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存。
下面就离子能否共存的原因与判断方法归纳如下:一、常见的离子不能大量共存的原因:(1)发生复分解反应生成难溶物、挥发性物质和难电离物质时不能大量共存。
如:①若阴阳离子能相互结合生成难溶物或微容物性盐,就不能大量共存。
如常见的Ba2+、Ca2+ 与CO32-、SO32-、SO42-、PO43-、SiO32-等;再如常见的Ag+ 与Cl-、Br-、I-、PO43-、CO32-、SO42-、S2-等。
②弱碱的阳离子不能与OH-大量共存。
如常见的Fe2+、Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Zn2+等与OH-不能大量共存。
③弱酸根阴离子不能与H+ 大量共存。
如常见的CH3COO-、F-、CO32-、SO32-、S2-、PO43-等与H+ 不能大量共存。
④弱酸的酸式阴离子与H+ 或OH-均不能大量共存。
如常见的HCO3-、HSO3-、HS-、H2PO42-等既不能与H+ 大量共存也不能与OH-大量共存。
-、HPO4(2)若离子间能发生氧化还原反应,也不能大量共存。
如:①在酸性条件下,MnO4-具有较强的氧化性,与常见的Cl-、Br-、I-、S2-等能发生氧化还原反应,而不能大量共存;同样,NO3-在酸性条件下也具有较强的氧化性,与Br-、I-、S2-、Fe2+、SO32-等不能大量共存。
②在中性条件下,NO3-与I-、Fe2+ 等可以大量共存。
③无论是在酸性或碱性条件下,ClO-都具有氧化性,与常见的还原性离子如I-、Fe2+、S2-、SO32-等均不能大量共存。
(3)若阴、阳离子间发生“双水解”反应,有的促进反应进行,不能大量共存。
常见的能发生“双水解”反应离子归纳如下:① Al3+与HS-、S-、CO32-、HCO3-、AlO2-、SiO32-、ClO-等;② Fe3+与CO32-、HCO3-、AlO2-、ClO-等;③ NH4+与AlO2-、SiO32-等;发生“双水解”反应时,由于水解彻底,可用“===”连接反应物和产物,水解生成的难容物或挥发性物质要加沉淀符号“↓”或气体反符号“↑”。
不能共存的离子总结

不能共存的离子总结在化学领域中,离子是指带电的原子或分子。
有些离子之间存在着强烈的排斥作用,它们不能共存于同一化合物中。
以下是几个常见的不能共存的离子。
1. 钠离子和氯离子钠离子(Na+)和氯离子(Cl-)是组成食盐的主要离子。
在食盐晶体中,钠离子和氯离子通过离子键结合在一起。
由于它们之间的电荷相互吸引,它们不能分离或独立存在。
如果试图将钠离子和氯离子分开,它们会迅速重新结合形成食盐晶体。
2. 铁离子和硫离子铁离子(Fe2+或Fe3+)和硫离子(S2-)是组成铁硫矿物的主要离子。
它们通过离子键结合在一起形成稳定的化合物。
铁离子具有正电荷,而硫离子具有负电荷,因此它们之间存在强烈的电荷吸引力。
不能将铁离子和硫离子分离,否则它们会重新结合形成铁硫矿物。
3. 氢离子和氢氧根离子氢离子(H+)和氢氧根离子(OH-)是水中的离子。
在水中,它们通过离子键结合在一起形成水分子。
氢离子具有正电荷,氢氧根离子具有负电荷,它们之间的电荷吸引力使它们无法分离。
水分子是由一个氧原子和两个氢原子组成的,其中氧原子与两个氢原子之间形成了共价键。
4. 锂离子和氟离子锂离子(Li+)和氟离子(F-)是组成锂离子电池的主要离子。
锂离子具有正电荷,氟离子具有负电荷。
它们之间的电荷相互吸引使它们无法分离。
锂离子电池中的锂离子和氟离子通过离子交换在电解质中移动,从而产生电流。
总结:以上是一些不能共存的离子的例子。
这些离子之间的电荷相互吸引,使它们无法独立存在。
了解这些离子之间的相互作用有助于我们理解化学反应和化学物质的性质。
离子不能共存四类型

1、由于发生复分解反应,离子不能大量共存(1)有气体产生:如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成:①如Ba2+、Ca2+、Mg2+、Ag+等不能与SO32-、SO42-、 CO32-等大量共存;②Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;③Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成:①如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、C6H5O-、等与 H+不能大量共存;②一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存;③弱碱的简单阳离子(比如:Cu2+、Al3+、Fe3+、Fe2+、Mg2+等等)不能与OH-大量共存2、能相互发生氧化还原反应的离子[①+②]不能大量共存:①常见还原性较强的离子有:Fe2+、I-、HS-、S2-、SO32-、H SO3-;②氧化性较强的离子有:Fe3+、ClO-、MnO4-、Cr2O72-、FeO42-、(H++NO3-);③此外,S2O32-与H+也不能共存(发生歧化反应);④在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存;3、发生盐的双水解反应的离子不能大量共存,凡水解使溶液显酸性的阳离子与水解使溶液显碱性的阴离子不能大量共存的有:①(Al3+与 HS-、S2-、SiO32-、C6H5O-、AlO2-、CO32-、HCO3-)发生盐的双水解反应;②(Fe3+与 SiO32-、C6H5O-、AlO2-、CO32-、HCO3-)发生盐的双水解反应;③(NH4+与 SiO32-、AlO2-)浓溶液发生盐的双水解反应;注意:①(Fe3+与 S2 -、HS-)发生氧化还原反应,而不发生盐的双水解反应;②S2-与Cu2+、Fe2+、Pb2+、Ag+、Hg2+等发生复分解反应不能大量共存;③(NH4+与 CO32-、HCO3-)双水解反应较弱仍可大量共存。
中学化学中常见离子共存问题归纳

中学化学中常见离子共存问题归纳:在溶液中离子共存问题的实质是:哪能些离子刘不能发生反应,能发生反应者不能共存。
主要的反应类型有四类;复分解反应、氧化还原反应、络合反应、双水解反应。
中学化学常见不能共存的离子组如下:1、看是否因发生氧化还原反应而不共存:常见的如下:Fe3+与S2-、I-不能共存;;;NO3-(H+)、MnO4-(H+)、ClO-(H+)、Cr2O72-(H+)、H2O2、等与S2-、I-、SO32-、Fe2+等不能共存。
;;;;;;;;;;另在酸性条件下,特殊离子间不共存并附离子方程式如下:①H+与S2O32-:②H+与SO32- 和S2-:③H+与ClO- 和Cl- :④H+与MnO4- 和Cl- :2、看是否发生复分解反应而不共存:具体又分三种情况:①生成难溶于混合体系的物质:(即常理解为生成沉淀的一大类)常见的如下:H+与SiO32-、AlO2-、C17H35COO- ;;;OH-与除NH4+之外的所有的弱碱金属阳离子均生成难溶的碱;Ag+与Cl-、OH-、S2-、I-、Br-、SO32-、CO32-、SiO32-、PO43-、SO42- 等;Pb2+与OH-、S2-、SO32-、CO32-、SiO32-、PO43-、SO42-等;Ba2+、Ca2+与SO32-、CO32-、SiO32-、PO43-、SO42-等;Fe2+、Cu2+、Mg2+、Zn2+等与OH-、S2-、SO32-、CO32-、SiO32-、PO43-等;S2-(H2S)与Ag+、Cu2+、Pb2+、Hg2+、Fe2+与S2-反应与H2S不反应。
②生成易挥发的物质:(即常理解为生成气体的一大类)常见的如下:H+与S2-(H2S)、SO32-(HSO3-)、CO32-(HCO3-)不共存,OH-与NH4+加热时生成氨气不共存;另外有些时侯也要特别注意HCl和HNO3的挥发性。
③生成难电离的物质:(即初中常理解为生成水的)除了生成水的以外主要就是H+与弱酸根离子生成难电离的弱酸以及OH-与NH4+常温时生成NH3·H2O难电离。
高中化学知识点总结:离子共存问题及分析

高中化学知识点总结:离子共存问题1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。
如CO32—、SO32-、S2—、HCO3—、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存.(2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH—大量共存;Pb2+与Cl—,Fe2+与S2—、Ca2+与PO43—、Ag+与I-不能大量共存.(3)有弱电解质生成.如OH—、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2—、SiO32—、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42—、HS—、H2PO4—、HSO3—不能与OH—大量共存;NH4+与OH—不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2—、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。
如3AlO2-+3Al3++6H2O=4Al(OH)3↓等.2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2—、HS—、SO32-、I—和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、Cr2O7-、NO3-、ClO—与S2—、HS-、SO32-、HSO3—、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32—+6H+=3S↓+3H2O反应不能共在.H+与S2O32—不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
离子能否大量共存问题的分析与判断

离子能否大量共存问题的分析与判断判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存,否则就能大量共存。
下面讨论离子能否共存的原因与判断方法:一、常见的离子不能大量共存的原因:(1)发生复分解反应生成难溶物、挥发性物质和难电离物质时不能大量共存。
如:①若阴阳离子能相互结合生成难溶物或微容物性盐,就不能大量共存。
如常见的Ba2+、Ca2+ 与CO32-、SO32-、SO42-、PO43-、SiO32-等;再如常见的Ag+ 与Cl-、Br-、I-、PO43-、CO32-、SO42-、S2-等。
②弱碱的阳离子不能与OH-大量共存。
如常见的Fe2+、Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Zn2+等与OH-不能大量共存。
③弱酸根阴离子不能与H+ 大量共存。
如常见的CH3COO-、F-、CO32-、SO32-、S2-、PO43-等与H+ 不能大量共存。
④弱酸的酸式阴离子与H+ 或OH-均不能大量共存。
如常见的HCO3-、HSO3-、HS-、H2PO4-、HPO42-等既不能与H+ 大量共存也不能与OH-大量共存。
(2)若离子间能发生氧化还原反应,也不能大量共存。
如:①在酸性条件下,MnO4-具有较强的氧化性,与常见的Cl-、Br-、I-、S2-等能发生氧化还原反应,而不能大量共存;同样,NO3-在酸性条件下也具有较强的氧化性,与Br-、I-、S2-、Fe2+、SO32-等不能大量共存。
②在中性条件下,NO3-与I-、Fe2+ 等可以大量共存。
③无论是在酸性或碱性条件下,ClO-都具有氧化性,与常见的还原性离子如I-、Fe2+、S2-、SO32-等均不能大量共存。
(3)若阴、阳离子间发生“双水解”反应,有的促进反应进行,不能大量共存。
常见的能发生“双水解”反应离子归纳如下:①Al3+与HS-、S-、CO32-、HCO3-、AlO2-、SiO32-、ClO-等;②Fe3+与CO32-、HCO3-、AlO2-、ClO-等;③NH4+与AlO2-、SiO32-等;发生“双水解”反应时,由于水解彻底,可用“===”连接反应物和产物,水解生成的难容物或挥发性物质要加沉淀符号“↓”或气体反符号“↑”。
高中化学知识点总结:离子共存问题及分析 太强太好了!!!

高中化学知识点总结:离子共存问题1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生―双水解‖反应。
如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。
H+与S2O32-不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
专题02 离子反应【考点清单】(讲+练)(解析版)高一化学上学期期中考试复习
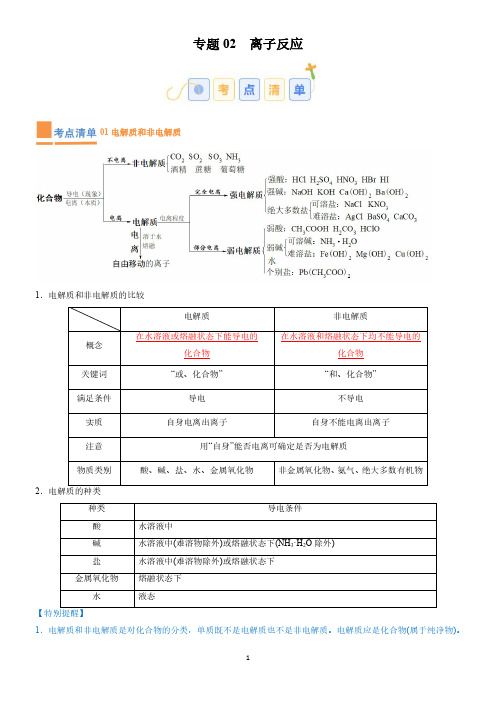
专题02离子反应01电解质和非电解质1.电解质和非电解质的比较电解质非电解质概念在水溶液或熔融状态下能导电的化合物在水溶液和熔融状态下均不能导电的化合物关键词“或、化合物”“和、化合物”满足条件导电不导电实质自身电离出离子自身不能电离出离子注意用“自身”能否电离可确定是否为电解质物质类别酸、碱、盐、水、金属氧化物非金属氧化物、氨气、绝大多数有机物2.电解质的种类种类导电条件酸水溶液中碱水溶液中(难溶物除外)或熔融状态下(NH 3·H 2O 除外)盐水溶液中(难溶物除外)或熔融状态下金属氧化物熔融状态下水液态【特别提醒】1.电解质和非电解质是对化合物的分类,单质既不是电解质也不是非电解质。
电解质应是化合物(属于纯净物)。
而Cu 则是单质(能导电的物质不一定是电解质,如石墨或金属),K 2SO 4与NaCl 溶液都是混合物。
2.电解质应是一定条件下本身电离而导电的化合物。
有些化合物的水溶液能导电,但溶液中离子不是它本身电离出来的,而是与水反应后生成的,因此也不是电解质。
例如CO 2能导电是因CO 2与H 2O 反应生成了H 2CO 3,H 2CO 3能够电离而非CO 2本身电离。
所以CO 2不是电解质,是非电解质(氨气、二氧化硫、三氧化硫同样道理)。
而H 2CO 3、H 2SO 3、NH 3·H 2O 是电解质。
3.酸、碱、盐、活泼金属氧化物、水是电解质,蔗糖、酒精为非电解质。
4.BaSO 4、AgCl 难溶于水,导电性差,但由于它们的溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,所以它们是电解质。
02电解质溶液或熔融电解质导电的原因(以NaCl 为例)电解质――→水中电离产生阴、阳离子――→电场作用定向移动―→导电(1)干燥的NaCl 固体不导电。
NaCl 属于电解质,固体中含有带电微粒Na +、Cl -,但这些离子不能自由移动,故氯化钠固体不导电。
因双水解不能大量共存的离子组合

因双水解不能大量共存的离子组合在化学反应过程中,离子的存在与相互作用是至关重要的。
然而,有些离子组合却不能在大量的条件下共存,其中一个主要的原因就是双水解反应。
本文将探讨这些不能大量共存的离子组合,并分析其原因。
首先,我们来讨论氧化还原反应中的离子组合。
在氧化还原反应中,氧化剂和还原剂进行电子转移,产生新的离子。
然而,某些离子组合却不能同时存在于反应溶液中。
一个典型的例子就是铁离子和铜离子。
这两种离子在水溶液中会发生双水解反应,导致形成絮状沉淀物,并使反应变得困难。
因此,在氧化还原反应中,这两种离子往往不能同时存在。
除了氧化还原反应,双水解反应也在其他化学反应中起到重要作用。
例如,钙离子和硬水中的碳酸根离子之间存在着双水解反应。
当钙离子和碳酸根离子的浓度较高时,双水解反应会导致大量沉淀物的形成,给实验操作带来困难。
因此,在实际应用中,我们往往需要避免这些不能大量共存的离子组合。
双水解不能大量共存的离子组合的形成原因主要与溶液中的离子浓度、电荷大小、溶液pH值等相关。
当两种离子的浓度较高时,它们更容易发生双水解反应,并形成大量的沉淀物。
此外,离子的电荷大小也会影响双水解反应的强度。
电荷较大的离子更容易与水分子结合,从而形成沉淀物。
另外,溶液的pH值对双水解反应也有重要影响。
在酸性条件下,某些离子会更容易发生双水解反应,并形成沉淀。
为了避免这些不能大量共存的离子组合带来的影响,我们可以通过一些方法进行控制。
例如,在实验操作中,我们可以通过控制溶液的pH值、稀释离子浓度、选择合适的配体等来避免双水解反应的发生。
此外,使用适当的溶剂、反应温度等也可以减少双水解反应的程度。
总之,由于双水解反应的存在,某些离子组合不能在大量的条件下共存。
这种现象在氧化还原反应和其他化学反应中都是普遍存在的。
离子浓度、电荷大小和溶液pH值是影响双水解反应的关键因素。
为了避免双水解反应的发生,我们可以通过控制溶液条件和实验操作来减少其影响。
离子间不能共存的条件

两种离子相互作用如果有水、气体或沉淀等物质生成,则这两种离子不能共存于同一溶液中。
初中化学阶段常见不共存离子如下:(1)H++OH-→H2O;(2)H++CO32-→CO2↑;(3)NH4++OH-→NH3↑;(4)Ba2++SO42-→BaSO4 ↓(5)Ag++Cl-→AgCl ↓;(6)Ca2++CO32-→CaCO3 ↓;(7)Ba2++CO32-→BaCO3 ↓; (8) Mg2++OH-→Mg(OH)2(9)Cu2++OH-→C u(OH)2(10)Fe3++OH-→Fe(OH)3↓(2)不共存离子间相互反应所得产物的特征:(1)CO2通常情况下为使澄清的石灰水变混浊的无色气体;(2)NH3通常情况下为无色有刺激性气味,且能使湿润的红色石蕊试纸变蓝的气体;(3)AgCl、BaSO4二者均为白色沉淀,且不溶于稀硝酸;(4)CaCO3、BaCO3二者均为白色沉淀,且与盐酸(或稀硝酸)反应产生CO2气体;(5)Mg(OH)2为白色沉淀,Fe(OH)3为红褐色沉淀,Cu(OH)2为蓝色沉淀,三者均溶于盐酸(或稀硝酸)。
另外1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
离子不能大量共存的四种情况

离子不能大量共存的四种情况
1 盐酸和氢氧化钠
盐酸是弱酸,氢氧化钠是强碱,两者末端带正负电荷,共存会发生酸碱反应,因此大量共存无法实现。
2 氢氯化氢和氢氧化钠
氢氯化氢带正电荷离子,氢氧化钠带负电荷,两者相互抵消,因此大量共存无法实现。
3 铁和氯
铁生成铁氯化物会发生氧化还原反应,同时还存在阳离子和阴离子的抵消,因此大量共存无法实现。
4 盐酸和乙酸
盐酸和乙酸都是弱酸,末端同为正电荷离子,相遇时会迅速进行反应,同时发生抵消作用,因此大量共存无法实现。
综上所述,由于有酸碱反应、有抵消作用、有氧化还原反应,这四种情况中,同时存在的离子不能大量共存。
我们要充分利用化学知识来对抗各种不良的物质,建立一个美好的环境。
离子能否共存的依据

溶液中离子大量共存指离子浓度均相当大,若离子间发生反应使离子浓度有些降低,也就是离子不能大量共存。
下面是十条规律可作为离子不能大量共存的判断依据1 生成气体不能大量共存如:硫离子,硫氢根离子,亚硫酸根离子,亚硫酸氢根,碳酸根,碳酸氢根等离子都能和氢离子反应生成气体,故均不能和氢离子大量共存;而铵根和氢氧根易产生氨气,故二者也不能大量共存。
2 生成沉淀不能大量共存溶解性表中不溶或微溶物质的阴阳离子不能大量共存。
如:a 氢氧根和铁离子,亚铁离子,铜离子,锌离子,铝离子,镁离子,银离子,汞离子易发生难容的氢氧化物或氧化物而不能大量共存。
b 硫离子和亚铁离子,锌离子,铜离子,汞离子,银离子等易结合成难容的硫化物沉淀,不能共存c 银离子和氯离子,溴离子,碘离子会形成卤化银沉淀,不能共存。
d 镁离子,钙离子,钡离子,铅离子易和碳酸根,亚硫酸根,硫酸根,磷酸根生成难溶盐(硫酸镁除外)而不能共存;钙离子与氟离子,四氧化二镉不能共存;镁离子,钙离子与C17H35COO- 不能共存;镁离子,钙离子,钡离子与磷酸一氢根等不能大量共存。
e 氢离子与硅酸根,硫代硫酸根,偏铝酸易发生沉淀不能共存。
f 两种离子相遇能结合生成微溶物时,也不能大量共存。
如:钙离子与氢氧根离子,硫酸根;银离子与硫酸根;铅离子与氯离子;镁离子与碳酸根离子,亚硫酸根离子;汞离子与硫酸根离子等均不能大量共存。
3 生成难电离物质不能大量共存如:氢离子与氢氧根离子,氟离子,次氯酸根,碳酸根,硫离子,硫氢根离子,亚硫酸根离子,偏铝酸根离子,磷酸根,氢青根,硫青根,醋酸根,甲酸根,四氧化二镉等易结合成难电离弱电解质,因而不能大量共存。
4 发生双水解反应不能大量共存溶解性表中“—"符号对应的阴离子和阳离子绝大多数因发生双水解而不能大量共存。
因弱碱的阳离子水解呈酸性,弱酸阴离子水解呈碱性,两类离子在溶液中相遇因中和反应促进双水解强烈进行或不能共存。
如:铝离子与碳酸根,碳酸氢根,硫离子,硫氢根,偏铝酸根;铁离子与碳酸根,碳酸氢根,硫离子(注意铁离子溶液中滴加硫离子主要反应为氧化还原);铵根与硅酸根均因双水解而不能共存。
溶液中离子共存

离子共存规律总结有关溶液中离子能否共存问题是中学化学中的常见问题。
近几年高考几乎每年都设置判断离子共存问题的试题。
题不难,但这类题上能否得分差异较大。
相关知识点:1由于发生复分解反应,离子不能大量共存。
1、有气体产生。
如CO32-、S2-、HS-、HSO3-、等易挥发的弱酸的酸根与H+不能大量共存,主要是由于CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。
2、有沉淀生成。
按照溶解性表,如果两种离子结合能形成沉淀的,就不能大量共存。
溶解性表,可总结成这么五句话:钾(K+)钠(Na+)硝(NO3-)铵(NH4+)溶,硫酸(SO42-)除钡(Ba2+)铅(Pb2+)(不溶),盐酸(Cl-)除银(Ag+)亚汞(Hg22+)(不溶),其他离子基本与碱同。
如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存主要是由于Ba2++CO32-=CaCO3↓、Ca2++SO42-=CaSO4(微溶);Cu2+、Fe3+等不能与OH-大量共存也是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等。
3、有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO-等与H+不能大量共存,主要是由于OH-+H+=H2O、CH3COO-+H+=CH3COOH;一些酸式弱酸根不能与OH-大量共存是因为HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O、NH4++OH-=NH3·H2O等。
4、一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。
如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
2由于发生氧化还原反应,离子不能大量共存1、具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
离子不能大量共存的四种类型

离子不能大量共存的四种类型在我们的生活中,离子就像那些不容易相处的朋友,稍微一碰撞,就可能引发一场“战争”。
说到离子不能大量共存,这可不是个简单的问题,今天咱们就来聊聊这四种类型,别紧张,轻松点,听我慢慢道来。
咱们得说说“反应性离子”。
这就像是一群非常敏感的小伙伴,一碰就炸,动不动就出事。
你想啊,反应性离子常常会跟其他离子发生激烈的反应,就像聚会上的那些大喇叭,根本不让人消停。
这类离子聚在一起,简直就是火药桶,一点就着!想象一下,如果钠离子和氯离子在同一个“舞池”里,那个场面就跟燃烧的烟火一样,激烈得让人瞠目结舌。
一般来说,这种离子喜欢单独行动,碰上其他家伙,没准就要立马开打,谁都不想被卷进去。
我们要说的是“电荷相斥的离子”。
这就像一群见了面就互看不顺眼的邻居,真是个头疼的问题。
正电荷和负电荷之间虽然有吸引力,但同种电荷碰到一起,就会产生强烈的排斥感。
就像你在地铁上碰到一个和你同款的背包,心里不免会想:“这家伙跟我竞争啥?”所以,这种离子在一起,就像两个超级自恋的人,彼此只会互相排斥,根本不愿意共处。
然后,咱们说说“相互作用弱的离子”。
这群家伙就像是那种在聚会里只喝水的朋友,平时不太显眼,但一旦被激活,嘿,那可就不得了!这些离子在低浓度的时候,基本上是相安无事,彼此并不干扰。
但如果浓度高了,嘿,他们就开始闲聊,甚至相互影响,搞得人心惶惶。
想象一下,一群安静的书生,一旦被激励,立马就能喧闹成一团,瞬间成了焦点。
所以,这种离子虽然平时不太引人注意,但一旦浓度升高,结果就让人捉摸不定。
咱们得提提“配位离子”。
这类离子就像是那些总是抱团取暖的小伙伴,喜欢团结在一起。
可偏偏,他们也有自己的小圈子,跟不同的小伙伴玩耍会引发麻烦。
有些离子一旦参与了配位,别的离子就很难插得上手,仿佛在排外,只有特定的离子才能加入。
就像你在朋友的派对上,只有受邀请的人才能进入VIP区,其他人想进去可就没门。
这让配位离子在共存时变得相当挑剔,不然就会闹得鸡飞狗跳,场面失控。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子不能共存的类型
一、离子不能共存的原因:
反应物中某些离子浓度的减小是离子不能大量共存的原因。
二、离子不能共存的类型
1、离子互换反应(复分解反应):
(1)生成沉淀(难溶或微溶性物质)如:CaCO3、Mg(OH)2、BaSO4、AgSO4等
(2)生成气体(挥发性物质)如:CO2、NH3、H2S等
(3)生成难电离的物质(弱电解质)如:CH3COOH、NH3·H2O、H2O等
2、双水解反应:弱酸所对应的阴离子与弱碱所对应的阳离子互相促进双水解进行到底。
如:Al3+与CO32-、S2-HCO3-、AlO2-;NH4+与SiO32-、AlO2-;Fe3+(Fe2+)与CO32-、HCO3-、AlO2- 等。
3、络合反应:如 Fe3+与 SCN-;Fe(SCN)2+、Fe(SCN)3、Ag(NH3)+、[Cu(NH3)4]2+等]
4、氧化还原反应:如
氧化性离子:Fe3+、MnO4-、NO3-(酸性条件下)、ClO-
还原性离子:S2-、I-;Fe2+
(其中只有Fe3+与Fe2+可以共存)
三、常见的前提设置
1、对溶液性质的要求:
(1)颜色:无色透明溶液中一定无Cu2+、Fe2+、Fe3+、MnO4-。
因为Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+ (浅绿色)、MnO4-(紫红色)、MnO42-(绿色)等都有颜色。
(2)溶液的酸碱性:如25℃时由水电离出的C(H+)或C(OH-)=1.0×10-12mol/L表示的是该溶液可能为强酸性或者为强碱性;与Al作用产生氢气(高二内容);室温时某指示剂的颜色(如酚酞变红);室温下pH=1或13的溶液等。
2、特殊要求:如在××离子存在下不能共存的;因发生氧化还原反应,而不能大量共存的;因生成沉淀和
气体而不能大量共存的等。
3、注意限制条件的设置,看清是问“能”、“不能”,还是“一定能”、“一定不能”等对选项的限制条件。
4、S2O32-与 H+不能共存,因为 2H+ +S2O32-→ S↓ + SO2↑+H2O 发生氧化还原反应。
5、IO3-与 I-在酸性条件下,因发生氧化还原反应而不能共存;但是,在碱性条件和中性条件不反应,是可
以共存的。
类似的还有:
NO3-强酸性条件下能氧化 Fe2+、I-、SO32-等物质,而使 NO3-与这些离子不能共存;在其它情况下就不能氧化Fe2+、I-、SO32-等;而使NO3-能够与这些离子共存。
但是,
MnO4-、ClO-无论是酸性条件还是碱性条件都有较强的氧化性,都不能与还原性离子共存。
四、强化训练
1、在 pH=1 溶液中能大量共存的离子组是()
A.MnO4−、OH−、SO42−、Cl−
B.Fe2+、K+、NO3−、Al3+
C.NH4+、Cu2+、SO42−、Cl−
D.Na+、Ca2+、Cl−、HCO3−
2、在酸性溶液中能大量共存,并且溶液为无色透明的是()
A.Na+、K+、Cu2+、SO42−
B.NH4+、Na+、NO3−、Cl−
C.K+、OH−、HCO3−、Cl−
D.Ag+、Ba2+、Cl−、NO3−
3、下列各组离子能大量共存的是()
A.Na+、Ba2+、S2−、SO32−
B.H+、K+、HS−、SO42−
C.Fe2+、H+、Cl−、NO3−
D.K+、NH4+、SO42−、NO3−
4、常温下,在水电离产生的氢离子浓度为 10−13mol/L 的溶液中,一定能大量共存的离子组是()
A.K+、NH4+、NO3−、Cl−
B.Na+、Ba2+、Cl−、NO3−
C.Fe2+、Cu2+、NO3−、SO42−
D.NH4+、K+、I−、NO3−
5、下列各组离子,在溶液中能大量共存的是()
A.Ba2+、K+、CO32−、Cl−
B.S2−、Cl−、Na+、H+
C.Na+、H+、I−、SO42−
D.Ca2+、Fe3+、NO3−、SCN−
6、某溶液中存在大量的 H+、Cl−、SO42−,该溶液中还可能大量存在的是()
A.HCO3−
B.Ba2+
C.Al3+
D.Ag+
7、室温时,某溶液中由水电离生成的 H+和 OH−物质的量浓度的乘积为 10−24,则在该溶液中一定不能大量共存的离子组是()
A.Al3+、Na+、NO3−、Cl−
B.K+、Na+、Cl−、CO32−
C.NH4+、Na+、Cl−、SO42−
D.Na+、K+、HCO3−、NO3−
8、含有下列各组离子的溶液中,通入过量 SO2气体后仍能大量共存的是_______(填序号)。
A.H+、Ca2+、Fe3+、NO3−
B.Ba2+、Cl−、Al3+、H+
C.Na+、NH4+、I−、HS−
D.Na+、Ca2+、K+、Cl−
【参考答案】
1.C
2. B
3.D
4.B
5.C
6.C
7.D
8.BD。
