酶法测定膳食纤维的推荐方法(AOAC
酶法测定膳食纤维的推荐方法(AOAC

酶法测定膳食纤维的推荐方法:试剂:1. 0.1M PBS, PH=0.6.2. 4M HCl ; 4M NaOH3. 95%乙醇,78%乙醇4. 丙酮酶:淀粉酶,蛋白酶,胰酶步骤:1. 湿样品需要均质并冻干,所有样品都需要粉碎至粒径0.3mm。
2. 当脂肪含量大于6-8%时或者需要适当粉碎时,需要在室温下用石油醚抽脂15min。
3. 称取1g样品,精确到0.1mg,转移至锥形瓶。
向其中加入25ml 0.1M的PBS,PH=6,充分悬浮样品。
4. 加入100ul 淀粉酶。
用膜盖住锥形瓶顶部,沸水浴保温15min,偶尔摇晃一下。
5. 室温下放凉,加入20ml蒸馏水,用HCL调至PH=1.5,用少量蒸馏水冲洗电极。
6. 加入100mg 胃蛋白酶,顶部盖膜,40℃保温并搅拌60min.7. 加入20ml蒸馏水,用NaoH调PH至6.8,少许蒸馏水冲洗电极。
8. 加入100ml 胰酶,顶部盖膜,40℃保温并搅拌60min.9. 用HCl调PH至4.5.10. 用干燥的称量过的G2坩埚(含0.5g硅藻土)作为辅助过滤设施。
用20m蒸馏水分两次冲洗。
A. 滤液残留(不溶性膳食纤维):11. 用20ml 95%乙醇和20ml 丙酮分两次冲洗。
12. 105℃干燥至恒重,干燥器内冷却后称重(D1)。
13. 550℃灰化5h,干燥器内冷却后称重(I1)B.滤液(可溶性膳食纤维)14. 将滤液可冲洗水合并定容至100ml.15. 加入微热(60℃)的95%乙醇400ml,沉淀1h(时间可以缩短).16. 用含有0.5g硅藻土的G2坩埚过滤。
17. 用20ml 78%乙醇、20ml 95%乙醇和20ml丙酮分别分两次冲洗。
18. 105℃烘至恒重,在干燥器内冷却后称重(D2)19. 550℃至少灰化5h,干燥器内冷却后称重(I2)空白:水溶性膳食纤维和不溶性膳食纤维空白值(B1和B2)的测定都是在没有添加样品的情况下进行。
膳食纤维测定方法

膳食纤维的测定方法【摘要】膳食纤维被称为人体的第七营养素,对维持人体健康具有重要作用。
膳食纤维通过发酵产物短链脂肪酸和对肠道菌群的调节作用从而影响肠道健康,本文对膳食纤维的测定方法进行了综述。
【关键词】膳食纤维;定义;测定膳食纤维已被确认为与传统的六大营养素并列的“第七营养素”,对维持人体健康具有重要的生理作用。
膳食纤维的理化特性概括起来是膨胀作用、持水能力、胶体形成、离子交换、改善胃肠微生物菌落和产生低热量等。
这些特性产生的生理作用如下:使人产生饱腹感并抑制进食,从而预防肥胖;润肠通便,防治肠道疾病和便秘;调控血清胆固醇,降血压,防治冠状动脉硬化,胆石症和预防心脑血管疾病;降血糖,防治糖尿病等。
目前,结肠癌、炎症性肠炎和其他结肠紊乱疾病已经严重影响身体健康。
膳食纤维为肠道微生物生长提供均衡的能量和营养,这是维持结肠生态系统平衡所必需的,另外,膳食纤维的发酵,特别是丁酸发酵,有利于结肠健康。
目前国内外业已研究开发的膳食纤维共有6大类约30余种,其中实际生产和应用的不超过10种。
一、膳食纤维膳食纤维(dietary fiber,df)被认为是食物中不被人体胃肠道消化酶水解,但能被肠道微生物消化的物质,特别是植物成分。
膳食纤维包括非淀粉多糖,如纤维素、半纤维素、树胶、果胶,以及木质素、抗性糊精和抗性淀粉。
二、膳食纤维的测定世界卫生组织建议的总膳食纤维摄入量下限为每人每天27.0克,上限为每人每天40.0克。
由此可见:膳食纤维检测结果的表示及产品标签标示等方面的问题应该作为膳食纤维研究中的又一个重要方面,而检测结果是由膳食纤维的检测方法和检测标准决定的,因此有必要建立统一的检测方法和标准。
df的不同测定方法因其测定原理不同结果差异较大。
自20世纪60年代初以来,分析化学家们建立起大量的检测方法,具有代表性的几种方法为非酶重量法、酶-重量和酶-化学法。
(1)非酶重量法。
非酶重量法又称粗纤维测定法,由einhof于1801-1809年建立。
检测膳食纤维的方法

检测膳食纤维的方法膳食纤维是指不能被人体消化吸收的多种碳水化合物,在人体内部没有被完全吸收利用,而是在消化道内发挥一系列重要生理功能的物质。
对于人体健康来说,膳食纤维具有重要的保健作用,能够降低血脂和血糖水平、促进肠道蠕动、预防便秘、降低结肠癌的发生率等。
为了能够准确地检测膳食纤维含量,提供科学的衡量指标,目前有一些常用的方法。
1. Gravimetric method(重量法)重量法是一种基本的膳食纤维分析方法,通过测定样品在经过一系列消化和提取过程后,残留物的质量来计算膳食纤维的含量。
首先,将样品经过酶解和洗涤等处理,去除可消化的部分,然后通过烘干使其失重,最后计算失重的质量即为膳食纤维的含量。
2. Chemical method(化学法)化学法是通过化学反应来测定膳食纤维的含量。
常用的化学方法有酚硫酸法、酶解法和高压液相色谱法等。
其中,酶解法是将样品暴露在特定的酶中,通过酶的作用降解多糖,然后通过化学分析方法确定被酶降解的物质的含量,从而计算膳食纤维的含量。
3. Enzymatic-gravimetric method(酶重法)酶重法结合了重量法和酶解法,通过测量提取液中的纤维残留物的质量以及可被酶解的非纤维物质的质量,从而计算出纤维的含量。
与传统的重量法相比,酶重法可以更加准确地测定纤维的含量。
4. Near Infrared Reflectance (NIR) Spectroscopy(近红外反射光谱法)近红外反射光谱法是一种无损检测方法,通过测量样品在近红外波段内的光谱反射,通过与已知含量的样品进行比对,从而确定膳食纤维的含量。
这种方法具有快速、无需样品处理的优点,但需要建立可靠的模型来实现准确的测量。
总结起来,目前常用的检测膳食纤维的方法有重量法、化学法、酶重法和近红外反射光谱法。
这些方法各有优势和局限性,需要根据实际需要选择适合的方法。
随着科学技术的发展,对膳食纤维的检测方法也将不断改进和完善,为人们提供更加准确和可靠的数据。
AOAC 985.29 食物中总膳食纤维 酶-重量法

45.4.07AOAC Of f i c ial Method 985.29To t al Di e tary Fi b er in FoodsEnzymatic–Gravimetric MethodFirst Ac t ion 1985Fi nal Ac tion1986AOAC–AACC MethodCo d ex-Adopted–AOAC Method*A.Prin ci pleDu p li c ate test por t ions of dried foods, fat-extracted if con t ain i ng >10% fat, are gelatinized with Termamyl (heat-stable α-am y l ase), and then en z y m at i c ally di g ested with pro t e a se and amyloglucosidase to re m ove pro t ein and starch. (When an a l yz i ng mixed di e ts, al w ays ex t ract fat prior to de t er m in i ng to t al di e tary fi b er.) Four vol u mes of ethyl al c o h ol are added to pre c ip i t ate sol u b le di e tary fi b er. To t al res i d ue is fil t ered, washed with 78% ethyl al c o h ol, 95% ethyl al c o h ol, and ac e t one. Af t er dry i ng, res i d ue is weighed. One du p li c ate is an a l yzed for pro t ein, and other is in c in e r a ted at 525°C and ash is de t er m ined. To t al di e tary fi b er = weight res i d ue – weight (pro t ein + ash).B. Ap p a r a t us(a)Fritted cru c i b le.—Po r os i ty No. 2 (Py r ex No. 32940, coarse, ASTM 40-60 µm; or Corning No. 36060 Büchner, fritted disk, Py r ex, 60 mL, ASTM 40-60 µm). Clean thor o ughly, heat 1 h at 525°C, and soak and then rinse in H2O. Add ca 0.5 g Celite to air-dried cru c i b les and dry at 130°C to con s tant weight (≥ 1 h). Cool and store in des i c c a t or un t il used.(b) V ac u um source.—V ac u um pump or as p i r a t or equipped with in-line dou b le vac u um flask to pre v ent con t am i n a t ion in case of H2O backup.(c) Vac u um oven.—70°C.Al ter na tively,105°C air oven can be used.(d) Des ic ca tor.(e)Muf fle fur nace.(f)Wa t e r b a t h s.—(1)B o i l i n g.(2)C o n s t a n t tem p er a t ure.—Ad j ust a ble to 60°C, with ei t her multistation shaker or multistation mag n etic stir r er to pro v ide con s tant ag i t a t ion of di g es t ion flasks dur i ng en z y m atic hy d ro l y s is.(g) Beakers.—Tall-form, 400 or 600 mL.(h) Bal a nce.—An a lyt i cal,readability to0.1mg.(i)pH me t er.—Stan d ard i zed with pH 7 and pH 4 buff e rs.C. Re a gents(a) 95% Eth a n ol.—v/v. Technical grade.(b) 78% Eth a n ol.—Place 207 mL H2O into 1 L vol u m et r ic flask. Di l ute to vol u me with 95% ethyl al c o h ol. Mix and di l ute to vol u me again with 95% ethyl al c o h ol if nec e s s ary. Mix. One vol u me H2O mixed with 4 vol u mes 95% ethyl al c o h ol will also give 78% ethyl al c o h ol fi n al con c en t ra t ion.(c)Ac e tone.(d)Phos p hate buffer.—0.08M, pH 6.0. Dis s olve 1.400 g so d ium phos p hate dibasic, an h y d rous (Na2HPO4) (or 1.753 g dihydrate) and 9.68 g so d ium phos p hate monobasic monohydrate (NaH2PO4⋅H2O) (or 10.94 g dihydrate) in ca 700 mL H2O. Di l ute to 1 L with H2O. Check pH with pH me t er.(e) Al p ha-amylase (heat sta b le).—Termamyl. (1) Store in re frig er a tor.Based on Nel s on/Somogyi re d uc i ng sugar with sol u b le starch as sub s trate.—10 000 + 1000 units/mL (1 unit is de f ined as the amount of en z yme re q uired to re l ease 1 µmole re d uc i ng sugar equiv a l ents/min at pH 6.5 and 40°C). (2) Based on Ceralpha method us i ng p-nitrophenyl-maltosaccharide as sub s trate in the pres e nce of a thermostable al p ha-glucosidase.—3000 + 300 Ceralpha units/mL (1 unit of en z yme is re q uired to re l ease 1 µmole p-nitrophenyl/min at pH 6.5 and 40°C).(f) Pro te ase.—Keep re frig er ated.(1)Ca sein as say.—300–400 Units/mL. (1 pro t e a se unit is de f ined as the amount of en z yme re q uired to hy d ro l yze (and solubilize in TCA) 1 µmole ty ro sine equiv a l ents/min from sol u b le ca s ein at pH 8.0 and 40°C); 7–15 units/mg (1 unit will hy d ro l yze ca s ein to pro d uce color equiv a l ent to 1.0 µmole ty r o s ine/min at pH 7.5 and 37°C). Color by Folin-Ciocalteau re a gent. (2) Azo-casein as s ay.—300–400 Units/mL [1 unit endo-peptidase ac t iv i ty is de f ined as the amount of en z yme re q uired to hy d ro l yze (and solubilize in TCA) 1 µmole ty r o s ine equiv a l ents/min from sol u b le ca s ein at pH 8.0 and 40°C].(g) Amyloglucosidase.—Keep re frig er ated.(1)Starch/glu c ose oxidase–peroxidase method.—2000–3300 Units/mL (1 unit en z yme ac t iv i ty is de f ined as the amount of en z yme re q uired to re lease1µmole glu c ose/min at pH 4.5 and 40°C). (2) PNPBM (p-nitrophenyl beta-maltosidase) method.—130–200 Units/mL (1 unit en z yme ac t iv i ty [PNP unit] is the amount of en z yme, which in the pres e nce of ex c ess lev e ls of beta-glucosidase, will re l ease 1 µmole p-nitrophenyl from p-nitrophenyl beta-maltosidase/min at 40°C).The only en z yme which has been found to be sig n if i c antly con tam i nated with in ter fer ing ac tiv i ties is amyloglucosidase. Thermostable al p ha-amylase and pro t e a se from com m er c ial sources have been found to be gen e r a lly free of in t er f er i ng en z ymes. Low lev e ls of beta-glucanase have been de t ected in pro t e a se prep a r a t ions, but at lev e ls well be l ow that which would in t er f ere with to tal di etary fi ber anal y sis.The ma jor con tam i nant in amyloglucosidase prep a r a t ion was shown to be an endo-cellulase and re s ulted in endo-depolymerization of mixed-linkage beta-glucan from bar l ey and oats, with re s ul t ant un d er e s t i m a t ion of this di etary fi ber com po nent.The con tam i na tion of amylogucosidase with endo-cellulase (beta-glucanase) can be eas ily de tected.Al t er n a t ively, there are kits con t ain i ng all 3 en z ymes (pre t ested) avail a ble from a num b er of com p a n ies.(h)So dium hy drox ide so lu tion.—0.275M. Dis s olve 11.00 g NaOH ACS in ca 700 mL H2O in 1 L vol u m et r ic flask. Di l ute to vol u me with H2O.(i) Hy d ro c hlo r ic acid so l u t ion.—0.325M. Di l ute stock so l u t ion of known ti t er, e.g., 325 mL 1M HCl, to 1 L with H2O.(j) Celite.—Acid-washed.© 2005 AOAC IN T ER N A T IONAL Ta b le 985.29. Test sam p les for en z yme pu r ityTest sam p leAc tiv itytestedTest por t ionweight, gEx pectedre cov ery,% Cit rus pec tin Pectinase0.195–100 Stractan (larch gum)Hemicellulase0.195–100 Wheat starch Am y lase 1.00–1Corn starch Am y lase 1.00–2Ca sein Pro te ase0.30–2β-Glucan (bar l ey gum)aβ-Glucanase0.195–100aSigma Chem i c al Co. or Megazyme In t er n a t ional Ire l and, Ltd.D.En zyme Pu rityTo en sure ab sence of un de sir able en zy matic ac tiv ity in en zymes used in this pro c e d ure, run ma t e r i a ls listed in Ta b le 985.29 through en t ire pro c e d ure each time lot of en z ymes is changed, or at max i m um in t er v al of 6 months to en s ure that en z ymes have not de g raded.E. Test Por t ion Prep a r a t ionDe t er m ine to t al di e tary fi b er on dried test sam p le. Ho m og e n ize test sam p le and dry over n ight in 70°C vac u um oven, cool in des i c c a t or, and dry-mill test sam p le to 0.3–0.5 mm mesh. If test sam p le can n ot be heated, freeze-dry be f ore mill i ng. If high fat con t ent (>10%) pre v ents proper mill i ng, defat with pe t ro l eum ether (3 times with 25 mL por t ions/g test sam p le) be f ore mill i ng. Re c ord loss of weight due to fat re m oval and make ap p ro p ri a te cor r ec t ion to fi n al % di e tary fi b er found in de t er m i n a t ion. Store dry-milled test sam p le in capped jar in des i c c a t or un t il anal y s is is car r ied out.F.De ter mi na tionRun blank through en t ire pro c e d ure along with test por t ions to mea s ure any con t ri b u t ion from re a gents to res i d ue.Weigh du p li c ate 1 g test por t ions, ac c u r ate to 0.1 mg, into 400 mL tall-form beak e rs. Test por t ion weights should not dif f er >20 mg. Add 50 mL pH 6.0 phos p hate buffer to each beaker. Check pH and ad j ust to pH 6.0 ± 0.2 if nec e s s ary. Add 0.1 mL Termamyl so l u t ion. Cover beaker with Al foil and place in boil i ng water bath 15 min. Shake gently at 5 min in t er v als. In c rease in c u b a t ion time when num b er of beak e rs in boil i ng water bath makes it dif f i c ult for beaker con tents to reach in ter nal tem per a ture of95°–100°C. Use ther mom e ter to in di cate that 15 min at 95°–100°C is at t ained. To t al of 30 min in water bath should be suf f i c ient.Cool so l u t ions to room tem p er a t ure. Ad j ust to pH 7.5 ± 0.2 by add i ng 10 mL 0.275M NaOH so l u t ion.Add 5 mg pro t e a se. (Pro t e a se sticks to spat u la, so it may be pref e r a b le to pre p are en z yme so l u t ion (50 mg in 1 mL phosphate buffer) and pipet 0.1 mL to each sam p le just be f ore use.Cover beaker with Al foil. In c u b ate 30 min at 60°C with con t in u o us ag i t a t ion. Cool. Add 10 mL 0.325M HCl so l u t ion. Mea s ure pH and dropwise add acid if nec e s s ary. Fi n al pH should be 4.0–4.6. Add 0.3 mL amyloglucosidase, cover with Al foil, and in c u b ate 30 min at 60°C with con tin u ous ag i ta tion.Add280mL 95% ethyl al c o h ol pre h eated to 60°C (mea s ure vol u me be f ore heat i ng). Let pre c ip i t ate form at room tem p er a t ure for 60 min. Weigh cru c i b le con t ain i ng Celite to near e st 0.1 mg, then wet and re d is t rib u te bed of Celite in cru c i b le by us i ng stream of 78% ethyl al c o h ol from wash bot t le. Ap p ly suc t ion to draw Celite onto fritted glass as even mat. Main t ain suc t ion and quan t i t a t ively trans f er pre cip i tate from en zyme di gest to cru ci ble.Wash res i d ue suc c es s ively with three 20 mL por t ions of 78% ethyl al c o h ol, two 10 mL por t ions of 95% ethyl al c o h ol, and two 10 mL por t ions of ac e t one. Gum may form with some prod u cts, trap p ing liq u id. If so, break sur f ace film with spat u la to im p rove fil t ra t ion. Time for fil t ra t ion and wash i ng will vary from 0.1 to 6 h, av e r a g i ng 0.5 h per sam p le. Long fil t ra t ion times can be avoided by care ful in ter mit tent suc tion through out fil tra tion.Dry cru c i b le con t ain i ng res i d ue over n ight in 70°C vac u um oven or 105°C air oven. Cool in des i c c a t or and weigh to near e st 0.1 mg. Sub t ract cru c i b le and Celite weight to de t er m ine weight of res i d ue. An a l yze res i d ue from 1 test por t ion of set of du p li c ates for pro t ein by 960.52 (see 12.1.07), us i ng N × 6.25 as con v er s ion fac t or, ex c ept in cases where N con t ent in pro t ein is known.In c in e r a te sec o nd test por t ion of du p li c ate 5 h at 525°C. Cool in des i c c a t or and weigh to near e st 0.1 mg. Sub t ract cru c i b le and Celite weight to de t er m ine ash.G.Cal cu la tionsDe t er m i n a t ion of blank:B = blank, mg = weight res i d ue − P B−A Bwhere weight res i d ue = av e r a ge of res i d ue weights (mg) for du p li c ate blank de t er m i n a t ions; and P B and A B = weights (mg) of pro t ein and ash, re s pec t ively, de t er m ined in first and sec o nd blank res i d ues.Cal c u l ate TDF as fol l ows:TDF, % =[(weight res i d ue −P−A−B) / weight test por t ion] × 100 where weight res i d ue = av e r a ge of weights (mg) for du p li c ate blank de t er m i n a t ions; and P and A = weights (mg) of pro t ein and ash, re s pec t ively, in first and sec o nd test por t ion res i d ues; and weight test por t ion = av e r a ge of 2 test por t ion weights (mg) taken.Ref er ences:JAOAC 68, 677(1985); 69, 259(1986).Re v ised: June 2003* Adopted as a Co d ex De f ining Method for gravimetry/en z y m atic di g est of to t al di e tary fi b re in spe c ial foods.© 2005 AOAC IN T ER N A T IONAL。
关于AOAC简介

AOAC婴幼儿食品营养素检测 国际标准研讨会
受国际配方食品咨询委员会委托,AOAC(国际官定分析检测协会) 计划在今后 两年半时间内,对婴幼儿配方食品及成人营养品中优先考虑的至少20种营养素制 定AOAC国际标准。为此,在2010年9月和11月,AOAC分别举行了两次SPIFAN会议 (Stakeholder Panel on Infant Formula and Adult Nutritional),讨论了最 初的五个营养素检测方法,并指定了标准主持实验室和协同验证实验室。为推动 中国对婴幼儿食品营养检测国家标准的制修订能力建设,部分中国专家和企业代 表赴美国参加了工作会议。
分部是由AOAC总部批准成立的专门设在中国的分部组织, 旨在帮助来自分析化学、微生物及其他专业领域的中国会员更 多地了解AOAC;积极参加AOAC的各项活动;协助AOAC总部联系 中国会员;组织各项专业培训及教育活动等。
AOAC Official Methods SM
AOAC 逐步认可新的检测技术作为官方方法,如 LC-MS(液 质联用技术) 和 SPR(表面等离子共振技术)。 2007-至今,SPADA (PCR 检测微生物会议)
液相色谱-质谱联用仪:它结合了液相色谱仪有效分离热不稳性及高沸点 化合物的分离能力与质谱仪很强的组分鉴定能力。是一种分离分析复杂有 机混合物的有效手段。实现对复杂混合物更准确的定量和定性分析。而且 也简化了样品的前处理过程,使样品分析更简便。
质谱仪由以下几部分组成
数据控制和采集及供电系统 ┏━━━━┳━━━━━╋━━━━━━┓ 进样系统 离子源 质量分析器 检测接收器
于250 mL三角瓶中,固体试样需用约50 mL 45 ℃~50 ℃水使其溶解,加 入维生素D3内标1 mL(1 ug/mL) ,混合均匀。
膳食纤维 标准方法

膳食纤维标准方法
膳食纤维是指人体无法消化吸收的碳水化合物类物质。
膳食纤维对人体健康具有重要的作用,包括促进消化系统健康、调节血糖和胆固醇水平、预防便秘以及控制体重等。
为了准确测量食物中的膳食纤维含量,需要进行标准方法的测定。
目前,国际通用的膳食纤维含量测定方法有两种:AOAC (Association of Official Analytical Chemists)方法和ISO (International Organization for Standardization)方法。
1. AOAC方法:AOAC方法是美国官方方法,也是国际上最常用的方法。
根据AOAC 991.43或AOAC 985.29方法,首先将食物样品经过一系列处理,如酶解、水解等,获得可溶性和不可溶性纤维。
然后,借助酶解、滴定、重量等技术手段,可以得到总纤维、不可溶性纤维和可溶性纤维的含量。
2. ISO方法:ISO方法是由国际标准化组织制定的方法,与AOAC方法相似。
ISO 13904和ISO 15954方法是常用的ISO 方法。
这些方法主要利用酶解、水解、甲弹法等技术,将膳食纤维分为不可溶性纤维和可溶性纤维,并使用滴定、重量等手段进行测定。
无论使用AOAC方法还是ISO方法,都需要进行样品的预处理、酶解、滴定等步骤,以获得准确的膳食纤维含量。
这些方法在实验室条件下进行,需要仪器设备和专业操作人员进行操作。
需要注意的是,虽然AOAC和ISO方法都是国际通用的标准方法,但在具体的实验操作过程中,可能会存在一些差异,因此在测定过程中应当依据相应的方法详细操作,并遵循实验室的操作规程。
AOAC985.29食物中总膳食纤维酶-重量法

AOAC985.29食物中总膳食纤维酶-重量法45.4.07AOAC Of f i c ial Method 985.29To t al Di e tary Fi b er in FoodsEnzymatic–Gravimetric MethodFirst Ac t ion 1985Fi nal Ac tion1986AOAC–AACC MethodCo d ex-Adopted–AOAC Method*A.Prin ci pleDu p li c ate test por t ions of dried foods, fat-extracted if con t ain i ng >10% fat, are gelatinized with Termamyl (heat-stable α-am y l ase), and then en z y m at i c ally di g ested with pro t e a se and amyloglucosidase to re m ove pro t ein and starch. (When an a l yz i ng mixed di e ts, al w ays ex t ract fat prior to de t er m in i ng to t al di e tary fi b er.) Four vol u mes of ethyl al c o h ol are added to pre c ip i t ate sol u b le di e tary fi b er. To t al res i d ue is fil t ered, washed with 78% ethyl al c o h ol, 95% ethyl al c o h ol, and ac e t one. Af t er dry i ng, res i d ue is weighed. One du p li c ate is an a l yzed for pro t ein, and other is in c in e r a ted at 525°C and ash is de t er m ined. To t al di e tary fi b er = weight res i d ue – weight (pro t ein + ash).B. Ap p a r a t us(a)Fritted cru c i b le.—Po r os i ty No. 2 (Py r ex No. 32940, coarse, ASTM 40-60 μm; or Corning No. 36060 Büchner, fritted disk, Py r ex, 60 mL, ASTM 40-60 μm). Clean thor o ughly, heat 1 h at 525°C, and soak and then rinse in H2O. Add ca 0.5 g Celite to air-dried cru c i b les and dry at 130°C to con s tant weight (≥ 1 h). Cool and store in des i c c a t or un t il used.(b) V ac u um source.—V ac u um pump or as p i r a t or equipped with in-line dou b le vac u um flask to pre v ent con t am i n a t ion in case of H2O backup.(c) Vac u um oven.—70°C.Al ter na tively,105°C air oven can be used.(d) Des ic ca tor.(e)Muf fle fur nace.(f)Wa t e r b a t h s.—(1)B o i l i n g.(2)C o n s t a n t tem p er a t ure.—Ad j ust a ble to 60°C, with ei t her multistation shaker or multistation mag n etic stir r er to pro v ide con s tant ag i t a t ion of di g es t ion flasks dur i ng en z y m atic hy d ro l y s is.(g) Beakers.—Tall-form, 400 or 600 mL.(h) Bal a nce.—An a lyt i cal,readability to0.1mg.(i)pH me t er.—Stan d ard i zed with pH 7 and pH 4 buff e rs.C. Re a gents(a) 95% Eth a n ol.—v/v. Technical grade.(b) 78% Eth a n ol.—Place 207 mL H2O into 1 L vol u m et r ic flask. Di l ute to vol u me with 95% ethyl al c o h ol. Mix and di l ute to vol u me again with 95% ethyl al c o h ol if nec e s s ary. Mix. One vol u me H2O mixed with 4 vol u mes 95% ethyl al c o h ol will also give 78% ethyl al c o h ol fi n al con c en t ra t ion.(c)Ac e tone.(d)Phos p hate buffer.—0.08M, pH 6.0. Dis s olve 1.400 g so d ium phos p hate dibasic, an h y d rous (Na2HPO4) (or 1.753 g dihydrate) and 9.68 g so d ium phos p hate monobasic monohydrate (NaH2PO4?H2O) (or 10.94 g dihydrate) in ca 700 mL H2O. Di l ute to 1 L with H2O. Check pH with pH me t er.(e) Al p ha-amylase (heat sta b le).—Termamyl. (1) Store in re frig er a tor.Based on Nel s on/Somogyi re d uc i ng sugar with sol u b le starch as sub s trate.—10 000 + 1000 units/mL (1 unitis de f ined as the amount of en z yme re q uired to re l ease 1 μmole re d uc i ng sugar equiv a l ents/min at pH 6.5 and 40°C).(2) Based on Ceralpha method us i ng p-nitrophenyl-maltosaccharide as sub s trate in the pres e nce of a thermostable al p ha-glucosidase.—3000 + 300 Ceralpha units/mL (1 unit of en z yme is re q uired to re l ease 1 μmole p-nitrophenyl/min at pH6.5 and 40°C).(f) Pro te ase.—Keep re frig er ated.(1)Ca sein as say.—300–400 Units/mL. (1 pro t e a se unit is de f ined as the amount of en z yme re q uired to hy d ro l yze (and solubilize in TCA) 1 μmole ty ro sine equiv a l ents/min from sol u b le ca s ein at pH 8.0 and 40°C); 7–15 units/mg (1 unit will hy d ro l yze ca s ein to pro d uce color equiv a l ent to 1.0 μmole ty r o s ine/min at pH 7.5 and 37°C). Color by Folin-Ciocalteau re a gent. (2) Azo-casein as s ay.—300–400 Units/mL [1 unit endo-peptidase ac t iv i ty is de f ined as the amount of en z yme re q uired to hy d ro l yze (and solubilize in TCA) 1 μmole ty r o s ine equiv a l ents/min from sol u b le ca s ein at pH 8.0 and 40°C].(g) Amyloglucosidase.—Keep re frig er ated.(1)Starch/glu c ose oxidase–peroxidase method.—2000–3300 Units/mL (1 unit en z yme ac t iv i ty is de f ined as the amount of en z yme re q uired to re lease1μmole glu c ose/min at pH 4.5 and 40°C). (2) PNPBM (p-nitrophenyl beta-maltosidase) method.—130–200 Units/mL (1 unit en z yme ac t iv i ty [PNP unit] is the amount of en z yme, which in the pres e nce of ex c ess lev e ls of beta-gl ucosidase, will re l ease 1 μmole p-nitrophenyl from p-nitrophenyl beta-maltosidase/min at 40°C).The only en z yme which has been found to be sig n if i c antly con tam i nated with in ter fer ing ac tiv i ties is amyloglucosidase. Thermostable al p ha-amylase and pro t e a sefrom com m er c ial sources have been found to be gen e r a lly free of in t er f er i ng en z ymes. Low lev e ls of beta-glucanase have been de t ected in pro t e a se prep a r a t ions, but at lev e ls well be l ow that which would in t er f ere with to tal di etary fi ber anal y sis.The ma jor con tam i nant in amyloglucosidase prep a r a t ion was shown to be an endo-cellulase and re s ulted in endo-depolymerization of mixed-linkage beta-glucan from bar l ey and oats, with re s ul t ant un d er e s t i m a t ion of this di etary fi ber com po nent.The con tam i na tion of amylogucosidase with endo-cellulase (beta-glucanase) can be eas ily de tected.Al t er n a t ively, there are kits con t ain i ng all 3 en z ymes (pre t ested) avail a ble from a num b er of com p a n ies.(h)So dium hy drox ide so lu tion.—0.275M. Dis s olve 11.00 g NaOH ACS in ca 700 mL H2O in 1 L vol u m et r ic flask. Di l ute to vol u me with H2O.(i) Hy d ro c hlo r ic acid so l u t ion.—0.325M. Di l ute stock so l u t ion of known ti t er, e.g., 325 mL 1M HCl, to 1 L with H2O.(j) Celite.—Acid-washed.2005 AOAC IN T ER N A T IONAL Ta b le 985.29. Test sam p les for en z yme pu r ityTest sam p leAc tiv itytestedTest por t ionweight, gEx pectedre cov ery,% Cit rus pec tin Pectinase0.195–100 Stractan (larch gum)Hemicellulase0.195–100 Wheat starch Am y lase 1.00–1Corn starch Am y lase 1.00–2Ca sein Pro te ase0.30–2β-Glucan (bar l ey gum)aβ-Glucanase0.195–100aSigma Chem i c al Co. or Megazyme In t er n a t ional Ire l and, Ltd.D.En zyme Pu rityTo en sure ab sence of un de sir able en zy matic ac tiv ity in en zymes used in this pro c e d ure, run ma t e r i a ls listed in Ta b le 985.29 through en t ire pro c e d ure each time lot of en z ymes is changed, or at max i m um in t er v al of 6 months to en s ure that en z ymes have not de g raded.E. Test Por t ion Prep a r a t ionDe t er m ine to t al di e tary fi b er on dried test sam p le. Ho m og e n ize test sam p le and dry over n ight in 70°C vac u um oven, cool in des i c c a t or, and dry-mill test sam p le to 0.3–0.5 mm mesh. If test sam p le can n ot be heated, freeze-dry be f ore mill i ng. If high fat con t ent (>10%) pre v ents proper mill i ng, defat with pe t ro l eum ether (3 times with 25 mL por t ions/g test sam p le) be f ore mill i ng. Re c ord loss of weight due to fat re m oval and make ap p ro p ri a te cor r ec t ion to fi n al % di e tary fi b er found in de t er m i n a t ion. Store dry-milled test sam p le in capped jar in des i c c a t or un t il anal y s is is car r ied out.F.De ter mi na tionRun blank through en t ire pro c e d ure along with test por t ions to mea s ure any con t ri b u t ion from re a gents to res i d ue.Weigh du p li c ate 1 g test por t ions, ac c u r ate to 0.1 mg, into 400 mL tall-form beak e rs. Test por t ion weights should notdif f er >20 mg. Add 50 mL pH 6.0 phos p hate buffer to each beaker. Check pH and ad j ust to pH 6.0 ± 0.2 if nec e s s ary. Add 0.1 mL Termamyl so l u t ion. Cover beaker with Al foil and place in boil i ng water bath 15 min. Shake gently at 5 min in t er v als. In c rease in c u b a t ion time when num b er of beak e rs in boil i ng water bath makes it dif f i c ult for beaker con tents to reach in ter nal tem per a ture of95°–100°C. Use ther mom e ter to in di cate that 15 min at 95°–100°C is at t ained. To t al of 30 min in water bath should be suf f i c ient.Cool so l u t ions to room tem p er a t ure. Ad j ust to pH 7.5 ± 0.2 by add i ng 10 mL 0.275M NaOH so l u t ion.Add 5 mg pro t e a se. (Pro t e a se sticks to spat u la, so it may be pref e r a b le to pre p are en z yme so l u t ion (50 mg in1 mL phosphate buffer) and pipet 0.1 mL to each sam p le just bef ore use.Cover beaker with Al foil. In c u b ate 30 min at 60°C with con t in u o us ag i t a t ion. Cool. Add 10 mL 0.325M HCl so l u t ion. Mea s ure pH and dropwise add acid if nec e s s ary. Fi n al pH should be 4.0–4.6. Add 0.3 mL amyloglucosidase, cover with Al foil, and in c u b ate 30 min at 60°C with con t in u ous ag i ta tion.Add280mL 95% ethyl al c o h ol pre h eated to 60°C (mea s ure vol u me be f ore heat i ng). Let pre c ip i t ate form at room tem p er a t ure for 60 min. Weigh cru c i b le con t ain i ng Celite to near e st 0.1 mg, then wet and re d is t rib u te bed of Celite in cru c i b le by us i ng stream of 78% ethyl al c o h ol from wash bot t le. Ap p ly suc t ion to draw Celite onto fritted glass as even mat. Main t ain suc t ion and quan t i t a t ively trans f er pre cip i tate from en zyme di gest to cru ci ble.Wash res i d ue suc c es s ively with three 20 mL por t ions of 78% ethyl al c o h ol, two 10 mL por t ions of 95% ethyl al c o hol, and two 10 mL por t ions of ac e t one. Gum may form with some prod u cts, trap p ing liq u id. If so, break sur f ace film with spat u la to im p rove fil t ra t ion. Time for fil t ra t ion and wash i ng will vary from 0.1 to 6 h, av e r a g i ng 0.5 h per sam p le. Long fil t ra t ion times can be avoided by care ful in ter mit tent suc tion through out fil tra tion.Dry cru c i b le con t ain i ng res i d ue over n ight in 70°C vac u um oven or 105°C air oven. Cool in des i c c a t or and weigh to near e st 0.1 mg. Sub t ract cru c i b le and Celite weight to de t er m ine weight of res i d ue. An a l yze res i d ue from 1 test por t ion of set of du p li c ates for pro t ein by 960.52 (see 12.1.07), us i ng N × 6.25 as con v er s ion fac t or, ex c ept in cases where N con t ent in pro t ein is known.In c in e r a te sec o nd test por t ion of du p li c ate 5 h at 525°C. Cool in des i c c a t or and weigh to near e st 0.1 mg. Sub t ract cru c i b le and Celite weight to de t er m ine ash.G.Cal cu la tionsDe t er m i n a t ion of blank:B = blank, mg = weight res i d ue ? P B?A Bwhere weight res i d ue = av e r a ge of res i d ue weights (mg) for du p li c ate blank de t er m i n a t ions; and P B and A B = weights (mg) of pro t ein and ash, re s pec t ively, de t er m ined in first and sec o nd blank res i d ues.Cal c u l ate TDF as fol l ows:TDF, % =[(weight res i d ue ?P?A?B) / weight test por t ion] × 100 where weight res i d ue = av e r a ge of weights (mg) for du p li c ate blank de t er m i n a t ions; and P and A = weights (mg) of pro t ein and ash, re s pec t ively, in first and sec o nd test por t ion res i d ues; and weight test por t ion = av e r a ge of 2 testpor t ion weights (mg) taken.Ref er ences:JAOAC 68, 677(1985); 69, 259(1986).Re v ised: June 2003* Adopted as a Co d ex De f ining Method for gravimetry/en z y m atic di g est of to t al di e tary fi b re in spe c ial foods.2005 AOAC IN T ER N A T IONAL。
总膳食纤维国标测定方法-符合AOAC等

总膳食纤维测定的介绍1、在α-淀粉酶的作用下,PH为6的磷酸盐缓冲溶液,95—100度下加热15分钟。
2、用蛋白酶在PH为7.5时60度培养30分钟。
3、用淀粉葡(萄)糖苷酶在PH为4.0---4.6下60度培养30分钟。
4、4体积的95%的乙醇沉淀。
5、过滤。
6、用78%和95%的乙醇和丙酮清洗沉淀物。
7、烘干称重。
8、干样可以拿去做凯氏定氮,也可以在525度的马弗炉里灰份5个小时,然后去称重。
不溶的膳食纤维的定义为进行烘干前用乙醇进行清洗并用温水洗涤后残留物。
总膳食纤维(TDF)—不溶膳食纤维= 可溶膳食纤维(SDF)标准酶法测定食品和饲料中的总膳食纤维量1、研磨分级样品2、在105度的烘箱烘干并恒重,在干燥箱中冷却到室温。
3、如果样品脂肪含量高于10%,需要用石油醚进行脱脂,在最终结果中再进行校正。
4、称出0.5—1克的样品,并转移到400毫升的烧杯中。
5、用α-淀粉酶在50毫升的PH为6的磷酸盐缓冲溶液中培养15分钟,培养温度为95—100度,温度可以用温度计控制。
6、冷却到室温,并用0.275 N 浓度的氢氧化钠溶液调节PH到7.5。
7、将烧杯和样品一起转移到磁力搅拌培养器中(GDE)。
8、在搅拌的情况下,加入蛋白酶在60度的情况下培养30分钟。
9、冷却到室温,用0.325的盐酸调节PH值为4.0—4.6。
10、在搅拌的情况下,加淀粉葡(萄)糖苷酶,在60度时培养30分钟。
11、通过加4体积的95%的乙醇沉淀可溶性膳食纤维,并且在室温下沉淀大约1个小时。
12、称量已经添加了0.5克的硅藻土(作为助滤剂)玻璃坩埚.13、将坩埚放在CSF6 (或者FIWE6)上,倒入上述操作的沉淀物,并用V ACUUM进行吸液排空,用78%的乙醇溶液进行洗涤转移沉淀物。
14、用20毫升的78%的乙醇溶液洗涤玻璃坩埚中的沉淀物两次,再用10毫升95%的乙醇溶液洗涤两次,10毫升的丙酮溶液洗涤两次并排除废液。
酶法测定膳食纤维的推荐方法1

酶-重量法(百度文库方法) 1.原理:样品分别用α-淀粉酶、蛋白酶、葡萄糖苷酶进行酶解消化以去除蛋白质和可消化的淀粉。
总膳食纤维(TDF)是先酶解,然后用乙醇沉淀,再将沉淀物过滤,将TDF残渣用乙醇和丙酮冲洗,干燥称重。
不溶性和可溶性膳食纤维(IDF和SDF)是酶解后将IDF过滤,过滤后的残渣用热水冲洗,经干燥后称重。
SDF是将上述滤出液用4倍量的95%乙醇沉淀,然后再过滤,干燥,称重。
TDF、IDF和SDF量通过蛋白质、灰分含量进行校正。
2.适用范围AOAC991.43 本方法适用于各类植物性食物和保健食品。
3.仪器 3.1烧杯:400或600ml高脚型。
3.2 过滤用坩埚:玻料滤板,美国试验和材料学会(ASTM)40-60μm,Pyrex 60ml(Corning No.36060 buchner,或同等的)。
如下处理:(1)在灰化炉525℃灰化过夜。
炉温降至130℃以下取出坩埚。
(2)用真空装置移出硅藻土和灰质。
(3)室温下用2%清洗溶液浸泡1小时。
(4)用水和去离子水冲洗坩埚;然后用15ml丙酮冲洗然后风干。
(5)在干燥的坩埚中加0.5g硅藻土,在130℃烘干恒重。
(6)在干燥器中冷却1小时,记录坩埚加硅藻土重量,精确至0.1mg。
3.3 真空装置:(1)真空泵或抽气机作为控制装置。
(2)1L的厚壁抽滤瓶。
(3)与抽滤瓶相配套的橡皮圈。
3.4振荡水浴箱:(1)自动控温使温度能保持在98±2℃。
(2)恒温控制在60℃。
3.5 天平:分析级,精确至±0.1mg。
3.6马福炉:温度控制在525±5℃。
3.7干燥箱:温度控制在105和130±3℃。
3.8干燥器:用二氧化硅或同等的干燥剂。
干燥剂两周一次在130℃烘干过夜。
3.9 PH计:注意温控,用pH4.0、7.0和10.0缓冲液标化。
3.10 移液管及套头:容量100μl和5ml。
3.11 分配器或量筒:(1)15±0.5ml,供分配78%的乙醇,95%的乙醇以及丙酮。
膳食纤维的测定

“粗纤维”一词最早用于营养学研究;并被认为是对人体不起营养作用的一种非营养成分..然而近年来分析技术的发展和对这种“非营养素”认识的提高;“粗纤维”也被“膳食纤维”所替代;而且赋予更丰富的内容..膳食纤维大致分为二类;一类为可溶性的;一类为不可溶性的;二者合并即为总的膳食纤维..它主要包括植物细胞壁的成分如纤维素、半纤维素、果胶、木质素、角质和二氧化硅等成分;最早曾有中型洗涤剂法和酸性洗涤剂法等;测定结果常不能包括全部..本章所介绍的Englist建立的、AOAC推荐的方法..它主要测定为可溶性的膳食纤维、不可溶性膳食纤维和总膳食纤维三种..膳食纤维实际上属于碳水化合物的范畴..膳食纤维的物化特性主要包括5个方面:1很高的持水力..2对阳离子有结合和交换能力..3对有机化合物有吸附螯合作用..4具有类似填充剂的充盈作用..5可改变肠道系统中的微生物群系组成..膳食纤维的测定方法主要有三种;包括非酶-重量法、酶重量法和酶化学法..非酶重量法是一个比较古老的方法;只能用于粗纤维的测定..而中性洗涤剂法也只能测定不溶性的膳食纤维..酶重量法却可以测定总膳食纤维包括可溶和不可溶性膳食纤维;也是AOAC的标准方法..酶化学法是AOAC最新承认的另一个标准方法;但此法易受仪器条件的限制;不适用于普通实验室..目前国标采用的还是中性洗涤剂法;食物成分表中列出的数据都是不溶性膳食纤维;所以下文先介绍不溶性膳食纤维的测定方法..一中性洗涤剂法1. 原理在中性洗涤剂的消化作用下;样品中的糖、淀粉、蛋白质、果胶等物质被溶解除去;不能消化的残渣为不溶性膳食纤维;主要包括纤维素、半纤维素、木质素、角质和二氧化硅等;并包括不溶性灰分..2. 适用范围GB 12394—90适用于各类植物性食物和含有植物性食物的混合食物中不溶性膳食纤维的测定..3. 仪器1烘箱:110~130℃..2恒温箱:37±2℃..3纤维测定仪..4如没有纤维测定仪;可由下列部件组成:电热板:带控温装置..高型无嘴烧杯:600mL..玻料坩埚:容量50mL;孔径40~60μm..回流冷凝装置..抽滤装置:由抽滤瓶、抽滤垫及水泵组成..4. 试剂实验用水均为蒸馏水;试剂不加说明均为分析纯试剂..1无水亚硫酸钠..2石油醚:沸程30~60℃..3丙酮..4甲苯..5中性洗涤剂溶液:将18.61gEDTA二钠盐和6.81g+水合四硼酸钠置于烧杯中;加水约150mL;加热使之溶解;将30g月桂基硫酸钠和10mL乙二醇独乙醚溶于约700mL热水中;合并上述两液;再将4.56g无水磷酸氢二钠溶于150mL热水中;再并入上述溶液中;用磷酸调节上述混合液至pH6.9~7.1;最后加水至1000mL..6磷酸盐缓冲液:由38.7mL 0.1mol/L磷酸氢二钠和61.3mL 0.1mol/L 磷酸二氢钠混合而成;pH为7..72.5%α—淀粉酶溶液:称取2.5gα—淀粉酶Sigma公司;VI-A型;产品号6880溶于100mLpH7的磷酸盐缓冲溶液中;离心;过滤;滤过的酶液备用..8耐热玻璃棉:耐热130℃;美国Corning玻璃厂出品;PYREX牌..5. 操作步骤1样品制备:① 粮食:磨粉;过20目筛1mm;贮于塑料瓶内;盖紧瓶塞保存;备用..② 蔬菜及其他植物性食物:取其可食部;用水洗净;纱布吸去水分;打碎;沸合均匀后备用..③ 脂肪含量超过10%样品:需先去除脂肪;即样品1.00g;用石油醚提取3次;每次10mL..2取样0.5~1.0g;加100mL中性洗涤剂溶液;再加0.5g无水硫酸钠..3电炉加热;5min内使其煮沸;移至电热板上;保持微沸1h..4于玻料坩埚中铺1g玻璃棉;移至烘箱中;110℃4h;取出置干燥器中;晾至室温;万分之一天平称重;得m1..5将煮沸后样品趁热倒入滤器;用水泵抽滤..用600mL热水90~100℃;分数次洗烧杯及滤器;抽干..洗净滤器下部的液体和泡沫;塞上橡皮塞..6于滤器中加酶液;液面需覆盖纤维;用细针挤压掉其中气泡;加几滴甲苯;盖上表玻皿;37℃恒温箱中过夜..7取出滤器;除去底部塞子;抽去酶液;并用300mL热水分数次洗去残留酶液;用碘液检查;如有残留;继续加酶水解;如淀粉已除尽;抽干;再以丙酮洗2次..8将滤器置烘箱中;110℃4h;取出;置干燥器中;晾至室温;精确称重;得m2..6. 计算式中ω——样品中不溶性膳食纤维的含量;%;m1——滤器加玻璃棉的质量;g;m2——滤器加玻璃棉及样品中纤维的质量;g;m——样品质量;g..7. 注意事项1因酶配成溶液后其活力会随时间延长而下降;从而影响酶解效力;所以酶溶液需当天现配..2过滤时若遇到操作困难;可采取滴加淀粉酶和将样品称重减少至0.3g的方法来加快过滤..3每次实验用完的坩埚去除玻璃棉;若玻板上残渣较多;可用重铬酸钾洗液浸泡数小时后取出;用水冲洗干净以备下次实验使用..二酶-重量法1. 原理样品分别用α-淀粉酶、蛋白酶、葡萄糖苷酶进行酶解消化以去除蛋白质和可消化的淀粉..总膳食纤维TDF是先酶解;然后用乙醇沉淀;再将沉淀物过滤;将TDF残渣用乙醇和丙酮冲洗;干燥称重..不溶性和可溶性膳食纤维IDF和SDF是酶解后将IDF过滤;过滤后的残渣用热水冲洗;经干燥后称重..SDF是将上述滤出液用4倍量的95%乙醇沉淀;然后再过滤;干燥;称重..TDF、IDF和SDF量通过蛋白质、灰分含量进行校正..2. 适用范围本方法适用于各类植物性食物和保健食品AOAC991.43..3. 仪器1烧杯:400mL或600mL高脚型..2过滤用坩埚:玻料滤板;美国试验和材料学会ASTM40~60μm;Pyrex 60mLCorning No.36060 buchner;或同等的..如下处理:① 在灰化炉525℃灰化过夜..炉温降至130℃以下取出坩埚..② 用真空装置移出硅藻土和灰质..③ 室温下用2%清洗溶液浸泡1h..④ 用水和去离子水冲洗坩埚;然后用15mL丙酮冲洗然后风干..⑤ 在干燥的坩埚中加0.5g硅藻土;在130℃烘干恒重..⑥ 在干燥器中冷却1h;记录坩埚加硅藻土质量;精确至0.1mg..3真空装置:① 真空泵或抽气机作为控制装置..② 1L的厚壁抽滤瓶..③ 与抽滤瓶相配套的桷皮圈..4振荡水浴箱:① 自动控温使温度能保持在98±2℃..② 恒温控制在60℃..5天平:分析级;精确到±0.1mg..6马福炉:温度控制在525±5℃..7干燥箱:温度控制在105℃和130±3℃..8干燥器:用二氧化硅或同等的干燥剂..干燥剂两周一次在130℃烘干过夜..9pH计:注意温控;用pH4.0、7.0和10.0缓冲液标化..10移液管及套头:容量100μL和5mL..11分配器或量筒:①15±0.5mL;供分配78%的乙醇、95%的乙醇以及丙酮..②40±0.5mL;供分配缓冲液..12磁力搅拌器和搅拌棒..4. 试剂全过程使用去离子水;试剂不加说明均为分析纯度剂..1乙醇溶液:① 85%:加895mL95%乙醇在1L量筒中;用水稀释至刻度..② 78%:加821mL95%乙醇在1L量筒中;用水稀释至刻度..2丙酮..3供分析用酶:在0~5℃下贮存..① 热稳定α-淀粉酶溶液:Cat. No. A3306;Sigma Chemical Co.;St.Louis;MO63178;或Termamyl 300L;Cat. No. 361-6282;Novo-Nordisk;Bagsvaerd;Denmark;或等效的酶..② 蛋白酶:Cat. No. P3910;Sigma Chemical Co.;或等效的..当天用MES/TRIS缓冲液中现配50mg/mL酶溶液..③ 淀粉葡糖苷酶溶液:Cat. No. AMG A9913;Sigma Chemical Co.;或等效的..4硅藻土:酸洗Celite 545 AW;No. C8656;Sigma Chemical Co.;或等效的..5洗涤液:两者挑一..① 铬酸:120g重铬酸钠Na2Cr2O7·2H2O;1000mL蒸馏水和1600mL浓硫酸..② 实验室用液体清洁剂;预备急需清洗的Micro;International Products Corp.;Trenton;NJ08016;或等效的..用水配制2%溶液..6MES-TRIS缓冲液:0.05mol/L;温度在24℃时pH为8.2..① MES:2-N-吗啉代磺酸基乙烷No.M-8250;Singma Chemical Co.或等效的..② TRIS:三羟羟甲基氨基甲烷No.T-1503;Sigma Chemical Co.或等效的..在1.7L的蒸馏水中溶解19.52gMES和12.2gTRIS;用6mol/L NaOH调pH到8.2;用水定容至2L注意:24℃时的pH为8.2;但是;如果缓冲液温度在20℃;pH就为8.3;如果温度在28℃;pH为8.1..为了使温度在20~28℃之间;需根据温度调整pH..7HCl溶液:0.561mol/L;加93.5mL 6mol/L盐酸到700mL水中;用水定容1L..5. 操作方法1样品制备:① 固体样品:如果样品粒度>0.5mm;研磨后过0.3~0.5mm40~60目筛..② 高脂肪样品:如果脂肪含量>10%;用石油醚去脂..每克样品用25mL;每次提取完静置一会儿再小心将烧杯倾斜;慢慢将石油醚倒出;共洗3次..③ 高碳水化合物样品:如果样品干重含糖>50%;用85%乙醇去除糖分;每克样品每次10mL;共洗3次轻轻倒出;然后在40℃烘箱中不时翻搅干燥过夜;并研磨过0.5mm筛..2样品消化:① 准确称取双份1.000±0.005g样品m1和m2;置于高脚烧杯中..② 在每个烧杯中加入40mL MES-TRIS缓冲液;在磁力搅拌器上搅拌直到样品完全分散注意:防止团块形成;使受试物与酶能充分接触..③ 用热稳定的淀粉酶进行酶解处理:加100μL热稳定的淀粉酶溶液;低速搅拌..用铝箔片将烧杯盖住;在95~100℃水浴中反应30min注意:起始的水浴温度应达到95℃..④ 冷却:所有烧杯从水浴中移出;晾至60℃..打开铝箔盖;用刮勺将烧杯边缘的网状物以及烧杯底部的胶状物刮离;以使样品能够完全的酶解..用10mL蒸馏水冲洗烧杯壁和刮勺..⑤ 用蛋白酶进行酶解处理:在每个烧杯中各加入10μL蛋白酶溶液..用铝箔盖住;在60℃持续摇动反应30min注意:开始时的水浴温度应达60℃;使之充分反应..⑥ pH测定:30min后;打开铝箔盖;搅拌中加入5mL 0.561mol/L HCl 至烧杯中..60℃时用溶液或1mol/L HCl溶液调最终pH为4.0~4.7注意:当溶液为60℃时检测和调整pH;因为在较低温度时pH会偏高..⑦ 用淀粉葡糖苷酶溶液酶解处理:搅拌同时加100μL淀粉葡糖苷酶溶液..用铝箔盖住;在60℃持续振摇反应30min;温度应恒定在60℃..3测定:① 总的膳食纤维测定:用乙醇沉淀膳食纤维:在每份样品中;加入预热至60℃的95%乙醇225mL;乙醇与样品的体积比为4:1..室温下沉淀1h..过滤装置:用15mL78%乙醇将硅藻土湿润和重新分布在已称重的坩埚中..用适度的抽力把坩埚中的硅藻土吸到玻板上..酶解过滤;用78%乙醇和刮勺移所有内容物微粒到坩埚中注意:如果一些样品形成胶质;用刮勺破坏表面;以加速过滤..抽真空;分别用15mL的78%乙醇;95%乙醇和丙酮冲洗残渣各2次;将坩埚内的残渣抽干后在105℃烘干过夜..将坩埚置干燥器中冷却至室温..坩埚重量;包括膳食纤维残渣和硅藻土;精确称至0.1mg..减去坩埚和硅藻土的干重;计算残渣重..② 蛋白质和灰分的测定:取成对的样品中的一份测定蛋白质;用本书前述或GB-960.52方法测定..用N×6.25作为蛋白质的转换系数..分析灰分时用平行样的第二份在525℃灼烧5h;在干燥器中冷却;精确称至0.1mg;减去坩埚和硅藻土的质量;即为灰分质量..③ 不溶性膳食纤维测定:称适量样品按②进行酶解;过滤前用3mL水湿润和重新分布硅藻土在预先处理好的坩埚上;保持抽气使坩埚中的硅藻土抽成均匀的一层..过滤并冲洗烧杯;用10mL70℃水洗残渣2次;然后再过滤并用水洗;转移到600mL高脚烧杯;保留用以测定可溶性膳食纤维;按④操作..用抽滤装置;分别用15mL78%乙醇;95%乙醇和丙酮各冲洗残渣2次..注意:应及时用78%乙醇、95%乙醇和丙酮冲洗残渣否则可造成不溶性膳食纤维数值的增大按②用双份样品测定蛋白质和灰分..④ 可溶性膳食纤维测定:将不溶性膳食纤维过滤后的滤液收集到600mL高脚烧杯中;对比烧杯和滤过液;估计体积..加约滤出液4倍量已预热至60℃的95%乙醇..或者将滤液和洗过残渣的蒸馏水的混合液调至80g;再加入预热至60℃的95%乙醇320mL..室温下沉淀1h..下面按②测定总膳食纤维;从“湿润和重新分布硅藻土……”..6. 计算TDF、IDF、SDF均用同一公式计算..膳食纤维DF;g/100g测定:式中 m5、m6——双份样品残留物质质量;mg;m3、m4——分别为蛋白质和灰分质量;mg;m1、m2——样品质量;mg..。
利用酶法制备食品中的膳食纤维

利用酶法制备食品中的膳食纤维Title: 酶法制备食品中的膳食纤维Abstract:本论文主要研究了利用酶法制备食品中的膳食纤维的方法和应用。
膳食纤维是食品中一类重要的生物活性物质,对人体健康有着重要的作用。
酶法制备膳食纤维相比传统方法更为高效、环境友好,具有广阔的应用前景。
本文首先介绍了膳食纤维的定义、分类和功能,重点讨论了酶法制备膳食纤维的原理和方法,包括酶种的选择、工艺条件的优化等。
然后,综述了酶法制备膳食纤维在食品加工中的应用,包括提高食品质量和改善食品口感等方面。
最后,展望了酶法制备膳食纤维的研究前景和挑战,提出了未来的研究方向。
通过本文的研究,有望推动酶法制备膳食纤维技术在食品工业中的广泛应用,从而改善人们的饮食结构,促进健康生活。
Keywords: 酶法,膳食纤维,食品加工,食品质量,食品口感1. 引言随着人们生活水平的提高和食物消费结构的转变,膳食纤维的重要性受到了越来越多人的关注。
膳食纤维是指在人体中不被消化吸收的多种多样的碳水化合物,主要来源于植物,包括大量的纤维素、半纤维素、可溶性纤维素等。
膳食纤维对人体健康有着重要的作用,如调节血糖、降低胆固醇、促进肠道蠕动等。
然而,传统的膳食纤维制备方法存在效率低、成本高以及对环境的污染等问题。
酶法是一种新型的制备膳食纤维的方法,具有高效、环境友好等优点。
酶法制备膳食纤维是利用特定的酶作用于原料中的多糖,使其发生酶解、水解、结构改性等反应,从而得到具有生理功能和应用价值的膳食纤维。
本论文旨在综述酶法制备膳食纤维的方法和应用,以期为食品工业的发展提供理论和应用基础。
2. 膳食纤维的定义和分类2.1 膳食纤维的定义膳食纤维是指在人体中无法被消化吸收,但对人体健康有着重要作用的一类碳水化合物。
它主要存在于植物食品中,如谷物、蔬菜、水果等。
膳食纤维是一种非营养物质,但其对人体健康有着重要的影响。
2.2 膳食纤维的分类根据其性质和结构,膳食纤维可以分为不同的类别。
膳食纤维的测定方法

膳食纤维的测定方法作者:赵升鹏周超进来源:《都市家教·上半月》2013年第05期【摘要】膳食纤维被称为人体的第七营养素,对维持人体健康具有重要作用。
膳食纤维通过发酵产物短链脂肪酸和对肠道菌群的调节作用从而影响肠道健康,本文对膳食纤维的测定方法进行了综述。
【关键词】膳食纤维;定义;测定膳食纤维已被确认为与传统的六大营养素并列的“第七营养素”,对维持人体健康具有重要的生理作用。
膳食纤维的理化特性概括起来是膨胀作用、持水能力、胶体形成、离子交换、改善胃肠微生物菌落和产生低热量等。
这些特性产生的生理作用如下:使人产生饱腹感并抑制进食,从而预防肥胖;润肠通便,防治肠道疾病和便秘;调控血清胆固醇,降血压,防治冠状动脉硬化,胆石症和预防心脑血管疾病;降血糖,防治糖尿病等。
目前,结肠癌、炎症性肠炎和其他结肠紊乱疾病已经严重影响身体健康。
膳食纤维为肠道微生物生长提供均衡的能量和营养,这是维持结肠生态系统平衡所必需的,另外,膳食纤维的发酵,特别是丁酸发酵,有利于结肠健康。
目前国内外业已研究开发的膳食纤维共有6大类约30余种,其中实际生产和应用的不超过10种。
一、膳食纤维膳食纤维(Dietary Fiber,DF)被认为是食物中不被人体胃肠道消化酶水解,但能被肠道微生物消化的物质,特别是植物成分。
膳食纤维包括非淀粉多糖,如纤维素、半纤维素、树胶、果胶,以及木质素、抗性糊精和抗性淀粉。
二、膳食纤维的测定世界卫生组织建议的总膳食纤维摄入量下限为每人每天27.0克,上限为每人每天40.0克。
由此可见:膳食纤维检测结果的表示及产品标签标示等方面的问题应该作为膳食纤维研究中的又一个重要方面,而检测结果是由膳食纤维的检测方法和检测标准决定的,因此有必要建立统一的检测方法和标准。
DF的不同测定方法因其测定原理不同结果差异较大。
自20世纪60年代初以来,分析化学家们建立起大量的检测方法,具有代表性的几种方法为非酶重量法、酶-重量和酶-化学法。
酶重量法测定食品中膳食纤维含量方法的改进

酶重量法测定⾷品中膳⾷纤维含量⽅法的改进分析检割————————————————7⽡五⿀⾯函⾯⼚—鲤酶重量法测定⾷品中膳⾷纤维含量汪红,祁⽟峰,魏红(河南省农科院农业质量标准与检测技术研究中⼼,河南郑州450002)摘要:对酶重量法测定⾷品中总膳⾷纤维、不溶性膳⾷纤维和可溶性膳⾷纤维含量的⽅法进⾏了改进,利⽤磷酸缓冲液取代了价格较⾼的MESI—TRIS缓冲液,并在过滤过程中采⽤热过滤法以加快过滤速度。
利⽤改进法对燕麦⽚和红枣粉为原料与传统测定⽅法进⾏了⽐较,结果表明,两种⽅法测定结果基本⼀致。
同时,对改进法在不同实验室进⾏了对⽐测定,发现该⽅法稳定性较好,可以代替传统的AOAC测定⽅法。
关键词:酶重量法,膳⾷纤维,测定,改进Abstract:Themethod0fthedeterminationoftotal,solubleandinsolubledietaryfiberinfoodsbyenzymatic—gravimetricwasimprovedwithphosphorusacidamortizeliquidreplacingcostlyMESI—TRISamortizeliquid,andusinghot-filtratingtoincreasethespeedinthefiltrationTheimprovedmethodwascomparedwithtraditionalAOACmethodinthetestingofoatmealandChinesedatepowderTheresultsshowedthattheresultsintestingbytwomethodsareverycloseThismethodwastestedindifferentlaboratories,theresultsindicatedthatthismethodhadagoodstability,canreplacethetraditionalAOACmethodKeywords:enzymatic—gravimetricmethod;dietaryfiber;determination;improvement中图分类号:TS201.2+3⽂献标识码:A⽂章编号:1002-0306(2007)09—0203—03膳⾷纤维被称为继淀粉、蛋⽩质、脂肪、维⽣素、矿物质和⽔之后的第七营养元素,它与⼈体的营养和健康有着密切的关系,因其具有较强的持油、持⽔、增溶和诱导有益微⽣物的作⽤⽽引起各国营养学家的关注。
检测膳食纤维的方法

检测膳食纤维的方法膳食纤维是指那些不能被人体的消化系统吸收和消化的多糖和木质素物质。
膳食纤维对于保持肠道健康和预防心血管疾病等具有重要作用。
因此,准确测定膳食纤维的含量对于我们了解食物的营养价值以及饮食指导至关重要。
以下将介绍几种常用的检测膳食纤维的方法。
一、重量法(Gravimetric Method)重量法是膳食纤维分析中最常用的方法之一。
其基本原理是通过将样品持续加热至高温,使样品中的有机物燃尽,进而得到膳食纤维的含量。
该方法的一个主要优点是可以同时测定膳食纤维的水溶性和不溶性部分。
二、酶解法(Enzymatic-Gravimetric Method)酶解法是一种常用的分析膳食纤维的方法。
该方法通过使用特定的消化酶来将非淀粉多糖和木质素水解为发酵产物,然后通过差异重量法测定发酵产物的重量来计算膳食纤维的含量。
酶解法具有准确、重复性好的特点,被广泛应用于食品分析实验室。
三、液相色谱法(Liquid Chromatography)液相色谱法是一种高效、准确的分析膳食纤维的方法之一。
该方法通过将样品溶解于适当的溶剂中并经过色谱柱分离,运用不同的检测器来检测膳食纤维的含量。
液相色谱法具有分离度高、准确性好以及可以获得更多关于多糖和木质素的组成信息的优点。
四、气相色谱法(Gas Chromatography)气相色谱法也是一种常用的分析膳食纤维的方法之一。
该方法通过将样品进行预处理,如提取和衍生化,然后通过气相色谱仪来分离和定量膳食纤维的成分。
气相色谱法主要适用于分析低分子量的挥发性膳食纤维成分。
五、光学显微镜法(Optical Microscopy)光学显微镜法是一种常用的视觉化分析膳食纤维的方法之一。
该方法通过显微镜观察样品中的颗粒形态和纹理来判断膳食纤维的含量。
光学显微镜法具有简便易行、成本低的优点,适用于快速初步判定膳食纤维含量。
需要指出的是,不同方法可能会对膳食纤维的不同成分产生不同的结果。
膳食纤维的测定

“粗纤维”一词最早用于营养学研究,并被认为是对人体不起营养作用的一种非营养成分。
然而近年来分析技术的发展和对这种“非营养素”认识的提高,“粗纤维”也被“膳食纤维”所替代,而且赋予更丰富的内容。
膳食纤维大致分为二类,一类为可溶性的,一类为不可溶性的,二者合并即为总的膳食纤维。
它主要包括植物细胞壁的成分如纤维素、半纤维素、果胶、木质素、角质和二氧化硅等成分,最早曾有中型洗涤剂法和酸性洗涤剂法等,测定结果常不能包括全部。
本章所介绍的Englist建立的、AOAC推荐的方法。
它主要测定为可溶性的膳食纤维、不可溶性膳食纤维和总膳食纤维三种。
膳食纤维实际上属于碳水化合物的范畴。
膳食纤维的物化特性主要包括5个方面:(1)很高的持水力。
(2)对阳离子有结合和交换能力。
(3)对有机化合物有吸附螯合作用。
(4)具有类似填充剂的充盈作用。
(5)可改变肠道系统中的微生物群系组成。
膳食纤维的测定方法主要有三种,包括非酶-重量法、酶重量法和酶化学法。
非酶重量法是一个比较古老的方法,只能用于粗纤维的测定。
而中性洗涤剂法也只能测定不溶性的膳食纤维。
酶重量法却可以测定总膳食纤维(包括可溶和不可溶性膳食纤维),也是AOAC的标准方法。
酶化学法是AOAC最新承认的另一个标准方法,但此法易受仪器条件的限制,不适用于普通实验室。
目前国标采用的还是中性洗涤剂法,食物成分表中列出的数据都是不溶性膳食纤维,所以下文先介绍不溶性膳食纤维的测定方法。
(一)中性洗涤剂法1. 原理在中性洗涤剂的消化作用下,样品中的糖、淀粉、蛋白质、果胶等物质被溶解除去,不能消化的残渣为不溶性膳食纤维,主要包括纤维素、半纤维素、木质素、角质和二氧化硅等,并包括不溶性灰分。
2. 适用范围GB 12394—90适用于各类植物性食物和含有植物性食物的混合食物中不溶性膳食纤维的测定。
3. 仪器(1)烘箱:110~130℃。
(2)恒温箱:(37±2)℃。
(3)纤维测定仪。
AOAC 993.19 可溶性膳食纤维测定
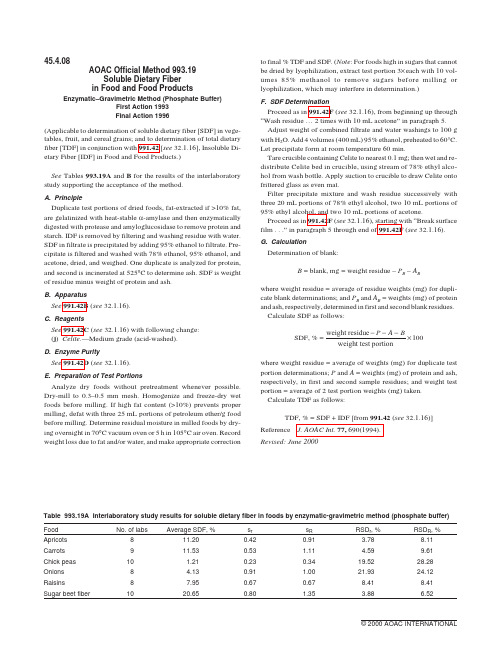
45.4.08AOAC Official Method993.19Soluble Dietary Fiberin Food and Food ProductsEnzymatic–Gravimetric Method(Phosphate Buffer)First Action1993Final Action1996(Applicable to determination of soluble dietary fiber[SDF]in vege-tables,fruit,and cereal grains;and to determination of total dietary fiber[TDF]in conjunction with991.42[see32.1.16],Insoluble Di-etary Fiber[IDF]in Food and Food Products.)See Tables993.19A and B for the results of the interlaboratory study supporting the acceptance of the method.A.PrincipleDuplicate test portions of dried foods,fat-extracted if>10%fat, are gelatinized with heat-stable a-amylase and then enzymatically digested with protease and amyloglucosidase to remove protein and starch.IDF is removed by filtering and washing residue with water. SDF in filtrate is precipitated by adding95%ethanol to filtrate.Pre-cipitate is filtered and washed with78%ethanol,95%ethanol,and acetone,dried,and weighed.One duplicate is analyzed for protein, and second is incinerated at525°C to determine ash.SDF is weight of residue minus weight of protein and ash.B.ApparatusSee991.42B(see32.1.16).C.ReagentsSee991.42C(see32.1.16)with following change:(j)Celite.—Medium grade(acid-washed).D.Enzyme PuritySee991.42D(see32.1.16).E.Preparation of Test PortionsAnalyze dry foods without pretreatment whenever possible. Dry-mill to0.3–0.5mm mesh.Homogenize and freeze-dry wet foods before milling.If high fat content(>10%)prevents proper milling,defat with three25mL portions of petroleum ether/g food before milling.Determine residual moisture in milled foods by dry-ing overnight in70°C vacuum oven or5h in105°C air oven.Record weight loss due to fat and/or water,and make appropriate correction to final%TDF and SDF.(Note:For foods high in sugars that cannot be dried by lyophilization,extract test portion3×each with10vol-umes85%methanol to remove sugars before milling or lyophilization,which may interfere in determination.)F.SDF DeterminationProceed as in991.42F(see32.1.16),from beginning up through “Wash residue…2times with10mL acetone”in paragraph5. Adjust weight of combined filtrate and water washings to100g with H2O.Add4volumes(400mL)95%ethanol,preheated to60°C. Let precipitate form at room temperature60min.Tare crucible containing Celite to nearest0.1mg;then wet and re-distribute Celite bed in crucible,using stream of78%ethyl alco-hol from wash bottle.Apply suction to crucible to draw Celite onto frittered glass as even mat.Filter precipitate mixture and wash residue successively with three20mL portions of78%ethyl alcohol,two10mL portions of 95%ethyl alcohol,and two10mL portions of acetone.Proceed as in991.42F(see32.1.16),starting with“Break surface film...”in paragraph5through end of991.42F(see32.1.16). G.CalculationDetermination of blank:B=blank,mg=weight residue–P B–A Bwhere weight residue=average of residue weights(mg)for dupli-cate blank determinations;and P B and A B=weights(mg)of protein and ash,respectively,determined in first and second blank residues. Calculate SDF as follows:SDF,%=weight residueweight test portion−−−P A B×100where weight residue=average of weights(mg)for duplicate test portion determinations;P and A=weights(mg)of protein and ash, respectively,in first and second sample residues;and weight test portion=average of2test portion weights(mg)taken. Calculate TDF as follows:TDF,%=SDF+IDF[from991.42(see32.1.16)] Reference J.AOAC Int.77,690(1994).Revised:June2000Table993.19A Interlaboratory study results for soluble dietary fiber in foods by enzymatic-gravimetric method(phosphate buffer) Food No.of labs Average SDF,%s r s R RSD r,%RSD R,% Apricots811.200.420.91 3.788.11 Carrots911.530.53 1.11 4.599.61 Chick peas10 1.210.230.3419.5228.28 Onions8 4.130.91 1.0021.9324.12 Raisins87.950.670.678.418.41 Sugar beet fiber1020.650.80 1.35 3.88 6.52Table993.19B Interlaboratory study results for total dietary fiber in foods by enzymatic-gravimetric method(phosphate buffer) Food No.of labs Average TDF,%s r s R RSD r,%RSD R,% Apricots1024.630.740.97 3.03 3.95 Carrots923.250.490.79 2.10 3.38 Chick peas1014.330.85 1.00 5.937.01 Onions916.130.95 1.02 5.88 6.33 Raisins1030.280.81 2.05 2.69 6.78 Sugar beet fiber1066.07 1.15 1.59 1.74 2.41。
总膳食纤维国标测定方法符合AOAC等

算计
。量重的下剩后量重的土藻硅和埚坩掉减量重总的步前是量重的份灰 ,)克毫 1.0 度精(重称却冷中箱燥干在,时小个 5 干烘中炉弗马的度 525 在样的物淀 沉个二第,�52.6*N�量含白蛋的化消能不析分法方氏凯用样的物淀沉个一中其 。 �样复重的要需�量重的土藻硅和量重的埚坩掉 减量重的终最是量重的物淀沉。克毫 1.0 为度精重称�温室到却冷�上晚个一干 烘起一土藻硅和物淀沉同连埚坩璃玻将�中箱空真的度 07�中箱烘的度 501 在 。时小个半要需程过洗清个整� �作操上器仪�面表吹来气空的微细用�态状体 液持保�降下力能滤过的使膜滤的状胶果如。次 2 涤洗液溶酮丙的升毫 01�次 2 涤洗液溶醇乙的%59 的升毫 01�次 3 物淀沉涤洗液溶醇乙的%87 的升毫 02 用 。集收行进管导用液出滤�物淀沉的完解消 酶移转斗漏用。空真用利�中器滤过的�6EWIF� 6FSC 在放并重称起一土藻硅 同 。克毫 1.0 度精,时小个一重恒中箱烘的度 031 在埚坩璃玻,土藻硅的克 5.0 加添 。干晾中气空在�洗清水用�温室到却冷�时小 1 干烘炉弗马的度 525 在放�埚坩璃玻的净干全完。钟分 06 降沉下温室在�度 06 热预醇乙的%59 的升毫 082 �子拌搅掉拿 。钟分 03 养培浴水度 06 下况情的拌 搅续连在箔铝上盖�液溶� 酶粉淀糖萄葡 �酶苷糖)萄(葡粉淀的升毫 003 加添 。值 HP 制控计 HP 用,6.4—0.4 到 HP 节调酸 盐的 N523.0 用�温室到却冷。钟分 03 养培时度 06 在下况情的拌搅续连箔滤上 盖杯烧.)中液冲缓盐酸磷升毫 1 在放克毫 05(液溶酶白蛋的升微 001 加,度 06 到 降度温将水冷加添中 EDG 向,5.7 到 HP 节调液溶钠化氧氢的 N572.0 的升毫 01 用 。温室到却冷�出移中浴水从后然�度温好制控�钟分 51 持保度 001—59 在持保度温品样让�中浴水的度 001 到放。箔铝上盖,合混底彻,液溶 酶粉淀-α的定稳热的生微 001 加,子拌搅力磁加,中液溶冲缓酸磷的 6 为 HP 升毫 05 到合混,中杯烧的升毫 004 在,克毫 1.0 到度精重称�品样克 1 将。响影的果结 对素因等剂试掉去以除扣中果结从要后最 �行进中程过验实个整在该应验实白空
食品中膳食纤维含量的测定与分析

食品中膳食纤维含量的测定与分析随着人们健康意识的提升,越来越多的人开始关注食物中的营养成分,其中膳食纤维作为一种重要的营养物质备受关注。
膳食纤维在维持肠道健康、调节血糖和血脂、预防肥胖等方面起着重要的作用。
那么,如何准确测定食品中的膳食纤维含量呢?一、测定方法目前常用的测定食品中膳食纤维含量的方法包括酶解-重量法(AOAC 985.29)和酶解-HPLC法(AOAC 991.43),其中HPLC法相对较为准确和简便。
在使用HPLC法测定膳食纤维含量时,通常采用两种酶解方法,即使用α-淀粉酶和葡萄糖酸酶进行酶解。
通过比较未酶解样品和酶解后样品中的膳食纤维含量,可以计算出样品中的膳食纤维含量。
二、食品中膳食纤维的分析1.粗纤维含量的分析粗纤维是指食物中不容易被消化吸收的纤维部分,一般包括纤维素、半纤维素和木质素等。
粗纤维含量的分析是衡量食品中纤维素含量的一种方法,一般通过水解和洗涤的方式来进行。
首先,将食品样品经过一定时间的水解,然后用水或酸进行洗涤,最后干燥并称重。
所得的质量差值即为粗纤维的含量。
2.溶解性膳食纤维含量的分析溶解性膳食纤维是指在水中可溶解的膳食纤维,如果胶、树胶等。
溶解性膳食纤维含量的分析主要通过酶解-过滤的方法进行。
首先,将食品样品经过一定时间的酶解,然后用滤液进行过滤,将溶解性膳食纤维从样品中分离出来。
最后,将滤渣干燥并称重,所得的质量差值即为溶解性膳食纤维的含量。
3.不溶性膳食纤维含量的分析不溶性膳食纤维是指在水中不溶解的膳食纤维,如纤维素、半纤维素等。
不溶性膳食纤维含量的分析主要通过酶解-过滤的方法进行。
首先,将食品样品经过一定时间的酶解,然后用滤液进行过滤,将溶解性膳食纤维从样品中分离出来。
将滤渣干燥并称重,所得的质量即为不溶性膳食纤维的含量。
三、膳食纤维含量的参考范围根据世界卫生组织的建议,成年人每天的膳食纤维摄入量应为25-30克。
然而,现代人的饮食结构大部分偏向高脂肪、高糖分的食物,膳食纤维的摄入量普遍不足。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酶法测定膳食纤维的推荐方法:
试剂:1. 0.1M PBS, PH=0.6.
2. 4M HCl ; 4M NaOH
3. 95%乙醇,78%乙醇
4. 丙酮
酶:淀粉酶,蛋白酶,胰酶
步骤:1. 湿样品需要均质并冻干,所有样品都需要粉碎至粒径0.3mm。
2. 当脂肪含量大于6-8%时或者需要适当粉碎时,需要在室温下用石油醚抽脂15min。
3. 称取1g样品,精确到0.1mg,转移至锥形瓶。
向其中加入25ml 0.1M的PBS,PH=6,充分悬浮样品。
4. 加入100ul 淀粉酶。
用膜盖住锥形瓶顶部,沸水浴保温15min,偶尔摇晃一下。
5. 室温下放凉,加入20ml蒸馏水,用HCL调至PH=1.5,用少量蒸馏水冲洗电极。
6. 加入100mg 胃蛋白酶,顶部盖膜,40℃保温并搅拌60min.
7. 加入20ml蒸馏水,用NaoH调PH至6.8,少许蒸馏水冲洗电极。
8. 加入100ml 胰酶,顶部盖膜,40℃保温并搅拌60min.
9. 用HCl调PH至4.5.
10. 用干燥的称量过的G2坩埚(含0.5g硅藻土)作为辅助过滤设施。
用20m蒸馏水分两次冲洗。
A. 滤液残留(不溶性膳食纤维):
11. 用20ml 95%乙醇和20ml 丙酮分两次冲洗。
12. 105℃干燥至恒重,干燥器内冷却后称重(D1)。
13. 550℃灰化5h,干燥器内冷却后称重(I1)
B.滤液(可溶性膳食纤维)
14. 将滤液可冲洗水合并定容至100ml.
15. 加入微热(60℃)的95%乙醇400ml,沉淀1h(时间可以缩短).
16. 用含有0.5g硅藻土的G2坩埚过滤。
17. 用20ml 78%乙醇、20ml 95%乙醇和20ml丙酮分别分两次冲洗。
18. 105℃烘至恒重,在干燥器内冷却后称重(D2)
19. 550℃至少灰化5h,干燥器内冷却后称重(I2)
空白:水溶性膳食纤维和不溶性膳食纤维空白值(B1和B2)的测定都是在没有添加样品的情况下进行。
使用新的一批酶时,应该不定时检查空白值。
计算:W=样品质量(g)。
D=干燥后的质量(g)。
I=灰化后的质量(g)。
B=无灰空白质量(g)
不溶性膳食纤维=D1-I1-B1。
