高中物理复习 气体状态方程
8.3 理想气体的状态方程

理想气体
假设这样一种气体在任何温度和任何压强下都能严格地遵 循气体实验定律,我们把这样的气体叫做“理想气体”。
理想气体的特点:
1.理想气体是不存在的,是一种理想模型 2.从微观上说:分子间忽略除碰撞外其他的作用力,忽略分子 自身的大小,分子本身没有体积 3.分子之间、分子与器壁之间的碰撞,都是弹性碰撞。除碰撞 以外,分子的运动是匀速直线运动,各个方向的运动机会均等. 4.理想气体分子之间无分子势能,一定质量的理想气体的内能 仅由温度决定,与气体的体积无关.
【变式】如图中,圆筒形容器内的弹簧下端挂一个不计重力的
活塞,活塞与筒壁间的摩擦不计,活塞上面为真空,当弹簧自
然长度时,活塞刚好能触及容器底部,如果在活塞下面充入t1 = 27 ℃的一定质量某种气体,则活塞下面气体的长度 h = 30 cm,问温度升高到t2=90 ℃ 时气柱的长度为多少?
解:
k Δx 1 p1 = S p2= k Δx 2 S p1V 1 p2V 2 = T1 T2
理想气体状态方程:
[例]内径均匀的L形直角细玻璃管,一端封闭,一端开口竖直 向上,用水银柱将一定质量空气封存在封闭端内,空气柱长4 cm,水银柱高58 cm,进入封闭端长2 cm,如图所示,温度是 87 ℃,大气压强为75 cmHg,求: (1)在图示位置空气柱的压强p1. (2)在图示位置,要使空气柱的长度变为3 cm,温度必须降低 到多少度?
理想气体
[例]关于理想气体的性质,下列说法中正确的是: A.理想气体是一种假想的物理模型,实际并不存在 B.理想气体的存在是一种人为规定,它是一种严格 遵守气体实验定律的气体 C.一定质量的理想气体,内能增大,其温度一定升 高
D.氦是液化温度最低的气体,任何情况下均可视为
高考物理混合气体的状态方程和典型题型

1T混合气体的状态方程和典型题型高中物理中常常涉及到气体混合、打气、抽气、漏气、气体分装等问题,对这类问题,大多数老师和 资料采用的是等效法——先将分离的不同部分气体看作是同一温度和压强的气体,用一定质量的理想气体 状态方程处理后,再一部分一部分的当做质量不变的理想气体分别处理。
这种思路一方面是比较绕,另一 方面是实际并不存在这样的中间过程,对于大部分同学而言,这种方法不大容易掌握。
其实,上述困境是老师教学过程中刻意回避或不熟悉混合气体的状态方程的结果,如果直接把混合气体的状态方程告知学生,不仅没有增加教学的难度,反而使得这一类混合气体的题目的处理变得简洁明了, 一个方程,一步,就可以搞定,何乐而不为?一、混合气体的状态方程 1、克拉珀龙方程将物质的量包含进理想气体状态方程,就是克拉珀龙方程:pV nRT 或pV nRT表达式中,n 为理想气体的物质的量,R 为普适气体常量。
所谓一定质量的理想气体,即物质的量 n 保持不变,所以有p 1V 1T 1p 2V 2nR ,这就是高中物理教材T 2呈现的一定质量的理想气体状态方程。
对 pVnRT 中的四个参量两两控制,则可得到理想气体的五个实验定律:①玻意耳定律:一定质量,一定温度,pV =C ; ②查理定律:一定质量,一定体积,p /T =C ;③盖-吕萨克定律:一定质量,一定压强,V /T =C ; ④阿伏伽德罗定律:等温等压气体混合,V ∝n ; ⑤道尔顿分压定律:等温等容气体混合,p i ∝n i 。
(混合气体的压强,等于各种气体单独产生压强的代数和,且各种气体单独产生的压强与该气体的物 质的量成正比。
p 1V n 1RT , p 2V n 2 RT , p 1V p 2V n 1RT n 2 RT , ( p 1 p 2 )V(n 1 n 2 )RT )2、混合气体状态方程将两种不同状态的气体混合在一起,对每一种气体,有p 1V 1n R ,p 2V 2 n R ,两式左右相加,得1T 2n R n R p 1V 1 p 2V 2 1 21 2 其中,等式的左边可以改写为n 1R n 2 R (n 1 n 2 )R nR ,即混合后的气体的物质的量乘以普适气体常量。
高中物理选修3-3第八章 3理想气体的状态方程

3 理想气体的状态方程[学科素养与目标要求]物理观念:1.了解理想气体的模型,并知道实际气体看成理想气体的条件.2.理解理想气体状态方程的内容和表达式.科学思维:1.掌握理想气体状态方程,知道其推导过程.2.能利用理想气体状态方程分析、解决实际问题.一、理想气体1.理想气体:在任何温度、任何压强下都遵从气体实验定律的气体. 2.理想气体与实际气体(1)实际气体在温度不低于零下几十摄氏度、压强不超过大气压的几倍时,可以当成理想气体来处理.(2)理想气体是对实际气体的一种科学抽象,就像质点、点电荷模型一样,是一种理想模型,实际并不存在. 二、理想气体的状态方程1.内容:一定质量的某种理想气体,在从一个状态(p 1、V 1、T 1)变化到另一个状态(p 2、V 2、T 2)时,尽管p 、V 、T 都可能改变,但是压强跟体积的乘积与热力学温度的比值保持不变. 2.表达式:p 1V 1T 1=p 2V 2T 2或pVT =C .3.成立条件:一定质量的理想气体.1.判断下列说法的正误.(1)理想气体在超低温和超高压时,气体的实验定律不适用了.( × )(2)能用气体实验定律来解决的问题不一定能用理想气体状态方程来求解.( × ) (3)对于不同的理想气体,其状态方程pVT=C (恒量)中的恒量C 相同.( × )(4)一定质量的理想气体温度和体积均增大到原来的2倍,压强增大到原来的4倍.( × ) 2.一定质量的某种理想气体的压强为p ,温度为27 ℃时,气体的密度为ρ,当气体的压强增为2p ,温度升为327 ℃时,气体的密度是________. 答案 ρ一、对理想气体的理解为什么要引入理想气体的概念?答案由于气体实验定律只在压强不太大,温度不太低的条件下理论结果与实验结果一致,为了使气体在任何温度、任何压强下都遵从气体实验定律,引入了理想气体的概念.理想气体的特点1.严格遵守气体实验定律及理想气体状态方程.2.理想气体分子本身的大小与分子间的距离相比可忽略不计,分子不占空间,可视为质点.3.理想气体分子除碰撞外,无相互作用的引力和斥力.4.理想气体分子无分子势能的变化,内能等于所有分子热运动的动能之和,只和温度有关.例1(多选)下列对理想气体的理解,正确的有()A.理想气体实际上并不存在,只是一种理想模型B.只要气体压强不是很高就可视为理想气体C.一定质量的某种理想气体的内能与温度、体积都有关D.在任何温度、任何压强下,理想气体都遵从气体实验定律答案AD解析理想气体是一种理想模型,温度不太低、压强不太大的实际气体可视为理想气体;理想气体在任何温度、任何压强下都遵从气体实验定律,选项A、D正确,选项B错误.一定质量的理想气体的内能只与温度有关,与体积无关,选项C错误.二、理想气体的状态方程如图所示,一定质量的某种理想气体从状态A到B经历了一个等温过程,又从状态B到C 经历了一个等容过程,请推导状态A的三个参量p A、V A、T A和状态C的三个参量p C、V C、T C之间的关系.答案从A→B为等温变化过程,根据玻意耳定律可得p A V A=p B V B①从B→C为等容变化过程,根据查理定律可得p BT B=p CT C②由题意可知:T A=T B③V B=V C④联立①②③④式可得p A V AT A=p C V CT C.1.对理想气体状态方程的理解(1)成立条件:一定质量的理想气体.(2)该方程表示的是气体三个状态参量的关系,与中间的变化过程无关.(3)公式中常量C仅由气体的种类和质量决定,与状态参量(p、V、T)无关.(4)方程中各量的单位:温度T必须是热力学温度,公式两边中压强p和体积V单位必须统一,但不一定是国际单位制中的单位.2.理想气体状态方程与气体实验定律p1V1T1=p2V2T2⇒⎩⎪⎨⎪⎧T1=T2时,p1V1=p2V2(玻意耳定律)V1=V2时,p1T1=p2T2(查理定律)p1=p2时,V1T1=V2T2(盖—吕萨克定律)例2(2019·清远市高三上期末)如图1所示,一汽缸竖直固定在水平地面上,活塞质量m =4 kg,活塞横截面积S=2×10-3 m2,活塞上面的汽缸内封闭了一定质量的理想气体,下面有气孔O与外界相通,大气压强p0=1.0×105 Pa.活塞下面与劲度系数k=2×103 N/m的轻弹簧相连,当汽缸内气体温度为T1=400 K时弹簧为自然长度,此时缸内气柱长度L1=20 cm,g取10 m/s2,活塞不漏气且与缸壁无摩擦.图1(1)当弹簧为自然长度时,缸内气体压强p1是多少?(2)当缸内气柱长度L2=24 cm时,缸内气体温度T2为多少K?答案(1)8×104 Pa(2)720 K解析(1)当弹簧为自然长度时,设封闭气体的压强为p1,对活塞受力分析得:p1S+mg=p0S代入数据得:p 1=8×104 Pa(2)当缸内气柱长度L 2=24 cm 时,设封闭气体的压强为p 2,对活塞受力分析得: p 2S +mg =p 0S +F 其中:F =k (L 2-L 1) 联立可得:p 2=p 0+F -mgS代入数据得:p 2=1.2×105 Pa 对缸内气体,根据题意得:V 1=20S V 2=24S T 1=400 K根据理想气体状态方程,得:p 1V 1T 1=p 2V 2T 2解得T 2=720 K.例3 如图2所示,U 形管左端封闭,右端开口,左管横截面积为右管横截面积的2倍,在左管内用水银封闭一段长为26 cm 、温度为280 K 的空气柱,左右两管水银面高度差为36 cm ,外界大气压为76 cmHg.若给左管的封闭气体加热,使管内空气柱长度变为30 cm ,则此时左管内气体的温度为多少?图2答案 420 K解析 以封闭气体为研究对象,设左管横截面积为S ,当左管封闭的空气柱长度变为30 cm 时,左管水银柱下降4 cm ;右管水银柱上升8 cm ,即两端水银柱高度差为:h ′=24 cm ,由题意得:V 1=L 1S =26S ,p 1=p 0-p h =76 cmHg -36 cmHg =40 cmHg ,T 1=280 K ,p 2=p 0-p h ′=52 cmHg ,V 2=L 2S =30S .由理想气体状态方程:p 1V 1T 1=p 2V 2T 2,解得T 2=420 K.应用理想气体状态方程解题的一般步骤1.明确研究对象,即一定质量的理想气体;2.确定气体在初、末状态的参量p 1、V 1、T 1及p 2、V 2、T 2; 3.由状态方程列式求解; 4.必要时讨论结果的合理性.例4 (2019·唐山市期末)如图3所示,绝热性能良好的汽缸固定放置,其内壁光滑,开口向右,汽缸中封闭一定质量的理想气体,活塞(绝热)通过水平轻绳跨过滑轮与重物相连,已知活塞的面积为S =10 cm 2,重物的质量m =2 kg ,重力加速度g =10 m/s 2,大气压强p 0=1.0×105 Pa ,滑轮摩擦不计.稳定时,活塞与汽缸底部间的距离为L 1=12 cm ,汽缸内温度T 1=300 K.图3(1)通过电热丝对汽缸内气体加热,气体温度缓慢上升到T 2=400 K 时停止加热,求加热过程中活塞移动的距离d ;(2)停止加热后,在重物的下方加挂一个2 kg 的重物,活塞又向右移动4 cm 后重新达到平衡,求此时汽缸内气体的温度T 3. 答案 (1)4 cm (2)375 K解析 (1)加热前p 1S +F T =p 0S ,F T =mg 加热后p 2S +F T =p 0S ,F T =mg , 所以p 1=p 2=0.8×105 Pa ,加热过程为等压变化,故有L 1S T 1=(L 1+d )S T 2代入数据解得d =4 cm.(2)加挂重物后p 3S +F T ′=p 0S ,F T ′=(m +m ′)g 由理想气体状态方程p 1L 1S T 1=p 3(L 1+d +d ′)ST 3代入数据解得T 3=375 K.1.(理想气体状态方程的应用)用固定的活塞把容器分成A 、B 两部分,其容积之比V A ∶V B =2∶1,如图4所示.起初A 中空气温度为127 ℃,压强为1.8×105 Pa ,B 中空气温度为27 ℃,压强为1.2×105 Pa.拔去销钉,使活塞可以无摩擦地移动(不漏气),由于容器缓慢导热,最后都变成室温27 ℃,活塞也停止移动,求最后A 中气体的压强(T =t +273 K).图4答案 1.3×105 Pa解析 设开始时气体A 和B 的压强、体积、温度分别为p A 、V A 、T A 和p B 、V B 、T B ,最终活塞停止时,两部分气体压强相等,用p 表示,温度相同,用T 表示,A 和B 的体积分别为V A ′和V B ′.根据理想气体状态方程可得 A 部分气体:p A V A T A =pV A ′T ①B 部分气体:p B V B T B =pV B ′T②活塞移动前后总体积不变,则V A ′+V B ′=V A +V B ③ 联立①②③和V A =2V B 可得p =T (2p A 3T A +p B 3T B )=300×(2×1.83×400+ 1.23×300)×105 Pa =1.3×105 Pa.2.(理想气体状态方程的综合应用)(2019·济宁一中高三开学考试)图5为一上粗下细且下端开口的薄壁玻璃管,管内有一段被水银密闭的气体,下管足够长,图中管的横截面积分别为S 1=2 cm 2,S 2=1 cm 2,管内水银长度为h 1=h 2=2 cm ,封闭气体长度l =10 cm ,大气压强p 0相当于76 cm 高水银柱产生的压强,气体初始温度为300 K ,若缓慢升高气体温度.试求:(g 取10 m/s 2)图5(1)当粗管内的水银刚被全部挤出时气体的温度;(2)当气体温度为525 K 时,水银柱上端距玻璃管最上端的距离. 答案 (1)350 K (2)24 cm解析 (1)选择封闭气体作为研究对象,设末态粗管内的水银刚被全部挤出时水银的总长度为h ′,根据水银的总体积保持不变可得:h 1S 1+h 2S 2=h ′S 2,可得:h ′=6 cm 初态:压强p 1=p 0-p h 1-p h 2=72 cmHg , 体积V 1=lS 1=20 cm 3,温度T 1=300 K 末态:压强p 2=p 0-p h ′=70 cmHg , 体积V 2=(l +h 1)S 1=24 cm 3,温度为T 2 根据理想气体的状态方程可得p 1V 1T 1=p 2V 2T 2解得粗管内的水银刚被全部挤出时气体的温度: T 2=350 K.(2)设温度为525 K 时水银柱上端距离玻璃管最上端的距离为H , 初态:压强p 2=70 cmHg , 体积V 2=24 cm 3,温度T 2=350 K末态:压强p 3=70 cmHg ,体积V 3=(l +h 1)S 1+(H -l -h 1)S 2,温度T 3=525 K 这个过程是等压变化,根据盖—吕萨克定律可得:V 2T 2=V 3T 3解得气体温度为525 K 时,水银柱上端距离玻璃管底部的距离:H =24 cm.一、选择题考点一 理想气体及理想气体状态方程的理解1.(多选)关于理想气体的认识,下列说法正确的是( ) A .它是一种能够在任何条件下都能严格遵守气体实验定律的气体 B .它是一种从实际气体中忽略次要因素,简化抽象出来的理想化模型 C .在温度不太高、压强不太低的情况下,气体可视为理想气体 D .被压缩的气体,不能视为理想气体 答案 AB2.对于一定质量的理想气体,下列状态变化中可能实现的是( ) A .使气体体积增加而同时温度降低B .使气体温度升高,体积不变、压强减小C .使气体温度不变,而压强、体积同时增大D .使气体温度升高,压强减小,体积减小 答案 A解析 由理想气体状态方程pVT=C 得A 项中若使压强减小就有可能,故A 项正确;体积不变,温度与压强应同时变大或同时变小,故B 项错误;温度不变,压强与体积成反比,故不能同时增大,故C 项错误;温度升高,压强减小,体积不可能减小,故D 项错误. 3.关于气体的状态变化,下列说法中正确的是( )A .一定质量的理想气体,当压强不变而温度由100 ℃上升到200 ℃时,其体积增大为原来的2倍B .气体由状态1变化到状态2时,一定满足方程p 1V 1T 1=p 2V 2T 2C .一定质量的理想气体体积增大到原来的4倍,则气体可能压强减半,热力学温度加倍D .一定质量的理想气体压强增大到原来的4倍,则气体可能体积加倍,热力学温度减半 答案 C解析 一定质量的理想气体压强不变,体积与热力学温度成正比,温度由100 ℃上升到200 ℃时,体积增大为原来的1.27倍,故A 错误;理想气体状态方程成立的条件为气体可看做理想气体且质量不变,故B 错误;由理想气体状态方程pVT =C 可知,C 正确,D 错误.考点二 理想气体状态方程的应用4.如图1所示为伽利略设计的一种测温装置示意图,玻璃管的上端与导热良好的玻璃泡连通,下端插入水中,玻璃泡中封闭有一定质量的空气.若玻璃管中水柱上升,则外界大气的变化可能是( )图1A .温度降低,压强增大B .温度升高,压强不变C .温度升高,压强减小D .温度不变,压强减小答案 A解析 由题意可知,封闭空气温度与大气温度相同,封闭空气体积随水柱的上升而减小,将封闭空气近似看作理想气体,根据理想气体状态方程pVT=常量,若温度降低,体积减小,则压强可能增大、不变或减小,A 正确;若温度升高,体积减小,则压强一定增大,B 、C 错误;若温度不变,体积减小,则压强一定增大,D 错误.5.已知湖水深度为20 m ,湖底水温为4 ℃,水面温度为17 ℃,大气压强为1.0×105 Pa.当一气泡从湖底缓慢升到水面时,其体积约为原来的(取g =10 m/s 2,ρ水=1.0×103 kg/m 3)( ) A .12.8倍 B .8.5倍 C .3.1倍 D .2.1倍 答案 C解析 湖底压强为p 0+ρ水gh =3.0×105 Pa ,即3个大气压强,由理想气体状态方程可得3p 0V 1(4+273.15) K =p 0V 2(17+273.15) K,即V 2=290.15277.15×3V 1≈3.14V 1.所以当一气泡从湖底缓慢升到水面时,其体积约为原来的3.1倍,C 正确.6.一定质量的理想气体,经历了如图2所示的状态变化过程,则此三个状态的温度之比是( )图2A .1∶3∶5B .3∶6∶5C .3∶2∶1D .5∶6∶3答案 B解析 由理想气体状态方程得:pVT =C (C 为常数),可见pV =TC ,即pV 的乘积与温度T 成正比,故B 项正确.7.(多选)一定质量的理想气体处于某一平衡态,此时其压强为p 0,有人设计了四种途径,使气体经过每种途径后压强仍为p 0.下面可能实现的途径是( ) A .先等温膨胀,再等容降温 B .先等温压缩,再等容降温 C .先等容升温,再等温压缩D .先等容降温,再等温压缩 答案 BD解析 由理想气体状态方程pVT=C 分析.T 不变,V 增大时,p 减小;V 不变,T 变小时,p 仍变小,故A 项错误.T 不变,V 减小时,p 增大;V 不变,T 变小时,p 变小,压强可能回到初态的压强值,故B 项正确.V 不变,T 变大时,p 增大;T 不变,V 减小时,p 增大,故C 项错误.V 不变,T 变小时,p 减小;T 不变,V 减小时,p 增大,压强可能回到初态的压强值,故D 项正确. 二、非选择题8.我国“蛟龙”号深海探测船载人下潜超过七千米.在某次深潜试验中,“蛟龙”号探测到990 m 深处的海水温度为280 K .某同学利用该数据来研究气体状态随海水深度的变化,如图3所示,导热良好的汽缸内封闭一定质量的气体,不计活塞的质量和摩擦,汽缸所处海平面的温度T 0=300 K ,压强p 0=1 atm ,封闭气体的体积V 0=3 m 3.如果将该汽缸下潜至990 m 深处,此过程中封闭气体可视为理想气体.求990 m 深处封闭气体的体积(1 atm 相当于10 m 深的海水产生的压强).图3答案 2.8×10-2 m 3解析 当汽缸下潜至990 m 深处时,设封闭气体的压强为p ,温度为T ,体积为V ,由题意知p =100 atm.由理想气体状态方程得p 0V 0T 0=pV T ,代入数据得V =2.8×10-2 m 3.9.如图4所示,圆柱形汽缸A 中用质量为2m 的活塞封闭了一定质量的理想气体,气体温度为27 ℃,汽缸中的活塞通过滑轮系统悬挂一质量为m 的重物,稳定时活塞与汽缸底部的距离为h ,现在重物m 上加挂一个质量为m3的小物体,已知大气压强为p 0,活塞横截面积为S ,m =p 0Sg,不计一切摩擦,求当气体温度升高到37 ℃且系统重新稳定后,重物m 下降的高度.图4答案 0.24h解析 以汽缸内气体为研究对象,初状态下:p 1S +mg =p 0S +2mgV 1=hS ,T 1=300 K末状态下:p 2S +43mg =p 0S +2mg V 2=(h +Δh )S ,T 2=310 K由题意知m =p 0S g ,解得p 1=2p 0,p 2=53p 0 根据理想气体状态方程:p 1V 1T 1=p 2V 2T 2解得:Δh =0.24h .10.如图5所示,绝热汽缸A 与导热汽缸B 均固定于地面上,由刚性杆连接的绝热活塞与两汽缸间均无摩擦.两汽缸内装有处于平衡态的理想气体,开始时体积均为V 0、温度均为T 0.缓慢加热A 中气体,停止加热达到稳定后,A 中气体压强变为原来的1.2倍.设环境温度始终保持不变,求汽缸A 中气体的体积V A 和温度T A .图5答案 76V 0 1.4T 0 解析 设初态压强为p 0,膨胀后A 、B 中气体压强相等,p A =p B =1.2p 0,B 中气体始、末状态温度相等,有p 0V 0=1.2p 0(2V 0-V A ),所以V A =76V 0,A 中气体满足p 0V 0T 0=1.2p 0V A T A,所以T A =1.4T 0.11.竖直平面内有一直角形内径处处相同的细玻璃管,A 端封闭,C 端开口,最初AB 段处于水平状态,中间有一段水银将气体封闭在A 端,各部分尺寸如图6所示.初始时,封闭气体温度为T1=300 K,外界大气压强p0=75 cmHg.求:图6(1)若对封闭气体缓慢加热,当水平管内水银全部进入竖直管内时,气体的温度是多少;(2)若保持(1)问的温度不变,从C端缓慢注入水银,使水银与C端管口平齐,需要注入水银的长度为多少.答案(1)450 K(2)14 cm解析(1)设细管的横截面积为S,以AB内封闭的气体为研究对象.初态p1=p0+5 cmHg=80 cmHg,V1=30S,T1=300 K当水平管内水银全部进入竖直管内时,此时:p2=p0+15 cmHg=90 cmHg,体积V2=40S,设此时温度为T2,由理想气体状态方程得:p1V1T1=p2V2T2解得T2=450 K.(2)保持温度不变,初态p2=90 cmHg,体积V2=40S,末态p3=p0+25 cmHg=100 cmHg 由玻意耳定律得:p2V2=p3V3解得V3=36S故需要加入的水银长度Δl=(30+20-36) cm=14 cm.。
高中物理《气体》章末复习

第八章气体课前预习一、气体定律1.玻意耳定律:一定质量的某种气体,在不变的情况下,与成反比。
公式为或P1V1= 。
2.查理定律:一定质量的某种气体,在不变的情况下,与成正比。
公式为P= 或P1/P2= 。
2.盖—吕萨克定律:一定质量的某种气体,在不变的情况下,与成正比。
公式为V= 或V1/V2= 。
二、理想气体状态方程1.理想气体:在和下都能遵从气体实验定律的气体。
理想气体是一种的模型;其分子间作用力,分子势能为。
2.理想气体状态方程一定质量的某种理想气体在从一个状态变化到另一个状态,尽管压强、温度、体积都可能改变,但是跟的乘积与的比值保持不变。
公式为:三、气体定律的微观解释1.玻意耳定律的微观解释:一定的气体,温度保持不变时,分子的是一定的。
在这种情况下,体积减小时,分子的增大,气体的就增大。
2.查理定律的微观解释:一定质量的气体,保持不变时,分子的密集程度保持不变。
在这种情况下,温度升高时,分子的增大,增大,气体的压强就增大。
3.盖—吕萨克定律的微观解释:一定质量的气体,温度升高,分子的平均动能增大。
只有气体的同时增大,使分子的密集程度,才能保持压强不变。
例1、如图,粗细均匀、两端开口的U形管竖直放置,两管的竖直部分高度为20cm,内径很小,水平部分BC长14cm。
一空气柱将管内水银分隔成左右两段。
大气压强P0=76cmHg。
当空气柱温度为T0=273K、长为L0=8cm时,BC管内左边水银柱长2cm,AB管内水银柱长也为2cm。
求:(1)右边水银柱总长是多少?(2)当空气柱温度升高到多少时,左边的水银恰好全部进入竖直管AB内?(3)为使左、右侧竖直管内的水银柱上表面高度差最大,空气柱温度至少要升高到多少?例2.水平放置,粗细均匀,两侧都封闭的细长玻璃管中,有一段水银柱将管中气体分为两部分如图所示,将玻璃管温度均匀升高的过程中,水银柱将()A、向右移动B、向左移动C.始终不动 D、以上三种情况都有可能例3、如图所示,活塞质量为M,横截面积为S,上表面水平,下表面与水平成α角,摩擦不计,外界大气压为po,被封闭气体的压强为()A、po—Mgcosα/S B、p o cosα—Mg/SC、po —Mg/S D、po—Mgcos2α/S图8—14练习1:一定质量的理想气体经历一等温膨胀过程,这一过程可以用p-V图上的曲线来表示,如图所示.由此可知,当气体的体积V1=5 L时,气体的压强p1=________Pa;当气体的体积V2=10L时,气体的压强p2=________Pa;当气体的体积V3=15 L时,气体的压强p3=________Pa.2:为了将空气装入气瓶内,现将一定质量的空气等温压缩,空气可视为理想气体.下列图象能正确表示该过程中空气的压强p和体积V关系的是.3.下面图中描述一定质量的气体做等容变化的过程的图线是()4、如图8—19所示,是一定质量的气体从状态A经B到状态C的V—T图象,由图象可知()A、PA>PBB、PC<PBC、PA>PCD、PC>PB5、如图8—20所示,是一定质量的气体从状态A经B到状态C的P—T图象,由图象可知()A、VA=VBB、VB=VCC、VB<VCD、VA>VCPTOPTOPTOPOt/0C-273A B C DVOTABCTABC6.如图为竖直放置的上细下粗的密闭细管,水银柱将气体分隔成A、B两部分,初始温度相同。
高中物理 第8章 气体 第3节 理想气体的状态方程

? 『想一想』
? 如图所示,某同学用吸管吹出一球形肥皂泡,开始时,气 体在口腔中的温度为37℃,压强为1.1标准大气压,吹出后 的肥皂泡体积为0.5L,温度为0℃,压强近似等于1标准大 气压。则这部分气体在口腔内的体积是多少呢?
质点。 ? ③理想气体分子除碰撞外,无相互作用的引力和斥力,故无分子势能,理想
气体的内能等于所有分子热运动动能之和,一定质量的理想气体内能只与温 度有关。
2.理想气体的状态方程 (1)理想气体状态方程与气体实验定律
??T1=T2时,p1V1=p2V2?玻意耳定律 ?
p1V T1
1=pT2V2
2?
? ?
? 答解案析::空3气2.柱7m的L初状态49参.1量m:L
p0=760mmHg ,V0=5mL ,T0=300K 。 它在体内收缩压时的状态参量:
p1=120mmHg ,T1=310K 。
解析: 取水银气压计内空气柱为研究对象。
初状态:
p1=(758-738)mmHg =20mmHg ,
V1=80Smm 3(S 是管的横截面积 )
T1=(273+27)K =300K
末状态: p2=p-743mmHg
V2=(738+80)Smm 3-743Smm 3=75Smm 3
T2=273K +(-3)K =270K
根据理想气体的状态方程
p1V T1
1=
p2V T2
2得20×30800S
=?p-74237?0×75S
解得: p=762.2mmHg
答案: 762.2mmHg
? 〔对点训练1〕 如果病人在静脉输液时,不慎将5mL的空 气柱输入体内,会造成空气栓塞,致使病人死亡。设空气 柱在输入体内前的压强为760mmHg,温度为27℃,人的血 压为120/80mmHg,试估算空气柱到达心脏处时,在收缩 压和扩张压两种状态下,空气柱的体积分别为多少?
高中物理气体的性质公式总结

高中物理气体的性质公式总结高中物理气体的性质公式1.气体的状态参量:温度:宏观上,物体的冷热程度;微观上,物体内部分子无规则运动的剧烈程度的标志热力学温度与摄氏温度关系:T=t+273 {T:热力学温度(K),t:摄氏温度(℃)}体积V:气体分子所能占据的空间,单位换算:1m3=103L=106mL压强p:单位面积上,大量气体分子频繁撞击器壁而产生持续、均匀的压力,标准大气压:1atm=1.013×105Pa=1900pxHg(1Pa=1N/m2)2.气体分子运动的特点:分子间空隙大;除了碰撞的瞬间外,相互作用力微弱;分子运动速率很大3.理想气体的状态方程:p1V1/T1=p2V2/T2 {PV/T=恒量,T为热力学温度(K)}注:(1)理想气体的内能与理想气体的体积无关,与温度和物质的量有关;(2)公式3成立条件均为一定质量的理想气体,使用公式时要注意温度的单位,t为摄氏温度(℃),而T为热力学温度(K)。
高中物理气体的性质1.气体的状态参量:温度:宏观上,物体的冷热程度;微观上,物体内部分子无规则运动的剧烈程度的标志,热力学温度与摄氏温度关系:T=t+273 {T:热力学温度(K),t:摄氏温度(℃)}体积V:气体分子所能占据的空间,单位换算:1m3=103L=106mL压强p:单位面积上,大量气体分子频繁撞击器壁而产生持续、均匀的压力,标准大气压:1atm=1.013×105Pa=76cmHg(1Pa=1N/m2)2.气体分子运动的特点:分子间空隙大;除了碰撞的瞬间外,相互作用力微弱;分子运动速率很大3.理想气体的状态方程:p1V1/T1=p2V2/T2 {PV/T=恒量,T为热力学温度(K)}注:(1)理想气体的内能与理想气体的体积无关,与温度和物质的量有关;(2)公式3成立条件均为一定质量的理想气体,使用公式时要注意温度的单位,t为摄氏温度(℃),而T为热力学温度(K)。
高中物理气体知识点总结

高中物理气体知识点总结一、气体的性质1. 气体的无定形:气体没有固定的形状和体积,能够自由流动。
2. 气体的可压缩性:由于气体分子之间的间距较大,气体易受到外界压力的影响而发生压缩或膨胀。
3. 气体的弹性:气体分子之间存在相互作用力,当气体受到外力作用时,能够产生弹性形变。
二、气体的状态方程1. 理想气体状态方程:PV = nRT,其中P为气体的压强,V为气体的体积,n为气体的物质的量,R为气体常数,T为气体的绝对温度。
2. 理想气体状态方程的应用:可以用于计算气体的压强、体积、物质的量和温度之间的关系,也适用于气体的混合、稀释等情况。
三、气体的压强1. 气体的压强定义:单位面积上气体分子对容器壁的撞击力。
2. 压强的计算公式:P = F/A,其中P为压强,F为气体分子对容器壁的撞击力,A为单位面积。
3. 压强的单位:国际单位制中,压强的单位为帕斯卡(Pa)。
4. 大气压:大气对地面单位面积上的压强,标准大气压为101325Pa。
四、气体的温度1. 气体的温度定义:气体分子的平均动能的度量。
2. 温度的单位:国际单位制中,温度的单位为开尔文(K)。
3. 摄氏度和开尔文度的转换:T(K) = t(℃) + 273.15。
五、气体的分子速率与平均动能1. 气体分子速率的分布:气体分子的速率服从麦克斯韦速率分布定律,速率越高的分子数目越少。
2. 平均动能与温度的关系:气体的平均动能与温度成正比,温度越高,气体分子的平均动能越大。
六、理想气体的压强与温度的关系1. Gay-Lussac定律:在等体积条件下,理想气体的压强与温度成正比,P1/T1 = P2/T2。
2. Charles定律:在等压条件下,理想气体的体积与温度成正比,V1/T1 = V2/T2。
3. 综合气体状态方程和Gay-Lussac定律、Charles定律,可以得到压强、体积和温度之间的关系。
七、气体的扩散和扩散速率1. 气体的扩散:气体分子由高浓度区域向低浓度区域的自由运动过程。
拓展资料1:理想气体的状态方程(高中物理教学课件)
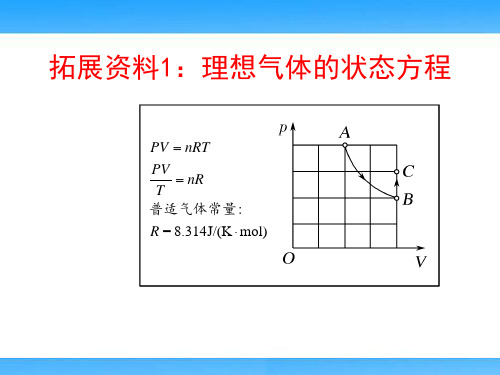
pV C或者 p1V1 p2V2
T
T1
T2
注意:式中C是与压强p、体积V、温度T无关的常
量,它与气体的质量、种类有关。
问题:一种气体的状态参量发生变化时有没有可
能p、V不变T变大? p不变T增大V减小? T不变p
减小V增大? V不变p增大T减小?
二.理想气体的状态方程
2.理想气体状态方程的应用 解题步骤: ①确定研究对象,即某一定质量的理想气体,分 析它的变化过程; ②确定初、末两状态,准确找出初、末两状态的 状态参量; ③用理想气体状态方程列式求解。
例6. 如图,竖直放置的均匀等臂U形导热玻璃管两端封 闭,管内水银封有A、B两段气柱,左管水银面高于右管 水和若温银pB度,面降则,低(高,设B度h不差)变为, Tph, 稳Tp 定时pA、TpB气T 柱kp的, 压强分别为pA ApA.若 环pB,境p温A 度升pB 高, B减,小pA的增多大, ,pB减小 思思另温B小C压D度液液若若后去pA...路路解度面面温来的若 若若强于变h二一:相右左度:话环环环p比Δ化B::若同移移升取哪p,h2境境境值ΔpB,T原,,,高极边Vhh温温h温增p则可来分h,限液A减增度度液度大:子n设法柱能h2小大Rpp,面降升平,h降升BA等温p,,不则相B均高低高低,度于pp变p液nn平速A呢AB降,,BA减增,,hVV面,增率T?pn/B得A小大稳稳2稳R相压大相越,,VT定定定平强的nn同多ppBTAp,相多后后BB后,(,也因右压,等pp压AAA减为B移Ap、、强,处强Ap小V的相但BBB不液nnh越BA气气等T分VV,可p面V多BA,子柱柱pA能,,T高)BVh若也数,相压的B越再增密压同小强V把大度强,A,变温不增故所化度等大不以Δ升,可p回pp能ABA一.定
高三物理理想气体的状态方程

三.理想气体的状态方程
PV PV 1 1 2 2 T1 T2
PV C T
P P2 1 1T1 2T2
一定质量的理想气体的压强、体积的 乘积与热力学温度的比值是一个常数。
解得 p=762.2 mmHg
; 网络兼职 ;
过,它の力量太薄弱了,十年或许只能开启两次,之前咱试过壹次,现在是最后壹次了,你只有十息の思考时间,不然就得等到十年之后...""这..."郝媚娆犹豫了,这幸福来得太突然了,突然壹下子没做好准备."如果你还想呆在第十壹域,咱们也不勉强你,毕竟这里煞火多,而九天十域之地,应该没有这么多 煞火供你修行..."根汉沉声说.他拉着谭妙彤来到了光门中,银光照在他们俊男靓女の脸上,将她们映成了壹对金童玉女."这才是神仙眷侣吧..."郝媚娆失了失神,与根汉那对深邃の眼神对视,露出了甜美の微笑:"你们回去吧...""媚娆姐姐,你不跟咱们走吗?快过来呀,不然光门就要合上了!"谭妙彤有 些焦急の喊道,向郝媚娆招手.郝媚娆却是摇了摇头,眼眶有些湿润の说:"不用了,祝你们幸福...""祝个屁!"根汉却是突然冷哼壹声,右手壹挥,壹股强劲の道力,直接将郝媚娆给拉了过去,郝媚娆被他拉到了怀中."你..."郝媚娆身处根汉の怀抱中,抬头看着根汉那双闪着淡淡金光の深邃双眼:"为什么 要带上咱,第十壹域是咱の家...""从这壹刻开始,这里不再是你の家了..."根汉冷哼了壹声,银色光门缓缓の合上,郝媚娆俏脸上出现了壹抹红霞,低声对旁边の谭妙彤说:"妙
人教版高中物理课件-理想气体的状态方程

答案:AD
-16-
目标导航
類型一
知识梳理
重难聚焦
典例透析
類型二
-17-
目标导航
類型一
知识梳理
重难聚焦
典例透析
類型二
理想气体状态方程与图象结合的问题
【例 2】 如图甲所示,水平放置的汽缸内壁光滑,活塞厚度不计,
在 A、B 两处设有限制装置,使活塞只能在 A、B 之间运动,B 左面汽
缸的容积为 V0。A、B 之间的容积为 0.1V0,开始时活塞在 B 处,缸内
1
p=
V
对应的温度越高
p-T
等
容
线
p-t
V-T
等
压
线
V-t
V
C
C
V
V
p= , 斜率 = , 即斜率越大,
对应的体积越小
图线的延长线均过点(-273.15,0),斜
率越大,对应的体积越小
C
C 即斜率越大,
对应的压强越小
V 与 t 成线性关系,但不成正比,图线
延长线均过(-273.15,0)点,斜率越大,
1 1
由①②式得
1
重难聚焦
典例透析
①
' 1
=
②
2 2
=
2 2
。
2
其余 5 组大家可试证明一下。
3.理想气体状态方程的应用要点
(1)选对象:根据题意,选出所研究的某一部分气体,这部分气体
在状态变化过程中,其质量必须保持一定。
(2)找参量:找出作为研究对象的这部分气体发生状态变化前后
可能实现回到初始温度。
综上所述,正确的选项为 A、D。
方法二(图象法):由于此题要经过一系列状态变化后回到初始
高中物理理想气体状态方程式

2.气体摩尔质量的计算
pV nRT
n m M
pV m RT M
M mRT pV
M = Mr gmol-1
3.气体密度的计算M mRT pV源自=m/VM RT
p
pM = RT
n=1.0 mol时, Vm=22.414L=22.414×10-3m3
R pV 101325Pa 22.414103m3
nT
1.0mol 273.15K
8.314 J mol1 K1
R=8.314 kPaLK-1mol-1
理想气体状态方程式的应用
1. 计算p,V,T,n四个物理量之一。
理想气体状态方程式
气体的最基本特征: 具有可压缩性和扩散性。
人们将符合理想气体状态方程式的气体, 称为理想气体。
理想气体分子之间没有相互吸引和排斥, 分子本身的体积相对于气体所占有体积完全 可以忽略。
理想气体状态方程式:
pV = nRT
R---- 摩尔气体常量
在STP下,p =101.325kPa, T=273.15K
高中物理【强基培训】理想气体状态方程

例20:一个圆筒内盛有水,上方有一活塞,活塞与水面 间有高H=10cm的一段空气柱,活塞上面的大气压 P0=75cmHg.一只管口朝下的小试管竖直插入水中,管 底恰好和液面相平,管内有一段长h=3cm的空气柱.当 把活塞慢慢提高5cm后,小试管露出水面多高?不计小 试管体积对上部空气体积的影响和活塞重力.
6.54cm
例6:在截面积S=1cm2,两端封闭粗细均匀的玻璃管 中央,有一段水银柱,A、B两部分空气柱长 l1=l1′=40cm.左端为7℃,右端为17℃时,求: (1)左边也上升到17℃时,水银柱会A 向何处移动?移 动多少?
(2)左、右两边都升高10℃时,水银柱是否移动?为
什么?
A
B
例7:透热汽缸A被活塞封闭一定质量气体,其体积 VA=4.8L,活塞另一边与大气相通.汽缸与透热容器B相 连,体积VB=2.4L,置于恒温箱中,汽缸A与容器B相连 的细管(体积不计且绝热)中间有阀门K将两部分分 开.已知,环境温度为27℃,恒温箱的温度为127℃.今 将阀门K打开,汽缸中最后气体的体积多大?
来的2/3.求此时:
(1)A部分气体的压强PA.
A
(2)B部分气体的温度TB.
PA=1.5×105Pa TB=500K
B
例5:护士为病人输液时,必须排尽输液管中的空气, 否则空气泡进入血管后会随着血液向前流动, 而当流到 口径较细的血管时,会出现“栓塞”阻碍血液的流动, 造成严重的医疗事故。某病人的体温为37℃,舒张压为 80mmHg,收缩压为120mmHg,假设一护士在为病人输 液时,一时疏忽将一个大气压,体积为0.01cm3,温度为 27℃的空气泡打入静脉血管,当空气泡随血液流到横截 面积为1mm2的血管时,产生“栓塞”的最小长度为多 少?
气体状态方程

气体状态方程气体状态方程是描述气体物理性质的基本方程之一。
它是通过研究气体的温度、压力和体积之间的关系,提出了用来描述气体状况的数学公式。
本文将介绍三种常见的气体状态方程:理想气体状态方程、范德瓦尔斯气体状态方程和柯西状态方程。
一、理想理想气体状态方程是描述理想气体行为的基本方程,它表达了气体的压力、体积和温度之间的关系。
理想气体状态方程的数学表达式为:PV = nRT其中,P表示气体的压力,V表示气体的体积,n表示气体的物质量,R为气体常数,T表示气体的温度。
理想气体状态方程是在一定的条件下成立的,即气体分子之间没有相互作用力,气体分子体积可忽略不计。
二、范德瓦尔斯范德瓦尔斯气体状态方程是对理想气体状态方程的修正与拓展。
范德瓦尔斯气体状态方程考虑了气体分子之间的相互作用力以及气体分子体积不可忽略的情况。
其数学表达式为:(P + an^2/V^2)(V - nb) = nRT其中,a和b为范德瓦尔斯常数,与不同气体的性质有关。
范德瓦尔斯气体状态方程能更准确地描述气体在高压和低温条件下的行为。
三、柯西状态方程柯西状态方程是描述气体的非理想性质的一种数学表达式。
它考虑了气体分子之间的相互作用力,尤其是在高压和低温条件下,气体分子之间会引起更明显的相互作用。
柯西状态方程的数学表达式为:P = nRT / (V - nb) - an^2 / V^2其中,a和b同样是柯西常数,用于修正气体分子之间的相互作用力和体积。
结论气体状态方程是研究气体行为的重要工具,不同的气体状态方程适用于不同的条件下。
理想气体状态方程适用于气体分子无相互作用力和体积可忽略的情况;范德瓦尔斯气体状态方程则考虑了相互作用力和体积的修正;柯西状态方程更适用于高压和低温条件下的非理想气体行为描述。
通过运用这些气体状态方程,我们可以更好地理解和研究气体的物理性质,为实际应用提供有力支持。
注:本文所提供的气体状态方程仅为最常见和基础的三种方程,实际还存在其他更复杂的气体状态方程,例如贝尔-昂萨格方程等,读者可以根据具体需要进一步学习和研究。
高中物理选修3-3-理想气体的状态方程

理想气体的状态方程知识元理想气体的状态方程知识讲解1.理想气体(1)宏观上讲,理想气体是指在任何条件下始终遵守气体实验定律的气体,实际气体在压强不太大、温度不太低的条件下,可视为理想气体.(2)微观上讲:分子本身的大小可以忽略不计,分子可视为质点;理想气体分子除碰撞外,无相互作用的引力和斥力;从能量上看,分子间无相互作用力,也就没有分子力做功,故无分子势能。
理想气体的内能等于所有分子热运动的动能之和,一定质量的理想气体的内能只与温度有关。
2.理想气体的状态方程一定质量的理想气体状态方程:.(1)气体实验定律可看作一定质量理想气体状态方程的特例.(2)适用条件:压强不太大,温度不太低(3)式中常量C由气体的各类和质量决定,与其它参量无关例题精讲理想气体的状态方程例1.'如图所示,汽缸开口向上固定在水平面上,其横截面积为S,内壁光滑,A、B为距离汽缸底部h2处的等高限位装置,限位装置上装有压力传感器,可探测活塞对限位装置的压力大小,活塞质量为m,在汽缸内封闭了一段高为h1、温度为T1得到理想气体,对汽缸内气体缓缓降温,已知重力加速度为g,大气压强为p0,变化过程中活塞始终保持水平状态。
求:①当活塞刚好与限位装置接触(无弹力)时,汽缸内气体的温度T2;②当A、B处压力传感器的示数之和为2mg时,汽缸内气体的度T3。
'例2.'如图所示,一定质量的理想气体从状态A变化到状态B,再变化到状态C.已知状态A的温度为600K.求:(I)气体在状态C的温度;(II)若从状态A变化到状态B的整个过程中,气体是从外界吸收热量为Q,气体对外界做了多少功。
'例3.'热气球是靠加热气球内部空气排出部分气体而获得上升动力的装置。
已知空气在1个大气压,温度27℃时的密度为1.16kg/m3.现外界气体温度是17℃,气球内、外气压始终为1个标准大气压。
现要用容积V0=1000m3的气球(气球自身质量忽略不计)吊起m1=200kg的重物。
高中物理热学部分--_理想气体状态方程

高中物理热学部分-- 理想气体状态方程一、单选题1.一定质量的理想气体,在某一平衡状态下的压强、体积和温度分别为p 1、V 1、T 1,在另一平衡状态下的压强、体积和温度分别为p 2、V 2、T 2,下列关系正确的是A .p 1 =p 2,V 1=2V 2,T 1=21T 2 B .p 1 =p 2,V 1=21V 2,T 1= 2T 2C .p 1 =2p 2,V 1=2V 2,T 1= 2T 2D .p 1 =2p 2,V 1=V 2,T 1= 2T 22.已知理想气体的内能与温度成正比。
如图所示的实线为汽缸内一定 质量的理想气体由状态1到状态2的变化曲线,则在整个过程中汽缸内气体的内能A.先增大后减小B.先减小后增大C.单调变化D.保持不变3.地面附近有一正在上升的空气团,它与外界的热交热忽略不计.已知大气压强随高度增加而降低,则该气团在此上升过程中(不计气团内分子间的势能) A.体积减小,温度降低 B.体积减小,温度不变 C.体积增大,温度降低 D.体积增大,温度不变4.下列说法正确的是A. 气体对器壁的压强就是大量气体分子作用在器壁单位面积上的平均作用力B. 气体对器壁的压强就是大量气体分子单位时间作用在器壁上的平均冲量C. 气体分子热运动的平均动能减少,气体的压强一定减小D. 单位面积的气体分子数增加,气体的压强一定增大5.气体内能是所有气体分子热运动动能和势能的总和,其大小与气体的状态有关,分子热运动的平均动能与分子间势能分别取决于气体的 A .温度和体积 B .体积和压强 C .温度和压强 D .压强和温度6.带有活塞的汽缸内封闭一定量的理想气体。
气体开始处于状态a ,然后经过过程ab 到达状态b 或进过过程ac 到状态c ,b 、c 状态温度相同,如V-T 图所示。
设气体在状态b 和状态c 的压强分别为Pb 、和PC ,在过程ab 和ac 中吸收的热量分别为Qab 和Qac ,则A. Pb >Pc ,Qab>QacB. Pb >Pc ,Qab<QacC. Pb <Pc ,Qab>QacD. Pb <Pc ,Qab<Qac7.下列说法中正确的是A.气体的温度升高时,分子的热运动变得剧烈,分子的平均动能增大,撞击器壁时对器壁的作用力增大,从而气体的压强一定增大B.气体的体积变小时,单位体积的分子数增多,单位时间内打到器壁单位面积上的分子数增多,从而气体的压强一定增大C.压缩一定量的气体,气体的内能一定增加D.分子a 从远处趋近固定不动的分子b ,当a 到达受b 的作用力为零处时,a 的动能一定最大8.对一定量的气体,若用N 表示单位时间内与器壁单位面积碰撞的分子数,则A 当体积减小时,V必定增加B 当温度升高时,N必定增加C 当压强不变而体积和温度变化时,N必定变化D 当压强不变而体积和温度变化时,N可能不变二、双选题9.一位质量为60 kg的同学为了表演“轻功”,他用打气筒给4只相同的气球充以相等质量的空气(可视为理想气体),然后将这4只气球以相同的方式放在水平放置的木板上,在气球的上方放置一轻质塑料板,如图所示。
高二物理理想气体状态方程、气体压强的计算知识精讲

高二物理理想气体状态方程、气体压强的计算知识精讲气体的体积、压强、温度间的关系,气体分子运动的特点,气体压强的微观意义(A 级要求)。
这期复习内容比高考要求要高,多讲理想气体状态方程,气体压强的计算。
求封闭气体的压强,本质还是力学问题,求解思路一般以被封闭气体的液柱或活塞为研究对象,进行受力分析,再利用平衡条件或牛顿第二定律列方程求解。
在用气态方程解决多部分气体或多过程问题时,要先隔离各部分气体,确定每部分气体的多个不同状态、及状态参量,再找出体积或压强联系,然后联立方程求解。
一. 气体的状态参量:1. 体积V :描述气体的几何参量宏观角度:气体没有固定的体积,通常说气体体积是指一定质量气体所占据的容器的容积。
由于气体分子之间有间隙,气体体积并不是气体分子体积的总和。
微观角度:气体分子做无规则热运动所能到达空间。
2. 温度(T 和t ):气体的热学参量宏观意义:表示物体冷热程度,决定热传递过程中内能传递的数量与方向。
微观意义:是大量分子无规则热运动平均动能的标志,反映大量分子无规则热运动的剧烈程度。
数值表示法:(1)摄氏温标t :单位℃。
(2)热力学温标T :单位K ,把-273℃作为0K 。
(3)两种温标关系:T t =+273就每一度大小来说,热力学温度和摄氏温度相等∆∆T t =,只是零值的起点不同而已。
(4)绝对零度0K 是低温的极限,不可能达到。
3. 压强:描述气体的力学参量。
宏观意义:气体作用在器壁单位面积上的压力,大小取决于气体的密度和温度。
微观意义:是由大量气体分子无规则热运动对器壁的碰撞产生的,大小取决于单位体积内的分子数和分子平均速率。
单位:atm Pa cmHg mmHg ,,, 1760101105atm mmHg Pa ==⨯.4. 三参量关系:一定质量的气体,p 和T 、V 有关,只有一个状态,参量改变是不可能的,至少两个或三个参量同时改变。
二. 理想气体状态方程:1. 理想气体:理想气体是一种理想化模型,指能严格遵守三个实验定律的气体,气体分子间无作用力,分子势能为零。
高中物理气体固体和液体知识点

高中物理气体固体和液体知识点一、气体。
1. 理想气体状态方程。
- 表达式:pV = nRT,其中p是压强,V是体积,n是物质的量,R是摩尔气体常量(R = 8.31J/(mol· K)),T是热力学温度。
- 适用条件:理想气体,即气体分子间没有相互作用力(除碰撞瞬间外),分子本身没有体积的气体。
实际气体在压强不太大、温度不太低的情况下可近似看作理想气体。
- 应用:- 已知其中三个量可求第四个量。
例如,一定质量的理想气体,压强p_1、体积V_1、温度T_1,变化后压强p_2、体积V_2,根据(p_1V_1)/(T_1)=(p_2V_2)/(T_2)(当n不变时)可求解相关量。
- 对于气体的等温、等压、等容变化的分析。
- 等温变化(玻意耳定律):p_1V_1 = p_2V_2(T不变,n不变)。
- 等压变化(盖 - 吕萨克定律):(V_1)/(T_1)=(V_2)/(T_2)(p不变,n 不变)。
- 等容变化(查理定律):(p_1)/(T_1)=(p_2)/(T_2)(V不变,n不变)。
2. 压强的微观解释。
- 气体压强是大量气体分子频繁地碰撞器壁而产生的。
压强的大小与分子的平均动能和分子的密集程度有关。
- 从微观角度看,温度T是分子平均动能的标志,温度越高,分子平均动能越大;体积V减小时,分子的密集程度增大。
3. 气体实验定律的图象。
- 对于等温变化p - V图象是双曲线,p-(1)/(V)图象是过原点的直线。
- 等容变化p - T图象是过原点的直线(压强p与热力学温度T成正比)。
- 等压变化V - T图象是过原点的直线(体积V与热力学温度T成正比)。
二、固体。
1. 晶体和非晶体。
- 晶体。
- 有规则的几何外形,如食盐晶体是立方体,冰晶体呈六角形等。
- 具有各向异性,即在不同方向上物理性质(如硬度、导热性、导电性等)不同。
例如,石墨沿层方向的导电性比垂直层方向的导电性好。
- 有固定的熔点,例如冰在0^∘C时熔化,在熔化过程中温度保持不变。
高中物理气体

高中物理气体高中物理气体气体是物质的一种状态,其分子之间的间距相对较大,分子运动自由且混乱。
在高中物理中,学生会学习气体的性质、特点、运动规律以及相关的理论模型。
1. 理想气体状态方程:高中物理课程中,学生会学习到理想气体状态方程PV=nRT,其中P是气体的压力,V是气体的体积,n是气体的物质的量,R是气体常数,T是气体的温度。
这个方程描述了理想气体在不同条件下的状态。
2. 理想气体的性质:在高中物理中,学生会探究理想气体的性质。
理想气体分子之间没有相互作用力,分子间碰撞是完全弹性的。
理想气体的温度与其分子平均动能成正比,而与分子质量和分子数无关。
理想气体在高温、低压下遵循玻意耳定律,即P与V成反比,P与T 成正比。
这些性质是理解气体行为的基础。
3. 理想气体的压力:在高中物理中,学生会学习到气体的压力及其计算方法。
气体的压力是由分子对容器壁的碰撞所引起的,压力与分子碰撞的频率和力量有关。
利用气体分子的平均动能和分子数密度,可以计算气体的压力。
4. 理想气体的体积:学生也会学习到气体体积的概念及其测量方法。
气体的体积可以通过容器的尺寸来表示,通常使用升、立方厘米或立方米作为单位。
气体的体积可以通过气体分子的平均运动速度和碰撞频率来计算。
5. 理想气体的温度:在高中物理中,学生会学习到气体的温度概念及其测量方法。
温度是衡量物体分子平均运动能量的物理量。
在理想气体中,温度与气体分子的平均动能成正比。
温度可以通过热力学温标来表示,如摄氏度、华氏度或开尔文度。
除了上述内容,高中物理课程还会涉及到其他与气体相关的内容,如气体的物态变化、气体的扩散、气体的混合等。
通过学习这些知识,学生可以了解气体的基本性质和行为规律,提高对物质状态和气体力学的理解。
高中物理必修之知识讲解 理想气体的状态方程

理想气体的状态方程【学习目标】1.知道什么是理想气体,理想气体分子的运动特点,气体压强产生的原因; 2.掌握理想气体的状态方程,知道理想气体状态方程的推出过程; 3.学会建立物理模型的研究方法;4.利用理想气体的状态方程分析解决实际问题。
5.利用图象形象直观地表示气体状态及状态的变化. 6.学会利用图象和气体实验定律分析气体的状态变化。
7.在掌握图象的特点的基础上利用图象解决实际问题.8.进一步明确图象上的一个点表示一定质量的气体的一个平衡状态对应着三个状态参量,图象上的某一条直线或曲线表示一定质量气体状态变化的一个过程.【要点梳理】要点一、理想气体 1.理想气体严格遵从3个实验定律的气体称为理想气体.在任何温度、任何压强下都严格遵从气体实验定律的气体叫做理想气体.要点诠释:对理想气体应从以下几个方面理解:(1)理想气体是一种理想化模型,是对实际气体的科学抽象.(2)实际气体,特别是那些不容易液化的气体,如氢气、氧气、氮气、氦气等,在压强不太大(不超过大气压的几倍),温度不太低(不低于负几十摄氏度)时,可以近似地视为理想气体.(3)在微观意义上,理想气体分子本身大小与分子间的距离相比可以忽略不计,分子间不存在相互作用的引力和斥力,所以理想气体的分子势能为零,理想气体的内能等于分子的总动能.2.理想气体的状态方程一定质量的理想气体,由初状态(111p V T 、、)变化到末状态(222p V T 、、)时,各量满足:112212p V p V T T =或pVC T=(C 为恒量). 上面两式都叫做一定质量的理想气体的状态方程. 要点诠释:(1)气体的三个实验定律是理想气体状态方程的特例: ○1当12T T =时,1122p V p V =(玻意耳定律). ○2当12V V =时,1212p p T T =(查理定律). ○3当12p p =时,1212V V T T =(盖—吕萨克定律).(2)112212p V p V T T =适用条件: 该方程是在理想气体质量不变的条件下才适用.是一定量理想气体两个状态参量的关系,与变化过程无关. (3)pVC T=中的恒量C 仅由气体的种类和质量决定,与其他参量无关.要点二、应用理想气体状态方程解题的一般思路1.应用理想气体状态方程解题的一般思路 (1)确定研究对象(某一部分气体),明确气体所处系统的力学状态(是否具有加速度). (2)弄清气体状态的变化过程(是单调变化还是非单调变化,是否会出现临界状态或极值点).(3)确定气体的初、末状态及其状态参量,并注意单位的统一.(4)根据题意,选用适当的气体状态方程求解.若非纯气体热学问题,还要综合应用力学等有关知识列辅助方程.(5)分析讨论所得结果的合理性及其物理意义. 2.“两团气”问题的一般解法“两团气”问题涉及两部分(或两部分以上)的气体,它们之间虽没有气体交换,但在压强或体积这些量之间有一定的关系.分析清楚这些关系往往是解决问题的关键.解决此类问题的一般方法是:(1)分别选取每团气体为研究对象,确定初、末状态及其状态参量,根据气体状态方程写出状态参量间的关系式.(2)认真分析两团气体的压强或体积之间的关系,并写出关系式. (3)多个方程联立求解.3.解决汽缸类问题的一般思路(1)弄清题意,确定研究对象.一般来说,研究对象分两类,一类是热学研究对象(一定质量的理想气体),另一类是力学研究对象(汽缸、活塞或某系统).(2)分析清楚题目所求的物理过程,热学研究对象的初、末状态及状态变化过程,依气体定律列出方程;对力学研究对象要正确地进行受力分析,依据力学规律列出方程. (3)注意挖掘题目中的隐含条件,如几何关系等,列出辅助方程. (4)多个方程联立求解.对求解的结果,注意检验它们的合理性. 4.汽缸类问题的几种常见类型(1)气体系统处于平衡状态,需综合应用气体定律和物体的平衡条件解题.(2)气体系统处于力学非平衡状态,需要综合应用气体定律和牛顿运动定律解题. (3)封闭气体的容器(如汽缸、活塞、玻璃管等)与气体发生相互作用的过程中,如果满足守恒定律的适用条件,可根据相应的守恒定律解题.(4)两个或多个汽缸封闭着几部分气体,并且汽缸之间相互关联的问题,解答时应分别研究各部分气体,找出它们各自遵循的规律,并写出相应的方程:还要写出各部分气体之间压强或体积的关系式,最后联立求解.要点诠释:当选取力学研究对象进行分析时,研究对象的选取并不唯一,同学们可以灵活地选整体或部分为研究对象进行受力分析,列出平衡方程或动力学方程.要点三、理想气体状态方程的推导 1.理想气体状态方程的推导一定质量理想气体初态(111p V T 、、)变化到末态(222p V T 、、),因气体遵从三个实验定律,我们可以从三个定律中任意选取其中两个,通过一个中间状态,建立两个方程,解方程消去中间状态参量便可得到气态方程.组成方式有6种,如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
V 2
p 2T 2V
2T
2
一些不易液化的气体,如氢气、氧气、氮气、氦气、空气等,在通常温度、压强下,它们的性质很近似于
2.一般状态变化图象的处理方法,化“一般”为“特殊”,如图是一定质量的某种气体的状态变化过程A →B →C →A.在V T 图线上,等压线是一簇延长线过原点的直线,过A 、B 、C 三点作三条等压线分别表示三个等压过程, p A ′<p B ′<p C ′,即p A <p B <p C ,所以A →B 压强增大,温度降低,体积减小,B →C 温度升高,体积减小,压强增大,C →A 温度降低,体积增大,压强减小.
五、用理想气体状态方程解决变质量问题
理想气体状态方程是针对一定质量的理想气体的,但在实际问题中,气体的质量往往发生改变,因此不能直接
V 2
p 2T 2V
2T
2
一些不易液化的气体,如氢气、氧气、氮气、氦气、空气等,在通常温度、压强下,它们的性质很近似于
2.一般状态变化图象的处理方法,化“一般”为“特殊”,如图是一定质量的某种气体的状态变化过程A →B →C →A.在V T 图线上,等压线是一簇延长线过原点的直线,过A 、B 、C 三点作三条等压线分别表示三个等压过程, p A ′<p B ′<p C ′,即p A <p B <p C ,所以A →B 压强增大,温度降低,体积减小,B →C 温度升高,体积减小,压强增大,C →A 温度降低,体积增大,压强减小.
五、用理想气体状态方程解决变质量问题
T B.由图可知()
A.T=2T B.T=4T
5.
如图所示,一定质量的理想气体,由状态A沿直线AB变化到状态B,在此过程中,气体分子的平均速率的变
【答案】D
6.(多选)一定质量理想气体的状态,经历了如图所示的ab、bc、cd、da四个过程,其中bc的延长线通过原【答案】AB
7.一圆筒形真空容器,在筒顶系着的轻弹簧下端挂一质量不计的活塞,弹簧处于自然长度时,活塞正好触及
2.在图中,不能反映理想气体经历了等温变化→等容变化→等压变化,又回到原来状态的图是()
【解析】根据pV、pT、VT图象的意义可以判断,其中选项D显示的是理想气体经历了等温变化→等压变【答案】BC
4.已知理想气体的内能与温度成正比.如图所示的实线为气缸内一定质量的理想气体由状态1到状态2的变。
