物质结构 元素周期律4PPT
合集下载
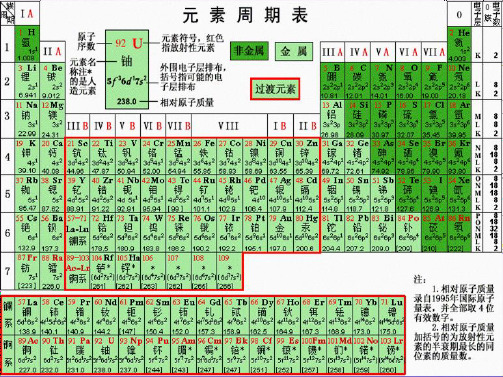
元素周期表 (4)

。
CS
族序数等于周期序数2倍的元素有:
。
Li、Ca
周期序数=族序数2倍的有:
。
练习与思考:
A、B、C是周期表中相邻的三种元素, 其中A、B是同周期,B、C是同主族。此三 种元素原子最外层电子数之和为17,质子数 之和为31,则A、B、C分别为什么元素?
7N 8O 14P 16S
观察,可得 A是氮元素 B是氧元素 C是硫元素
第一章 物质结构 元素周期律
第一节 元素周期表 化 学 Ⅱ
回忆初中化学有关内容, 说说原子的结构。
原子
原子核
质子 (带正电) 中子 (不带电)
核外电子 (带负电)
核电荷数=质子数=电子数
回忆初中所学内容,如何表示某个原子的 结构?请画出1-20号元素的原子结构示意图。
+19 2 8 8 1 +20 2 8 8 2
第四周期:18 种元素 第五周期:18 种元素 第六周期:32 种元素 (镧系元素)
不完全周期 第七周期:26种元素 (锕系元素)
周期序数 = 电子层数
族
纵行
主族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
共七个主族
副族:ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB ,
金属性 Na 〉Mg 〉Al
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的 难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性 强弱。碱性越强,则原金属元素的金属性越强。
3、可以根据对应阳离子的氧化性强弱判断。金 属阳离子氧化性越弱,则元素金属性越强。
的还原性逐渐 增强,与水和氧气的反应越来 越 剧烈,生成的氧化物越来越 复杂。最 高价氧化物对应水化物的碱性越来越 。
《原子结构》原子结构与元素周期表课件 图文

年代 1911年
模型
卢瑟福 原子 模型
观点或理论
在原子的中心有一个带正电 荷的核,它的质量几乎等于 原子的全部质量,电子在它 的周围沿着不同的轨道运转, 就像行星环绕太阳运转一样。
年代 1913年
模型
玻尔原子 模型
1926~ 1935年
电子云 模型
观点或理论
电子在原子核外空间的一定 轨道上绕核做高速圆周运动。
(8)内层电子总数是最外层电子数2倍的原子有Li、P。 (9)电子层数与最外层电子数相等的原子有H、Be、Al 。 (10)电子层数是最外层电子数2倍的原子是Li。 (11)最外层电子数是电子层数2倍的原子有He、C、S。 (12)最外层电子数是电子层数3倍的原子是O。
【迁移·应用】 1.(2019·南京师大附中高一检测)下列各原子结构示 意图中所表示的核外电子排布正确的是 ( )
【解析】选D。A原子的M层比B原子的M层少3个电子,B 原子的L层电子数恰为A原子L层电子数的2倍,说明A、B 为第二、第三周期元素;L层最多排8个电子,B原子的L 层电子数恰为A原子L层电子数的2倍,说明B原子的L层 有8个电子,A原子的L层有4个电子,故A是碳原子;A原子 的M层比B原子的M层少3个电子,故B为铝原子。
2.用A+、B-、C2-、D、E、F和G分别表示含有18个电子 的七种微粒(离子或分子),请回答: (1)A元素是________,B元素是________,C元素是 ________(用元素符号表示)。 (2)D是由两种元素组成的双原子分子,其分子式是 ________。
知识点 核外电子的分层排布 【重点释疑】 1.原子核外电子排布规律及其之间的关系
2.原子核外电子排布的表示方法 (1)原子结构示意图。
《元素周期表 核素》原子结构与元素周期表PPT

栏目导航
2.下列各图若为元素周期表的一部分(表中数字代表原子序数), 其中合理的是 ( )
A
B
C
D
栏目导航
D [本题要求熟记周期表的结构,知道 1~18 号元素在周期表 中的具体位置。解题时可根据稀有气体 2 号、10 号元素应在周期表 的最右端和 3 号元素在周期表的最左端排除 A、B、C 三项。]
栏目导航
【典例】 1869 年,俄国化学家门捷列夫制作出了第一张元素 周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程 碑之一。下列有关元素周期表的说法正确的是( )
A.元素周期表含元素最多的族是第ⅢB 族 B.元素周期表有 18 个族 C.第ⅠA 族的元素全部是金属元素 D.短周期是指第一、二、三、四周期
栏目导航
4.下列说法错误的是( ) A.11H、21H、H+和 H2 是氢元素的四种不同粒子 B.4200Ca 和4220Ca、石墨和金刚石均为同素异形体 C.11H 和21H 是不同的核素 D.12C 和 14C 互为同位素,物理性质不同,但化学性质几乎完 全相同
栏目导航
B [元素的存在形式有游离态和化合态两种,A 项中的四种微 粒是氢元素的四种不同粒子,11H 和21H 是质子数均为 1,中子数不等 的不同的氢原子,它们是不同的核素;12C 和 14C 由于其质子数均为 6,而中子数分别为 6 和 8,故它们互为同位素,同理,4200Ca 和4220Ca 互为同位素其物理性质不同但化学性质几乎完全相同;金刚石与石 墨是由碳元素组成的不同的单质,它们互为同素异形体。]
栏目导航
核心突破 攻重难
栏目导航
认识元素周期表 1.元素周期表的结构
栏目导航
(1)记忆口诀 横行叫周期,现有一至七,四长三个短,第七已排满。纵列称 为族,共有十六族,一八依次现①,一零再一遍②。一纵一个族,Ⅷ 族搞特殊,三纵算一族,占去 8、9、10。镧系与锕系,蜗居不如意, 十五挤着住,都属ⅢB 族。 说明:①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ; ②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
2.下列各图若为元素周期表的一部分(表中数字代表原子序数), 其中合理的是 ( )
A
B
C
D
栏目导航
D [本题要求熟记周期表的结构,知道 1~18 号元素在周期表 中的具体位置。解题时可根据稀有气体 2 号、10 号元素应在周期表 的最右端和 3 号元素在周期表的最左端排除 A、B、C 三项。]
栏目导航
【典例】 1869 年,俄国化学家门捷列夫制作出了第一张元素 周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程 碑之一。下列有关元素周期表的说法正确的是( )
A.元素周期表含元素最多的族是第ⅢB 族 B.元素周期表有 18 个族 C.第ⅠA 族的元素全部是金属元素 D.短周期是指第一、二、三、四周期
栏目导航
4.下列说法错误的是( ) A.11H、21H、H+和 H2 是氢元素的四种不同粒子 B.4200Ca 和4220Ca、石墨和金刚石均为同素异形体 C.11H 和21H 是不同的核素 D.12C 和 14C 互为同位素,物理性质不同,但化学性质几乎完 全相同
栏目导航
B [元素的存在形式有游离态和化合态两种,A 项中的四种微 粒是氢元素的四种不同粒子,11H 和21H 是质子数均为 1,中子数不等 的不同的氢原子,它们是不同的核素;12C 和 14C 由于其质子数均为 6,而中子数分别为 6 和 8,故它们互为同位素,同理,4200Ca 和4220Ca 互为同位素其物理性质不同但化学性质几乎完全相同;金刚石与石 墨是由碳元素组成的不同的单质,它们互为同素异形体。]
栏目导航
核心突破 攻重难
栏目导航
认识元素周期表 1.元素周期表的结构
栏目导航
(1)记忆口诀 横行叫周期,现有一至七,四长三个短,第七已排满。纵列称 为族,共有十六族,一八依次现①,一零再一遍②。一纵一个族,Ⅷ 族搞特殊,三纵算一族,占去 8、9、10。镧系与锕系,蜗居不如意, 十五挤着住,都属ⅢB 族。 说明:①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ; ②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
元素周期律_PPT课件

f.最轻单质的元素:H;最轻的金属元素:Li。 g.单质常温下呈液态的元素:Br 和 Hg。 h.最高价氧化物对应水化物既能与强酸反应, 又能与强碱反应的元素:Al。 i.元素的气态氢化物和它的最高价氧化物对应的 水化物起化合反应的元素:N。 j.元素的单质在常温下能与水反应放出气体的 短周期元素:Li、Na、F。 k.常见的能形成同素异形体的元素:C、P、O、 S。
依次增强
解析 结合元素周期表考查元素周期律。容易判 断出 a 为 Na、b 为 Mg、c 为 C、d 为 O、e 为 S、f 为 Cl。以下各选项可据此判断。本题若不推出具体元 素,结合“位—构—性”也可作答。氢化物的稳定性 取决于元素的非金属性,d、e 是同族元素,非金属性 从上往下减弱,因而氢化物稳定性也减弱,A 错;同 一周期元素,半径从左到右逐渐减小,a>b>e,B 错; C 是第ⅣA 元素,性质最稳定,C 错;最高价氧化物 的水化物酸性取决于元素的非金属性,非金属性越强, 酸性越强,元素的非金属性:c<e<f,因此酸性依次 增强,D 对。
答案 B
考点二 “位”、“构”、“性”三者的 关系
“位、构、性”之间的三角关系
(1)结构与位置互推问题是解题的基础 ①掌握四个关系式 a.电子层数=周期数 b.质子数=原子序数 c.最外层电子数=主族序数 d.主族元素的最高正价=族序数,负价=主族序数 -8 ②熟悉常见离子的电子层结构 a.第二周期第ⅠA、ⅡA 族元素原子能形成稳定的 2 电子结构的离子。 b.除第二周期第ⅠA、ⅡA、ⅢA 族元素外的其他主 族元素原子能形成稳定的 8 电子结构(氢元素除外)。
相同
逐渐 增多
子 原子 结 半径
逐渐 减小
逐渐 增大
构
离子 半径
第一节元素周期表(共40张PPT)
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
第四章 物质结构 元素周期律(章末整理与提升)(人教版2019必修第一册)
3.(2022·全国·高一单元测试)X、Y、Z、M是四种短周期主族元素,其中X、 Y位于同一主族,Y与M、X与Z位于同一周期。X原子的最外层电子数是其电子 层数的3倍,Z原子的核外电子数比X原子的少1。M是同周期主族元素中半径最 大的。下列说法错误的是( B ) A.X、Y的最简单氢化物中,X的最简单氢化物子具有相同的质子数、电子数
,可能是同位素,A项正确;一种微粒的质子数、电子数与另一种微粒的质子 数、电子数均相等可能是同一种原子,B项正确;同位素是同一元素的不同原子 ,其原子具有相同的质子数、电子数,故可能是同一种元素,C项正确;分子 是中性微粒,离子是带有电荷的原子或原子团,若一种分子和一种离子的质子 数相同,则它们的电子数一定不相同,D项错误。
5.现有部分元素的性质或结构如下表:
X
与Mg同周期,最外层电子数是最内层电子数的3倍
Y
常温下单质为双原子分子,为黄绿色有毒气体
Z
单质紫黑色,遇淀粉溶液显蓝色
(1)X的原子结构示意图_________。
(2)Z在元素周期表中的位置_第__五__周___期__Ⅶ__A__族____。 (3)判断非金属性:X_<__Y(填“>”“<”或“=”,下同)。 (4)判断非金属性:Y_>__Z,写出结构上的原因_二__者__最__外__层__电___子__相__同__,__但__I_的__电__子_
【例题2】(2022·全国·高一单元测试)如图为某国外学术期刊上刊登的八角形元 素周期表,八角形的每个顶角对应一种元素,下列说法错误的是(C )
A.图中虚线八角形所标元素属于我们现行元素周期表的第四周期 B.图中虚线箭头所经过的元素按箭头,原子的电子层数增多 C.图中①代表的元素单质在常温下能稳定存在,不发生化学反应 D.此八角形元素周期表中所表示的所有元素中没有副族元素
第四章结构-物质结构元素周期律第二节元素周期表和元素周期律课件

最低负化合价= __-__(_8_-__主__族__序__数__) _
同主族(上→下) 逐渐_增__大_ 逐渐增___多_ 逐渐增__大__
逐渐_增__大__
相同,最高正化合价= _主__族__序__数___(O、F除外)
项目
元素的金属 性和非金属 性
离子的氧化 性、还原性
气态氢化物 稳定性
最高价氧化 物对应的水 化物的酸碱 性
三种元素在元素周期表中的相对位置可知a+8-1=b,a+8
+1=c,且b+c=4a,所以a=8,b=15,c=17,即A、B、
C分别是O、P、Cl。 答案:A
3.已知X、Y、Z三种主族元素在元素周期表中的
位置如图所示,设X的原子序数为a。则下a
B.Y的原子序数可能为a-17
族。下列说法中不正确的是
()
A.原子半径:Ga>As>P
B.热稳定性:NH3>PH3>AsH3 C.酸性:H3AsO4>H2SO4>H3PO4 D.Ga(OH)3可能是两性氢氧化物 解析:酸性:H2SO4>H3PO4>H3AsO4,故C项错误。 答案:C
2.下列粒子半径大小的比较正确的是 A.Na+<Mg2+<Al3+<O2- B.S2->Cl->Na+>Al3+ C.Na<Mg<Al<S D.Cs<Rb<K<Na
[归纳拓展] 由稀有气体元素的原子序数确定元素在周期表中位置 第一~七周期稀有气体元素的原子序数依次为2、10、 18、36、54、86、118。 确定主族元素在周期表中位置的方法:原子序数-最邻近 的稀有气体元素的原子序数=x。 若x<0,则与稀有气体元素同周期,族序数为8-|x|; 若x>0,则在稀有气体元素下一周期,族序数为x。 例如:①35号元素(最邻近的是 36Kr),则35-36=-1, 故周期数为四,族序数为8-|-1|=7,即第四周期第ⅦA族, 即溴元素;②87号元素(最邻近的是 86Rn),则87-86=1,故 周期数为七,族序数为1,即第七周期第ⅠA族,即钫元素。
同主族(上→下) 逐渐_增__大_ 逐渐增___多_ 逐渐增__大__
逐渐_增__大__
相同,最高正化合价= _主__族__序__数___(O、F除外)
项目
元素的金属 性和非金属 性
离子的氧化 性、还原性
气态氢化物 稳定性
最高价氧化 物对应的水 化物的酸碱 性
三种元素在元素周期表中的相对位置可知a+8-1=b,a+8
+1=c,且b+c=4a,所以a=8,b=15,c=17,即A、B、
C分别是O、P、Cl。 答案:A
3.已知X、Y、Z三种主族元素在元素周期表中的
位置如图所示,设X的原子序数为a。则下a
B.Y的原子序数可能为a-17
族。下列说法中不正确的是
()
A.原子半径:Ga>As>P
B.热稳定性:NH3>PH3>AsH3 C.酸性:H3AsO4>H2SO4>H3PO4 D.Ga(OH)3可能是两性氢氧化物 解析:酸性:H2SO4>H3PO4>H3AsO4,故C项错误。 答案:C
2.下列粒子半径大小的比较正确的是 A.Na+<Mg2+<Al3+<O2- B.S2->Cl->Na+>Al3+ C.Na<Mg<Al<S D.Cs<Rb<K<Na
[归纳拓展] 由稀有气体元素的原子序数确定元素在周期表中位置 第一~七周期稀有气体元素的原子序数依次为2、10、 18、36、54、86、118。 确定主族元素在周期表中位置的方法:原子序数-最邻近 的稀有气体元素的原子序数=x。 若x<0,则与稀有气体元素同周期,族序数为8-|x|; 若x>0,则在稀有气体元素下一周期,族序数为x。 例如:①35号元素(最邻近的是 36Kr),则35-36=-1, 故周期数为四,族序数为8-|-1|=7,即第四周期第ⅦA族, 即溴元素;②87号元素(最邻近的是 86Rn),则87-86=1,故 周期数为七,族序数为1,即第七周期第ⅠA族,即钫元素。
物质结构和元素周期律-PPT课件

答案:D
19
A.质子数为 7
B.最外层电子数为 2
C.核外电子数为 7
D.核外有 3 个电子层
解析:示意图中“+12”表示该原子质子数为 12,核外电子
共 12 个,电子排布情况为:最内层 2 个电子,次外层 8 个电
子,最外层 2 个电子,电子层数为 3,故应选 B、D。
答案:BD
9
大家有疑问的,可以询问和交流
4
典例剖析
【例 1·单选Ⅰ】下列说法正确的是( )。 A.同位素3648Se、6380Zn 具有相同的质量数 B.1210Na 与1119Na 互称为核素 C.氟元素的符号为197F D.同一元素的不同核素互称为同位素 解析:6384Se、6380Zn 质子数不同,不互为同位素,A 错误;2110Na 与1119Na 互称为同位素,B 错误;氟元素的符号为 F,C 错误。 答案:D
2
6.以ⅠA 和ⅦA 族为例,了解同一主族内元素性质递变规 律与原子结构的关系。
7.了解金属、非金属在元素周期表中的位置及其性质递变 的规律。
8.了解化学键的定义。了解离子键、共价键的形成。了解 化学反应的本质。
3
元素、核素、同位素
1.元素 元素是具有相同的___核__电__荷__数___(即__质__子__数__)的一类原子 的总称。 2.核素 核素是具有一定数目质子和一定数目中子的一种原子。 3.同位素 质子数___相__同___而中子数___不__同___的同一元素的不同原子 互称为同位素。
17
3.共价键 (1)定义:通过____共__用__电__子__对__而形成的相互作用。非金属 元素原子之间一般形成共价键。例如,
(2)共价键的分类。 ①非极性键:由同种元素原子形成的共价键,如 H-H 等。 ②极性键:由不同种元素原子形成的共价键,如 H-Cl 等。 4.化学反应的本质 化学反应的本质是旧化学键断裂,新化学键形成的过程。
第四章 物质结构 元素周期律总结提升-2024年秋高中化学人教版必修第一册PPT课件

20
21
返回目录
19. (2024·江苏省江阴高级中学期末)短周期主族元素A、B、C、D
的原子序数依次增大,A、C的原子序数相差8,A原子的最外层电子数
是其次外层电子数的3倍,B单质的焰色试验呈黄色。下列说法错误的是
(
A )
A. 阴离子的还原性:A n->C n-
B. A与B可形成两种化合物
C. 最高价氧化物对应的水化物的酸性:C<D
C. YX的水化物具有两性
D. W单质只有四种同素异形体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
返回目录
12. W、X、Y、Z均为短周期元素且原子序数依次增大,X和Z同族。盐
YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷的烧碱溶液作
用,可得到含YZW的溶液。下列说法正确的是( D )
第7题
C. 丙和庚原子的核外电子数相差13
D. 乙的单质在空气中燃烧生成只含离子键的化合物
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
返回目录
考点二
元素周期律
8. (2024·辽宁鞍山检测)硒(34Se)是第四周期第ⅥA族元素,由元
素周期表和元素周期律的知识,下列判断不正确的是(
2
3
4
5
6
7
8
9
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.第一电离能 气态电中性基态原子失去一个电子转化为气态基态正离子所 需要的 最低能量 ,符号: I1 ,单位: kJ·mol-1 。
2.规律 (1)同周期:第一种元素的第一电离能 最小 ,最后一种元素的 第一电离能 最大 ,总体呈现 从左至右逐渐增大 的变化趋势。 (2)同族元素:从上至下第一电离能 逐渐减小 。 (3)同种原子:逐级电离能越来越 大 (即 I1 < I2 < I3…)。
知识梳理·题型构建
元素的电离能表征原子核外电子的行为,因而它必定呈现周期性变化。一般 地,同一周期元素的 I1 基本上随原子序数的递增而增大,同一主族元素的 I1 从上到下一般趋于减小,这些都和元素金属性递变规律一致。有时候也有一 些反常和交错的现象,这跟过渡元素和镧系元素半径的收缩或出现轨道全充 满、半充满状态等因素有关。如:在比较元素的第一电离能时,要注意第ⅡA 族和第ⅤA 族较同周期相邻元素的第一电离能都大。
解析 A 中 N 原子 p 电子轨道属于半 充满状态,较稳定,其 I1 会出现反常; B 中 F 和 O,F 的原子半径较小,非金 属性氟>氧,因而 I1(氟)>I1(氧); C 中镁 3s 全满,较为稳定,I1 出现反常; D 中镁和钙最外层 ns2 均为全满,但金 属钙比镁多一个能层,钙的原子半径较 大,因而 I1(钙)<I1(镁)。
知识梳理·题型构建
题பைடு நூலகம்一
1
2
3
题组二
4
题组二 元素推断与元素逐级电离能
解析 (1)根据电离能的变化趋势知,Q 为稀有气体元素,R 为第ⅠA 族元素,S 为第ⅡA 族元素,T 为第ⅢA 族元素,U 为第ⅠA 族元素, 所以 R 和 U 处于同一主族。 (2)由于 U+为第ⅠA 族元素且比 R 电离能小,所以 U+的氧化性最弱。 (3)由于 Q 是稀有气体元素,所以氦的物理性质和化学性质与此最像。 (4)电离能的突跃变化,说明核外电子是分层排布的。若 U 是短周期元 素,则 U 是 Na,其核外电子排布式为 1s22s22p63s1,由于 2s22p6 所处 能层相同,所以它的第 2 次电离能飞跃数据发生在失去第 10 个电子时。 (5)同一周期,第一电离能呈增大趋势,但ⅡA、ⅤA 族比相邻元素要高, 因为其最外层电子呈全充满或半充满结构。
如果 U 元素是短周期元素,你估计它的第 2 次电离能飞跃数 据将发生在失去第___1_0__个电子时。
(5)如果 R、S、T 是同周期的三种主族元素,则它们的原子序 数由小到大的顺序是__R_<_S_<__T___,其中__S___元素的第一电离 能异常高的原因是 S 元素的最外层电子处于 s 能级全充满状 态,能量较低,比较稳定,失去一个电子吸收的能量较多 。
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组二 元素推断与元素逐级电离能 4.根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),
回答下列各题:
元素代号 Q
I1 2 080
I2 4 000
I3 6 100
I4 9 400
R
500
4 600 6 900 9 500
S
740
1 500 7 700 10 500
高考热点——电离能和电负性
[考纲要求] 1.了解电离能的含义,了解同一周期、同一主族中
元素第一电离能变化规律。 2.了解电负性的概念,知道元素的性质与电负性的关系。 重难点:电离能和电负性的应用。
知识梳理·题型构建
高考热点——电 离能和电负性
考点一 电离能 考点二 电负性
知识梳理·题型构建
I 考点一 电离能
知识梳理·题型构建
深度思考
1.为什么一个原子的逐级电离能是逐渐增大的? 答案 随着电子的逐个失去,阳离子所带的正电荷数越来越 大,再要失去一个电子需克服的电性吸力也越来越大,消耗的 能量越来越多。
2.为什么镁的第一电离能比铝的大,磷的第一电离能比硫的大? 答案 Mg:1s22s22p63s2 P:1s22s22p63s23p3。镁原子、磷原 子最外层能级中,电子处于全满或半满状态,相对比较稳定, 失电子较难。如此相同观点可以解释 N 的第一电离能大于 O, Zn 的第一电离能大于 Ga。
T
580
1 800 2 700 11 600
U
420
3 100 4 400 5 900
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组二 元素推断与元素逐级电离能
(1)在周期表中,最可能处于同一族的是____E____。
A.Q 和 R B.S 和 T C.T 和 U D.R 和 T E.R 和 U
(2)下列离子的氧化性最弱的是_____D___。
A.S2+
B.R2+
C.T3+
D.U+
(3)下列元素中,化学性质和物理性质最像 Q 元素的是__C____。
A.硼
B.铍
C.氦
D.氢
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组二 元素推断与元素逐级电离能 (4)每种元素都出现相邻两个电离能的数据相差较大的情况, 这一事实从一个侧面说明:电子分层排布,各能层能量不同 ,
知识梳理·题型构建
【递进题组】
题组一
1
2
3
题组二
4
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组一 元素电离能的判断及应用 1.下列元素中哪一个基态原子的第一电离能最大?
A.Be
B.B
C.C
D.N
( D)
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组一 元素电离能的判断及应用
2.在下面的电子结构中,第一电离能最小的原子可能是 ( C )
知识梳理·题型构建
深度思考
3.为什么 Na 容易形成+1 价离子,而 Mg、Al 易形成+2 价、+3 价离子?
答案 Na 的 I1 比 I2 小很多,电离能差值很大,说明失去第一个 电子比失去第二个电子容易得多,所以 Na 容易失去一个电子 形成+1 价离子;Mg 的 I1 和 I2 相差不多,而 I2 比 I3 小很多, 所以 Mg 容易失去两个电子形成+2 价离子;Al 的 I1、I2、I3 相 差不多,而 I3 比 I4 小很多,所以 Al 容易失去三个电子形成+3 价离子。而电离能的突跃变化,说明核外电子是分能层排布的。
A.ns2np3
B.ns2np5
C.ns2np4
D.ns2np6
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组一 元素电离能的判断及应用
3.同周期内不同元素的第一电
离能 I1 随着原子序数的增大 而增大,但个别元素的 I1 出 现反常现象。下列关系正确
的是
(A )
A.I1(氮)>I1(氧) B.I1(氟)<I1(氧) C.I1(镁)<I1(铝) D.I1(钙)>I1(镁)
2.规律 (1)同周期:第一种元素的第一电离能 最小 ,最后一种元素的 第一电离能 最大 ,总体呈现 从左至右逐渐增大 的变化趋势。 (2)同族元素:从上至下第一电离能 逐渐减小 。 (3)同种原子:逐级电离能越来越 大 (即 I1 < I2 < I3…)。
知识梳理·题型构建
元素的电离能表征原子核外电子的行为,因而它必定呈现周期性变化。一般 地,同一周期元素的 I1 基本上随原子序数的递增而增大,同一主族元素的 I1 从上到下一般趋于减小,这些都和元素金属性递变规律一致。有时候也有一 些反常和交错的现象,这跟过渡元素和镧系元素半径的收缩或出现轨道全充 满、半充满状态等因素有关。如:在比较元素的第一电离能时,要注意第ⅡA 族和第ⅤA 族较同周期相邻元素的第一电离能都大。
解析 A 中 N 原子 p 电子轨道属于半 充满状态,较稳定,其 I1 会出现反常; B 中 F 和 O,F 的原子半径较小,非金 属性氟>氧,因而 I1(氟)>I1(氧); C 中镁 3s 全满,较为稳定,I1 出现反常; D 中镁和钙最外层 ns2 均为全满,但金 属钙比镁多一个能层,钙的原子半径较 大,因而 I1(钙)<I1(镁)。
知识梳理·题型构建
题பைடு நூலகம்一
1
2
3
题组二
4
题组二 元素推断与元素逐级电离能
解析 (1)根据电离能的变化趋势知,Q 为稀有气体元素,R 为第ⅠA 族元素,S 为第ⅡA 族元素,T 为第ⅢA 族元素,U 为第ⅠA 族元素, 所以 R 和 U 处于同一主族。 (2)由于 U+为第ⅠA 族元素且比 R 电离能小,所以 U+的氧化性最弱。 (3)由于 Q 是稀有气体元素,所以氦的物理性质和化学性质与此最像。 (4)电离能的突跃变化,说明核外电子是分层排布的。若 U 是短周期元 素,则 U 是 Na,其核外电子排布式为 1s22s22p63s1,由于 2s22p6 所处 能层相同,所以它的第 2 次电离能飞跃数据发生在失去第 10 个电子时。 (5)同一周期,第一电离能呈增大趋势,但ⅡA、ⅤA 族比相邻元素要高, 因为其最外层电子呈全充满或半充满结构。
如果 U 元素是短周期元素,你估计它的第 2 次电离能飞跃数 据将发生在失去第___1_0__个电子时。
(5)如果 R、S、T 是同周期的三种主族元素,则它们的原子序 数由小到大的顺序是__R_<_S_<__T___,其中__S___元素的第一电离 能异常高的原因是 S 元素的最外层电子处于 s 能级全充满状 态,能量较低,比较稳定,失去一个电子吸收的能量较多 。
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组二 元素推断与元素逐级电离能 4.根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),
回答下列各题:
元素代号 Q
I1 2 080
I2 4 000
I3 6 100
I4 9 400
R
500
4 600 6 900 9 500
S
740
1 500 7 700 10 500
高考热点——电离能和电负性
[考纲要求] 1.了解电离能的含义,了解同一周期、同一主族中
元素第一电离能变化规律。 2.了解电负性的概念,知道元素的性质与电负性的关系。 重难点:电离能和电负性的应用。
知识梳理·题型构建
高考热点——电 离能和电负性
考点一 电离能 考点二 电负性
知识梳理·题型构建
I 考点一 电离能
知识梳理·题型构建
深度思考
1.为什么一个原子的逐级电离能是逐渐增大的? 答案 随着电子的逐个失去,阳离子所带的正电荷数越来越 大,再要失去一个电子需克服的电性吸力也越来越大,消耗的 能量越来越多。
2.为什么镁的第一电离能比铝的大,磷的第一电离能比硫的大? 答案 Mg:1s22s22p63s2 P:1s22s22p63s23p3。镁原子、磷原 子最外层能级中,电子处于全满或半满状态,相对比较稳定, 失电子较难。如此相同观点可以解释 N 的第一电离能大于 O, Zn 的第一电离能大于 Ga。
T
580
1 800 2 700 11 600
U
420
3 100 4 400 5 900
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组二 元素推断与元素逐级电离能
(1)在周期表中,最可能处于同一族的是____E____。
A.Q 和 R B.S 和 T C.T 和 U D.R 和 T E.R 和 U
(2)下列离子的氧化性最弱的是_____D___。
A.S2+
B.R2+
C.T3+
D.U+
(3)下列元素中,化学性质和物理性质最像 Q 元素的是__C____。
A.硼
B.铍
C.氦
D.氢
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组二 元素推断与元素逐级电离能 (4)每种元素都出现相邻两个电离能的数据相差较大的情况, 这一事实从一个侧面说明:电子分层排布,各能层能量不同 ,
知识梳理·题型构建
【递进题组】
题组一
1
2
3
题组二
4
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组一 元素电离能的判断及应用 1.下列元素中哪一个基态原子的第一电离能最大?
A.Be
B.B
C.C
D.N
( D)
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组一 元素电离能的判断及应用
2.在下面的电子结构中,第一电离能最小的原子可能是 ( C )
知识梳理·题型构建
深度思考
3.为什么 Na 容易形成+1 价离子,而 Mg、Al 易形成+2 价、+3 价离子?
答案 Na 的 I1 比 I2 小很多,电离能差值很大,说明失去第一个 电子比失去第二个电子容易得多,所以 Na 容易失去一个电子 形成+1 价离子;Mg 的 I1 和 I2 相差不多,而 I2 比 I3 小很多, 所以 Mg 容易失去两个电子形成+2 价离子;Al 的 I1、I2、I3 相 差不多,而 I3 比 I4 小很多,所以 Al 容易失去三个电子形成+3 价离子。而电离能的突跃变化,说明核外电子是分能层排布的。
A.ns2np3
B.ns2np5
C.ns2np4
D.ns2np6
知识梳理·题型构建
题组一
1
2
3
题组二
4
题组一 元素电离能的判断及应用
3.同周期内不同元素的第一电
离能 I1 随着原子序数的增大 而增大,但个别元素的 I1 出 现反常现象。下列关系正确
的是
(A )
A.I1(氮)>I1(氧) B.I1(氟)<I1(氧) C.I1(镁)<I1(铝) D.I1(钙)>I1(镁)
