第七章 还原反应
合集下载
药物合成反应_第七章_还原反应

肼NH2-NH2或二酰亚胺NH=NH,可选择性还原非极性重键(如C=C、碳碳叁键、N=N), 而不影响极性重键(如C=N、腈基、硝基等)。
Ph
C
C
Ph
NH2 NH2 Cu2 + 空气
Ph CH2CH2 Ph
(80%)
烯 ︑ 炔 烃 的 还 原
C7H7SO2NHNH2 CH2 CH CH2 S S CH2 CH CH2 △ C3H7SSC3H7
硝基可被还原为氨基,常用的条件为铁粉+酸、锌或锡+酸、硫化物(如Na2S,Na2S2等)。
O2N
C C C H H O COOEt Fe/HOAc EtOH+H2O NO2
NH2 COOEt
Fe/NH4Cl
H2N
C C C H H O NH2 Na2S
NH2
NO2
硝 基 的 还 原
NO2 NH2
NO2
NaBH4-AlCl3不影响硝基;
HOOO (CH2)4 COOEt
B2H6 / THF -18 C, 10h
0
HOCH2 (CH2)4 COOEt
(88%)
硼烷或乙硼烷与羧基反应最快,如果控制低温和用量,可选择性优先还原羧基而不影响硝
基、卤素、酰卤、氰基、酯基、醛、酮等,选择性非常优秀。
4
硝基的还原 肟和亚甲胺的还原 偶氮、叠氮的还原
OH
NO2
饱 和 醛 酮 的 活 性 大 于 α,β-不 饱 和 醛 酮
2
醇铝为还原剂(Meerwein-Ponndorf-Verley反应)
在异丙醇铝中,醛、酮被还原为醇,取而代之的是异丙醇被氧化为丙酮;此反应可看做是 Oppenauer氧化的逆反应。
第七章 氢化和还原反应

H3C HC CH3 OH
NH2
H2/Pd/C 50~60℃
C O
+ HCl
H2/Pd/C C2H5OH
COOH + CH3
优点:反应易于控制,产品纯度较高,收率 较高,三废少,在工业上应用广泛。 缺点:需要使用带压设备,安全措施要求高, 催化剂的选择要求严格。
7.2.2 非均相催化氢化反应历程
C C
C C
O C OH
O O
芳杂环
O C H
O C
N
C N
催化氢解
在催化剂存在下,含有碳杂键的有机物 分子与氢气反应,发生碳杂键断裂,分解成 两部分氢化产物的反应叫做催化氢解。
催 化 剂 H2
C Z
C H + HZ
Z=X, O, S
H3C HC CH2
O
NO2 C O Cl
COO CH2
催 化 剂 H2
在碱性介质中对硝基化合物的双分子还原
X H2N X NH2
X= H, CH3, Cl, OCH3
OHH+
2ArNO2 + 5Zn + H2O Ar-NH-NH-Ar
Ar-NH-NH-Ar + 5ZnO
H2N-Ar-Ar-NH2
第一阶段:100~105℃,碱浓度12~13% ArNO2 → ArNO → ArNHOH Ar-N=N-Ar O 第二阶段:90~95℃,碱浓度% Ar-N=N-Ar → Ar-NH-NH-Ar O 第三阶段:酸性条件 Ar-NH-NH-Ar → H2N-Ar-Ar-NH2
催化剂 Cu/SiO2、Cu/浮石、Cu/Al2O3 工艺 200~300℃ 固定床、流化床 实例
第七章还原反应7课件1

N
LiAlH4 LiBH4 NaBH4 KBH4
+
+
+
+
+
-
-
-
+
-
-
-
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+2)
+2)
+
+
+
+
RSSR 或 RSO2Cl
RSH
+
+
+
+
1). 脂肪族(RCOOR1)被还原成RCH2OH+R1OH 2). 还原成氧化偶氮化合物Ph-N=NPh
2+02表4年示8月能1日还星期原四,-
原
CN
实
例
CH2CN N
Cl
COOH
CH2NH2 Cl
供氢体
2024年8月1日星C期H四=CHCOOCH3
催化 剂
Pd
产物 CH3CH2(CH2)5CH3
收率 %
70
Pd
CH3CH2CH2Ph
90
Pd-C H2N
COCH3 98
Pd-C Pd-C
O2N
80 NH2
CH3
90
Pd-C N
Pd-C H
CH2CH3
所有非均相催化反应都在催化剂表面进行
影响催化反应的因素:反应物的浓度、反应温度、压力、 搅拌、催化剂的表面面积、助催与中毒现象等
非均相催化反应的过程:五个连续步骤
1). 作用物分子向催化剂界面扩散 2). 作用物分子在催化剂表面吸附(物理吸附和化学吸附) 3). 作用物分子在催化剂表面进行化学反应 4). 产物分子在催化剂表面解吸 5). 产物分子在从催化剂界面向介质扩散解吸
LiAlH4 LiBH4 NaBH4 KBH4
+
+
+
+
+
-
-
-
+
-
-
-
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+2)
+2)
+
+
+
+
RSSR 或 RSO2Cl
RSH
+
+
+
+
1). 脂肪族(RCOOR1)被还原成RCH2OH+R1OH 2). 还原成氧化偶氮化合物Ph-N=NPh
2+02表4年示8月能1日还星期原四,-
原
CN
实
例
CH2CN N
Cl
COOH
CH2NH2 Cl
供氢体
2024年8月1日星C期H四=CHCOOCH3
催化 剂
Pd
产物 CH3CH2(CH2)5CH3
收率 %
70
Pd
CH3CH2CH2Ph
90
Pd-C H2N
COCH3 98
Pd-C Pd-C
O2N
80 NH2
CH3
90
Pd-C N
Pd-C H
CH2CH3
所有非均相催化反应都在催化剂表面进行
影响催化反应的因素:反应物的浓度、反应温度、压力、 搅拌、催化剂的表面面积、助催与中毒现象等
非均相催化反应的过程:五个连续步骤
1). 作用物分子向催化剂界面扩散 2). 作用物分子在催化剂表面吸附(物理吸附和化学吸附) 3). 作用物分子在催化剂表面进行化学反应 4). 产物分子在催化剂表面解吸 5). 产物分子在从催化剂界面向介质扩散解吸
第七章还原 一节

第七章 还原反应
(reduction reaction)
一、还原反应定义:
在化学反应中,使有机分子中碳原子总的氧化态降低的反应 称为还原反应;即在还原剂的作用下,能使有机分子得到电子 或使参加反应的碳原子上的电子云密度增加的反应。(可看作 为有机分子中加氢或减少氧的反应)。
二、分类:
按 还 原 方 法
三、硼氢化钠还原羧酸机理
氢负离子还原机理
O R C OH + NaBH4 O 4 R C O B Na
3
O
4R
C
O
B3 Na + H2
+ 2NaBH4
4
RCH2O 2H2O
B3 Na + 2NaBO2
4RCH2OH + NaBO 2
O 机理:R C R
OBH3 Na
O ℃
NaBH4 -I2 95
℅
THF ,0-25
℃
CH3(CH2)8COOH
CH3(CH2 )8CH2OH
℅
4. 采用卡特缩合剂(BOP reagent)NaBH4体系可以很容易的实现羧酸的选择性还原, 而-NO2、-CN、-COOR等不被还原。
COOH
OH
BOP reagent NaBH4,THF
OH
陈宁等对ZrCl-NaBH4 体系还原羧酸作了系统 的研究,研究内容包括苯甲酸、月桂酸、水杨酸、 硬脂酸、已二酸等的还原,均获得了较高的收率。
3. 以NaBH4-I2体系还原羧酸时,室温条 件下反应,可以获得较高的收率。
需要注意的是,当苯环上为相邻的羧基 和脂基时,只有羧酸被还原。
COOH CO2Et NaBH4 -I2 THF ,0-25 OH CO2Et 82
(reduction reaction)
一、还原反应定义:
在化学反应中,使有机分子中碳原子总的氧化态降低的反应 称为还原反应;即在还原剂的作用下,能使有机分子得到电子 或使参加反应的碳原子上的电子云密度增加的反应。(可看作 为有机分子中加氢或减少氧的反应)。
二、分类:
按 还 原 方 法
三、硼氢化钠还原羧酸机理
氢负离子还原机理
O R C OH + NaBH4 O 4 R C O B Na
3
O
4R
C
O
B3 Na + H2
+ 2NaBH4
4
RCH2O 2H2O
B3 Na + 2NaBO2
4RCH2OH + NaBO 2
O 机理:R C R
OBH3 Na
O ℃
NaBH4 -I2 95
℅
THF ,0-25
℃
CH3(CH2)8COOH
CH3(CH2 )8CH2OH
℅
4. 采用卡特缩合剂(BOP reagent)NaBH4体系可以很容易的实现羧酸的选择性还原, 而-NO2、-CN、-COOR等不被还原。
COOH
OH
BOP reagent NaBH4,THF
OH
陈宁等对ZrCl-NaBH4 体系还原羧酸作了系统 的研究,研究内容包括苯甲酸、月桂酸、水杨酸、 硬脂酸、已二酸等的还原,均获得了较高的收率。
3. 以NaBH4-I2体系还原羧酸时,室温条 件下反应,可以获得较高的收率。
需要注意的是,当苯环上为相邻的羧基 和脂基时,只有羧酸被还原。
COOH CO2Et NaBH4 -I2 THF ,0-25 OH CO2Et 82
第七章还原反应(精)

(69%)
(C=C取代基增多,氢化明显下降)
C7H7SO2NHNH2
CH2 CH CH2 S S CH2 CH CH2
△
C3H7SSC3H7 (93%)
(用其他方法还原多导致二硫键断裂)
2 均相催化氢化
OH (Ph3P)3RhCl / H2 / PhH
OH (90%)
CH3 O (Ph3P)3RhCl / H2
n-BuCH2CH2BH2
n-BuCH=CH2 b
(n-BuCH2CH2)2BH
n-BuCH=CH2 c
(n-BuCH2CH2)3B
反应速度:a>b>c
(2)
X
2 BH3 CH CH2
X
CH2 CH2 B + X
CH CH3
B
X=-OCH3 91%
9%
当X为供电子基时,更有利单硼化物生成
当烯烃碳原子上取代基数目相等时,取
Coupling
Pinacol Coupling
Blanc Reduction
• 溶解金属还原的一般过程:双电子化,双 质子化。
伯奇还原
金属钠溶解在液氨中可得到一种蓝色的溶液,它 在醇的存在下,可将芳香化合物还原成1,4-环己二烯 化合物,该还原反应称为伯奇还原。
Na NH3(l) C2H5OH
EtOH/HCl/H2O 93%
7%
EtOH/KOH 35-50% 65-50%
(2) 炔、烯的选择性加氢及立体化学
O
O
AcO
Pd / CaCO3 / H2
1kg / cm2, 450C
AcO H
(85%)
(避孕药双炔失磺酯中间体)
(位阻小的一面加氢)
第七章 还原反应

第七章 还原反应
• 一、概述 • 1.定义: 在化学反应中,使有机物分子中碳原子总的氧
化态降低的反应称还原反应。 • 在还原剂的作用下,使有机物分子得到电子或使参加反
应的碳原子上的电子云密度增加的反应称还原反应。 • 有机分子增加氢或减少氧的反应。
3.应用
意义: NO2
O
NH2
C
OH
C
CC
H
CH CH OH
10036,U.S.A
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
多相氢化因素:
a 催化剂:活性高 稳定性 不易中毒,再生 用量 Ni 10%~15%被催化物质质量 Pd/C 1%~5%被催化物质质量 Pt 0.5%~1%被催化物质质量
载体:为增大催化剂的表面在催化剂制备中加入的多孔物质
氯霉素
Ph
C H
C H
CHO Al(OEt)3 Ph EtOH
C H
C H
CH2OH
还原有选择性
第四节 羧酸及其衍生物的还原二酯及酰胺的还原1 酯还原成醇
1 酯还原成醇
①金属复氢化合物为还原剂
(a)LiAiH4 O
R C OR' + LiAiH4
R
OAlH3 C OR'
-AlH3(OR')
H
酯:LiAiH4=1:0.5
Al-Ni+NaOH H2O Na2AlO4+Ni+H2↑
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
亚当斯1889年生于美国波士顿,1908年毕业于哈佛大学,曾 在柏林E·费歇尔实验室从事博士后研究工作。这一年的国外学习为 他以后一生的事业奠定了基础,使他成长为美国化学界最有代表性的 人物之一
• 一、概述 • 1.定义: 在化学反应中,使有机物分子中碳原子总的氧
化态降低的反应称还原反应。 • 在还原剂的作用下,使有机物分子得到电子或使参加反
应的碳原子上的电子云密度增加的反应称还原反应。 • 有机分子增加氢或减少氧的反应。
3.应用
意义: NO2
O
NH2
C
OH
C
CC
H
CH CH OH
10036,U.S.A
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
多相氢化因素:
a 催化剂:活性高 稳定性 不易中毒,再生 用量 Ni 10%~15%被催化物质质量 Pd/C 1%~5%被催化物质质量 Pt 0.5%~1%被催化物质质量
载体:为增大催化剂的表面在催化剂制备中加入的多孔物质
氯霉素
Ph
C H
C H
CHO Al(OEt)3 Ph EtOH
C H
C H
CH2OH
还原有选择性
第四节 羧酸及其衍生物的还原二酯及酰胺的还原1 酯还原成醇
1 酯还原成醇
①金属复氢化合物为还原剂
(a)LiAiH4 O
R C OR' + LiAiH4
R
OAlH3 C OR'
-AlH3(OR')
H
酯:LiAiH4=1:0.5
Al-Ni+NaOH H2O Na2AlO4+Ni+H2↑
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
亚当斯1889年生于美国波士顿,1908年毕业于哈佛大学,曾 在柏林E·费歇尔实验室从事博士后研究工作。这一年的国外学习为 他以后一生的事业奠定了基础,使他成长为美国化学界最有代表性的 人物之一
chapter还原反应

PhCH=CHCO2Na
Na-Hg H2O
PhCH2CH2CO2Na H+ PhCH2CH2CO2H
1.以甲苯和C3以下的有机物合成PhCH2CH(Li、Na 、K)与液氨、醇组成的混合物进行的还原 谓Birch还原。碱金属在液氨中的溶解度次序为:Li>K>Na。 醇作为质子供给剂。进行还原时,务必除去存在于未经蒸馏的液 氨中的铁盐及其它杂质,少量的这些杂质将促进金属氢化物的 形成,从而抑制碱金属的还原。由于有机反应物在液氨中溶解 度较小,往往于反应体系中加入除去过氧化物和水的干醚和THF 等溶剂溶解。
镁汞齐能还原酮为相应的仲醇,并发生双分子还原反应 生成片呐醇。
1.Mg-Hg/PhH
2 (CH3)2C=O 2.H2O
(CH3)2C C(CH 3)2 OH OH
2PhC=O 1.Al-Hg /THF Ph2C CPh2
2.H2O
OH OH
O + (CH3)2C=O Mg-Hg
Ti C l4
CH3 C CH3 OH OH
NaHB4, LiAlH4, Al(OCH(CH3)2)3: 羰基还原成羟基, 不还原双键 Mg(-Hg) /苯; 双分子还原,得到邻二醇
Zn-Hg/HCl: 羰基---亚甲基 与羰基 共轭的双键也被还原
NH2NH2 + NaOH/O(CH2CH2OH)2 Fe+HCl, 如果芳环上有易被还原的羰基(如醛基),用SnCl2+HCl 较好
O CH3 Na,NH3 EtO H
O CH3
Li ,EtNH2
EtO H Na,NH3
1,4-二氢萘
EtO H
1,4,5,8 四氢萘
COOH Na,NH3 EtO H
第七章 还原反应

H R
H R
R C C R
2) HOAc
在硼烷对烯键的还原反应中,硼烷可视为亲电性氢负离子还原剂, 它首先对富电子的烯键发生亲电进攻,随后将氢负离子转移至烯键上。
金属氢化物还原剂一般对烯键无还原作用,但炔键可被LiAlH4还原 成E-烯烃,如果相邻位置上有羟基(αorβ-炔醇)时,还原反应大大加 速。这可能与羟基参与配位形成环状中间体有关。使用1:2LiAlH4NaOCH3时可增加还原反应的立体选择性,其原因目前尚未弄清。
H H
NH3
H H
H
H
H H
例如:长效避孕药18-甲基炔诺酮(norgestrel)中间体(12)的制备 中,采用了Birch还原。
OH
Li / NH 3 / Et2O -40℃ , 30min
PhCH
CHCN
NaBH4 / BiCl3 95%乙醇
PhCH2CH2CN
(90%)
经过研究证实,它们是首先形成硼烷而发挥其还原作用的。
THF
3 NaBH4 + BiCl3
2B2H6 + NaCl + Bi
7.1. 2 芳烃的还原
苯为难以氢化的芳烃。稠环芳烃(如萘、蒽、菲)的氢化活性大于苯 环。取代苯(如苯酚、苯胺)的活性也大于苯。在乙酸中用铂作催化剂时, 取代基的活性为AcOH>ArNH2>ArH>AcCOOH>AcCH3。不同的催化剂 有不同的活性次序。用铂、钌催化剂可在较低的温度和压力下氢化,而钯 则需较高的温度和压力。例如,苯甲酸催化氢化可生成环己基甲酸:
CO O H
H 2 / 5% P h-C 145~160℃ , 3.92M Pa
COOH
(95% )
酚类氢化可得环己酮类化合物,这是制备取代环己酮类简捷的方法。 如2,4-二甲基苯酚氢化得2,4-二甲基环己酮。
第七章 还原反应(Reduction reaction)

+
CH2OH
+
+
+
+
(ro内酯)
CH2OH
+
ROH
+
+
1
+
HNR2
+ + + + + + + +
15
RCH2OH RCHO CH2NH2 or CHO CH=NH
反应的功能基(底物)生成的功能基(产物) LiAlH4 C R NOH NO2 R C HNH2 NH2 CH3
+
LiBH4
+
NaBH4 KBH4
10
在金属原子上有件大的负电荷,如果在中央金属周围存在给电子 的配位体,如Hө、Clө等则有利于Mn+1…H2ө的形成。通常,若配 合物中央金属原子存在空轨道和处于低氧化态时,更有利于氢的 活化。 H-H键的断裂可以通过异裂或均裂两种方式。由异裂产生的 H-能取代配合物中的负离子(通常是卤素离子),而本身结合到 配合物中去。例如:
+ + +
Mn-2
+
RH2
+
(c) RH2 (d) (e) (f)
Mn(RH) RH Mn(RH)
2 Mn-1 Mn-1 MnX
+ +
RH2 RH2
三、负氢离子转移还原 第三族元素硼、铝等的氢化物,可以氢负离子的形式与不 饱和键加成,得一配合物离子,进而与质子结合而完成加氢还
13
原过程。
H H B H H
9
上述过程可能有不同的途径。 (1)氢的活化 氢的活化为催化氢化关键性的步骤。氢分子十分稳定,离 解能高达109Kcal/mol(1cal=4.1840J)。但当与中央金属配 合时,可显著降低断裂键能。氢分子的活化途径有两种:氢分 子作为电子给与体,将部分成键电子转移到中央金属的空轨道 上去以形成σ-配键;氢分子作为电子接受体,中央金属将部分 电子转移到氢分子的反键轨道,形成反馈键。这类过渡态的两 种极端形式(受电子或给电子)可用Mn-1…H2⊕和Mn+1…H2ө来表 示(M示中央金属。在H2ө和H2⊕中H-H键断裂能量分别为62k cal/mol和18.6kcal/mol。达到低于普通未活化氢分子的键断 裂能量。 形成Mn-1…H2⊕过渡态,配合物中金属原子必须具有低能量 的空轨道,第Ⅷ族过渡金属具有此种空轨道;形成Mn+1…H2ө 过渡态,电子必须由金属原子转移到氢分子的反键轨道,这就
第七章 还原反应

第七章 还原反应
7.1 催化氢化
7.2 碳—碳不饱和键的还原
7.3 芳环、杂环的还原 7.4 羰基化合物的还原 7.5 羧酸及其衍生物的还原 7.6 含氮化合物的还原
还原反应:为有机化合物中的不饱和键进行加
氢,以及对分子中与碳原子相连的原子和
基团用氢去置换的反应。
还原反应类型:催化氢化;化学还原;电解
碳-碳叁键属最容易氢化基团,反应条件较温和, 从工业制备价值看,炔烃氢化主要是选择性氢化,
使反应终止在烯烃阶段
RCHC CCH2R' B2H6 RCH2CH R'CH2C 3 B CH3COOH H H H2C C C H CH2 R'
若用钠在液氨中则得到反式烯烃。
RCHC CCH 2R' 2Na NH 3 RCH 2 Na C C Na CH2R' 2NH3 RCH 2 H C C H CH 2 R'
+ 2CH 3CH 2ONa
2CH 3CH2OH H
H
苯甲醚用金属钠在液氨中还原得到3,6-二氢苯甲醚,
在酸性溶液中水解,经酸催化异构化可得环己烯-3-酮。 典型还原反应可用于(±)硫辛酸的合成。
OCH3 (1)BuLi (2) CH2 CH2 O OCH3 CH2CH2OH Na , NH3 EtOH OCH3 CH2CH2OH
COOH Na , NH3 EtOH
OC2H5 Na-EtOH
β-乙氧基萘
COOH
OC2H 5 H 2O,H +
92%
O
四氢酮-2
OCH 3 (1)Na-EtOH H3CO (2)H O
OCH3
7.3.2 杂环催化氢化还原
CH3 H 2 ,Pa/C, CH 2COOH,CH3COONa 55-70 ℃,0.2MPa Cl CH3
7.1 催化氢化
7.2 碳—碳不饱和键的还原
7.3 芳环、杂环的还原 7.4 羰基化合物的还原 7.5 羧酸及其衍生物的还原 7.6 含氮化合物的还原
还原反应:为有机化合物中的不饱和键进行加
氢,以及对分子中与碳原子相连的原子和
基团用氢去置换的反应。
还原反应类型:催化氢化;化学还原;电解
碳-碳叁键属最容易氢化基团,反应条件较温和, 从工业制备价值看,炔烃氢化主要是选择性氢化,
使反应终止在烯烃阶段
RCHC CCH2R' B2H6 RCH2CH R'CH2C 3 B CH3COOH H H H2C C C H CH2 R'
若用钠在液氨中则得到反式烯烃。
RCHC CCH 2R' 2Na NH 3 RCH 2 Na C C Na CH2R' 2NH3 RCH 2 H C C H CH 2 R'
+ 2CH 3CH 2ONa
2CH 3CH2OH H
H
苯甲醚用金属钠在液氨中还原得到3,6-二氢苯甲醚,
在酸性溶液中水解,经酸催化异构化可得环己烯-3-酮。 典型还原反应可用于(±)硫辛酸的合成。
OCH3 (1)BuLi (2) CH2 CH2 O OCH3 CH2CH2OH Na , NH3 EtOH OCH3 CH2CH2OH
COOH Na , NH3 EtOH
OC2H5 Na-EtOH
β-乙氧基萘
COOH
OC2H 5 H 2O,H +
92%
O
四氢酮-2
OCH 3 (1)Na-EtOH H3CO (2)H O
OCH3
7.3.2 杂环催化氢化还原
CH3 H 2 ,Pa/C, CH 2COOH,CH3COONa 55-70 ℃,0.2MPa Cl CH3
第七章 还原反应

*通常,比旋度和立体异构体的组成成线性关系,如忽略测定 的实验误差,则%e e和%op两者数值应相等。
Chapter 7 Reduction Reaction
③立体选项百分率(不对称合成百分率): 当产物为一非对映异构体时用立体选项百分率表示。
立体选择(选向)性与立体专一性的区别: 前者选择性(或选向率)大于0,小于100%;后者选向 率或产品关学纯度为100%。一般生物反应具有立体专一性特 征。
Chapter 7 Reduction Reaction
一、手性醛、酮的不对称还原(Cram规则)
对于手性醛、酮,根据手性碳上连接基团性质的差异,其 立体控制途径可分为三类模型: 1.开链模型
O
Z
M
S
R'
LR
OZ
M
S
R
R'
L
Chapter 7 Reduction Reaction
开链模型要点说明:
② 还原试剂包括金属氢化物、醇铝(也包含格氏试剂同 类)将从所成环空间阻碍较小的一边(S所在一边)对羰基进 行加成,从而决定反应的立体选择性;
③ 环状模型中影响立体选择性的因素较之开链模型要复 杂一些,除了手性碳基团与前手性中心羰基之间的立体效应和 电子效应以外,还可能受反应试剂、溶剂、温度等因素的影响。
Chapter 7 Reduction Reaction
不对称反应(合成)效率的表示: 一种立体异构体在产品中占优势的程度。
根据不同的检测方法,可有不同几种表达形式: ①光学纯度百分率(percent optical purity):
②对映体过量百分率(percent enatiomeric excess):
Chapter 7 Reduction Reaction
Chapter 7 Reduction Reaction
③立体选项百分率(不对称合成百分率): 当产物为一非对映异构体时用立体选项百分率表示。
立体选择(选向)性与立体专一性的区别: 前者选择性(或选向率)大于0,小于100%;后者选向 率或产品关学纯度为100%。一般生物反应具有立体专一性特 征。
Chapter 7 Reduction Reaction
一、手性醛、酮的不对称还原(Cram规则)
对于手性醛、酮,根据手性碳上连接基团性质的差异,其 立体控制途径可分为三类模型: 1.开链模型
O
Z
M
S
R'
LR
OZ
M
S
R
R'
L
Chapter 7 Reduction Reaction
开链模型要点说明:
② 还原试剂包括金属氢化物、醇铝(也包含格氏试剂同 类)将从所成环空间阻碍较小的一边(S所在一边)对羰基进 行加成,从而决定反应的立体选择性;
③ 环状模型中影响立体选择性的因素较之开链模型要复 杂一些,除了手性碳基团与前手性中心羰基之间的立体效应和 电子效应以外,还可能受反应试剂、溶剂、温度等因素的影响。
Chapter 7 Reduction Reaction
不对称反应(合成)效率的表示: 一种立体异构体在产品中占优势的程度。
根据不同的检测方法,可有不同几种表达形式: ①光学纯度百分率(percent optical purity):
②对映体过量百分率(percent enatiomeric excess):
Chapter 7 Reduction Reaction
第七章还原反应

第七章还原反应
镍的基本原料是镍—铝合金,其中镍的含量一般在30 %—50%,其镍—铝合金组成的变化,以及在Raney镍的 制备过程中所用碱的浓度、反应温度、反应时间和洗涤 催化剂的条件等方面的差异,可以得到不同活性的Raney 镍。 Raney镍的制备方法可用下列反应式表示
常用的w—2型催化剂的制备过程如下:
5.铂催化剂 铂催化剂包括铂黑、铂/炭和二氧化铂。二氧化铂最为常用, 在使用时将其还原成铂,被称为Admas(克拉姆)催化剂
配料比 氯铂酸:水:纯硝酸钠=1.00:2.86:10.00
第七章还原反应
6.亚铬酸铜(CuCr2O4)催化剂 亚铬酸铜催化剂实际上是多种成分的混合物,CuCr2O4并不能表示其全 部组成。 制法如下:
• 2.被还原物结构的影响
第七章还原反应
3.反应温度和压力的影响
反应温度增高,氢压加大,反应速度也相应加快.但也容易引起副 反应增多,反应选择性下降。
第七章还原反应
4.溶剂的极性与酸碱度的影响
催化剂的活性通常随着溶剂的极性和酸性的增加而增强。低压
催化氢化常用的溶剂有乙酸乙酯、乙醇、水、醋酸等。同一催化 剂在这些溶剂中所表现出来的活性顺序是
配料比 氯化钯:活性炭(处理过):水:浓盐酸:
37%甲醛水溶液=1.00:11.34:146.342.44(V):0.98(V)
第七章还原反应
4.Lindlar催化剂 配料比 氯化钯:浓盐酸:碳酸钙:0.7mol.L-1甲酸 钠水溶液: 8.3%醋酸铅三水合物溶液= 1.00:2.43:12.16:7.09(v):12.06(v)
高压催化氢化不能用酸性溶剂,以免腐蚀高压釜。常用的 溶剂为乙醇、水、环己烷、甲基环已烷、1,4—二氧六环 等。 介质的酸碱度不仅可影响反应速度和选择性,而且对产物的构型 也有较大的影响。 选用的溶剂沸点应高于反应温度,并对产物有较大的溶解度, 这样有利于产物从催化剂表面解吸出来。
第七章 还原反应
H3CO H3CO CH3 CO(CH2)9OAc OCH3 H2, Pd/C H3CO H3CO OCH3 O ClCO(CH2)9OAc H3CO H3CO OCH3 CH3 H3CO H3CO O CH3 (CH2)10OH CH3 (CH2)10OAc -Ac [O]
还原成醇的反应p378 二、还原成醇的反应
O NH2NH2/KOH N H
O
O H2NNH2. H2O kOH O
△
N H
85%
盐酸胺碘酮中间体
分子中存在的双键不受影响
O 85%H2NNH2 H2O/KOH/TEG 180-200oC
(三)催化氢化还原
O FG R H2/Pd-C H+ FG R
芳香醛、 芳香醛、酮的还原 加压、酸性条件下, 加压、酸性条件下,有利于羰基还原成甲基或亚甲基 条件温和,无副产物 条件温和,
第七章 还原反应
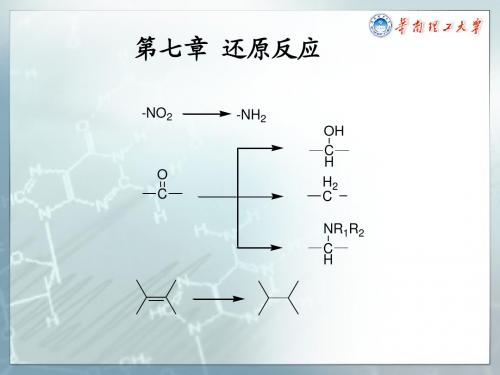
-NO2 -NH2
O C
OH C H H2 C NR1R2 C H
羰基( 的还原反应p374 第三节 羰基(醛、酮)的还原反应
H2 C
(芳香环上引入碳链) 芳香环上引入碳链)
O C
OH C H NR1R2 C H
一、还原成烃的反应
O C
H2 C
(一) Clemmensen还原(酸性条件) 一 还原( 还原 酸性条件)
Leuckart胺烷基化反应 胺烷基化反应p383 胺烷基化反应
R C O + HCOONH4 R'
甲酸铵
R CH R'
NH2
R C O + HCOONR1R2 R'
N-烷基取代甲酰胺 烷基取代甲酰胺
R CH R'
还原成醇的反应p378 二、还原成醇的反应
O NH2NH2/KOH N H
O
O H2NNH2. H2O kOH O
△
N H
85%
盐酸胺碘酮中间体
分子中存在的双键不受影响
O 85%H2NNH2 H2O/KOH/TEG 180-200oC
(三)催化氢化还原
O FG R H2/Pd-C H+ FG R
芳香醛、 芳香醛、酮的还原 加压、酸性条件下, 加压、酸性条件下,有利于羰基还原成甲基或亚甲基 条件温和,无副产物 条件温和,
第七章 还原反应
-NO2 -NH2
O C
OH C H H2 C NR1R2 C H
羰基( 的还原反应p374 第三节 羰基(醛、酮)的还原反应
H2 C
(芳香环上引入碳链) 芳香环上引入碳链)
O C
OH C H NR1R2 C H
一、还原成烃的反应
O C
H2 C
(一) Clemmensen还原(酸性条件) 一 还原( 还原 酸性条件)
Leuckart胺烷基化反应 胺烷基化反应p383 胺烷基化反应
R C O + HCOONH4 R'
甲酸铵
R CH R'
NH2
R C O + HCOONR1R2 R'
N-烷基取代甲酰胺 烷基取代甲酰胺
R CH R'
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.1 催化氢化
催化氢化:分子氢在催化剂作用下,将不饱和 键或基团转化为饱和键与基团的还原反应。
优点:反应定向进行,副反应少、产品质量好、
产率高。生产能力大,对解决环境污染问 题有明显的优越性。 缺点:对生产装置和工业控制的要求较高, 需要优良的催化剂和氢气来源。
机理:首先,在催化剂作用下氢气分解为氢原子、 并吸附在催化剂上。其次,氢原子进攻烯烃双键 碳,使烯烃双键打开,氢原子与其中一个碳原子 成键,另一个吸附在催化剂上的氢原子也与另一
酯族化合物。
N Na EtOH N PhCOCl NaOH N COPh 77-81%
COOH OH
Na , -C5H11OH
COOH COOH 43-50%
OH Li-NH3-EtOH
OH
苯环上有推电子基团,如烃基、烷氧基、胺
基等时,使苯环钝化(苯甲醚除外),致使质子
化发生在2,5位,得3,6-二氢化物。
+ 2CH 3CH 2ONa
2CH 3CH2OH H
H
苯甲醚用金属钠在液氨中还原得到3,6-二氢苯甲醚,
在酸性溶液中水解,经酸催化异构化可得环己烯-3-酮。 典型还原反应可用于(±)硫辛酸的合成。
OCH3 (1)BuLi (2) CH2 CH2 O OCH3 CH2CH2OH Na , NH3 EtOH OCH3 CH2CH2OH
还原。
在精细有机合成中,以化学还原法为主。有
机分子中的氢化反应是所有合成中发展水
平最高的反应。其选择性方面的知识也是
遥遥领先。
还原剂:氢气。低价金属盐,如TiCl3, TiCl2等。
还原性的金属:Li,Na,Mg,Ca,Zn
金属或金属配位催化剂:Ni,Pd,Pt,Ru, Rh, LiAlH4,NaBH4,B2H6 低价态化合物:(N2H4, N2H2,Ph3P,MeS, Na2S2O4,HO-CH2-SO3Na即SFS)。 催化剂活性:Pt>Rh>Ni>Ru, 反应速率跟压力、温度及溶剂有关。
COOH Na , NH3 EtOH
OC2H5 Na-EtOH
β-乙氧基萘
COOH
OC2H 5 H 2O,H +
92%
O
四氢酮-2
OCH 3 (1)Na-EtOH H3CO (2)H O
OCH3
7.3.2 杂环催化氢化还原
CH3 H 2 ,Pa/C, CH 2COOH,CH3COONa 55-70 ℃,0.2MPa Cl CH3
第七章 还原反应
7.1 催化氢化
7.2 碳—碳不饱和键的还原
7.3 芳环、杂环的还原 7.4 羰基化合物的还原 7.5 羧酸及其衍生物的还原 7.6 含氮化合物的还原
还原反应:为有机化合物中的不饱和键进行加
氢,以及对分子中与碳原子相连的原子和
基团用氢去置换的反应。
还原反应类型:催化氢化;化学还原;电解
溶剂的存在不仅起溶解分散作用,而且帮助减
轻和较好的控制放热反应。但溶剂对反应速
度和选择性是有影响的。
低压氢化常用溶剂为乙酸乙酯、乙醇、水、醋
酸等,它们在反应中的活性次序是:
• CH3CO2C2H3>H20>C2H5OH>CH3COOH
• 催化剂的影响 其它条件一定时,催化剂用量增加一倍,反应 速度可增加5—10倍。使用大比例的催化剂, 可使反应在极低压力和温度下反应,可避免 剧烈条件下的副反应,提高选择性。 催化剂用量的选择,据被氢化物的性质、反应 类型、反应条件、催化剂种类等确定。
O H3C (CH2)3 C C (CH2)8 O C CH3 H2,Pd -BaSO4 顺式98% O O C CH3
• 环状炔烃部分氢化后,主要得顺式环烯烃。
Pd , H2 C C H C C Cis H 93%
若用钠在液氨中还原,则得反式烯烃。
Na , 液氨 C C H C C H tras 73%
RCH=CH2
H Ph3P Rh CO H Ph3P H Rh CO
插入
Ph3P CO
RCHCH3 Rh PPh3
H2 还原 -H
PPh3
RCHCH3 PPh3
消除
Ph3P H
CO Rh PPh3 + RCH2CH3
• 均相氢化对位阻很敏感,优先催化氢化位
阻小的双键。(Ph3P)3Rh(CO)H对末端双 键的氢化具有高度的选择性。 • 优点:不发生异构化、歧化氢解等副反应
由于催化剂对有机合成化合物的不饱和键以л吸附为
主,氢原子只能从一面进攻,以顺式加成产物为主。
机理:属于非均相催化,主要是吸附、脱附
CH3 CH3 + H2 催化剂 H CH3 H CH3
双键碳原子上取代基愈多反应速度愈慢。取代基大分子 易扭曲不利于表面吸附。同分异构物中反应次序是:
CH3CH2CH CH2 > CH3CH CH CH3 > H3C H3C C CH2
O (1)PhCOCl (2)H
O CH2CH 2OCOPh H 2-Pt CH 2CH2OCOPh CH 3CO 3H
CO O CH 2CH 2OCOPh
OH
NH COOH (1) H 2 + HS C CH 2CH2OCOPh NH HO (2)OH
SH
SH FeCl3 S
HO2C (CH2)4 CH CH2CH3
个吸附在催化剂上的碳原子成键。第三,生成新
的化合物从催化剂上脱下来成为生成物,图示如下。
C C H2 H C C H H C C H 脱附 H H C C
7.1.1 各类官能团的催化氢化 几乎所有不饱和官能团均可用催化氢化的方 法还原,只是难易不同而已。 类型:对分子中的一个或多个不饱和键(如双 键、叁键、羰基、氰基、硝基、芳环等)加 氢,即加氢反应; 通过催化氢化把碳杂原子间的键打断,并重 新构成C—H键。即氢解反应。
7.1.2 影响催化氢化的因素
温度对氢化反应速率影响
几乎所有氢化反应都是大约温度每升高10—20℃,
速度增加一倍。温度越低,催化剂选择性越显著。
压力的影响 低压氢化用于双键、叁键加氢和硝基、羰基 还原,高压氢化用于苯环、杂环加氢和羧酸 衍生物的还原。 压力增高,可加快反应速度,但选择性降低。
• 溶剂的影响
CH 2CO2C2H 5
芳烃在液氨中被金属锂(或钠)与醇部分还原的反
应在有机合成中占重要地位。这个反应是1949年
澳大利亚有机化学家伯奇(A.J.Birch)发现的, 称为Birch还原。苯的Birch还原产物为非共轭的 环己烯。
Na,NH3(液) C2H5OH
反应机理: Na + NH3
e R
Na + + e -(NH3 ) (氨溶剂化的电子很活泼)
(CH2)4COOH S ( + )硫辛酸
烷基取代苯,经钠、氨还原为3,6-二氢化物。锂的胺 溶液在有醇存在时还原也得3,6-二氢化物。无醇存
在时双键位移成共轭状态,进一步还原成四氢化物。
CH3 Na , NH3 EtOH CH3 83%
苯环或萘环上如有羟基、氨基或羧基等具活泼
氢原子的基团取代时可以氢化。甚至可开环成
H
H
H
H
苯环上有推电子基团,如烃基、烷氧基、胺基等时, 使苯环钝化(苯甲醚除外),致使质子化发生在2,5位,得
3,6-二氢化物。
OCH3
OCH3 Na,液氨 CH 3CH2OH OCH3
Na , NH3 EtOH
OCH3 H Na,液氨 CH3CH 2OH H H
OCH3
79%
OCH3 H H H
H H R Na, H H H R R/OH
H
H R H
R
R/OH
-
锂、液氨与芳环作用机理为:还原也是是由电子 转移开始的。芳环从从碱金属得到一个电子, 从醇夺得质子,成为中性游离基,再接收一个 电子转变为负离子,最后质子化,生成二氢化
合物,反应机理如下:
H Li, 液氨 CH 3OH H H H H Li, 液氨 H H H CH 3OH
7.2烯、炔类化合物催化氢化还原 7.2 1烯烃类化合物的催化氢化 烯烃结构对双键的氢化有显著影响,由于取代基
的增多,阻碍了双键在催化剂表面的吸附,造
成反应速率上的差别。可选择合适的催化剂用
来分离双键位置不同的烯烃,也可在同一分子
中进行选择性氢化。
HP)RhCl OH
羰基易于还原生成相应的醇和次甲基,但比
碳—碳双键,叁键的还原要困难一些,脂
肪链上的羰基比苯环上羰基容易还原些。
而芳环上的羰基又比脂肪族上的羰基容易
进行催化氢化
7.4.1 金属催化氢化还原
脂肪族醛、酮在Pt、Ni、Rh等催化下将羰基 还原成醇
C4H9CHO H2 5% Ru / C C2H5OH-H2O C4H9CH2OH
碳-碳叁键属最容易氢化基团,反应条件较温和, 从工业制备价值看,炔烃氢化主要是选择性氢化,
使反应终止在烯烃阶段
RCHC CCH2R' B2H6 RCH2CH R'CH2C 3 B CH3COOH H H H2C C C H CH2 R'
若用钠在液氨中则得到反式烯烃。
RCHC CCH 2R' 2Na NH 3 RCH 2 Na C C Na CH2R' 2NH3 RCH 2 H C C H CH 2 R'
N
N
吡啶及其衍生物容易从金属接受一个电子生成阴离 子游离基,用金属作催化剂在质子性溶剂中将吡啶 环还原,而不还原芳环。
Na-C2H5OH N 或 Sn -HCl
PhCOCl NaOH
NH
四氢异喹啉
Na-C 2H5OH N N H
