绿色荧光蛋白gfp的激发波长
gfp绿色荧光蛋白序列_概述及解释说明

gfp绿色荧光蛋白序列概述及解释说明1. 引言1.1 概述GFP(绿色荧光蛋白)是一种具有独特发光特性的蛋白质,被广泛应用于细胞和分子生物学领域。
其绿色荧光可以通过外源激活而观察到,使得科学家们能够可视化细胞内发生的过程,并实时跟踪靶标分子的定位与转移。
GFP的序列是理解其结构、功能以及应用关键的基础。
1.2 文章结构本文将从多个方面对GFP绿色荧光蛋白序列进行概述及解释说明。
首先,我们将介绍GFP的历史和发现过程,以及其在现代生物学中的重要性。
随后,我们将详细探讨GFP序列的组成和编码基因信息,并解析与功能相关性方面的研究进展。
最后,我们将阐述GFP序列在生物学研究中的广泛应用,并就目前存在的问题和未来发展进行思考。
1.3 目的本文旨在提供有关GFP绿色荧光蛋白序列的全面概述及解释说明,深入探讨其组成、结构、功能和应用,并对其未来发展进行展望。
通过本文的阐述,读者将能够更好地理解和应用GFP序列在生物学领域中的价值,为相关研究提供指导和启示。
同时,我们也希望通过此文促进对GFP技术的探索和创新,推动生物科学的不断发展。
2. GFP绿色荧光蛋白序列概述2.1 GFP简介GFP(Green Fluorescent Protein)绿色荧光蛋白是一种来自于海洋水母的蛋白质。
它的主要特点是能够发出绿色荧光,并且在非生物致死条件下仍然保持稳定。
由于这些特性,GFP成为了生物学领域中一种广泛使用的标记工具。
2.2 GFP的发现历程GFP最早是在1960年代末期由奥斯汀·盖因斯、罗德南·麦迪安和道格拉斯·普里肯特等科学家在研究水母Aequorea victoria时发现的。
他们观察到当GFP暴露在紫外线下时会发出绿色荧光,并且将其提取出来进行进一步研究。
随后,科学家们发现GFP能够自身形成一个染色体,而不需要其他辅助物质。
2.3 GFP的结构特征GFP的序列长约238个氨基酸残基,具有高度保守性。
增强型绿色荧光蛋白的色谱分离和纯化

成 功构 建菌 株 E.c o l i D H 5 c #p UC 1 8 - E GF P的基 础
mL / mi n 。柱温 为 2 5℃ 。收集 流 出组分 , 经 紫外 、 荧 光 检测 器检 测 。紫外检 测波 长为 2 8 0 n m; 荧光 检 测
凝胶 排 阻 色谱 分 离 目标 蛋 白质 , 获取 高纯 度 EG F P
H i s T r a p HP色谱 柱 , 连 入 HP L C系 统 , 洗 脱 缓 冲 液
A液 为 l 0 mmo l / L咪 唑 缓 冲 液 ( p H 7 . 4) ,B 液 为 5 0 0 mmo l / L的 咪 唑 缓 冲液 ( p H 7 . 4 ) 。用 1 0~1 5 个 柱体 积 的 A液平衡 H i s T r a p HP柱 , 至基 线平 稳 。 将 菌体 破碎 上 清 液 过 0 . 4 5 m 滤膜后, 取1 mL上 样 。用 A 液 与 B 液 进 行 洗 脱 , 0~4 0 mi n内, 从
・
1 5 2・
色
谱
第 3 1 卷
报 道 。Wa r d等 ¨ 使用 S e p h a d e x G 一 7 5色 谱 柱分 离 得到 G F P 。罗文 新 等 从 厦 门 水 域 的大 型 多 管 水 母 中, 采用 色谱柱 T S K GE L S W3 0 0 0分 离 到新 的绿 色荧 光蛋 白 G F P x m。曲 萍等 构 建 了原 核 表达 载 体 p G E X 4 T . 1 . E GF P, 转化 大 肠杆 菌 B L 2 1 ( DE 3) p L y s S , 经 异丙 基硫代 一 D- 半 乳糖 苷诱 导表 达 , 用 谷 胱甘 肽 ( G S T ) . S e p h a r o s e 4 B色 谱 分 析法 纯 化 含 有
常见tag蛋白标签介绍
蛋白标签之阿布丰王创作蛋白标签(proteintag)是指利用DNA体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和纯化等。
随着技术的不竭发展,研究人员相继开发出了具有各种分歧功能的蛋白标签。
目前,这些蛋白标签已在基础研究和商业化产品生产等方面得到了广泛的应用。
美国GeneCopoeia(复能基因)为客户提供50多种蛋白标签,可以满足客户的分歧需求,包含各种最新型的标签,如:SNAP-Tag™、Halo Tag™、AviTag™、Sumo等;也提供齐全的各种经常使用标签,如eGFP、His、Flag等等标签。
以下是部分蛋白标签的特性介绍,更加详细的介绍可在查询克隆产品的结果列内外面看到各种推荐的蛋白标签和载体。
TrxHISHis6是指六个组氨酸残基组成的融合标签,可拔出在目的蛋白的C末端或N末端。
当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。
组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
使用His-tag有下面优点:•标签的分子量小,只有~0.84KD,而GST和蛋白A分别为~26KD和~30KD,一般不影响目标蛋白的功能;•His标签融合蛋白可以在非离子型概况活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;•His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;•His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫并制备抗体。
•可应用于多种表达系统,纯化的条件温和;•可以和其它的亲和标签一起构建双亲和标签。
Flag标签蛋白Flag标签蛋白为编码8个氨基酸的亲水性多肽(DYKDDDDK),同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高。
绿色萤光蛋白

绿色萤光蛋白(green fluorescent protein),简称GFP,这种蛋白质最早在一种学名Aequorea victoria的水母中发现。
其基因所产生的蛋白质,在蓝色波长范围的光线激发下,会发出绿色萤光。
这个发光的过程中还需要冷光蛋白质Aequorin的帮助,且这个冷光蛋白质与钙离子(Ca+2)可产生交互作用。
由水母Aequorea victoria中发现的野生型绿色萤光蛋白,395nm和475nm分别是最大和次大的激发波长,它的发射波长的峰点是在509nm,在可见光绿光的范围下是较弱的位置。
由海肾(sea pansy)所得的绿色萤光蛋白,仅有在498nm有一个较高的激发峰点。
在细胞生物学与分子生物学领域中,绿色萤光蛋白基因常被用作为一个报导基因(reporter gene)。
一些经修饰过的型式可作为生物探针,绿色萤光蛋白基因也可以克隆到脊椎动物(例如:兔子上进行表现,并拿来映证某种假设的实验方法。
我们这边细胞组的基本上都在用这个东东。
标记细胞GFP的分子结构和发光机制绿色荧光蛋白为一个由238个氨基酸残基组成的单链,GFP有两个吸收峰,主峰在395nm,次峰在470nm,其荧光发射峰在509nm。
GFP 的化学性质相当稳定,其变性需要在90℃或pH<4或pH>12的条件下用6mollL盐酸胍处理,这一性质与GFP的结构特性相关。
Yang等的研究表明,GFP是由两个相当规则的内含一个α-螺旋和外面包围l1个β-折叠的β-桶状结构组成的二聚体,β-桶状结构直径约3nm,高约4nm。
β折叠彼此紧密结合,象桶板一样形成桶状结构的外围,并且形成了一个规则的氢键带。
桶状结构和位于其末端的短α螺旋以及环状结构一起组成一个单独的致密结构域,没有可供扩散的配体进入缝隙。
这种坚实的结构保证了其稳定和抗热、抗变性的特点。
GFP的生色基团附着于α-螺旋上,几乎完美的包被于桶状结构中心。
位于圆桶中央的α-螺旋含有一个由六肽组成的发光中心,而发光团是由其中的三肽Ser65-Tyr66-Gly67经过环化形成了对羟基苯咪唑啉酮。
绿色荧光蛋白

GFP作为标记蛋白的优点
①荧光稳定 ②检测方便 ③无种属特异性,也无有细胞种类和位置的限制 ④GFP对受体细胞基本无毒害 ⑤易于构建载体,不受假阳性干扰 ⑥不需任何反应底物和辅助因子 ⑦可制成永久标本
绿色荧光蛋白
绿色荧光蛋白的分子生物学 及其应用
绿色荧光蛋白的研究史
1962年Shimomure等首先从维多利亚水母(Aequorea Victoria) 中分离出了GFP (Green-Fluorescent Protein) 。
维多利亚水母 (Aequorea Victoria)
A test tube containing a sample of a cyan (greenish-blue) fluorescent protein from a sea anemone illuminated by ultra-violet light from below.
பைடு நூலகம்
GFP发色团的骨架在左边。蛋白质链形成一个圆柱形罐头(蓝色),子链的一部分 直接从中间穿过(绿色),发色团刚好在罐头盒的中间,它被保护起来以免受周围环境 的影响。这种保护对于发射荧光是必需的。一但发色团吸收一个光子,激活的水分子通 常就会夺取它的能量。但是在蛋白质内部改为发射能量稍低的光子来释放能量,使它得 到了保护。发色团(右图)由蛋白质链上的三个氨基酸:甘氨酸,酪氨酸和苏氨酸(或 丝氨酸)自发形成。
绿色荧光蛋白的研究史
1994年Chalfie等首次在大肠杆菌细胞和线虫中表达了 GFP,开创了GFP应用研究的先河。
对绿色荧光蛋白(GFP)的了解及应用

对绿色荧光蛋白的了解及应用学院:生命科学学院姓名:马宗英年级:2011学号:2011012923前言绿色荧光蛋白(green fluorescent protein),简称GFP,是一种具有奇妙特性的“光学蛋白质”。
这种蛋白质从成分和结构上来说,没有丝毫的特殊性,它的组成单元是20种常见的氨基酸,二级结构也是普通的α螺旋和β片层。
但是,这种蛋白质却具有一个非常特别的性质——发出绿色荧光。
【关键词】绿色荧光蛋白生命科学应用一、绿色荧光蛋白绿色荧光蛋白最早是由下村修等人于1962年在一种学名Aequorea victoria的水母中发现的。
其基因所产生的蛋白质,在蓝色波长范围的光线激发下,吸收蓝光的部分能量,发出绿色荧光。
野生型水母GFP的一级序列已由其cDNA序列推导出来[1],它至少存在4种同源GFP,但这些突变并不影响GFP的基本功能,只是使突变的GFP具有了新的性质。
生色团是GFP发出荧光的物质基础,也是GFP结构中的一个重要组成部分。
GFP的生色团位于氨基酸序列64~69位的六肽内,65~67位的丝氨酸、脱氢酪氨酸、甘氨酸通过共价键形成的对羟基苯甲基咪唑环酮是一个独特的、相当稳定的环状三肽结构,构成了GFP生色团的核心[2],见图1。
图2为生色团的形成机制。
图1 多管水母中GFP生色团的化学结构和附近序列图2生色团的形成机制目前人们对GFP的荧光发光机制并不十分清楚,大家只是认为,GFP是生物发光过程中的能量受体,并且是最终的发光体,不同的生物发光机制各不相同,不同的突变体发光机制也有很大差异。
二、GFP在生命科学中的应用1、作为蛋白质标签(protein tagging)利用绿色荧光蛋白独特的发光机制,可将GFP作为蛋白质标签(protein tagging),即利用DNA重组技术,将目的基因与GFP基因构成融合基因,转染到合适的细胞中进行表达,然后借助荧光显微镜便可对标记的蛋白质进行细胞内的活体观察。
常见tag蛋白标签介绍

蛋白标签蛋白标签(proteintag)是指利用DNA体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和纯化等。
随着技术的不断发展,研究人员相继开发出了具有各种不同功能的蛋白标签。
目前,这些蛋白标签已在基础研究和商业化产品生产等方面得到了广泛的应用。
美国GeneCopoeia(复能基因)为客户提供50多种蛋白标签,可以满足客户的不同需求,包括各种最新型的标签,如:SNAP-Tag™、Halo Tag™、AviTag™、Sumo等;也提供齐全的各种常用标签,如eGFP、His、Flag等等标签。
•标签的分子量小,只有~0.84KD,而GST和蛋白A分别为~26KD和~30KD,一般不影响目标蛋白的功能;•His标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;•His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;•His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫并制备抗体。
•可应用于多种表达系统,纯化的条件温和;•可以和其它的亲和标签一起构建双亲和标签。
Flag标签蛋白Flag标签蛋白为编码8个氨基酸的亲水性多肽(DYKDDDDK),同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高。
FLAG作为标签蛋白,其融合表达目的蛋白后具有以下优点:•FLAG作为融合表达标签,其通常不会与目的蛋白相互作用并且通常不会影响目的蛋白的功能、性质,这样就有利用研究人员对融合蛋白进行下游研究。
•融合FLAG的目的蛋白,可以直接通过FLAG进行亲和层析,此层析为非变性纯化,可以纯化有活性的融合蛋白,并且纯化效率高。
•FLAG作为标签蛋白,其可以被抗FLAG的抗体识别,这样就方便通过Western Blot、ELISA等方法对含有FLAG的融合蛋白进行检测、鉴定。
阿拉伯糖诱导绿色荧光蛋白的表达

分子生物学实验报告阿拉伯糖诱导绿色荧光蛋白的表达阿拉伯糖诱导绿色荧光蛋白的表达摘要绿色荧光蛋白(green fluorescent protein),简称GFP,这种蛋白质最早是由下村修等人在1962年在一种学名Aequorea victoria的水母中发现。
绿色荧光蛋白(GFP)基因来自海底生物多孔水母,该基因表达产物在紫外光照射下可发出绿色荧光。
现已将该基因克隆到阿拉伯糖启动子驱动的原核表达pGLO中,通过阿拉伯糖的诱导,可使该基因在细菌中进行表达。
GFP融合蛋白的荧光灵敏度远比荧光素标记的荧光抗体高,抗光漂白能力强,因此更适用于定量测定与分析。
关键字:绿色荧光蛋白阿拉伯糖操纵子前言由水母Aequorea victoria中发现的野生型绿色荧光蛋白,395nm和475nm分别是最大和次大的激发波长,它的发射波长的峰点是在509nm,在可见光绿光的范围下是较弱的位置。
由海肾(sea pansy)所得的绿色荧光蛋白,仅有在498nm 有一个较高的激发峰点。
在细胞生物学与分子生物学领域中,绿色荧光蛋白基因常被用作为一个报导基因(reporter gene)。
一些经修饰过的型式可作为生物探针,绿色荧光蛋白基因也可以克隆到脊椎动物(例如:兔子上进行表现,并拿来映证某种假设的实验方法。
2008年10月8日,日本科学家下村修(伍兹霍尔海洋生物学研究所)、美国科学家马丁·查尔菲(哥伦比亚大学)和钱永健(加利福尼亚大学圣迭戈分校)因为发现和改造绿色荧光蛋白而获得了当年(2008)的诺贝尔化学奖。
实验目的1.学习用诱导物诱导外源基因的表达。
2.学习感受态细胞的制备和转化。
实验材料、试剂及仪器实验材料GFP质粒DNA、感受态大肠杆菌实验试剂实验仪器恒温摇床、无菌操作台(含酒精灯.)、紫外灯、灭菌锅、电泳仪、1.5ml 离心管、培养皿、PCR扩增仪、台式离心机、紫外分析仪恒温水浴、冷冻离心机、平衡天平、微量移液器等实验步骤<一>GFP质粒DNA的提取与P38质粒提取方法相同。
gfp激发光波长和发射光波长

gfp激发光波长和发射光波长GFP激发光波长和发射光波长:深入探究引言绿色荧光蛋白(GFP)是一种非常流行的荧光蛋白家族成员,自从1990年首次从水螅上分离出来以来,已经成为生物技术和分子生物学领域的研究热点。
GFP 是一种蛋白质,能够在特定条件下发出特定颜色的荧光,广泛应用于荧光显微镜和融合蛋白质表达等领域。
在使用GFP时,有两个重要的概念需要了解,即GFP 激发光波长和发射光波长。
本文将介绍这两个概念的定义和相关背景知识,并探讨它们对GFP应用的影响。
第一部分:GFP的背景知识GFP的背景知识我们不必过多赘述,因为它在分子生物学和生物技术领域已被广泛运用,但我们仍然需要介绍一下它的简要历史和结构。
GFP的简要历史GFP最初是在1962年从海葵(Aequorea victoria)的触手中分离出来的。
然而,由于当时在结构和化学组成方面的技术限制,GFP的分子结构和工作机制一度不为人们所知。
1990年,Martin Chalfie等人成功地将GFP引入到线虫(Caenorhabditis elegans)的基因表达研究中。
随后,Douglas Prasher和Roger Tsien分别研究GFP的发射光波长和在其他生物系统中的应用。
由于这些重要研究的贡献,GFP成为了分子生物学和生物技术领域的研究热点,并在2008年赢得了化学领域的诺贝尔奖。
GFP的结构GFP是由一个238个氨基酸残基组成的蛋白质,其分子结构的最重要特点是三个环状结构。
这三个环状结构共同构成了GFP的一个色团(chromophore),这个色团是GFP能够发出荧光的根本原因,因此这个结构是研究GFP的重要关键之一。
值得一提的是,GFP虽然是从海葵中分离出来的,但它实际上是一种正常存在于海葵内的分子。
海葵在需要发出荧光时,GFP就会在细胞中储存并释放出来,所以GFP对于海葵来说就像是一种反应器,而我们可以通过基因工程技术在其他生物体系中引入这个反应器,从而实现在生物学中的应用。
转染绿色荧光蛋白表达载体

• 肿瘤发病机制的应用 • GFP 与目的基因融合,将目的基因标记为 绿色,即可定量分析目的基因的表达水平 ,显示其在肿瘤细胞内的表达位置和量的 变化,为探讨该基因在肿瘤发生、发展中 的作用及其分子机制提供便利条件。
转染原理
• 脂质体也称人工细胞膜,是由脂质双分子层组成的。在水 中可以自动生成闭合的双层膜,最初 ,人们只是运用脂质 体模拟生物膜 ,研究膜的构造及功能 ,后来发现了膜的融合 及内吞作用 ,因而可用作外源物质进入细胞的载体。 • 现商品化的脂质体通常都是阳离子脂类和中性脂类的复合 体。其中以阳离子脂类起主要作用,阳离子脂质体既能与 DNA可以通过静电作用形成脂-DNA复合物,也能被表面 带负电荷的细胞膜吸附。从而引导DNA进入细胞。 • 本次用脂质体为invitrogen公司Lipofectamine® 2000
• 而F64L点突变则改善了GFP在37℃的折叠能力, 综上就产生了增强型GFP,分也是钱永健的功劳。现在有蓝色荧光蛋 白(EBFP)、青色荧光蛋白(ECFP)和 黄色荧光蛋白(YFP) • 于2008年获得诺贝尔奖
• 作为一种新型的报告基因,GFP已在生物 学的许多研究领域得到应用。 • 将GFP作为蛋白质标签,即利用DNA重 组 技术,将目的基因与GFP基因构成融合基 因,转染合适的细胞进行表达,然后借助 荧光显微镜便可对标记的蛋白质进行细胞 内活体观察。 • 利用GFP来检测目标蛋白的定位为我们提 供了一种对细胞内的一些基本的生理过程 进行更详尽观察的新方法。
转染绿色荧光蛋白表达载体
• 绿色荧光蛋白(GFP)是1962年从水母中发现的一个荧光 蛋白,1992年被克隆,近年得到广泛应用。其分子中的发 光基团对蓝色光照特别敏感。当它受到蓝光照射时,会吸 收蓝光的部分能量,然后发射出绿色的荧光。
3绿色荧光蛋白GFP研究进展

万方数据2004年6月绿色荧光蛋白(GFP)研究进展71随着生命科学和医学研究的不断深入,研究者们迫切需要一种能够在活体中表达且易于检测的报告基因,现有的报告基因主要有:分泌型胎盘磷酸酯酶(s秘P)、B一半乳糖苷酶(互丑cz)、8一葡糖苷酸酶(GUS)、萤火虫荧光素酶(LUc)等,但这些基因的检测方法并不理想,它们都需要底物和辅助因子,因而在活体中的应用受到限制。
最近,一种全新的非酶性报告基因——绿色荧光蛋白(GFP)引起了人们的关注,该蛋白能够自身催化形成发色结构并在蓝光激发下发出绿色荧光。
作为报告基因,GFP是目前唯一能在活细胞中表达的发光蛋白;作为荧光标记分子,GFP既具有敏感的标记检测率,又没有放射性的危害。
最近又发现G即还是一个良好的细胞间信号传递的动态标记分子,可以跟踪观测第二信使。
近来关于GFP方面的研究和综述越来越多,但多是针对某一方面的特点或应用,作者将cFP基础理论和应用研究进展作一简要综述。
lGFP基础理论研究进展1.1发展历史1962年蹦n舢u飓等…首先从多管水母属(枷ria、ricto.ria)中分离出了cFP;1992年Prasller等u3克隆了GFP基因的cDNA,并分析了GFP的一级结构;1994年ch址e等b3首次在大肠杆菌细胞和线虫中表达了GFP,开创了GFP应用研究的先河,之后很快发现GFP能在多种异源细胞中表达,GFP在细胞学、分子生物学和医学、病毒学等领域中迅速掀起了一股热潮;199r7年10月18—22日在美国New—J嘲y专门召开了一次关于GFP的国际会议。
1.2GFP结构、生化特性、发光机制、光谱特性1.2.1结构由正常野生型cFP(wtG即)的cDNA序列推出的蛋白质一级结构,由238个氨基酸残基组成,sD卜PAGE凝胶电泳测定其分子量为27—30l【D。
晶体学证据H’表明,GFP中央是一个B罐(p一锄)结构。
GFP的生色团位于“一69的六肽内。
亚细胞定位实验报告(3篇)

第1篇实验目的:本研究旨在通过亚细胞定位技术,确定目标蛋白质在细胞内的具体分布位置,为进一步研究该蛋白质的生物学功能提供实验依据。
实验材料:1. 目标蛋白质表达质粒2. 表达载体(如pEGFP-N1)3. 农杆菌(如GV3101)4. 烟草植株5. 激光共聚焦显微镜6. 其他实验试剂和仪器实验方法:1. 构建表达载体:将目标蛋白质基因与表达载体(如pEGFP-N1)连接,构建融合表达质粒。
2. 农杆菌转化:将构建好的融合表达质粒电转化农杆菌,获得转化子。
3. 农杆菌培养:将转化子接种于YEB液体培养基中,在170rpm/min的条件下培养1小时。
4. 农杆菌悬浮:用接种环将农杆菌从固体培养皿上刮下,接于10ml YEB液体培养基中,悬浮农杆菌。
5. 收集菌体: 4000rpm/min,离心4分钟,去除上清。
6. 重悬菌体:用10mM MgCl2(含120uM AS)悬浮液重悬菌体,调整OD600至0.6左右。
7. 注射烟草:挑选生长状况良好的烟草植株,用去枪头的1ml注射器从烟草叶片下表皮注射,并做好标注。
8. 培养烟草:将注射完成的烟草植株弱光培养2天。
9. 观察与拍照:取标记的农杆菌注射的烟草叶片,制作成玻片,在激光共聚焦显微镜下观察,并拍照。
实验结果:通过激光共聚焦显微镜观察,发现融合表达质粒中的绿色荧光蛋白(GFP)信号在烟草叶片中呈现明显的细胞内分布。
根据GFP信号的位置,可以初步判断目标蛋白质在细胞内的分布情况。
结果分析:1. 细胞核定位:若GFP信号主要分布在细胞核区域,则表明目标蛋白质定位于细胞核。
2. 细胞质定位:若GFP信号主要分布在细胞质区域,则表明目标蛋白质定位于细胞质。
3. 细胞膜定位:若GFP信号主要分布在细胞膜区域,则表明目标蛋白质定位于细胞膜。
根据实验结果,可以初步判断目标蛋白质在烟草细胞中的定位情况,为进一步研究其生物学功能提供实验依据。
讨论:1. 亚细胞定位实验是研究蛋白质生物学功能的重要手段之一。
绿色荧光蛋白要点

绿色荧光蛋白钱永健等三科学家获诺贝尔化学奖本报驻伦敦记者郭林刊发时刻:2020-10-09 04:44:01 光明日报瑞典皇家科学院诺贝尔奖委员会今天宣布,美籍华裔科学家钱永健和美国科学家马丁·沙尔菲、日本科学家下村修取得2020年度诺贝尔化学奖,因为他们发觉和研究了绿色荧光蛋白。
钱永健1952年生于纽约,祖籍浙江杭州,现为加州大学圣迭戈分校化学及药理学系教授,是美国科学院院士、医学院院士。
他的堂叔是被誉为“中国导弹之父”的钱学森。
钱永健对熟悉绿色荧光蛋白的发光机理有着奉献,他发明了多色荧光蛋钱永健白标记技术,可用各类颜色来标识不同的蛋白和细胞,为细胞生物学和神经生物学进展带来一场冲破。
下村修1928年诞生在东京,1960年从名古屋大学取得生物化学博士学位,是波士顿大学医学院和海上生物实验室的名誉退休教授。
下村修是首位从水母中分离出绿色荧光蛋白的科学家。
对生物发光现象,早前就有人研究。
萤火虫发荧光,是由荧光酶作为酶催化底物分子荧光素,产生氧化等化学反映,发出荧光。
下村修研究发觉,蛋白质本身发光无需底物。
1962年,他分离纯化了水母中发光蛋白水母素,1974年他和其他科学家合作纯化了绿色荧光蛋白。
水母素和绿色荧光蛋白都有重要的应用意义。
但水母素仍是荧光酶的一种,它需要荧光素。
而绿色荧光蛋白本身发光,在原理上有重大冲破。
听说下村修用水母提取发光蛋白时,有一天下班回家前,把实验产物倒进水池里,临出门关灯后,转头发觉水池闪闪发光。
因为水池也同意养鱼缸的水,他不久就确信是钙离子增强了水母素发光。
尔后,其他科学家提出可用水母素来检测钙浓度,制造了检测钙的新方式。
水母素成为第一个有空间分辨能力的钙检测方式,沿用至今。
马丁·沙尔菲1947年诞生,1977年取得哈佛大学神经生物学博士学位,1982年任哥伦比亚大学生物学教授。
他的成绩马丁·沙尔菲在于将绿色荧光蛋白表达到其他生物体,绿色荧光蛋白能够作为各类生物现象的亮光基因标签,他的奉献庞大。
荧光蛋白

绿色荧光蛋白开放分类:化学奖相关背景知识技术植物生理学科学自然科学绿色萤光蛋白(green fluorescent protein),简称GFP,这种蛋白质最早是由下村修等人在1962年在一种学名Aequorea victoria的水母中发现。
其基因所产生的蛋白质,在蓝色波长范围的光线激发下,会发出绿色萤光。
由于具有自发荧光等特性,在分子生物学和细胞生物学领域得到广泛应用。
GFP作为一种报告分子,在检测蛋白表达、蛋白和细胞荧光示踪、研究蛋白质之间相互作用和构象变化中,起到了重要的作用。
绿色荧光蛋白- 简介及其发光机理绿色荧光蛋白(GreenFluorescent Protein,简称GFP)是一种在美国西北海岸所盛产的水母中所发现的一种蛋白质。
这类学名为Aequorea victoria的水母有着美丽的外表,生存历史超过1.6亿年。
1962年,下村修正是在这种水母的发光器官内发现天然绿色荧光蛋白。
它之所以能够发光,是因在其包含238个氨基酸的序列中,第65至67个氨基酸(丝氨酸—酪氨酸—甘氨酸)残基,可自发地形成一种荧光发色团。
当蛋白质链折叠时,这段被深埋在蛋白质内部的氨基酸片段,得以“亲密接触”,导致经环化形成咪唑酮,并发生脱水反应。
但此时还不能发射荧光,只有当有分子氧存在的条件下,发生氧化脱氢,方能导致绿色荧光蛋白发色团的“成熟”,形成可发射荧光的形式。
上述绿色荧光蛋白发色团的形成过程,系由几位科学家分别研究完成的。
绿色荧光蛋白不仅无毒,而且不需要借助其他辅酶,自身就能发光,可以让科学家在分子水平上研究活细胞的动态过程。
当绿色荧光蛋白的基因和我们感兴趣的有机体内所拟研究的蛋白质基因相融合时,蛋白质既能保持其原有的活性,绿色荧光蛋白的发光能力也不受影响。
通过显微镜观察这种发光的“标签”,科学家就能做到对蛋白质的位置、运动、活性以及相互作用等一目了然。
在一个活体中有数万种不同的蛋白质,这些蛋白质精细地控制着重要的化学进程。
GFP
GFP是典型的β桶形结 构,包含β叠和α螺 旋,将荧光基团包含 在其中。严密的桶形 结构保护着荧光基团, 防止它被周围环境淬 灭,内部面向桶形的 侧链诱导Ser65– Tyr66–Gly67三肽环化, 导致荧光基团形成。
The advantages of GFP
1、GFP是一种可溶性蛋白,性质稳定,高温处理、甲醛固定、 石蜡包埋、酸、碱等对荧光性质无明显影响。 2、荧光基因能够利用普通的分子生物学工具简单加工到各种蛋 白质的基因序列上,进而在各种难于甚至不能进行显微注射的细 胞类型和组织范围内表达荧光,荧光基团相当明亮。 3、荧光的表达不需要花费固定的时间,无需组织加工的步骤。 4、由于不存在免疫试剂的部分或不完全进入的问题,GFP比免 疫细胞化学方法可靠得多。 5、由于GFP及其多种突变体具有不同的光谱,因此可以对蛋白 质进行共标记,并能对多重转基因细胞进行快速地分辨。 6、表达GFP融合物的细胞能够在生活状态进行实验和检测。
5.张晓东,王文亮. 阿霉素诱导人肝癌细胞株HCC-9204肝癌 细胞凋亡的实验研究. 肿瘤,1995;15(1):242-244 6. 金鹰,邢达.肿瘤细胞的标记及其活体荧光成像.华南师范大 学激光生命科学广东省重点实验室 7.Chishima T , Miyagi Y, Wang X , et al . Cancer invasion and micrometastasis visualized in live tissue by green fluorescent protein expression. Cancer Res , 1997 , 57 (10) : 2042~2047 8.Yang M , Baranov E , Jiang P. Whole2body optical imaging of green fluorescent protein2expressing tumors and metastases. Proc Natl Acad Sci USA , 2000 , 97 (3) : 1206~1211
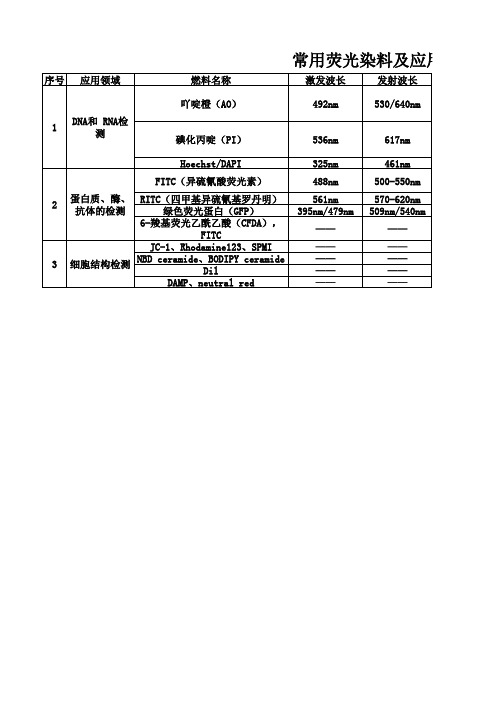
常用荧光染料及应用领域
617nm 461nm 500-550nm 570-620nm 509nm/540nm —— —— —— —— ——
2
3
蛋白质、酶、 RITC(四甲基异硫氰基罗丹明) 抗体的检测 绿色荧光蛋白(GFP) 6-羧基荧光乙酰乙酸(CFDA), FITC JC-1、Rhodamine123、SPMI NBD ceramide、BODIPY ceramide 细胞结构检测 Dil DAMP、neutral red
常用荧光染料及应用领域
序号 应用领域 燃料名称 吖啶橙(AO) 1 DNA和 RNA检 测 激发波长 492nm 发射波长 530/640nm
碘化丙啶(PI) Hoechst/DAPI FITC(异硫氰酸荧光素)
536nm 325nm 488nm 561nm 395nm/479nm —— —— —— —— ——
料及应用领域
特性 用激光共聚焦显微镜双通道观察可见;活细胞的胞核呈黄绿色荧 光,胞质呈绿色荧光;死细胞呈红色荧光 PI不能进入完整的细胞膜,常用于检测膜损伤、细胞凋亡、细胞 核定位、核酸定量等。 对细胞毒性小,特异性强。不与DNA特异性结合 能够结合细胞内总蛋白质,是检测蛋白质最常用的荧光探针,它 还能广泛地结合各种特异性的配体。光照下易淬灭。 常用的共价标记探针,稳定性高 跟踪活组织或细胞内基因表达及蛋白质定位的标记物 FRAP技术 线粒
绿色荧光

绿色荧光蛋白(green fluorescent protein),简称GFP,这种蛋白质最早是由下村脩等人在1962年在一种学名Aequorea victoria的水母中发现。
其基因所产生的蛋白质,在蓝色波长范围的光线激发下,会发出绿色萤光。
这个发光的过程中还需要冷光蛋白质Aequorin的帮助,且这个冷光蛋白质与钙离子(Ca2+)可产生交互作用。
由水母Aequ orea victoria中发现的野生型绿色萤光蛋白,395nm和475nm分别是最大和次大的激发波长,它的发射波长的峰点是在509nm,在可见光绿光的范围下是较弱的位臵。
由海肾(sea pansy)所得的绿色萤光蛋白,仅有在498nm有一个较高的激发峰点。
在细胞生物学与分子生物学领域中,绿色萤光蛋白基因常被用作为一个报导基因(reporter gene)。
一些经修饰过的型式可作为生物探针,绿色萤光蛋白基因也可以克隆到脊椎动物(例如:兔子上进行表现,并拿来映证某种假设的实验方法。
GFP由238个氨基酸组成,分子量为26.9 kDa,最初是从维多利亚多管发光水母中分离出来的,在蓝光照射下会发出绿色荧光。
来源于水母的野生型GFP在395 nm和475 nm分别有主要和次要的激发峰,它的发射峰在509 nm,处于可见光谱的绿色区域(图1)。
来源于海肾的GFP只在498 nm有单个激发峰GFP的化学性质相当稳定,其变性需要在90℃或pH<4或pH>12的条件下用6mollL盐酸胍处理,这一性质与GFP的结构特性相关。
GFP是典型的β桶形结构,包含β折叠和α螺旋,将荧光基团包含在其中(图2)。
严密的桶形结构保护着荧光基团,防止它被周围环境淬灭,内部面向桶形的侧链诱导Ser65–Tyr66–Gly67三肽环化,导致荧光基团形成。
在蛋白质编号lema中可以看到GFP发色团的骨架在左边。
蛋白质链形成一个圆柱形罐头(蓝色),子链的一部分直接从中间穿过(绿色),发色团刚好在罐头盒的中间,它被保护起来以免受周围环境的影响。
