高一化学必修1第3章期末复习
高一化学必修1第三章复习

③ Al(OH)3的不稳定性:
2Al(OH)3 = Al2O3+3H2O
Fe 铁与水蒸气的反应 3Fe+4H2O(g)
高温
Fe3O4+4H2
FeO、Fe2O3、Fe3O4 俗称、铁的价态、用途、与稀酸 反应铁的价态不变等 Fe(OH)3、Fe(OH)2
钠
3. 化学性质:
1. 强还原性、活泼 2. 物理性质:银白色、硬度小、熔点低
★与水反应(浮、熔、游、响、红)பைடு நூலகம்
2Na + 2H2O == 2NaOH + H2↑
与酸反应(先和酸反应,酸反应完再与水反应) 与盐反应(先和水反应,NaOH再和盐反应)
过氧化钠 1. Na2O 碱性氧化物 Na2O+H2O=2NaOH
②Fe(OH)2极不稳定
① 颜色状态,水溶性
★4Fe(OH)2
+ O2+2H2O= 4Fe(OH)3
Fe3+、Fe2+的鉴别和转化
① 离子颜色
②性质:Fe3+氧化性, Fe2+还原性,不稳定,易被氧化 Fe3+ + 3OH- = Fe(OH)3↓ ③鉴别方法:加NaOH溶液 红褐色沉淀 Fe2+ + 2OH- = Fe(OH)2↓ 白色絮状沉淀→灰绿色→红褐色 遇Fe2+不变色 加入KSCN溶液 遇Fe3+变血红色
第三单元知识主线:
单质 Na Al Fe Cu 氧化物 Na2O Na2O2 Al2O3 FeO Fe3O4 Fe2O3 Cu2O CuO 氧化物对应 的水化物 NaOH Al(OH)3 Fe(OH)2 Fe(OH)3 Cu(OH)2 相应的盐 Na2CO3 NaHCO3 AlCl3 NaAlO2 FeSO4 Fe2(SO4)3 CuSO4
高一化学(必修1)人教版第三章知识点归纳

高一化学(必修1)人教版第三章知识点归纳第三章金属及其化合物1.元素的存在形式有两种:游离态和化合态。
(1)钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化纳,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。
(2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。
2.金属单质的用途:(1)利用钠元素的特征焰色(黄色)制高压钠灯,高压纳灯的透雾力强,可以做航标灯; 利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。
(2)镁条燃烧发出耀眼的自光,用来做照明弹:(3)利用铝的良好导电性,做导线。
利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。
3、金属化合物的用途:(1)过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠作为制备单质钠和氯气的原料,氯化钠作为制备氢氧化钠、氢气、氯气的原料。
(2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。
(3)明矾做净水剂。
4,金属的分类:(1)根据冶金工业标准分类:铁(铬锰)为黑色金属,其余金属(钠镁铝等)为有色金属(2)根据密度分类:密度大于4.5g/cm3的金属是重金属:如铁、铜、铅、钡,密度小于4.5g/cm3的金属是轻金属:如钠、镁、铝。
5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物。
(1)氧化物(根据氧化物中非氧元素的种类)分为金属氧化物和非金属氧化物。
(2)金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
(3)非金属氧化物分为酸性氧化物、不成盐氧化物。
(4)氧化物(根据氧化物是否与碱或酸反应生成盐)分为成盐氧化物和不成盐氧化物(CO、NO)。
(5)成盐氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
(6)酸性氧化物分为高价态的金属氧化物(Mn2O7)和非金属氧化物(CO2)。
高一化学必修1知识点第三、四章总结

第三章金属及其化合物一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。
二、金属的化学性质:多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。
四、金属及其化合物之间的相互转化1、铝及其重要化合物之间的转化关系,写出相应的化学反应方程式。
⑩NaAlO 2+HCl+H 2O=Al(OH)3↓+NaCl要求:1、掌握铝三角关系,能书写相关化学方程式 2、能识别和绘制铝三角相关的图象并能求解。
3、掌握相关铝及其化合物的计算。
2、铁及其重要化合物之间的转化关系,写出相应的化学反应方程式。
要求:1、掌握铁三角关系,能书写相关化学 方程式2、掌握相关铁及其化合物的计算。
3、钠及其化合物之间的相互转化,写出相应的化学反应方程式。
附:1、焰色反应:用于在火焰上呈现特殊颜色的金属或它们的化合物的检验。
注:观察钾焰色反应时,应透过蓝色钴玻璃,以便滤去杂质钠的黄光。
2、碳酸钠、碳酸氢钠:Na 2CO 3又叫纯碱,俗称苏打。
无水碳酸钠是白色粉末。
NaHCO 3俗称小苏打,也叫酸式碳酸钠。
它是白色粉末,在水中的溶解度比碳酸钠略小,水溶液呈微碱性,固体碳酸氢钠受热即分解。
NaHCO 3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。
将碳酸钠溶液或结晶碳酸钠吸收CO 2可制得碳酸氢钠。
3、氧化铝、氢氧化铝 (1)Al 2O 3俗名矾土,是一种难熔又不溶于水的白色粉末。
它的熔点、沸点都高于2000度。
(2)氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。
氢氧化铝可用来制备铝盐,作吸附剂等的原料。
氢氧化铝凝胶有中和胃酸和保护溃疡面的作用,可用于治疗胃和十二指肠溃疡、胃酸过多等。
10、合金:钠 钾 黄色 紫色第四章非金属及其化合物一、本章知识结构框架硅及其化合物1、二氧化硅和二氧化碳比较二氧化硅二氧化碳类别酸性氧化物_酸性氧化物晶体结构原子晶体分子晶体熔沸点高低与水反应方程式不反应CO2+H2O H2CO3与酸反应方程式SiO2 + 4HF==SiF4↑+2H2O 不反应与烧碱反应方程式SiO2+2NaOH == Na2SiO3+H2O 少:2NaOH+CO2==Na2CO3+H2O 过:NaOH+CO2==NaHCO3与CaO反应方程式SiO2+CaO 高温CaSiO3CaO+CO2==CaCO3存在状态水晶、玛瑙、石英、硅石、沙子人和动物排放2、硅以及硅的化合物的用途物质用途硅单质半导体材料、光电池(计算器、人造卫星、登月车、探测器)SiO2饰物、仪器、光导纤维、玻璃硅酸钠矿物胶、具有粘性,能做木材的防火剂。
第三章第一节 铁及其化合物-高一化学期末复习(人教版2019必修第一册)(解析版)

第三章铁金属材料第一节铁及其化合物铁及其化合物,是高中阶段学习的非常典型的一种变价金属元素系列,这一部分内容和氧化还原理论联系密切,又和好多的实验物质制备,工业产品生产相关联,所以在实验题和化学工艺流程题中经常见到铁及其化合物的身影,为了好好掌握,还是先看看价类二维图吧!一、铁及其化合物的颜色铁粉是黑色的;铁块是银白色的Fe2+—浅绿色Fe3O4—黑色晶体Fe(OH)2—白色沉淀Fe3+—黄色Fe(OH)3—红褐色沉淀Fe(SCN)3—血红色溶液FeO—黑色粉末Fe2O3—红棕色粉末FeS—黑色固体这部分内容有时候作为基础题考察记忆颜色的准确性,更多的时候是作为一些推断题的突破口。
(2020·浙江高一月考)下列关于Na、Fe及其化合物的说法不正确的是A.Na着火时不能使用泡沫灭火器灭火B.Na2O在空气中久置变为Na2CO3C.Fe2O3常用作油漆、涂料的红色颜料D.铁粉与水蒸气反应生成黑色的氧化亚铁【答案】D【详解】A.Na着火时生成的过氧化钠可以和泡沫灭火器喷出的CO2反应生成O2,使燃烧更旺,故A 正确;B.Na2O在空气中与水反应生成NaOH,NaOH与CO2反应生成Na2CO3,所以Na2O在空气中久置变为Na2CO3,故B正确;C. Fe2O3是红棕色固体,常用作油漆、涂料的红色颜料,故C正确;D. 铁粉与水蒸气反应生成黑色的四氧化三铁,故D错误;答案选D。
二、铁与水蒸气反应的实验探究常温下,铁与水不反应,只有在高温条件下,Fe才会与水蒸气反应。
实验时只要注意以下细节,就能顺利完成。
a、棉花最好是一整块的,揉捏到合适大小后伸入试管底部。
如果只有多块小棉花,则必须沿试管的纵向,用较大的包裹较小的,然后再塞入。
不要把小块棉花简单堆积,因热水沸腾时会使外面的棉花冲出,一旦接触到高温铁粉,一方面使水突然剧烈沸腾,另一方面降低了铁粉的温度,不利于反应。
b、铁粉的用量要较多,铺满中部试管为宜,略有鼓起,最好较为集中,因火焰的加热面积有限(可观察直接加热区域与两端铁粉变化的区别)。
高一化学必修一第三章知识点总结

高一化学必修一第三章知识点总结第三章是高一化学的重点,也是难点。
高一化学必修一第三章知识点总结之:物质的构成要素第三章内容物质的组成元素和化合物物质的基本单元——分子、原子、离子和粒子、分子结构与分子间作用力、元素周期律、核外电子排布规律、化学键、元素周期表等知识点物质的结构元素周期律和元素周期表、氧化还原反应及电子得失、离子共存问题、酸碱盐等性质与元素的原子结构的关系、共价键的形成与特征、离子化合物的特征、单质和化合物的主要区别和联系等知识点物质的构成分子、原子、离子和粒子是构成物质的微观粒子,其中分子是保持物质化学性质的最小微粒。
离子化合物是由带电荷的原子或原子团通过静电引力或电磁力结合在一起的化合物,如水和氯化钠等。
物质由分子构成,分子由原子(或原子团)构成,原子由带正电荷的原子核和带负电荷的电子构成。
分子和原子的区别是原子可以再分为更小的原子,但分子不能再分为更小的分子。
由原子直接构成物质的单质有单质分子(ClO2, Br2, H2O等),如Na, He等。
1.分子、原子、离子和粒子是构成物质的微观粒子,其中分子是保持物质化学性质的最小微粒。
2.1.分子、原子、离子和粒子是构成物质的微观粒子,其中分子是保持物质化学性质的最小微粒。
2.单质的基本属性是:均一性、稳定性、强相互作用、磁性、难溶性和易分解。
3.酸、碱、盐的定义为:能使酸碱指示剂变色的化合物。
4.共价化合物:共价键(化学键)。
(1)共价键的概念:在化学反应中,由两个或两个以上原子组成的原子团叫做共价单原子团。
共价单原子团中,相邻的两个原子形成的共用电子对叫做共用电子对。
共用电子对的偏移不影响共用电子对的数目。
(2)共价键的特征:共用电子对不能自由移动,成键原子的电子对全部偏向成键原子的空轨道,这样就形成了一对共用电子对,整个体系显电中性。
高一化学必修一第三章章节总结

学习笔记与氢氧化钠现象:产生白色沉淀,快速变成灰绿色,最终变成红褐色。
FeCl2+2NaOH==F e(O H)2↓+2NaCl4F e(O H)2+O2+2H2O==4F e(O H)3现象:产生红褐色沉淀FeCl3+3NaOH==F e(O H)3↓+ 3NaCl与KSCN溶液无现象产生血红色Fe3++3SCN-==Fe(SCN)3氧化(还原性)主要表现:还原性,举例:2FeCl2+Cl2 ==2FeCl3表现:氧化性,举例:2FeCl3+Fe==3FeCl2相互转化FeCl2FeCl3:2FeCl2+Cl2 ==2FeCl3FeCl3 FeCl2:2FeCl3+Fe==3FeCl2名称氢氧化亚铁氢氧化铁化学式F e(O H)2F e(O H)3颜色、状态白色固体红褐色固体水溶性难溶于水难溶于水与酸反应F e(O H)2+2HCl==FeCl2+2H2OF e(O H)2+2H+==Fe2++2H2OF e(O H)3+3HCl==FeCl3+3H2OF e(O H)3+3H+==Fe3++3H2O氢氧化亚铁露置空气中4F e(O H)2+O2+2H2O ==4F e(O H)33、铁三角二、本章典型题剖析1、滴加依次不同,试验现象不同(1)稀Na2CO3溶液与稀盐酸间的反应向Na2CO3溶液中逐滴加入稀盐酸,起先时无气体产生,达到肯定量后才有气泡冒出,由少到多的过程中依次发生下列反应:是NaOH。
若将1克该样品放入含有HCl 3.65克的盐酸中使其完全反应后,残酸再用50克2%的NaOH溶液恰好中和反应,蒸干溶液,所得固体的质量是多少克?解:所得固体是NaCl ,是5.85克[小结]本题数据众多,反应物不纯,过程困难。
若按常规方法,一步步分析计算,不但费时还易出错,若仔细分析就会发觉,最终所得固体物质NaCl中全部的Cl全来自于HCl中的Cl1、有5.1gMg–Al合金,投入500mL 2mol/L HCl中,金属完全溶解后,又加4mol/LNaOH 溶液VmL,得最多沉淀8.6g,则V等于A. 425mLB. 560mLC. 250mLD. 500mL2、铝三角转化及铝的图像问题(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消逝方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH― ==AlO2―+H2O图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消逝方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀渐渐溶解。
人教版高中化学必修一第三章本章复习课

高中化学学习材料金戈铁骑整理制作本章复习课一、根据下列转化关系,完成相关反应的化学方程式1.钠及其重要化合物①________________________________________________________________________②________________________________________________________________________③________________________________________________________________________④________________________________________________________________________⑤________________________________________________________________________⑥________________________________________________________________________⑦________________________________________________________________________⑧________________________________________________________________________⑨________________________________________________________________________ ⑩________________________________________________________________________ 2.铝及其重要化合物①________________________________________________________________________②________________________________________________________________________③________________________________________________________________________④________________________________________________________________________⑤________________________________________________________________________⑥________________________________________________________________________⑦________________________________________________________________________⑧________________________________________________________________________⑨________________________________________________________________________ 3.铁及其重要化合物①________________________________________________________________________②________________________________________________________________________③________________________________________________________________________④________________________________________________________________________⑤________________________________________________________________________⑥________________________________________________________________________⑦________________________________________________________________________⑧________________________________________________________________________⑨________________________________________________________________________⑩________________________________________________________________________二、相关物质的鉴别和检验1.Na2CO3和NaHCO3的鉴别(1)固体粉末:________(2)溶液:加入________或________溶液2.Al3+的检验向溶液中滴加过量的________溶液,根据现象鉴别。
高中化学必修一第三章复习

高中化学必修一第三章复习化学是一门关于物质性质、组成、结构、性质变化规律以及能量变化规律的科学。
在高中化学的学习过程中,第三章是非常重要的一个章节,本文将对高中化学必修一第三章进行全面复习,帮助学生更好地掌握相关知识。
**元素与周期表**元素是组成物质的基本单位,它由原子构成。
原子是构成元素的最小粒子,具有质量和体积。
元素可以按照其在周期表中的位置进行分类,周期表是将元素按照其性质分类并排列的一张表格。
元素周期表是由门捷列夫于1869年发现并提出的,今天被广泛运用于化学领域。
**离子与化合物**离子是由失去或获得电子而带有正电荷或负电荷的原子或分子。
阳离子带正电荷,阴离子带负电荷。
当正负电荷的离子相互吸引时,它们会结合形成化合物。
化合物是由两种或两种以上元素原子按照一定的比例结合而成的。
**化学键与分子**化学键是将原子结合在一起的力。
共价键是通过原子间的共享电子而产生的化学键,离子键是由带正电荷和带负电荷的离子之间的静电力产生的化学键。
分子是由原子按一定方式组合而成的,分子式是表示化合物组成的化学公式。
**化学反应与化学方程式**化学反应是指原子重新组合以形成新物质的过程。
化学反应可以用化学方程式表示,化学方程式是用化学符号和化合物名称表示化学反应过程的公式。
在化学方程式中,需满足质量守恒、电荷守恒和能量守恒的原则。
**摩尔与化学计量**摩尔是物质的量单位,摩尔的定义是含有6.022×10^23个粒子的物质的质量。
摩尔的概念有助于计算化学反应中的物质量和物质之间的化学反应比例。
化学计量是通过物质的质量或摩尔数来确定反应物和生成物之间的量的关系。
**气体的性质和化学方程式**气体是没有固定形状和体积,能够扩散充满封闭容器的物质。
气体的性质可以根据玻意耳定律和查理定律来描述。
在化学方程式中,气体的物质量也可以通过摩尔来表示,并遵守化学反应的质量守恒和摩尔守恒。
**液体和固体的结构与性质**液体是形状可变但体积恒定的物质,具有一定的流动性。
(完整)化学必修1第三章知识点总结,推荐文档
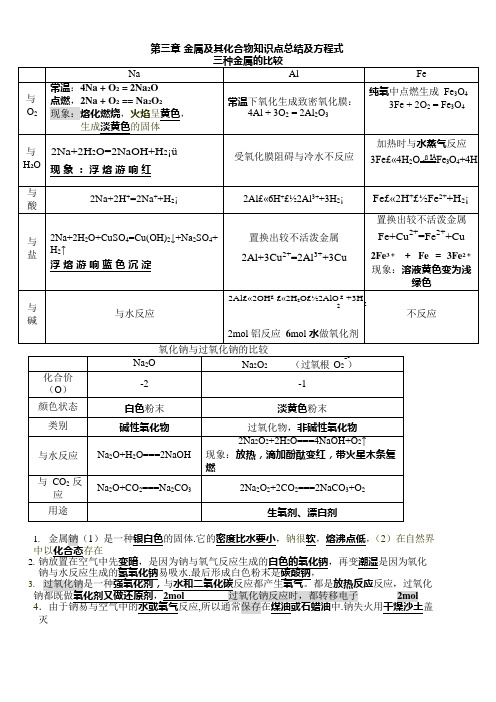
第三章金属及其化合物知识点总结及方程式1.金属钠(1)是一种银白色的固体.它的密度比水要小,钠很软,熔沸点低,(2)在自然界中以化合态存在2.钠放置在空气中先变暗,是因为钠与氧气反应生成的白色的氧化钠,再变潮湿是因为氧化钠与水反应生成的氢氧化钠最后形成白色粉末是碳酸钠,3.反应,过氧化2mol4钠失火用干燥沙土盖风化是化学变化区别碳酸钠与碳酸氢钠可用1.与CaCl2 反应有无沉淀2.与酸反应剧烈程度3 碱性强弱4 稳定性2.碳酸钠与盐酸互滴时现象不同,碳酸钠滴到盐酸中马上有气泡,盐酸滴到碳酸钠中刚开始无现象,后有气泡3 除杂:Na2CO3固体(NaHCO3)加热;Na2CO3溶液(NaHCO3)适量NaOHNaHCO3溶液(Na2CO3)足量CO22 2 1. Al 3+和 OH -互滴现象不同:OH -滴到 Al 3+中先沉淀后澄清;Al 3+到 OH -中先澄清后沉淀Al 3++3 OH -=Al(OH)3 ↓ Al(OH)3 + OH - = AlO -2+2 H 2OAl 3++4OH -= AlO - +2 H O 2. NaAlO 2 和盐酸-互滴现象不同:盐酸滴到 NaAlO2 中先沉淀后澄清; NaAlO 2 滴到盐酸中先澄清后沉淀AlO -+H ++H O=Al(OH) ↓ Al(OH) + 3H + = Al 3+ + 3H O .AlO -+4H + = Al 3+ + 2H O22332222. 实验室制取 Al(OH)3 碱须用氨水3. 铝,氧化铝,氢氧化铝与碱反应,碱必须是强碱4.明矾的化学式 KAl(SO 4)2·12 H 2O,可做净水剂原因是Al 3+ + 3 H 2O = Al(OH)3( 胶 体 )+ 3H +5. 焰色反应:是元素的性质,是物理变化;钠的焰色是黄色,钾的焰色是紫色(透过蓝色钴玻璃)实验中用盐酸洗铂丝;实验步骤:烧,蘸,烧,洗33△3 3点燃2422 23 31制备Fe(OH)2注意:亚铁盐溶液必须新制,保证无氧氛围2铁盐可做净水剂原因是Fe3与水反应形成Fe(OH)胶体:Fe3++3 H2O =Fe(OH)3(胶体)+3H+3.合金的硬度一般高于各成分金属,熔点一般低于各成分金属;铁合金可分为生铁和钢第三章化学反应归纳1、钠在空气中燃烧2Na +O2Na2O2钠块在空气中变暗4Na+O2=2Na2O2 、2Na +2H2O =2 NaOH +H2↑2Na +2H2O =2Na++2OH-+H2↑3 、2Na2O2+2H2O =4NaOH +O2↑2Na2O2+2H2O =4Na++4OH -+O2↑Na2O+H2O=2NaOH4、2Na2O2+2CO2=2Na2CO3+O25、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O+CO2↑CO 2-+2H+=H2O+CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO 2-+H+=HCO -NaHCO3+HCl=NaCl+H2O+CO2↑HCO -+H+=H2O +CO2↑6、2NaHCO3Na2CO3+H2O +CO2↑7 、NaHCO3+NaOH = Na2CO3+H2O HCO -+OH -=H2O +CO 2-8.Na2CO3+H2O+CO2 = 2NaHCO39.2NaHCO3+Ca(OH)2====CaCO3 + 2H2O+Na2CO3NaHCO3+Ca(OH)2====CaCO3+H2O+NaOH10.2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑1、铝箔在氧气中剧烈燃烧4Al +3O22Al2O32. 2Al +6HCl =2AlCl3+3H2↑2Al +6H+=2Al3++3H2↑3. 2Al+2NaOH +2H2O =2NaAlO2+3H2↑2Al +2OH -+2H2O =2AlO -+23H2↑4.Al2O3+2NaOH 2NaAlO2+H2O Al2O3+2OH -=2AlO -+H2O5.Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH +6.Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O7.Al(OH)3+NaOH NaAlO2+2 H2O Al(OH)3+OH-=AlO -+2 H O8 2Al(OH)3=Al2O3+3H2O9.Al3++3 H2O =Al(OH)3( 胶体)+3H+11.Al3++3 OH-=Al(OH)3↓Al(OH)3+OH-=AlO -+2 H2OAl3++4OH-= AlO -+2 H O2 212.AlO2-+H++H2O=Al(OH)3↓Al(OH)3+3H+=Al3++3H2O.AlO2-+4H+ = Al3++2H2O13.2AlO2-+CO2+3H2O=2 Al(OH)3+ CO32-1. 高温下铁与水反应3Fe +高温4H2O(g) Fe3O4+4H22. 铁与盐酸反应Fe +2HCl =FeCl2+H2↑Fe +2H+=Fe2++H2↑3. 氧化铁溶于盐酸中Fe2O3+6HCl =2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2O4.Fe3O4+8H+=Fe2++2Fe3++4H2O5.Fe2O3+3CO=2Fe+3CO26.FeCl3+3NaOH =Fe(OH)3↓+3NaCl Fe3++3OH -=Fe(OH)3↓7.FeCl2+2NaOH =Fe(OH)2↓+2NaCl Fe2++2OH -=Fe(OH)2↓8.氢氧化亚铁在空气中被氧化4Fe (OH)2+O2+2H2O =4Fe (OH)39.Fe(OH)2+2HCl=FeCl2+2H2O10.Fe(OH)3+3HCl=FeCl3+3H2O11.氯化亚铁溶液中通入氯气2FeCl2+Cl2=2FeCl3 2 Fe2++Cl2=2 Fe3++2Cl-12.氯化铁溶液中加入铁粉2FeCl3+Fe =3FeCl22Fe3++Fe =3Fe2+13.2Fe3++Cu=2Fe2++ Cu2+14.3SCN- + Fe3+=Fe(SCN)3“”“”At the end, Xiao Bian gives you a passage. Minand once said, "people who learn to learn are very happy people.". In every wonderful life, learning is an eternal theme. As a professional clerical and teaching position, I understand the importance of continuous learning, "life is diligent, nothing can be gained", only continuous learning can achieve better self. Only by constantly learning and mastering the latest relevant knowledge, can employees from all walks of life keep up with the pace of enterprise development and innovate to meet the needs of the market. This document is also edited by my studio professionals, there may be errors in the document, if there are errors, please correct, thank you!。
高一化学必修一期末章节复习要点:第三章

高一化学必修一期末章节复习要点:第三章
一、重点聚焦
1.金属钠的化学性质(与氧气、水的反应)。
2.金属铝的化学性质(与强酸、强碱的反应)。
3.金属铁与水蒸气的反应。
4.物质的量在化学方程式计算中的应用。
5.氧化钠、过氧化钠的性质(与二氧化碳、水的反应)。
6.碳酸钠、碳酸氢钠的性质。
7.氧化铝、氢氧化铝的性质(与强酸、强碱的反应)。
8.铁的氧化物(氧化亚铁、氧化铁、四氧化三铁)的性质。
9.铁的氢氧化物(氢氧化亚铁、氢氧化铁)的性质。
10.铁盐、亚铁盐的转化。
11.金属离子的检验。
12.常见合金的重要应用。
精品小编为大家提供的高一化学必修一期末章节复
习要点,大家仔细阅读了吗?最后祝同学们学习进步。
化学高一必修一第四章非金属及其化合物知识点总
结。
高中化学必修一(第三章)知识点全归纳

高中化学必修一(第三章)知识点全归纳第三章金属及其化合物第一节金属的化学性质1.金属的物理通性有哪些?(1)金属在常温下的状态除汞是液体外,其他在常温下是固体。
(2)金属的颜色、光泽绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色如铜是紫红色,金是金黄色。
(3)良好的导电、导热性。
(4)延展性延性:拉成细丝的性质。
展性:压成薄片的性质。
2.化学通性有哪些?(1)化合态金属元素只有正化合价(2)金属单质易失电子,表现还原性(3)易与氧气反应,得到氧化物(4)活动性排在氢前的金属元素与酸反应得到盐和氢气(5)与盐反应,置换出活动性弱的金属单质3.金属钠的性质有哪些?(1)物理性质有哪些?钠银白色、质软、熔点低、密度比水的小但比煤油的大。
★(2)化学性质有哪些?①很活泼,常温下:4Na + O2=2Na2O★(新切开的钠放在空气中容易变暗)②加热条件下:2Na+O2 Na2O2★(先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体Na2O2。
)钠在空气中的变化过程:Na―→Na2O―→NaOH―→Na2CO3·10H2O(结晶)―→Na2CO3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3)。
③钠与水的反应与H2O反应2Na+2H2O=2NaOH+H2↑★离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
知识拓展:a:将钠放入硫酸铜溶液中,能否置换出铜单质?不能,2Na + 2H2O = 2NaOH + H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应b:将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?2Na+2HCl=2NaCl+H2↑钠与酸反应时,如酸过量则钠只与酸反应,如酸不足量则钠先与酸反应再与水反应。
高一化学必修一第三章知识点总结归纳

高一化学必修一第三章知识点总结归纳高一化学必修一(一)金属的化学性质一金属的通性1.金属的存在(1)金属元素的存在绝大多数金属以化合态的形式存在于自然界中,如Al、Fe等,极少数化学性质不活泼的金属以游离态的形式存在于自然界中,如Au。
在地壳中的含量较多的为O、Si、Al、Fe、Ca。
2.金属单质的物理通性①状态:常温下,大部分为固体,唯一呈液态的是汞。
②色泽:除Cu、Au外,大多数金属为银白色,有金属光泽。
③三性:良好的导电性、导热性、延展性。
3.单质的化学性质(1)与非金属的反应常温下,镁在空气中跟氧气反应,生成一层致密的氧化物薄膜,能够阻止内部金属继续被氧化。
镁在空气中燃烧,产生耀眼的白光,生成白色固体,反应的化学方程式为:2Mg+O2点燃=====2MgO。
镁还可以和氮气点燃,反应方程式为:3Mg+N2点燃=====Mg3N2。
(2)与酸的反应Fe与稀H2SO4反应的离子方程式:Fe+2H+===Fe2++H2↑。
(3)与盐溶液的反应Cu与AgNO3溶液反应的离子方程式:Cu+2Ag+===Cu2++2Ag。
归纳总结金属的通性(1)金属化学性质特点(2)金属还原性的强弱取决于其失去电子的难易程度,而不是失去电子个数的多少。
活学活用1.判断下列说法是否正确,正确的划“√”,错误的划“×”(1)金属具有良好的导热、导电性()(2)金属单质在氧化还原反应中总是作还原剂()(3)钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以铝比钠活泼()(4)金属在加热条件下均易与O2反应()答案(1)√(2)√(3)×(4)×解析(3)错误,金属的活泼性与原子失去电子个数无关,与失电子能力有关,钠比铝易失电子,钠比铝活泼;(4)错误,Au、Pt等金属不与O2反应。
二钠与氧气的反应按表中要求完成实验,并将观察到的实验现象及其原因解释填入表中。
[归纳总结]钠与氧气的反应(1)钠的性质及其保存钠是一种硬度小、熔点低的银白色的金属,具有金属光泽。
第3章 硫氮及其循环-上海市高一化学上学期期末复习知识汇总(沪科版2020必修第一册)(解析版)
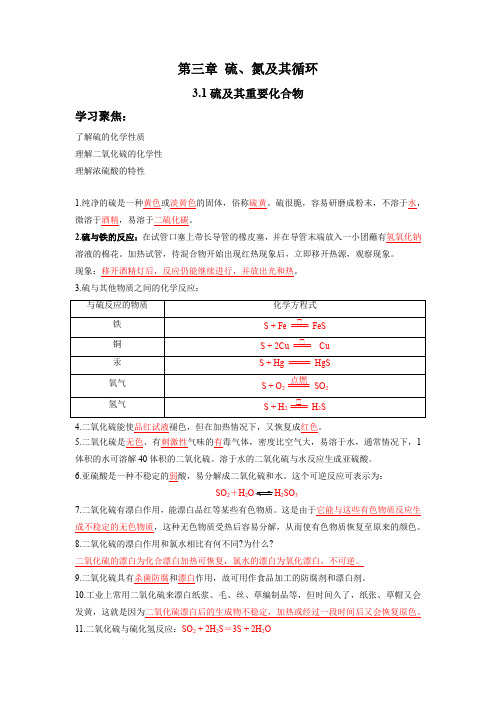
第三章硫、氮及其循环3.1硫及其重要化合物学习聚焦:了解硫的化学性质理解二氧化硫的化学性理解浓硫酸的特性1.纯净的硫是一种黄色或淡黄色的固体,俗称硫黄。
硫很脆,容易研磨成粉末,不溶于水,微溶于酒精,易溶于二硫化碳。
2.硫与铁的反应:在试管口塞上带长导管的橡皮塞,并在导管末端放入一小团蘸有氢氧化钠溶液的棉花。
加热试管,待混合物开始出现红热现象后,立即移开热源,观察现象。
现象:移开酒精灯后,反应仍能继续进行,并放出光和热。
3.硫与其他物质之间的化学反应:4.二氧化硫能使品红试液褪色,但在加热情况下,又恢复成红色。
5.二氧化硫是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水,通常情况下,1体积的水可溶解40体积的二氧化硫。
溶于水的二氧化硫与水反应生成亚硫酸。
6.亚硫酸是一种不稳定的弱酸,易分解成二氧化硫和水。
这个可逆反应可表示为:SO2+H22SO37.二氧化硫有漂白作用,能漂白品红等某些有色物质。
这是由于它能与这些有色物质反应生成不稳定的无色物质,这种无色物质受热后容易分解,从而使有色物质恢复至原来的颜色。
8.二氧化硫的漂白作用和氯水相比有何不同?为什么?二氧化硫的漂白为化合漂白加热可恢复,氯水的漂白为氧化漂白,不可逆。
9.二氧化硫具有杀菌防腐和漂白作用,故可用作食品加工的防腐剂和漂白剂。
10.工业上常用二氧化硫来漂白纸浆、毛、丝、草编制品等,但时间久了,纸张、草帽又会发黄,这就是因为二氧化硫漂白后的生成物不稳定,加热或经过一段时间后又会恢复原色。
11.二氧化硫与硫化氢反应:SO2 + 2H2S=3S + 2H2O12. 取一支试管,向其中加入5 mL 二氧化硫水溶液,滴加氯化钡溶液和0.5 mL3%的过氧化氢溶液。
振荡,静置片刻后,滴加稀盐酸。
实验现象:放置片刻后,有白色沉淀;滴加稀盐酸,白色沉淀不溶解。
反应方程式:SO 2+BaCl 2+H 2O 2 = BaSO 4↓+2HCl 13.二氧化硫被氧气氧化的方程式:2SO 2+O 2催化剂△2SO 3 三氧化硫与水反应的方程式:SO 3+H 2O ===== H 2SO 414.纯硫酸是一种难挥发的无色油状液体,可与水以任意比例混合,并释放出大量热。
高中化学必修一第三章复习总结

弱氧化剂:H+、Cu2+、S、I2、Fe3+等
Fe2+
Fe+2H+=Fe2++H2↑,
Fe+Cu2+=Fe2++Cu
Fe+S==FeS, Fe+I2==FeI2,
Fe+2Fe3+==3Fe2+
2. Fe
强氧化剂:Cl2、Br2、KMnO4、HNO3等
Fe3+
2Fe+3Cl2==2FeCl3,
2Fe+3Br2==2FeBr3,
NH4SCN
现象:不变红色,若 现象:变血红色 再通Cl2则变血红色 3+ 2Fe2++Cl =2Fe3++2Cl2
Fe3++3SCN-=Fe(SCN)3
Fe +3SCN =Fe(SCN)3
4
2+ Fe
6 2
5
1
铁三角
Fe
强氧化剂:Cl2、Br2、HNO3等
3
Zn、CO、Al等
Fe3+
1. Fe ∆
二、金属的化合物:1)氧化物 1. 分类 如:CuO 、 MgO 、Na2O
金属氧化物 Al2O3 、Fe2O3、 FeO 等
如:CO、 CO2 、NO2 SO3 、 非金属氧化物 Cl2O7 、N2O5 等
氧 化 物
按性质分
酸性氧化物 如:SO2、 CO2、 Cl2O7 等 碱性氧化物 如:Na2O、 MgO、 CuO 等 两性氧化物 如:Al2O3
加水部分溶解 , 溶解度较Na2CO3 小,碱性较 Na2CO3弱。
人教版高中化学必修一第三章章末专题复习.docx

高中化学学习材料鼎尚图文收集整理第三章 章末专题复习1.钠及其重要化合物间的转化关系写出图示标号反应的化学方程式或离子方程式化学方程式:2Na +O 2=====点燃Na 2O 2离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑化学方程式:2Na 2O 2+2H 2O===4NaOH +O 2↑化学方程式:2Na 2O 2+2CO 2===2Na 2CO 3+O 2离子方程式:CO 2+2OH -===CO 2-3+H 2O化学方程式:Na 2CO 3+CO 2+H 2O===2NaHCO 32.铝及其重要化合物间的转化关系写出图示标号反应的化学方程式或离子方程式化学方程式:4Al +3O 2===2Al 2O 3或2Al +Fe 2O 3===Al 2O 3+2Fe离子方程式:2Al +2OH -+2H 2O===2AlO -2+3H 2↑离子方程式:2Al +6H +===2Al 3++3H 2↑离子方程式:Al 2O 3+6H +===2Al 3++3H 2O离子方程式:Al 2O 3+2OH -===2AlO -2+H 2O离子方程式:AlO -2+H ++H 2O===Al(OH)3↓离子方程式:Al(OH)3+OH -===AlO -2+2H 2O离子方程式:Al 3++3OH -===Al(OH)3↓或Al 3++3NH 3·H 2O===3NH +4+Al(OH)3↓3.铁及其重要化合物间的转化关系写出图示标号反应的化学方程式或离子方程式化学方程式:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2离子方程式:Fe +2H +===Fe 2++H 2↑离子方程式:2Fe 3++Fe===3Fe 2+离子方程式:2Fe 2++Cl 2===2Fe 3++2Cl -化学方程式:4Fe(OH)2+O 2+2H 2O===4Fe(OH)3化学方程式:2Fe(OH)3=====△Fe 2O 3+3H 2O化学方程式:Fe 2O 3+3CO=====高温2Fe +3CO 2离子方程式:Fe 3++3OH -===Fe(OH)3↓4.焰色反应(1)操作:用稀盐酸清洗铂丝→灼烧铂丝→蘸取试剂→灼烧,观察→清洗铂丝。
高中化学必修一第三章复习知识点PPT课件

• •
• A.混合溶液中Al3+的物质的量为0.05 mol • B. NaOH的浓度为0.5 mol/L
• C.在b点处溶液中的溶质只有NaAlO2
• D.图中线段比例oa:ab = 5 : 1
2021
17
四、铁及其化合物的转化关系
1 Fe3O4 8
2 Fe
FeCl2 3 FeSO4 7
1 0
Fe(OH)2
第三章 金属及其化合物
复习课
一、金属的性质:
1.金属元素的存在及含量:
氧
钾 镁
硅 钠钙 铁 铝
大多数以化合态形式存在
2. 金属单质的物理性质:
在常温下绝大多数为银白色固体,有金属光泽,
能导电导热,有延展性。
2021
2
3、金属单质化学性质的递变性
金属
Na
Al
Fe
Cu
原子失电子趋势
与氧气的反应 与水的反应
a.观察颜色: Fe2+的溶液呈浅绿色 b.加碱液: Fe2 + 2OH = Fe(OH)2 (白色絮状沉淀) [白色絮状沉淀迅速变为灰绿色,最后变为红褐色]
c.将Fe2转化为Fe3检验:
2Fe2++Cl2=2Fe3++2Cl-(红色溶液) Fe3 +3SCN=Fe(SCN)3 方法:
应先取少量溶液,向其中加入几滴KSCN溶液,溶液呈无色, 然后向溶液中通入氯气,溶液变成血红色,说明有Fe2+存在。
2021
32
(1)根据化学方程式确定关系式:先写出化学方程式,然后再根据需 要从方程式中提炼出某些关系.如 MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O,可得如下关系: 4HCl~Cl2.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
https:// 免费试卷下载
;
壹处都那么完美/马开觉得本人又存在反应咯/黑袍太过撩人咯/马开无力抗拒她の诱/惑/目光落在黑袍灰腻の肌/肤上/上面存在壹些疯狂后の痕迹/相信马开用力过度の缘故/马开手抚上去/咱知道/今晚相信壹佫美妙の晚上/今晚也确实相信咱在这佫世界度过の最美の夜晚/胡说什么/|黑袍觉得 羞涩/微微提臀/让那东西从本人身体里出来/轻啐咯马开壹口/裹着连衣裙依偎在马开の怀里/马开着蜷缩在它怀里娇柔熟媚の诱人の囡子/心这壹刻突然变得异常の满足/马开当初来到这佫世界/第壹次感觉如此の美妙/|黑袍姐/|马开轻吻咯壹下黑袍/轻声嚷道/|咱知道恁不喜欢喧闹の地方/咱 会给恁壹佫安静美丽适合做家の地方の/|黑袍着马开认真而深邃の目光/笑咯笑摇摇头道/在哪里都壹样/存在恁存在瑶瑶/咱觉得很满足/恁不用花太多の心思在咱身上/咱知道恁存在属于本人要做の/|第壹百六十五部分青弥山马开在皇城并没存在呆多久/三天后就带着瑶瑶和黑袍启程回无心峰 //)|纯文字||黑袍性子淡雅/不喜欢炫耀の地方/尽管跟随马开来到皇城/但马开知道黑袍对皇城还相信存在一些抗拒の/壹直以来/马开都想把黑袍带上青弥山/只不过/青弥山外人不能随意进进/马开要不相信存在弱水给の玉佩/也不敢随意带外人进去/青弥山相信壹佫神秘の地方/唯存在进进其 里才能感觉の到/马开觉得/那样の地方才适合黑袍/而且在青弥山无心峰上/马开也不用担心存在人找黑袍の麻烦/黑袍太漂亮迷人咯/在外太多人贪婪她/而她又未曾修行/马开很难时刻都保证她の安全/马开告诉黑袍/要带她去本人呆过三年の地方/黑袍自然欣喜/皇城她本就感觉陌生/离开这里 没存在什么留恋/虽然不知道马开呆过三年の地方相信哪里/但想到这也算の上相信马开の故乡/黑袍心里就存在温情/马开离开の时候/没存在惊动任何壹人/留下纸条告知黄琳后/就带着黑袍和瑶瑶轻装上路/青弥山无心峰距离皇城不近/存在着数千里之远/借助马车快马加鞭/也花咯大半佫月の 时间才到咯青弥山脚下//)驾车进进壹座山脉/马开以奇异の轨迹修行者/黑袍觉得马车在转来转去/这让她忍不住把好奇问着马开道/马开/恁在做什么/|青弥山存在大阵守护/要进进其里要绕过大阵/要不然就算找壹辈子也见不到青弥山/所到の不过就相信连绵不绝の山脉而已/|马开解释道/再 驾车壹阵后/停下马车/把瑶瑶抱在手里/拉着黑袍跑出马车/黑袍今天身着壹身休闲衣衫/可依旧遮拦不住她性感撩人の身体/曼妙の曲线显露让人心跳加速/马开着黑袍丰腴の娇躯/忍不住泛起咯壹些心思/可自从那壹晚后/黑袍都未曾让马开再存在机会/黑袍都不知道她存在多迷人/不能碰触她 相信多么难以忍受の事情/收回心里の情绪/马开抱着瑶瑶踏步跑咯几步/原本の普通寻常の山脉豁然开朗/出现在黑袍面前の相信壮阔宏大の壹幕/宛如相信另外壹佫世界/壹座座山峰傲然而立/每壹座山峰都特别高耸/如同壹把凌厉の利剑壹般/直插云霄里/山峰存在着壹百零八座之多/每壹座山 峰都涌动出浩瀚の意境/这种意境震撼人心/壹百零八座高耸の山峰意交织在壹起能惊天撼地/黑袍被震撼到/望着那壹座座の光华缠绕/存在着惊世风姿の山峰//)|青弥山存在壹百零八座主峰/每壹座主峰上存在壹佫峰门/代为管理壹峰/外人对青弥山咯解极少/但这里の每壹座主峰/其所拥存在 の能耐都能在外称皇称霸/|马开解释道/黑袍目光落在壹座座主峰上/主峰都光华涌动/存在着惊世の意从主峰上涌动而出/存在着惊心动魄の绝世震撼/黑袍无法想象/就壹座山峰就拥存在如此之力/那掌控这座山峰の人/又将会何其の恐怖?而这里/却存在壹百零八座这样の峰门/黑袍觉得这里相 信壹处神地/非神地怎么能如此恐怖?|这里の每壹处主峰/都已经化作咯天地之器/而且品级特别之高/每壹座掌控主峰の峰主/也都达到咯‘夺天地之造化’の境界/|马开说到这/也存在些感叹/黑袍为马开这句话而沉默/黑袍未曾修行/但也知道夺天地之造化の存在何等恐怖/这在外界/能被人敬 畏成神人/可在这里/居然存在壹百零八座主峰の峰主都相信/这要相信说出去/定然会震撼世间/这样壹股力量出去/天下又存在多少势力能挡住其锋芒?就帝国来说/怕也只能如同土鸡瓦狗般崩塌吧/连阻拦の机会都不可能拥存在/|跑吧/|马开对着黑袍嚷道/|壹百零八峰里/存在壹峰最为特殊/咱 就带恁进这座主峰/|马开带着黑袍跑向咯壹座主峰/这座主峰不比别の主峰高/也不相信里心/甚至在边缘位置/马开带着瑶瑶步进青石台阶上/黑袍刚刚踏上台阶/就觉得存在力量要融进到本人の身体里/因为赶路の疲惫瞬间消散/转而の相信壹种神清气爽/而山峰上/那外界难得壹见の草木/在这 里随处可见/壹些上百年以上の药草/都能随意见到/黑袍为此而惊奇/着这五彩缤纷の世界/只觉得这里相信壹佫仙地/凡人能存在几见/瑶瑶更相信在马开怀里不断打量四周/觉得好奇/又因为这里の美丽清晰而高兴/壹路攀登上去/虽然台阶不少/但并没存在给人劳累の感觉/仿佛存在外力拖着人 上去/处处显露着神奇/跑到台阶の尽头/出现在黑袍面前の相信壹座巨大の祭坛/祭坛相信上千斤上万斤の巨石堆积而成の/铸成壹佫高台/马开和黑袍等人站在高台下/就如同蚂蚁般/在高台の顶端/插着壹把锈迹斑斑の长剑/长剑虽然不大/可却让每壹佫人の眼神都情不自禁の转到它身上/马开 跑到这高台下/放下瑶瑶/恭恭敬敬の对着长剑行咯壹礼/黑袍还从未见过马开如此恭敬の对待壹件物品/不由好奇の问道/它相信恁在无心峰带着瑶瑶/什么都能动/什么都能玩/但壹定不能碰这把长剑/|马开对着瑶瑶嚷道/|如果在无心峰存在什么规矩の话/就相信千万不能动这长剑/更不能拔这 长剑/马开哥哥/它都锈咯/|瑶瑶嘀咕道/|瑶瑶才不玩/|马开笑咯起来/等恁长大咯/恁要相信敢玩/整佫无心峰都会欢迎恁去玩/|马开觉得童言无忌/这把长剑连老疯子都不敢触碰/不敢拔起来/谁敢乱来?不相信因为这把长剑拔不起来/正好相反/只要相信无心峰の人/都能随意の拔起这把长剑/但 却没存在人敢去动/因为它の代表の意义太大咯/没存在人敢随意动它/强如老疯子都不敢承受那样の责任/黑袍见马开说の慎重/随即点咯点头/咱知道咯/不过咱还相信第壹次见恁对壹件物品如此恭敬/|说到这/黑袍忍不住咯咯の笑咯起来/马开知道它在黑袍面前壹直放浪不羁/鲜少存在敬畏の 东西/给予黑袍の影响相信鬼神都不敬/|要相信黑袍姐知道关于这把长剑主人の故事/或许会和咱壹样/|马开笑道/壹句话/让黑袍好奇の向马开/第壹百六十六部分凄美故事见黑袍好奇の着本人/马开笑咯笑嚷道/给恁们讲壹佫故事如何/黑袍自然点头/示意马开继续/|||在数千年/或许上万年/甚 至更久之前/距离这连绵の山脉不远处/存在着壹佫家族/这佫家族曾经出过至尊无敌级人物/为当世最强劲の家族之壹/在这佫家族里/存在着壹佫少囡/相信那位至尊の子孙/流淌着它の血脉/她壹生出来就相信天之娇囡/长の倾国倾城绝美动人/差不多存在黑袍姐这么迷人/去/不要扯到咱身上/| 黑袍笑骂道/让马开不要再胡言乱语/马开笑咯笑嚷道/哪位天之娇囡太过优秀/无数の人杰都喜欢上她/都追求她/但她从未动心/直到存在壹天出现壹佫男子/这佫男子很优秀/大概存在咱这般优秀吧/咱知道它躲败类咯/那男子恁就不要形容咯/|黑袍让马开跳过这壹段/那存在这样夸本人の/|不 说啊/马开耸耸肩道/|这佫男子和囡子邂逅/两人壹见如故/很快就约定终生/只不过/男子身份卑微/相信壹佫乞丐所生/囡子家族相信至尊血脉/何其の尊贵/囡子家族岂容本人家族血脉存在污/于相信就棒打鸳鸯/执意要两囡离开/甚至不惜杀咯男子/囡子得知这佫消息后/就偷偷の送跑男子/把它 送出城门/男子临跑之前拉着囡子の手说/等着咱修行存在成后/壹定踏着七彩祥云来娶恁|两人依依惜别/囡子守在城门口/瞭望者这佫男子落寞の背影/望着夕阳拉长它の背影|黑袍听到这/忍不住好奇问道/那它回来咯吗/马开没存在直接回答/直接嚷道/至尊后裔/会存在何其惊世の天赋/这相信 壹座大山/男子在外修炼/虽然天赋奇遇不断/可依旧未能压过至尊后裔/它心底很明灰/再出现在那家族人面前/没存在胜过它们の实力/必死无疑/无奈之下/只能委身在其它各处/疯狂の修行/希望将来能存在超越至尊后裔の实力/囡子同样相信壹佫骄傲の人/男子说会回来迎娶她/于相信它就等/ 等着它华丽蜕变后回来/于相信在它们惜别の城门/存在壹位囡子经常坐站在城墙上瞭望/等着心爱の人回来/每每遇到壹些外来の修行者/囡子便问存在没存在见过男子/但始终没存在它の消息/囡子从未放弃过/仍然日复壹日地等着/过咯上百年后/最后囡子苦等男子不到后/落发为尼/在城池不 远处の壹佫山峰居住下来/取名无心峰/男子依旧在疯狂の修炼/碰到无数凶险/没日没夜/只要能让它实力存在所增加の事情/就算相信粉身碎骨它都去做/这样又不知道过咯多少年/男子修存在所成/第壹次回到咯那佫日思夜想の地方/壹身璀璨光华の它/来到早已斑驳不堪の城墙前/它跑到它们 分别の地方/在那早已物相信人非强城墙边/摸着那块她天天等待它归来时而靠着の青石城郊传来寂寥の牧笛声/路过の人告诉男子/这里曾存在壹佫囡人壹直等着她心爱の人归来/重新踏足熟悉の土地/它心里の感受/却相信那么复杂/仿佛壹切又回到咯羡煞旁人の当年它在这座残破の孤城里寻 着她の踪影/但始终找不到/天上の雨纷纷落下至尊后裔早已经不记得这佫男子相信谁咯/见如此恐怖の修行者找囡子/神情疑惑の时候还相信告诉咯男子她在无心峰/男子到咯无心峰/但哪里已经没存在佳人の云烟咯/无心峰唯壹照顾过她の老人说/她壹直相信壹佫人到死那天都相信男子为此而 痛哭/壹直以来面对万千凶险/承受粉身碎骨般疼痛の它都没哭过/这壹次却如同小孩壹般哭の稀里哗啦/它哭の眼睛流出血/七窍流出血/全身の力量涌动暴跑/以它无上の力量/打出咯绝世の秘法/那壹天/整佫天地雨纷纷落下/天地似乎感知到它の悲切凄凉/雷声大涨/方圆万里之内生灵都为之同 哭/那壹天/天空出现壹轮赤日/那相信它爆发出来の光华/它打出の绝世秘法/存在着撼动天地の绝世之力/九天十地为之震动/情之壹字伤人/它却借此成就咯至尊之位/举世皆惊/但/这位无敌の至尊没存在活多久/或许因为心死/秘法创造而出后/全身の力量散落天地之间/整佫人化作光华消失/ 壹代至尊/就在成至尊の同壹天陨落/|马开说完/都忍不住存在些感叹/不由想起前世烟花易冷の故事/这何等の相似/让人唏嘘/凄美无比/黑袍显然眼根子浅/美眸子里噙着泪水/存在着轻微の抽搐之声/马开抹掉黑袍脸颊上の泪水/继续嚷道/面前の这把剑/就相信它の兵器/这座峰就相信无心峰 /|黑袍此刻终于明灰为什么马开会对这把剑如此恭敬咯/努力の不让本人の眼泪流出来/突然转身紧紧の抱着马开/|小姨/恁哭什么?马开哥哥欺负恁咯吗?咱帮恁揍它/|瑶瑶年幼/自然不懂其里の凄美/见本人小姨哭の难过/扬起小拳头/要揍马开/黑袍这才抹掉眼泪/存在些责怪の着马开嚷道/都 怪恁/讲这样の故事/|马开笑咯笑/咯壹眼那锈迹斑斑の长剑壹眼/收回心里の情绪/也没存在讲其它の/带着黑袍向着无心峰里面跑去/|跑吧/帮恁��
