氧化锌
氧化锌

检查
碱度 取本品1.0g,加新沸的热水10mL,振摇5分钟,放冷,滤过,滤液加酚酞指示液2滴,如显粉红色,加盐酸 滴定液(0.1mol/L)0.10mL,粉红色应消失。 硫酸盐 取本品1.0g,加稀盐酸适量使溶解,依法检查(通则0802),与标准硫酸钾溶液0.5mL制成的对照液比较, 不得更深(0.005%)。 碳酸盐与酸中不溶物 取本品2.0g,加水10mL混合后,加稀硫酸30mL,置水浴上加热,不得发生气泡,搅拌后,溶液应澄清。 炽灼失重 取本品约1.0g,精密称定,在800℃炽灼至恒重,减失重量不得过1.0%。 铁盐 取本品0.40g,加稀盐酸8mL、水15mL与硝酸2滴,煮沸5分钟使溶解,放冷,加水适量使成50mL,混匀后, 取出
应用领域
应用领域
1、在橡胶或电缆工业工业中用作天然橡胶、合成橡胶及乳胶的硫化活性剂、补强剂及着色剂,以使橡胶具 有良好的耐腐蚀性,抗撕裂性和弹性。白色胶的着色剂和填充剂,在氯丁橡胶中用作硫化剂,颗粒细小者(粒径 0.1μm左右)可用作聚烯烃或聚氯乙烯等塑料的光稳定剂。
2、有机合成催化剂、脱硫剂, 3、在化肥工业中对原料气作精脱硫用,用于合成氨、石油、天然气化工原料气的脱硫,甲醇和制氢等工业 原料气、油的深度脱硫净化过程, 4、用作分析试剂、基准试剂、荧光剂和光敏材料的基质 5、用于静电湿法复印、干法转印、激光传真通讯、电子计算机的静电记录及静电制版档 6、用于塑料行业、防晒化妆品系列产品、特殊陶瓷制品、特种功能涂料以及纺织卫生加工等 7、制药,用作收敛药,用于制软膏、锌糊、橡皮膏 8、用作白色颜料,着色力不及二氧化钛及立德粉。用于ABS树脂、聚苯乙烯、环氧树脂、酚醛树脂、氨基树 脂和聚氯乙烯及油漆和油墨的着色。用于颜料锌铬黄、醋酸锌、碳酸锌、氯化锌等的制造。
氧化锌制备

氧化锌制备
氧化锌可以通过不同的方法进行制备,常见的方法有以下几种:
1. 煅烧法:将锌粉或锌矿石在空气中进行高温煅烧,使其氧化生成氧化锌。
这种方法适合大规模工业生产。
2. 水热法:将锌离子与氢氧化钠或氢氧化铵等氢氧化物进行反应,生成氢氧化锌沉淀。
然后将氢氧化锌沉淀在高温和高压的条件下经过一定时间处理,得到氧化锌。
3. 溶胶-凝胶法:通过将适当的锌盐与氨水或其他碱性溶液反
应生成氢氧化锌溶胶,然后经过适当的处理得到氧化锌胶体。
最后将氧化锌胶体进行干燥和煅烧,得到氧化锌粉末。
4. 溶液法:将适当的锌盐溶解在水或其他溶剂中,加入适量的碱性溶液,使得pH值升高。
在适当的条件下,锌盐会与碱性
溶液中的氢氧化物反应生成氢氧化锌沉淀。
然后将氢氧化锌沉淀进行过滤、洗涤、干燥和煅烧,最终得到氧化锌粉末。
需要注意的是,不同的制备方法所得到的氧化锌粉末的颗粒大小、形貌以及性质可能会有所差异。
选取合适的制备方法可以根据具体的需求和应用。
氧化锌
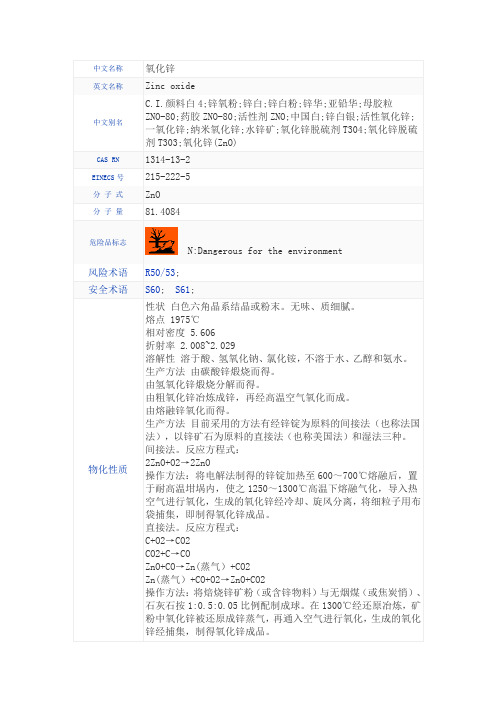
中文名称氧化锌英文名称Zinc oxide中文别名C.I.颜料白4;锌氧粉;锌白;锌白粉;锌华;亚铅华;母胶粒ZNO-80;药胶ZNO-80;活性剂ZNO;中国白;锌白银;活性氧化锌;一氧化锌;纳米氧化锌;水锌矿;氧化锌脱硫剂T304;氧化锌脱硫剂T303;氧化锌(ZnO)CAS RN 1314-13-2EINECS号215-222-5分子式ZnO分子量81.4084危险品标志N:Dangerous for the environment 风险术语R50/53;安全术语S60; S61;物化性质性状白色六角晶系结晶或粉末。
无味、质细腻。
熔点 1975℃相对密度 5.606折射率 2.008~2.029溶解性溶于酸、氢氧化钠、氯化铵,不溶于水、乙醇和氨水。
生产方法由碳酸锌煅烧而得。
由氢氧化锌煅烧分解而得。
由粗氧化锌冶炼成锌,再经高温空气氧化而成。
由熔融锌氧化而得。
生产方法目前采用的方法有经锌锭为原料的间接法(也称法国法),以锌矿石为原料的直接法(也称美国法)和湿法三种。
间接法。
反应方程式:2ZnO+O2→2ZnO操作方法:将电解法制得的锌锭加热至600~700℃熔融后,置于耐高温坩埚内,使之1250~1300℃高温下熔融气化,导入热空气进行氧化,生成的氧化锌经冷却、旋风分离,将细粒子用布袋捕集,即制得氧化锌成品。
直接法。
反应方程式:C+O2→CO2CO2+C→COZnO+CO→Zn(蒸气)+CO2Zn(蒸气)+CO+O2→ZnO+CO2操作方法:将焙烧锌矿粉(或含锌物料)与无烟煤(或焦炭悄)、石灰石按1:0.5:0.05比例配制成球。
在1300℃经还原冶炼,矿粉中氧化锌被还原成锌蒸气,再通入空气进行氧化,生成的氧化锌经捕集,制得氧化锌成品。
湿法。
用锌灰与硫酸反应生成硫酸锌,再将其分别与碳酸钠和氨水反应,以制得的碳酸锌和氢氧化锌为原料制氧化锌。
反应方程式如下:Zn+H2SO4→ZnSO4+H2↑ZnSO4+Na2CO3→ZnCO3+Na2SO4ZnSO4+2NH3·H2O→Zn(OH)2+(NH4)2SO4以碳酸锌为原料,经水洗、干燥、煅烧、粉碎制得产品氧化锌。
氧化锌(Zinc oxide)基本资料

氧化锌(Zinc oxide)基本资料氧化锌(ZnO)是锌的一种氧化物,俗称锌白,英文名称是Zinc oxide。
中文别名有锌氧粉、锌白、锌白粉、锌华、亚铅华、锌白银、一氧化锌、水锌矿等等。
难溶于水,可溶于酸和强碱。
氧化锌是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶、润滑油、油漆涂料、药膏、粘合剂、食品、电池、阻燃剂等产品的制作中,在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中均有应用。
此外,微颗粒的氧化锌作为一种纳米材料也开始在相关领域发挥作用。
氧化锌氧化锌生产厂家主要集中在辽宁(大连)、山东(潍坊)、河北(高邑、邢台)、江苏、浙江等地,生产的氧化锌以99.7%含量的为主,俗称997(99.7)氧化锌。
一、氧化锌物理化学性质1.1.基本信息密度:5.6沸点:2360ºC熔点:1975°C分子式:OZn分子量:81.408精确质量:79.924065PSA:17.07000外观性状:白色粉末折射率:2.008~2.0291.2.分子结构摩尔折射率:无可用的摩尔体积(cm3/mol):无可用的等张比容(90.2K):无可用的表面张力(dyne/cm):无可用的介电常数:无可用的极化率(10-24cm3):无可用的单一同位素质量:79.924061Da 标称质量:80Da平均质量:81.4084Da1.3.编号系统CAS号:1314-13-2MDL号:MFCD00011300 EINECS号:215-222-5 RTECS号:ZH4810000二、性质与稳定性2.1.如果遵照规格使用和储存则不会分解,未有已知危险反应,避免碱、碱金属2.2.受阳光照射发磷光,在阴极线和阳极线上,能发出绿色和紫色等光。
为两性氧化物,溶于稀酸、浓氢氧化碱溶液、氨水和铵盐溶液,不溶于水和醇。
2.3.工作人员应做好防护,应注意防尘通风。
空气中最高允许浓度0.5mg/m3。
溶于酸、氢氧化钠、氯化铵,不溶于水、乙醇和氨水。
氧化锌和次氧化锌

氧化锌和次氧化锌一、氧化锌(ZnO)1. 物理性质外观:白色粉末或六角晶系结晶体。
熔点:1975℃。
密度:5.606g/cm³。
溶解性:难溶于水,可溶于酸和强碱。
例如,它能与盐酸反应生成氯化锌和水,化学方程式为:ZnO + 2HCl = ZnCl₂+ H₂O;与氢氧化钠反应生成偏锌酸钠和水,化学方程式为:ZnO+2NaOH = Na₂ZnO₂ + H₂O。
2. 化学性质氧化性:在高温下,氧化锌具有一定的氧化性。
例如,它可以与一氧化碳反应,将一氧化碳氧化为二氧化碳,自身被还原为锌,反应方程式为:ZnO+CO = Zn + CO₂(高温条件)。
酸碱性:氧化锌是一种两性氧化物,既能与酸反应表现出碱性,又能与碱反应表现出酸性。
3. 制备方法直接法:以锌精矿为原料,经高温氧化焙烧,使锌精矿中的硫化锌转变为氧化锌,反应方程式为:2ZnS+3O₂ = 2ZnO + 2SO₂(高温条件)。
间接法:将锌锭加热至1000℃以上,使其挥发形成锌蒸气,锌蒸气与空气中的氧气反应生成氧化锌,反应方程式为:2Zn+O₂ = 2ZnO。
湿法:用锌盐(如硫酸锌)溶液与碱(如氢氧化钠或氨水)反应生成氢氧化锌沉淀,然后将氢氧化锌加热分解得到氧化锌,以硫酸锌和氢氧化钠为例,反应方程式为:ZnSO₄+2NaOH = Zn(OH)₂↓+Na₂SO₄,Zn(OH)₂ = ZnO + H₂O(加热条件)。
4. 用途在橡胶工业中,氧化锌作为硫化活性剂使用,能提高橡胶的硫化效率,改善橡胶的物理性能,如硬度、耐磨性等。
在涂料工业中,可作为白色颜料,具有良好的遮盖力和着色力,同时还能提高涂料的耐候性和抗粉化性。
在电子工业中,氧化锌是一种重要的半导体材料,可用于制造压敏电阻、发光二极管(LED)等电子元件。
二、次氧化锌(ZnO·Zn(OH)₂)1. 物理性质外观:通常为淡黄色粉末。
密度:相对氧化锌有所不同,一般在4 5g/cm³左右。
氧化锌 表征-概述说明以及解释

氧化锌表征-概述说明以及解释1.引言1.1 概述概述氧化锌(Zinc Oxide,ZnO)是一种重要的无机化合物,由锌和氧两种元素构成。
它具有多种物理和化学性质,广泛用于各个领域。
本文将对氧化锌的表征进行详细介绍。
首先,我们将介绍氧化锌的物理性质。
氧化锌是一种白色粉末状固体,无味无臭。
其晶体结构属于六方晶系,具有高熔点和热稳定性。
此外,氧化锌具有优异的电学性能,是一种半导体材料,具有特殊的光学和电学性质。
其次,我们将探讨氧化锌的化学性质。
氧化锌在常温下相对稳定,不溶于水和酸,但可溶于碱性溶液。
它具有良好的催化活性,可以催化多种有机反应,例如光催化和氧化反应。
此外,氧化锌还具有抗菌、抗氧化、光敏和防紫外线等特性,因此在医药、化妆品和防晒等领域得到广泛应用。
最后,我们将介绍氧化锌的应用领域。
氧化锌作为一种重要的功能材料,广泛应用于多个领域。
例如,在橡胶工业中,氧化锌可用作活性剂,起到促进橡胶硫化反应的作用。
在电子行业中,氧化锌可以制备成透明导电膜,用于平板显示器和太阳能电池等器件。
此外,氧化锌还可用于催化剂、染料、润滑剂和防腐剂等方面。
综上所述,本文将全面介绍氧化锌的物理性质、化学性质和应用领域。
通过对氧化锌的表征,我们可以深入了解这种材料的特性和潜在的应用价值。
接下来的正文将对氧化锌的各个方面进行详细探讨,希望通过本文的阐述能够增加对氧化锌的全面理解,并为未来的研究和应用提供参考。
1.2 文章结构文章结构本文主要围绕氧化锌的表征展开,文章分为引言、正文和结论三部分。
引言部分(Chapter 1)为文章的开篇,主要包括概述、文章结构和目的。
在概述(1.1)中,将简要介绍氧化锌的基本情况,包括其化学式、晶体结构等相关信息,以及氧化锌在实际应用中的重要性。
这一部分旨在引起读者对本文的兴趣,并为后续内容做好铺垫。
接下来是文章的文章结构(1.2)部分,本部分将详细介绍整篇文章的组织结构。
首先,将会介绍本文的大纲,即引言、正文和结论三个主要部分。
氧化锌的物理化学性质及用途

氧化锌的物理化学性质及用途氧化锌(ZnO),俗称锌白,是锌的一种氧化物。
难溶于水,可溶于酸和强碱。
氧化锌是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶、润滑油、油漆涂料、药膏、粘合剂、食品、电池、阻燃剂等产品的制作中。
氧化锌的能带隙和激子束缚能较大,透明度高,有优异的常温发光性能,在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中均有应用。
此外,微颗粒的氧化锌作为一种纳米材料也开始在相关领域发挥作用。
中文名称:氧化锌英文名称:Zinc oxide中文别名:C.I.颜料白4;氧化锌; 锌氧粉; 锌白; 锌白粉; 锌华; 亚铅华; 预分散ZnO-80; 母胶粒ZnO-80; 药胶ZnO-80; 活性剂ZnO; 环氧乙酰蓖麻油酸甲酯;中国白; 锌白银; 活性氧化锌;一氧化锌; 氧化锌掺杂银; 锌白银(色料名);纳米氧化锌; 水锌矿; 氧化锌脱硫剂T304; 氧化锌脱硫剂T303; 金属氧化物; ZnO英文别名:C.I. 77947; C.I. Pigment White 4; Zinc oxide [USAN]; zincoxideheavy; flowers of zinc; zinc white; zinc oxide,edible; active zinc oxide; zinkoxyd aktiv; zinci oxidum; activox; activox b; actox14; zine oxide; zine white; zincoxide; actox16; actox216; ai3-00277; akro-zincbar85; akro-zincbar90; amalox; azo22; azo-33; azo-55; azo-55tt; azo-66; azo-66tt[1]CAS编号:1314-13-2物理性质白色六方晶系结晶或粉末。
无味、质细腻。
溶于酸、氢氧化钠、氯化铵,不溶于水、乙醇和氨水。
氧化锌 9类

氧化锌9类摘要:I.氧化锌简介A.氧化锌的基本性质B.氧化锌的分类II.氧化锌的9类应用领域A.电子工业1.半导体材料2.光电子器件B.涂料工业1.防腐涂料2.防晒涂料C.医药领域1.药物载体2.药用辅料D.陶瓷工业1.陶瓷釉料2.电子陶瓷E.橡胶工业1.轮胎制造2.橡胶补强剂F.化学工业1.催化剂2.吸附剂G.食品工业1.食品添加剂2.营养强化剂H.环保领域1.废水处理2.空气净化I.其他领域1.光学材料2.磁性材料正文:氧化锌(ZnO)是一种常见的无机化合物,具有良好的物理和化学性质。
作为一种重要的工业原料,氧化锌在众多领域都有广泛的应用。
本文将对氧化锌的9类应用领域进行详细介绍。
首先,氧化锌在电子工业中有着广泛的应用。
作为一种半导体材料,氧化锌在光电子器件、光电传感器等方面具有重要应用。
此外,氧化锌具有良好的压敏性能,可用于制作压敏电阻。
其次,氧化锌在涂料工业中具有重要地位。
由于其优异的耐候性和防腐性能,氧化锌被广泛用作防腐涂料和防晒涂料的主要成分。
在医药领域,氧化锌具有良好的生物相容性和药物释放性能,可用作药物载体和药用辅料。
在陶瓷工业中,氧化锌作为陶瓷釉料的主要成分,可以提高陶瓷制品的硬度和耐磨性。
同时,氧化锌还在电子陶瓷等领域有广泛应用。
在橡胶工业中,氧化锌被用作轮胎制造中的补强剂,可以提高轮胎的耐磨性和抗老化性能。
此外,氧化锌在化学工业中可用作催化剂和吸附剂,具有良好的催化活性和吸附性能。
在食品工业中,氧化锌作为食品添加剂和营养强化剂,被广泛应用于食品生产中。
同时,氧化锌在环保领域也有重要应用,可用于废水处理和空气净化等方面。
在其他领域,氧化锌还可用作光学材料和磁性材料。
其高折射率和良好的透明性使其成为一种理想的光学材料;而磁性氧化锌在磁性材料领域具有巨大的应用潜力。
综上所述,氧化锌在众多领域具有广泛的应用,其多种功能和优异性能使其成为一种不可或缺的工业原料。
氧化锌

氧化锌氧化锌是采用环保节能的工艺生产而成的。
氧化锌别名锌氧粉、锌白粉、铅华、亚铅华、锌白,主要应用于橡胶工业、涂料工业、玻璃及陶瓷工业、催化剂、脱硫剂、电子工业、医药、颜料、火柴、农药等多个行业。
产品规格产品名称:氧化锌分子式:ZnO国际商品名称:Zinc Oxide CAS注册号:1314-13-2产品质量标准:GB/T3494-1996 分子量:81.39外观结构:白色或微黄色精细粉末粒径:0.15~0.7μm在玻璃中的用途:在玻璃工业中,氧化锌用在特种玻璃制品中。
玻璃中加入氧化锌,用作助熔剂,可增加透明度、光亮度和抗张力变形,可减少热膨胀系数,在光学玻璃、电气玻璃及低熔点玻璃中得到了新的作用。
纳米氧化锌由于颗粒细、活性高,可以降低玻璃的烧结温度。
添加铝、镓和氮的氧化锌的透明度达90%,可用作玻璃涂料,让可见光通过的同时反射红外线。
涂料可涂在窗户玻璃的内或外,以达到保温或隔热的效果。
间接法、直接法氧化锌的区别间接法氧化锌:间接法氧化锌的原材料是经过冶炼得到的金属锌锭或锌渣。
锌在石墨坩埚内于1000 °C的高温下转换为锌蒸汽,随后被鼓入的空气氧化生成氧化锌,并在冷却管后收集得氧化锌颗粒。
间接法是于1844年由法国科学家勒克莱(LeClaire)推广的,因此又称为法国法。
间接法生产氧化锌的工艺技术简单,成本受原料的影响较大。
间接法生产的氧化锌颗粒直径在0.1-10微米左右,纯度在99.5%-99.7%之间。
按总产量计算,间接法是生产氧化锌最主要的方法。
可用于橡胶、压敏电阻、油漆、磷化液、薄膜、导热材料等产业。
锌锭或锌渣的重金属含量直接影响产物的重金属杂质含量,重金属含量低的产品,还可用于家畜饲料、药品、医疗保健等产业。
直接法氧化锌:直接法氧化锌以各种含锌矿物或杂物为原料。
氧化锌在与焦炭加热反应时,被还原成金属锌被蒸汽,同时再被空气中的氧气氧化为氧化锌,以除去大部分杂质。
直接法获得的氧化锌颗粒粗,产品纯度在75%-99.5%之间。
氧化锌规格

氧化锌规格
氧化锌是一种无机化合物,其规格通常包括物理性质和化学性质。
以下是一般情况下氧化锌的规格:
1.化学式:氧化锌的化学式为ZnO。
2.外观:氧化锌通常呈白色粉末状,有时也可以是颗粒状。
3.纯度:氧化锌的纯度是一个重要的规格。
高质量的氧化锌通常要求具有较高的纯度,以满足不同应用领域的需求。
4.粒度:氧化锌的粒度也是一个重要的规格。
不同的应用可能需要不同粒度的氧化锌,因此通常会有特定的粒度要求。
5.比表面积:氧化锌的比表面积是指单位质量或单位体积的氧化锌颗粒所具有的表面积。
这一规格通常与氧化锌的粒度有关。
6.吸油值:在一些特定应用中,氧化锌的吸油值也是一个重要的规格,特别是在橡胶工业中。
7.熔点:氧化锌的熔点通常较高,约为1,975摄氏度(1,083摄氏度)。
8.导电性:氧化锌通常是一种绝缘体,但在一些特殊处理下,如掺杂或处理成纳米颗粒形式,可能具有一定的导电性。
9.应用:氧化锌的规格还可能与其应用领域相关,比如在橡胶、陶瓷、涂料、医药等方面的不同规格要求。
需要注意的是,氧化锌的规格可能因生产厂家、用途和具体行业标准而有所不同。
在购买氧化锌时,最好根据具体的需求仔细查阅相关的产品规格和标准。
氧化锌百度百科

氧化锌百度百科百科名片氧化锌(ZnO),俗称锌白,是锌的一种氧化物。
难溶于水,可溶于酸和强碱。
氧化锌是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶、润滑油、油漆涂料、药膏、粘合剂、食品、电池、阻燃剂等产品的制作中。
氧化锌的能带隙和激子束缚能较大,透明度高,有优异的常温发光性能,在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中均有应用。
此外,微颗粒的氧化锌作为一种纳米材料也开始在相关领域发挥作用。
本品不受管制中文名称:氧化锌中文别名:白铅粉、锌白英文别名:ZincOxide(AS),Philosopher'swool,Chinesewhite,C.I.Pigmentwhite4,C.I.77947ZnO81.39白色、浅黄色粉末或六方结晶。
无气味。
味苦。
在正常压力下能升华。
能吸收空气中的二氧化碳。
加热至300℃色变黄,但冷却后又成白色。
溶于稀乙酸、矿酸、氨水、碳酸铵和氢氧化碱溶液,几乎不溶于水。
相对密度5.67(六方结晶),(d204)5.607。
熔点1800℃以上。
折光率(nD)2.0041(2.0203)。
密封阴凉保存。
标定乙二胺四乙酸二钠的基准物质。
在锰的氧化还原容量法测定中用以沉淀盐类易水解的元素,如铁、铬、钒、钛和锆。
用作硫化氢吸收剂。
颜料。
半导体。
CAS编号:1314-13-2化学式:ZnO分子量:81.37外观:白色固体相对密度:5.606熔点:1975°C(分解)沸点:2360°C在水中溶解度:0.16mg/100mL(30°C)能带隙:3.3eV标准摩尔生成焓:-348.0kJ/mol标准摩尔熵:43.9J/(K·mol)MSDS编号:ICSC0208EU分类:对环境有害(N)警示性质标准词:R50/53(对水生生物有剧毒,可能对水生环境造成长期的不良影响)安全建议标准词:S60(物质及容器必须按危险废物放置)、S61(防止排向环境)闪点:1436°C氧化锌主要以白色粉末或红锌矿石的形式存在。
锌的氧化物

锌的氧化物一、引言锌是一种常见的金属元素,它的氧化物也是研究的重要对象之一。
锌的氧化物包括氧化锌(ZnO)、亚氧化锌(Zn2O)和二氧化锌(ZnO2)等,其中以氧化锌最为常见。
本文将对锌的氧化物进行全面深入地探讨。
二、氧化锌1. 氧化锌的结构和性质氧化锌是一种白色晶体,具有六方晶系结构。
它具有高温稳定性和耐酸碱性,在空气中不易受到腐蚀。
此外,氧化锌还具有半导体特性,因此被广泛应用于电子器件、太阳能电池等领域。
2. 氧化锌的制备方法(1)热分解法:将碳酸锌在高温下分解,得到氧化锌。
(2)水热法:将硫酸或碱金属离子与碳酸钠混合后,在高温高压下反应得到纳米级别的氧化锌颗粒。
(3)溶胶-凝胶法:将硝酸锌和氨水混合后,通过凝胶化和热处理等过程制备氧化锌。
3. 氧化锌的应用(1)电子器件:氧化锌是一种优良的半导体材料,可用于制备场效应晶体管、发光二极管等电子器件。
(2)太阳能电池:氧化锌可以作为太阳能电池中的透明导电层,提高太阳能电池的转换效率。
(3)医药领域:氧化锌具有抗菌、消炎、止痒等作用,被广泛应用于医药制品中。
三、亚氧化锌1. 亚氧化锌的结构和性质亚氧化锌是一种黑色固体,具有立方晶系结构。
它是一种还原型氧化物,在高温下可以分解为金属锌和氧气。
此外,亚氧化锌还具有超导性质,在低温下表现出良好的超导性能。
2. 亚氧化锌的制备方法(1)高温还原法:将碳酸锌在高温下还原得到亚氧化锌。
(2)溶胶-凝胶法:将硝酸锌和乙醇混合后,通过凝胶化和热处理等过程制备亚氧化锌。
3. 亚氧化锌的应用(1)超导材料:亚氧化锌是一种重要的超导材料,可用于制备高温超导体。
(2)催化剂:亚氧化锌可以作为催化剂在有机合成反应中发挥重要作用。
四、二氧化锌1. 二氧化锌的结构和性质二氧化锌是一种白色粉末,具有立方晶系结构。
它具有较高的热稳定性和光学透明性,在紫外线下表现出良好的荧光特性。
2. 二氧化锌的制备方法(1)热分解法:将碳酸锌在高温下分解,得到二氧化锌。
氧化锌

(4)氧化锌(Zn0)
英文名:Zincoxide;Zincwhite别名:锌氧粉;锌白
相对分子质量:81.37CAS号:1314-13-2
电镀设备用途:用于碱性镀锌、氰化镀锌、含锌合金电解液中和磷化液中。
主要物化性质:白色六角晶系结晶或粉末。
无味、无毒、质细腻。
相对密度5.606。
折射率2.008~2.029。
熔点1975℃。
溶于酸、氢氧化钠、氯化铵,不溶于水、乙醇和氨水。
属两性氧化物。
在空气中吸收二氧化碳和水生成碳酸锌,呈黄色。
加热时变黄,冷却后恢复白1不透过紫外线,遇硫化氢不变黑。
氧化锌中毒者会亡出现食欲不佳,疲倦,胸闷及压痛,嗜睡,干咳,出现体温升高,瞳孔扩大,结膜及咽部、面部充血,糖尿,有时还出现肝大。
质量标准:GB/T3185-92
氧化锌(以干品计)99.7f-99.599.4
金属物(以Zn计)无无0.008
锰的氧化物(以Mn计)0.0370.050.14
部分供应厂家:开封开化(集团)有限公司炼锌厂,湖南省新邵杨桥锌化厂,兰州黄河品有限责任公司
更多电镀设备,详见。
氧化锌参数

氧化锌参数
氧化锌是一种无色或白色固体,其化学式为ZnO,常用于制备橡胶、涂料、化妆品、防晒霜等。
除此之外,氧化锌还具有一些特殊的性质和用途,下面就来详细介绍一下氧化锌的参数。
一、物理性质
1.外观:氧化锌呈无色或白色固体,具有粉末状、晶体状或颗粒状等多种形态。
2.密度:氧化锌的密度为5.606 g/cm³。
3.熔点:氧化锌的熔点为1,975℃,可以通过电弧加热、电炉加热等方式进行熔化。
4.沸点:氧化锌在常压下不会沸腾,只有在高温高压下才会分解。
5.溶解性:氧化锌不溶于水,但可溶于酸、碱、非极性有机物等。
6.热稳定性:氧化锌在高温下稳定性较好,可以抵抗高温热解分解。
二、化学性质
1.化学反应:氧化锌可以与酸、碱等物质发生化学反应,生成相应的盐类和水。
2.氧化还原性:氧化锌具有一定的氧化性和还原性,可以作为氧化剂或还原剂使用。
3.稳定性:氧化锌在空气中相对稳定,但容易吸收水分和二氧化碳,从而发生化学变化。
三、应用领域
1.橡胶工业:氧化锌可以作为防老剂、促进剂等添加剂,用于制备橡胶制品。
2.涂料工业:氧化锌可以作为白色或淡色颜料添加到涂料中,用于提高涂料的遮盖力和光泽度。
4.医药工业:氧化锌可以作为外用药膏、粉末、液体等剂型,用于治疗痤疮、皮炎、烧伤等疾病。
以上就是氧化锌的一些基本参数,无论是在生产制造还是在应用领域,这些参数都有着重要的意义。
随着科技的不断进步,氧化锌的应用领域还会继续扩大和深化。
氧化锌

氧化锌(ZnO),俗称锌白,是锌的一种氧化物。
难溶于水,可溶于酸和强碱。
氧化锌是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶、润滑油、油漆涂料、药膏、粘合剂、食品、电池、阻燃剂等产品的制作中。
氧化锌的能带隙和激子束缚能较大,透明度高,有优异的常温发光性能,在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中均有应用。
此外,微颗粒的氧化锌作为一种纳米材料也开始在相关领域发挥作用。
理化常数CAS编号:1314-13-2化学式:ZnO分子量:81.37外观:白色固体相对密度:5.606熔点:1975 °C(分解)沸点:2360 °C在水中溶解度:0.16 mg / 100 mL(30 °C)能带隙:3.3eV标准摩尔生成焓:-348.0 kJ / mol标准摩尔熵:43.9 J / (K · mol)MSDS编号:ICSC 0208EU分类:对环境有害(N)警示性质标准词:R50/53(对水生生物有剧毒,可能对水生环境造成长期的不良影响)安全建议标准词:S60(物质及容器必须按危险废物放置)、S61(防止排向环境)闪点:1436 °C化学性质氧化锌主要以白色粉末或红锌矿石的形式存在。
红锌矿中含有的少量锰元素等杂质使得矿石呈现黄色或红色。
氧化锌晶体受热时,会有少量氧原子溢出(800 °C时溢出氧原子占总数0.007%),使得物质显现黄色。
当温度下降后晶体则恢复白色。
当温度达1975 °C时氧化锌会分解产生锌蒸气和氧气。
单质碳可用于氧化锌中锌的还原,在高温条件下发生反应:·ZnO + C → Zn + CO氧化锌是一种两性氧化物,难溶于水或乙醇,但可溶于大多数酸,例如盐酸:·ZnO + 2HCl → ZnCl2 + H2O同时可以与强碱反应生成可溶性锌酸盐,例如与氢氧化钠反应:·ZnO + 2NaOH + H2O → Na2[Zn(OH)4]氧化锌在脂肪酸中可发生缓慢的反应,生成相应的羧酸盐,如油酸盐和硬脂酸盐。
氧化锌离子晶体

氧化锌(ZnO)是一种常见的离子晶体,由锌离子(Zn²⁺)和氧离子(O²⁻)组成。
在氧化锌中,锌离子和氧离子以晶格的形式排列,形成了一种稳定的固态材料。
氧化锌具有较高的熔点、良好的热稳定性和机械强度,此外,它还具有半导体性质,因此在电子学和光学领域有着广泛的应用。
氧化锌的离子晶体结构可以通过其空间群来描述,空间群是指晶体中原子或离子的排列方式。
氧化锌的常见晶体结构是六方最密堆积(HCP)结构,这种结构中原子或离子的排列非常紧密,使得材料具有较高的密度和强度。
在实际应用中,氧化锌离子晶体可以通过不同的方法合成,如固相反应、溶胶-凝胶法、化学气相沉积(CVD)等。
这些合成方法可以控制氧化锌的粒径、形状和结晶度,从而满足不同的应用需求。
此外,氧化锌还具有多种同素异形体,如纤锌矿结构(wurtzite structure)和闪锌矿结构(blende structure),这些不同的结构形态对氧化锌的性质有很大影响,如光学性质、电学性质等。
氧化锌离子晶体是一种具有多种应用前景的材料,其独特的物理和化学性质使其在半导体、光伏、催化剂、传感器等领域有着广泛的应用。
国标氧化锌

国标氧化锌国标氧化锌,即GB/T 3185-2016《氧化锌》是中国国家标准化管理委员会发布的一项国家标准。
本文将从氧化锌的性质和用途、国标氧化锌的制备方法和质量要求等方面进行介绍。
氧化锌是一种无机化合物,化学式为ZnO。
它是一种白色结晶粉末,无味无臭,具有良好的光学和电学性质。
氧化锌具有高温稳定性、耐候性和耐腐蚀性,因此被广泛应用于各个领域。
在橡胶工业中,氧化锌是一种重要的橡胶增塑剂,能有效地提高橡胶的强度和耐磨性。
在陶瓷工业中,氧化锌是一种常用的釉料添加剂,能够改善陶瓷的光泽和硬度。
此外,氧化锌还用于制备防晒霜、涂料、橡胶制品、电子元件等。
国标氧化锌的制备方法主要有化学法和物理法两类。
化学法主要包括直接法、间接法和湿法法。
直接法是指将锌粉或锌矿石在高温下与氧气反应生成氧化锌。
间接法是指先将锌粉或锌矿石还原为金属锌,再将金属锌氧化为氧化锌。
湿法法是指利用溶液中的锌盐与氧化剂反应生成氧化锌。
物理法主要包括热分解法和水热法。
热分解法是指将锌化合物在高温下分解生成氧化锌。
水热法是指利用水热条件下的化学反应生成氧化锌。
国标氧化锌的制备方法要求采用化学法或物理法制备,并且要求产品的纯度达到一定的标准。
国标氧化锌对产品的质量要求也有一定的规定。
国标要求氧化锌的主要成分为ZnO,且不得含有有害物质。
产品的外观应为白色结晶粉末,无异物。
国标还对氧化锌的物理性质、化学性质和颗粒性质进行了详细的规定。
例如,国标规定氧化锌的平均粒径、比表面积、吸油量、烧失量等指标应符合相应的要求。
此外,国标还对氧化锌的包装、标志、储存和运输等方面进行了规定。
国标氧化锌是中国国家标准化管理委员会发布的一项国家标准,用于规定氧化锌的制备方法和质量要求。
氧化锌是一种重要的无机化合物,具有广泛的应用领域。
制备氧化锌的方法主要包括化学法和物理法。
国标要求氧化锌的纯度和各项指标符合相应要求。
国标氧化锌的发布为氧化锌产品的制备和应用提供了参考依据,有助于提高产品质量和标准化水平。
氧化锌种类(3篇)

第1篇一、锌烟法氧化锌锌烟法氧化锌是通过锌的燃烧或者锌的氧化反应制得的。
这种氧化锌的制备方法简单,生产成本低,是氧化锌生产的主要方法之一。
锌烟法氧化锌的特点如下:1. 物理形态:呈白色粉末状,具有良好的流动性和分散性。
2. 化学性质:具有较强的吸附性和催化活性,对酸、碱、盐等化学物质具有良好的稳定性。
3. 应用领域:主要用于橡胶、塑料、涂料、陶瓷等行业,可提高产品的耐磨性、耐热性、耐候性等性能。
二、电解法氧化锌电解法氧化锌是通过锌的电解反应制得的。
这种方法具有高纯度、低杂质含量的特点,是高品质氧化锌的主要生产方法之一。
电解法氧化锌的特点如下:1. 物理形态:呈白色粉末状,颗粒均匀,流动性好。
2. 化学性质:具有很高的纯度和化学稳定性,对酸、碱、盐等化学物质具有良好的稳定性。
3. 应用领域:主要用于电池、电子、光学、医药等行业,可提高产品的导电性、光学性能、生物活性等。
三、直接法氧化锌直接法氧化锌是通过锌的燃烧或者锌的氧化反应制得的,与锌烟法氧化锌的制备方法类似。
但直接法氧化锌具有更高的生产效率和更好的环保性能。
直接法氧化锌的特点如下:1. 物理形态:呈白色粉末状,具有良好的流动性和分散性。
2. 化学性质:具有较强的吸附性和催化活性,对酸、碱、盐等化学物质具有良好的稳定性。
3. 应用领域:主要用于橡胶、塑料、涂料、陶瓷等行业,可提高产品的耐磨性、耐热性、耐候性等性能。
四、纳米氧化锌纳米氧化锌是指粒径在1-100纳米范围内的氧化锌粉末。
由于其具有特殊的物理化学性质,纳米氧化锌在许多领域具有广泛的应用前景。
纳米氧化锌的特点如下:1. 物理形态:呈白色粉末状,粒径小,比表面积大。
2. 化学性质:具有优异的吸附性、催化性、光催化性等,对酸、碱、盐等化学物质具有良好的稳定性。
3. 应用领域:主要用于橡胶、塑料、涂料、陶瓷、医药、环保等行业,可提高产品的耐磨性、耐热性、耐候性、环保性能等。
五、活性氧化锌活性氧化锌是指具有较高比表面积和孔隙率的氧化锌。
氧化锌常识

1 普通氧化锌的生产工艺及制备方法进展普通氧化锌包括直接法氧化锌、间接法氧化锌和湿法氧化锌。
其中直接法氧化锌占10%-20%,间接法氧化锌占70%气80%,而湿法氧化锌只占1%-2%。
直接法也称“韦氏炉”法,因首先出现在美国,又称“美国法”。
直接法生产氧化锌,优点是成本较低,热效率高。
含锌的原料在1000-1200℃下,被含碳物质(主要是煤)还原。
锌原料的含锌质量分数在60%-70%。
反应设备一般选用回转窑。
常用的回转窑长30m,直径2.5 m左右。
燃烧气中含有的锌蒸气和CO,可导入氧化设备,使氧化反应进行完全,再经过热交换器,冷却后进入布袋分离器,以收集成品。
直接法生产的氧化锌为针状结构,是工业等级氧化锌。
直接法氧化锌因含有未能完全分离的杂质,白度也较差,但因价格较低而有一定的销路。
间接法出现于19世纪中叶,法国使用金属锌在坩埚中高温气化,并使锌蒸气氧化燃烧,而收集到氧化锌粉末,因此也称为“法国法”。
工业上,间接法生产ZnO是先将锌块在高温下熔融而蒸发成锌蒸气,进而氧化生成ZnO。
产品品型及物理性能与氧化的条件有关,而产品的纯度与所用的锌块纯度有关。
间接法也可使用锌渣等低规格的含锌原料,但需要采用气-液相的分离技术,预先分离出Cd,Pb,Fe及Al等杂质,以提高锌蒸气的纯度。
除去杂质的措施如下:1)采用坩埚法或马弗炉法,使不易蒸发的Fe和Pb等杂质成渣而分离;2)采用分馏法,使高温蒸发的原料蒸气中的Cd,Pb,Fe,Al及Cu等杂质在通过由碳化硅材料制成的分馏塔板时得以分离;3)采用二室炉分离法,原料预先在一室炉中分离杂质,进入第二室后,在无氧存在的条件下进行蒸馏,以提高锌蒸气的纯度,如纯度不够,还可以继续用分馏法分离少量的Pb;4)采用回转窑法,在回转窑中使物料熔化、蒸馏,并有部分氧化,可控制温度、CO2及O2的分压等操作条件,以减少Pb杂质的含量,还可控制生成的氧化锌的颗粒和晶体形状。
间接法生产的氧化锌为无定形,可制成光敏氧化锌、彩电玻壳用氧化锌、药用氧化锌及饲料级氧化锌等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ZrO2粉体合成与表征一前言ZrO2属于新型陶瓷,由于它具有十分优异的物理、化学性能,不仅在科研领域已经成为研究热点,而且在工业生产中也得到了广泛的应用,是耐火材料、高温结构材料和电子材料的重要原料。
在各种金属氧化物陶瓷材料中,ZrO2的高温热稳定性能,热性能最好,最适宜傲陶瓷涂层和高温耐火制品,以ZrO2为主要原料的锆英石基陶瓷颜料,高级釉料的重要成分;ZrO2的热导率在常见的陶瓷材料中最低,而热膨胀系数又与金属材料较为接近,成为重要的结构陶瓷材料;特殊的晶体结构,使之成为重要的电子材料;ZrO2的相变增韧等特性,成为塑性陶瓷材料的宠儿;良好的机械性能和热物理性能,使它能够成为金属基复合材料中性能优异的增强相。
目前在各种金属氧化物陶瓷中ZrO2的重要作用仅次于Al2O3由于氧化锆材料具有高硬度,高强度,高韧性,极高的耐磨性及耐化学腐蚀性等等优良的物化性能,氧化锆已经在陶瓷、耐火材料、机械、电子、光学、航空航天、生物、化学等等各种领域获得广泛的应用。
二结构性质氧化锆是白色固体,含有杂质时会显现灰色或淡黄色,添加显色剂还可显示各种其它颜色。
纯氧化锆的分子量为123.22,理论密度是5.89g/cm3,熔点为2715℃。
通常含有少量的氧化铪,难以分离,但是对氧化锆的性能没有明显的影响。
氧化锆有三种晶体形态:单斜、四方、立方晶相。
常温下氧化锆只以单斜相出现,加热到1100℃左右转变为四方相,加热到更高温度会转化为立方相。
由于在单斜相向四方相转变的时候会产生较大的体积变化,冷却的时候又会向相反的方向发生较大的体积变化,容易造成产品的开裂,限制了纯氧化锆在高温领域的应用。
但是添加稳定剂以后,四方相可以在常温下稳定,因此在加热以后不会发生体积的突变,大大拓展了氧化锆的应用范围。
氧化锆(化学式:ZrO2)是锆的主要氧化物,通常状况下为白色无臭无味晶体,难溶于水、盐酸和稀硫酸。
一般常含有少量的二氧化铪。
化学性质不活泼,但高熔点、高电阻率、高折射率和低热膨胀系数的性质,使它成为重要的耐高温材料、陶瓷绝缘材料和陶瓷遮光剂。
能带间隙大约为5-7eV。
二氧化锆的晶体结构自然界中以少见的斜锆石存在,为单斜晶系结构。
高熔点的立方氧化锆也是二氧化锆晶型之一,自然界以等轴钙锆钛矿((Zr,Ti,Ca)O2)少量存在,但多为人工合成,用作钻石的替代品。
二氧化锆还有另外一种四方晶系晶型。
这三者之间的转变温度受杂质影响很大,因此很难确定,大致在1100°C(单斜↔四方)和1900°C(四方↔立方)。
图1-1 ZrO2的三种晶形及相应的空间群如图1-1所示,ZrO2共有三种晶型,在高温段(>2370℃)为立方相,在中温段(1200—2370℃)为四方相,在低温段(<950℃)为单斜相。
ZrO2的四方晶型相当于萤石结构沿着C轴伸长而变形的晶体结构,而单斜晶则为四方晶沿着β角偏转一个角度而成。
三种晶形ZrO2的晶格常数见表1-1[6]。
纯二氧化锆的单斜相从室温到ll70℃是稳定的,超过这一温度转变为四方相,然后在2570℃转变为立方相,直到2680℃发生熔化。
二氧化锆的这三种晶型:单斜、四方和立方,其密度分别为5.65g·cm-3.6.10g·cm-3.6.27g·cm-3。
可见在同样质量下,温度越低,体积越大。
纳米二氧化锆的特性二氧化锆具有熔点和沸点高、硬度大、常温下为绝缘体、而高温下则具有导电性等优良性质二氧化锆有3种晶型.属多晶相转化的氧化物稳定的低温相为单斜晶结构(m—ZrO2)。
高于1 000 ℃时四方晶相(t—ZrO2 )逐渐形成,直至2 370 ℃只存在四方晶相,高于2 370 ℃至熔点温度则为立方晶相(c—ZrO2 )ZrO2在加热升温过程中伴随着体积收缩,而在冷却过程中则体积膨胀,因此在使用时为使其不发生体积变化,必须进行晶型稳定化处理。
常用的稳定剂有Y 0j、CaO、MgO、CeO:和其它稀土氧化物这些氧化物的阳离子半径与Zr“相近(相差在1 2 以内),它们在ZrO2中的溶解度很大.可以和ZrO2形成单斜、四方和立方等晶型的置换型固溶体。
这种固溶体可以通过快冷避免共析分解,以亚稳态保持到室温。
二氧化锆的化学性质很稳定,经煅烧后的二氧化锆性质尤其不活泼。
它可以被热浓盐酸、硫酸、氢氟酸和硝酸所侵蚀,高温下与氢氧化物、氧化物和碳酸盐共熔可生成锆酸盐,在酸中的溶解度与ZrO2的煅烧温度有关,煅烧温度愈高,溶解度则越低,见表1-2[7]。
高温煅烧过的ZrO2在浓硫酸中不易溶解,仅溶于氢氟酸。
ZrO2容易与碱和碳酸盐熔烧,形成锆酸盐。
也能与卤素化合,如在有碳存在下与氯作用生成ZrCl4。
表1-2 ZrO2的煅烧温度与酸溶解关系Table 1-2 The relationship on temperature of calcination and solubility in acid①表中的数字为50ml溶液溶解ZrO2的克数。
二氧化锆实质上是高分子的混合金属氧化物。
二氧化锆与碳和氯气高温反应,或者与四氯化碳反应,生成四氯化锆及二氯氧化锆,水解又得到二氧化锆。
它在电弧中与碳作用生成碳化锆。
三制备方法制备ZrO2纳米陶瓷粉体的方法有很多,大致分为固相法、气相法、液相法,也有的是这几种方法的综合,还有一种利用机械能的高能球磨法。
每一类方法又包括几种具体的方法。
在制备不同的陶瓷粉体时,同样的方法所需要的条件也可能不同。
由于液相法制备纳米粉体所需要的设备比较容易得到,因此在实验室中多采用液相法来制备纳米粉体。
在制备纳米粉体时,也多采用液相法。
长期以来,人们采用了许多方法来制备ZrO2纳米粉体。
3.1共沉淀法【1】共沉淀法是在羟基氯化锆等水溶性锆盐与稳定剂盐的混合水溶液中加入氨水等碱性物质,以获得两者的氢氧化物共沉淀的方法。
将沉淀物干燥后一般得到非晶态氢氧化物,经煅烧而制成ZrO2粉,其工艺流程如图1所示。
该方法工艺简单,所得粉体性能优良,但在洗涤后的沉淀物中,保留少量残余物(NH4Cl)对煅烧粉末的性能有不良影响。
另外,该法在反应过程中会产生团聚,所制备粉末分散性能较差,直接影响到陶瓷的性能。
为避免粉末的团聚,在粉末的制备过程中,可适当加入分散剂、表面活性剂或助表面活性剂,来分散和制粉末的分散性和粒径。
3.2水热法【2】水热法的实质是把前驱物置于高温高压的水热介质中进行化学反应,实现原子、分子级的微粒成核和晶体生长,最终形成具有一定粒度和结晶形态的晶粒的过程。
无论是从热力学与动力学观点或者是从工艺技术考虑,水热法都有着明显的优势。
例如:固体试样的大范围稳定性、动力学快速结晶;低温一步水热工艺、晶粒大小的可控制性、多功能性、环保技术等等。
国外水热法制备ZrO2已经实现工业生产,但由于该法需要特殊的高压釜设备,该设备易被腐蚀,且后处理设备复杂,目前在我国尚未实现工业化大生产。
3.3溶胶一凝胶法【3】溶胶一胶法是指金属的有机或无机化合物经过溶解、水解、沉淀、胶化、凝胶而固化成水合氧化锆,然后经脱水,干燥及煅烧来制得纳米ZrO2粉末。
这种无机胶化的溶胶—凝胶法的特点可概括为以下3点:①反应的速度很快,生成物几乎全为次粒子,团聚很少;②粒子的大小和形状均一;③化学纯度和相结构的单一性好。
四表征TEM是指简称透射电镜,是把经加速和聚集的电子束投射到非常薄的样品上,电子与样品中的原子碰撞而改变方向,从而产生立体角散射。
散射角的大小与样品的密度、厚度相关,因此可以形成明暗不同的影像。
通常,透射电子显微镜的分辨率为0.1~0.2nm,放大倍数为几万~百万倍,用于观察超微结构。
光学显微镜下无法看清的结构,又称“亚显微结构”。
XRD是X-ray diffraction 的缩写,X射线衍射,通过对材料进行X射线衍射,分析其衍射图谱,获得材料的成分、材料内部原子或分子的结构或形态等信息的研究手段。
显微镜ZrO2(3Y)粉体的XRD图谱见图1。
由图可见粉体基本为四方相,此外有少量的单斜相。
图2为粉体的TEM照片,由照片可见粉体颗粒为30纳米时,分散性最好。
五总结和展望对于ZrO2陶瓷粉体性能研究来说,今后研究的重点仍是寻求行之有效的适合工业化大生产的高质量ZrO2粉体制备方法,也就是说,特种粉体性能与其制备方法紧密相关,要制备出粒度更细、分布更窄、更均匀、分散性更好、表面性能更优越的粉体,就要首先研究新的制备原理,制备方法及制备设备,从而使粉体制造工艺流程短,生产能力大,能耗低,经济合理适于工业化。
随着人们对ZrO2的不断认识,以及对纳米材料的更深入的了解,纳米ZrO2的制备方法将得到更大的发展。
根据不同的用途而采用不同的制备方法,将成为现实,使纳米ZrO2的性质得到更大的发挥。
六实验方案6.1实验原料试剂与仪器磁力加热搅拌器,自制以阴离子交换膜隔膜的两室电解槽,梅特勒一托利多仪,马福炉,直流稳压电源红外线快速干燥器,离心机,两块网状扩张性钌钛电极,碘化钾淀粉试纸。
硝酸氧锆(ZrO(NO3)2)硝酸钠,氢氧化钠,无水乙醇均为分析纯,去离子水。
6.2实验方法(1)取0.1mol/L硝酸氧锆50mL加入0.5mo/L硝酸钠置于电解槽的阴极室,同时将一定量的05mol/L硝酸钠溶液置于阳极室(用浓氢氧化钠溶液始终控制阳极室pH>7)。
(2)在室温下,通入直流电,控制阴极电流密度为100A/m2,阳极室有氧气释放,阴极室强烈磁搅拌下,在在不断电解水消耗H释放OH一。
开始时阴极室电解液的pH值为2.1上升到4.0左右白色乳浊液生成,PH值不断上升时有大量的白色乳浊液析出,当pH值达到12.0左右,停止反应。
(3)先用去离子水反复洗涤白色乳浊液,同时使滤液酸化,碘化钾淀粉试纸检验无NO3-,NO2-为止.后用无水乙醇洗涤三次,沉淀物置于温度为9℃的红外线快速干燥器内干燥2h。
得到ZrO2·XH2O(前躯体)。
(4)按3℃/min升温速率加热到不同焙烧温度保温2h后随炉冷却,可得到粒径和晶型不同的ZrO2粉体。
7.实验方案依据共沉淀法该法在洗涤后的沉淀物中,保留少量残余物(NH4Cl)对煅烧粉末的性能有不良影响。
另外,在反应过程中会产生团聚,所制备粉末分散性能较差,直接影响到陶瓷的性能;机械研磨法在细磨过程中介质容易对原料污染;用湿化学方法制备ZrO2超细粉末,一般纯度不会太高,杂质主要来源于两个方面:反应原料和制备工艺。
为了获得高纯度的超细粉末,要在低浓度环境下为需使用高纯锆盐原料,用小剂量高效表面活性剂等。
电解法以其流程短、成本低、工艺简单、量高、纯度高产等优点在工业上广泛应用。
在以阴离子交换膜将电解槽分为两室中,进行电解,阴极表面形成类似均匀释放OH~的硬模板,成了均匀沉淀反应,制备出粒径均匀、分散性好的纳米粉体。
