酸碱盐溶解性表的分类解释
常见酸碱盐溶解性表的巧用

SO42-、CO32- )所形成的化合物就是酸, (表2常见酸碱盐化学式表第一横行的物质)。 读某酸,如硝酸HNO3、盐酸HCl 、硫酸 H2SO4 、碳酸H2CO3。
2.什么是碱、常见的碱
金属阳离子(NH4+相当于金属阳离子)和氢氧根离 子(OH-)所形成的化合物就是碱,(表2常见酸 碱盐化学式表第一纵行的物质)。读氢氧化某,如 氢氧化钾KOH、氢氧化钠NaOH、氢氧化钡Ba (OH)2、氢氧化钙Ca(OH)2 、氢氧化镁Mg (OH)2、氢氧化铝Al( OH)3 、氢氧化锰Mn ( OH)2 、氢氧化锌Zn( OH)2、氢氧化亚铁 Fe ( OH)2 、氢氧化铁Fe( OH)3、氢氧化铜Cu ( OH)2(NH3.H2O读一水合氨)。
Al3+、Mn2+、Zn2+、Fe2+ 、Fe3+ 、Cu2+ 、 Ag+、OH-、NO3-、Cl-、SO42-、CO32-。只
要把这十几个离子符号记住(记离子符号要 同时记元素符号和化合价),然后我们再根 据化合物中各元素化合价代数和为零的原则, 就可以很轻松地把各酸碱盐的化学式写出来 了。
温故而知新!
(3)酸+盐→新酸+新盐。如:
H2O+CO2↑; H2SO4+BaCl2==BaSO4↓+2HCl (4)盐(溶)+碱(溶)→新盐+新碱。如: 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ ; NaOH+NH4Cl=NaCl+NH3↑+H2O (5)盐(溶)+盐(溶)→两种新盐。如: Na2SO4+BaCl2=2NaCl+BaSO4↓ CaCl2+Na2CO3==2NaCl+CaCO3↓
溶解性表详解

部分酸、碱和盐的溶解性表(室温)
阳 离
阴离子 OH - (氢氧根) NO3 - (硝酸根) Cl- (盐酸根)
子
H+
NH
+ 4
1.写出所有的阳离子与CO32-结合所生成的
K+
化合物的化学式和名称。
Na + 2.生成的化合物有什么共性?什么是盐酸
Ba2+
盐?
Ca 2+ Mg2+
3.共有几种?几种可溶、几种微溶、几种 不溶?
Fe2+
3.除BaSO4不溶,CaSO4、Ag2SO4微
Fe3+
溶,11种硫酸盐可溶。
Cu2 +
Ag +
SO4 2- (硫酸根) CO32 - (碳酸根)
H2SO4 (硫酸) (NH4)2SO4(硫酸铵) K2SO4 (硫酸钾) Na2SO4 (硫酸钠) BaSO4 (硫酸钡) CaSO4 (硫酸钙) MgSO4 (硫酸镁) Al2(SO4)2 (硫酸铝) MnSO4 (硫酸锰) ZnSO4 (硫酸锌) Fe SO4 (硫酸亚铁) Fe2(SO4)3 (硫酸铁) CuSO4 (硫酸铜) Ag2SO4 (硫酸银)
Ag +
AgCl(氯化银)
SO4 2- (硫酸根) CO32 - (碳酸根)
2.它们的阴离子全部是Cl - , 酸根离子全部是Cl- 离子的 化合物叫盐酸盐。 3.除AgCl不溶,12种盐酸 盐可溶。
部分酸、碱和盐的溶解性表(室温)
阳 离
阴离子 OH - (氢氧根) NO3 - (硝酸根) Cl- (盐酸根)
NH
+ 4
K+
NH 3.H2O (铵水) KOH (氢氧化钾)
溶解性表详解

Na +
NaOH (溶)
Ba2+ Ca 2+ Mg2+
Ba(OH )2(溶) Ca(OH)2 (微) Mg(OH)2(不)
Al 3+
Al(OH )3 (不)
Mn2+
Mn(OH )2(不)
Z n2+
Zn(OH)2(不)
Fe2+
Fe(OH)2(不)
Fe3+
Fe(OH )3(不)
Cu2 +
Cu(OH )2(不)
(NH4)2CO3(碳酸铵) K2CO3 (碳酸钾) Na2CO3 (碳酸钠) BaCO3 (碳酸钡) CaCO3 (碳酸钙 ) MgCO3 (碳酸镁 )
—— MnCO3 (碳酸锰) ZnCO3 (碳酸锌) FeCO3 (碳酸亚铁)
——
——
Ag2CO3 (碳酸银)
部分酸、碱和盐的溶解性表(室温)
所有的化学式与名称
(溶)
(溶)
(溶)
(溶)
(溶)
(溶) (溶) (溶) (溶) (溶) (溶) (溶) (溶) (溶)
(溶)
(溶) (溶) (溶) (溶) (溶) (溶) (溶) (溶) (溶) 第9页,共12(页。不)
SO4 2- (硫酸根) CO32 - (碳酸根
(溶)
)(溶、挥)
(溶)
(溶)
(溶)
(溶)
(溶) (不) (微)
Al2(SO4)2 (溶)
MnSO4 ZnSO4 Fe SO4
(溶) (溶) (溶)
—— MnCO3 (不) ZnCO3 (不) FeCO3 (不)
Fe2(SO4)3 (溶)
——
CuSO4 (溶) Ag2SO4 (微)
部分酸碱盐的溶解性表

OH H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+ 酸 1、三大强酸:HCl、HNO3、H2SO4 2、四大强碱:KOH、NaOH、Ba(OH)2、Ca(OH)2 3、可溶性碱:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O 4、不可溶性碱的颜色:Cu(OH)2蓝色、Fe(OH)3红褐色、其余不溶性碱为白色 5、盐类物质记忆口诀:钾钠氨盐都可溶;碳酸氢盐都可溶;硝酸盐遇水无影踪;氯化物不溶氯化银;硫酸盐不溶硫酸钡,微溶硫酸钙、硫 酸银;碳酸盐、磷酸盐只溶钾钠氨 溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不
说明:溶表示可溶于水;不表示不溶于水;微表示微溶于水;挥表示挥发性
-
NO3
-
Cl
-
SO4
2-ห้องสมุดไป่ตู้
CO3
2-
O
2-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 碱
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 不
溶 溶 溶 溶 不 微 溶 溶 溶 溶 溶 溶 溶 微 盐
溶、挥 溶 溶 溶 不 不 微 溶 溶 溶 溶 不 不 不 不 不 不 不 不 不 不 不 不 氧化物
酸碱盐的溶解性表是学习化学的重要工具之一

酸碱盐的溶解性表是学习化学的重要工具之一酸碱盐溶解性表:一把可以“开启”化学大门的钥匙。
酸碱盐的溶解性表是学习化学的重要工具之一,它能够清楚表明物质在各种不同条件下的溶解性,这种特殊的属性有助于我们理解并预测化学过程及其产物。
一、什么是酸碱盐溶解性表酸碱盐溶解性表是一张总结了各种酸碱盐物质在不同条件下溶解性的表格,它是由三行表示酸、碱、盐的溶解性,并有一些特殊的符号表示物质的溶解性。
在这张表中,化学学家会根据实际测试结果,用相应的符号来标注各种物质在不同条件下的溶解性,从而使该表能够表现出一种完成的形式来总结酸碱盐的溶解性。
二、酸碱盐溶解性表的意义在学习和加深对酸碱盐溶解性方面的理解中,酸碱盐溶解性表是至关重要的。
它可以让我们准确知道不同物质在各种环境中溶解性的变化,从而帮助我们更清楚地理解化学过程及其产物。
1、帮助我们理解化学过程酸碱盐溶解性表是学习化学的一个很重要的工具,其中涵盖了各种各样的反应,例如过程中物质的分解、混合、变质等,通过其中的反应公式,我们可以更清楚地了解反应的机理。
2、帮助我们预测化学反应的产物酸碱盐溶解性表中的符号也可以用来预测化学反应的产物,因为它直接表明了酸碱盐物质在混合后溶解性的变化情况,可以帮助我们判断反应过程中物质会产生什么样的结果,从而使我们能够更好地预测化学反应的产物。
三、总结酸碱盐溶解性表是学习化学的重要工具,帮助我们更清楚地理解化学过程及其产物,也能预测化学反应的产物,从而有助于我们深入了解酸碱盐的溶解性特点。
然而,学习酸碱盐溶解性并不仅仅是停留在表格上读取信息,而是要深入了解每一个现象背后的原理,这样才能正确地解释这些现象,并获得更好的理解,灵活运用酸碱盐溶解性表格,以期更好地利用酸碱盐溶解性表中的信息,实现高效的化学学习。
酸碱盐溶解性表的解说

酸碱盐溶解性表的解说
在这个表中,我们首先要能认识里面的酸、碱、盐。
第一横行和第一纵行分别表示的是阴、阳离子;第一横行和第二纵行相交的空格表示H2O; 向右依次是HNO3\HCl\H2SO4\H2CO3。
酸都可溶。
第一纵行的阳离子和第二纵行的氢氧根离子构成的是碱,碱中只有NH3·H2O、KOH、NaOH、Ba(OH)2可溶、Ca(OH)2微溶第一纵行的阳离子和第三纵行的NO3-离子(除第一横行的酸)构成的是硝酸盐,如硝酸铵、硝酸钾、硝酸钠等,硝酸盐类都可溶。
硝酸盐是指阴离子都是硝酸根的盐。
再向右依次是:盐酸盐、硫酸盐、碳酸盐。
盐的另一种命名法是用它含有的阳离子来命名,如KNO3、KCl、K2SO4、K2CO3等,它们的阳离子都是钾离子,我们又可以把它们叫做钾盐,因此,又有钠盐、铵盐、钙盐等记忆的口诀是:钾、钠、铵盐水中溶;硝酸盐入水无影踪(也就是说它们对应的盐都可溶);盐酸盐除了银亚汞(盐酸盐中除了氯化银和氯化亚汞不溶,其他都可溶);硫酸钡、铅水不溶(硫酸盐中只有硫酸钡和硫酸铅不溶、硫酸钙微溶,其他都可溶);碳酸盐只溶钾钠铵(碳酸盐中只有碳酸钾、碳酸钠、碳酸铵、碳酸氢铵可溶、碳酸镁微溶,其他都不溶)。
钾、钠、铵盐水中溶;
硝酸盐入水无影踪;
盐酸盐除了银亚汞;
硫酸钡、铅水不溶;
碳酸盐只溶钾钠铵。
酸都可溶
碱中只溶钾钠钡钙铵(碱中只有NH3·H2O、KOH、NaOH、Ba(OH)2可溶、Ca(OH)2微溶)。
酸碱盐规律溶解性及典型口决

四:当酸与两种盐混合溶液反应产生气体、沉淀时,产生“气体” 优于产生“沉淀”。
例:向稀盐酸与氯化钡的混合溶液中逐滴滴加碳酸钠溶 五:当金属、金属氧化物与酸反应时,金属氧化物优先于金属与酸 反应。 兴城四中 太极晓月原创
P114 溶解 性表
盐:
碱:
硫酸盐: 盐酸盐: 碳酸盐:
钾钠铵盐硝酸盐 完全溶解不困难 碱中铵钾钠钡溶 钙是微溶银无用 其余全部都不溶 硫酸盐中钙和银 微溶最好不要用 硫酸钡和氯化银 遇水硝酸都不溶 碳酸盐中镁微溶 铝铁和铜真无用 剩余基本都不溶 兴城四中 太极晓月原创
溶液颜色:蓝色溶液铜离子 亚铁浅绿铁黄色
沉淀颜色:氢氧化铜是蓝色 氢氧化铁红褐色 剩余沉淀是白色
兴城四中 太极晓月原创
ቤተ መጻሕፍቲ ባይዱ
复分解反 应条件:
酸碱中和必反应 酸盐作用酸要溶 碱盐都溶才可能 有酸参加须强酸 盐盐相互更要溶 无酸参加须可溶 酸遇金属氧化物 斑斑锈迹无影踪 互换成分要成立 沉气或水有就行
兴城四中 太极晓月原创
酸的化学性质(通性) 排在金属活动性顺
只有当两种化合物互相交换成分, 生成物中有沉淀或有气体或有水 生成时,复分解反应才可以发生。
复分解反应的实质
酸碱盐在溶液中发生离子间的互 换反应。
兴城四中 太极晓月原创
空气口决 氮七八氧二一
零点九四是稀气 还有两个零点零三
二氧化碳和稀气
兴城四中 太极晓月原创
复分解反应类型 :
1.金属氧化物+酸→盐+水
酸碱盐知识和溶解性

微 MgCO3
--不 ZnCO3 不 FeCO3 ---
--不 Ag2CO3
酸碱盐溶解性表口诀
钾钠铵盐皆可溶, 硝酸盐类也全溶, 氯化物中银不溶, 硫酸钡铅水不溶, 碳酸盐类多不溶, 看完盐类看碱类, 只溶钾钠氨和钡。
二、酸碱盐溶解性表的应用
HNO3 HCl H2SO4 H2CO3
KOH
NaOH 碱的组成:
NH3·H2O
Ba(OH)2
金属离子 + OH-
Ca(OH)2
Mg(OH)2
Al(OH)3
Zn(OH)2
Fe(OH)2 Fe(OH)3
Cu(OH)2
一、什么是酸?碱?盐?
2.碱:电离是时,产生的阴离子 全部是 OH- 的化合物。
NaOH
1.根据离子符号,书写物质的化学式。 2.判断酸碱盐之间的复分解反应能不能发生。
复分解反应发生的条件: 两种化合物相互交换成分,生成物中 有沉淀、或有气体、或有水生成。
例1:下列哪些复分解反应能够发生?为什么? 能反应的写出化学方程式.
(1)NaOH+CuCl2— (2)NaCl+K2CO3— (3)BaSO4+HNO3— (4)Cu(OH)2+H2SO4—
酸碱盐溶解性表口诀钾钠铵盐皆可溶硝酸盐类也全溶氯化物中银不溶硫酸钡铅水不溶碳酸盐类多不溶看完盐类看碱类2
酸碱盐知识
学习的基本方法
一、什么是酸?碱?盐?
HNO3 HCl
H2SO4 H2CO3
酸的组成: H+ + 酸根离子
一、什么是酸?碱?盐?
1.酸:电离是时,产生的阳离子 全部是 H+的化合物。
完整)初中化学酸碱盐溶解性表以及口诀

完整)初中化学酸碱盐溶解性表以及口诀
盐的分类可以分为盐酸盐、硝酸盐、碳酸盐、硫酸盐、钠盐、钾盐、镁盐、钙盐、亚铁盐和铁盐等多种类型。
其中,盐酸盐包括NaCl和KCl,硝酸盐包括NaNO3和KNO3,碳酸盐包括Na2CO3、MgCO3、FeCO3和CaCO3,硫酸盐包括
Na2SO4、K2SO4、MgSO4、FeSO4和CaSO4,钠盐包括NaCl、NaNO3、Na2CO3、Na2SO4和NaNO3等。
钾盐包括KCl、KNO3和K2CO3等。
酸碱盐的溶解性与阳离子和阴离子的组合有关。
在20℃下,H+、NH4+、K+、Na+、Ba2+、Ca2+、Mg2+、Al3+、
Mn2+、Zn2+、Fe2+、Fe3+和Cu2+等阳离子与NO3-、Cl-和
SO42-等阴离子结合时,大多数都能溶解。
但是,AgCl只有微溶,BaSO4只有微溶,而碳酸盐只有K+、Na+、NH4+等阳离
子才能溶解,碱类只有K+、Na+、NH4+和Ba2+、Ca(OH)2、CaSO4、Ag2SO4等阳离子才能溶解。
为了记忆这些酸碱盐的溶解性,可以使用口诀:“钾钠铵
硝酸盐全溶,盐酸盐只有AgCl不容,硫酸盐只有BaSO4不容,
碳酸盐只溶K+、Na+、NH4+,碱类只溶K+、Na+、NH4+和Ba2+、Ca(OH)2、CaSO4、Ag2SO4”。
初中化学酸、碱和盐的溶解性表

溶
溶
溶
不
Ag+
-
溶
不
微
不
“溶”表示那种物质可溶于水,
“不”表示不溶于水,
“微”表示微溶于水,
“挥”表示挥发性,
“---”表示那种物质不存在或遇到水就分解了
Mg(OH)2,Al(OH)3,AgCl,BaSO4,BaCO3等均为白色沉淀
Cu(OH)2蓝色沉淀
Fe(OH)3红褐色沉淀
溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液
部分酸、碱和盐的溶解性表(20℃)
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
溶溶Leabharlann 溶溶溶K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
-
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
-
Cu2+
不
化学常见酸碱盐溶解性

化学常见酸碱盐溶解性中考重点|化学常见酸碱盐溶解性1.酸:氢离子和各酸根离子构成酸,都是可溶的。
注意:硝酸(HNO3),盐酸(HCl)以及硫酸(H2SO4)属于三大强酸,碳酸(H2CO3)则属于弱酸。
除了浓硫酸具有吸水性,另外三种酸都具有挥发性。
2.碱:由金属元素或铵根与氢氧根组成的化合物,称为碱。
记住常见的碱中可溶性的碱,五个字:“钾钠钙钡铵”【KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3∙H2O】都是可溶性的碱。
补充:氢氧化钙微溶于水,也就是我们经常提到的澄清石灰水,氢氧化铜是蓝色絮状沉淀,氢氧化铁是红棕色的絮状沉淀。
物质的特性,在推断题中常作为物质的信息点和突破口。
Cu(OH)2沉淀Fe(OH)3沉淀前方高能!重!点!来!了!3.盐:金属离子(或铵根)与酸根离子构成的化合物3.1.三个字——“钾钠铵”。
在盐的分类中,根据盐中金属元素(或铵根) 的种类,盐可以分为钾盐(KCl、K2CO3、K2SO4),钠盐(NaCl、Na2CO3、NaNO3),铵盐(NH4Cl、NH4NO3、NH4HCO3)等。
由钾、钠、铵【K、Na、NH4】组成的盐,一定都是可溶的,以上已举例。
3.2. 三个字——“三强酸”找三强酸的酸根,前面讲到三大强酸,分别是硝酸,盐酸,和硫酸。
当盐中有盐酸根(Cl−),硫酸根(SO42−),硝酸根(NO3−)的时候,都是可溶的。
比如:NaCl、Na2SO4、NaNO3。
但是!但是!记住两个挑事儿的特例①含有盐酸根(Cl−)的盐当中,氯化银(AgCl)是不可溶的白色沉淀;②含有硫酸根(SO42−)的盐中,硫酸钡(BaSO4)是不可溶的白色沉淀;这两个是含有三强酸酸根的常见盐当中唯一两个不可溶的碱。
所以,如果某种盐中既没有钾钠铵,也没有三强酸酸根,则该种盐为不可溶性盐。
你也会发现,大部分的碳酸盐,都是不可溶的。
下面你可以花30s时间来记住以上几点。
然后检查一下自己是否有理解和记住:判断以下三种物质的溶解性:(1) MgSO4 (2) BaCO3 (3) Mg(OH)2(1) MgSO4:属于盐,以三强酸中的硫酸根结尾,为可溶性盐;(2) BaCO3:属于盐,没有钾钠铵,也没有三强酸的酸根,为不可溶性盐;(3) Mg(OH)2:属于碱,非“钾钠钙钡铵”其中之一,为不可溶性碱。
部分酸碱盐的溶解性表及应用

在药物制备中的应用案例
1
在药物制备过程中,溶解性表可以帮助研究者了 解药物的溶解性,从而优化制备工艺和条件。
2
对于溶解度较低的药物,可以通过改变溶剂、温 度、压力等条件来提高其溶解度,从而提高药物 的生物利用度和治疗效果。
3
溶解性表还可以用于指导药物制剂的制备,如片 剂、注射剂等,以确保药物的质量和稳定性。
氢氧化钙(Ca(OH)₂): 微溶于水,能与酸、非金 属氧化物等反应。
氢氧化钾(KOH):溶于 水,能与酸、非金属氧化 物等反应。
氢氧化镁(Mg(OH)₂): 难溶于水。
盐类物质的溶解性
氯化钠(NaCl):溶于水,能与 酸、碱等反应。
硫酸钾(K₂SO₄):溶于水,能 与酸、碱等反应。
氯化钙(CaCl₂):溶于水,能 与酸、碱等反应。
性表可以帮助工程师选择能够促进反应进行的溶剂。
生产工艺优化
03
通过了解物质的溶解性,可以优化生产工艺,提高生产效率和
产品质量。
在环境科学中的应用
污染物迁移转化研究
溶解性表在环境科学中可用于研究污染物的迁移转化。了解物质的溶解性有助于预测污 染物在环境中的扩散、吸附和降解行为。
水处理
在污水处理和水质净化过程中,溶解性表可用于指导水处影响
压力对溶解度的影响较小,但在高压 下,一些气体在水中的溶解度会增加 。
高压对溶解度的影响主要适用于气体 ,对于固体和液体物质,压力对其溶 解度的影响较小。
溶剂的影响
溶剂的种类和浓度会影响物质的溶解度。例如,在水中溶解度较大的物质在油类溶剂中可能溶解度较 小。
溶剂的极性和介电常数也会影响物质的溶解度。极性较强的溶剂有利于极性物质的溶解,介电常数较 大的溶剂有利于离子化合物的溶解。
溶解性表详解讲解

NH 3.H2O (溶、挥) KOH (溶)
NaOH (溶) Ba(OH )2(溶) Ca(OH)2 (微) Mg(OH)2(不) Al(OH )3 (不) Mn(OH )2(不) Zn(OH)2(不) Fe(OH)2(不)
Na2SO4 (溶)
Na2CO3 (溶)
BaSO4
CaSO4
(不)
(微)
BaCO3
SO4 2- (硫酸根) CO32 - (碳酸根)
H2SO4 (硫酸) H2CO3 (溶) (NH4)2SO4(硫酸铵) K2SO4 (硫酸钾) (NH4)2CO3(溶) K2CO3 (溶)
H+ NH 4+ K+ Na + Ba2+ Ca 2+ Mg2+ Al 3+ Mn2+ Z n2+ Fe2+ Fe3+ Cu2 + Ag +
H+ NH 4+ K+ Na + Ba2+ Ca 2+ Mg2+ Al 3+ Mn2+ Z n2+ Fe2+ Fe3+ Cu2 + Ag +
NH 3.H2O (铵水) KOH (氢氧化钾)
NaOH (氢氧化钠) Ba(OH )2(氢氧化钡) Ca(OH)2 (氢氧化钙) Mg(OH)2(氢氧化镁) Al(OH )3 (氢氧化铝) Mn(OH )2(氢氧化锰) Zn(OH)2(氢氧化锌) Fe(OH)2( 氢氧化亚铁)
(不)
(不) (微) ——
CaSO4
(硫酸钙)
Mg(NO3)2(硝酸镁)
MgSO4 (硫酸镁) Al2(SO4)2 (硫酸铝) MnSO4 (硫酸锰)
酸碱盐的溶解性表
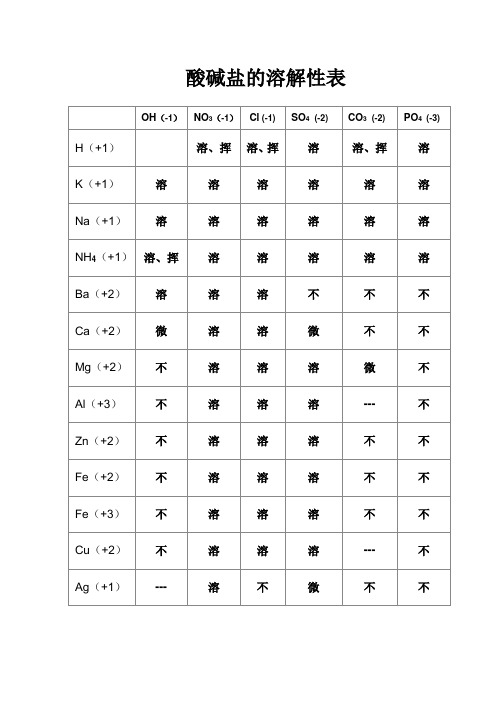
硝酸盐遇水影无踪
碳酸盐除钾钠铵都不溶
钾钠钡钙碱可溶
红褐铁,蓝絮铜
其它沉淀白色呈
注:氢氧化铁(红褐色),氢氧化铜(蓝色),
氯化银【不溶酸】,硫酸钡【不溶酸】,碳酸钙,碳酸钡,氢氧化铝,氢氧化镁,为白色沉淀。
不
Zn(+2)
不
溶
溶
溶
不
不
Fe(+2)
不
溶
溶
溶
不
不
Fe(+3)
不
溶
溶
溶
不
不
Cu(+2)
不
溶
溶
溶
---
不
Ag(+1)
---
溶
不
微
不
不
说明:此为20℃时的情况。“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了
背诵口诀:
钾钠铵盐都可溶,氯化物不溶氯化银
酸碱盐的溶解性表
OH(-1)
NO3(-1)
Cl(-1)
SO4(-2)
CO3(-2)
PO4(-3)
H(+1)
溶、挥
溶、挥
溶
溶、挥
溶
K(+1)
溶Байду номын сангаас
溶
溶
溶
溶
溶
Na(+1)
溶
溶
溶
溶
溶
溶
NH4(+1)
溶、挥
溶
溶
溶
溶
溶
Ba(+2)
溶
溶
溶
酸碱盐溶解性表的分类解释

四种微溶物质:Ca(OH)2、Ag2SO4、CaSO4、MgCO3;
“——”表示三种不存在或遇水就水解的物质:AgOH、Fe2(CO3)3、Al2(CO3)3、CuCO3
酸碱盐溶解性表的分类解释
阴离子
阳离子
碱类
硝酸盐
盐酸盐
硫酸盐
碳酸盐
氧化物
OH—
NO3—
Cl—
SO42—
CO32—
O2—
酸类
H+
H2O
HNO3
HCl
H2SO4
H2CO3
H2O
溶、挥
溶、挥
溶
溶、挥
铵盐
NH4+
NH3·H2O
NH4NO3
NH4Cl
(NH4)2SO4
(NH4)2CO3
——
溶、挥
溶
溶
溶
溶
钾盐
K+
KOH
KNO3
KCl
K2SO4
K2CO3
K2O
溶
溶
溶
溶
溶
钠盐
Na+
③生成沉淀↓:七字沉淀——“一蓝一红褐五白”◆NH4++OH—==NH3↑+H2O
★Cu2++2OH—==Cu(OH)2↓(蓝色)★Fe3++3OH—==Fe(OH)3↓(红褐色)
★Mg2++2OH—==Mg(OH)2↓(白色)★Ba2++CO32—==BaCO3↓(白色)
★Ca2++CO32—==CaCO3↓(白色)★Ag++Cl—==AgCl↓(白色)★Ba2++SO42—==BaSO4↓(白色)
部分酸碱盐的溶解性表说课讲解

部分酸碱盐的溶解性表部分酸碱盐的溶解性表.txt鲜花往往不属于赏花的人,而属于牛粪。
道德常常能弥补智慧的缺陷,然而智慧却永远填补不了道德空白人生有三样东西无法掩盖:咳嗽贫穷和爱,越隐瞒,就越欲盖弥彰。
名称化学式溶解性溶液及沉淀颜色硝酸HNO3 溶、挥无色硝酸铵NH4NO3 溶无色硝酸钾KNO3 溶无色硝酸钠NaNO3 溶无色硝酸钡Ba(NO3)2 溶无色硝酸钙Ca(NO3)2 溶无色硝酸镁Mg(NO3)2 溶无色硝酸铝Al(NO3)3 溶无色硝酸锰Mn(NO3)2 溶无色硝酸锌Zn(NO3)2 溶无色硝酸铁Fe(NO3)3 溶黄色硝酸亚铁Fe(NO3)2 溶浅绿色硝酸铜Cu(NO3)2 溶蓝色硝酸银AgNO3 溶无色氯化氢HCl 溶、挥无色氯化铵NH4Cl 溶无色氯化钾KCL 溶无色氯化钠NaCl 溶无色氯化钡BaCl 溶无色氯化钙CaCl 溶无色氯化镁MgCl2 溶无色氯化铝AlCl3 溶无色氯化锰MnCl2 溶无色氯化锌ZnCl2 溶无色氯化铁FeCl3 溶黄色氯化亚铁FeCl2 溶浅绿色氯化铜CuCl2 溶蓝绿色氯化银AgCl 不白色硫酸H2SO4 溶无色硫酸铵(NH4)2SO4 溶无色硫酸钾K2SO4 溶无色硫酸钠Na2SO4 溶无色硫酸钡BaSO4 不白色硫酸钙CaSO4 微无色、白色硫酸镁MgSO4 溶无色硫酸铝Al2(SO4)3 溶无色硫酸锰MnSO4 溶无色硫酸锌ZnSO4 溶无色硫酸铁Fe2(SO4)3 溶黄色硫酸亚铁FeSO4 溶浅绿色硫酸铜CuSO4 溶蓝色硫酸银Ag2SO4 微无色、白色碳酸H2CO3 溶、挥无色碳酸氨(NH4)2CO3 溶无色碳酸钾K2CO3 溶无色碳酸钠Na2CO3 溶无色碳酸钡BaCO3 不白色碳酸钙CaCO3 不白色碳酸镁MgCO3 微无色、白色碳酸铝/碳酸锰MnCO3 不白色碳酸锌ZnCO3 不白色碳酸铁/碳酸亚铁FeCO3 不白色碳酸铜CuCO3 不蓝色碳酸银Ag2CO3 不白色一水合氨NH3.H2O 溶、挥无色氢氧化钾KOH 溶无色氢氧化钠NaOH 溶无色氢氧化钡Ba(OH)2 溶无色氢氧化钙Ca(OH)2 微无色、白色氢氧化镁Mg(OH)2 不白色氢氧化铝Al(OH)3 不白色氢氧化锰Mn(OH)2 不白色氢氧化锌Zn(OH)2 不白色氢氧化铁Fe(OH)3 不红褐色氢氧化亚铁Fe(OH)2 不白色氢氧化铜Cu(OH)2 不蓝色氢氧化银/。
酸碱盐表格
一、干燥剂 1. 使用干燥剂的目的是除去气体中混有的水蒸气。
2.我们学过的干燥剂有氢氧化钠、浓硫酸、氧化钙、氯化钙等。
氢氧化钠易潮解;浓硫酸具有吸水性;而氧化钙可以与水反应:CaO+H 2O=Ca(OH)2 3.氢氧化钠氢氧化钠等碱性干燥剂不能干燥氯化氢、二氧化碳、二氧化硫等酸性气体。
4. 浓硫酸浓硫酸等酸性干燥剂不能干燥氨气等碱性气体。
二、酸的定义和分类酸:物质溶于水时,形成的阳离子全部是H +的化合物。
由于酸、碱、盐溶于水时会电离出阴、阳离子,所以酸、碱、盐的水溶液具有导电性。
酸的电离:HCl=H ++Cl -,H 2SO 4=2H ++SO 42-三、碱的定义和分类碱:物质溶于水时,形成的阳离子全部是OH -的化合物。
四、氢氧化钠和氢氧化钙部分变质 1.氢氧化钠部分变质的证明方法:① 取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:Na 2CO 3+CaCl 2=2NaCl+CaCO 3↓ 或 Na 2CO 3+Ca(NO 3)2=2NaNO 3+CaCO 3↓② 过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
2.氢氧化钙固体部分变质的证明方法:① 取样,加适量水使固体完全溶解,加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑② 另取少量固体,加氯化铵(或硫酸铵)研磨,如果闻到刺激性氨味,说明氢氧化钙存在,氢氧化钙部分变质:Ca(OH)2+2NH 4Cl=CaCl 2+2NH 3↑+2H 2O 或 Ca(OH)2+(NH 4)2SO 4=CaSO 4+2NH 3↑+2H 2O 3.在所有的复分解反应中,中和反应优先发生,并且反应可以瞬时完成。
中和反应是放热的反应。
中和反应同氧化反应、还原反应一样,是特征反应,不属于四大基本反应类型。
酸碱盐的溶解性表(好)
溶
溶
溶
不
Fe(+3)
不
溶
溶
溶
不
Cu(+2)
不
溶
溶
溶
不
Ag(+1)
不
溶
不
微
不
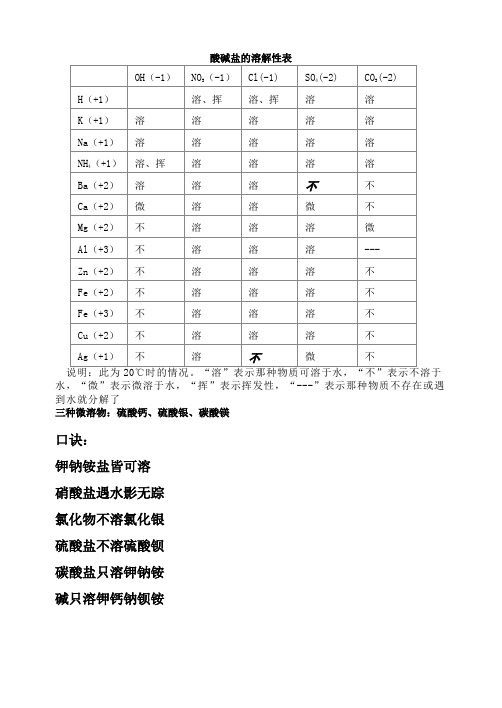
说明:此为20℃时的情况。“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了
三种微溶物:硫酸钙、硫酸银、碳酸镁
口诀:
钾钠铵盐皆可溶
硝酸盐遇水影无踪Biblioteka 酸碱盐的溶解性表OH(-1)
NO3(-1)
Cl(-1)
SO4(-2)
CO3(-2)
H(+1)
溶、挥
溶、挥
溶
溶
K(+1)
溶
溶
溶
溶
溶
Na(+1)
溶
溶
溶
溶
溶
NH4(+1)
溶、挥
溶
溶
溶
溶
Ba(+2)
溶
溶
溶
不
不
Ca(+2)
微
溶
溶
微
不
Mg(+2)
不
溶
溶
溶
微
Al(+3)
不
溶
溶
溶
---
Zn(+2)
不
溶
溶
溶
不
Fe(+2)
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
碱只溶钾钙钠钡铵
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
K2CO3 溶
Na2SO4 溶
NaCO3 溶
BaSO4 ☆不
BaCO3 ☆不
CaSO4 微
CaCO3 ☆不
MgSO4 溶
MgCO3 微
Al2(SO4)3 ———
溶
———
MnSO4 溶
MnCO3 不
ZnSO4 溶
ZnCO3 不
FeSO4 溶
FeCO3 不
Fe2(SO4)3 ———
溶
———
CuSO4 溶
8、表中涉及到三种挥发性酸: HNO3、HCl、H2CO3 应密封保存;
四种微溶物质: Ca(OH)2、Ag2SO4、CaSO4、MgCO3; “—”表示 三种不存在或与水就水解的物质:AgOH、Fe2(CO3)3、Al2(CO3)3。
293K 常见酸、碱、盐溶解性详表
OH- NO3- Cl- SO42- Br-
微
溶
溶
溶 水解 水解 水解 不
Fe2+ 不
溶
溶
溶
溶
溶
不
不
不
不
Fe3+ 不
溶
溶
溶
溶 氧化 水解 水解 氧化 不
Cd2+ 不
溶
溶
溶
溶
溶
不
不
不
不
Tl+ 溶
溶
微
溶
不
不
微
溶
溶
溶
Ni2+ 不
溶
溶
溶
溶
溶
不
不
不
不
Sn2+ 不
溶
溶
溶
溶
微 水解 水解 不 水解
Pb2+ 不
溶
微
不
微Leabharlann 微不不不
不
Cu2+ 不
溶
溶
溶
溶 氧化 不
CuCO3 不
Ag2SO4 微
Ag2CO3 不
硫酸某 碳酸某
氧化物
O2—
H2O —— K2O Na2O BaO CaO MgO Al2O3 MnO2 ZnO FeO Fe2O3 CuO Ag2O 氧化某
1、元素化合价口诀:钾钠银氢正一价,钙镁钡锌正二价。铝三碳四氧负二,
氟氯溴碘负一价。金正非负单质零,正负总价和为零。
注
③生成沉淀↓:七字沉淀——“一蓝. 一红褐 五白”(初中重点记忆这七种离子相结合) ★Cu2++OH—→Cu(OH)2↓(蓝色) ★Fe3++OH—→Fe(OH)3↓(红褐色)
★Mg2++OH—→Mg(OH)2↓(白色) ★Ba2++CO32—→BaCO3↓(白色)
★Ca2++CO32—→CaCO3↓(白色) ★Ag++Cl—→AgCl↓(白色) ★Ba2++SO42—→BaSO4↓(白色)
BaSO4
CaCO3
AgCl
★其中 BaSO4 、AgCl 既难溶于水,又不溶于稀硝酸。(初中重点记忆这七个沉淀)
能 7、判断复分解反应的实质:十对粒子——“一水 两气 七字沉淀”
①生成水:H++OH—/O2—→H2O;
备 ②生成气体↑:◆H++ CO32+→CO2↑+H2O ◆NH4++OH-→NH3↑+H2O;
NH4Cl 溶
KCl 溶
NaCl 溶
BaCl2 溶
CaCl2 溶
MgCl2 溶
AlCl3 溶
MnCl2 溶
ZnCl2 溶
FeCl2 溶
FeCl3 溶
CuCl2 溶
AgCl 不
氯化某
硫酸盐 碳酸盐
SO42+
CO32+
H2SO4 溶
H2CO3 溶、挥
(NH4)2SO4 (NH4)2CO3
溶
溶
K2SO4 溶
氢氧化某
硝酸盐
NO3—
HNO3 溶、挥
NH4NO3 溶
KNO3 溶
NaNO3 溶
Ba(NO3)2 溶
Ca(NO3)2 溶
Mg(NO3)2 溶
Al(NO3)3 溶
Mn(NO3)2 溶
Zn(NO3)2 溶
Fe(NO3)2 溶
Fe(NO3)3 溶
Cu(NO3)2 溶
AgNO3 溶
硝酸某
盐酸盐
Cl—
HCl 溶、挥
不
不
不
Hg2+ 分解 溶
微
溶
微
不 水解 不
不 水解
Ag+ 分解 溶
不
微
不
不
不
不
不
不
溶 溶、挥
溶
溶
不
溶
微
溶
溶
溶
微
溶
不
溶
不
溶
不
溶
溶
溶
不
溶
不 水解
不
溶
不
溶
不
溶
不 水解
不
溶
不 水解
不
溶
不
溶
不
溶
不 水解
不
溶
不
溶
不 水解
不
溶
注:“溶”表示溶解度大于 1g/100g 水; “微”表示溶解度为(0.01~1)g/100g 水; “不”表示溶解度小于 0.01g/100g 水;“挥”表示挥发性; “氧化”表示正、负离子间因发生氧化还原反应而不存在; “水解”表示因完全水解而不存在; “分解”表示遇水分解。
酸碱盐溶解性表的分类解释
阴
阳离子离 子
酸类 H+ 铵盐 NH4+ 钾盐 K+ 钠盐 Na+ 钡盐 Ba2+ 钙盐 Ca2+ 镁盐 Mg2+ 铝盐 Al3+ 锰盐 Mn2+ 锌盐 Zn2+ 亚铁盐 Fe2+ 铁盐 Fe3+ 铜盐 Cu2+ 银盐 Ag+
物质的命名
碱类
OH—
H2O
NH3·H2O 溶、挥 KOH 溶 NaOH 溶 Ba(OH)2 溶 Ca(OH)2 微 Mg(OH)2 ☆不 Al(OH)3 不 Mn(OH)2 不 Zn(OH)2 不 Fe(OH)2 不 Fe(OH)3 ☆不 Cu(OH)2 ☆不 ——— ———
溶
溶
不
溶
溶
不
不
溶
不
Sr2+ 微
溶
溶
微
溶
溶
微
不
不
溶
Ca2+ 微
溶
溶
微
溶
溶
不
不
微
不
Na+ 溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
Mg2+ 不
溶
溶
溶
溶
溶
微
微 水解 不
Al3+ 不
溶
溶
溶
溶
溶 水解 水解 水解 不
Be2+ 不
溶
溶
溶 水解 水解 不
不 水解 不
Mn2+ 不
溶
溶
溶
溶
溶
微
不
不
不
Zn2+ 不
溶
溶
溶
溶
溶
不
不
不
不
Cr2+ 分解 溶
2、原子团化合价口诀:负一硝酸氢氧根,负二硫酸碳酸根。负三记住磷酸根,正一价的是铵根。
3、溶液颜色口诀:铜蓝、亚铁绿、铁黄、高锰酸钾紫
4、复分解反应的特点:“两内项、两外项、价不变”
多 5、复分解反应的条件:“产物中有水、气体或沉淀”
功
6、酸碱盐溶解性口诀:七字沉淀——“一蓝. 一红褐 五白” ●蓝色:Cu(OH)2 ●红褐色:Fe(OH)3 ●白色:Mg(OH)2 BaCO3
I- CO32- SO32- S2- SiO32- PO43- HCO3-
H+
溶、挥 溶、挥 溶 溶、挥 溶、挥 溶、挥 溶、挥 溶、挥 微
NH4+ 溶、挥 溶
溶
溶
溶
溶
溶
溶
溶 水解
Li+ 溶
溶
溶
溶
溶
溶
微
溶
溶
溶
Rb+ 溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
Cs+ 溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2+ 溶
