药品不良反应报告表
药品不良反应事件报告表
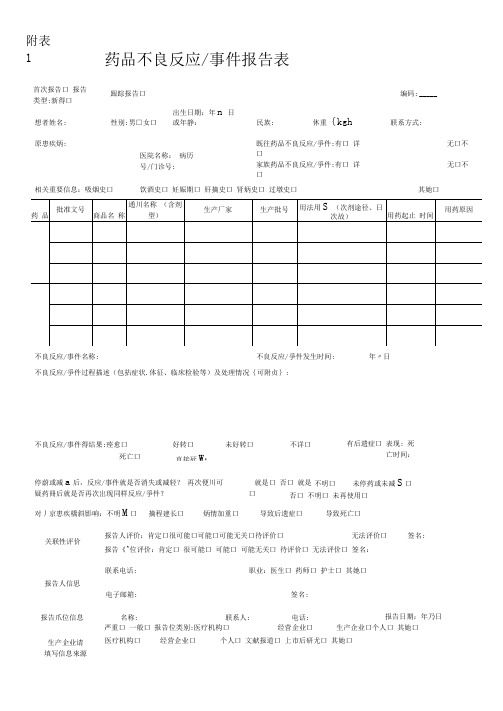
药品不良反应/事件报告表跟踪报告口编码: _____严重口 一般口 报告位类别:医疗机构口 经营企业口生产企业口个人口 其她口医疗机构口经营企业口个人口 文献报道口 上市后研尤口 其她口附表1首次报告口 报告类型:新得口 想者姓名: 原患疾炳:性别:男□女口 出生日期:年n 日 或年静:民族:休重{kgh联系方式:医院名称: 病历号/门诊号:既往药品不良反应/爭件:有口 详口家族药品不良反应/爭件:有口 详口无口不 无口不不良反应/爭件过程描述(包拈症状.体征、临床检验等)及处理情况{可附贞}:不良反应/事件得结果:痊愈口死亡口好转口 未好转口 直接死W : ________不详口有后遗症口 表现: 死亡时间:停蔚或减a 后,反应/事件就是否消失或减轻? 再次便川可疑药冊后就是否再次岀现同样反应/爭件? 就是口 否口 就是口 不明口 未停药或未减S 口 否口 不明口 未再使用口对丿京患疾橋斜影响:不明M 口摘程建长口炳情加重口导致后遗症口导致死亡口关联性评价报告人评价:肯定口很可能口可能口可能无关口待评价口无法评价口签名:报告《^位评价:肯定口 很可能口 可能口 可能无关口 待评价口 无法评价口 签名: 联系电话:职业:医生口 药师口 护士口 其她口报告人信思电子邮箱:签名: 报告爪位信息名称: 联系人: 电话:报告日期:年乃日生产企业请 填写信息來源其她口不良反应/事件名称:不良反应/爭件发生时间:相关重要信息:吸烟史口饮酒史口 妊娠期口 肝摘史口 肾炳史口 过墩史口年〃日注填写说明一、严重药品不良反应就是指因使用药品引起以下损害情形之一得反应:1)导致死亡;2 )危及生命:3)致癌、致畸、致出生缺陷:4)导致显著得或者永久得人体伤残或者器官功能得损伤:5)导致住院或者住院时间延长;6)导致英她重要医学事件,如不进行治疗可能出现上述所列情况得。
二、新得药品不良反应就是指药品说明书中未载明得不良反应。
药品不良反应事件报告表

药品不良反应/事件报告表跟踪报告口 严重口 一般口报告单位类别:医疗机构口 编码: 经营企业口生产企—其他口附表1首次报告口 报告类型:新的口填写说明一、严重药品不良反应是指因使用药品引起以下损害情形之一的反应:1)导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
二、新的药品不良反应是指药品说明书中未载明的不良反应。
药品不良反应在说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
三、报告时限新的、严重的药品不良反应应于发现或者获知之日起15 日内报告,其中死亡病例须立即报告,其他药品不良反应30 日内报告。
有随访信息的,应当及时报告。
四、关联性评价指标肯定:用药及反应发生时间顺序合理;反应符合该药已知的不良反应类型;停药或减量后,反应停止或减轻;再次使用可疑药品,反应再现;已排除并用药、原患疾病等其它因素影响。
很可能:用药及反应发生时间顺序合理;反应符合该药已知的不良反应类型;停药或减量后,反应停止或减轻;已排除并用药、原患疾病等其它因素影响。
可能:用药及反应发生时间关系密切;反应表现与已知该药ADR 不相吻合;无法排除并用药、原患疾病等其它因素影响。
可能无关:用药及反应发生时间相关性不密切;反应表现与已知该药ADR 不相吻合;无法排除并用药、原患疾病等其它因素影响。
待评价:需要补充材料才能评价。
无法评价:评价的必需资料无法获得。
五、其他说明怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
六、报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
不良反应报告表

不良反应报告表在临床治疗中,药物不良反应是一种常见的现象,它可能会对患者的身体健康产生不良影响。
因此,及时准确地记录和报告药物不良反应是非常重要的。
以下是不良反应报告表,用于记录和汇总药物不良反应的相关信息。
不良反应报告表。
1. 基本信息。
患者姓名:年龄:性别:联系方式:就诊医院:就诊科室:医生姓名:2. 药物信息。
药物名称:剂量:给药途径:使用频率:使用时间:是否为长期用药:3. 不良反应描述。
不良反应发生时间:不良反应症状描述:不良反应严重程度:是否已停止使用该药物:是否存在其他可能引起不良反应的因素:4. 处理措施。
医生采取的处理措施:患者的反应和症状变化:是否需要转诊或住院治疗:5. 结果评估。
不良反应的影响程度:是否对患者造成了严重影响:是否已经康复或症状缓解:6. 报告人信息。
姓名:职务:联系方式:报告时间:不良反应报告表的填写和汇总对于药物不良反应的监测和评估具有重要意义。
通过及时准确地记录和报告药物不良反应,可以帮助医务人员对药物的安全性和有效性进行评估,保障患者的用药安全。
因此,医务人员应当重视不良反应报告表的填写工作,确保信息的准确性和完整性。
在填写不良反应报告表时,需要尽可能详细地描述患者出现的不良反应症状,包括发生时间、症状描述、严重程度等信息。
同时,还需要对医生采取的处理措施和患者的反应进行记录,以便进行后续的结果评估。
最后,报告人需要在表格中填写自己的相关信息,确保报告的真实性和可追溯性。
总之,不良反应报告表是临床工作中不可或缺的一部分,它对于保障患者的用药安全和促进药物监测评估具有重要意义。
希望医务人员能够充分重视不良反应报告表的填写工作,做好药物不良反应的监测和报告工作,为患者的用药安全提供有力保障。
药品不良反应事件报告表

药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
药品不良反应报告表

药品不良反应报告表
药品不良反应报告表是用于记录药物使用过程中出现的不良反应或药物相关事件的表格。
该表格通常包括以下内容:
1. 报告者信息:包括报告者的姓名、联系方式等。
2. 反应/事件描述:详细描述不良反应或药物相关事件的发生
情况,包括症状、严重程度等。
3. 药品信息:记录涉及的药品名称、批号、规格等信息。
4. 用药信息:记录患者的用药情况,包括用药途径、用药剂量、用药频率等。
5. 其他相关信息:如病历号、就诊日期、报告日期等。
通过填写药品不良反应报告表,可以帮助医药监管机构或药企了解和收集药品使用过程中可能出现的不良反应,以便及时采取措施保障患者用药安全。
同时,这些报告数据也可用于药物监测和临床研究,有助于促进药物的质量控制和改进。
药品不良反应事件报告表

药品不良反应 / 事件报告表
患者姓名性别:男
□女□
出生日期:年月
日
或年龄
民族联系方式:
体重
(kg)
病历号/门
诊号
家族药品不良反
应/事件:有□无□不详□既往药品不良反应/事件情况:有□无□ 不详□
既往病史:(如高血压、糖尿病、肝肾疾病等)相关重要情况:怀孕□ 吸烟□ 饮酒□ 药物滥用□ 放射治疗□ 其他□
不良反应/事件名称:不良反应/事件发生时间:年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):不良反应/事件的结果:治愈□ 好转□ 未好转□ 不详□ 有后遗症□ 表现:
死亡□ 直接死因:死亡时间:年月日
1.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
2.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
商品名称通用名称(含剂型,监
测期内品种用*注明)
生产
厂家
批号
用法用
量
用药起止时间
用药原
因
怀疑药品
关联性评价报告人:肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能无关□待评价□无法
除非得到允许,报告表中的个人信息将予以保密。
药品不良反应事件报告表

药品不良反应 / 事件报告表(报告时限:发现药品不良反应要立即报告。
)表中若有选择项,请将选中的内容涂成红色。
不良反应/事件过程描述及处理情况填写说明:
(1)首先要对患者原患疾病进行描述,并要描述合并用药情况;开始用药时间,不良反应发生时间,采取措施干预时间及ADR终结时间;
(2)填写不良反应/事件表现时,要明确、具体,如为过敏型皮疹,要填写皮疹的类型、性质、部位、面积大小等;如为心律失常,要填写何种心律失常;如为上消化道出血,有呕血者需估计呕血量的多少等;严重病例应注意生命体征指标(体温、血压、脉搏、呼吸)的记录。
(3)与可疑不良反应/事件有关的辅助检查结果要尽可能明确填写,如怀疑某药引起血小板减少症,应填写病人用药前的血小板计数情况及用药后的变化情况;如怀疑某药引起药物性肝损害,应填写用药前后的肝功变化情况,同时要填写肝炎病毒学检验结果。
所有检查要注明检查日期。
(4)填写本次临床上发现的不良反应/事件的处理情况,主要是针对不良反应/事件而采取的医疗措施,包括为关联性评价而进行的辅助检验结果,如补做皮肤试验的情况。
(5)对与不良反应/事件发生有关的既往史进行简要描述:高血压、糖尿病、肝/肾功能障碍等;过敏史、怀孕史、吸烟史、饮酒史、药物滥用史等。
药品不良反应事件报告表
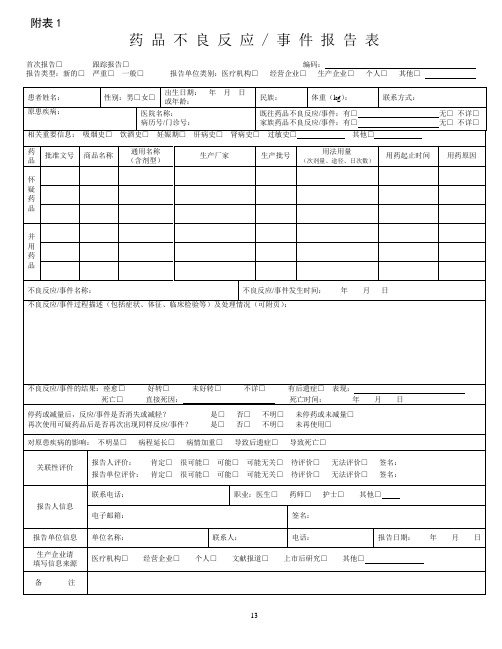
附表1
药品不良反应 / 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
13
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
药品不良反应报告表(国家)

药品不良反应报告(bàogào)表(国家)制表单位:国家(guójiā)食品药品监督管理局药品不良反应 / 事件报告表新的□严重(yánzhòng)□一般(yībān)□医疗卫生机构(jīgòu)□生产(shēngchǎn)企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□单位名称:部门:电话:报告日期:年月日◇不良反应/事件(shìjiàn)分析1.用药与不良反应/事件的出现有无合理的时间关系?有□无□2.反应是否符合该药已知的不良反应类型?是□否□不明□3.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□4.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□不明□◇严重药品不良反应/事件是指有下列(xiàliè)情形之一者:①引起(yǐnqǐ)死亡□②致畸、致癌或出生(chūshēng)缺陷□③对生命有危险并能够导致人体永久(yǒngjiǔ)的或显著的伤残□④对器官功能产生永久损伤□⑤导致住院或住院时间延长□◇编码规则:省(自治区、直辖市)市(地区)县(区)单位年代流水号□□□□□□□□□□□□□□□□□□□注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和国行政区划代码填写。
单位编码第一位如下填写:医疗机构1、军队医院2、计生机构3、生产企业4、经营企业5。
个人报告单位编码一栏填写6000◇注:通用名称一栏,首次获准进口5年内的进口品种用*注明国家药品不良反应监测中心药品不良反应监测中心通信地址:北京市崇文区法华南(Huánán)里11号楼二层通信地址:邮编:100061邮编:电话:(010)67164979电话:传真:(010)67184951传真:E – mail :report@ E – mail:新的、严重的药品(yàopǐn)不良反应/事件病例报告要求药品生产企业报告(bàogào)要求1.填报(tiánbào)《药品不良反应/事件报告表》;2.产品(chǎnpǐn)质量检验报告;3.药品(yàopǐn)说明书(进口药品还须报送国外药品说明书);4.产品注册、再注册时间,是否在监测期内(进口药是否为首次获准进口5年内);5.产品状态(是否是国家基本药物、国家非处方药、国家医疗保险药品、中药保护品种);6.国内上年度的销售量和销售范围;7.境外使用情况(包括注册国家、注册时间);8.变更情况(药品成分或处方、质量标准、生产工艺、说明书变更情况);9.国内外临床安全性研究及有关文献报道情况;10.除第1、2项以外,其他项目一年之内如无变更,可以免报。
药品不良反应事件报告表

单位名称: 患者姓名: 不良反应/事件名称: 部门: 性别: 无 不详 电话: 出生日期: 民族: 报告日期: 体重: 无 年 月 日 既往药品不良反应/事件情况:有 不良反应/事件发生时间:
家族药品不良反应/事件:有
不
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
事件报告表
报告日期: kg 联系方式: 无 不详 月 日 病历号/单位:
不良反应/事件情况:有
年
剂量
用药起止时间 用法
用药原因
直接死因:
死亡时间:
表现 1有 2无 3不详
导致死亡
类似不良反应
签名: 签名: 5无法评价 5无法评价 签名: 签名:
3不明 4未停药或未减量 4未再使用 3不明
1是 1是 1是 1是
2否 2否 2否 2否 1是 3不明 3不明 3不明 2否
5. 反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?
严重药品不良反应/事件是指下列情形之一者: 1、引起死亡 2、致畸、致癌、致出生缺陷 3、对生命有危险并能够导致人体永久的或显著的伤残 4、对器官功能产生永久损伤 5、导致住院或住院时间延长 报告人职业: 1、医生 2、医师 3、护士 4、其他 报告人:
批准文号 商品名称
通用名称(含剂型)
生产厂家
批号
怀疑药品
并用药品
不良反应/事件的结果:治愈 原患疾病: 对原患疾病的影响: 1不明显 国内有无类似不良反应好转ຫໍສະໝຸດ 有后遗症表现:死亡:
2病程延长3病情加重4导致后遗症 1有 2无 3不详 国外有无类似不良反应
报告人: 1肯定 关联性评价 报告单位: 1肯定
药品不良反应报告表2篇

药品不良反应报告表药品不良反应报告表第一篇:药品不良反应报告表尊敬的医务工作者:感谢您的配合与支持,为保障患者用药安全、监测药品的不良反应情况,请按照以下格式填写药品不良反应报告表,并将填写内容发送至指定邮箱。
1. 药品信息:药品名称:药品批号:生产厂家:使用年限:2. 患者信息:姓名:性别:年龄:联系方式:3. 不良反应描述:(请将不良反应的症状、程度、持续时间等详细描述,包括但不限于以下内容)- 主要不良反应:- 其他不良反应:4. 与药品使用相关的其他因素:- 是否同时使用其他药物?- 是否存在过敏史或不良反应史?- 使用药品前的身体健康状况:5. 初次发生不良反应的时间及药品的使用情况:初次发生不良反应的时间:初次使用药品的时间:药品的用量和频率:6. 对不良反应的处理及结果:如需急救或住院治疗,请详细描述治疗过程,并附上医生的诊断意见和治疗结果。
请将填写完整的不良反应报告表发送至指定邮箱(请咨询药店或相关医疗机构获取邮箱地址)。
我们将及时处理您提供的信息,并进行必要的药物安全监测和处理措施。
感谢您的合作与支持!第二篇:药品不良反应报告表尊敬的医务工作者:感谢您的关注与参与,为了进一步监测药品的不良反应情况,保障患者的用药安全,以下是药品不良反应报告表,请您按照要求填写,并及时将填写完整的报告表发送至指定邮箱。
1. 药品信息:药品名称:药品批号:生产厂家:使用年限:2. 患者信息:姓名:性别:年龄:联系方式:3. 不良反应描述:(请详细描述不良反应的症状、程度、持续时间等信息,包括但不限于以下内容)- 主要不良反应:- 其他不良反应:4. 其他与药品使用相关因素:- 是否同时使用其他药物?- 是否有过敏史或不良反应史?- 使用药品前的身体健康状况:5. 初次出现不良反应的时间及药品使用情况:初次出现不良反应的时间:初次使用药品的时间:药品的用量和频率:6. 对不良反应的处理和结果:如有急救或住院治疗,请详细描述治疗过程,并附上医生的诊断意见和治疗结果。
药品不良反应事件报告表
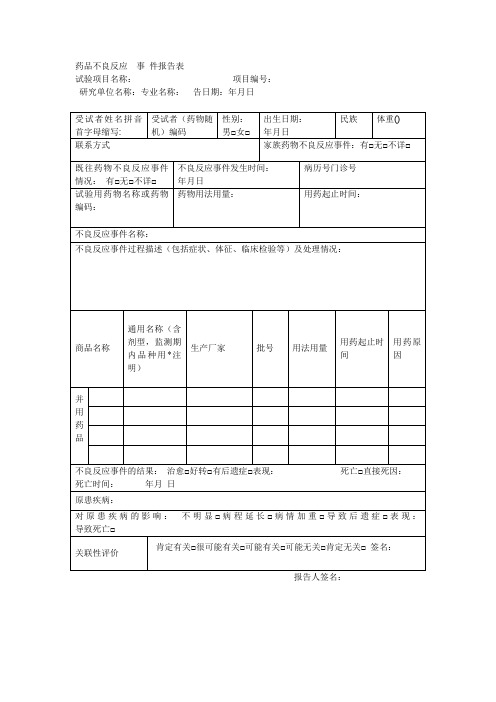
药物用法用量:
用药起止时间:
不良反应事件名称:
不良反应事件过程描述(包括症状、体征、临床检验等)及处理情况:
商品名称
通用名称(含剂型,监测期内品种用*注明)
生产厂家
批号
用法用量
用药起止时间
用药原因
并
用
药
品
不良反应事件的结果:治愈□Βιβλιοθήκη 转□有后遗症□表现:死亡□直接死因:
死亡时间:年月日
药品不良反应事件报告表
试验项目名称:项目编号:
研究单位名称:专业名称:告日期:年月日
受试者姓名拼音首字母缩写:
受试者(药物随机)编码
性别:
男□女□
出生日期:
年月日
民族
体重()
联系方式
家族药物不良反 应事件:有□无□不详□
既往药物不良反应事件情况:有□无□不详□
不良反应事件发生时间:
年月日
病历号门诊号
原患疾病:
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现: 导致死亡□
关联性评价
肯定有关□很可能有关□可能有关□可能无关□肯定无关□签名:
报告人签名:
药品不良反应报告表
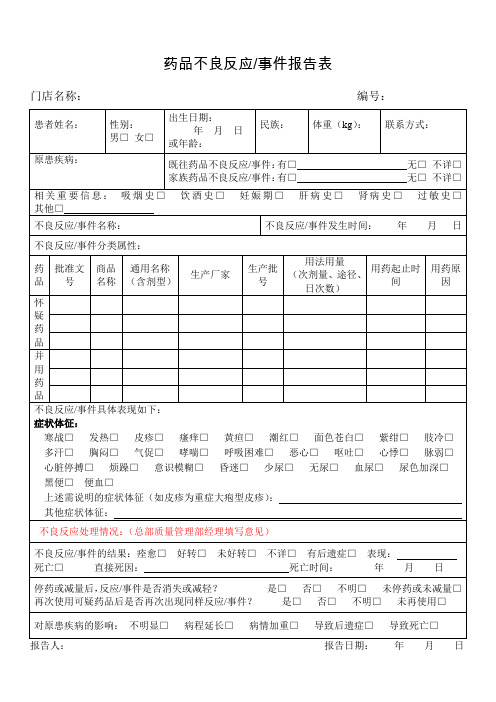
黑便□便血□
上述需说明的症状体征(如皮疹为重症大疱型皮疹):
其他症状体征:
不良反应处理情况:(总部质量管理部经理填写意见)
不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
药品不良反应/事件报告表
门店名称: 编号:
患者姓名:
性别:
男□女□
出生日期:
年月日
பைடு நூலகம்或年龄:
民族:
体重(kg):
联系方式:
原患疾病:
既往药品不良反应/事件:有□无□不详□
家族药品不良反应/事件:有□无□不详□
相关重要信息:吸烟史□ 饮酒史□ 妊娠期□ 肝病史□ 肾病史□ 过敏史□其他□
不良反应/事件名称:
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□
报告人:报告日期:年月日
不良反应/事件发生时间:年月日
不良反应/事件分类属性:
药品
批准文号
商品名称
通用名称
(含剂型)
生产厂家
生产批号
用法用量
(次剂量、途径、日次数)
用药起止时间
用药原因
怀疑药品
并用药
品
不良反应/事件具体表现如下:
症状体征:
寒战□发热□皮疹□瘙痒□黄疸□潮红□面色苍白□紫绀□肢冷□
多汗□胸闷□气促□哮喘□呼吸困难□恶心□呕吐□心悸□脉弱□
药品不良反应事件报告表

昌宁县人民医院药品不良反应/事件报告表新的□严重□一般□医疗卫生机构编码5305241单位名称:昌宁县人民医院科室:电话:报告日期:年月日报告人职业(医疗机构):医生□药师□护士□其他□报告人职务职称:报告人签名:科主任审核签名:药品不良反应事件报告表填报要求一、法规要求1.《药品管理法》第七十一条明确规定,“我国实行药品不良反应报告制度”;2.《药品不良反应报告和检测管理办法》中第二、四、十三等条款中对医疗机构的职责做了具体的规定。
强调报告药品不良反应是义务人员应尽的法律义务。
二、报告数量要求:1.百万人口报告数为:不低于170/百万人口;2.住院总人数的5-10%(据统计有5-10%的人员因药品不良反应而住院,住院病人住院治疗期间10-20%的病人发生药品不良反应)。
三、质量要求:1.报表完整不缺项;2.报表真实不虚报;3.钢笔填写;4.时限要求:○1群体不良反应立即填报(3天内),○2新的或严重的不良反应3天内上报,○3一般病例发现之日起一个月内填报;5.不良反应/事件名称:填写使用药品导致的不良反应(例:变态反应,过敏性休克);6.怀疑药品:需填写全名称;7.原患疾病:填写使用该药品的疾病诊断名称;8.不良反应过程描述及处理情况一栏应包括:○1患者基本情况○2就诊主诉○3常规检查(T、BP、P、R等)○4初步诊断○5使用药品情况○6出现药品不良反应时间及反应情况○7处理情况○8转归或结果;9.国内外有无不良反应报道,以说明书(或其他医学期刊记录为准);10.关联性评价:一般不填可能无关一栏;11.不良反应分析:用药与不良反应的出现有无合理的时间关系,应勾“是”。
四、填报要求1.表格填写完整后应有报告人签名,科主任审核后签名,报药剂科审核后网络报告,医务科负责报告情况收集和完成情况督查;2.每位医生每年至少报告一份。
药店药房-药品不良反应报告表
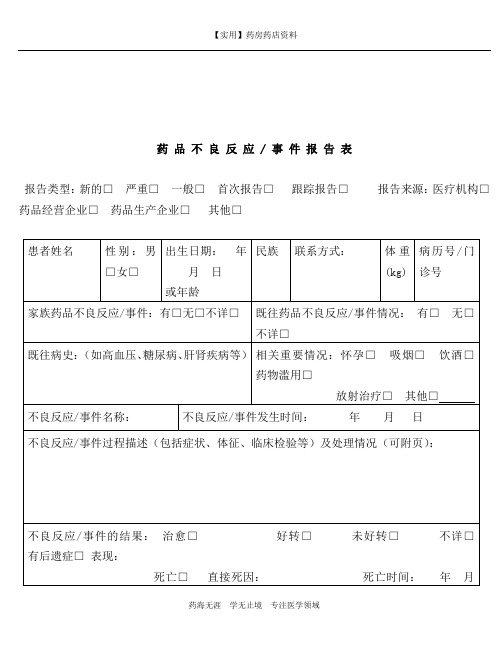
药品不良反应 / 事件报告表报告类型:新的□严重□一般□首次报告□跟踪报告□报告来源:医疗机构□药品经营企业□药品生产企业□其他□除非得到允许,报告表中的个人信息将予以保密。
严重药品不良反应/事件是指因使用药品引起以下损害情形之一的反应/事件:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或永久的人体伤残或器官功能的损伤;5)导致住院或住院时间延长6)其他有意义的重要医学事件。
如,尽管事件不会立即危及生命或导致死亡和/或需住院,但为了预防出现任一上述所列情况可能需要进行治疗,通常也被认为是严重的。
关联性评价说明:肯定:用药及反应发生时间顺序合理;停药以后反应停止,或迅速减轻或好转;再次使用,反应再现,并可能加重(即激发试验阳性),同时有文献资料佐证,并已排除原患疾病等其他混杂因素影响。
很可能:无重复用药史,余同“肯定”,或虽然有合并用药,但基本可排除合并用药导致反应发生的可能性。
可能:用药与反应发生时间关系密切,同时有文献资料佐证;但引发ADR/ADE的药品不止一种,或原患疾病病情进展因素不能排除。
可能无关:ADR/ADE与用药时间相关性不密切,反应表现与已知该药的ADR/ADE不吻合,原患疾病发展同样可能有类似的临床表现。
待评价:报表内容填写不齐全,等待补充后再评价,或因果关系难以定论,缺乏文献佐证。
无法评价:报表缺项太多,因果关系难以定论,资料又无法补充。
其他说明合并用药:指发生此药品不良反应/事件时患者除怀疑药品外得其他用药情况,其中也包括患者自行购买的药品或中草药等。
报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应之间的关系。
我们会考虑风险是否普遍或严重,然后决定我们是否需要采取行动,例如在药品说明书中加入警示信息,更新药品如何安全使用的信息,如,限制使用剂量或在某些特定人群中限制使用。
极少数情况下,我们会把产品撤市,只有当我们认为产品的风险大于效益时。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附表1制表单位:国家食品药品监督管理局
药品不良反应/ 事件报告表
新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□
如有你有帮助,请购买下载,谢谢!◇不良反应/事件分析
1.用药与不良反应/事件的出现有无合理的时间关系?有□无□
2.反应是否符合该药已知的不良反应类型?是□否□不明□
3.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
4.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□不明□
◇严重药品不良反应/事件是指有下列情形之一者:
①引起死亡□
②致畸、致癌或出生缺陷□
③对生命有危险并能够导致人体永久的或显著的伤残□
④对器官功能产生永久损伤□
⑤导致住院或住院时间延长□
◇编码规则:
省(自治区、直辖市) 市(地区)县(区)单位年代流水号
□□□□□□□□□□□□□□□□□□□
注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和国行政区划代码填写。
单位编码第一位如下填写:医疗机构1、军队医院2、计生机构3、生产企业4、经营企业5。
个人报告单位编码一栏填写6000
◇注:通用名称一栏,首次获准进口5年内的进口品种用*注明
国家药品不良反应监测中心药品不良反应监测中心
通信地址:北京市崇文区法华南里11号楼二层通信地址:
邮编:100061 邮编:
电话:(010)电话:
传真:(010)传真:
E – mail : E – mail:。
