高等有机合成化学_02.3_偶合反应
高等有机化学

NaNH2 液氨
(CH3)2CH-C
- (CH3)2CHBr C
(CH3)2CH
C
C CH(CH 3)2
H2 C-Pd-BaSO4
(CH3)2CH C H C
CH(CH3)2 (TM4) H
二、醇及其衍生物
1、简单醇的切断,可以在羟基官能团处 切断。
a R2 b C R1 a R3 b R1 + R2 + R3COOR3 OH R3 + R1 + R2 OH R2 R1 O
例14 试合成
N
TM14
O
分析 方法一
N O
+ N
HO O
CO 2 +
BrMg
FGI
HO
MgBr CH3CH2CHO +
Synthesis 1:
Br Mg,Et 2O MgBr 1)C2H5CHO,Et2O + 2)H3O
1)PBr3 2)Mg,Et2O
HO BrMg
CO2 Et 2O
H3O
+
逆合成法
逆合成法是采用结构分析的方法,在回推过程
中将复杂的分子结构逐步简化,只要每步回推 得当,就可得出合理的合成路线。
逆合成法
目标分子 中间体 原料 目标分子←中间体←原料
1、最推崇的分析方法——切断法 (disconnection) 2、重新连接法以Con表示(Connection) 3、重排法以rearr表示(rearrangement)
分析
O O
FGI
O
-
+ MeI
O CO 2Et
+
Br
合成
O CO 2Et
大学有机化学有机合成全面总结

OH
α -氰 醇
α -羟 基 酸
应用范围:醛、甲基脂肪酮 、C8以下环酮
2. 增加二个碳原子的反应
R MgX + CH2 CH2 O
R CH2CH2 H3O+ RCH2CH2OH OMgX
3. 增加多个碳原子的反应
① R-C CH NaNH2 R-C CNa R/X R-C C-R/
其中:R/ 为伯卤代烃 X 为Cl、Br、I
H2O / OH- PX3 Mg
NH3 R-NH2
R-MgX
R-X
① ②
CO2 H3O+
R-COOH
H3O+
NaCN
R-CN
R-NH2 R-NHR
[H]
R-CH2NH2
R-X
R-NR2
2. 羧酸及其衍生物的转换
R-COCl
NH3
R-CONH2
R/OH
R-COOH
NH3
R-COOR/
R/OH
(RCO)2O
H2SO4 H2O
① (BH3)2 ② H2O2 /
OH-
R-CH-CH3(符合马氏规则) OH
R-CH2CH2OH(反马氏规则)
[H]
② R-C=O H(R/) [ O ]
R-CH-OH H(R/)
[ H ] = LiAiH4 、NaBH4 、 H2 / Ni、Pt、Pd等
③ R-COOR/ [ H ] R-CH2OH + R/OH [ H ] = LiAiH4 、C2H5OH + Na 、 H2 / Ni、Pt、Pd等
R-NH2
● 碳环的合成
① 双烯合成(D-A反应)
X△
-X
高等有机化工工艺学烃类的合成方法讲课文档

第4页,共94页。
H O
O H O
+ H O
H O
O H
Z 2 nCl
C H 3
O
H O
O H
Zn(Hg)
C H 3HCl
C H 3
65%
81%
第5页,共94页。
2、金属氢化物还原法
常见的金属氢化物:LiAlH4 NaBH4 NaB(CN)H3 用金属氢化物还原羰基化合物,通常得到醇。
O R1 R2
二缩三乙二醇等)中加热反应。羰基化合物首先转化成腙,然后在碱的作用下,生 成的腙在高温下分解成烃。
还原机理:
第10页,共94页。
第11页,共94页。
第12页,共94页。
第13页,共94页。
Wolff-Kishner-黄鸣龙还原法的反应温度很高,(180~200 ℃,5小时)反应 物必须耐碱。
NC N
DCC
NC N
N H
+ CuCl
R O H
N C
O R
O-烷基异脲
OH
H2 Pd/C
CuCl DCC
NC6H11c cC6H11 N O
H
第18页,共94页。
将伯醇或仲醇首先转化成磺酸酯,然后以硼氢化钠等还原。
CN A r
O H H
1.M sCl,Et3N ,CH 2Cl2
2.N aBH 4,tBuO H CH 3O C2H 4O CH 3
2 % P d (P P h 3 )4 C H C l3
O
96%
第28页,共94页。
四、卤代烃的还原
RX 1、金属还原
RH + HX
大多数能够产生新生态氢的金属还原剂均可用于卤代烃的还原。 其中,锌(如Zn/HCl、Zn/AcOH、Zn/NaoH体系)、钠(如钠/醇体 系)、铝(如铝镍合金/NaOH体系)、镁(如Mg/i-PrOH体系)、锂(如Li/ THF/t-BuOH体系)等均是早已沿用的还原剂。
大学有机化学有机合成全面总结

② H2O2 / OH
②
R-C=O R-CH-OH [O] / H( R ) H(R/) [ H ] = LiAiH4 、NaBH4 、 H2 / Ni、Pt、Pd等
R-COOR/
[H]
③
R-CH2OH + R/OH
[ H ] = LiAiH4 、C2H5OH + Na 、 H2 / Ni、Pt、Pd等
R、 R/、R//、 R///可以为 –H、-R、-Ar、-COOR等
● 碳链的减短
① 不饱和烃的氧化
RCH=CHR/
R-C=CH2 R/ KMnO4 R-C CH H+ CH2CH2CH3 -CH(CH3)2
KMnO4 H+ KMnO4 H+
RCOOH + R/COOH R-C=O + CO2 R/ RCOOH + CO2 COOH
Na
R-R
其中:R/ 最好为伯烷基 X 为Cl、Br、I ③ 铜锂试剂反应 R-X
Li
CuI R /X
R-Li
R2CuLi
R-R/
其中:R/ 最好为伯烷基; R 一般无限制 X 为Cl、Br、I ④ 傅-克反应 烷基化: + R-X
AlCl3 (或烯、醇)
R
R ≥3 时重排产物为主
酰基化: + CH3CH2CH2-C-Cl
-
酸式分解
CH2(COOC2H5)2
R-CH(COOC2H5)2
=
△
酮式分解
C2H5ONa
-
CH(COOC2H5)2 Na
R-CH2COOH
+
R-X
① OH / H2O ② H+ ,△
偶合反应原理

偶合反应原理
偶合反应是一种化学反应,通常是指芳伯胺的重氮盐与酚或芳胺等作用生成偶氮化合物的过程。
这个反应过程可以用以下通式表示:Ar-N=X-+H-Ar′─→Ar-N=N-Ar′+HX,其中Ar为芳基,X-为酸根,H-Ar′为酚或芳胺。
偶合反应的原理主要是基于反应的标准吉布斯自由能变。
当反应的标准吉布斯自由能变为负值时,该反应就有可能发生。
在偶合反应中,重氮盐和酚或芳胺等物质作为反应的组分,通常将重氮盐称为重氮组分,将与重氮盐偶合的酚或芳胺称为偶合组分。
偶合反应的特点是放热反应,反应速率很快,重氮盐很活泼。
为了避免副反应的发生,偶合反应通常需要在0~15℃下进行,并控制偶合组分过量,使重氮组分完全反应。
偶合反应一般在水介质中进行,不同类型的偶合组分对介质要求的pH值也不同。
例如,酚类偶合时在弱碱性介质中速率较快;芳胺偶合时在弱酸性介质中速率较快。
偶合反应是亲电取代反应,偶氮基(-N=N-)通常进入羟基、氨基的邻位或对位。
在偶合反应完成后,有时还需要对生成的偶氮染料进行后处理,如加热等操作。
偶合反应在生产中有重要应用,如偶氮染料和有机颜料的生产。
偶联反应及举例

偶联反应[编辑]偶联反应,也写作偶合反应或耦联反应,是两个化学实体(或单位)结合生成一个分子的有机化学反应。
狭义的偶联反应是涉及有机金属催化剂的碳-碳键形成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
在偶联反应中有一类重要的反应,RM(R = 有机片段, M = 主基团中心)与R'X的有机卤素化合物反应,形成具有新碳-碳键的产物R-R'。
[1]由于在偶联反应的突出贡献,根岸英一、铃木章与理查德·赫克共同被授予了2010年度诺贝尔化学奖。
[2]偶联反应大体可分为两种类型:•交叉偶联反应:两种不同的片段连接成一个分子,如:溴苯(PhBr)与氯乙烯形成苯乙烯(PhCH=CH2)。
•自身偶联反应:相同的两个片段形成一个分子,如:碘苯(PhI)自身形成联苯(Ph-Ph)。
反应机理[编辑]偶联反应的反应机理通常起始于有机卤代烃和催化剂的氧化加成。
第二步则是另一分子与其发生金属交换,即将两个待偶联的分子接于同一金属中心上。
最后一步是还原消除,即两个待偶联的分子结合在一起形成新分子并再生催化剂。
不饱和的有机基团通常易于发生偶联,这是由于它们在加合一步速度更快。
中间体通常不倾向发生β-氢消除反应。
[3]在一项计算化学研究中表明,不饱和有机基团更易于在金属中心上发生偶联反应。
[4]还原消除的速率高低如下:乙烯基-乙烯基> 苯基-苯基> 炔基-炔基> 烷基-烷基不对称的R-R′形式偶联反应,其活化能垒与反应能量与相应的对称偶联反应R-R与R′-R′的平均值相近,如:乙烯基-乙烯基> 乙烯基-烷基> 烷基-烷基。
另一种假说认为,在水溶液当中的偶联反应其实是通过自由基机理进行,而不是金属-参与机理。
[5]§催化剂[编辑]偶联反应中最常用的金属催化剂是钯催化剂,有时也使用镍与铜催化剂。
钯催化剂当中常用的如:四(三苯基膦)钯等。
钯催化的有机反应有许多优点,如:官能团的耐受性强,有机钯化合物对于水和空气的低敏感性。
有机化学反应列表

• • • • • • • • • • • • • • • • • • • • • • • • • • • • •
• • • • • • • B • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • •
ቤተ መጻሕፍቲ ባይዱ
Asinger 反应(Asinger reaction) Asscher-Vofsi 反应 (Asscher-Vofsi reaction) Atherton-Openshaw-Todd 合成(Atherton-Openshaw-Todd synthesis) Auwers 合成、von Auwers 黄酮醇合成 (Auwers flavonol synthesis) von Auwers 1- 茚酮合成(von Auwers indane-1-one synthesis) Auwers 重排反应、von Auwers 重排反应 (von Auwers rearrangement) von Auwers-Inhoffen 重排反应 (von Auwers-Inhoffen rearrangement)
• Barbier-Wieland 递 降 反 应 、 Barbier-Locquin-Wieland 递 降 反 应 (Barbier-Wieland degradation) • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • Bardhan-Sengupta 菲合成 (Bardhan-Sengupta phenanthrene synthesis) Bargellini 反应 (Bargellini reaction) Bargellini 成环反应 (Bargellini ring-closure) Barger 去甲基化反应(Barger demethylation) Barry 反应(Barry reaction) Bart 反应、Bart-Schmidt 反应 (Bart reaction; Bart-Schmidt reaction) Bartlett-Condon-Schneider 反应(Barlett-Condon-Schneider reaction) Bartoli 吲哚合成 (Bartoli indole synthesis) Barton 反应(Barton reaction) Barton 苯基化反应(Barton phenylation) Barton 脱氨反应(Barton deamination) Barton 脱羧反应(Barton decarboxylation) Barton-Kellogg 烯烃合成 (Barton-Kellogg olefination) Barton-McCombie 去氧反应(Barton-McCombie deoxygenation) Barton-Zard 吡咯合成 (Barton-Zard pyrrole synthesis) Baudart 合成(Baudart synthesis) Baudart 酮醇合成(Baudart acyloin synthesis) Baudisch 反应(Baudisch reaction) Baum 苯甲酰基化反应(Baum benzoylation) Baumann-Fromm 合成(Baumann-Fromm synthesis) Baylis-Hillman 反应、 Baylis-Hillman-Morita 反应 (Baylis-Hillman reaction) Béchamp 反应 (Béchamp reaction) Béchamp 还原反应 (Béchamp reduction) Beckmann 重排反应 (Beckmann rearrangement) Beckmann-Chapman 重排反应 (Beckmann-Chapman rearrangement) Bedoukian 反应(Bedoukian reaction) Béhal-Sommelet 合成 (Béhal-Sommelet synthesis) Behrend 重排反应 (Behrend rearrangement) Behrend-Roosen 合成 (Behrend-Roosen synthesis) Belluš-Claisen 重排反应 (Belluš-Claisen rearrangement) Belousov-Zhabotinsky 反应、B-Z 反应 (Belousov-Zhabotinsky reaction) Benary 反应 (Benary reaction) Benet 合成 (Benet synthesis) Benkeser 反应(Benkeser reaction) Benkeser 还原反应(Benkeser reduction) Berchtold 反应 (Berchtold reaction) Bergman 反应、 Bergman 环化反应、 Bergman-Masamune 环化反应 (Bergman reaction) Bergmann 二氢恶唑酮肽合成 (Bergmann azlactone peptide synthesis) Bergmann 递降反应 (Bergmann degradation) Bergmann 蒽合成 (Bergmann anthracene reaction) Bergmann-Schotte 反应 (Bergmann-Schotte reaction) Bergmann-Zevars 法 ( 多 肽 合 成 中 用 氯 代 甲 酸 苯 甲 酯 保 护 氨 基 ) (Bergmann-Zevars
高等有机合成化学 02.3 偶合反应

OSiR3
H
CHC5H11 OSiR3
炔烃在铜或亚铜盐催化下,可经双分子偶合 生成二炔烃。该反应称为Glaser反应。
HOOC HOOC Cu Cl /O H 1) 2 2 2 2)H3PO4, aq COOH
实验室中,18-轮烯就是以1,5-己二炔为原料经该反应而制 备的。
MgBr ClCH2C CCH2Cl R Et2O
R 70-90%
R
2013-8-23
30
将芳基Grignard试剂同硼酸酯作用可得相应的芳基硼 酸,后者在四-(三苯基膦)钯催化下,能与芳基溴 或芳基碘发生偶联。由于该反应产率很好,而且芳 卤化合物的邻对位可带有不同取代基,从而具有广 泛的实用价值。
两分子芳基卤的偶联反应最早可能是由Ullmann发现 的,所以称为Ullmann反应。
该反应可用来合成许多对称的和不对称的联芳基卤化合物。 芳环上的取代基除-OH、-NH2、CH3CONH-、-COOH等外, 一般对反应没有不良影响。现已发现,卤原子邻位的硝基可 促进反应的进行,R、RO基在所有位置都能促进反应。
2013-8-23
19
在合成中,有机镍化合物和卤化物的偶联应用也很广泛。 烯丙基卤和羰基镍首先形成两分子烯丙基卤和两个 Ni原子键合的络合物,后者能和许多有机卤化物 反应,结果烯丙基与卤代物中的烃基连接。例如:
Br CH2=CHCH2Br Ni(CO)4 Ni Br CH2=CHBr I [(CH2=CHCH2)NiBr]2 [(CH2=CHCH2)NiBr]2 CH2=CHCH2CH=CH2 CH2CH=CH2 70% 91% Ni [(CH2=CHCH2)NiBr]2
+
H3C
偶合和偶氮化合物

二.偶合和偶氮化合物1.偶合反应概述 偶合反应是指重氮盐与含活泼氢原子的化合物发生的以偶氮基取代氢原子的反应。
如 这一反应是重氮正离子的亲电取代反应,不论A-H是芳香族或脂肪族化合物,只要A 有足够的电子云,都可发生亲电取代反应。
反应时重氮盐正离子进攻偶合组分核上电子云较高的碳原子,形成中间产物,这是一步可逆反应。
该中间产物迅速失去一个氢质子,不可逆地转化为偶氮化合物。
2.芳胺和酚的偶合反应 芳胺和酚的对位(和邻位)电子云密度较大,易发生偶合反应,但一般仅进攻对位,这是因为重氮正离子受羟基或氨基的位阻影响,不易对邻位进攻。
若对位被其它基团占据,则视该基团的性质,或进入其邻位,或是芳偶氮基取代该基团(-SO3H,-COOH),生成对羟基偶氮化合物。
若对位和两个邻位均被占据,则不发生偶合。
由各种酚和芳胺经重氮盐形成的偶合化合物,色彩鲜艳,经常做染料使用,称为偶氮染料。
以上反应是偶氮染料化学的基本反应,酚和重氮盐的偶合,必须在弱碱性溶液中进行。
在强酸性的溶液中,偶合反应一般不发生。
在弱酸性介质中,重氮组分与芳胺反应有三种情况: (1).与芳环活性强的胺,如间甲苯胺、间苯二胺、N,N-二甲基苯胺、α-萘胺等反应,直接生成偶氮化合物。
(2).与芳环活性弱的胺,如苯胺,对甲苯胺、邻甲苯胺、N-甲基苯胺等反应,先生成重氮胺基化合物,然后在一定条件下重排为偶氮化合物。
(3).与易生成难重排的重氮胺基化合物的伯胺偶合时,应将氨基保护起来,待偶合反应完成后再把它水解释放出来。
保护氨基常用的方法是: 苯二胺(酚)作偶合组分时,通常只有间位化合物易偶合,偶合产物主要在4-位。
若4-位被占据,偶合产物则主要在6-位。
3.萘系化合物的偶合反应(1).α-萘胺(酚)作偶合组分时,偶氮产物主要在4-位。
若4-位被占据,则进入2-位:(2).β-萘酚(胺)作偶合组分时,芳偶氮基进入α-位。
若α-位被占据,一般不发生偶合或在个别情况下发生偶合时,α-位原基团脱掉。
反应的耦合

二、生化反应中的耦合
生物能力学: 生物能力学:热力学原理和方法研究生命系统中的能量关系
-7 -1 溶液化学势标准态: 含H+溶液化学势标准态 c H + = 10 mol L (pH = 7) ⊕ Gm 标准态Gibbs能符号: 能符号: 标准态 能符号
生物体内存在大量反应偶合例子,如37 °C时, 生物体内存在大量反应偶合例子 6–磷酸葡萄糖 磷酸葡萄糖
单击网页左上角“后退”退出
返回
1 H 2 ( g ) + O 2 ( g ) = H 2 O( g ) 2
298K时,rGθm= –208.59 kJmol-1 时 总反应: 总反应:氧化脱氢
1 C 6 H 5 C 2 H 5 ( g ) + O 2 ( g ) = C 6 H 5 C 2 H 3 ( g ) + H 2 O( g ) 2 298K时,rGθm= –145.48 kJmol-1,极易反应 时
⊕ r Gm = 13.4 kJ mol 1 磷酸盐) 葡萄糖 + pi(磷酸盐)= 6–磷酸葡萄糖 磷酸葡萄糖
ATP→ADP + pi + H+ → 两者偶合 ATP 葡萄糖 ADP 6–磷酸葡萄糖 磷酸葡萄糖
⊕ r Gm = 30.5 kJ mol 1
⊕ r Gm = 17.2 kJ mol 1
偶合:同时发生二个反应, 偶合:同时发生二个反应,一个反应的产物为另一反应的反应 物,这二个反应为偶合 意义: 意义:用容易进行的反应带动难以进行的反应
一、反应偶合概念
例 乙苯脱氢 C6H5C2H5(g) →C6H5C2H3(g) + H2(g) 298K时,rGθm= 83.11 kJmol-1,极难反应 时 偶合第二反应
金属有机化学 第9章 偶联反应

Suzuki Coupling
• Susuki coupling: a palladium-catalyzed reaction of an organoborane (R’-BY2) with an alkenyl, aryl, or alkynyl halide or triflate (R-X)
Suzuki Coupling
– these examples illustrate the versatility of the reaction
H B(Sia) 2 + Br H
B(OMe) 2 + Br N NH2
H C6 H1 3 Pd( Ph3 ) 4 NaOMe
Ph( OAc) 2 Na2 CO3 N
H
C6 H1 3
NH2
B( OMe) 2
Pd( OAc) 2 + Br Et 3 N
Suzuki Coupling
由烯烃对M-C键的插入和β-消除组成的 Heck 反应
H RX + + Base [Pd] R
催化循环?
Heck Reaction
BH X
+ -
R- X L2 Pd
oxidative addition 1
R H
4
R4 R3 R2 R
R3
R2
3 rotation about th e C-C b on d by 60°
R
补充作业
1. 获得手性化合物的方法有哪些? 2. 什么是不对称催化?对其中起关键性作用的催 化剂有何要求? 3. 过渡金属催化的交叉偶联反应的共性是什么? 根据金属试剂的不同,有哪些(人名)偶联反 应? 4. 分别写出Suzuki反应和Heck反应的催化循环。
偶合和分散技术

"偶合"和"分散"通常用于描述化学反应或物理过程中的两种不同的方式。
偶合技术(Coupling)通常涉及将两个或多个分子中的原子或基团结合成一个新的分子。
这种技术在有机化学中非常常见,尤其是在合成复杂有机分子时。
例如,Suzuki偶合是一种重要的偶合反应,可用于连接芳香烃基团。
偶合技术可以通过形成键来将分子连接在一起,通常需要使用催化剂来促进反应。
分散技术(Dispersion)通常是指将某种物质分散在另一种物质中的过程。
这种技术在不同领域都得到广泛应用。
例如,在涂料工业中,使用分散技术将颜料分散在溶剂或树脂中。
在生物学和化学中,分散技术也用于分散颗粒或分子以便随后的实验操作。
总的来说,偶合技术是将两个或多个分子结合成一个新的分子,而分散技术则是将物质均匀地散布在另一种物质中。
这两种技术在化学和其他领域中都扮演着重要的角色。
偶联反应ppt--总合

I Cu
可能的机理为:
ArI Cu ArCuI ArI Ar Ar
(2) Glaser反应:炔烃在铜或亚铜盐催化下,可经双分子 偶合生成二炔烃。 例如:
HOOC HOOC H 1)Cu2Cl2/O2 2)H3PO4, aq COOH
CuCl, NH4Cl O2
60%
(4)Cadiot-chodkiewicz反应:在亚铜盐催化下,端位炔与 炔卤化合物的偶合可得不对称的二炔烃。
Stille 偶联
Yu Chen, Polym. Chem, DOI: 10.1039/c3py01018j,IF:5.321
Suzuki偶联反应
科研应用:
Yu Chen, Chem. Eur. J,2013,19,30, IF:5.925
Stille 偶联
一、自由基偶联反应
酯等羰基化合物在金属还原下,会形成双分子偶联产 物(偶姻反应)。 例如:
偶联反应
自身偶联:相同的两个片段形成一个分子,如:碘苯(PhI)自身形成 联苯 (Ph-Ph)。
基本类型
基本应用
1.Suzuki reaction(铃木偶联反应) 2.Stille coupling(施蒂勒反应)
3.Yamamoto coupling(山本偶联反应)
4. Sonogashira coupling(薗头偶联反应)
机理为:
(5)Castro-stephens反应:反应性较低的芳基卤化物与炔化 亚铜反应,可生成收率很高的炔基芳香化合物。 例如:
(6)Kumada反应:在Ni或Pd催化下,格式试剂(Grignard reagent) 与卤化物的偶联反应。 例如:
催化剂: NiX2L2(L2=双膦) 溶剂: Et2O or THF 反应条件: 0oC~R.T., reflux, 1~20h, [Ni]/R'X' =10-2~10-3 R‘X’: sp2碳的卤化物 在Pd催化下,卤代烃的反应性大小顺序为:I >Br >Cl; 而在Ni催化下,其活性顺序为:Cl> I> Br。上式中dppe为 Ph2PCH2CH2PPh2的缩写。
化学物质硫代偶合反应探究实验应用

工业生产:硫代 偶合反应在工业 生产中也有应用, 可用于生产高分 子材料、染料、 农药等。
03 硫代偶合反应实验步骤
实验前的准备
实验材料:硫代偶合剂、 氧化剂、还原剂等
实验设备:搅拌器、温度 计、压力计等
实验试剂:去离子水、有 机溶剂等
安全措施:佩戴防护眼镜、 实验服等
实验操作流程
准备试剂和仪器:根据实验需要,准备好所需 的试剂和仪器,并确保它们是干净的。
实验误差控制
实验操作规范:确保实验步骤准确无误,遵循操作规程。 试剂质量控制:确保实验所用的试剂质量合格,没有杂质。 实验条件控制:确保实验温度、湿度等条件符合要求,保持恒定。 实验数据记录和处理:详细记录实验数据,采用合适的方法处理数据,减少误差。
实验数据处理与分析
数据记录:及时、 准确记录实验数 据,包括反应时 间、温度、pH值 等
实验结果分析
产物颜色:描述产 物的颜色和状态
产率计算:根据实 验数据计算产率
产物表征:通过光 谱、质谱等方法对 产物进行表征
结果分析:分析实 验结果,探究反应 机理
04
硫代偶合反应实验应用 实例
在有机合成中的应用
硫代偶合反应在合 成有机化合物中具 有广泛的应用,可 以用于合成多种类 型的有机化合物, 如醇、醚、硫醚等。
硫代偶合反应在生物医学领域中可用于制备荧光探针和生物传感器,用于疾病诊断和治疗监 测。
该反应还可用于设计和合成具有生物活性的小分子干扰RNA,用于基因治疗和癌症治疗。
05
硫代偶合反应实验注意 事项
实验安全注意事项
实验操作人员必须经过专业培训,熟悉实验原理和操作规程。
实验过程中要穿戴好防护眼镜、实验服和化学防护手套等个人防护用 品。
偶合反应相关知识

重氮化重氮化和偶合反应是重要的有机合成反应,在精细化工中有很重要的地位,该类反应在染料合成中应用很广,是两个主要的工序。
可合成酸性、冰染、直接、分散、活性、阳离子等类型的染料,还可合成各类黄色、红色偶氮型有机颜料。
一.重氮化和重氮化合物1.重氮化反应及影响因素芳香族伯胺和亚硝酸作用生成重氮盐的反应称为重氮化。
重氮化反应要在强酸中进行,实际上是亚硝酸作用于铵离子。
由于亚硝酸不稳定,通常使用亚硝酸钠和盐酸或硫酸,使反应生成的亚硝酸立刻与芳伯胺反应,避免亚硝酸的分解。
为了使反应能顺利进行,必须首先把芳伯胺转化为铵正离子。
芳胺的碱性较弱,因此重氮化要在较强的酸中进行。
有些芳胺碱性非常弱,要用特殊的方法才能进行重氮化。
重氮化是放热反应,重氮盐对热不稳定,因此要在冷却的情况下进行,一般都用冰盐浴冷却,并调节亚硝酸钠的加入速度,维持反应温度在0℃附近,由于重氮盐不稳定,一般就用它们的溶液,随做随用。
固体重氮盐遇热或震动、摩擦,都将发生爆炸,必需应用某些稳定性好的固体重氮盐时,也需谨慎小心。
自重氮化反应发现以来,人们为了弄清楚其反应的影响因素,对重氮化反应的机理进行了反复研究,已普遍接受了重氮化反应的亚硝化学说即重氮化反应是由亚硝酸产生的亲电质点对游离芳伯胺基进行亲电取代反应的机理,其反应的主要影响因素如下。
(1).酸的影响酸的影响主要考虑酸的种类、用量及浓度的影响。
重氮化所用的酸,从反应速度来说,以盐酸或氢溴酸等最快,硫酸与硝酸较次。
由反应式可以看出酸的理论用量为2摩尔,在反应中无机酸的作用是:首先是使芳胺溶解,其次可和亚硝酸钠生成亚硝酸,最后是生成稳定的重氮盐。
重氮盐一般来讲是容易分解的,只有在过量的酸液中才稳定,所以重氮化时实际上酸用量过量很多,常达3~4摩尔。
反应完毕时介质应呈强酸性,PH值为3,对刚果红试剂呈蓝色,重氮化过程经常检查介质的PH值是十分重要的。
反应时若酸量不足,生成的重氮盐容易和未反应的芳胺偶合,生成重氮胺基化合物。
(完整版)大学有机化学人名反应总结
【例】
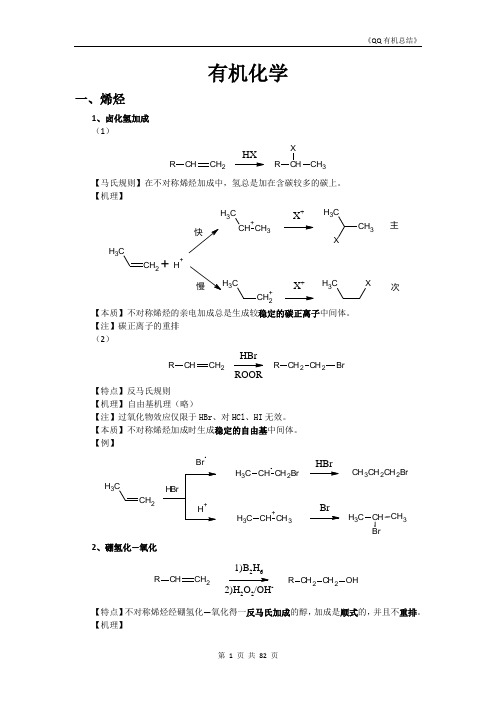
6、醛(酮)的还原
(1)催化氢化
【注】很多基团都可以催化氢化,如碳碳双键、碳碳三键、硝基、氰基……,所以选择催化氢化还原羰基的时候,要看好化合物是否还有其他可以催化氢化的基团。
(2)用LiAlH4、NaBH4还原
3、醇的氧化
(1)沙瑞特(Sarret)试剂
【注】沙瑞特试剂,是CrO3和吡啶的络合物。它可以把伯醇的氧化控制在生成醛的阶段上,产率比较高,且对分子中的双键无影琼斯试剂是把CrO3溶于稀硫酸中,滴加到醇的丙酮溶液中,在室温下就可以得到很高的产率的酮。同样对分子中的双键无影响。
(格式试剂)
(2)与金属钠反应 武兹(Wurtz)反应
(3)与金属锂反应
【注】二烷基铜锂主要是与卤代烃偶联成烷烃
4、还原反应
5、氯甲基化
五、醇
1、卢卡斯(Lucas)试剂
无水氯化锌与浓盐酸的很合溶液叫卢卡斯试剂,用于鉴别伯、仲、叔醇
2、把羟基变成卤基
(1)、醇与卤化磷(PX5、PX3)
(2)、醇与亚硫酰氯(SOCl2)
4、环氧化合物
(1)开环
①酸性开环
【注】不对称环氧化合物的酸性开环方向是亲核试剂优先与取代较多的碳原子结合。
【例】
②碱性开环
【注】碱性开环,亲核试剂总是先进攻空间位阻较小的,空间效应。
【例】
【注】环氧开环不论酸式还是碱式开环,都属于SN2类型的反应,所以亲核试剂总是从离去基团(氧桥)的反位进攻中心碳原子,得到反式开环产物。这种过程犹如在烯烃加溴时,溴负离子对溴鎓离子的进攻。
【机理】
【注】类似的构型也可发生重排
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+
H3C
2013-11-11
(CH3)2SO4 H3C CH3
52-60%
CH3
13
C6H5 MgCl
+
CH3(CH2)3OSO2C3H7
C6H5(CH2)4CH3
50 59
- %
除了Na、Li、Mg等活泼金属化合物外,铜的有机金属化合物 在碳碳单键的形成中特别有用。 这类化合物最典型的有机铜锂试剂,是由甲基锂和碘化亚铜 制备的,生成二甲基铜锂。这种试剂是优良的烷基化试剂, 其分子中的烷基能取代多种类型的卤原子。特别可贵的是能 同高支链的仲、叔卤代烷偶合成不对称烷烃,而且没有消除 产物烯类生成。一些典型实例如下:
(CH2)2CH3 62-72%
Br
Br
CH3I
CH3 50%
2013-11-11
8
有机锂化物、Grignard试剂等其它有机金属化 合物也能发生类似Wurtz反应的偶合。
RLi
RX R'X
R R
RMgX
RX
R R
RC CNa
RC CR'
2013-11-11
9
为了揭示Wurtz反应的机理,曾对有机锂与卤代 烷的偶合作了较为深入的研究. 结果表明:结构简单的烷基锂偶合时,可以通过 现代物理方法检测到自由基的存在,偶联产物中 除了正常较高级的烷烃外,还有自由基的歧化和 自联产物。
NO2
NO2 CF3SO3Cu Br
O2 N
2013-11-11
27
除铜外,现已发现有机镍化合物也可催化芳基卤化 合物本身或它与芳基格式试剂的偶联。 该反应虽然不属于Ullmann反应,但是近年来研究 发现,其机理有类似之处。
曾报导用双(乙酰丙酮基)镍(Ⅱ),或者氯化镍的三 苯基膦络合物催化偶联反应,其温和的条件和较高 的产率是比较引人注目的。例如:
2013-11-11 17
OSiR3
H
CHC5H11 OSiR3
炔烃在铜或亚铜盐催化下,可经双分子偶合 生成二炔烃。该反应称为Glaser反应。
HOOC HOOC Cu Cl /O H 1) 2 2 2 2)H3PO4, aq COOH
实验室中,18-轮烯就是以1,5-己二炔为原料经该反应而制 备的。
本节将介绍形成碳碳单键的另一类反应--偶合反应。
2013-11-11
4
2.3.1
脂烃基偶合
脂烃基之间或脂烃基与芳基之间的偶合,一般是通过 活泼金属有机物和卤代烃之间的反应而实现的。 一个早期的例子是Wurtz反应。在金属钠作用下,两 分子卤代烷通过Wurtz反应可生成两个烷基连接的烷 烃。 当两分子卤代烷相同时,产率可达40-60%。不同卤 代烷分子之间的偶合可能生成三种产物,所以缺少合 成价值。
2013-11-11
11
此外,有机锂试剂的碳负离子对卤代烷的SN2机理, 其产物发生高度构型反转似乎是很有力的证据。
C2H5 C6H5CH2Li H Br CH3 C6H5CH2 C2H5 H 58%(100% reverse) CH3
由此可见,有机金属化合物和卤代烷的偶合不是 一种机理所能概括的。反应物结构和反应条件的 不同,可能使偶联经不同的途径而进行。
NC C6H5CH=CHBr Br (COD)2Ni NC CN 81%
(COD)2Ni
C6H5CH=CH CH=CHC6H5 46%
另外,乙烯卤或芳基卤和Grignard试剂的偶合也能 被2价镍化合物催化:
Cl CH3(CH2)3MgBr
2013-11-11
(CH2)3CH3 (R2PCH2)2NiCl2 94% (CH2)3CH3
MgBr ClCH2C CCH2Cl R Et2O
R 70-90%
R
2013-11-11
30
将芳基Grignard试剂同硼酸酯作用可得相应的芳基硼 酸,后者在四-(三苯基膦)钯催化下,能与芳基溴 或芳基碘发生偶联。由于该反应产率很好,而且芳 卤化合物的邻对位可带有不同取代基,从而具有广 泛的实用价值。
2013-11-11
12
在合成中,甲基、苄基和烯丙基卤代烷作为烷 基化试剂时,与Grignard试剂进行偶合的烷基化 具有实用价值。一些实例如下:
CH3 C6H5 Cl CH3 MgBr CH3 CH3 (CH2)4CH3 + CH3(CH2)MgBr
9
CH3 C6H5 (CH2)9CH3 (CH2)4CH3
芳基偶合反应
两分子芳基卤的偶联反应最早可能是由Ullmann发现 的,所以称为Ullmann反应。
该反应可用来合成许多对称的和不对称的联芳基卤化合物。 芳环上的取代基除-OH、-NH2、CH3CONH-、-COOH等外, 一般对反应没有不良影响。现已发现,卤原子邻位的硝基可 促进反应的进行,R、RO基在所有位置都能促进反应。
一种认为偶合经有机钠化合物对卤代烷的SN2反应而实现。 证据是反应一般得到构型反转的产物,而且卤代烷的活性顺 序是1o> 2o> 3o 。 另一种认为钠首先与卤代烷作用生成自由基R ,然后两 个R再结合生成烷烃。主要依据是反应生成的烯烃副产物是 相应的烷基歧化作用(disproportionation)所致。 由于钠过于活泼,对Wurtz反应的机理还缺乏统一的意见。
22
Cl
在钛催化下,羰基化合物能发生还原偶合反应而得 烯烃。反应中两个羰基氧原子生成TiO2被脱除,该 方法可制备高位阻烯烃。
O Ti THF,N2
91%
2013-11-11
23
CHO Ti THF,N2
85%
COCH3
CH3COCH3 Ti THF,N2
95%
2013-11-11
24
2.3.2
I Cu
对于反应机理还不清楚,可能的机理是:
ArI
2013-11-11
Cu
ArCuI ArI
Ar
Ar
25
一些实例如下:
NO2 I Cu+,CH3COCH3 NH3 , H2O
NO2
O2N
I COOCH3 Br NO2
92%
COOCH3 61% O2N
Cu 74% I
2013-11-11
I
Cu
26
Ullmann反应的改良是用三氟甲磺酸亚铜为催化剂, 这样可使反应在30℃ 左右的温度下进行。
2013-11-11
7
Fittig曾用芳基卤化物代替卤代烷进行上述反应,因 反应生成多种副产物而无应用价值。 但改用一分子芳卤化物与一分子卤代烷在钠存在下反 应时,可成功地获得烷基芳烃类产物。该反应即为 Wurtz-Fittig反应。
Br
Br(CH2)2CH3 Na Et2O Na Et2O H3C
HO 4%
(CH3)2CuLi
(CH3)3CCH=CHCH2C(CH3)3
2013-11-11
15
烷基铜锂和卤代烷的偶合具有良好的立体选择性。 反应中手性卤代烷所得的产物构型发生反转, 这是反应经SN2历程的一个有力证据。
H Br (C6H5)2CuLi THF C6H5 H 87% (84-92%ee)
n C4H9Br n C4H9Li C6H5CH(CH3)2 n C8H18 43% n C4H10 19%
2013-11-11
C2H5CH=CH2 3%
C6H5C(CH3)2 18%
C(CH3)2C6H5
10
烯丙基卤与苯基或烷基锂偶合时,同位素示 踪表明偶联为协同机理:
CH2 C6H5
CH CH2 Cl Li C6H5CH2CH=CH2
2013-11-11
28
BrMg I Br
Ni(AcAc)2 80%
NiCl2(Ph3P)2 MgBr Br H3COOC (COD)2Ni COOCH3
2013-11-11
73%
COOCH3 85%
29
1,4-二氯-2-丁炔或1,4-二氯-2-丁烯也具有催化上 述反应的作用。由于能与芳基Grignard试剂发生电 子转移,从而使偶联容易进行,结果以相当高的产 率生成联芳mann反应)
2013-11-11
33
OCH3 OCH3 CH3 Tl(OCOCF3)3 81-92% CH3
CH3 OCH3
2013-11-11 32
2.3 偶合反应--小结
序 号 反应名称(中英文) 反应物种类 反应条件 产物种类 反应实例 (使用何种 催化剂)
1
脂 烃 基 偶 合 反 应
Wurtz反应 Wurtz-Fittig反应 Glaser反应 Cadiot- Chodkiewicz反应
2013-11-11
16
不对称的烷基铜锂试剂可由炔铜与相应烃基的锂化物来制备。 由于炔基和铜的结合十分牢固,因此这种试剂在反应时只选 择性地转移另一个烃基。利用炔基铜锂的这种选择性,可在 卤代烷的碳原子上或在,-不饱和酮的-碳原子上引入比较 复杂的烷基。
C3H7C CCuLi H C3H7C CCu [(CH3)2N]3P LiCH=CHCHC5H11 O O OSiR3 CH=CHCHC5H11
2013-11-11
5
所以,Wurtz反应一般仅用于对称烷烃的制备, 例如
2 C4H9Br Na C4H9 C4H9 Na 48%
2 CH3CHCH2CH2Br CH3
BrCH2CH2CH2Br
CH3CH(CH2)4CHCH3 CH3 CH3
70%
Na
2013-11-11
6
关于该反应的机理有两种不同看法。
2013-11-11
20
另外,分子内进行时,能使双烯丙基卤化物环化。 合成上制备大环化合物。
