CNBr-4B活化填料使用说明书(译文)
CNBr_handbook

Affinity chromatography
CNBr-activated Sepharose 4 Fast Flow
• Rapid, efficient coupling and maintained biological activity of
the ligand
• Multi-point attachment of many protein ligands, resulting in a
The coupling reaction
The coupling reaction, which is rapid and spontaneous, is easy to carry out and requires no special chemicals or equipment.
spherical
Linear flow*
150 cm/h at 100 kPa
CNBr-activated Sepharose 4 r
4–5 ml drained gel/g
Coupling capacity
13-26 mg α-chymotrypsinogen/ml
We recommend users of affinity chromatography, especially those developing purifications for scale up to production, to evaluate both products. NHS-activated Sepharose 4 Fast Flow is described separately in Data File 18-1113-53.
CNBr-activated Sepharose 4 Fast Flow is a new pre-activated affinity matrix that combines the advantages of CNBr coupling with the high flow and stability characteristics of Sepharose 4 Fast Flow. In our experience, the CNBr coupling technique has a well-proven track record for the purification of therapeutic proteins. This, plus the performance of the matrix at large scale, makes the use of CNBr-activated Sepharose 4 Fast Flow particularly attractive for manufacturing applications in the pharmaceutical industry. Furthermore, the medium is a member of the BioProcess™ media family and carries comprehensive technical and regulatory support for production applications.
快速高效偶联亲和层析介质试剂盒说明书

快速高效偶联亲和层析介质试剂盒说明书【产品名称】通用名称:CDI预活化琼脂糖凝胶4B试剂盒。
商品名称:快速高效偶联试剂盒。
【包装规格】20mL活化柱+500mL缓冲液/盒,附送亲和层析用空柱一支。
【预期用途】快速高效偶联试剂盒适用于亲和层析填料的快速制备以及固相吸附、固定化酶等用途。
【主要组成成份】●预活化琼脂糖凝胶4B●缓冲液【原理】本试剂盒系用优质琼脂糖凝胶 4B活化后存放于保护液中和适合的偶联缓冲液制成,用活性咪唑碳酸酯基团偶联需要的配体。
使用时,保护液被洗去后就可使欲偶联的配体的氨基和活性咪唑碳酸酯反应,脱去咪唑基,使得配体的氨基通过共价键牢固的链接在基质上,即可方便得到高偶联效率的亲和层析填料。
【存储条件和有效期】存储条件:原包装应储存于4-8 C。
密封保存在阴凉干燥处切忌冷冻。
有效期:一年。
【适用仪器】本产品无需特殊仪器辅助使用,只需要在操作时使用抽滤装置帮助抽去洗涤液,以免洗涤时间过长造成偶联效果不理想。
附送的亲和层析空柱可安装适合的接口用于自动纯化仪。
【配体要求】配体溶液的质量至关重要。
配体需溶解于偶联缓冲液中并使得浓度大于15mg/mL,并且浓度越大,偶联效果越好,如已经溶解在其他缓冲液中,可用偶联缓冲液透析平衡。
【偶联方法】方法一:1、预先准备好溶解在偶联缓冲液中的配体(可用直接溶解或透析方法制备),浓度>15mg/ml或者更高,浓度越高偶联效果越好。
2、将活化琼脂糖摇匀,倒入抽滤漏斗,加5倍体积的去离子水,抽气至快干时拔掉抽气管,注意不可抽干,此步速度宜快。
3、用配体溶液悬浮抽滤漏斗里的琼脂糖固体,摇床缓慢振荡(不可使用磁力搅拌器),室温3小时或4摄氏度过夜,然后洗净即可。
洗出来的配体可回收使用。
此方法适用于比较昂贵的配体。
方法二:1、用干燥枪头吸去保护剂。
制备配体在溶液B中的溶液(可用直接溶解或透析方法制备),浓度>15mg/ml或者更高,浓度越高偶联效果越好。
CNBr-4B活化填料使用说明书(译文)

CNBr活化柱说明书溴化氰活化琼脂糖™-4B是一种预活化并固定配体来结合氨基的介质。
它提供了一个非常方便的固定溴化氰配体的方法。
这个偶联反应是自发的、快速和容易实现的。
它的应用领域涵盖了固定化蛋白质、多肽和核酸等。
注:线性流速=体积流速(L/h)/ 层析柱横截面积(cm2)这里所给出的范围是基于我们的立论知识和经验估计的。
请注意以下几点:pH值稳定、长期保存的pH值区间指的是凝胶在很长一段时间内可以保持稳定,没有在其随后的层析分离时出现不利的影响。
pH值稳定、短期保存的pH值区间是相对于再生、在线清洗和维护程序来说的。
准备阶段溴化氰活化琼脂糖™-4 B是以添加剂的形式冻干处理得到的。
这些添加剂在填料螯合所需的配体前必须在低pH(pH 2 – 3)条件下进行清洗。
活化后的活性基团也应该使用低pH 值(pH值2 – 3)保存,而在高pH值则会出现降解。
称取所需量的冻干粉(1 g冻干粉可获得3.5ml终体积的介质),使用1mM HCl悬浮。
介质会立刻膨胀,再用1mM HCl在玻璃过滤器中进行清洗15min。
每克冻干粉添加约200ml 1mM 的HCl溶胀,实际按几等分的量来添加。
螯合配体常规的配体螯合过程1.在螯合前,使用0.1 M NaHCO3、0.5 M NaCl pH 8.3的螯合缓冲液来溶解配体,每克冻干粉使用5ml螯合缓冲液溶解。
一般,每毫升的填料介质可以结合5-10mg的蛋白配体。
对于较小的配体,一般每毫升填料介质添加1-10μM的配体。
2.称出所需量的溴化氰活化琼脂糖-4B填料。
如上所述,用1mM HCl来溶胀和清洗冻干粉。
3. 在一个密封的容器里,将溶解的配体与待螯合的介质混合。
在室温下反复旋转混合约1 h或在4℃下过夜混合,其他温和的搅拌方法也可以使用的。
4.使用至少5倍填料体积的螯合缓冲液来洗去多余的配体。
5.排除任何剩余的活性配体,将填料转移到0.1M Tris-HCl缓冲液pH 8.0或1M 乙醇胺,pH值8.0溶液中,保持2h。
CNBr活化琼脂糖填料明书(GE)

GE HealthcareInstructions 71-7086-00 AF Affinity mediaCNBr-activated Sepharose™ 4B CNBr-activated Sepharose 4B is a pre-activated medium for immobilization of ligands containing primary amines. It provides a very convenient way to immobilize ligands by the cyanogen bromide method. The coupling reaction is spontaneous, rapid and easy to carry out.The application area covers immobilization of proteins, peptides and nucleic acids.Table 1. Medium characteristics.Bead structure: 4% agaroseSpacer: NoneCoupling capacity: 25–60 mg α-chymotrypsinogen/ml drainedmediumBead size range: 45–165 μmAverage bead size: 90 μmMax linear flow rate*: 75 cm/h at 25°C, HR 16/10 column, 5 cm bed height pH stability**:Long term: 3–11Short term: 2–11Chemical stability***: Stable to all commonly used aqueous solutions.Can be used with non-ionic detergents, denaturingsolvents, e.g. 8 M urea and 6 M guanidinehydrochloride. Stable in organic solvents, such as50% dimethylformamide and 50% dioxane. Autoclavable: Not recommended* Linear flow rate = volumetric flow rate (cm3/h) column cross-sectional area (cm2)** The ranges given are estimates based on our knowledge and experience. Please note the following:pH stability, long term refers to the pH interval where the gel is stable over a longperiod of time without adverse effects on its subsequent chromatographic perfor-mance.pH stability, short term refers to the pH interval for regeneration, cleaning-in-place and sanitization procedures.*** Data refer to the coupled product, provided that the ligand can withstand the pH or chemical environment.p.Contents1. Preparing the medium 42. Coupling the ligand 43. Factors effecting the coupling efficiency 54. Packing Sepharose 4B 75. Binding 96. Elution 97. Regeneration 108. Storage 109. Further information 1010. Ordering information 11p.1. Preparing the mediumCNBr-activated Sepharose 4B is supplied lyophilized in the presence ofadditives. These additives must be washed away at low pH (pH 3) beforecoupling the desired ligand. The use of low pH (pH 3) preserves the activity ofthe reactive groups, which otherwise hydrolyze at high pH.Weigh out the required amount of powder (1 g lyophilized powder givesabout 3.5 ml final volume of medium) and suspend it in 1 mM HCl. Themedium swells immediately and should now be washed for 15 minutes with1 mM HCl on a sintered glass filter (porosity G3). Use approximately200 ml 1 mM HCl per gram freeze-dried powder, added in several aliquots. 2. Coupling the ligandGeneral ligand coupling procedure1. Dissolve the ligand to be coupled in coupling buffer, 0.1 M NaHCO3 pH 8.3 containing 0.5 M NaCl. Use about 5 ml coupling solution/glyophilized powder.About 5–10 mg protein per ml medium is recommended. For smallerligands add 1–10 μmoles per ml medium.2. Add the coupling solution containing the ligand with the preparedmedium suspension in a stoppered vessel.3. Rotate the mixture end-overend for 1 h at room temperature orovernight at 4 °C. Other gentle stirring methods may be employed.Do not use a magnetic stirrers as these can disrupt the Sepharosebeads.4. Wash away excess ligand with at least 5 medium (gel) volumes ofcoupling buffer.5. Block any remaining active groups. Transfer the medium to 0.1 M Tris-HCl buffer, pH 8.0 or 1 M ethanolamine, pH 8.0. Let it stand for 2 hours.p.6. Wash the medium with at least three cycles of alternating pH. Wash withat least 5 medium volumes of each buffer.Each cycle should consist of a wash with 0.1 M acetic acid/sodiumacetate, pH 4.0 containing 0.5 M NaCl followed by a wash with0.1 M Tris-HCl, pH 8 containing 0.5 M NaCl.3. Factors effecting the coupling efficiencypHThe coupling reaction proceeds most efficiently in the pH range 8–10 where the amino groups on the ligand are predominantly in the unprotonated form. A buffer at pH 8.3 is most frequently used for coupling proteins. Coupling at low pH is less efficient but may be advantegeous if the ligand looses biological activity when it is fixed firmly by multi-point attachmentor if steric hindrance between binding sites occurs when a large amount of high molecular weight ligand is immobilized. A buffer of approximately pH 6is used for coupling at low pH.Coupling solutionCoupling should be performed in bicarbonate or borate buffers. Tris andother buffer salts containing amino groups should not be used since thesewill couple to the medium.Organic solvents may be needed to dissolve the ligand. Dimethylformamide and dioxane may be used up to 50% of the final mixture. The same concentration of organic solvents should be included in the coupling buffer. Always adjust the pH after dissolving the ligand, since organic solvent usually lowers pH.p.SaltTo minimize protein-protein adsorption and the formation of proteinaggregates, it is recommended to have a high salt content, 0.5 M NaCl, in the coupling buffer.TemperatureCoupling is completed within 2 hours at room temperature, 20–25 °C. If cold room temperatures are necessary, coupling can be carried out overnight. Ligand concentrationA very high ligand concentration can have adverse effects on affinitychromatography. Firstly, the binding efficiency of the adsorbent maybe reduced due to steric hindrance between the active sites. Secondly,substances are more strongly bound to the immobilized ligand and this may result in difficult elution. Thirdly, the extent of non-specific binding increases at high ligand concentrations.For an efficient adsorbent, 1–10 μmoles ligand per ml medium isrecommended. For protein ligands, 5–10 mg protein per ml medium isrecommended.Controlling the coupling efficiencySometimes it may be necessary to reduce the number of coupling groups on the matrix to preserve the structure of the binding site in a labile molecule, or to facilitate elution when high binding constants make elution difficult or when steric effects reduce the binding efficiency of a large ligand.Reduced coupling activity may be achieved by controlled hydrolysis ofthe activated medium prior to coupling, or by coupling at a lower pH. Pre-hydrolysis reduces the number of active groups available for couplingand reduces the number of points of attachment between the protein and matrix as well as the amount of protein coupled. In this way a higher binding activity of the product is obtained. At pH 3, coupling activity is lost onlyslowly, whereas at pH 8.3 activity is lost fairly rapidly. A large molecule is coupled at only about half as many points after 4 h pre-hydrolysis at pH 8.3 as it is before the number of active groups was reduced.p. 6Blocking excess remaining groupsRemaining active groups on the medium should be deactivated or blocked after the coupling. These can be hydrolyzed in a mildly alkaline pH (2 hoursat room temperature or 16 h at 4 °C).Alternatively, these can also be blocked by adding an excess of a small primary amine (e.g. Tris-HCl, ethanolamine, glycine) at approximatelypH 8 (2 hours at room temperature or 16 h at 4 °C).These blocking agents introduce a small number of charged groups intothe medium. The effect of these charged groups is overcome by the useof a relatively high salt concentration (0.5 M NaCl) in the buffer for affinity chromatography.Washing the adsorbentTo remove excess of uncoupled ligand after coupling, the adsorbentis washed alternatively with high and low pH buffer solutions at leastthree times. Acetate buffer (0.1 M, pH 4) and coupling buffer (pH 8.3) each containing 0.5 M NaCl are suitable. This procedure ensures that no freeligand remains ionically bound to the immobilized ligand.4. Packing Sepharose 4BPrepare a slurry with binding buffer, see below, in a ratio of 75% settled medium to 25% buffer. The binding buffer should not contain agents which significantly increase the viscosity. The column may be equilibrated with viscous buffers at reduced flow rates after packing is completed.1. Equilibrate all material to the temperature at which the chromatographywill be performed.2. De-gas the medium slurry.3. Eliminate air from the column dead spaces by flushing the end pieceswith buffer. Make sure no air has been trapped under the column net.Close the column outlet with a few centimeters of buffer remaining in the column.p. 74. Pour the slurry into the column in one continuous motion. Pouring theslurry down a glass rod held against the wall of the column will minimize the introduction of air bubbles.5. Immediately fill the remainder of the column with buffer, mount thecolumn top piece onto the column and connect the column to a pump.6. Open the bottom outlet of the column and set the pump to run at thedesired flow rate. This should be at least 133% of the flow rate to beused during subsequent chromatographic procedures. However, themaximum flow rate, see Table 1, is typically employed during packing. Note: If you have packed at the maximum linear flow rate, do not exceed 75% of this in subsequent chromatographic procedures.7. Maintain the packing flow rate for 3 bed volumes after a constant bedheight is reached.Using an adapterAdapters should be fitted as follows:1. After the medium has been packed as described above, close thecolumn outlet and remove the top piece from the column. Carefully fillthe rest of the column with buffer to form an upward meniscus at thetop.2. Insert the adapter at an angle into the column, ensuring that no air istrapped under the net.3. Make all tubing connections at this stage. There must be a bubble-freeliquid connection between the column and the pump.4. Slide the plunger slowly down the column so that the air above thenet and in the capillary tubings is displaced by eluent. Valves on theinlet side of the column should be turned in all directions during thisprocedure to ensure that air is removed.5. Lock the adapter in position on the medium surface, open the columnoutlet and start the eluent flow. Pass eluent through the column at thepacking flow rate until the medium bed is stable. Re-position the adapter on the medium surface as necessary.The column is now packed and equilibrated and ready for use.p. 85. BindingConditions for binding depend on which ligand is used. Literature references and textbooks may give good guidelines.The adsorption will depend upon parameters such as sample concentration, flow rate, pH, buffer composition and temperature. General guidelines for adsorption are:• Sample pH should be the same as that of the binding buffer. Filter the sample through a 0.22 μm or 0.45 μm filter to prolong the working life of the medium.• After the sample has been loaded, wash the medium with binding buffer until the base line is stable.6. ElutionConditions for elution of bound substances depend on which ligand is used. Literature references and textbooks may give good guidelines.General guidelines are described below.• pH change: A change in pH alters the degree of ionization of charged groups at the binding sites. Elution is generally affected by a decrease in pH. The chemical stability of the matrix, ligand and adsorbed substances determines the limits of pH which may be used.•Ionic strength: A buffer with increased ionic strength is used. Elution with a continuous or step-wise gradient may be used. A gradient ofincreasing salt concentration can be used to separate substances bound to the adsorbent. NaCl is most frequently used and enzymes usuallyelute at a concentration of 1 M NaCl or less. If the interaction has a very high affinity, a chaotropic salt may be required.• Competitive elution: Competitive eluents are often used to selectively elute substances from a group specific adsorbent and also when theaffinities are relatively low. Selectively retained substances are usuallydisplaced at low concentrations of eluting agents, often less then 10 mM.Either continuous or step-wise gradients may be used.p.• Reduced polarity: Conditions which lower the polarity of the eluent to promote elution may be used if they do not inactivate elutedsubstances. Dioxane (up to 10%) or ethylene glycol (up to 50%) may beused.• Deforming eluents: If the elution methods described above fail to affect elution, deforming agents, such as chaotropic salts, guanidine-HCl orurea, which alter the structure of the proteins can be used.7. RegenerationConditions for regeneration depend on which ligand has been coupled.Literature references and textbooks may give good guideines.A general regeneration method is described below:An affinity medium may be regenerated for re-use by washing the medium with 2–3 column volumes of alternating high pH (0.1 M Tris-HCl, 0.5 M NaCl, pH 8.5) and low pH (0.1 M sodium acetate, 0.5 M NaCl, pH 4.5) buffers. This cycle should be repeated 3 times followed by re-equilibration in binding buffer.8. StorageLyophilized CNBr-activated Sepharose 4B should be stored below 8 °C.Swollen coupled medium should be stored at 4–8 °C in presence of abacteriostatic agent, e.g. 20% ethanol.9. Further informationCheck /protein-purification for more information.Useful information is also available in the Affinity ChromatographyHandbook, se ordering information.p. 1010. Ordering informationProduct Pack size Code No. CBNr-activated Sepharose 4B 15 g 17-0430-01250 g 17-0430-02 LiteratureAffinity Chromatography Handbook, 1 18-1022-29 Principles and MethodsAffinity Columns and Media, 1 18-1121-86 Product Profilep. 11GE, imagination at work and GE monogram are trademarks of General Electric Company.Drop Design and Sepharose are trademarks of GE Healthcare companies. © 1996-2009 General Electric Company – All rights reserved. Previously published Aug. 1996.All goods and services are sold subject to the terms and conditions of sale of the company within GE Healthcare which supplies them. A copy of these terms and conditions is available on request. Contact your local GE Healthcare representative for the most current information.GE Healthcare Europe GmbH Munzinger Strasse 5D-79111 Freiburg GermanyGE Healthcare UK Limited Amersham Place Little ChalfontBuckinghamshire, HP7 9NA UKGE Healthcare Bio-Sciences Corp.800 Centennial Avenue P.O. Box 1327Piscataway, NJ 08855-1327USAGE HealthcareJapan Corporation Sanken Bldg.3-25-1, HyakuninchoShinjuku-ku, Tokyo 169-0073JapanFor local offoce contact information, visit /contact GE Healthcare Bio-Sciences AB Björkgatan 30751 84 Uppsala Sweden/protein-purification71-7086-00 AF 12/2009imagination at work。
谷胱甘肽-琼脂糖凝胶4B (GST标签纯化树脂)使用说明

谷胱甘肽-琼脂糖凝胶4B(GST标签纯化树脂)使用说明货号:P2020规格:5ml/10ml保存:4℃保存,有效期至少一年产品简介:pGEX载体表达的外源蛋白与谷胱甘肽S-转移酶融合,因此可以通过谷胱甘肽-琼脂糖亲和层析进行纯化。
GSTs是一类以谷胱甘肽(γ-谷氨酰半胱氨酰甘氨酸)作为底物,通过形成硫醇尿酸失活毒性小分子的酶。
由于GST对底物的亲和力是亚毫摩尔级的,因此谷胱甘肽固化于琼脂糖形成的亲和层析树脂对GST及其融合蛋白的纯化效率很高。
可以用含游离谷胱甘肽的缓冲液洗脱结合GST融合蛋白。
树脂用3mol/L NaCl的缓冲液再生。
谷胱甘肽琼脂糖对GST融合蛋白的结合能力很强(每毫升柱床体积的树脂能结合8毫克融合蛋白)。
特性:粒度:45-165um流速:75cm/h工作PH:4-10耐压:0.3Mpa载量:>5mg谷胱甘肽S-转移酶使用说明:谷胱甘肽树脂的处理:1.轻轻颠倒盛有谷胱甘肽-琼脂糖树脂的容器,将树脂混成匀浆。
2.取部分匀浆放入15ml聚丙烯管(每100ml细菌培养物大约需要2ml匀浆)。
3.4℃500g离心5分钟,小心去掉上清。
4.在树脂中加入10倍柱床体积预冷的PBS,颠倒数次混匀,4℃500g离心5分钟,小心去掉上清。
5.每毫升树脂加入1毫升冷的PBS,制成50%匀浆,颠倒数次,混合均匀,悬液冰上放置待用。
制备细胞抽提物:6.每100毫升培养物的细胞沉淀重悬于4mlPBS缓冲液中。
7.加入溶菌酶至终浓度为1mg/ml,冰上放置30分钟。
8.用针筒将10ml浓度为0.2%的TritonX-100强行注入黏稠的细胞裂解物中,剧烈振动数次混匀。
加入DNase和RNase至终浓度5ug/ml,4℃振动温育10分钟,4℃3000g 离心30分钟,去除不溶性细胞碎片,上清转移到一只新管中,加入DTT至终浓度1mmol/L。
纯化融合蛋白:9.细胞裂解物与适量50%谷胱甘肽-琼脂糖树脂匀浆混和,每100毫升细菌培养物加2ml树脂,于室温轻摇30min。
层析树脂和填料操作手册

北京慧德易科技有限责任公司
-7– 电话:010-51528296/97/98
树脂和填料操作手册
重要。
ೋɺ 过滤 过滤是在进行低压、中压及高压液相色谱分离前最简单易行的样品制备手段。通过滤纸
或烧结玻璃漏斗的过滤,可除去颗粒状物质及不溶物质。 此外,也可通过装有硅胶、活性炭或其他填料的短柱进行过滤,去除其中具有强吸附力
北京慧德易科技有限责任公司
-6– 电话:010-51528296/97/98
树脂和填料操作手册
样品前处理
样品的制备对于复杂的分离与纯化非常重要。恰当的样品预处理可以免去后续操作中许多麻 烦,使得分离纯化变得更为容易。
Ұɺ 提取 合理的选择单一或混合溶剂进行提取是保证正确的样品制备的第一步。中草药成分在溶
作为一种初步的纯化方法,沉淀经常被用于皂苷的研究中。将含有皂苷的提取物(如经 过丁醇-水分配之后)的浓缩甲醇液倾入大量的乙醚中,利用过滤或离心的方法收集沉淀的 皂苷。反复利用这种沉淀法可达到更好的效果。
排阻极限45kd与所用溶剂有关吸附模式取决于所需分辩率分子量大小小于总体积的20正相分配小于总体积的1胶粒形状球形多孔颗粒大小干18111um直径颗粒大小中间值干70um直径颗粒大小甲醇27163um直径颗粒大小中间值甲醇103um直径最大线性流速720cmmin参考线性流速60cmminph的稳定性操作中211清洗中213化学稳定性在许多水溶液及有机溶剂系统中都稳定
分辨率:
tR(1)
tR(2)
RS=
2(t R 2-t R1 tW 1+tW 2
)
进样
W1/2(1)
W1/2(2)
tW1
tW2
4. 分离度 K1和 K3 HPLC的目的和要求是:峰要尽可能窄(W1/2小),峰的间距尽可能大(tR相差大)。 ⑴基线分离度 K1 :
人C反应蛋白的分离纯化及初步应用

maiL com
万方数据
中国民族民间医药
・14・ Chinese
论著
Treatis
journal
of ethnomedieine
and
ethnopharmacy
gallneateehin一3一Gallate sion in Keloid Fibrnhlasts
vest
Inhibit M∞t CeU—Stimulated Type I via Blocking PI一3K/Akt Signaling
(下转第14页)
pH7.8)溶解沉淀,充分透析除去硫酸铵。 1.2.1.2初步纯化CRP 取适馈活化好的DEAE填料按常规方法装柱,用基础 缓冲液平衡。经过预处理的样品上样,通过改变离子强度
作者简介:黄国团,广两师范大学在读硕十研究生;王丽兰,桂林医学院临床检验系主管技师。王丽兰与黄国团对本文有同等贡献。 通讯作者:蔡豪斌(1963一),男.医学硕士学位,桂林医学院副教授。桂林英美特生物技术研究所副研究员。Email:enihaobin@hot—
[19]冯幼平.粉防己碱对增生性雅痕戚纤维细胞增殖及ERK/NF—KB通路 的影响[J].实用医学杂志,2008,24(20):3459—3461. [20]袁志-呸,何晓升,何文涓.粉防已碱对人增生性缀痕成纤维细胞增殖 及细胞周期的影响【J].中国牛化药物杂志,2008,29(2):127—128. [21]何晓升,钟晓春.粉防已碱对搬痕成纤维细胞超微结构的影响[J]. 浙江医学,2005,27(9).665—666. [22]曹治东。石崇荣,黄崇本。等.汉肪己甲索对增牛性瘢瘦基质胶原酶 活性的影响[J].中华整形外科杂志.2006,22(6):448—450. [23]汤苏阳。蔡宝仁,徐获荣,等.苦参碱对增生性瘢痕成纤维细胞凋亡 及相关调控蛋白表达的影响[J].中华烧伤杂志,2002,18(5):299
CNBr活化琼脂糖凝胶 4B

CNBr-Activated Crystarose 4B活性基团:C≡N一、简介CNBr-Activated Crystarose 4B 是CNBr活化填料,它采用平均粒径为45--165μm的琼脂糖凝胶。
该活化填料的活化基团可以结合蛋白质、多肽以及核酸等其他含有氨基(-HN2)基团的配基。
其优点是具有反应条件温和,反应速度快、活性高、偶联效率高,与市场上同类产品不同的地方是偶联后的配基脱落极低。
二、产品技术指标:三、适用范围自制亲和层析填料,提供对不同用户具体的偶联方案。
四、应用实例实验名称:偶联牛血清白蛋白(BSA)实验步骤:1、取BSA 100mg 溶解于10ml 的0.1M 碳酸钠缓冲液中,pH8.3。
2、称量活化填料1g,(1g 干粉经完全溶胀后体积为4-4.5ml)。
3、在抽滤瓶中用3倍体积的1mM HCL水清洗填料,或用5倍体积浸泡填料后丢弃上清,尽量吸干液体(可选方法:也可不用清洗直接加入偶联蛋白液进行偶联)。
4、将清洗后的填料加入BSA 溶液中混合,在摇床上振荡,室温偶联1-3小时或者4℃过夜。
5、然后加用Tris-HCL缓冲液或者加入50mg 甘氨酸,室温反应2小时以上以封闭剩余的基团。
6、将偶联后的BSA 的填料装柱子,用5—10倍体积的0.5M NaCl溶液洗柱,收集洗脱液。
7、偶联量测定:计算方法:BSA 的偶联量=(B0—B1)/V。
注:B0:偶联前BSA 总蛋白量,单位:mg。
B1:偶联后(洗柱液)未偶联的BSA 总蛋白量,单位:mg。
V:填料的体积,单位:ml。
备注:该偶联方法可用于偶联单抗及其它蛋白,均能获得很好的偶联效果。
蓝晓生物科技CNBr Activated Seplife FF介质说明书

CNBr Activated Seplife FF说明书1.产品介绍CNBr Activated Seplife FF琼脂糖层析介质是蓝晓科技自主研发的一种新型活化中间体填料,它是通过溴化氰和琼脂糖上面的羟基反应生成活化的氰酸酯基团。
蛋白质、多肽、氨基酸等可以偶联到溴化氰活化琼脂糖凝胶上。
具有以下优点:偶联条件温和,效率高;可偶联含有氨基的配体,应用范围广。
2.性能介绍产品牌号CNBr Activated Seplife FF外观白色球状冻干粉,无臭无味基质Seplife4FF配基溴化氰形状球形最大线性流量75cm/h(25℃),直径1.6cm色谱柱,5cm柱床高粒径(μm)45~165偶联能力20~60mg α-胰凝乳蛋白酶原/ml凝胶pH稳定性2~11在以下溶液中稳定:6M盐酸胍;8M尿素;非离子型表面活性剂;化学稳定性一般有机溶剂:50%二甲基甲酰胺、50%二氧六环应用活化中间体,用于偶联配基3.使用方法下面简要介绍介质偶联配体的使用过程。
具体实验条件取决于配基,应根据具体配基选择偶联、洗脱和再生条件。
3.1干粉的溶胀称取一定量的CNBr Activated Seplife FF冻干粉放置在1mmol/L HCl中悬浮溶胀,放置大约30分钟后抽滤,用约15倍胶体积的 1mmol/L HCl溶液冲洗干净,用偶联缓冲液洗涤,抽干。
3.2 配基的偶联一般配体偶联的过程如下:(1)将所需要偶联的配基溶解到含有0.5mol/L NaCl 的0.1mol/LNaHCO3 (pH8.3)缓冲溶液中,加入溶胀好的CNBr activated seplife®4B。
(2)在室温中搅拌反应2~4小时或者在4℃下反应过夜。
(3)反应完全后,先用5倍反应体积的偶联缓冲液洗涤掉其中多余的配体,然后用10倍体积的水洗涤。
(4)将反应完洗涤过的凝胶悬浮到水中,加入乙醇胺(1mol/L)或者pH8.0 T ris-HCl缓冲液,在常温最少搅拌反应2小时,以消除残余活性基团。
多克隆抗体纯化
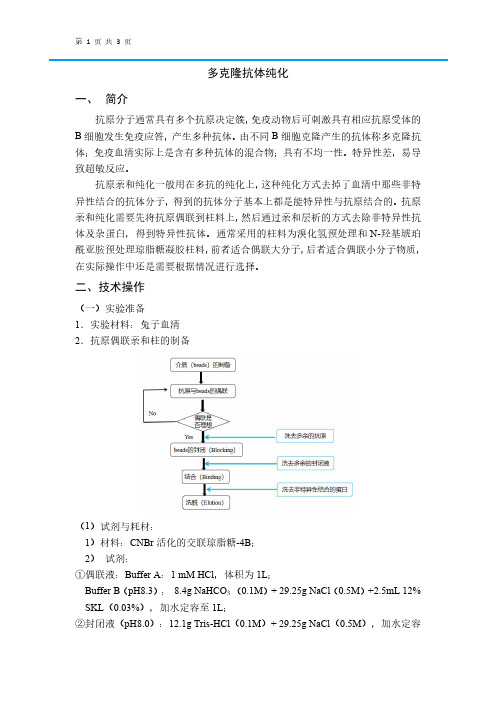
多克隆抗体纯化一、简介抗原分子通常具有多个抗原决定簇,免疫动物后可刺激具有相应抗原受体的B细胞发生免疫应答,产生多种抗体。
由不同B细胞克隆产生的抗体称多克隆抗体;免疫血清实际上是含有多种抗体的混合物;具有不均一性。
特异性差,易导致超敏反应。
抗原亲和纯化一般用在多抗的纯化上,这种纯化方式去掉了血清中那些非特异性结合的抗体分子,得到的抗体分子基本上都是能特异性与抗原结合的。
抗原亲和纯化需要先将抗原偶联到柱料上,然后通过亲和层析的方式去除非特异性抗体及杂蛋白,得到特异性抗体。
通常采用的柱料为溴化氢预处理和N-羟基琥珀酰亚胺预处理琼脂糖凝胶柱料,前者适合偶联大分子,后者适合偶联小分子物质,在实际操作中还是需要根据情况进行选择。
二、技术操作(一)实验准备1.实验材料:兔子血清2.抗原偶联亲和柱的制备(1)试剂与耗材:1)材料:CNBr活化的交联琼脂糖-4B;2)试剂:①偶联液:Buffer A:1mM HCl,体积为1L;Buffer B(pH8.3):8.4g NaHCO3(0.1M)+29.25g NaCl(0.5M)+2.5mL12% SKL(0.03%),加水定容至1L;②封闭液(pH8.0):12.1g Tris-HCl(0.1M)+29.25g NaCl(0.5M),加水定容至1L;③清洗液(pH4.0):29.25g NaCl(0.5M)+11.5mL冰醋酸,加水定容至1L;④亲和纯化试剂:1xPBS缓冲溶液(pH7.4),0.1M Gly-HCl(pH2.7);⑤其他试剂:硫酸铵,考马斯亮蓝G-2503)仪器与设备:Thermo台式离心机miro17R酶标仪(2)实验步骤①清洗:称取0.2g的CNBr活化交联琼脂糖-4B到柱子中,用偶联液A(1mM HCl)清洗,再用偶联液B清洗3-4遍。
②偶联:用偶联液B溶解的蛋白与填料介质混合,室温旋转孵育1h或4℃过夜;再用偶联液B洗去多余的蛋白;③封闭:将上述填料转移到封闭液(0.1M Tris-HCl,pH8.0)中封闭,室温封闭2h或4℃过夜;④循环清洗:封闭液(pH8.0)和清洗液(pH4.0)交替清洗填料至少3个循环;⑤平衡:用1xPBS缓冲溶液(pH7.4)平衡填料⑥保存:4℃,20%乙醇;3.多抗亲和纯化(1)硫酸铵沉淀①样品预处理:取过滤后的血清,用1xPBS稀释4-5倍;②硫酸铵沉淀:称取终浓度为0.277mg/mL的硫酸铵(45%)。
4B说明书-内文16页

尊敬的顾客:感谢您使用华汉针神牌DJT—4B型诊疗仪。
为充分发挥本仪器的功效,请在使用前详细阅读本使用说明书。
注意事项及禁忌:●本仪器不要与其它医用电子仪器,如心脑电图仪、高频及微波治疗仪等同时使用。
●体内植入心脏起搏器、电子肺等电子医疗器械的患者应在医生指导下使用本仪器。
●骨折和大出血及有出血倾向性疾病的患者应在医生指导下使用本仪器。
●孕期、哺乳期、产褥期的妇女应在医生指导下使用本仪器。
●使用本仪器严禁在体表创伤溃疡部位选用穴位。
选用头部穴位及面部穴位时,请严格控制强度和时间。
●本仪器禁止幼儿或无自主表达能力者使用。
●使用前应保持治疗部位皮肤的清洁和湿润度,以增加治疗强度和疗效。
●当使用 0V交流电(市电)供电时,必须使用本产品配套提供的专用直流稳压器。
●使用时请勿用力拉抻诊疗线和专用直流稳压器的电源线,在插拔各电极插头时,请捏住插头根部。
●治疗过程中,更换电极或更换治疗部位时,请关断电源。
●本仪器严禁在浴室等潮湿环境里使用。
●请将废电池投放到专设的垃圾箱或收集站。
目 录一、概述 (4)1、产品型号和特点 (4)、主机与主要附件的名称 (4)、性能参数 (4)4、使用环境条件 (4)5、安全标记 (5)6、适用范围 (5)二、产品原理与结构 (5)1、基本原理 (5)、诊病原理 (6)、治病原理 (7)4、工作原理 (7)三、使用方法 (8)1、诊断疾病方法 (8)、治疗疾病方法 (10)四、故障分析与排除 (1)五、产品的配套 (15)六、售后服务、承诺 (15)一、概述DJT-4B型诊疗仪是我公司研制生产的诊疗仪系列产品之一。
它是中医经络理论、人体凸出部位全息论与现代电子全息针灸相结合的新型医疗器械。
仪器仅用电极接触皮肤表面治疗(为非植入式治疗),无毒副作用,安全可靠。
1、产品型号和特点本仪器的型号为DJT—4B型,按国家医疗器械管理分类属于Ⅱ类:68 7中医器械“治疗仪器”类。
仪器采用微电脑技术,具有诊断、治疗和健身三种功能。
蛋白纯化实验常见问题精华解析

蛋白纯化实验常见问题精华解析本文主要介绍了蛋白纯化过程中常见的问题.内容选择方面恐存众不足,望指正。
1)我现在手头有个融合蛋白,纯化的时候用助溶剂溶解后做了GST 亲和层析,之后用蛋白酶切割后却发现目的蛋白没有活性。
请问有哪些可能会出现这种原因?怎么解决?测过基因序列,没有问题。
细胞破碎后,融合蛋白在沉淀里,我用助溶剂提取后,可以用GST做亲和层析,但效率只有50~60%左右。
洗脱完融合蛋白不需要助溶剂,但这样的条件下切割完后目的蛋白会沉淀,我用0.5%CHAPS 助溶可勉强溶解部分,目的蛋白疏水性比较强。
既然是疏水性很强你可以加点甘油或者乙二醇降低极性,这样溶解就会好得多,此外你也直接加2%的PEG这样也降低极性,同时保护你的蛋白,你再做纯化就可以了,我以前遇到这样的蛋白是用10%的乙醇加3-5%的PEG5000,这样的情况下蛋白还是活性回收率很高,我觉得那些表面活性剂能不用还是不用的好,你失去活性你可以监测一下提取,纯化,酶切到底哪里失去了活性,这样更容易解决你的问题。
还有注意缓冲液PH值,看看改变它对溶解度有没有影响。
蛋白有沉淀那你可以稍微把蛋白的浓度降低点,这也是个办法。
2)请问楼主有没有合成过配体为FMN的亲和胶?我已经给你发了相关一些偶联的材料,请查收,现在一般要自己合成亲和填料,有很多公司都提供活化好的介质,自己偶联就可以,其中比较常用的有溴化氰琼脂糖凝胶,环氧琼脂糖凝胶,氨基琼脂糖凝胶,羧基琼脂糖凝胶,活化酯琼脂糖凝胶,以及巯基琼脂糖凝胶等,但是如果是小分子的配基最好选择有3-10碳作为手臂的活化介质为好,此外也曾经有文献报导固定辅酶时,偶联位置不同,选择性有差别,因此你可以选择自己适合的活化介质。
不同的活化的介质对偶联的配基有不同的要求,所以要对自己的配基了解比较清楚就可以选择合适的活化介质。
我一般在合成的时候大多选择环氧琼脂糖凝胶,它能应用的范围广氨基巯基羟基都可以,而且合成的介质刚性好,非特异吸附少,所以不需要特殊处理未反应基团。
CNBr 4FF 使用说明书

网址:CNBr 4FF使用说明书为确保产品的性能和无忧的操作,使用前请仔细阅读本手册,有任何疑问请咨询本公司售后技术支持或当地的销售人员。
1. 产品介绍CNBr 4FF是经过溴化氰活化后含有氰酸酯基团的快流速纯化介质,适用于偶联蛋白质、多肽、核酸等含有氨基的生物分子。
在生物医药纯化工艺中经过反复的验证,得到了广泛的应用。
特点如下:a. 应用广泛,可适用于偶联含氨基的生物类大分子。
b. 多点偶联,简单、灵活、快速、有效,能高效的维持生物分子的生物学活性及稳定性。
c. 流速快、产率高、易于放大。
表1:介质性能参数基质高度交联4%的琼脂糖粒径范围45-165µm平均粒径90µm结合载量30mg(Trypsinogen)/ml(介质)pH稳定性3-11(长期)2-11(短期)最大流速700cm/h操作压力≤0.3MPa贮存溶液100%丙酮贮存温度4-8℃2. 偶联条件a.(A液)清洗取适量的沉降胶(0.83g清洗完成后约为1.0ml),用5倍体积的A液将介质重悬,5min后将溶液抽干。
重复此步骤5次。
备注:此步骤用于激活介质,要保证A液的清洗体积要充足、清洗时间固定在0.5h左右(时间太久介质上面的基团会水解)。
b. 配基溶液的制备将要偶联的生物分子用B液溶解或者将生物分子置换到B液中(生物分子浓度为1-10mg/ml,建议为5mg/ml)。
备注:确保偶联时的pH和盐浓度与B液一致。
c. 偶联将清洗完的介质和准备好的样品按等比例(体积比)混合,室温条件下温和混匀3-4h。
确网址:定偶联成功(通过测定偶联前后生物分子含量确定偶联效率)后,将溶液抽干。
备注:偶联建议在室温条件下偶联3-4h。
对于不稳定的配基,建议4-8℃偶联过夜。
d.(C液)清洗用5倍体积的C液将偶联后的介质重悬,再将溶液抽干。
再重复此步骤3次。
备注:此步骤用于清洗介质中残留的生物分子,清洗要彻底。
e. 封闭用5倍体积的C液进行重悬,室温条件下温和混匀3-4小时后,将溶液抽干。
两种pH值条件下CNBr活化Sepharose 4B偶联DSA方法的比较研究

两种pH值条件下CNBr活化Sepharose 4B偶联DSA方法的比较研究王念跃;赵伟;李勇;黄宇峰;端木浩【期刊名称】《中国生化药物杂志》【年(卷),期】2005(26)6【摘要】目的研究碱性、中性两种条件下CNBr活化Sepharose 4B偶联欧蔓陀罗凝集素(DSA)的效果.方法在两种偶联条件下,通过改变CNBr用量、活化时间以及温度等条件,观察DSA的偶联率指标.结果碱性条件下,活化15 min即使增加CNBr用量至300mg/ml凝胶,固定化凝集素偶联率没有提高,DSA偶联率较低,在29.1%~50.9%之间;中性条件下,CNBr用量仅为碱性条件下的20%,活化温度控制在-10~-20℃可能获得较好的活化效果,DSA偶联率在78.8%~80.9%之间.结论中性条件下CNBr活化Sepharose 4B偶联DSA,实验易于控制,DSA偶联率比较稳定,实验重复性好于碱性条件下的结果,且可获较高偶联率的DSA-Sephrose 4B.【总页数】3页(P356-358)【作者】王念跃;赵伟;李勇;黄宇峰;端木浩【作者单位】东南大学,医学院,附属南京第二医院,江苏,南京,210003;东南大学,医学院,附属南京第二医院,江苏,南京,210003;南京军区南京总医院,江苏,南京,210002;南京军区南京总医院,江苏,南京,210002;东南大学,医学院,附属南京第二医院,江苏,南京,210003【正文语种】中文【中图分类】Q503【相关文献】1.魔芋葡苷聚糖(KGM)凝胶为亲和层析载体与 Sepharose 4B的比较研究Ⅱ.KGM 染料亲和层析分离人血清白蛋白 [J], 周立;蒋磊;郑远旗;李建吾Br-Papain-Sepharose 4B 亲和填料的制备及其性质研究 [J], 刘明宇;李树红;杨娟;林昊;杨珂;谭小千3.环氧氯丙烷偶联单克隆抗体——Sepharose 4B亲和层析柱的制备与应用 [J], 杨竞平;杨翰仪;王永丽4.国产免疫磁珠与溴化氢活化Sepharose 4B亲和层析分离羊抗人IgG的比较 [J], 童军;李勇;陈亚光;刘庆海;杨文冲;刘颖5.魔竽葡苷聚糖凝胶为亲和层析载体与Sepharose 4B的比较研究——Ⅰ.KGM金属螯和层析分离纯化猪血SOD [J], 周立;蒋磊;郑远旗;李建吾因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CNBr活化柱说明书
溴化氰活化琼脂糖™-4B是一种预活化并固定配体来结合氨基的介质。
它提供了一个非常方便的固定溴化氰配体的方法。
这个偶联反应是自发的、快速和容易实现的。
它的应用领域涵盖了固定化蛋白质、多肽和核酸等。
注:线性流速=体积流速(L/h)/ 层析柱横截面积(cm2)
这里所给出的范围是基于我们的立论知识和经验估计的。
请注意以下几点:
pH值稳定、长期保存的pH值区间指的是凝胶在很长一段时间内可以保持稳定,没有在其随后的层析分离时出现不利的影响。
pH值稳定、短期保存的pH值区间是相对于再生、在线清洗和维护程序来说的。
准备阶段
溴化氰活化琼脂糖™-4 B是以添加剂的形式冻干处理得到的。
这些添加剂在填料螯合所需的配体前必须在低pH(pH 2 – 3)条件下进行清洗。
活化后的活性基团也应该使用低pH 值(pH值2 – 3)保存,而在高pH值则会出现降解。
称取所需量的冻干粉(1 g冻干粉可获得3.5ml终体积的介质),使用1mM HCl悬浮。
介质会立刻膨胀,再用1mM HCl在玻璃过滤器中进行清洗15min。
每克冻干粉添加约200ml 1mM 的HCl溶胀,实际按几等分的量来添加。
螯合配体
常规的配体螯合过程
1.在螯合前,使用0.1 M NaHCO3、0.5 M NaCl pH 8.3的螯合缓冲液来溶解配体,每克冻干粉使用5ml螯合缓冲液溶解。
一般,每毫升的填料介质可以结合5-10mg的蛋白配体。
对于较小的配体,一般每毫升填料介质添加1-10μM的配体。
2.称出所需量的溴化氰活化琼脂糖-4B填料。
如上所述,用1mM HCl来溶胀和清洗冻干粉。
3. 在一个密封的容器里,将溶解的配体与待螯合的介质混合。
在室温下反复旋转混合约1 h或在4℃下过夜混合,其他温和的搅拌方法也可以使用的。
4.使用至少5倍填料体积的螯合缓冲液来洗去多余的配体。
5.排除任何剩余的活性配体,将填料转移到0.1M Tris-HCl缓冲液pH 8.0或1M 乙醇胺,pH值8.0溶液中,保持2h。
6.每个循环均要使用包括0.1M 醋酸盐缓冲液,0.5M NaCl pH4.0以及0.1M Tris-HCl,0.5M NaCl,pH8.0的缓冲液来清洗,交替用两种pH缓冲液清洗填料至少三个循环,每次至少用5倍填料体积的缓冲液来清洗。
影响螯合的因素
pH
偶联反应最有大效率是pH值在8 – 10的范围内,此时配体上的氨基主要是以非质子化的形式存在。
pH值在8.3的缓冲体系最常用于结合蛋白。
螯合反应在低pH值下效率较是很低的,但是也可能是有效的,比如说当采用多点附着稳定固定的时候,配体生物活性有所损失,或是在大量的高分子配体固定化时,结合位点之间出现位阻,此时pH在6.0的缓冲液则是适合配体的螯合。
螯合用缓冲液
螯合过程应该在碳酸氢盐或硼酸盐缓冲液中完成。
Tris和其他包含氨基的缓冲盐液不应使用,因为这些氨基将会结合到凝胶上。
配体可能需要有机溶剂来溶解,可以使用终浓度在50%的二甲基甲酰胺和二恶烷,而在螯合缓冲液也应使用相同浓度的有机溶剂。
由于有机溶剂通常处于较低pH值,在溶解配体后需要调整pH值。
盐离子
在螯合缓冲液中,为减少蛋白质吸附和蛋白质聚集的形成,建议高盐环境,如含0.5 M NaCl的缓冲液。
温度
螯合过程在室温下一般需要2h来完成,20~25℃。
如果需要在冷库内完成,则是需要过夜螯合。
配体浓度
非常高的配体浓度会对亲和层析带来不利的影响。
首先,由于结合位点之间的位阻会出现,吸附剂的结合效率可能会减少。
其次,物质更强烈地结合到固定化的配体上,这可能导致难以被洗脱。
第三,在高配体浓度下,非特异性结合的程度会增加。
对于一个高效的吸附剂,推荐每毫升介质螯合1~10μM配体。
对蛋白质配体来说,推荐每毫升介质螯合5 – 10mg蛋白质。
控制螯合效率
对于结构不稳定的配体,有时可能需要减少螯合组分的数量来保护结合位点的结构,或是用来避免在高密度螯合时出现不易洗脱的情况,再或是为减少大分子配体在螯合过程中的空间位阻效应。
在结合之前,控制活性介质的水解可降低结合活性,或是在一个较低的pH下进行螯合。
预水解可以降低具有结合能力活性基团的数量,也可以减少蛋白质与基质间结合位点的数量,以及降低结合蛋白的数量,用这种方法可以得到更高活性的胶。
在pH为3.0的条件下,螯合过程较为缓慢,而在pH值8.3时活性降低的也是相当的快。
在pH8.3条件下,经过4h 的预水解后的活性位点减少到介质没有降低前数量的一半。
排除剩余的活性配体
结合之后,基质中残留的一些活性组分应该进行灭活,活性组分可在一个弱碱性条件下被水解(在室温下2h或在4℃下16h)。
另外,这些残留配体也可以通过添加少量的伯胺类物质(例如Tris-HCl、乙醇胺、甘氨酸),大约在pH 8.0(在室温下2h或在4℃下16 h)加以去除。
这些阻滞剂会引入一小部分带电的基团到介质之中,这些带电介质对亲和层析的影响会被后续的缓冲液中较高浓度的盐(0.5M NaCl)所抵消。
吸附剂的清洗
为了在螯合结束后去除多余的未螯合的配体,填料需要在高pH或低pH下冲洗至少三次。
比较合适的是选择0.1M 醋酸盐缓冲液,0.5M NaCl pH4.0和螯合缓冲液,pH8.3的缓冲液交替来清洗。
这一步确保了没有游离的配体残留而不可预料的结合到固定的配体上。
洗脱方式
pH洗脱pH的变化会改变结合位点组分的电离度,pH降低通常会影响洗脱过程,基质、
配体以及结合物质的化学稳定性决定洗脱所采用的pH值范围。
离子强度采用多线或者梯度的洗脱的方式时,需要增加缓冲液的离子强度。
梯度增加洗脱液中的盐离子浓度,可以对结合到吸附剂上的不同物质进行分离。
酶类的洗脱时盐离子浓度通常在1M或者更低的浓度。
如果结合物质与吸附剂高度亲和,就需要适当提高盐离子浓度。
竞争洗脱竞争洗脱通常是从吸附剂上选择性洗脱结合物质,也可以在亲和力较低时洗脱特异性吸附物质,而选择性保留下来的物质在低浓度洗脱液中才能被置换出来,一般浓度低于10mM,采用线性洗脱或是梯度洗脱都可以。
降低极性如果洗脱物质不能被固定,可以在洗脱液中添加二氧己环(10%)或是乙烯(50%)来降低洗脱液的极性,从而促进洗脱的进行。
变性洗脱如果上述洗脱方式不是很好的洗脱,可适当添加一些变性剂,如盐酸胍胡、离液序列较高的盐或是尿素来改变蛋白质的结构,从而促进洗脱的进行。
再生与保存
再生亲和填料再生时使用0.1M Tris-HCl,0.5M NaCl,pH8.5与0.1M 醋酸盐缓冲液,0.5M NaCl pH4.5交替清洗,清洗三个循环后,使用结合缓冲液进行再生,待下一次的使用。
保存溴化氰填料干粉一般保存在2-8℃,溶胀后需要添加抑菌剂后再在2-8℃下保存,一般抑菌剂选择NaN3.。
