天津大学反应工程课件[专业类别]
天津大学反应工程-第6章-4

6.4.4内外扩散都有影响时有效因子
用总有效因子表示的表观速率
*A 0kwcAG
用外扩散速率表示的反应速率(定态下)
*A kG am (cAG cAS )
用内扩散有效因子表示的表观速率
*A kwcAS
6.4.4内外扩散都有影响时有效因子
反应过程达到定态时,三式是等效的,即
R*A L2 2D cAG
e cAC
f f
cAG <<1
cA dcA
满足上式表明内扩散过程的影响已消除。
6.6.2 内扩散影响的判定
单一粒度催化剂实验判据
对于一级反应来说,满足
s
R*AL2 <<1
DecAG
表明内扩散过程的影响已消除。
• 当Rp≤RC时,内扩 散阻力对过程没有 影响。
RA*
Rc
R
6.6.2 内扩散影响的判定
对α级反应,因为
1
L
2De
(
1)k
p
c 1 AS
✓消除内扩散影响的粒度与温度有关,温度 越高,所要求的粒度越小。
✓消除内扩散影响的粒度与浓度有关(一级 反应除外),浓度越高,粒度越小。
6.6.2 内扩散影响的判定
搅拌速度 rpm0
6.6.1外扩散影响的判定
(3)经验判据
• 浓差判据
*AL 0.15
cAGkG
• 温差判据
L*A (Hr ) 0.15 RTG
hsTG
E
符合上两式,则相间浓度差和温度差可视为零。
6.6.2 内扩散影响的判定
(1)实验要求
• 实验前提是消除了外扩散的影响,即
cAS cAG,TS TG
化学反应工程课件

天津大学化工学院 反应工程教学组
整理PPT课件
1
2.1 化学反应速率
定义:单位时间,单位体积反应物系中某一反应组分 的反应量。
AABB RR
rAV 1d dAn ,trBV 1d dBn ,trRV 1ddRnt
1. 对反应物dn/dt<0,对产物dn/dt>0
2. 按不同组分计算的反应速率数值上不等,因此
A
rB
B
rR R
r
r 1 dni 1 d iV dt V dt
恒容 rAV 1d(c dA V t)ddA ctc V 整A 理d Pd PT课V t件 过程
rA
dcA dt3
流动床反应器(定常态过程)
FA0
FA
M
Vr
FA
dVr
FA+dFA
连续反应器 反应速率
rA
dFkc A A c B B c R R kcA A cB B cR R
整理PPT课件
8
平衡时,r=0 kc AAc BBc RR kcA AcB BcR R
c c c AA BB RR ABR
k/k
cAAcBBcRR Kc
1
A AAB BBR RR
A B C
cA cB cR k/k
阿累尼乌斯方程 kAexp E/(R)T
指前因子
活化能
k又称为比反应速率,其意义是所有反应组分 的浓度均为1时的反应速率。它的因次与速率 方程的形式和反应速率及浓度的因次有关。
lnklnAERT
lnk1T
气相反应
kc整(R 理PPT)课 件T kp(R/T p )ky 12
●正逆反应活化能与反应热的关系
化学反应工程绪论课件

管式反应器其物料参数随位置而变。
3、半连续操作
半连续操作反应器的反应物系组成,
釜式:随时间而变
管式:随位置而变。 三)按反应器的传热条件分 1、等温反应器: 整个反应器维持等温操作; 2、绝热反应器:反应器与外界没有热量交换,全 部反应热使物系升温或降温; 3、非等温反应器:与外界有热量交换,但不等温。
1、间歇操作 反应所需的物料一次装入反应器内,反应一定
时间,达到要求的反应程度后便卸出全部物料, 清洗反应器,再装料、反应、卸料。
特点: (1)、反应器内各处的物料浓度、温度均一 (2)、反应器内的物料组成随时间而变
CA0
A
R
CR C
CA
时间 t
2、连续操作
连续地将原料输入反应器,反应产物也连续地从反 应器中流出。
三、化学反应工程的影响因素和研究方法
反应物的浓度与反应温度是影响化学反应速率的两大主 要因素,也是直接因素,对于一个化学反应来说,如果 没有其他因素,只需控制反应温度与反应浓度,这样反 应工程问题非常简单,而在工业生产的大反应器中,除 温度与浓度影响外,还受到物质的扩散和混合等影响。
工业规模的化学反应与实验室规模相比复杂很多,在实 验室规模上影响不大的质量和热量传递,在工业规模可 能起着主导作用。在工业反应器中既有化学反应过程又 有物理过程。物理过程与化学过程相互影响,相互渗透, 有可能导致工业反应器内的反应结果与实验室规模大相 径庭。
1. 实验室规模的试验 2. 小型试验 3. 大型冷膜试验:探索传递规律 4. 中间试验 5. 计算机试验
四、 化学反应及反应器分类
(一)化学反应分类
化学反应工程学科一般是按反应物系的相态来 分类。
天津大学工业化学基础第三章第一节概述PPT课件

28.11.2020
28.11.2020
28.11.2020
目标: 单位设备容积的反应器处理能力大 目的产物单一性大 安全,稳定
核心 ——复杂系统的工程放大
28.11.2020
1)改进和强化现有反应技术和设备,使之优 质、高产、低能耗;
(2)开发新的反应技术和设备; (3)利用实验室数据解决反应过程中放大问
题; (4)实现反应过程的最优化; (5)不断发展化学反应工程学的理论和方法 (6)化学反应器的正确选型与合理设计
28.11.2020
2、反应工程概念的提出
20世纪30年代,丹克莱尔(Damhohler)论述了扩散、流体流动 和传热对反应器产率的影响——奠定了基础 梯尔(Thiele)和史尔多维奇对扩散反应问题作了开拓性的工作 40年代末,霍根(Hougen)和华生(Waston)著作《化学过程原理》 法兰克-卡明聂斯基著作《化学动力学中的扩散与传热》问世
大规律,具有十分重要的意义
28.11.2020
在现代化大规模连续操作的化工厂中,化 学反应器约占生产设备总投资的15%-20 %,分离设备的投资占生产设备总投资的 大部分。但是反应器设计的优劣、反应结 果的好坏,常常是决定整个生产过程效益 的关键所在。在现代生产体系中,社会分 工较细,一个工厂的产品常常又是另一个 工厂的原料,所以构成化工产品成本的诸 因素中,原料所占的比重常常是决定性的。 如何在一个化学反应过程中,最大限度地 利用原料生产出最多的目标产品,就成为 至关重要的因素,而这一问题正是化学反 应工程所要研究解决的。
化学反应工程 及反应器
28.11.2020
第一节 概述
1 反应工程在化学工程学科中的地位 2 反应工程的范畴和任务 3 反应工程的研究方法 4 化学反应过程分类
反应工程_天大_李绍芬
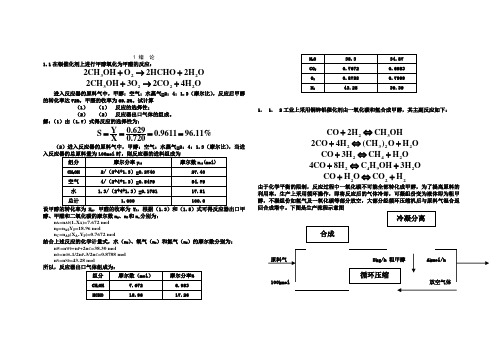
1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进A P 醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P=18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图Bkg/h 粗甲醇原料气和冷凝分离后的气体组成如下:(mol)组分原料气冷凝分离后的气体CO 26.82 15.49H268.25 69.78CO2 1.46 0.82CH40.55 3.62N2 2.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
天津大学反应工程-第6章-3

6.4.2 内扩散有效因子
(2)一级不可逆反应内扩散有效因子
薄片式催化剂 ✓内扩散无影响时,
cAC cAS
rA k pcAS
6.4.2 内扩散有效因子
✓内扩散有影响时
平均反应速率
rA
1 aL
L 0
k pcAadZ
因为
cA cosh(Z / L) cAS cosh()
rA
1 L
L
k pcAS
6.4.2 内扩散有效因子
✓球形催化剂内扩散-反应方程
d 2cA dr 2
2 r
dcA dr
kp De
cA
✓边界条件
r Rp , cA cAS r 0, dcA dr 0
6.4.2 内扩散有效因子
✓球形催化剂反应物浓度分布
其中,
cA
cAS
Rp sinh 3r Rp
r sinh3
Rp
• 努森扩散系数
DK A 9.7 103 ra T / M 8.22103cm2 / s
• 复合扩散系数
DA
1 1/(DK )A 1/
DAB
1 1000 / 8.22 1/ 0.0454
6.97 10-3 cm2 / s
• 催化剂中A的有效扩散系数
DeA DA p / m 9.29104 cm2 / s
6.4多孔催化剂中的扩散与反应
6.4.1 催化剂内反应组分浓度分布
催化剂颗粒内反应物
浓度分布示意图
CAG
CAS
CPC
A为反应物
P为产物
CPG
CPS
CAC
R+δ R
0
R R+δ
6.4.1 催化剂内反应组分浓度分布
天津大学反应工程课件第五章课件

1. 示踪剂加入方法; 2. 输出曲线的测定方法。
8
t→t+dt
系统出口检测 的示踪剂量
Qc t dt
示踪剂加 入总量
示踪剂 分布
m • E(t)dt
E(t) Qc(t) m
m Qc(t)dt
0
c(t) E(t)
c(t)dt
0
例5.1脉冲法停留时间分布的计算。
9
阶跃法
主流体Q
系统
0
2E( )d
1
0
N
e N N 1 N
N 1!
d
1
1 N
29
多釜串联模型的E()图
30
P151,例5.8(1) 多釜串联模型进行反应器计算 (2)若采用活塞流管式反应器,试预测 反应器出口A的转化率,并比较。
31
5.8 流动反应器中流体的混合 基本概念 1. 宏观混合:设备尺度上的混合。
降阶法
c(0)
c(0)
c0(t)
c(t)
0
t=0
t
输入曲线
0 t
响应曲线
C(0):含示踪剂的流体中示踪剂的浓度
13
降阶法
1 F (t) Qc(t)dt Qc ()dt
停留时间大于 t 的示踪剂量
t→t +dt
示踪剂输入量
1 F (t) c(t) c(0)
14
示踪剂选择基本原则
1. 示踪剂应易于和主流体溶或混为一体,除 了显著区别于主流体的某一性质以便于检 测外,两者应尽可能相同饿物理性质;
3. 短路 23
4. 径向速率不均匀
E( ) 0, 0.5
E( )
1
2 2
天津大学反应工程课件1 (1)

International Symposia on Chemical Reaction Engineering (ISCRE) Name ESCRE 1 ESCRE 2 ESCRE 3 ESCRE 4 ISCRE 1 ISCRE 2 ISCRE 3 ISCRE 4 ISCRE 5 ISCRE 6 ISCRE 7 ISCRE 8 ISCRE 9 ISCRE 10 ISCRE 11 ISCRE 12 ISCRE 13 ISCRE 14 ISCRE 15 ISCRE 16 ISCRE 17 Place Amsterdam Amsterdam Amsterdam Brussels Washington Amsterdam Evanston Heidelberg Houston Nice Boston Edinburgh Philadelphia Basel Toronto Torino Baltimore Brugge Newport Cracow Hong Kong Country Netherlands Netherlands Netherlands Belgium USA Netherlands USA Germany USA France USA Great Britain USA Switzerland Canada Italy USA Belgium USA Poland China Year 1957 1960 1964 1968 1970 1972 1974 1976 1978 1980 1982 1984 1986 1988 1990 1992 1994 1996 1998 2000 2002 Co-Sponsoring Organizations EFChE EFChE EFChE EFChE ACS/AIChE EFChE ACS/AIChE EFChE ACS/AIChE EFChE ACS/AIChE EFChE ACS/AIChE EFChE ACS/AIChE/CSCE EFChE ACS/AIChE EFChE ACS/AIChE EFChE Asia Pacific CRE
《反应工程整》课件

随着环保意识的提高,反应工程需要 更加注重环保,减少废气、废水和固 废的产生,降低能耗和资源消耗,实 现绿色生产。
新型反应器的研发与优化
01
新型反应器的研究
针对特定反应过程,研究开发新型反应器,以提 高反应效率和产物收率。
02
反应器的优化
通过对现有反应器的优化改造,提高其性能和效 率,降低能耗和物耗,实现可持续发展。
《反应工程整》ppt 课件
目录
• 反应工程概述 • 反应工程的基本原理 • 反应工程的应用领域 • 反应工程的前沿技术 • 反应工程的挑战与展望 • 案例分析
01
反应工程概述
定义与特点
定义
反应工程是研究化学反应和相关传递过程在工业 反应器中的集成和优化的一门科学。
特点
反应工程注重化学反应与传递过程的相互影响, 强调工业反应器的实际应用,涉及范围广泛,包 括化学、物理、数学等多个领域。
详细描述
对某环保处理技术的反应过程进行分析,研究反应机理、 反应动力学以及传递特性对处理效果的影响。通过分析反 应过程,发现反应条件和工艺参数的优化空间,为提高处 理效果提供指导。
总结词
工艺参数优化
总结词
处理效果评估
详细描述
对优化后的环保处理技术进行实际应用和效果评估。通过 对比优化前后的处理效果数据,发现优化方案显著提高了 处理效率和降低了能耗,证明了优化的效果。
反应工程的历史与发展
01 历史回顾
反应工程的发展可以追溯到20世纪初,随着化学 工业的快速发展和科学技术的不断进步,反应工 程逐渐成为一门独立的学科。
02 当前发展
当前,反应工程的研究领域不断扩大,涉及的新 技术和新方法也不断涌现,如计算流体力学、人 工智能等在反应工程中的应用越来越广泛。
天津大学反应工程课件1 (2)

(NO)2+O2→ 2NO2 )
NO3 + NO → 2NO2
r = kc NO2 cO2
虽然机理不同,导出的动力学方程相同,且与质量作用定律形式相同。 虽然机理不同,导出的动力学方程相同,且与质量作用定律形式相同。 说明动力学实验数据与速率方程相符合,仅是证明机理正确的必要条件, 说明动力学实验数据与速率方程相符合,仅是证明机理正确的必要条件, 而不是充分条件。机理判断需证明中间化合物的存在。 而不是充分条件。机理判断需证明中间化合物的存在。
第二章 反应动力学基础
本章内容
化学反应速率 反应速率方程 温度对反应速率的影响 复合反应 反应速率方程的变换与积分 多相催化与吸附 多相催化反应动力学 建立速率方程的步骤
2.1 化学反应速率
1. 定义: 定义:
单位时间、单位体积反应物系中某一反应组分的反应量。 单位时间、单位体积反应物系中某一反应组分的反应量。
→ → →
g(X A ) = ←← ← E A exp(− E/ RTop ) f ( X A )
Te为反应体系中 ← 实际组成对应的 RTe E 1 + ← → ℓn → 平衡温度, 平衡温度,为转 E− E E 化率XA的函数 的函数, 化率 的函数, 因此, 因此, Top是XA的 函数。 函数。 因此,存在一个最佳反应温度,此温度下的反应速率最大。 因此,存在一个最佳反应温度,此温度下的反应速率最大。
2.3 温度对反应速率的影响
k = A exp( − E / RT )
CA (mol/d m3)
-rA (mol/dm3 *s)
Reaction Order zero 1st 2nd
Rate Law -rA = k -rA = kCA -rA = kCA2
天津大学反应工程课件1 (4)

理想流动模型
1.基本概念 1.基本概念
活塞流模型(平推流): 活塞流模型(平推流): 基本假定: 基本假定: 径向流速分布均匀, (1) 径向流速分布均匀,所有粒子以相 同的速度从进口向出口运动。 同的速度从进口向出口运动。 (2) 轴向上无返混 符合上述假设的反应器,同一时刻进入 符合上述假设的反应器, 反应器的流体粒子必同一时刻离开反应 所有粒子在反应器内停留时间相同。 器,所有粒子在反应器内停留时间相同。 特点:径向上物料的所有参数都相同, 特点:径向上物料的所有参数都相同, 轴向上不断变化。 轴向上不断变化。
等温管式反应器的设计
单一反应
Fi 0
进入量 = 排出量 + 反应量 + 累积量
Fi
Fi = (dFi + Fi ) + (−R i )dVr + 0
dVr
dFi = Ri dVr
FA = FA0 (1 − X A )
FA0
dFA =RA dVr
dz
Fi + dFi
dX A = −R A ( X A ) dVr
X A0
M
c A0
Vr
Qr = ψQ0
X Af
Reactor
N
Vr = ?⋅ c A0
∫
X Af
?
dX A (−ℜ A )
Vr = (1 + ψ )Q0 c A0 ∫ψX Af
1+ψ
X Af
dX A (−ℜ A )
循环反应器
Qr 设循环物料与新鲜原料量之比为循环比: 设循环物料与新鲜原料量之比为循环比: ψ = Q0
X Af
FA0 = Q0 c A0
Q0 c A0
天津大学反应工程-第6章-5

6.7.1外扩散干扰下的动力学假象
• 外扩散控制条件下定态过程的基本方程
NA
kGam (cAG
cAS )
*A
k
a
c
A
a
G
✓在外扩散控制条件下,任何反应表观上都
变成了一级反应。
6.7.1外扩散干扰下的动力学假象
d ln( *A ) d ln( ka ) Ea d (1/ T ) d (1/ T ) R
NA
kGam (cAG
cAS )
*A
k
a
ca AG
✓在外扩散控制条件下,表观速率常数基本
不随温度变化,表观活化能几乎为0。
6.7.2 内扩散干扰下的动力学假象
(1)表观反应级数 a
• 用本征动力学表示的宏观反应速率(忽略 外扩散阻力)
*A k pcAG
• 用表观动力学表示的反应速率
*A
k
a
c
A
应,该反应为一级不可逆放热反应.颗粒直径为 0.3cm, 颗 粒 外 表 面 的 气 膜 传 热 系 数 为 161kJ/m2.K.h, 气膜传质系数 310m/h, 反应热 效 应 为 -162 kJ/mol , 气 相 主 体 A 的 浓 度 为 0.20mol/L, 实 验 测 得 A 的 表 观 反 应 速 率 为 1.67mol/min.L, 有 效 扩 散 系 数
a
6.7.2 内扩散干扰下的动力学假象
a
( 1)
2
d d
ln ln
内扩散影响严重时
1/
d ln / d ln 1
a
( 1)
2
(1)
(
1) /
化学反应工程完整ppt课件

2. 化学计量数ν,为速率控制步骤出现的次数。
设 2A+B ↔ R 的反应机理为
(1) A ↔ A* (2) A* + B ↔ X (3) A* + X ↔ R
.
10
例2.2 等温下进行醋酸(A)和丁醇(B)酯化反应
CH3COOH+C4H9OH ↔ CH3COOC4H9+H2O 醋酸和丁醇的初始浓度分别为0.2332和1.16kmol/m3,测 得不同时间下醋酸转化量,试求该反应的速率方程。
反应变 量:XA
● 恒
cA
nA V
nA V0
容
nAnA0nA0XA
过 程
cAnA0(1V0XA)cA0(1XA).
cB
nB V
nB nB0
nB
V0B A
nA0XA
cB
cB0
B A
cA0XA
28
kc A cB kc A 0(1X A )(cB 0BcA 0X A ) A
V 1d d n tA V 1 0d n A 0 (1 d t X A ) n V A 0 0d d X tA c A 0d d X tA
.
8
平衡时,r=0
kc AAc BBc RR kcA AcB BcR R
c c c AA BB RR ABR
k/k
cAAcBBcRR Kc
1
A AAB BBR RR
A B C
cA cB cR k/k
cAA/cBB/cRR/Kc1/
.
9
A AAB BBR RR1
k/ k KC1/
一定要注明反应速率是按哪一个组分计算的。
有机催化反应工程1,天津大学

办公地点:天南大联合大厦B-103、B-801 E-mail: xbma@
有机催化反应特点
1.
大多数反应是在催化剂存在下进行的。
环氧乙烷、丙烯腈、苯乙烯
2.
相同物料,不同催化剂,反应不同,产物 不同。
Al2O C2 H 5OH ⎯⎯ 3 → CH 2 = CH 2 + H 2O(T > 380 o C ) ⎯ Al2O3 − ZnO 2C2 H 5OH ⎯⎯ ⎯⎯→ CH 2 = CH − CH = CH 2 + 2 H 2O + H 2
β 12 ⋅ ⋅ ⋅ β 1n ⎤ ⎡ ΔN1 ⎤ ⎥ ⎢ ΔN ⎥ β 22 ⋅ ⋅ ⋅ β 2n ⎥ ⎢ 2 ⎥
⋅⋅⋅ ⋅⋅⋅
βl2 ⋅ ⋅ ⋅
⎡0⎤ ⎢0⎥ =⎢ ⎥ ⋅ ⋅ ⋅ ⎥ ⎢ ⋅ ⋅ ⋅ ⎥ ⎢⋅ ⋅ ⋅⎥ ⎥⎢ ⎥ ⎢ ⎥ β ln ⎦ ⎣ΔNn ⎦ ⎣ 0 ⎦
独立反应数r = n − k
课程内容(一)
有机催化(催化剂工程) 流化床 气液反应 气固相非催化反应 化学反应速率的数据收集与分析
课程内容(二)
有机催化(催化剂工程)
催化特征、吸附与催化、中毒失活及动力学
流化床
流化床特征、泡相乳相行为、流化床传热及相 关数学模型
课程内容(三)
气液反应
气液相传质、反应宏观动力学、气液反应特征 参数
绿色化学的手段
非传统底物/原料 非传统试剂 非传统溶剂 非传统产物/目标分子 在线分析化学 非传统催化剂
绿色化学的原理
1.
防止废物的产生优于在其生成后再进行处理或 清理。 合成方法应被设计成能把反应过程中所用的所 有材料尽可能多地转化到最终产物中。 只要可行,合成方法应被设计成能使用和产生 对人类健康无毒性或很低毒性的物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(rA ) : (rB ) : rR A : B : R
→ rA rB rR 常数 r
A B R
r 1 dni
iV dt
r 1 d (cAV ) dcA cA dV
V dt
dt V dt
r 1 d
V dt
恒容
精制rA课件
dcA dt
4
2.1 化学反应速率
3. 对于流动反应器(定常态过程):
k为反应速率常数,其意义是所有反应组分的浓度均
为1时的反应速率。 Where:
E = activation energy (cal/mol)
R = gas constant (cal/mol*K)
T = temperature (K)
A = frequency factor
(units of A, and k, depend on overall reaction
NO+NO (NO)2 (NO)2+O2→ 2NO2
NO + O2
NO3
NO3 + NO → 2NO2
r kcNO2 cO2
虽然机理不同,导出的动力学方程相同,且与质量作用定律形式相同。
说明动力学实验数据与速率方程相符合,仅是证明机理正确的必要条件,
而不是充分条件。机理判断需证明中间化合物的存在。
第二章 反应动力学基础
精制课件
1
本章内容
化学反应速率
反应速率方程
温度对反应速率的影响
复合反应
反应速率方程的变换与积分
多相催化与吸附
多相催化反应动力学
建立速率方程的步骤 精制课件
2
2.1 化学反应速率
1. 定义:
单位时间、单位体积反应物系中某一反应组分的反应量。
对反应: A A BB RR
order)
活化能E反映了精制r课对件T的敏感性
10
2.3 温度对反应速率的影响
k Aexp(E / RT)
CA
(mol/d m3)
-rA
Reaction Order
(mol/dm3 *s)
zero
1st
2nd
精制课件
Rate Law
k
-rA = k
(mol/dm3 *s)
-rA = kCA
-rA = kCA2
s-1
(dm3/mol *s)
11
2.3 温度对反应速率的影响
T , k A T 0, k 0
nk nA E ( 1 ) RT
kc (RT) k精p 制课(件RT / p) ky
12
2.3 温度对反应速率的影响
讨论:在下列情况下lnk与1/T呈非线性关系 (1)所假设的速率方程不合适; (2)传质(内外扩散)的影响与温度有关; (3)A与温度有关。
有:
rA
1 V
dnA dt
, rB
1 V
dnB dt
, rR
1 V
dnR dt
2. 注意:
⑴ 对反应物dn/dt<0,对产物dn/dt>0
⑵ 按不同组分计算的反应速率数值上不等,因
此一定要注明反应速率是精按制哪课件一个组分计算的
3
2.1 化学反应速率
以不同组分计的r间关系:
→ 由 dnA : dnB : dnR A : B : R
r f (c,T )
C为浓度向量
A A BB RR
若为基元反应,可根据质 量作用定律直接写出:
若为非基元反应,可仿基 元反应写出:
rA
k
c A A
c B B
精制课件
r kcAA cBB
6
2.2 反应速率方程
强调:对非基元反应,须根据反应机理推导动力学方程
举例1: A → P + D 的反应机理
精制课件
17
若第一步为速率控制步骤,则ν=2,即ν表达速率控 制步骤出现的次数。
精制课件
15
2.3 温度对反应速率的影响
引申关系2-正、逆反应活化能间的关系
nk nA E ( 1 ) RT
dnk E dT RT 2
k/
k
K
1/ C
1
n k n k nK p
dn k E dT RT 2
及
dn k E
A A* P
c
* A
c
p
cA
K1
A* → D
c*A K1cA cP
rA
rA
k
2
c
A
rA k2 K1cA / cP kcA / cP
可见,非基元反应的速率方精程制课不件能根据质量作用定律写出。 7
2.2 反应速率方程
举例2:一氧化氮氧化反应
2NO+O2→ 2NO2
反应机理(1):
反应机理(2):
因此:关系式 的温度范围,不能外推。
精制课件
只适用于一定
13
2.3 温度对反应速率的影响
引申关系1-反应级数与化学平衡常数间的关系
A A BB RR
反应达平衡时,r=0,有:
k/ k
K
1/ C
A A B B R R 1
A
B
R
k
cA A
cB B
cR R
k
c c c A B R ABR
c c c K A / B / R /
1/
ABR
c
c R R R
c c A A B B
A
B
k
k
c c c A B R ABR
Kc
精制课件
14
2.3 温度对反应速率的影响
引申关系1-反应级数与化学平衡常数间的关系
举例: ν的意义 设 2A+B ↔ R 的反应机理为: (1) A ↔ A* (每生成1mol R,此步需出现两次) (2) A* + B ↔ X (3) A* + X ↔ R
精制课件
8
2.2 反应速率方程
目前,绝大多数化学反应的机理还不清楚,因
此主要是根据实验结果来确定速率方程。方程的 一种形式是幂函数型。
对于可逆反应
N
r
k
cA
A
c
B
B
...
k
ci i
i 1
N
N
r k
ci i
k
c i i
i 1
i 1
精制课件
9
2.3 温度对反应速率的影响
k Aexp(E / RT)
ቤተ መጻሕፍቲ ባይዱ
FA0 M Vr
取反应器内任意一个小微元 M,其体积为dVr,可认为 此体积内物系参数均匀。
FA
FA-dFA
dVr
则:
rA
dFA dVr
对多相反应:
r'A
dFA da
rA aV r'A br''A
精制课件
r''
A
dFA dW
5
2.2 反应速率方程
在溶剂、催化剂和压力等因素一定的情况下,描述反应速 率与温度和浓度的定量关系,即速率方程或动力学方程:
dT RT 2
d吸dnTk热 d反dnT应k ,1 ddnHTK pr>0,E>E
dn k dn k E E
dT
dT RT 2
放热反d应nKp, HHr r<0,E<E
dT RT 2
1
E E H r
精制课件
16
2.3 温度对反应速率的影响
引申关系3-反应速率随温度的变化规律
问题?
根据阿式,温度升高,正反应速率常数增大,那么 逆反应速率常数增大否? 反应速率增大否?
