常见指示剂
酸碱中和指示剂的选择

酸碱中和指示剂的选择简介酸碱中和指示剂是在化学实验或工业生产中用于检测溶液pH值的重要工具。
它们可以通过改变颜色来指示溶液的酸性或碱性程度。
选择合适的酸碱中和指示剂对于准确测定溶液的酸碱性非常重要。
常见的酸碱中和指示剂以下是一些常见的酸碱中和指示剂:1. 酚酞:酚酞是一种常用的指示剂,它在酸性环境下呈现红色,而在碱性环境下呈现无色。
2. 苯红:苯红在酸性环境下为黄色,而在碱性环境下为红色。
3. 甲基橙:甲基橙在酸性环境下为红色,而在碱性环境下为黄色。
如何选择适当的酸碱中和指示剂在选择酸碱中和指示剂时,需要考虑以下几个因素:1. pH范围:不同的酸碱中和指示剂适用于不同的pH范围。
确保选择的指示剂能够准确地反映溶液的酸碱性。
2. 颜色变化: 考虑指示剂在酸性和碱性条件下的颜色变化情况。
选择对于观察者来说易于辨识的颜色变化。
3. 可见性:选择具有良好可见性的指示剂,使其变化能够清晰地观察到。
注意事项在使用酸碱中和指示剂时,还要注意以下几点:1. 精确称量:确保准确称量指示剂的数量,以获得准确的结果。
2. 实验条件:考虑实验条件对指示剂的影响,例如温度变化、溶剂选择等。
3. 参考指南:在选择酸碱中和指示剂时,可以参考专业化学指南或文献。
结论选择合适的酸碱中和指示剂对于准确测定溶液的酸碱性至关重要。
在选择指示剂时,需要考虑其适用的pH范围、颜色变化和可见性等因素。
此外,在使用指示剂时还要注意实验条件和精确称量的问题。
以上是关于酸碱中和指示剂选择的简要介绍,希望对您有所帮助。
化学酸碱指示剂

化学酸碱指示剂化学酸碱指示剂是一种在化学实验和日常生活中常用的化学试剂,用于确定溶液的酸碱性质。
它能够通过颜色变化的方式表现出溶液的酸碱性,便于进行判断和定量分析。
本文将介绍酸碱指示剂的种类、工作原理和应用领域。
一、酸碱指示剂的种类酸碱指示剂可以根据不同的化学性质和变色范围分为多种类型,常见的有苯酚红、甲基橙、溴酚蓝等。
下面将分别对几种常用的酸碱指示剂进行介绍。
1. 苯酚红苯酚红是一种常见的酸碱指示剂,它呈现出酸性溶液为红色,碱性溶液为黄色。
它的变色范围在pH 0-6之间,适用于酸碱度较弱的溶液。
2. 甲基橙甲基橙是另一种常用的酸碱指示剂,它在酸性溶液中呈现橙色,碱性溶液中呈现黄色。
甲基橙的变色范围在pH 3.1-4.4之间,适用于酸碱度较中等的溶液。
3. 溴酚蓝溴酚蓝是一种广泛使用的酸碱指示剂,它在酸性溶液中为黄色,碱性溶液中为蓝色。
溴酚蓝的变色范围在pH 3.0-4.6之间,适用于酸碱度较强的溶液。
二、酸碱指示剂的工作原理酸碱指示剂的颜色变化是由于当分子处于不同的电离状态时,吸收光的波长发生改变。
在酸性环境中,酸碱指示剂的分子结构中存在酸性基团,从而使得分子发生质子化反应,吸收特定波长的光线;在碱性环境中,则发生去质子化反应,吸收不同波长的光线。
这种电离状态的变化导致了颜色的改变。
三、酸碱指示剂的应用领域酸碱指示剂广泛应用于化学实验和日常生活中。
在实验室中,它被用于酸碱滴定、酸碱中和反应和pH值测定等。
例如,酸碱指示剂常被用于酸碱滴定实验中,通过观察滴定过程中溶液颜色的变化,确定滴定终点。
在日常生活中,酸碱指示剂被广泛应用于家庭实验、水质检测、肥料分析等。
例如,通过使用酸碱指示剂,我们可以判断自来水的PH值,以确定其安全性。
总结:化学酸碱指示剂是一种通过颜色变化来表现溶液酸碱性质的化学试剂。
它可以帮助实验室工作者和普通人快速判断溶液的酸碱度,并应用于化学实验和日常生活中的各种场合。
不同种类的酸碱指示剂具有不同的变色范围和适用性,因此在选择使用时需要根据具体情况进行判断。
高考化学常见物质酸碱指示剂

高考化学常见物质酸碱指示剂酸碱指示剂是一种在化学试验中用来检测溶液酸碱性质的化学物质。
酸碱指示剂能够通过改变颜色来指示溶液的酸碱性质,因此在化学实验、分析和工业生产中都起着重要的作用。
一、酸碱指示剂的基本原理酸碱指示剂的基本原理是通过它们与氢离子(H+)或氢氧根离子(OH-)的结合来改变颜色。
在酸性溶液中,指示剂会接受氢离子而颜色发生改变;而在碱性溶液中,指示剂会捐出氢离子而产生颜色变化。
所以,酸碱指示剂的选择要根据实验所需的酸碱范围来确定。
常见的酸碱指示剂有酚酞、甲基橙、溴腙绿、甲基红、龙胆紫等。
下面我们详细介绍一下这些常见的酸碱指示剂的特点和应用。
二、常见的酸碱指示剂及其特点1. 酚酞(phenolphthalein)酚酞是一种常用的酸碱指示剂,它在无色酸性环境中呈现无色,而在碱性环境中呈现粉红色。
这是因为在酸性环境中,酚酞的分子不发生颜色变化;而在碱性环境中,酚酞会捐出氢离子形成带负电荷的离子,这种离子呈现出粉红色。
酚酞的使用范围较窄,只适用于中性到碱性的溶液。
在实验室中,酚酞常被用于酸碱滴定、中和反应等实验。
2. 甲基橙(methyl orange)甲基橙是一种常用的酸碱指示剂,它在酸性环境中呈现红色,而在碱性环境中呈现黄色。
这是因为甲基橙的分子在酸性环境中能够与氢离子结合并改变颜色,形成带正电荷的离子,这种离子呈现出红色;而在碱性环境中,甲基橙会捐出氢离子形成带负电荷的离子,这种离子呈现出黄色。
甲基橙的酸碱变色范围较广,可适用于酸度相对较强的酸性溶液和碱性溶液的检测。
在实验室中,甲基橙常被用于酸碱滴定实验和酸性物质的测试。
3. 溴腙绿(bromothymol blue)溴腙绿是一种常用的酸碱指示剂,它在酸性环境中呈现黄色,而在碱性环境中呈现蓝色。
这是因为溴腙绿的分子在酸性环境中能够与氢离子结合并改变颜色,形成带正电荷的离子,这种离子呈现出黄色;而在碱性环境中,溴腙绿会捐出氢离子形成带负电荷的离子,这种离子呈现出蓝色。
常见指示剂
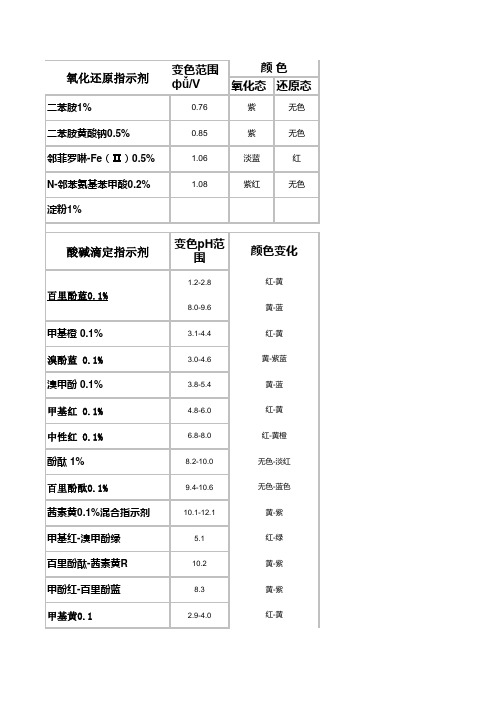
二苯胺1%
变色范围
颜色
фǚ/V
氧化态 还原态0.76紫 Nhomakorabea无色
二苯胺黄酸钠0.5%
0.85
紫
无色
邻菲罗啉-Fe(Ⅱ)0.5%
1.06
淡蓝
红
N-邻苯氨基苯甲酸0.2%
1.08
紫红
无色
淀粉1%
酸碱滴定指示剂
百里酚蓝0.1%
甲基橙 0.1% 溴酚蓝 0.1% 溴甲酚 0.1% 甲基红 0.1% 中性红 0.1% 酚酞 1% 百里酚酞0.1% 茜素黄0.1%混合指示剂 甲基红-溴甲酚绿 百里酚酞-茜素黄R 甲酚红-百里酚蓝 甲基黄0.1
苯酚红0.1
6.8-8.4
黄-红
配位滴定指示剂
铬黑T(EBT) 二甲酚橙(XO) K-B指示剂 钙指示剂 吡啶偶氮萘酚(PAN) 磺基水杨酸 酸性铬蓝K PAR 钙镁试剂
离解平衡及颜色变化
H2In-(紫红)HIn(蓝)In(橙) H3In-(黄)H2In(红)
H2In (红) HIn-(蓝) In2 (酒红) H2In-(酒红) HIn2(蓝) In-(酒红) H2In+(黄绿) HIn(黄) In-(淡红) H2In (红紫) HIn-(无色) In-(黄)
0.1g苯酚红溶于100mL60%乙醇中
与NaCl 1:100 0.5%乙醇或水溶液 0.2酸性铬蓝K和0.2萘酚绿B溶于水 5%乙醇溶液 1%乙醇溶液 10%水溶液 0.1%乙醇溶液 0.05%或0.2%水溶液 0.05%水溶液[2]
配制方法
变色pH范 围
1.2-2.8 8.0-9.6 3.1-4.4 3.0-4.6 3.8-5.4 4.8-6.0 6.8-8.0 8.2-10.0 9.4-10.6 10.1-12.1
酸碱指示剂的选择与鉴别

酸碱指示剂的选择与鉴别酸碱指示剂是一种可以改变颜色的化学物质,在酸碱中起到指示作用。
在实验室和工业生产中,酸碱指示剂被广泛应用于酸碱滴定、溶液酸碱性检测等方面。
本文将介绍酸碱指示剂的选择与鉴别。
一、酸碱指示剂的选择酸碱指示剂的选择主要取决于所要测定溶液的酸碱性范围。
以下是几种常见的酸碱指示剂及其适用范围:1. 酚酞:酸性溶液呈现红色,中性和碱性溶液无色。
适用于酸性溶液的滴定以及pH值低于6的测定。
2. 溴酚蓝:酸性溶液呈黄色,中性和弱碱性溶液呈绿色,强碱性溶液呈蓝色。
适用于中性和弱碱性溶液的滴定以及pH值在3.0-4.6范围内的测定。
3. 甲基橙:酸性溶液呈红色,中性溶液呈橙色,碱性溶液呈黄色。
适用于酸性溶液的滴定以及pH值在3.1-4.4范围内的测定。
4. 酚酞:酸性溶液呈红色,中性和碱性溶液无色。
适用于酸性溶液的滴定以及pH值低于6的测定。
5. 金黄色红:酸性溶液呈红色,中性和碱性溶液呈黄色。
适用于酸性溶液的滴定以及pH值低于5.0的测定。
通过选择合适的酸碱指示剂,我们可以准确、快速地判断溶液的酸碱性,从而开展后续的实验操作和分析。
二、酸碱指示剂的鉴别为了确保测定结果的准确性,我们需要对酸碱指示剂进行鉴别。
下面介绍几种常见的酸碱指示剂的鉴别方法:1. 鉴别酚酞和酚酞钠:将少量酚酞溶于无水乙醇中,滴加氢氧化钠溶液。
若溶液出现红色,则为酚酞;若溶液无色,则为酚酞钠。
2. 鉴别甲基橙和溴酚蓝:将少量甲基橙溶于无水乙醇中,滴加氯化钠溶液。
若溶液出现红色,则为甲基橙;若溶液无色,则为溴酚蓝。
3. 鉴别甲基橙和金黄色红:将少量甲基橙溶于无水乙醇中,滴加氯化钙溶液。
若溶液出现橙色,则为甲基橙;若溶液呈红色,则为金黄色红。
以上鉴别方法可以帮助我们辨认不同的酸碱指示剂,确保实验结果的准确性。
总结:酸碱指示剂在化学实验和工业生产中起到重要的指示作用。
选择合适的酸碱指示剂可以帮助我们准确判断溶液的酸碱性,进而进行后续的实验与分析。
酸碱指示剂变色表

酸碱指示剂变色表
酸碱指示剂是一种能够在酸碱溶液中发生颜色变化的化学物质。
它们的变色机理主要是基于分子结构和酸碱性质的变化。
不同的指示剂在不同的pH值下会呈现出不同的颜色,因此它们被广泛应用于化学实验、水质检测、生物学等领域。
以下是几种常见的酸碱指示剂及其变色范围:
1. 酚酞指示剂:pH 范围为 8.0-10.0,由无色变为红色。
2. 甲基橙指示剂:pH 范围为
3.1-
4.4,由红色变为黄色。
3. 酚酞红指示剂:pH 范围为 6.8-8.4,由黄色变为红色。
4. 甲基红指示剂:pH 范围为 4.2-6.3,由红色变为黄色。
5. 甲基紫指示剂:pH 范围为 0.0-1.6,由黄色变为紫色。
6. 酚酸指示剂:pH 范围为
7.2-9.8,由无色变为蓝色。
7. 酸性橙指示剂:pH 范围为 3.5-4.5,由橙色变为黄色。
8. 碘化钾淀粉指示剂:pH 范围为 5.0-7.0,由蓝色变为无色。
以上指示剂变色表仅供参考,实际使用时应根据具体的实验要求进行选择。
同时,在使用指示剂时也应注意其对溶液的影响,尽量减少指示剂的使用量,以免产生误差。
- 1 -。
高中化学常见的指示剂

高中化学常见的指示剂
1.
铁(Ⅱ)硫酸盐指示剂:铁(Ⅱ)硫酸盐指示剂(FeSO4指示剂),又称硫酸铁指示剂,它是一种紫红色溶液,在酸性溶液中呈紫红色,在碱性溶液中呈蓝色。
2.
氢氧化钠指示剂:氢氧化钠指示剂(NaOH指示剂),又称碱度指示剂,它是一种紫色溶液,在酸性溶液中呈紫色,在碱性溶液中呈橙色。
3.
氯化钾指示剂:氯化钾指示剂(KCl指示剂),又称盐度指示剂,它是一种紫红色溶液,在酸性溶液中呈紫红色,在碱性溶液中呈蓝色。
4.
氢氧化铜指示剂:氢氧化铜指示剂(Cu(OH)2指示剂),又称碱度指示剂,它是一种绿色溶液,在酸性溶液中呈绿色,在碱性溶液中呈红色。
指示剂的作用

指示剂的作用指示剂是一种用于检测化学反应的物质,它通过改变颜色或产生可见的物理变化来指示是否发生了化学反应。
指示剂在实验室和工业生产中起到非常重要的作用,以下是其主要功能和应用领域的简要描述。
1. 酸碱指示剂:酸碱指示剂可以根据颜色的变化来指示溶液的酸碱性质。
常用的酸碱指示剂包括酚酞、苏丹红、溴酚蓝等。
在实验室中,酸碱指示剂广泛应用于酸碱中和反应的判断和调整,例如在滴定实验中,通过观察指示剂颜色变化的终点确定反应的终点。
2. 氧化还原指示剂:氧化还原指示剂可以根据电子的转移来指示氧化还原反应的进行。
常用的氧化还原指示剂有甲基橙、溴甲酚绿等。
在氧化还原反应中,可以通过观察指示剂的颜色变化来判断反应的进行程度或终点,例如在滴定法中,通过添加氧化还原指示剂来确定滴定终点。
3. 沉淀指示剂:沉淀指示剂可以通过形成特定的沉淀来指示化学反应的进行。
常见的沉淀指示剂有硫化氢、氯气等。
在实验室和工业生产中,沉淀指示剂通常用于检测金属离子的存在和测定,例如通过加入沉淀指示剂可以判断水中是否存在铅离子。
4. 非均相反应指示剂:非均相反应指示剂可以通过产生明显的气体或液滴来指示非均相反应的进行。
常用的非均相反应指示剂有碱式碳酸铜等。
在实验室和工业生产中,非均相反应指示剂广泛应用于检测气体的存在和测定,例如通过观察产生的气泡或液滴来判断反应是否进行。
指示剂在化学实验中的应用是非常重要的,它可以帮助实验者判断反应的进行程度和终点,提高实验的准确性和可靠性。
同时,指示剂的应用还可以加速实验的进行,减少实验所需的复杂步骤和时间。
指示剂的选择应根据实验的要求和反应特点来确定,使用时要严格按照操作手册的要求进行,并注意化学品的安全使用。
指示剂的正确应用将有助于提高实验的效率和研究的可信度,推动科学研究的发展。
常见指示剂变色范围及配制方法

黄~蓝
参看第一变色范围
酚酞
8.2~10.0
无色~紫红
(1)0.1g指示剂溶于100mL60%乙醇中(2)1g酚酞溶于100mL90%乙醇中
百里酚酞
9.4~10.6
无色~蓝
0.1g指示剂溶于100mL90%乙醇中
茜素红S
(第二变色范围)
10.0~12.0
紫~淡黄
参看第一变色范围
茜素黄R
(第二变色范围)
8.3
黄
紫
pH8.2玫瑰色pH8.4紫色变色点微红色
10.1~12.1
黄~淡紫
1g·L-1水溶液
孔雀绿
(第二变色范围)
11.5~13.2
蓝绿~无色
参看第一变色范围
达旦黄
12.0~13.0
黄~红
1g·L-1水溶液
混合酸碱指示剂
一份1g·L-1甲基黄乙醇溶液,一份
1g·L-1次甲基蓝乙醇溶液
3.25
蓝紫
绿
pH3.2蓝紫色pH3.4绿色
四份2g·L-1溴甲酚绿乙醇溶液,一份
2g·L-1甲基红乙醇溶液
5.1
酒红
绿
一份2g·L-1甲基红乙醇溶液,一份
1g·L-1次甲基蓝乙醇溶液
5.4
红紫
绿
pH5.2红紫pH5.4暗蓝pH5.6绿
一份1g·L-1溴甲酚绿钠盐水溶液,一份1g·L-1氯酚红钠盐水溶液
6.1
黄绿
蓝份1g·L-1溴甲酚紫钠盐水溶液,一份1g·L-1溴百里酚蓝钠盐水溶液
1.9~3.3
红~黄
1g·L-1水溶液
二甲基黄
2.9~4.0
红~黄
0.1g或0.01g指示剂溶于100mL90%乙醇中
颜色溶液的酸碱指示剂

颜色溶液的酸碱指示剂酸碱指示剂是一种广泛应用于化学实验及其他领域的重要化学试剂,可根据溶液的酸碱性质发生颜色变化,帮助我们快速判断溶液的酸碱度。
本文将围绕颜色溶液的酸碱指示剂展开讨论,介绍其原理、种类以及应用领域。
一、原理酸碱指示剂的变色原理是基于指示剂分子在酸性和碱性介质中电离程度不同的特性。
在酸性溶液中,指示剂分子发生酸性离子化,颜色变化为红色或橙色;而在碱性溶液中,指示剂分子发生碱性离子化,颜色变化为蓝色或绿色。
通过观察溶液颜色的变化,我们可以快速判断其酸碱性质。
二、常见酸碱指示剂种类1. 酚酞:酚酞是一种常见的酸碱指示剂,其在酸性溶液中呈现无色,而在碱性溶液中变为红色。
这种指示剂适用于中性到弱碱性的溶液。
2. 酚酞红:与酚酞相似,酚酞红在酸性溶液中呈现无色,而在碱性溶液中变为红色。
然而,酚酞红的酸碱范围更广,适用于中性到强碱性的溶液。
3. 酚酞黄:酚酞黄在酸性溶液中呈现黄色,在碱性溶液中变为红色。
它可用于中性到弱碱性的溶液。
4. 甲基橙:甲基橙在酸性溶液中呈现红色,而在碱性溶液中变为黄色。
它主要用于中性到强酸性的溶液。
5. 酚蓝:酚蓝在酸性溶液中呈现红色,而在碱性溶液中变为蓝色。
它适用于中性到强酸性的溶液。
三、酸碱指示剂的应用领域1. 化学实验:酸碱指示剂广泛应用于化学实验中,帮助确定反应体系的酸碱性质以及终点的判断。
例如,在酸碱滴定实验中,我们可以使用酸碱指示剂观察颜色变化,准确测定滴定过程中的终点。
2. 污水处理:污水处理是酸碱指示剂的另一个重要应用领域。
通过添加适量的酸碱指示剂,可以帮助监测污水处理过程中的酸碱度,确保达到合适的处理效果。
3. 食品工业:在食品加工中,酸碱指示剂可以用于检测食品中的酸碱成分,确保食品质量的稳定和卫生安全。
4. 医药领域:在医药研究和生产中,酸碱指示剂可以用于监测药物的酸碱性质,以及酸碱度对药效的影响,为药物选择和调整提供有力的依据。
结语总之,颜色溶液的酸碱指示剂在化学实验及其他领域中发挥着重要的作用。
压力蒸汽五类化学指示物

压力蒸汽五类化学指示物压力蒸汽是一种常见的物质,用于多种工业和日常生活中的应用。
在化学领域,压力蒸汽也有五类化学指示物。
以下将介绍这五类化学指示物的特点和应用。
第一类化学指示物是酚酞。
酚酞是一种常见的指示剂,其在酸性溶液中呈现红色,而在碱性溶液中呈现无色。
这种特性使得酚酞在酸碱滴定中起到了重要的作用。
例如,在酸碱中和反应过程中,当酚酞由红色变为无色时,可以判断反应到达了等当点,从而准确地确定溶液的酸碱度。
第二类化学指示物是甲基橙。
甲基橙是一种鲜艳的橙色染料,其在酸性溶液中呈现红色,而在碱性溶液中呈现黄色。
因此,甲基橙可以用作酸碱指示剂,特别是在氧化还原反应和滴定中。
通过观察甲基橙的颜色变化,可以确定溶液中的氧化还原状态或酸碱度。
第三类化学指示物是溴甲蓝。
溴甲蓝是一种深蓝色的指示剂,在酸性溶液中呈现黄色,而在碱性溶液中呈现蓝色。
由于其鲜明的颜色变化,溴甲蓝常用于酸碱滴定和化学分析中。
它可以帮助确定溶液的酸碱度,并检测溶液中的其他化学物质。
第四类化学指示物是甲基红。
甲基红是一种常见的指示剂,其在酸性溶液中呈现红色,而在碱性溶液中呈现黄色。
甲基红可以用于酸碱滴定和化学反应的监测。
通过观察甲基红的颜色变化,可以判断溶液的酸碱度以及反应的进行程度。
第五类化学指示物是酚酞指示剂。
酚酞指示剂是一种常用的酸碱指示剂,其在酸性溶液中呈现无色,而在碱性溶液中呈现红色。
酚酞指示剂常用于酸碱滴定和化学分析中。
通过观察酚酞指示剂的颜色变化,可以准确地确定溶液的酸碱度,并帮助分析化学家进行实验。
以上介绍了压力蒸汽五类化学指示物的特点和应用。
这些化学指示物在化学实验和分析中起着重要的作用,帮助我们准确地判断溶液的酸碱度和化学反应的进行程度。
在实际应用中,我们需要根据具体实验的要求选择合适的指示剂,并严格遵守实验操作规范,以确保实验结果的准确性和可靠性。
酸碱指示剂的颜色变化

酸碱指示剂的颜色变化酸碱指示剂是一种可以通过颜色变化来区分溶液酸碱性质的物质。
它在化学实验、环境监测、医疗和食品饮料行业等领域有着广泛的应用。
本文将介绍几种常见的酸碱指示剂及其颜色变化特性。
一、酚酞指示剂酚酞指示剂是一种常用的酸碱指示剂,常见的颜色变化特性为:在酸性条件下呈红色,中性条件下呈无色,碱性条件下呈深紫色。
酚酞指示剂在酸碱中的颜色变化明显,操作简便,因此被广泛应用于酸碱滴定等实验中。
二、溴酚蓝指示剂溴酚蓝指示剂是一种常用的酸碱指示剂,常见的颜色变化特性为:在酸性条件下呈黄色,中性条件下呈绿色,碱性条件下呈蓝色。
溴酚蓝指示剂的颜色变化较为明显,常用于酸碱滴定和溶液酸碱性质的初步检测。
三、甲基橙指示剂甲基橙指示剂是一种常用的酸碱指示剂,常见的颜色变化特性为:在酸性条件下呈红色,中性条件下呈橙色,碱性条件下呈黄色。
甲基橙指示剂的颜色变化比较明显,适用于酸碱滴定以及检测物质酸碱性质的变化。
四、酸碱指示剂的应用酸碱指示剂在生活与实验中有着广泛的应用。
在日常生活中,我们可以通过酸碱指示剂来检测饮用水的PH值,了解水的酸碱性质,保证人体健康。
在医疗行业,酸碱指示剂也被用于一些生化检测中,帮助医生判断体内物质的酸碱性质。
在化学实验中,酸碱指示剂是进行酸碱滴定等实验的重要工具,能够准确测定溶液的酸碱度。
总结:酸碱指示剂通过颜色的变化来表达溶液的酸碱性质,可以方便地判断溶液的性质,并在科研、工业生产和生活中发挥重要作用。
在选择酸碱指示剂时,我们需要根据实际需求选取合适的指示剂,并严格按照指示剂的使用方法操作,以保证实验的准确性和结果的可靠性。
希望本文对于你了解酸碱指示剂及其颜色变化特性有所帮助。
酸碱指示剂的种类与用途

酸碱指示剂的种类与用途酸碱指示剂是一种化学试剂,通过改变颜色的方式来指示物质的酸碱性质。
它们广泛应用于实验室、工业生产和日常生活中,具有多样的种类和用途。
本文将介绍酸碱指示剂的种类、原理及其常见的用途。
一、中性指示剂中性指示剂是指在酸性和碱性溶液中都呈现中性颜色的指示剂。
常见的中性指示剂有酚酞、酚酞酸钠和尼龙红等。
酚酞在酸性溶液中呈现无色,而在碱性溶液中呈现粉红色。
酚酞酸钠和尼龙红也具有类似的性质。
这些中性指示剂的用途包括测定酸碱中和点、盐酸浓度的测定等。
二、酸性指示剂酸性指示剂是指在酸性溶液中呈现酸性颜色的指示剂。
常见的酸性指示剂有甲基橙、溴酚蓝和甲基红等。
甲基橙在酸性溶液中呈现红色,而在碱性溶液中呈现橙色。
溴酚蓝和甲基红也具有类似的性质。
酸性指示剂可以用于测定溶液的酸碱性质、观察化学反应的进程等。
三、碱性指示剂碱性指示剂是指在碱性溶液中呈现碱性颜色的指示剂。
常见的碱性指示剂有苏丹红、兰氏红和酚酞等。
苏丹红在碱性溶液中呈现红色,而在酸性溶液中呈现桔黄色。
兰氏红和酚酞也具有类似的性质。
碱性指示剂在测定碱溶液的浓度、酸碱中和反应等方面有重要的应用。
四、内吸质指示剂内吸质指示剂是一种能够进入晶格中的化学物质,在溶液中发生颜色变化。
常见的内吸质指示剂有溴十六烷、溴十八烷和溴二十烷等。
这些指示剂可以通过与酸碱反应生成带电的大分子,从而改变颜色。
内吸质指示剂可用于测定溶液中的酸碱浓度、观察化学反应的进程等。
五、其他指示剂除了上述常见的指示剂外,还有一些其他的特殊指示剂。
比如酮酸指示剂在酸性溶液中呈现黄色,而在碱性溶液中呈现绿色。
这些特殊指示剂在特定的实验或工业生产中有其独特的应用。
总结起来,酸碱指示剂的种类繁多,每种指示剂都具有其独特的颜色变化特性。
通过选择合适的指示剂,我们可以方便地判断物质是否为酸性或碱性,并在实验和生产中进行准确的测定和调控。
酸碱指示剂的应用范围广泛,涉及到化学实验、医药、环境保护等多个领域。
常见指示剂变色范围

酸碱指示剂序号(No.) 名称(Name)pH变色范围 (pH transition interval)酸色 (Acid color)碱色(Base color) pKa 浓度(Concentration)1 甲基紫(第一次变色) 0.13~0.5 黄绿0。
80.1%水溶液2 甲酚红(第一次变色)0.2~1.8 红黄-0.04%乙醇(50%)溶液ﻫ3甲基紫(第二次变色) 1.0~1。
5绿蓝—0。
1%水溶液4百里酚蓝(第一次变色) 1.2~2.8 红黄 1.65 0.1%乙醇(20%)溶液5 茜素黄R (第一次变色) 1.9~3.3红黄- 0。
1%水溶液6 甲基紫(第三次变色)2.0~3.0 蓝紫—0。
1%水溶液7 甲基黄2.9~4.0红黄 3.3 0.1%乙醇(90%)溶液8 溴酚蓝3.0~4.6 黄蓝3.85 0.1%乙醇(20%)溶液ﻫ9甲基橙3。
1~4。
4红黄 3.40 0。
1%水溶液10溴甲酚绿3。
8~5.4黄蓝4。
68 0.1%乙醇(20%)溶液ﻫ11 甲基红4。
4~6。
2 红黄4。
95 0。
1%乙醇(60%)溶液ﻫ12溴百里酚蓝 6.0~7.6 黄蓝7.1 0.1%乙醇(20%)13 中性红 6.8~8.0 红黄7.4 0.1%乙醇(60%)溶液14 酚红6.8~8。
0 黄红7.9 0。
1%乙醇(20%)溶液15 甲酚红(第二次变色)7.2~8。
8 黄红8.2 0。
04%乙醇(50%)溶16百里酚蓝(第二次变色)8.0~9。
6 黄蓝8.9 0.1%乙醇(20%)液ﻫ溶液17酚酞8。
2~10.0 无色紫红9.40。
1%乙醇(60%)溶液18百里酚酞9.4~10.6无色蓝10.0 0.1%乙醇(90%)溶19茜素黄R (第二次变色) 10.1~12.1 黄紫11.160.1%水溶液液ﻫ20靛胭脂红11.6~14.0 蓝黄12.225%乙醇(50%)溶液混合酸碱指示剂序号(No.) 指示剂名称(Indicator name) 浓度 (Concentration) 组成 (Co nstitution) 变色点pH(Transition point pH)酸色 (Acid color)碱色(Base color)1 甲基黄0。
酸碱指示剂的种类与原理

酸碱指示剂的种类与原理酸碱指示剂是一种广泛应用在化学实验和各个领域中的化学物质。
它们具有颜色变化的特性,能够在酸碱溶液中显示出明显的颜色反应。
酸碱指示剂的种类繁多,每种指示剂都有其特定的原理和应用场景。
本文将介绍几种常见的酸碱指示剂,探讨它们的原理和使用方法。
一、酚酞酚酞是一种常见的酸碱指示剂,它呈红色。
在酸性溶液中呈现无色或淡黄色,而在碱性溶液中则呈现红色。
这是因为酚酞在酸性环境下可发生酸碱指示反应,酚酞分子中的酚羟基会与酸中的氢离子结合,产生不稳定的负离子形式,导致颜色变化。
二、溴蓝溴蓝是一种常用的酸碱指示剂,它呈红色和暗蓝色之间的颜色变化。
在酸性溶液中呈现红色,而在碱性溶液中则呈现暗蓝色。
这种颜色变化是由于溴蓝分子结构中的溴根离子与酸中的氢离子发生反应所致。
三、甲基橙甲基橙是一种常见的酸碱指示剂,它呈橙红色和黄色之间的颜色变化。
在酸性溶液中呈现橙红色,而在碱性溶液中则呈现黄色。
甲基橙的颜色变化是由于其分子结构中的阴离子形式与酸中的氢离子发生反应。
四、菊池蓝菊池蓝是一种广泛应用的酸碱指示剂,它呈蓝色和无色之间的颜色变化。
在酸性溶液中呈现蓝色,而在碱性溶液中则呈现无色。
菊池蓝的颜色变化是由于其分子结构中的阳离子与酸中的氢离子发生反应所造成的。
五、苯酚酞苯酚酞是一种常用的酸碱指示剂,它呈酸性溶液下的无色和碱性溶液下的红色。
苯酚酞通过颜色变化来指示酸碱溶液的pH值。
在酸性溶液中,酸性羟基离子会与苯酚酞发生反应,使其呈现无色;而在碱性溶液中,苯酚酞分子中的羟基离子会被氢离子取代,导致颜色变为红色。
六、溴甲酚绿溴甲酚绿是一种常见的酸碱指示剂,它呈酸性溶液下的黄色和碱性溶液下的蓝色。
溴甲酚绿的颜色变化也是由于其分子结构中的酸性羟基离子与碱中的氢离子发生反应所致。
总结:酸碱指示剂是一种在实验室和其他领域广泛使用的化学物质。
根据不同的化学原理和反应机制,我们可以选择合适的酸碱指示剂来探测酸碱溶液的pH值。
本文介绍了几种常见的酸碱指示剂及其颜色变化的原理,包括酚酞、溴蓝、甲基橙、菊池蓝、苯酚酞和溴甲酚绿。
初中化学知识点归纳常见酸碱指示剂的性质和使用方法

初中化学知识点归纳常见酸碱指示剂的性质和使用方法酸碱指示剂是化学实验室中常用的一种试剂,用于检测溶液的酸碱性质。
它们能够通过改变颜色来显示溶液的酸碱性,使我们能够更直观地判断溶液的酸碱性。
下面,我们将归纳一些常见的酸碱指示剂的性质和使用方法。
1. 甲基橙甲基橙是一种酸碱指示剂,其在酸性溶液中呈红色,在中性溶液中呈橙色,在碱性溶液中呈黄色。
因此,可以用甲基橙来判断溶液的酸碱性质。
使用时,只需滴加几滴甲基橙溶液到待测溶液中,根据溶液的颜色变化来判断其酸碱性。
2. 甲基紫甲基紫是一种酸碱指示剂,其在酸性溶液中呈红色,在碱性溶液中呈蓝色。
使用时,滴加几滴甲基紫溶液到待测溶液中,根据溶液的颜色变化来判断其酸碱性。
3. 酚酞酚酞是一种酸碱指示剂,其在酸性溶液中呈无色,在中性溶液中呈浅红色,在碱性溶液中呈深红色。
使用时,滴加几滴酚酞溶液到待测溶液中,根据溶液的颜色变化来判断其酸碱性。
4. 甲基橙酸溶液甲基橙酸溶液是一种常用的酸碱指示剂,其在酸性溶液中呈红色,在碱性溶液中呈黄色。
与甲基橙相比,甲基橙酸溶液更加灵敏,能够更好地判断溶液的酸碱性。
使用时,滴加几滴甲基橙酸溶液到待测溶液中,根据溶液的颜色变化来判断其酸碱性。
5. 酚酞溶液酚酞溶液是一种酸碱指示剂,其在酸性溶液中呈无色,在中性溶液中呈浅红色,在碱性溶液中呈深红色。
与酚酞相比,酚酞溶液对溶液的酸碱变化更加敏感。
使用时,滴加几滴酚酞溶液到待测溶液中,根据溶液的颜色变化来判断其酸碱性。
酸碱指示剂的使用方法基本相同,只需将指示剂溶液滴加到待测溶液中,观察颜色的变化即可。
需要注意的是,每次滴加的量应该尽量保持一致,以确保结果的准确性。
值得一提的是,酸碱指示剂的选择应该根据不同溶液的酸碱性质来确定。
对于酸性溶液,适合使用甲基橙、甲基紫等指示剂;对于碱性溶液,适合使用酚酞、甲基橙酸溶液等指示剂。
总结起来,常见酸碱指示剂包括甲基橙、甲基紫、酚酞、甲基橙酸溶液和酚酞溶液。
常见指示剂的变色范围

序号(No.) 名称(Name) pH 变色范围(pH transition interval) 酸色(Acid color) 碱色(Base color) pKa 浓度(Concentration)1 2 甲基紫(第一次变色)甲酚红(第一次变色)甲基紫(第二次变色)百里酚蓝(第一次变色)手.廿西素黄甲基紫甲基黄溴酚蓝0.13〜0.5黄绿0.2〜1.8红黄1.0〜1.5绿蓝1.2〜2.8红黄1.9〜3.3红黄2.0〜3.0蓝紫-R (第一次变色)(第三次变色)2.9〜4.0 红黄3.3 0.1%乙醇(90%)溶液3.0〜4.6黄蓝 3.85 0.1%乙醇(20%)溶液0.8 0.1%水溶液-0.04%乙醇(50%)溶液0.1%水溶液1.65 0.1%乙醇(20%)溶液-0.1%水溶液0.1%水溶液9甲基橙 3.1〜4.4红黄 3.40 0.1%水溶液10溴甲酚绿 3.8〜5.4黄蓝4.68 0.1%乙醇(20%)溶液11甲基红 4.4〜6.2 红黄 4.95 0.1%乙醇( 60%)溶液12溴百里酚蓝 6.0〜7.6 黄蓝 7.1 0.1%乙醇( 20%)13中性红 6.8〜8.0 红黄 7.4 0.1%乙醇( 60%)溶液14酚红 6.8〜8.0 黄红 7.9 0.1%乙醇( 20%)溶液15甲酚红(第二次变色)7.2〜8.8 黄红 8.2 0.04%乙醇( 50%)溶液16百里酚蓝(第二次变色)8.0〜9.6 黄蓝 8.9 0.1%乙醇( 20%)溶液17酚酞 8.2〜10.0 无色紫红 9.4 0.1%乙醇( 60%)溶液18百里酚酞 9.4〜10.6 无色蓝 10.0 0.1%乙醇( 90%)溶液19茜素黄 R (第二次变色)10.1〜12.1 黄紫 11.16 0.1%水溶液20靛胭脂红 11.6〜14.0 蓝黄 12.2 25%乙醇( 50%)溶液混合酸碱指示剂序号 (No.) 指示剂名称 (Indicator name) 浓度 (Concentration) 组成(Constitution) 变色点 pH(Transition point pH) 酸色 (Acid color) 碱色 (Base color)1甲基黄 0.1%乙醇溶液 1:1 3.28 蓝紫绿亚甲基蓝 0.1%乙醇溶液2甲基橙 0.1%水溶液 1:1 4.3 紫绿苯胺蓝 0.1%水溶液3溴甲酚绿 0.1%乙醇溶液 3:1 5.1 酒红绿甲基红 0.2%乙醇溶液4溴甲酚绿钠盐 0.1%水溶液 1:1 6.1 黄绿蓝紫氯酚红钠盐 0.1%水溶液5中性红 0.1%乙醇溶液 1:1 7.0 蓝紫绿亚甲基蓝 0.1%乙醇溶液6中性红 0.1%乙醇溶液 1:1 7.2 玫瑰绿溴百里酚蓝 0.1%乙醇溶液7甲酚红钠盐 0.1%水溶液 1:3 8.3 黄紫百里酚蓝钠盐 0.1%水溶液8酚酞 0.1%乙醇溶液 1:2 8.9 绿紫甲基绿 0.1%乙醇溶液9酚酞 0.1%乙醇溶液 1:1 9.9 无色紫百里酚酞 0.1%乙醇溶液10百里酚酞 0.1%乙醇溶液 2:1 10.2 黄绿茜素黄 0.1%乙醇溶液注:混合酸碱指示剂要保存在深色瓶中。
常见指示剂

名称
离解平衡及颜色变化
配制方法
铬黑T(EBT)
H2In-(紫红)HIn(蓝)In(橙)
与NaCl 1:100
二甲酚橙(XO)
H3In-(黄)H2In(红)
0.5%乙醇或水溶液
K-B指示剂
H2In(红) HIn-(蓝) In2 (酒红)
0.2酸性铬蓝K和0.2萘酚绿B溶于水
钙指示剂
H2In-(酒红) HIn2(蓝) In-(酒红)
甲基红-溴甲酚绿
5.1
红-绿
3份0.1%溴甲酚绿乙醇溶液与1份0.1%甲基红乙醇溶液混合
二、氧化还原指示剂
名 称
变色pH范围
颜 色
配 制 方 法
氧化态
还原态
二苯胺1%
0.76
紫
无色
将1g二苯胺在搅拌下溶于100mL浓硫酸和100mL浓磷酸,储于棕色瓶中
二苯胺黄酸钠0.5%
0.85
紫
无色
将0.5g二苯胺黄酸钠溶于100mL水中,必要时过滤
5%乙醇溶液
吡啶偶氮萘酚(PAN)
H2In+(黄绿) HIn(黄) In-(淡红)
1%乙醇溶液
磺基水杨酸
H2In(红紫) HIn-(无色) In-(黄)
10%水溶液
酸性铬蓝K
红-蓝
0.1%乙醇溶液
PAR
红-黄
0.05%或0.2%水溶液
钙镁试剂
H2In-(红) HIn-(蓝) In-(红橙)
0.05%水溶液[2]
邻菲罗啉-Fe(Ⅱ)0.5%
1.06
淡蓝
红
将0.5gFeSO4·7H2O溶于100mL水中,加两滴硫酸,加0.5g邻菲罗啉
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
变色pH范 围
1.2-2.8 8.0-9.6 3.1-4.4 3.0-4.6 3.8-5.4 4.8-6.0 6.8-8.0 8.2-10.0 9.4-10.6 10.1-12.1
5.1 10.2 8.3 2.9-4.0
颜色变化
红-黄 黄-蓝 红-黄 黄-紫蓝 黄-蓝 红-黄 红-黄橙 无色-淡红 无色-蓝色 黄-紫 红-绿 黄-紫 黄-紫 红-黄
0.1g苯酚红溶于100mL60%乙醇中
与NaCl 1:100 0.5%乙醇或水溶液 0.2酸性铬蓝K和0.2萘酚绿B溶于水 5%乙醇溶液 1%乙醇溶液 10%水溶液 0.1%乙醇溶液 0.05%或0.2%水溶液 0.05%水溶液[2]
配制方法
红-蓝 红-黄 H2In-(红) HIn-(蓝) In-(红橙)
配制方法
将 1g二苯胺在搅拌下溶于100mL浓硫酸和100mL浓磷酸,储于棕色瓶中 将0.5g二苯胺黄酸钠溶于100mL水中,必要时过滤 将0.5g FeSO4·7H2O溶于100mL水中,加两滴硫酸,加0.5g邻菲罗啉 将0.2g邻苯氨基苯甲酸加热溶解在100mL 0.2% Na2CO3溶液中,必要时过滤 将淀粉加少许水条成浆状,在搅拌下加入100mL沸水中,微沸2min,放置,取上层溶液使 用。
配制方法
0.1g指示剂与4.3mL 0.05mol/LNaOH溶液一起研匀,加水稀释成100mL
将0.1g甲基橙溶于100mL热水 0.1g溴酚蓝与3mL 0.05mol/L NaOH 溶液一起研磨均匀,加水稀释成100mL 0.01g指示剂与21mL0.05mol/L NaOH溶液一起研匀,加水稀释成100mL 将0.1g甲基红溶于60mL乙醇中,加水至100mL 将中性红溶于乙醇中,加水至100mL 将1g酚酞溶于90mL乙醇中,加水至100mL 将0.1g指示剂溶于90mL乙醇中加水至100mL 将0.1g茜素黄溶于100mL水中 3份0.1%溴甲酚绿乙醇溶液与1份0.1%甲基红乙醇溶液混合 将0.1g茜素黄和0.2g百里酚酞溶于100ml乙醇中 1份0.1%甲酚红钠盐水溶液与3份0.1%百里酚蓝钠盐水溶液。 0.1g指示剂溶于100mL90%乙醇中
苯酚红0.1
6.8-8.4
黄-红
配位滴定指示剂
铬黑T(EBT) 二甲酚橙(XO) K-B指示剂 钙指示剂 吡啶偶氮萘酚(PAN) 磺基水杨酸 酸性铬蓝K PAR 钙镁试剂
离解平衡及颜色变化
H2In-(紫红)HIn(蓝)In(橙) H3In-(黄)H2In(红)
H2In (红) HIn-(蓝) In2 (酒红) H2In-(酒红) HIn2(蓝) In-(酒红) H2In+(黄绿) HIn(黄) 还原指示剂
二苯胺1%
变色范围
颜色
фǚ/V
氧化态 还原态
0.76
紫
无色
二苯胺黄酸钠0.5%
0.85
紫
无色
邻菲罗啉-Fe(Ⅱ)0.5%
1.06
淡蓝
红
N-邻苯氨基苯甲酸0.2%
1.08
紫红
无色
淀粉1%
酸碱滴定指示剂
百里酚蓝0.1%
甲基橙 0.1% 溴酚蓝 0.1% 溴甲酚 0.1% 甲基红 0.1% 中性红 0.1% 酚酞 1% 百里酚酞0.1% 茜素黄0.1%混合指示剂 甲基红-溴甲酚绿 百里酚酞-茜素黄R 甲酚红-百里酚蓝 甲基黄0.1
