表达质粒的构建方法
质粒构建 (2)

质粒构建1. 引言质粒是一种重要的实验工具,广泛应用于基因工程、遗传学和生物学研究中。
质粒构建是指将感兴趣的DNA片段插入到质粒中的过程,用于进一步研究DNA序列的功能和相互作用。
本文将介绍质粒构建的基本原理和步骤。
2. 质粒构建的基本原理质粒构建需要以下几个基本要素:•质粒:质粒是一种环状的DNA分子,可存在于细菌、酵母等生物体内。
•DNA片段:DNA片段是质粒构建中要插入质粒的感兴趣DNA序列,可以通过PCR扩增、基因合成等方法得到。
•限制酶:限制酶是一种特殊的酶,能够识别和切割DNA的特定序列。
•连接酶:连接酶是一种酶,能够将DNA片段与质粒连接起来。
基于以上要素,质粒构建的基本原理如下:1.将质粒和目标DNA片段分别进行限制性内切酶切割。
限制酶切割会产生粘性末端或平滑末端的DNA片段。
2.使用连接酶将目标DNA片段与质粒连接起来。
连接酶能够将两条DNA片段的末端连接起来,形成一个完整的质粒。
3.利用转化或转染等方法将质粒导入到宿主细胞中。
质粒在宿主细胞中进行复制和表达。
3. 质粒构建的步骤质粒构建的具体步骤如下:3.1 质粒提取从质粒宿主细胞中提取质粒是质粒构建的第一步。
常用的质粒提取方法包括碱裂解法、盐溶解法、商业提取试剂盒等。
质粒提取的目的是获取纯度较高的质粒样本,便于后续实验操作。
3.2 目标DNA片段的获取目标DNA片段可以通过PCR扩增、基因合成等方法得到。
PCR扩增需要设计引物,引物的序列与目标DNA片段的两端相互衔接。
基因合成则需要将目标DNA序列依照设定的序列进行化学合成。
3.3 DNA片段与质粒的连接将目标DNA片段与质粒进行连接,需要使用连接酶。
连接酶则需要根据DNA片段和质粒的不同情况选择合适的连接酶和反应条件。
连接酶反应通常包括连接酶、DNA片段和质粒的混合体系,以及一定的温度和时间。
3.4 转化或转染将连接好的质粒导入到宿主细胞中,以使质粒在宿主细胞中进行复制和表达。
表达质粒的构建

表达质粒的构建一、表达载体的构建表达载体是指具有宿主细胞基因表达所需调控元件,能使克隆的基因在宿主细胞内转录与翻译的载体。
也就是说,克隆载体只是携带外源基因,使其在宿主细胞内扩增;表达载体不仅使外源基因扩增,还使其表达。
外源基因在受体细胞内表达与否及表达水平受到许多因素(调控元件)的制约。
1、正确的阅读框架外源基因编码区在插入表达质粒中原核基因编码区时,阅读框架应保持一致。
外源基因只有在它与载体DNA的起始密码相吻合时,才算处于正确的阅读框架中,从而表达融合蛋白,使外源蛋白与宿主蛋白相融合。
2、目的基因有效转录的启动子启动子是DNA链上一段能与DNA聚合酶结合并能起始mRNA合成的序列,它是基因表达不可缺少的重要调控序列。
原核启动子是有两段彼此分开且又高度保守的核苷酸序列组成的,分别称为-35区和-10区。
-35区序列为TTGACA,-10区的序列为TATAAT。
两序列之间的最佳间距为17bp。
可与RNA聚合酶结合,并指导该酶在正确的转录部位开始合成mRNA。
由于细菌RNA聚合酶不能识别真核基因的启动子,因此原核表达载体必须用原核启动子带动真核基因在原核生物中转录。
原核表达载体启动子的转录常常是可以控制的,一般情况下不转录,而受诱导剂诱导时就能转录,带动外源基因的高效表达。
(1) 大肠杆菌的lac启动子是乳糖操纵子的启动子,受lac I编码的阻遏蛋白调节控制(2) 大肠杆菌的trp启动子是色氨酸操纵子启动子,受trpR编码的阻遏蛋白调节控制(3) tac启动子,由lac启动子的-10区和trp启动子的-35区融合而成,汇合了lac和trp两者优点,是一个很强的启动子,受lac I编码的阻遏蛋白调节控制(4) lacUV5启动子是经紫外线诱变改造的lac启动子,该启动子失去了CAP和cAMP的证调控,只要有乳糖或IPTG存在时就能够启动转录(5) 噬菌体的λP启动子是λ噬菌体左、右向启动子,是一个温度敏感的阻遏蛋、LR白受温度调控的很强的启动子(6) T7噬菌体启动子,比大肠杆菌启动子强得多,并且十分专一,只被T7RNA 聚合酶所识别。
yfp蛋白表达质粒

yfp蛋白表达质粒
YFP蛋白表达质粒是一种常用的实验工具,用于研究蛋白的表达和功能。
YFP蛋白是一种荧光蛋白,可以发出黄绿色的荧光,因此在生物学研究中被广泛应用。
YFP蛋白表达质粒的构建是一项重要的实验步骤。
首先,需要选择适当的质粒载体,常用的有pUC19、pET28a等。
质粒载体是一种环状的DNA分子,可以自主复制,并携带外源基因的表达序列。
接下来,将YFP基因的编码序列克隆到质粒载体中。
克隆的方法有多种,常用的是PCR扩增和限制性内切酶切割。
通过PCR扩增,可以得到所需的YFP基因片段,然后使用限制性内切酶将其与质粒载体进行连接。
连接后,将质粒转化到大肠杆菌等宿主细胞中,使其复制和表达。
YFP蛋白表达质粒的构建完成后,可以通过蛋白表达实验来验证其功能。
常用的方法是将质粒转化到宿主细胞中,诱导蛋白的表达,并利用荧光显微镜观察YFP蛋白的荧光信号。
荧光信号的强度和分布可以反映YFP蛋白的表达水平和定位情况。
此外,还可以通过Western blot等方法检测YFP蛋白的表达量。
YFP蛋白表达质粒在生物学研究中具有广泛的应用。
例如,可以将YFP蛋白与其他蛋白融合,用于研究蛋白的亚细胞定位、相互作用和功能调控等方面。
此外,YFP蛋白还可以用于追踪细胞的运动和分裂过程,研究细胞的生物学行为。
YFP蛋白表达质粒是一种重要的实验工具,可以用于研究蛋白的表达和功能。
通过构建YFP蛋白表达质粒,可以实现对YFP蛋白的定位、追踪和功能研究,为生物学研究提供了有力的支持。
重组表达质粒的构建——原核表达载体选择
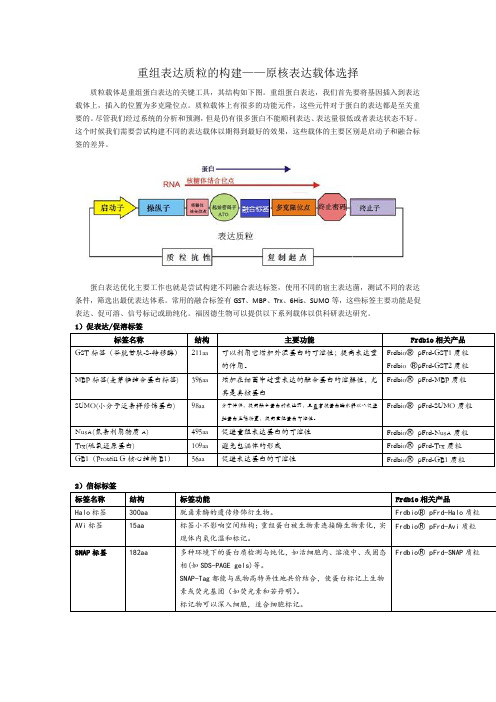
重组表达质粒的构建——原核表达载体选择质粒载体是重组蛋白表达的关键工具,其结构如下图。
重组蛋白表达,我们首先要将基因插入到表达载体上,插入的位置为多克隆位点。
质粒载体上有很多的功能元件,这些元件对于蛋白的表达都是至关重要的。
尽管我们经过系统的分析和预测,但是仍有很多蛋白不能顺利表达、表达量很低或者表达状态不好。
这个时候我们需要尝试构建不同的表达载体以期得到最好的效果,这些载体的主要区别是启动子和融合标签的差异。
蛋白表达优化主要工作也就是尝试构建不同融合表达标签,使用不同的宿主表达菌,测试不同的表达条件,筛选出最优表达体系。
常用的融合标签有GST、MBP、Trx、6His、SUMO等,这些标签主要功能是促表达、促可溶、信号标记或助纯化。
福因德生物可以提供以下系列载体以供科研表达研究。
1)促表达/促溶标签2)信标标签3)纯化标签我们选择表达载体的时候不但要考虑蛋白怎么表达成功,更要考虑蛋白怎么纯化出来,纯化的问题主要是考虑纯化标签和酶切位点的选择,下表我们列举了常见的纯化标签和酶切位点。
4)酶切位点以上为原核表达常用的标签和酶切位点,其性质也都作了简要的介绍,各专业网站或专业书籍已对此做详尽解释,科研工作者可根据具体实验设计方案,组合设计以上标签和酶切位点的使用。
特别值得注意的是,选用和设计蛋白酶切位点的时候首要考虑的是序列内部有没有蛋白酶位点,同时要考虑酶切的效率和蛋白酶试剂成本。
一般商业化载体,在标签蛋白与载体多克隆位点之间都设计有酶切位点。
标签可设计在N-端也可在C-端,设计在N-端的优势是,可通过标签高效翻译起始位点带动插入蛋白的表达,可溶性标签的高效表达更可促进蛋白的可溶性表达;同时,大部分的蛋白内切酶的切割位点在C-端,所以标签设计在N-端可将标签切割完全。
在设计标签序列与酶切位点的时候还要考虑N-端稳定性原则,也就是所谓宿主细胞的N-端规则(N-end rule),这个要避免;同时,还应该检查是否引入了可与别的蛋白相互作用的序列或者蛋白酶切位点。
4重组表达质粒的构建——基因的克隆

重组表达质粒的构建——基因的克隆长片段基因在大肠杆菌中表达往往比较困难,作为抗原使用的重组蛋白可以考虑选择抗原性好的区段原核表达,前文已作阐述。
对整个蛋白结构研究,必须全长表达该蛋白,此时最好考虑真核表达系统,特别是含有跨膜区的蛋白。
选定要克隆的区段,需先富集纯化之后才方便插入载体,常用的富集方法是PCR或者质粒繁殖复制。
为了防止在PCR扩增过程中引入碱基错误或者碱基缺失,PCR扩增基因时候必须使用高保真Taq酶。
为了满足科研工作者不同实验需求,福因德生物将高保真Taq酶优化为即用型Mix,使用时直接加引物和模板就可以扩增。
除此之外,福因德生物还开发出LA Taq、S-Taq Mix以及SYBR荧光定量PCR Mix(需要更高品质的可选用SYBR PCR SuperMix)。
原核重组表达常用克隆技术主要有以下几种:1)酶切连接这个是目前应用最为广泛的的克隆技术,主要优点是技术稳定;缺点是周期长、步骤多,任何一个环节产生的误差都会影响克隆构建的成败。
如用酶切连接的策略进行载体批量构建,不同载体和不同外源基因尽可能选用相同的上下游酶切位点,比如,批量克隆基因到某个载体上,可一次性大量双酶切将载体线性化后保存备用,每次构建载体只需酶切外源基因片段,载体可直接取用,不必每次都酶切,省时省力(此处需特别留意的是基因内部不能有与上述所用冲突的酶切位点)。
2)TA克隆TA克隆必须使用商业的线性化载体,线性载体3´末端有一个T碱基,与PCR扩增产物3´末端A正好匹配。
这种克隆策略最大的优点是载体使用方便,扩增产物可以直接克隆到载体上,不需要酶切位点等冗余序列;缺点是:必须依赖商业化载体,载体选择受限;扩增外源片段所使用的Taq酶也必须是可以在3´末端加A,这种Taq酶的保真度不高;外源片段插入之后还必须鉴定方向。
目前,这种构建表达载体的策略已经逐渐被淘汰。
3)TOPO克隆TOPO克隆载体利用DNA拓扑异构酶I识别序列中的CCCTT松弛双螺旋并重新连接,同时兼具限制性内切酶和连接酶的功能。
抗体表达质粒

抗体表达质粒引言:抗体是一种广泛应用于生物学和医学研究领域的重要工具。
为了大规模生产抗体,科学家们开发了一种方法,即利用表达质粒来实现抗体的高效表达。
本文将介绍抗体表达质粒的概念、构建方法以及其在研究和应用中的重要性。
一、什么是抗体表达质粒?抗体表达质粒是一种重组DNA分子,它含有人工合成的基因序列,用于表达特定抗体的重链和轻链。
质粒一般由多个功能区组成,包括启动子、信使RNA结合位点、选择性标记、多克隆位点等。
通过将抗体基因序列插入到质粒的多克隆位点,可以实现抗体的高效表达。
二、抗体表达质粒的构建方法1. 选择合适的质粒载体:根据抗体的表达需求,选择合适的质粒载体。
常用的载体包括pET、pUC、pCDNA等。
2. 插入抗体基因序列:将抗体基因的重链和轻链序列克隆到质粒的多克隆位点中。
可以通过PCR扩增和限制性内切酶切割等方法来实现。
3. 转化宿主细胞:将构建好的质粒转化至宿主细胞中,如大肠杆菌等。
通过培养和筛选,筛选出含有目标抗体基因的细胞。
三、抗体表达质粒的重要性1. 高效表达:通过抗体表达质粒,可以实现大规模高效地表达抗体,满足研究和应用的需求。
2. 快速筛选:利用质粒载体中的选择性标记,可以快速筛选出含有目标抗体基因的细胞,提高研究效率。
3. 多克隆位点:质粒中的多克隆位点可以容纳多个抗体基因序列,实现多个抗体的同时表达,方便研究人员进行多个抗体的比较和筛选。
4. 稳定性和可扩展性:抗体表达质粒可以稳定地持续表达抗体,且可以进行扩增和传代,满足不同规模和需求的抗体生产。
结论:抗体表达质粒是一种重要的工具,可以实现抗体的高效表达和大规模生产。
通过合理构建抗体表达质粒,研究人员可以快速筛选和比较不同抗体,为生物学和医学研究提供有力支持。
抗体表达质粒的应用将进一步推动抗体相关研究的发展和应用的广泛推广。
质粒构建的原理及方法

质粒构建的原理及方法质粒构建的原理及方法是指通过研究DNA片段的特征,以及其在生物学实验中的复制、表达、合成和移植的原理及方法,来构建质粒。
质粒是一类由DNA片段组成的可重复使用的基因工程载体,用于转移和表达外源基因,广泛应用于基因工程和生物技术研究中。
质粒构建的原理主要是根据DNA片段的周期性结构形成的,即质粒的结构是由DNA片段组成的,而不是其他的物质。
在质粒构建中,首先要明确需要构建的质粒的目的和功能,然后根据此目的和功能,从DNA片段库中选择合适的片段,将其组装成质粒,以达到预期的效果。
质粒构建的方法有几种,常用的有PCR扩增法、等位子构筑法、同源克隆法和限制性内切酶构建法等。
1 PCR扩增法:PCR扩增法是一种用于构建质粒的有效方法,其原理是利用特定酶,如Taq DNA聚合酶,对DNA 片段进行反复扩增,从而获得大量的DNA片段。
该方法的优点是快速、灵敏,可以构建任意大小的质粒,但也有一定的缺点,例如扩增的精确性和准确性较差,可能会引入噪声,影响质粒的质量。
2 等位子构建法:等位子构建法是指在特定的位置插入预先准备好的DNA片段,即将DNA片段配对到等位子上,从而构建质粒。
该方法的优点是可以以高精度构建质粒,精度可达99.9%,但是缺点是时间较长,构建大型质粒时耗时较长。
3 同源克隆法:同源克隆法是指将DNA片段插入到一种特定的质粒中,从而形成新的质粒。
该方法的优点是可以用于构建任意大小的质粒,但缺点是构建的质粒的精确性较差,可能会引入噪声,影响质粒的质量。
4 限制性内切酶构建法:限制性内切酶构建法是指将DNA片段插入到限制性内切酶识别序列中,从而形成质粒。
该方法的优点是可以快速构建质粒,而且可以构建任意大小的质粒,但缺点是质粒的精确性较差,可能会引入噪声,影响质粒的质量。
以上就是质粒构建的原理及方法,质粒构建的方法也不断发展壮大,未来还有可能推出更多的质粒构建方法,以满足更多的应用需求。
真核表达质粒的构建与表达

真核表达质粒的构建与表达1. 真核表达质粒的构建真核表达质粒是一种含有真核基因的质粒,它可以用于在真核细胞中表达外源基因。
真核表达质粒的构建主要包括以下步骤:(1)选择表达载体:首先,需要选择一种合适的表达载体,例如质粒、质杆菌、噬菌体等,以及一种合适的表达系统,例如T7系统、T3系统、SP6系统等。
(2)构建表达质粒:其次,通过合成或克隆技术将外源基因插入到表达载体中,构建表达质粒。
(3)筛选表达质粒:最后,通过PCR、Southern blotting等技术筛选出含有外源基因的表达质粒。
2. 真核表达质粒的表达真核表达质粒的表达是一种细胞内的转录和翻译过程,它可以将外源基因插入真核细胞中,从而实现基因的表达。
表达质粒的表达通常由以下几个步骤组成:首先,将外源基因与表达质粒的启动子序列结合,以形成表达质粒;其次,将表达质粒转染到真核细胞中,以便在细胞中表达外源基因;最后,真核细胞将表达质粒中的基因转录成mRNA,然后翻译成蛋白质,从而实现基因的表达。
此外,表达质粒的表达过程还可以通过调节启动子序列的表达水平来调控基因的表达。
真核表达质粒的稳定性是指质粒在不同的环境条件下,表达量不受外界环境变化的影响,能够保持恒定的表达量。
稳定性的提高可以改善表达质粒的性能,并且能够更好地满足实验要求。
为了提高真核表达质粒的稳定性,一般采用以下几种方法:一是优化质粒的结构特征。
质粒结构特征包括质粒的大小、碱基组成、表达载体的类型等。
优化质粒的结构特征可以有效提高质粒的稳定性,从而改善质粒的性能。
二是改变质粒的表达系统。
质粒的表达系统包括表达调控因子、载体、表达调控序列等。
改变表达系统可以改变质粒的表达量,从而提高质粒的稳定性。
三是改变质粒的表达条件。
质粒的表达条件包括培养基、温度、pH值、溶液浓度等。
改变质粒的表达条件可以改变表达量,从而提高质粒的稳定性。
四是改变质粒的表达调控序列。
表达调控序列是控制质粒表达的关键因素,改变表达调控序列可以改变质粒的表达量,从而提高质粒的稳定性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 表达载体的构建方法及步骤
2.
3. 一、载体的选择及如何阅读质粒图谱
4. 目前,载体主要有病毒和非病毒两大类,其中质粒DNA 是一种新的
非病毒转基因载体。
5. 一个合格质粒的组成要素:
6. (1)复制起始位点 Ori 即控制复制起始的位点。
原核生物 DNA 分
子中只有一个复制起始点。
而
7. 真核生物 DNA 分子有多个复制起始位点。
8. (2)抗生素抗性基因可以便于加以检测,如 Amp+ ,Kan+
9. (3)多克隆位点 MCS 克隆携带外源基因片段
10. (4) P/E 启动子/增强子
11. (5)Terms 终止信号
12. (6)加 poly(A)信号可以起到稳定 mRNA 作用
13. 选择载体主要依据构建的目的,同时要考虑载体中应有合适的限制
酶切位点。
如果构建的目
14. 的是要表达一个特定的基因,则要选择合适的表达载体。
15. 载体选择主要考虑下述3点:
16. 【1】构建DNA 重组体的目的,克隆扩增/基因表达,选择合适的
克隆载体/表达载体。
17. 【2】.载体的类型:
18. (1)克隆载体的克隆能力-据克隆片段大小(大选大,小选小)。
如<10kb 选质粒。
19. (2)表达载体据受体细胞类型-原核/真核/穿梭,E.coli/哺乳类细
胞表达载体。
20. (3)对原核表达载体应该注意:选择合适的启动子及相应的受体
菌,用于表达真核蛋白质时注意克服4个困难和阅读框错位;表达
天然蛋白质或融合蛋白作为相应载体的参考。
21. 【3】载体 MCS 中的酶切位点数与组成方向因载体不同而异,适应
目的基因与载体易于链接,不能产生阅读框架错位。
22. 综上所述,选用质粒(最常用)做载体的5点要求:
23. (1)选分子量小的质粒,即小载体(1-1.5kb)→不易损坏,在
细菌里面拷贝数也多(也有大载
24. 体);
25. (2)一般使用松弛型质粒在细菌里扩增不受约束,一般10个以上
的拷贝,而严谨型质粒<10个。
26. (3)必需具备一个以上的酶切位点,有选择的余地;
27. (4)必需有易检测的标记,多是抗生素的抗性基因,不特指多位
Ampr(试一试)。
28. (5)满足自己的实验需求,是否需要包装病毒,是否需要加入荧
光标记,是否需要加入标签蛋白,是否需要真核抗性(如Puro、
G418)等等。
29. 无论选用哪种载体,首先都要获得载体分子,然后采用适当的限
制酶将载体 DNA 进行切割,获得线性载体分子,以便于与目的基因片段进行连接。
30. 如何阅读质粒图谱
31. 第一步:首先看Ori 的位置,了解质粒的类型(原核/真核/穿梭质
粒)
32. 第二步:再看筛选标记,如抗性,决定使用什么筛选标记。
33. (1)Ampr 水解β-内酰胺环,解除氨苄的毒性。
34. (2)tetr 可以阻止四环素进入细胞。
35. (3)camr 生成氯霉素羟乙酰基衍生物,使之失去毒性。
36. (4)neor(kanr)氨基糖苷磷酸转移酶使G418(长那霉素衍生
物)失活
37. (5)hygr 使潮霉素β失活。
38. 第三步:看多克隆位点(MCS)。
它具有多个限制酶的单一切
点。
便于外源基因的插入。
如果在这些酶切位点以外有外源基因的插入,会导致某种标志基因的失活,而便于筛选。
决定能不能放目的基因以及如何放置目的基因。
39. 第四步:再看外源DNA 插入片段大小。
质粒一般只能容纳小于
10Kb 的外源 DNA 片段。
一般来说,外源 DNA 片段越长,越难插入,越不稳定,转化效率越低。
40. 第五步:是否含有表达系统元件,即启动子-核糖体结合位点-克
隆位点-转录终止信号。
这是用来区别克隆载体与表达载体。
克隆载体中加入一些与表达调控有关的元件即成为表达载体。
选用那种载体,还是要以实验目的为准绳。
41. 第六步:启动子-核糖体结合位点-克隆位点-转录终止信号
42. (1)启动子-促进 DNA 转录的 DNA 序列,这个 DNA 区域常在
基因或操纵子编码序列的上游,是DNA 分子上可以与RNApol 特异性结合并使之开始转录的部位,但启动子本身不被转录。
43. (2)增强子/沉默子-为真核基因组(包括真核病毒基因组)中的
一种具有增强邻近基因转录过程的调控顺序。
其作用与增强子所在的位置或方向无关。
即在所调控基因上游或下游均可发挥作用。
/沉默子-负增强子,负调控序列。
44. (3)核糖体结合位点/起始密码/SD 序列(Rbs/AGU/SDs):
mRNA 有核糖体的两个结合位点,对于原核而言是AUG(起始密码)和 SD 序列。
45. (4)转录终止序列(终止子)/翻译终止密码子:结构基因的最后
一个外显子中有一个AATAAA的保守序列,此位点down-stream 有一段 GT 或 T 富丰区,这2部分共同构成 poly(A)加尾信号。
结构基因的最后一个外显子中有一个AATAAA 的保守序列,此位点down-stream 有一段GT 或 T 富丰区,这2部分共同构成 poly(A)加尾信号。
46. 质粒图谱上有的箭头顺时针有的箭头逆时针,那其实是代表两条
DNA 链,即质粒是环状双链DNA,它的启动子等在其中一条链上,而它的抗性基因在另一条链上.根据表达宿主不同,构建时所选择的载体也会不同。
47.
48. 二、目的基因的获得
49. 一般来说,目的基因的获得有三种途径:
50. 调取基因:根据目的基因的序列,设计引物从含有目的基因的
cDNA中通过PCR的方法调取目的基因,链接到克隆载体挑取单克隆进行测序,以获得想要的基因片段,这种方法相对成本较低,但是调取到的基因往往含有突变,还有不同基因的表达丰度不同,转录本比较复杂,或是基因片段很长,这些情况都很难调取到目的基因。
51. 全基因合成:根据目的基因的DNA序列,直接设计合成目的基因。
此方法准确性高,相对成本会高一些,个人操作比较困难,需要专业的合成公司完成。
优点是可以合成难调取及人工改造的任何基因序列,同时可以进行密码子优化,提高目的基因在宿主内的表达量。
52.
53. 三、克隆构建
54. 目前,克隆构建的方法多种多样,除了应用广泛的酶切链接以外,
现在还有很多不依赖酶切位点的克隆构建方式。
下面具体说一下双酶切方法构建载体的步骤。
55. 实验材料
56.
57. 实验试剂
58. 试剂名称59. 生产厂家
60. 载体pCDNA3.161. Transheep
62. 大肠杆菌菌株DH5α63. Tiangen
64. 限制性内切酶65. Fermentas
66. T4连接酶67. Fermentas
68. 质粒DNA小,大量抽提试剂盒69. Axygen
70. 凝胶回收试剂盒71. Axygen
72. 琼脂糖73. Biowest
74. DNA ladder75. Fermentas
(2)X基因慢病毒载体的构建
X基因基因由Transheep全基因合成,构建于载体PUC57中。
PUC57-X基因 EcoRI/BamHI酶切结果:
Lane1:GeneRay 1kb DNA Ladder (从上至下依次为:3000bp, 2000bp, 1500bp, 1000bp, 500bp, 250bp,100bp)
Lane2:PUC57-Neurod1 EcoRI/BamHI酶切产物
酶切完成后进行胶回收
2. 载体用pCDNA
3.1双酶切,酶切体系如下。
20ul酶切体系 37度3小时
4ul pCDNA3.1载体(500 ng/ul)
1ul BamHI
1ul EcoRI
2ul 10×buffer
12 ul H2O
酶切完成后胶回收(见附录)
Lane1:GeneRay 1kb DNA Ladder (从上至下依次为:12000bp, 8000bp, 6000bp, 5000bp, 4000bp, 3000bp, 2500bp, 2000bp, 1500bp, 1000bp, 750bp, 500bp, 250bp)
Lane2: pcDNA3.1载体酶切回收产物
76. 处理好的目的片段与载体连接反应体系:
6ul PCR 酶切回收片段(约50ng/ul)
1ul 酶切好的载体(约50ng/ul)
2ul ligase buffer
1ul T4ligase
10ul H2O
以上连接液在16℃过夜。
77. 转化 (感受态细胞: DH5a),具体步骤见附录转化部分。
抗性: Amp; 37℃,培养过夜
78. 转化后X基因分别平板挑菌, 37℃ 250转/分钟摇菌14小时,PCR鉴定
后,将阳性菌液送上海权阳生物技术有限公司测序。
X基因慢病毒载体单克隆菌落PCR鉴定(使用载体通用引物,PCR条带大小应比实际大200bp左右):
Lane1:GeneRay 1kb DNA Ladder
(从上至下依次为:2000bp, 1500bp, 1000bp, 750bp, 500bp, 250bp,100bp)
Lane2-4: X基因菌落鉴定PCR产物。
