第四章酰化反应答案
第四章 烃化反应

H2C N N
+
ROH
H3C N N OR
N2
CH3OR
R = Ar 或 R' C 酸 O 酚
OMe OMe OH OMe OH OH
过量CH2N2
2 mol CH2N2
COOMe
COOMe
COOH
什么情况下为过量? 1 mol CH2N2
OH OH
羧酸比酚更易于反应
COOMe
DCC催化酚醇偶联 催化酚醇偶联
b
R H
OH
H H Nu
过渡态时 C- O断 裂 少 - 断
位阻小
H2SO4
Ph O
* CH2OH Ph 2h
OMe
+ +
Ph
* CH2OMe
OH
+
MeOH CH3ONa 2h
Ph
90% * CH2OH
OMe
10% * CH2OMe
OH
Ph
25%
75%
由于产物中含羟基,如果环氧乙烷过量,就可形成聚醚, 由于产物中含羟基,如果环氧乙烷过量,就可形成聚醚,故 甲醇必须过量
多卤化物与醇钠反应,得到多醚化产物: 多卤化物与醇钠反应,得到多醚化产物:
CHCl3
+ 3 RONa CCl3NO2 + 4 RONa
CH(OR)3 C(OR)4
原酸酯 四烷氧基甲烷
Cl
EtOH/NaOH
NO2
OEt
(95.6%) 转化率70%
NO2
4.1.1.2 芳磺酸酯作烃化剂
芳磺酸酯的应用比硫酸酯(有毒 广 是很好的离去基团。 芳磺酸酯的应用比硫酸酯 有毒)广,且OTs是很好的离去基团。 有毒 是很好的离去基团
药物合成反应 第四章 酰化反应

O CHCl2 H2O
CHO
Vilsmeier甲酰化反应 芳香化合物、杂环化合物及活泼烯烃化合物用二取代 甲酰胺及氧氯化磷处理得到醛类的反应称Vilsmeier甲酰化 反应。是芳香环的甲酰化反应最普通的方法。
POCl3 R1 R1 + ArCHO ArH + N C H NH R2 R2 O
机理
B: PhCOCl
CH3COCHCOOC2H5 COPh
PhCOOH + CH2
X -CN -H -CN
X DEPC/Et3N/DMF X PhCOCH Y r.t. Y
Y -COOC2H5 -NO2 -CN 收率 93.4% 85.5% 92.8% 96.8%
-COOC2H5 -COOC2H5
(2). 酮及羧酸衍生物的-位C-酰化 Claisen酯缩合反应 含有-氢的酯在醇钠等碱性缩合剂作用下发生缩合作 用,失去一分子醇得到酮酯的反应称为Claisen酯缩合反应。
N CH3.I
C O + ( CH2 )n O
n=5 (89%) n=11 (69%)
N O CH3
(3) 羧酸三硝基苯酯
O R''OH+ R-C-OH + Cl
O2N NO2
O R-C-OR''
O2N
O R C O
O2N NO2
难 于 分 离 ,所 以 三 种 物 质 一 起 加 入
O2N
酸酐为酰化剂
73%
COOH
CH3
+
H3C
C
CH3
OH
(CF3CO)2O
COOBu-t
混合酸酐的应用 ②羧酸-磺酸混合酸酐
(整理)羧酸与胺的缩合酰化反应

羧酸与胺的缩合酰化反应王露化工与制药专业 1105班学号110150151指导教师刘雪凌老师摘要合成是制药的基本方法,也是很重要的方法,人类对药物的需求很大,要不断的创新、研发新药,合成是其中必不可少的方法,本文介绍了常见合成酰胺的方法,合成酰胺通用的方法是先活化羧基,然后再与胺反应得到酰胺。
其中羧酸与胺的反应是合成酰胺的重要方法【5】。
这一反应是一个平衡反应,采用过量的反应物之一或除去反应中生成的水,均有利于平衡向产物方向转移。
除去水的方法通常是在反应物中加入苯或甲苯进行共沸蒸馏【1】。
关键词:合成酰化活化前言药物对于我们任何一个人来说都不陌生,而且离不开。
现在药物的种类有很多,但还是有一些疾病无法治疗,所以我们需要不断的研发新药,而合成又是制药的基本领域和方法,所以我们需要学习、了解具体的合成方法【3】。
常见合成酰胺的方法➢羧酸与胺的缩合酰化反应➢氨或胺与酰卤的酰化反应➢氨或胺与酸酐的酰化反应➢其他缩合方法➢酯交换为酰胺➢氰基转化为酰胺羧酸与胺的缩合酰化反应1羧酸和胺的直接缩合反应羧酸与胺的反应是合成酰胺的重要方法: 这一反应是一个平衡反应,采用过量的反应物之一或除去反应中生成的水,均有利于平衡向产物方向转移。
除去水的方法通常是在反应物中加入苯或甲苯进行共沸蒸馏。
例如将a-羟基乙酸及苄胺于90℃共热,并蒸出生成的水及过量的苄胺,则生成a-羟基乙酰基苄胺【7】:90o C1.1混合酸酐法1.1.1混合酸酐法(一)氯甲酸酯法:主要应用羧酸与氯甲酸乙酯或异丁酯反应生成混合酸酐,而后再与胺反应得到相应的酰胺。
这一反应如果酸的a-位位阻大或者连有吸电子基团,有时会停留在混合酸酐这一步。
但加热可以促使其反应;这一反应也可用于无取代酰胺的合成。
ClCOOEt, NEt3 CHCl3, -20~5o C, 1.5h NH3 (gas) rt, 30min91%NMM, DMFr.t.33%1.1.2混合酸酐法 (二)羰基二咪唑:应用羰基二咪唑(CDI)与羧酸反应得到活性较高的酰基咪唑,许多酰基咪唑有一定的稳定性,有时可以分离出来。
第4章 烷基化反应和酰基化反应.

含活泼亚甲基氢的化合物如乙酰乙酸乙酯、丙二酸 二乙酯、2,4-戊二酮等与卤代烷的C-烷化反应可用于制 备其α-H被烃基取代的衍生物。
H C2H5ONa + H C COOC2H5
C4H9 C H COOC2H5
R'OR'OH
RHC O
CH2
[RCHCH2OR'] O-
RCHCH2OR' + R'OOH
高级脂肪醇能加成环氧乙烷生成高级脂肪醇聚氧乙烯醚型 非离子表面活性剂:
ROH + n H2C O CH2 RO (CH2CH2O )n H
高级脂肪酸也能加成环氧乙烷生成酯类聚氧乙烯型非离子表 面活性剂,是一种性能优良的乳化剂:
ROH + NaOH RO-Na+ + XAlk RO-Na+ + H2O ROAlk + NaX
在氢氧化钾和相转移催化剂聚乙二醇-400存在下,酚类与卤 代烷的反应非常顺利,如:
OH + CH3 I + KOH 聚乙二醇-
CH2Cl2,H2O
OCH3
+ KI + H2 O
用氯乙酸做烷基化剂可用于制备苯氧乙酸类的化合物。
O C
O Cl
<
H3C
C
Cl
4.4.1 用羧酸的N-酰化 用羧酸对胺类化合物进行酰化是合成酰胺的重要方法,反应有 水生成,是一个可逆反应,其酰化反应通式为:
R'NH2 + RCOOH R'NHCOR + H2O
酰化反应

-
-
R带吸电子基团 利于进行反应;R带给电子不利于反应; R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行; R为芳基时,由于芳基与N原子或O原子的共轭效应,使N原子或O原子 上的云密度降低而反应活性下降,所以RNH2>ArNH2;ROH>ArOH 。
10
概 述 催化
酸碱催化
碱催化作用是可以使较弱的亲核试剂H-Nu转化成亲核性较强的 亲核试剂Nu-,从而加速反应。 酸催化的作用是它可以使羰基质子化,转化成羰基碳上带有更 大正电性、更容易受亲核试剂进攻的基团,从而加速反应进行。
16
第一节 氧原子的酰化反应
一 醇的氧酰化
b.催化剂
(1)质子酸催化法: 常用浓硫酸,氯化氢气体,磺酸,四氟硼酸等
O R C OH H+ OH R C OH OH R C OH
1) 羧酸为酰化剂
各种质子酸都具有各自卑优点和缺点。
17
第一节 氧原子的酰化反应
一 醇的氧酰化
1) 羧酸为酰化剂
浓硫酸具有催化能力强、性质稳定、价廉等优势,其缺 点是有一定的氧化性、易发生磺化、脱水、脱羧等副反应, 所以一般不饱和酸、羟基酸、甲酸、草酸、丙酮酸等不宜采 用之。 无水氯化氢具有催化能力强、无氧化性、价廉等优势,其 缺点是易发生加成、卤代等副反应,另外对反应设备的有一 定腐蚀性和易对环境造成一定的污染。一般不饱和酸(醇)、 叔醇等不易采用之。 对甲苯磺酸具有浓硫酸的一切优点,且无氧化性,在有机 溶剂中的溶解度较大,不易发生磺化副反应等优点,尤其是在 使用共沸带水等反应条件时更为适用,但其缺点是价格比较贵, 一般用于复杂结构的酯的制备中。
O C X
当然还有(硫代)异氰酸酯[R-N=C=O(S)]等.
药物合成反应 第四章 酰化反应

Et O RCOOH R NH2 Et O
O P
Et3N/DMF
O N BDP
N N Nr.t.20minRCOHR二、氮原子上的酰化反应
2.影响因素
(1)催化剂 为加快酰化反应的速度,有时需加入少量强酸 作为催化剂。
RCOOH H RC OH OH OH H RC OH OH R NH2 R C N R
羧酸是一个弱酰化剂,对于弱碱性氨基化合物若直接用 羧酸酰化较为困难,反应中可加入缩合剂以提高反应活性。 活性磷酸酯类是近年发展较快的一类N-酰化偶合剂,这 些试剂在反应中可迅速转化成相应的酯类活性中间体与胺反 应生成酰胺。
二、氮原子上的酰化反应
此类试剂由于具有活化能力强,反应条件温和,光学活 性化合物不发生消旋化等特点,广泛应用于肽类或β-内酰胺 类化合物的合成中。如苯并三唑基磷酸二乙酯(BDP)
间接酰化法
(1)间接亲电酰化
N(CH3)2 [ R2N CH Cl ] . OPOCl2 - HOPOCl2 N(CH3)2 CH Cl H2O N(CH3)2 CHO R2NH HCl NR2
间接酰化法
(2)间接亲核酰化
HS HS R 、C R S S S S O H2O/HgCl2 R C C4H9Li S S
- H2O
O R C NHR H
OH H
二、氮原子上的酰化反应
(2)胺的结构 羧酸作为酰化剂一般用于碱性较强的胺类,氨基氮原子 上的电子云密度愈大,空间位阻愈小,则反应活性愈强。胺 类化合物酰化反应的活性:伯胺>仲胺;脂肪胺>芳香胺。 在芳香族胺类化合物中,芳环上有给电子基团时,反应活性 增强;反之,有吸电子基团时,则反应活性下降。
C C C O
H N N H C O
第四章 酰化反应 答案
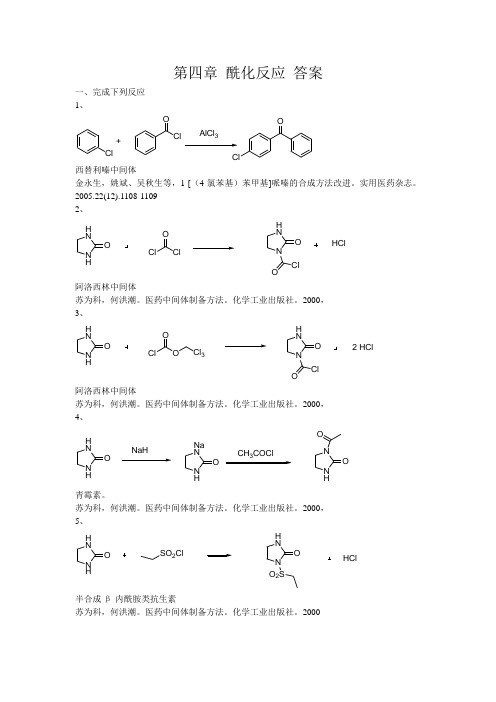
第四章 酰化反应 答案一、完成下列反应 1、ClClClOO+AlCl 3西替利嗪中间体金永生,姚斌、吴秋生等,1-[(4-氯苯基)苯甲基]哌嗪的合成方法改进。
实用医药杂志。
2005.22(12).1108-1109 2、 N HH NO ClO ClN H NO ClOHCl阿洛西林中间体苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 3、 N HH NO ClO ON H NO ClO2 HClCl 3阿洛西林中间体苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 4、 N HH NO NaHN HNa NO CH COClN HNO O青霉素。
苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 5、 N HH NO SO 2ClN H NO O 2SHCl半合成β-内酰胺类抗生素苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
20006、OOO3C OCH 2CH 2COOH芬不芬章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,1340 7N HS CH3C O O CCH O NS COCH 3乙酰丙嗪8NH 2COOHNHCOCH 3COOH安眠酮章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,13 9N N SH 2NSHCH3C O CCH 3O N N S HN SHCOCH 3乙酰唑胺章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,14 10 NH 2OHCH3C O O CCH O NHCOCH 3OH嘧啶苯芥章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,15 11 NH 23NHCOCH 3磺胺类药物章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,17 12NH2 F3CCl2NHCOClF3CClCH3CN卤卡班章思规。
实用精细化学品手册(有机卷)下。
2015酰化反应

反应机理:
RCOOH + C6H11N C NC6H11 C6H11 N C N C6H11 H RCOO NHC6H11 O RCOOH R C O C NC6H11 O C NHC6H11 O + RCOO R C O C NHC6H11 A O C6H11NHCNHC6H11
A
R'OH
R
O R' + H
酰化反应
酰化反应
定义:有机化合物分子中引入酰基的反应称为酰化 反应。主要发生在碳、氧、氮、硫等原子上。 用途:活性化合物的必要官能团 结构修饰和前体药物 羟基、胺基等基团的保护 类型:直接酰化 间接酰化
Page 2
直接酰化反应类型
亲电酰化反应 亲核酰化反应 自由基酰化反应
-H RCO2R'
Page 9
氨基的酰化:
O R' + H N R C OH R''
RCOO NH2R'R'' O R C OH NH R' R'' O R C N R' R''
羧酸与胺 需高温脱水 催化剂:可用DCC、DIC等缩水剂(活化羧酸)
Page 10
COOH NH2 N H CH3OH SOCl2 N H COOMe DCC/Et3N/CH2Cl2 COOH N H HN O
用量:至少是底物的一倍以上(?)
Page 32
催化剂的选择:
以酰氯、乙酸酐为酰化剂时,多用Lewis酸为催化剂如AlCl3、 FeCl3、TiCl4、ZnCl2
O C Cl F + AlCl3 NH2 O C F
NH2
药物合成反应酰化反应

( C H 2 ) n
INX + H O ( C H 2 ) n C O O H△ ,7 .5 - 8 h
CO IN O
C H 3
C H 3
n ( H 2 C ) C O +
No O
C H 3
c.羧酸三硝基苯酯
Cl-TNB
O O2N RCO
NO2
O2N
O
O2N
R''OH+R-C-OH+Cl
NO2
O2N
(1)H+ 催化
O
RC H
O RC
O
O RC
O H RC
O
O
O
RCO H + RC
(2)Lewis酸催化
O R C
O
RC O
A lC l3
OO
RC+ R C O A lC l3
(3)吡啶碱催化
3、影响因素
(1)酸酐结构的影响 羰基α 位有吸电子基,亲电性增强
(2)催化剂的影响 酸催化 碱催化 三氟甲磺酸盐催化
二、羧酸酯为酰化剂
1、反应通式
酰化剂:各种脂肪族和芳香族的羧酸酯 被酰化物:伯、仲、叔醇 催化剂:质子酸、醇钠 溶剂:醇类、醚类、卤代烃类等
2、反应机理
(1)酸催化机理:增强羧酸酯的活性
O R ''O H+RCO HR '
R '' O H
O CH OR '
HR
O
O
R '' H OCR ' -H + R '' OCR '
如何提高收率:
(1)增加反应物浓度 (2)不断蒸出反应产物之一 (3)水添A加l2脱(S水O4剂)3,或(分CF子3C筛O除)2O水,。D(CC无。水)CuSO4,无
酰化反应原理

O2N
COOH HOCH2CH2NEt2/ Xyl O2N
COOCH2CH2NEt2
137~145
(97.6%)
( 11 )
3.配料比及操作特点
酯化反应是一可逆平衡反应,要提高产物 的收率,可采取增大反应物(醇或酸)的 配比,同时不断将反应生成的水或酯从反 应系统中除去。
除去水可用以下几种方法: (1)加入脱水剂,如浓硫酸、无水氯化钙、
H
CH2COOH TSOH/PhH
OH
,10min
H
H
O (97%) H
O
Cl
OCH2COOH HOCH2CH2NMe2/TsOH Cl
OCH2COOCH2CH2NMe2
,间二甲苯带水
HCl(gas)
Cl
(8)
OCH2COOCH2CH2NMe2 HCl
(2)Lewis酸 常用的Lewis酸催化剂有BF3、 AlCl3、ZnCl2及硅胶等。Lewis酸作催化剂 具有收率高、产品纯度好,并可避免双键 的分解或重排副反应等优点。如:
酰化剂:醇、酚的O-酰化常用的酰化剂有羧酸、羧酸酯、 酸酐、酰氯、烯酮等。
一、羧酸为酰化剂
由于羧酸是较弱的酰化试剂,其对醇进行 酰化为可逆平衡反应,反应式如下:
RCOOH R'OH
RCOOR' H2O
反应机理一般为酸催化下的酰氧断裂的双 分子反应。
1.反应温度和催化剂 对于许多酯化反应,温度每升高10℃,反应速度可增加
O R C OH
NCN (9)
NH C N RCOO
O
N
RCOC
NH
O
NH
RCOOH
RCOC
(10) NH
酰化反应

4. 酰氯为酰化剂
(1)反应通式 (2)反应机理
55
(3)影响因素
A 酰氯结构的影响
■ 脂肪族酰氯 > 芳酰氯 ■ 羰基的α位连有吸电子基团时,活性增强 ■ 芳酰氯邻位有取代基时,活性降低
B 催化剂的影响
■ 有机碱:吡啶、三乙胺、N,N-二甲基苯胺、N,N-二甲基吡啶 ■ 无机碱:NaOH、KOH、Na2CO3、K2CO3 ■ 采用吡啶类碱不仅可以中和反应生成的HCl,还有催化作用,增强活性
S
R CH S
n-C4H9Li
S RC Li S
H2O/HgCl22
第二节 氧原子上的酰化反应
• 醇的O-酰化反应 • 酚的O-酰化反应 • 醇、酚羟基的保护
13
一、醇的O-酰化反应
1. 羧酸为酰化剂
(1)反应通式
(2)反应机理
提高收率:
■ 增加反应物浓度
19
(iii) Vesley法 采用强酸型离子交换树脂加硫酸钙 催化能力强、收率高、条件温和
Vesley法
CH3COOH + CH3OH 10min
CH3COOCH3 (94%)
20
(iv) DCC法( dicyclohexylcarbodiimide,二环己基碳二亚胺)
21
DCC类似物:
CH3-N=C=N-C(CH3)3
N
r.t., 12 min
(96%)
H3C
CH3 COOC(CH3)3
金属离子Hg2+、Ag+、Cu+、Cu2+等对反应有催化作用
35
(ii) 羧酸吡啶酯
36
(iii) 羧酸三硝基苯酯( 一锅煮合成法 )
药物合成学习题

《药物合成技术》习题集适用于制药技术类专业河北化工医药职业技术学院李丽娟二00六年七月第一章 概论一、本课程的学习内容和任务是什么?学好本课程对从事药物及其中间体合成工作有何意义?二、药物合成反应有哪些特点?应如何学习和掌握? 三、什么是化学、区域选择性?举例说明。
四、什么是导向基?具体包括哪些类型?举例说明。
五、药物合成反应有哪些分类方法?所用试剂有哪些分类方法?举例说明。
六、查资料写一篇500字左右的短文,报道药物合成领域的新技术及发展动态?第二章 卤化技术(Halogenation Reaction )一、简答下列问题1.何为卤化反应?按反应类型分类,卤化反应可分为哪几种?并举例说明。
2.在药物合成中,为什么常用卤化物作为药物合成的中间体?3.在较高温度或自由基引发剂存在下,于非极性溶剂中,B r 2和NBS 都可用于烯丙位和苄位的溴取代,试比较它们各自的优缺点。
4.比较X 2、HX 、HOX 对双键离子型加成的机理、产物有何异同,为什么?5.解释卤化氢与烯烃加成反应中,产生马氏规则的原因(用反应机理)。
为什么Lewis 酸能够催化该反应?6.解释溴化氢与烯烃加成反应中,产生过氧化效应的原因?7.在羟基卤置换反应中,卤化剂(HX 、SOCl 2、PCl 3、PCl 5)各有何特点,它们的使用范围如何?二、完成下列反应C CH 3CH 3CHCH 3Ca(OCl)2/AcOH/H 2O1.Ph 2CHCH 2CH 2OH PBr 2.CH 3SO 2ClCl /AIBN3.OH4CH 3CH 35.2OC O CH 3OHI 2/CaOTHF/MeOHAcOK Me 2CO?6.三、为下列反应选择合适的试剂和条件,并说明原因。
(CH 3)2CCHCH 3CHCH 2Br(CH 3)2C1.CH 3CH CH COOHCH 3CH CH COCl 2.HOCH 2(CH 2)4CH 2OH(CH 2)4CH 2I CH 2I 3.CH 3OCH 2CH 2CO 2HCH 2CHCOBrCH 3O 4.CH 3CH CH CO 2CH 3CH 2CH CH CO 2CH 3Br 5.OCH 2CH 2OH CH 2CH 2OHO2CH 2CH 2CH 2ClCl 6.CH 2OH3CH2ClOCH 37.8.BrCH 2(CH 2)9COOH CH 3CH(CH 2)8COOHBrCH 2CH(CH 2)8COOHCH 3NO 2CH 2C(COOC 2H 5)3CH 2BrNO 2CH 2C(COOC 2H 5)39.CH 22CH 2N(CH 2CH 2OH)2C(COOC 2H 5)3(抗肿瘤药消卡芥)CH 2NO 2CH 2N(CH 2CH 2Cl)2CHCOOH 2CH 2NO 2CH 2N(CH 2CH 2Cl)2C(COOC 2H 5)NHCOCH 310.CH 3(CH 2)5OCH 3C 2H 5CH 3(CH 2)5OCH 2BrC 2H 5CH3(CH 2)5OOHC 2H 5CH 3(CH 2)4CH 2OHCH 3(CH 2)4CH 2Cl CH 3(CH 2)4CH 2Cl (构型反转)(构型保持)11.OC 2H 5OC 2H 5Br12.四、分析讨论1.试预测下列各烯烃溴化(Br 2/CCl 4)的活性顺序。
酰化反应原理与实例解析

第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1.围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2.围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;3.围绕典型药物的生产过程,完成用羧酸法、酯交换法、酸酐法、酰氯法生产酯类产品。
学习目标1.掌握羧酸、羧酸酯、酸酐、酰氯酰化剂的特点、适用范围、使用条件及其N-酰化、酯化中的应用;2.掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法;3.掌握生产中操作及注意事项;4.掌握Friedel-Crafts酰化反应的基本原理、影响因素以及在药物合成中的应用,在生产中的应用及注意事项;5.理解Hoesch反应、Gattermann反应、Vilsmeier反应的用途、适用条件及在药物合成中的应用;6.掌握活性亚甲基化合物α位C-酰化的原理、使用条件及在药物合成中的应用;7.了解新型酰化剂及其在医药科研、生产中的新技术与应用学时安排课堂教学10学时现场教学6学时实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标● 掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用; ● 掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
● 掌握生产中操作及注意事项● 了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章 酰化技术第一节 概述一、酰化反应 1. 概念酰化反应是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应。
酰基 是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团。
2. 反应通式RCZOR CSOHZ(式中RCOZ 为酰化剂,Z 代表X ,OCOR ,OH ,OR ˊ,NHR ″等;SH 为被酰化物,S 代表R ˊO 、R ″、Ar 等。
)二、常用酰化剂及其活性★1.常用酰化剂:羧酸、羧酸酯、酸酐、酰氯等酰化剂的活性规律:当酰化剂(RCOZ )中R 基相同时,其酰化能力随Z —的离去能力增大而增加(即酰化剂的酰化能力随离去基团的稳定性增加而增大)★常用酰化试剂的酰化能力强弱顺序:酰氯 >酸酐 > 羧酸酯 > 羧酸 > 酰胺三、酰化反应在化学制药中的应用永久性酰化 制备含有某些官能团的药物 保护性酰化第二节 N-酰化常用酰化剂:羧酸酰化剂、羧酸酯酰化剂、酸酐酰化剂和酰氯酰化剂 一、羧酸酰化剂 1.反应过程R C NR'R''O R C NR'R''R C LO R'R''NHH _★2.适用对象 羧酸是弱的酰化试剂,一般适用于酰化活性较强的胺类。
精细有机合成第四章酰化

O CH3 C
O
CH3 C O
R1 + ቤተ መጻሕፍቲ ባይዱH
R2
O R1 CH3C N R2 +
O CH3C OH
式中R1可以是氢、烷基或芳基,R2可以是氢或烷 基。这个反应不生成水,因此是不可逆的。
Company Logo
4.1.2 酸酐的N-酰化
❖ 如果被酰化的胺和酰化产物熔点不太高,在乙酰 化时可不另加溶剂。
Company Logo
4.1.1用酰氯的N-酰化
用酰氯进行N-酰化的反应通式如下:
R NH2 + Ac Cl
R NHAc + HCl
式中R表示烷基或芳基,AC表示各种酰基,这类反应 是不可逆的。酰氯是比相应的酸酐更活泼的酰化剂。 许多酰氯比相应的酸酐容易制备,因此常常用酰氯作 酰化剂。最常用的酰氯有长碳链脂肪酸的酰氯,芳羧 酰氯、芳磺酰氯、光气和三聚氰酰氯等。
用羧酸的N-酰化是一个可逆的过程,首先生成铵 盐,然后脱水生成酰胺:
O R C OH + H2N R'
成盐
O R C O H3NR'
-H2O 加热
OH R C N R'
Company Logo
4.1.3 羧酸的N-酰化
为了使酰化反应尽可能完全并使用过量不太多的 羧酸,必须除去反应生成的水,脱水的方法主要 有下述几种。 ❖ 1.高温熔融脱水酰化法 ❖ 2.反应精馏脱水酰化法 ❖ 3.溶剂共沸蒸馏脱水酰化法 此3种方法的用法见书P253页。
❖ 如果被酰化的胺和酰化产物熔点较高,就需要另 外加苯,甲苯或氯苯等非水溶性惰性有机溶剂。
❖ 如果被酰化的胺和酰化产物易溶于水,而乙酰化 的速度比乙酐的水解速度快的多,乙酰化反应也 可以在水介质中进行。
酰化反应原理与实例解析

精心整理第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1.围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2.围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标●掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用;●掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
●掌握生产中操作及注意事项●了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章酰化技术第一节概述一、酰化反应1.概念酰化反应是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应。
酰基是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团。
2.反应通式代表RR基反应精馏脱水法主要用于乙酸与芳胺的N-酰化,例如,将乙酸和苯胺加热至沸腾,用蒸馏法先蒸出含水乙酸,然后减压蒸出多余的乙酸,即可得N-乙酰苯胺。
溶剂共沸脱水法主要用于甲酸(沸点100.8℃)与芳胺的N-酰化反应。
(以上方法大多在较高温度下进行,因此,不适合热敏性酸或胺)(2)催化剂强酸作催化剂适用于活性较强的胺类的酰化缩合剂作催化剂适用于活性弱的胺类、热敏性的酸或胺类常用的此类缩合剂有★DCC(Dicyclohexylcarbodiimide,二环己基碳二亚胺)DIC(DiisopropylCarbodiimide,二异丙基碳二亚胺)等。
DCC是一个良好的脱水剂,以DCC作脱水剂用羧酸直接酰化,条件温和,收率高,在复杂结构的酰胺、半合成抗生素及多肽的合成中有较多的应用。
二、羧酸酯酰化剂反应过程1.反应物活性(1)对于羧酸酯(RCOORˊ)的合成)将7—ACA、水、丙酮加入反应体系中,降温,加入三乙胺、活性酯,反应至7-ACA 基本消失后,加有机酸酸,有头孢噻肟酸沉淀生成。
酰化反应原理与实例解析

精心整理第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1.围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;N-6.掌握活性亚甲基化合物α位C-酰化的原理、使用条件及在药物合成中的应用;7.了解新型酰化剂及其在医药科研、生产中的新技术与应用学时安排课堂教学10学时现场教学6学时实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标)随离去基团的稳定性增加而增大)★常用酰化试剂的酰化能力强弱顺序:酰氯>酸酐>羧酸酯>羧酸>酰胺三、酰化反应在化学制药中的应用永久性酰化制备含有某些官能团的药物保护性酰化第二节N-酰化常用酰化剂:羧酸酰化剂、羧酸酯酰化剂、酸酐酰化剂和酰氯酰化剂一、羧酸酰化剂1.反应过程★2.适用对象羧酸是弱的酰化试剂,一般适用于酰化活性较强的胺类。
3.反应条件及催化剂(1)反应条件酸过量为了加速反应,并使反应向生成酰胺的方向移动,必须使反应物之一过量,通常是酸过量。
脱水可用以下方法脱水?高温熔融脱水酰化法适用于稳定铵盐的脱水,例如苯甲酸和苯胺加热到225℃进行脱水,可制得N-苯甲酰苯胺。
电性有吸电子取代基则活性高,易酰化。
离去基团的稳定性离去基团越稳定,则活性越高(2)对于胺类胺的碱性碱性越强,活性越高,空间位阻空间位阻越小,活性越高(3)羧酸二酯与二胺类化合物,如果反应后能得到稳定的六元环,则反应易发生。
如哌拉西林等青霉素药物中间体乙基-2,3-哌嗪二酮(6)催眠药苯巴比妥(Phenobarbital,7)等的合成。
2.催化剂(1)强碱作催化剂由于酯的活性较弱因此在反应中常用碱作为催化剂脱掉质子,以增加胺的亲核性。
用的碱性催化剂有醇钠或更强的碱,如NaNH2、n-BuLi、LiAlH4、Na等(2)反应物胺作催化剂过量的反应物胺也可起催化作用。
(3)催化剂的选择与反应物的活性有关反应物活性越高,则可选用较弱的碱催化;反之,则需用较强的碱催化。
药物合成反应 酰化反应

+
C
CH3
b.羧酸-磺酸混合酸酐
O R CO O H R CO C l + + R 'S O 2 C l R 'S O 2 C l R R' C O R C
O
SO 2
+
R 'S O 2 O H
c.羧酸-磷酸混合酸酐
d.羧酸-取代苯甲酸混合酸酐
e.其他混合酸酐
O 其它: Cl C O Cl C O EtO C OEt 碳酸酯 OEt Cl O R O
O 2N NO2
O R -C -O R ''
O 2N
O R C O
O 2N NO2
难 于 分 离 ,所 以 三 种 物 质 一 起 加 入
O 2N
d.其他活性酯 羧酸异丙烯酯、羧酸二甲硫基烯醇酯、羧酸-1-苯并三唑酯
O R CO O H + H 3C C CH O C H 2 = C = O + C H 3 -C -C H 3
O O -C -R
OH E t3 N
△
( C H 2 )n I N CH3 C O O n(H 2 C ) O C O+ N CH3 o
+ HO(CH2)nCOOH
I N CH3 X
,7 .5 -8 h
c.羧酸三硝基苯酯 Cl-TNB
O R C O O2N O 2N NO2
O R ''O H + R -C -O H + C l
(3)反应溶剂的影响 (4)反应温度的影响
4、应用特点
(1)单一酸酐位酰化剂的酰化反应 (使用较少)
(2)混合酸酐的应用 a.羧酸-三氟乙酸混合酸酐(适用于立体位组较大的羧酸的酯 O O O 化)O
酰化反应一

O CH2OH O O + I COOH DCC/DMAP O 25° 96% O I CH2O C
Mitsunobu 反应
对光学活性仲醇的构型转化
OH DEAD/Ph3P/PhCOOH O O K2CO3/MeOH O
OH
O
2.羧酸酯为酰化剂
CH3(CH2)3 HN
例:局麻药丁卡因
COOCH2CH3 + HOCH2CH2N(C2H5)2 O C2H5ONa △
R C
O * C O * C O C C O O * C O C NR2 X O O R OH
O
+ HNu
加成
R C L
O Nu
消除
R Nu
C
O + HL
L
(L=OH、OR、OCOR、X、NH2等)
CH2=C=O
加成阶段: 反应是否易于进行决定于羰基的活性,若L的电子 效应是吸电子的,不仅有利于亲核试剂的进攻,而且使中间体 稳定;若是给电子的作用相反。 消除阶段: 反应是否易于进行主要取决于L的离去倾向。L-碱性 越强,越不容易离去,Cl- 是很弱的碱,-OCOR的碱性较强些, OH-、OR-是相当强的碱,NH2-是更强的碱。 ∴ RCOCl>(RCO)2O>RCOOH 、RCOOR’>RCONH2 > RCONR2′ R: R带吸电子基团利于进行反应;R带给电子不利于反应; R的 体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进 行
O R C O F3C C O CH3 O R O O P N O O N N R C O N N CH3 N I CH3 O C R O R C O N N S O C R
O
2
R C O O CH3 R C O S O Cl Cl Cl O O CH2=C=O O C O O C R R C O C Cl
药物合成教学资料 酰化反应

ii. 碱类催化剂
Et3N, AcONa Py DMAP PPy
编辑课件
(4) 反应特点 ① 单一酸酐为酰化剂的酰化反应 常见 Ac2O, (CH3CH2CO)2O, (PhCO)2 O
编辑课件
编辑课件
② 混合酸酐为酰化剂的酰化反应 i. 羧酸-三氟乙酸混合酸酐
编辑课件
ii. 羧酸-磺酸混合酸酐
反之,醇羟基的α位连有给电子基团时,通过 给电子效应使醇羟基氧原子上的电子云密度 增加,从而增强醇的亲核性,有利于酰化反 应
编辑课件
③ 催化剂的影响
i. 用来提高羧酸反应活性的催化剂 (a) 质子酸
编辑课件
(b) Lewis酸
编辑课件
(c) Vesley法 以强酸型离子交换树脂加硫酸钙为催化剂 特点:催化能力强,收率高,条件温和
供电子基多 取代的芳环
供电子基单 取代的芳环
编辑课件
需强活性的腈
② 腈结构的影响
α-碳上吸电子基越多,腈的活性越高 ③ 催化剂
Lewis酸:AlCl3, ZnCl2, FeCl3, BX3
编辑课件
(4) 应用特点 ① 二元酚(醚),三元酚(醚)的反应
被酰化物活性高,产率也高
编辑课件
② 一元酚(醚)、苯胺的反应
编辑课件
② 酸酐为酰化剂
编辑课件
③ 酚羟基的选择性酰化 酚羟基乙酰化
Ac-TMH 3-乙酰基-1, 5, 5,-三甲基乙内酰脲
编辑课件
可以用碱先把酚羟基转化为氧原离子,提高其 亲核性,再进行酰化
编辑课件
第三节 氮原子上的酰化反应
一、脂肪胺的N-酰化反应 1. 羧酸为酰化剂 (1)反应通式
编辑课件
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 酰化反应 答案一、完成下列反应 1、ClClClOO+AlCl 3西替利嗪中间体金永生,姚斌、吴秋生等,1-[(4-氯苯基)苯甲基]哌嗪的合成方法改进。
实用医药杂志。
2005.22(12).1108-1109 2、 N HH NO ClO ClN H NO ClOHCl阿洛西林中间体苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 3、 N HH NO ClO ON H NO ClO2 HClCl 3阿洛西林中间体苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 4、 N HH NO NaHN HNa NO CH COClN HNO O青霉素。
苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 5、 N HH NO SO 2ClN H NO O 2SHCl半合成β-内酰胺类抗生素苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
20006、OOO3C OCH 2CH 2COOH芬不芬章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,1340 7N HS CH3C O O CCH O NS COCH 3乙酰丙嗪8NH 2COOHNHCOCH 3COOH安眠酮章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,13 9N N SH 2NSHCH3C O CCH 3O N N S HN SHCOCH 3乙酰唑胺章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,14 10 NH 2OHCH3C O O CCH O NHCOCH 3OH嘧啶苯芥章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,15 11 NH 23NHCOCH 3磺胺类药物章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,17 12NH2 F3CCl2NHCOClF3CClCH3CN卤卡班章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,1438 13NHNH2OOO N NHOO6-羟基-2-苯基-3-哒酮章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,1509 14O COCl +O CO2CHCOOCH2CH2CH(CH3)2 (CH3)2CHCH2CHCOOCH2OH呋布西林苏为科,何潮洪。
医药中间体制备方法。
化学工业出版社。
2001,671 15NH2CF32CH3NHCOClCF3间三氟甲苯异氰酸脂制备章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,1357 16COOH NO2HOCH CH N(C H)xylene O2N ONO盐酸普鲁卡因制备尤启冬。
药物化学。
化学工业出版社。
2005,89 醇的O-酰化17CH3NH2 CH3ClCH2COClCH3NHCH3ClO盐酸利多卡因制备尤启冬。
药物化学。
化学工业出版社。
2005,96 胺的N-酰化18H 3H 2+H 3COOEt 3N,DMFH 3CO依托咪酯尤启冬。
药物化学。
化学工业出版社。
2005,89 胺的N-酰化 19NHCH 3CClO ClCH 2COCl C 6H 12N CClO COCH 2Cl CH 3地西泮尤启冬。
药物化学。
化学工业出版社。
2005,114 胺的N-酰化 20F+ClClO3FClO氟哌啶醇尤启冬。
药物化学。
化学工业出版社。
2005,139 苯环的C-酰化 21OHAC 2OOHCOCH 3对乙酰氨基酚尤启冬。
药物化学。
化学工业出版社。
2005,176 苯环的C-酰化 22OHOH O +H 3COCH 3OO H SO O OHOOCH 3阿司匹林尤启冬。
药物化学。
化学工业出版社。
2005,179 酚的O-酰化 23H 3CONHNHSO 3NaClCOClN H 3COC NHO SO 3Na Cl吲哚美辛尤启冬。
药物化学。
化学工业出版社。
2005,187 胺的N-酰化 24N HClCl ClCH 2COClNO ClCl双氯芬酸钠尤启冬。
药物化学。
化学工业出版社。
2005,189 胺的N-酰化和苯环的C-烃化 25H 3CCH 3CH COCl 3H 3CCH 3CH 3O布洛芬尤启冬。
药物化学。
化学工业出版社。
2005,192 苯环的C-酰化 26H 3COCH 3CH 2COClAlCl 3H 3COCH 3O萘普生尤启冬。
药物化学。
化学工业出版社。
2005,193 芳环的C-酰化 27HO HOPOCl 3,ClCH 2COOHHO HOCCH 2ClO肾上腺素尤启冬。
药物化学。
化学工业出版社。
2005,240 苯的C-酰化 28H 3CSClO CH 3O H NOHOH 3CSNOCH 3OOHO卡托普利尤启冬。
药物化学。
化学工业出版社。
2005,283 胺的N-酰化 29、HC CHClClO 3ClClO替卡西林Tetrahydro,1984,70: 1555-1558 炔烃的碳酰化 30、N S NH 2OOOOC 2H 5OH HNS N HOO胺磺噻唑胺Bombas L. J Am Chem Soc. 1945,67,671 氮原子上的酰化反应 31、 SO O OSOCH 3COOH头孢西丁,头孢三唑Hartough H B, et al. J Am Chem Soc,1947,69:1102 碳原子上的酰化反应 32、 OO O OOOCH 3COOHH 3PO 4头孢呋辛,头孢呋辛酯Howard D,et al. J Am Chem Soc,1947,69:3093 碳原子上的酰化反应33、合成新型头孢菌素中间体3-乙酰基-2-咪唑烷酮-1-甲酰氯的合成 1)光气法NH NO TMSClNNNO OOTMS N ClTMSClNNO OTMS ClClO NNO OCOCl2)双光气法NH NO OClOO NNO OCOCl 2N22N2HCl3)光气法NH N O OCl 3ONNO OCOCl 3O 3HClCCl 3O 3苏为科。
3-取代基-1-氯甲酰基-2-咪唑烷酮,系列产品合成的研究报告。
杭州浙江大学,1995 Kong H B,Schrock W, Metzger K G .GB1392850 Michael P,et al. EP3992,1979 .33、COOHSOCl 23O盐酸塞庚啶尤启冬。
药物化学。
化学工业出版社。
2005,362 苯的C-酰化34、西维菌杀虫剂的合成OHCoCl 2NaOH TolOClO22NaOHO N HOHaynes, et al.,Contrib.Boye Thompson Inst.,1957,18,507 (1)氧原子上的酰化反应,酚的O-酰化 (2)氮原子上的酰化反应35、卡马西平的合成N HCOCl 2TolN 2ClO N ClOBr-HBrN ClO3C 2H 5OHN NH 2ODavis,M.A.et al.,J.Med.Chem.1964,7,88(1)氮原子上的酰化反应,光气为酰化剂 36、COOH H 2NNH 2I I I32COOHNHNH III OO泛影酸诊断用药J.Am.Chem.Soc.,1956,78,3210氮原子上的酰化反应,醋酐为酰化剂 37、N N HOEt 2NClO N N OO吡喹酮尤启冬。
药物化学。
化学工业出版社。
2005,395 胺的N-酰化 38Cl Cl F3CH 3COCl F ClCl C OCH 3环丙沙星尤启冬。
药物化学。
化学工业出版社。
2005,421 苯的C-酰化 39OHAlCl 3HOO枸橼酸氯米芬尤启冬。
药物化学。
化学工业出版社。
2005,565 苯的C-酰化 40 OO 2NHC CHCOOHPCl 5OO 2NHC CHCOCl呋喃丙胺王汝龙,原正平。
化工产品手册-药物。
化学工业出版社。
2005,190 羧羟基卤置换反应 41NH 2COOH2NHCOCH 3COOH甲喹酮王汝龙,原正平。
化工产品手册-药物。
化学工业出版社。
2005,270 胺的N-酰化,以酸酐为酰化剂42、氧原子的酰化反应 醇的氧酰化 羧酸为酰化剂 镇痛药盐酸呱替啶的合成CH 3OH/C 6H 6/△HCl(gas)NHO ON OOHCl闻韧,药物合成反应,化学工业出版社。
115 43、氧原子的酰化反应 醇的氧酰化 羧酸为酰化剂 局部麻醉药盐酸普鲁卡因的合成HOCH 2CH 2N(C 2H 5)2/二甲苯HCl(gas)45℃,2hOHO O 2NOO O 2NNOOO 2NNHCl闻韧,药物合成反应,化学工业出版社。
11544、氧原子的酰化反应 醇的氧酰化 羧酸酯为酰化剂 局麻药丁卡因C 2H 5ONa △N HOO HONN HOO NC 2H 5OH闻韧,药物合成反应,化学工业出版社。
118 45、氧原子的酰化反应 醇的氧酰化 羧酸酯为酰化剂32CH Br60-80℃,45minO COH ONHOO COH ONO COH ONBr 77%闻韧,药物合成反应,化学工业出版社。
118 46、氧原子的酰化反应 醇的氧酰化 羧酸酯为酰化剂 抗胆碱药格隆溴胺(胃长宁)的合成Na 3·BrOHOONOHOH OONOHO O N闻韧,药物合成反应,化学工业出版社。
11947、氧原子的酰化反应 醇的氧酰化 酸酐为酰化剂 镇痛药阿法罗定(安那度尔)的合成①(C 2H 5CO)2O/Py/△OH N·HClON OO闻韧,药物合成反应,化学工业出版社。
120 48、氮原子上的酰化反应 脂肪氨-N 酰化 羧酸为酰化剂消炎痛ClCOCl +N HH 3COCH 2COOHCH 3N H 3COCH 2COOH CH 3ClCO闻韧,药物合成反应,化学工业出版社。
13549、氮原子上的酰化反应 脂肪氨-N 酰化 羧酸酯为酰化剂 巴比妥类通用方法H 2NC H 2NO R'R C COOEt +NH C C C NH C R R OO O '闻韧,药物合成反应,化学工业出版社。
13650、氮原子上的酰化反应 脂肪氨-N 酰化 羧酸酯为酰化剂 舒比利H 2NO 2SOCH 3C ONO 2NO 2O N H 2CH 2N C 2H 5+H 2NO 2SOCH 3C O N H 2CH NC 2H 5闻韧,药物合成反应,化学工业出版社。
136 51、醇的酰化羧酸为酰化剂 镇痛药盐酸呱替啶的合成 52、醇的酰化羧酸为酰化剂局部麻醉药盐酸普鲁卡因的合成CH 3OH/C 6H 6/△HCl(gas)N COOH N CO 2Et HCl(gas)Fe/HCl 45℃,2hO 2NCOOH 22252O 2N OO NH 2NO ON53、醇的酰化羧酸酯为酰化剂 丁卡因54、醇的酰化羧酸酯为酰化剂抗胆碱药溴美喷酯(宁胃适)的合成55、醇的酰化酸酐为酰化剂镇痛药阿法罗定(安那度尔)的合成56、氮原子上的酰化反应羧酸酯为酰化剂 巴比妥类药物合成通法 57、碳原子上的酰化反应 羰基α位C-酰化 活性亚甲基化合物的C-酰化HOCH 2CH 2N(C 2H 5)2C 2H 5ONa △t-BuHN O Ot-BuHN O O N Et Et CH CH ONa60-80℃,45min (77%)HO O O+NHO HO O ONMeBr HO O ON BrN OH CH 3CH 3①(C 2H 5CO)2O/Py/△②HCl(gas)N OCOC 2H 5CH 3CH 3·HClH 2N NH 2O R'RCOOEt COOEt +NH R R O O O'氯苯乙酮(氯喘定的合成中间体)的制备58、碳原子上的酰化反应 羰基α位C-酰化 酮及羧酸衍生物的α-C 酰化 苯基丙二酸二乙酯(苯巴比妥中间体)的合成59、扑热息痛(对羟基乙酰苯胺)的合成(一种解热镇痛药),其制备经过乙酰基化反应60、OHOHCOCH 3苯环上的酰化,F-C 酰化反应 普罗帕酮王汝龙,原正平。
