第三篇(第十四章)非均相化学反应器.
环境工程原理教学大纲
《环境工程原理》教学大纲一、基本信息二、教学目标及任务《环境工程原理》是环境工程专业的重要专业基础课,该课程的主要任务是系统、深入地阐述环境污染控制工程,即水质净化与水污染控制工程、大气污染控制工程、固体废物处理与处置及资源化工程,以及其他污染控制工程中涉及的具有共性的工程学基础基本过程和现象,以及污染控制装置的基本原理。
通过本课程的学习应使学生能掌握物料与能量衡算、传热、传质、沉降、离心、过滤、吸收、吸附的基本原理和基本计算,掌握化学与生物反应动力学、各类化学及生化反应器理论,为后续专业课程的学习奠定基础。
课程学习结束后,学生应达到以下要求:①掌握环境工程学的基本概念和基本理论:主要包括物料与能量衡算、流体流动、热量传递和质量传递过程的基本概念和基本理论;②掌握分离过程的原理:主要包括沉淀、过滤、吸收、吸附、离子交换、膜分离等基本分离过程的原理;③掌握反应工程原理:主要包括化学与生物反应计量学及动力学,各类化学与生物反应器的解析与基本设计理论等。
本课程支撑环境工程专业毕业要求1、2、3、4、5、6和12。
三、学时分配四、教学内容及教学要求第一章绪论1.环境问题与环境学科的发展2.环境污染与环境工程学3.污染控制技术体系,包括水污染控制技术体系大气污染控制技术体系固体废物处理处置技术体系等。
4.污染控制技术原理的基本类型5.环境工程原理课程的主要内容本章重点、难点:环境污染与环境工程学;环境工程原理课程的主要内容本章教学要求:了解环境问题与环境学科的发展;了解环境工程学的学科体系;了解环境净化与污染控制的基本方法与原理;了解环境工程原理课程的主要内容及学习方法。
第二章质量与能量衡算第一节常用物理量1.计量单位2.物理量的单位换算3.量纲和无量纲准数4.常用物理量及其表示方法习题要点:物理量的单位换算;各种浓度的相互换算第二节质量衡算1.质量衡算的基本概念2.总质量衡算习题要点:质量衡算第三节能量衡算1.能量衡算方程2.热量衡算方程3.封闭系统的热量衡算4.开放系统的热量衡算习题要点:各类能量衡算本章重点、难点:计量单位、物理量的单位换算、量纲和无量纲准数、常用物理量及其表示方法。
化学反应中的非均相反应及其机理研究

化学反应中的非均相反应及其机理研究化学反应是指化学物质之间发生化学变化的过程,而非均相反应则是其中一种重要的类型。
在一个非均相反应中,反应物和反应产物之间的差别较大,有时也伴随着明显的相变。
这篇文章将介绍一些非均相反应及其机理研究的相关内容。
1.非均相反应概述非均相反应是化学反应的一种类型,通常发生在两种或多种反应物的不同相之间的界面上,例如在气体与固体、液体与固体等各种不同相之间的交界处。
这种反应的主要特点在于,其反应速率取决于物质之间的接触面积。
比如,在铁和氧气之间的反应中,铁表面的氧化速率对反应速度有着很大的影响。
2.固体-气体反应固体表面的反应是几乎所有非均相反应的基础。
在固体和气体之间的反应中,反应发生在气体分子与固体表面之间的接触界面上。
例如,氧气分子与锌表面接触会迅速导致氧化锌的形成。
反应的速率由气态反应物与固体表面之间的接触面积、反应物的分子构型、反应物与表面之间的热力学相容性等因素共同决定。
目前广泛的研究表明,固体-气体界面上的非均相反应之一的主要驱动力是固体表面的活性位点和形态。
创造具有多孔度的晶体、涂覆纳米颗粒、涂覆催化剂等方法,能够调节表面形态和活性位点浓度,能够有效地提高反应速率、固体表面积和反应速率的限制性因素。
3.液态反应液-液和气-液的反应路径被广泛使用在许多工业应用和环境污染治理中。
一些环境重金属元素会从土壤中溶解到地下水和水中。
处理这些重金属元素的常规方法是用氧气从液态中滤除它们。
在液态反应中,反应物的分子结构和反应环境(例如溶剂和离子浓度)对反应速率有重要的影响。
液-液反应通常被认为是缓慢的反应,需要额外的能量才能触发。
此类反应在化学药品制造和性质改变的工艺中具有广泛的应用。
4.气态反应气-气反应包括气体之间的化学交互和气体在固体表面上的表现。
例如,燃烧是气-气反应的例子,其中燃料和氧气之间的反应需要分子之间的相互作用及其之间的能量和反应路径。
此外,气-气界面上的反应也被大量研究,例如硫酸气和水蒸气之间的反应会导致硫酸在雾形或气态的形式下形成。
反应工程原理

第一节 反应器与反应操作
③空间时间(空时、空塔接触时间)(space time) 反应器有效体积(V)与物料体积流量(qv)之比值。 空间时间
V / qV
(11.1.1)
注意: • 具有时间的单位,但不是反应时间也不是接触时间 • 可视为处理与反应器体积相同的物料所需要的时间。 τ=30s 表示了什么? 每30s处理与反应器有效体积相等的流体
反应量 -rAV
qnA0 qV cA0
浓度cA,cB 体积V
第一节 反应器与反应操作
(四)有关反应器操作的几个工程概念 ①反应持续时间 (reaction time): 简称反应时间,主 要用于间歇反应器,指达到一定反应程度所需的时 间。 ②停留时间 (retention time): 亦称接触时间,指连续 操作中一物料“微元”从反应器入口到出口经历的实 际时间。 平均停留时间:在实际的反应器中,各物料“微元” 的停留时间不尽相同,存在一个分布,即停留时间分 布。各“微元”的停留时间的平均称平均停留时间。
第III篇 反应工程原理
将化学和生物反应原理应用于污染控制工程, 需要借助适宜的装置,即反应器来实现。 系统掌握反应器的基本类型及其操作原理和设 计计算方法,对于优化反应器的结构型式、操作方 式和工艺条件,提高污染物去除效率有重要意义。 本篇主要阐述化学与生物反应的计量学、 动力学及其研究方法,环境工程中常用的各类 化学和生物反应器及其基本设计计算方法等。
第一节 反应器与反应操作
四、反应器内反应物的流动与混合状态
在实际的反应器中,一般存在浓度、温度和流速的分布,从 而可能造成不同的“流团”间有不同的停留时间、组分、浓度和 反应速率。(例子:同时进场以班为单位顺序出场;跳球抽号机) 返混(back mixing): 处于不同停留时间的“流团”间的混合称返混。 混合后形成的新“流团”的组分和浓度与原来的“流团” 不同,反应速率亦可能随之发生变化,这将影响整个反应器 的反应特性。
化工原理 第三章 非均相物系的分离PPT课件

层流
24
u
d2( s
)g
R et
t
18
试差法:假设 流型
选择 公式
计算
ut
计算
Re t
验算 Ret<1 ?
例:求直径40μm球形颗粒在30℃大气中的自由沉降 速度。已知ρ颗粒为2600kg/m3,大气压为0.1MPa。
解: 查30℃、0.1MPa空气: 1.16k5gm3
设为Байду номын сангаас流,则:
1.8 61 0 5Pa s
9 28/ 0.295 0.01
筛孔尺寸 d, μm
1.981(9号) 1.651(10号) 1.397 (12号) 1.168 (14号) 0.991 (16号) 0.833 (20号) 0.701 (24号) 0.589 (28号) 0(无孔底盘)
筛过量质 量分数F
100 0.96 0.9 0.66 0.44 0.19 0.03 0.01
多层降尘室
清洁气流
挡板
隔板
含尘气流
降尘室的生产能力:VsNbLut
例:降尘室高2m,宽2m,长5m。气体流量为4m3/s, ρ为0.75kg/m3,μ为0.026cp。(1)求除尘的dc; (2)粒径 为40um的颗粒的回收百分率?(3)如欲回收直径为 15um的尘粒,降尘室应隔成多少层?
解:(1) V bLu
表面积 s=πd2
m2
比表面积 a=s/v=6/d 1/m
(2)非球形颗粒
①的体球积的当直量径直。径de:与非球形颗粒体积相等 de=(6vp/π)1/3
②的形表状面系积数与ψ该s :颗与粒非表球面形积颗之粒比体。积相等的球 ψs=s/sp
式中:vp为非球形颗粒的体积。 Sp为非球形颗粒的表面积。
反应器基础知识—化学反应器的类型
反应过程 进行的条件
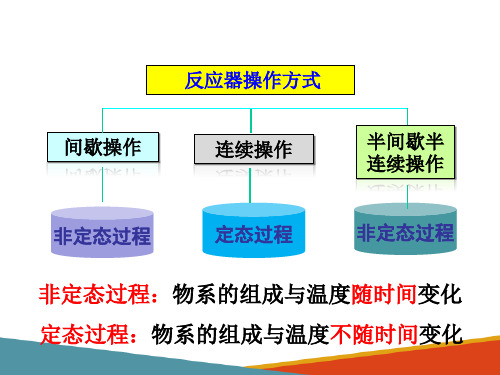
操作温度:等温反应、变温反应。 操作压力:常压反应、加压反应、减压反应。 操作方式:间歌式、连续式、半连续式。 旗热方式:自热式、对外换热式、绝执斗。
相的类别和数目
根据反应过程中所涉及的物料的相态可把反应分为均相反应和 非均相反应。 均相度应:指反应过程中只存在一个相态。如气相反应、液相 反应、固相反应。 均相反应:反应过程中不只存在一个相态。如气液相反应、液固相反应、气-液-固三相反应、气-固相反应。
反应速率除考虑温度、浓度等因素外,还与相间传质速率有关。
2. 按反应器结构分类 (a) 釜式反应器; (b)管式反应器; (c)固定床反应器; (d)流化床反应器; (e)塔式反应器:板式塔、填料塔、鼓泡塔、喷雾塔
实质是按传递过程的特征分类,相同结构反应器内物料具 有相同流动、混和、传质、传热等特征。
。
常见的工业反应器
均相间歇反应器
半间歇反应器
连续搅拌反应器组合
轴向填充床催化反应器
流化床催化反应器
一、化学反应类型:
化学反应类型
操作温度: 操作压力: 操作方式: 换热方式:
均相反应: 非均相反应:
反应特性
反应机理:简单反应(只发生一个化学反应)、复杂反应(不 只发生一个反应,如平行反应、连串反应、自催化反应)。 反应级数:零级反应、一级反应、二级反应、分数级反应等。 不同级数的反应,反应浓度对反应速率的贡献不同。 反应分子数:单分子反应、双分子反应、三分子反应等。 可逆性:可逆反应、不可逆反应。 热效应:吸热反应、放热反应。
均相: 气相:如石油烃管式裂解炉 液相: 如乙酸丁酯的生产
非均相: g-l相:如苯的烷基化 g-s相:如合成氨 l-l相:如已内酰胺缩合 l-s相:如离子交换 g-l-s相:如焦油加氢精制
环境工程原理总结2011.11

第I 篇环境工程原理基础第二章质量衡算与能量衡算第二节质量衡算◆质量衡算的三个要素:划定衡算系统;确定衡算对象;确定衡算基准;◆稳态系统和非稳态系统的特征当系统中流速、压力、密度等物理量只是位置的函数,不随时间变化,称稳态系统;当系统中流速、压力、密度等物理量不仅随位置变化,而且随时间变化,称非稳态系统。
◆质量衡算的基本关系式:见(2.2.4)p29第三节能量衡算◆封闭系统和开放系统封闭系统:与环境没有物质交换的系统开放系统:与环境既有物质交换又有能量交换的系统第四章热量传递第一节热量传递的方式◆根据传热机理的不同,热的传递三种方式的特点1、热传导:条件:物体各部分之间无宏观运动机理:通过物质的分子、原子和电子的振动、位移和相互碰撞发生的热量传递过程。
在气态、液态和固态物质中都可以发生,但传递的方式和机理不同。
气体的热量传递方式:不规则热运动时相互碰撞固体的热量传递方式:两种方式:晶格振动、自由电子迁移液体的热量传递方式:分子振动、分子间的相互碰撞2、对流传热:流体中质点发生相对位移引起的热量传递过程,仅发生在液体和气体中。
对流与热传导的区别:流体质点的相对位移。
自然对流传热强制对流传热3、辐射传热:物体由于热的原因而发出辐射能的过程。
能量传递的同时又有能量的转化,不需要任何介质作媒介。
第二节热传导◆傅立叶定律的意义和适用条件意义:见(4.2.2)适用条件:平壁和圆管壁的稳态热传导◆多孔材料具有保温性能◆若采用两种导热系数不同的材料为管道保温,分析应如何布置效果最好。
第三节对流传热◆对流传热的机理、传热阻力的分布及强化传热的措施机理:流体中质点发生相对位移引起的热量传递过程,仅发生在液体和气体中。
传热阻力的分布:层流底层(热传导)、缓冲层(热传导、对流传热)、湍流中心(对流传热)强化传热的措施:减小层流底层◆影响对流传热的因素:物性特征;几何特征;流动特征◆保温层的临界直径和保温层的临界厚度。
什么情况下保温层厚度增加反而会使热损失加大(保温层外径小于临界直径)?保温层的临界直径由什么决定(导热系数与对流传热系数的比值)?◆间壁传热热阻包括哪几部分?若冷热流体分别为气体和液体,要强化换热过程,需在哪一侧采取措施?(1)两侧流体的对流传热热阻、污垢热阻、间壁导热热阻。
非均相反应

影响因素
除化学的结合能力以外,某些影响相同物质传递速率的物理因素,也影响非均相反应的总速率。这些因素如 下:
(1)界面面积大小。在某些情况下它和反应速率成正此。界面是由于粉碎固体、用喷嘴或搅拌器分散流体, 或在渗透过固体颗粒床时的分散作用所形成的。
(2)流体透过界面薄膜时的扩散速率。除受反应物的物料性质和系统的几何条件的影响外主要受到二相间的 相对流速、气相压强、其次也受系统的温度等的影响。
(1)机理(a)是气体分子G在表面的非反应性的可逆吸附。假设吸附符合简单的朗格缪尔(Langmuir)吸 附机理,则G分子的覆盖度将取决于G分子在大气中的分压P、温度和朗格缪尔平衡常数K。
(2)机理(b)代表了气体分子的可逆吸附和随后的表面反应,这种情况下,要考虑吸附的限制,由于反应 后与表面键合的生成物可能阻碍了活性位,反应会随之减弱。该机理主要应用于O3在有机物附着的烟炱表面的反 应,对矿物颗粒表面的反应也能适用。
(3)机理(c)代表了气体分子的可逆吸附和随后的表面反应,反应可能生成新的气相产物,同时表面的产 物进入颗粒物的体相中。该机理中,表面反应位得到再生,颗粒物的反应性将由其总体积决定,而不仅仅是表面 反应位。
(4)机理(d)代表气体分子吸附在矿物颗粒物表面的潮解液膜中,随后经过溶解、扩散进入液相并在液膜 中反应,反应可能生成新的气相产物。这种反应与气体分子在含有相似组成的液滴中的反应相似。
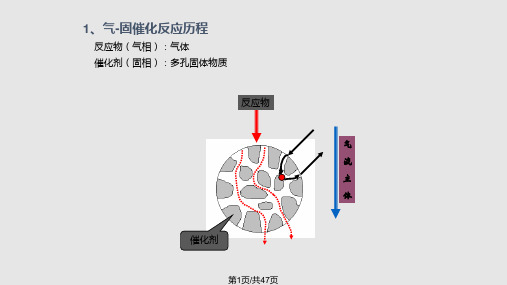
(5)机理(e)代表催化反应。该机理的反应能够连续地发生,表面不会达到体燃烧反应属于非均相化学反应。非均相反应涉及的物质存在不同的物态,即气液反 应或气固反应。整个多相催化反应过程可概括为以下七个步骤 :
(1)反应组分从流体主体向固体催化剂外表面传递; (2)反应组分从外表面向催化剂内表面传递; (3)反应组分在催化剂表面的活性中心上吸附; (4)在催化剂表面上进行化学反应; (5)反应产物在催化剂表面上脱附; (6)反应产物从催化剂内表面向外表面传递; (7)反应产物从催化剂的外表面向流体主体传递。 以上七个步骤中,(1)和(7)是气相主体通过气膜与颗粒外表面进行物质传递,称为外扩散过程;(2) 和(6)是颗粒内的传质,称为内扩散过程;(3)、(4)、(5)分别是在颗粒表面上进行吸附、化学反应、脱 附的过程统称为化学动力学过程。
环境工程原理习题集胡洪营版-完整答案

“十五”国家级规划教材《环境工程原理》配套教材环境工程原理习题集胡洪营黄霞张旭等编著高等教育出版社2006年8月内容提要本书是“十五”国家级规划教材《环境工程原理》的配套教材,内容包括习题解答、思考题和综合练习题3部分。
习题解答部分对《环境工程原理》教材中的习题进行了较为详细的解答,其主要目的是训练学生的基本设计计算能力并为学生自学提供参考;思考题部分的主要目的是加强学生对基本概念、基本原理和基本过程的理解;综合习题部分的主要目的是训练学生的知识综合应用能力和解决问题的能力。
本教材适用于环境工程、环境科学、给水排水工程以及其他相关专业本科生,也可作为相关专业研究生参考书。
前言《环境工程原理习题解答》是“十五”国家级规划教材《环境工程原理》的配套教材。
“环境工程原理”课程是教育部“高等学校环境工程教学指导委员会”规定的高等学校环境工程专业新的核心课程。
《环境工程原理》教材是与该课程配套的国内第一本本科教材,由清华大学从事“环境工程原理”课程教学的一线教师在讲义的基础上编写而成,已经于2005年8月由高等教育出版社正式出版。
“环境工程原理”课程自2003年在清华大学首次开设以来,开设该课程的院校逐步增加。
《环境工程原理习题解答》是为了适应日益增长的“环境工程原理”课程教学需要而编写的。
本教材适用于环境工程、环境科学、给水排水工程及其它相关专业本科生,也可作为研究生参考。
也可作为研究生考试的复习参考资料。
本教材的主要内容包括以下三部分,所用符号与《环境工程原理》教材相同:第一篇:《环境工程原理》教材各章后的习题解答(参考答案)第二篇:思考题第三篇:综合练习题本教材第一篇和第二篇的主要编写人员如下:第一章、第十一章~第十五章:胡洪营、吴乾元、王丽莎第二章~第五章:张旭、王灿、陆松柳第六章~第十章:黄霞、刘春第三篇的编写人员为:一、环境工程原理基础:张旭二、分离工程原理:黄霞三、反应工程原理:胡洪营高等教育出版社的陈文副编审、陈海柳编辑为该教材的出版付出了大量心血。
非均相反应动力学PPT课件
;若为化学反应,则为化学反应平衡式; (4)将(2)中所写的速率方程式中各项表面浓度利用(3)式中的
各平衡关系式转换成气相分压或浓度的函数; (5)若为均匀吸附模型,则由(4)可得到最终能够实际使用的动力
真
m V骨
空隙率:堆密度倒数与假密度倒数之差。
V空 1 1
m 堆 假
孔容或比孔容:假密度倒数与真密度倒数之差。
Vg
V孔 m
1
假
1
真
孔隙率:
P
V孔 V孔 V骨
1
假 真
假Vg
0.4 ~ 0.6
第18页/共47页
Vg
平均孔径:
rPdV
;
rP
0
Vg
如缺乏数据(孔径分布数据),可以用下式近似计算:r P
实际上,由于孔径存在分布,孔内两种类型扩散同时存在。
扩散系数的求取(包括:分子扩散和努森扩散) 费克(Fick)定律:沿Z方向上的一维扩散,扩散通量N(kg or mol.s1.m-2)与浓度梯度(也叫扩散推动力)成正比, 其比例常数即为扩散系数D
第20页/共47页
A、分子扩散系数的求取:
以A、B两组分混合物为例,则DAB:
定 态 法
dx 0
dt
第3页/共47页
Return
2、吸附等温方程式
吸附温度恒定后,则吸附量取决于吸附压力。 等温吸附模型包括:
Langmuir模型 Temkin模型 Freundlich模型 BET模型
(1)Langmuir型: 四个基本假定: I)表面均匀; II)单分子层吸附; III)被吸附分子互不影响,也不影响别的分子的吸附; IV)具有相同的吸附机理。
化学反应工程-14-第三章-均相非理想流动反应器

I是随所取样品的尺寸而改变的,单凭I不能完全反映混合状态。
混合尺度 用以说明调匀度是在何种尺度上测得。
①若在设备尺度上来考察,上图中两者都是均匀的,这时的状态 称为宏观均匀。
②若在微团尺度上,则两者具有不同的调匀度。 ③若在分子尺度上,两者都是不均匀的,只有微团消失,才 称为分子尺度的均匀或微观均匀。 结论:混合状态的度量由调匀度、混合尺度结合在一起共同描述的。
④对平推流,滴际混合对反应也没有影响。因为这时即使存在滴 际混合,在平推流情况下,这种混合只能是停留时间相同的物料 之间的混合,故不影响反应的总结果,而返混越大,滴际混合的 影响也越大;
⑤若整个反应过程转化率很低,则滴际混合的影响也很 小,转化率越高,滴际混合对反应过程的影响也越突出。
⑴液滴合并原因——界面张力
界面张力力图使液滴的表面积最小,抵抗任何变形和破碎。为
使液滴破碎,首先必须克服界面张力使液滴变形。界面张力是 搅拌过程的抗力。
⑵液滴破碎原理——绕流产生的不均匀压力和剪切力
当总体流动中存在高度湍动状态时,存在着方向迅速变换
的湍流脉动,液滴不能追随这种脉动而产生相对速度很大 的绕流运动。这种绕流运动,沿液滴表面产生不均匀的压 强分布和表面剪应力,从而将液滴压扁并破碎。
3.5 流体的混合态及其对化学反应的影响
问题的缘起:
对于两组分参加的化学反应,如果两组分未经预先混合而是
直接加入反应装置内,则它们在反应之前必需先发生混合。
对单一流体,同样存在着新鲜物料与反应器内已有的反应物 料之间的混合。
结论:
混合过程将直接影响反应组分在装置内的浓度,因而会影响
反应速率和反应效果。
3、流体混合态对反应结果的影响实例
⑴PFR中:
天津大学工业化学基础课件第三章第四节非均相反应器课件

三章第四节理想流动模型非均相反应器一 .催化剂及催化反应动力学二 .固定床催化反应器三 .流化床催化反应器四 .气-液反应器一.催化剂及催化反应动力学�1. 引言�2. 多相催化反应动力学�3. 工业催化剂的使用技术及再生4.1.1 引言�催化剂是能够加速化学反应速率,但本身能复原的物质.催化剂具有以下基本特征:�产生中间产物,改变反应途径,因而降低反应活化能和加速反应速率.�不能改变平衡状态和反应热,必然同时加速正反应和逆反应速率.�具有选择性,可使化学反应朝着期望反响进行,抑制不需要的副反应.� 1 .催化剂分类:�①均相催化: 催化剂和反应体系处于同一相中即为均相催化反应.催化剂与产物不易分离,产物后处理麻烦.4.1.1 引言②. 多相催化:反应在两相界面上进行称为多相催化。
例如:V 2O 5对SO 2氧化为SO 3的催化作用,Fe 对合成氨反应的催化 作用等,都属于多相催化。
此类催化反应在化工生产中居多数,由于催化剂很容易与反应物和产物分离,因而较为经济。
③. 生物催化:例如制药,制酒过程中的发酵均属于酶催化。
酶催化的特点是催化剂活性和选择性都非常高。
在化学工业中,多相催化剂应用最为广泛,使用最多的是 气-固催化反应。
4.1.1 引言2. 固体催化剂的主要组成及制备方法●固体催化剂一般由活性组分,助催化剂和载体组成。
主要起催化作用的是活性组分。
常用的催化剂活性组分是金属和金属氧化物,金属催化剂大多数采用载体,称为负载性催化剂。
●助催化剂在催化剂中的含量很少,它们对于反应没有活性或活性很小,但是加入到催化剂中后却能提高催化剂的活性,选择性和稳定性。
●催化剂载体主要作用是承载活性组分和助催化剂的分散剂,耦合物或支撑物,是负载活性组分的骨架,同时增大内表面积。
4.1.1 引言常用的载体多为氧化铝,二氧化硅,碳化硅,浮石,刚玉,活性炭,铁矾土,白土,氧化镁,硅胶,硅藻土,浮石分子筛等物质。
用作载体的物质应具有以下特性:①. 提供足够大的内表面积。
非均相化氧化-文档资料

6 醇的氧化
醇氧化制备相应的醛和酮
二、烯烃环氧化-乙烯催化氧化制备环氧乙烷 1 环氧乙烷的性质、用途、制备 环氧乙烷 最简单但最重要的环氧化合物
有毒、易爆 活性高 易自聚
用途 水解制备乙二醇-聚酯树脂和聚酯纤维的单体,防冻剂
制备表面活性剂 乙醇胺、乙二醇醚
环氧乙烷的制备 氯醇法 首先将乙烯和氯通入水中,生成2-氯乙醇
氧化产物 α-β不饱和醛, α-β不饱和酮, α-β不饱和酸和酸酐
α-β不饱和腈化物,二烯烃
烯丙基氧化产物的特性 氧化产物含不饱和键,可均聚、共聚
合成高分子化合物的原料
4 烯烃的乙酰氧基化反应
在钯催化剂存在下,烯烃或二烯烃与 醋酸和氧反应,直接在烯烃分子中引入乙 酰氧基,生成不饱和醋酸酯
5 芳烃的催化氧化
助剂 碱金属盐 碱土金属盐 稀土金属化合物
提高活性、增大稳定性、延长寿命
载体 负载、分散活性组分
提高稳定性 载体的结构(特别是孔结构)对助剂活性的发挥、选择性控 制有极大的影响 乙烯氧化制环氧乙烷 要求比表面积低、大孔为主
抑制剂 抑制非目标产物的形成 硒、碲、氯、溴等
催化剂的制备方法
粘结法、烧结法、浸渍法,… 或 各种方法的组合
然后把2-氯乙醇与Ca(OH)2反应生成环氧乙烷
评价:反应条件缓和,对原料乙烯纯度的要求也不高
消耗氯气、石灰,腐蚀性,废物处理难度大
乙烯非均相催化氧化直接生成环氧乙烷
2 乙烯催化氧化环氧化的反应
在银催化剂存在下,乙烯用空气或氧氧化,生成环氧乙烷,并生成 副产物二氧化碳、水
示踪原子研究结果:完全氧化产物二氧
化碳和水主要由乙烯直接氧化形成
反应的选择性取决于平行副反应的竞争
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
qnG1,YA1
rAL kc c
m n AL BL
四川农业大学 本科生课程 环工原理
根据边界条件:z=0,YA=YA1;Z=H, YA=YA2可求得H或出口处气体的浓度。
14/200
2.连续操作的鼓泡塔设计计算
假设气相在反应器内的流动为平推流,液相为全混流。 物料衡算式为:qnGI dYA
第十四章 非均相化学反应器
第一节 固相催化反应器(自学) 第二节 气-液相反应器
四川农业大学 本科生课程 环工原理
1/200
第二节 气-液相反应器
一、气液相反应
气膜
A( g ) B(l ) P
液膜
PAG
PA
液相主体
p 或 c
pAi
传质方向
CAi
气相主体 dz
cA
dG dL
cA
dc A dz dz
2.连续操作的鼓泡塔
四川农业大学 本科生课程 环工原理
13/200
1.半连续操作的鼓泡塔
YA2
A( g ) B B(l ) P
假设气相在反应器内的流动为平推流, dz z
YA+dYA H YA
液相为全混流。
qnGI dYA (rAL( ) 1 )dz
液相反应速率即 本征反应速率: 气含率,无量纲
填料塔
qnGI H pt
pA2
p A1
dpA (rAS ) i
qnGI H B ct
dcB cB 2 (rAS )i
cB1
11/200
四川农业大学 本科生课程 环工原理
P519例14.2.3
四川农业大学 本科生课程 环工原理
12/200
(三)鼓泡塔的设计计算
1.半连续操作的鼓泡塔
rA kc AcB
对液膜微元内的反应物A作物料衡算:
dc A d dc A 0 DLA (rA )dz [ DLA (c A dz )] dz dz dz
积累量 扩散进入量 反应量
2
扩散出去量
四川农业大学 本科生课程 环工原理
d cA DLA rA 2 dz
4/200
cB XB ct cB
H dz
0
Hห้องสมุดไป่ตู้
qnLI
B
X B2
X B1
dX B (rAS ) i
H
qnGI ct
B
dcB cB 2 (ct cB )2 (rAS )i
c B1
----以液相为基准
对稀薄气体和稀溶液,有:
pt p A pt ct cB ct
四川农业大学 本科生课程 环工原理
8/200
微元内的A损失量=微元内A反应量
qnG1, YA2 qnL, XB2
以相界面积为基准的反应速率
qnGI dYA (rAS )i dz
YA+dYA Z=H XB+dXB
dz
YA
YA XB
气相中A物质的量 A的分压 = 气相中惰性组分 I物质的量 I的分压
(rAS )i dz
H dz qnGI
0
H
YA 2
YA1
dYA (rAS ) i
式中:-rAS-以相界面积为基准的反应速率;
αi – 以液相体积为基准的比相界面积。
四川农业大学 本科生课程 环工原理
15/200
CA z
气液相 反应器 双膜模 型中组 分 A的 传质示 意图
2/200
距离
四川农业大学 本科生课程 环工原理
双膜模型
二、气液相反应动力学
传质 反应 传质控制 反应控制
四川农业大学 本科生课程 环工原理
3/200
(一)气液相反应的基本方程
对二级不可逆气液相反应
其本征反应速率方程为:
A( g ) B B(l ) P
对于二级反应,有
d cA DLA kcAcB 2 dz
对于组分B,同理可得
2
2
根据边界条件可求解得出 A组分在液膜中的浓度分 布方程:
cA f ( z)
DLB
d cB rB B (rA ) B kcAcB 2 dz
5/200
四川农业大学 本科生课程 环工原理
(二)不同类型气液相反应的宏观速率方程
H YA 2
H dz qnGI
0
qnL, XB1
YA1
dYA (rAS ) i
qnG1, YA1
H qnGI pt
pA2
p A1
dpA ( pt p) 2 (rAS ) i
----以气相为基准
同样,对液相组分B进行物料衡算,得:
qnLI dXB B (rAS )i dz
A( g ) B B(l ) P
瞬间反应 快速反应 中速反应
慢速反应
四川农业大学 本科生课程 环工原理
6/200
三、气液相反应器的设计
填料塔反应器的设计计算
塔径 填料层高度
四川农业大学 本科生课程 环工原理
7/200
假设反应
A( g ) B B(l ) P
为瞬间反应或快速反应,则在液相主体中A的浓度 为0,即CAL=0。 假设填料塔内气液相均为平推流
