中国科学院研究生院2009年无机化学考研真题
2015年中国科学院有机化学考研历年真题试题及答案2(2000-2009)共10套经典

2015年中国科学院有机化学考研
历年真题试题2(2000-2009)
(共10套)
目录
2000年中国科学院有机化学考研真题 (2)
2001年中国科学院有机化学考研真题 (5)
2002年中国科学院有机化学考研真题 (9)
2003年中国科学院有机化学考研真题 (17)
2004年中国科学院有机化学考研真题 (27)
2005年中国科学院有机化学考研真题 (33)
2006年中国科学院有机化学考研真题 (37)
2007年中国科学院有机化学考研真题 (45)
2008年中国科学院有机化学考研真题 (57)
2009年中国科学院有机化学考研真题 (61)
2000年中国科学院有机化学考研真题
2001年中国科学院有机化学考研真题
2002年中国科学院有机化学考研真题
2003年中国科学院有机化学考研真题
2004年中国科学院有机化学考研真题
2005年中国科学院有机化学考研真题
2006年中国科学院有机化学考研真题
2007年中国科学院有机化学考研真题。
(完整版)无机化学考研试题(含答案,已经整理好的)

一、单选题 第2章 热化学1、在下列反应中,Q p =Q v 的反应为( )(A )CaCO 3(s) →CaO(s)+CO 2(g) (B )N 2(g)+3H 2(g) →2NH 3(g)(C )C(s)+O 2(g) →CO 2(g) (D )2H 2(g)+O 2(g) →2H 2O (l )2、下列各反应的(298)值中,恰为化合物标准摩尔生成焓的是( ) (A )2H(g)+ O 2(g)→H 2O (l ) (B )2H 2(g)+O 2(g)→2H 2O (l )(C )N 2(g)+3H 2(g)→2NH 3(g) (D )N 2(g) +H 2(g)→NH 3(g)3、由下列数据确定CH 4(g)的为( ) C(石墨)+O 2(g)=CO 2(g) =-393.5kJ·mol -1H 2(g)+ O 2(g)=H 2O (l) =-285.8kJ·mol -1CH 4(g)+2O 2(g)=CO 2(g)+2H 2O (l ) =-890.3kJ·mol -1(A )211 kJ·mol -1; (B )-74.8kJ·mol -1;(C )890.3 kJ·mol -1; (D )缺条件,无法算。
4、已知:(1)C(s)+O 2(g)→CO(g), (1)= -110.5k J·mol -1(2)C(s)+O 2(g)→CO 2(g),(2)= -393.5k J·mol -1 则在标准状态下25℃时,1000L 的CO 的发热量是( )(A )504 k J·mol -1 (B )383 k J·mol -1 (C )22500 k J·mol -1 (D )1.16×104 k J·mol -15、某系统由A 态沿途径Ⅰ到B 态放热100J ,同时得到50J 的功;当系统由A 态沿途径Ⅱ到B 态做功80J 时,Q 为 ( )(A ) 70J (B ) 30J (C )-30J (D )-70J6、环境对系统作10kJ 的功,而系统失去5kJ 的热量给环境,则系统的内能变化为 ( )(A )-15kJ (B ) 5kJ (C ) -5kJ (D ) 15kJ7、表示CO 2生成热的反应是( )(A )CO (g )+ 1/2O 2(g )=CO 2(g )ΔrHmθ=-238.0kJ.mol-1(B )C (金刚石)+ O 2(g )=CO 2(g )ΔrHmθ=-395.4kJ.mol-1(C )2C (金刚石)+ 2O 2(g )=2CO 2(g )ΔrHmθ=-787.0kJ.mol-1(D )C (石墨)+ O 2(g )=CO 2(g )ΔrHmθ=-393.5kJ.mol-1二、填空题1、25℃下在恒容量热计中测得:1mol 液态C 6H 6完全燃烧生成液态H 2O 和气态CO 2时,放热3263.9kJ ,则△U 为-3263.9,若在恒压条件下,1mol 液态C 6H 6完全燃烧时的热效应为-3267.6。
中科院有机化学历年考研真题及答案 1985-2006年

中科院有机化学历年考研真题及答案 1985-2006年中科院有机化学历年真题目录年份1986 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 试题有有有有有有有有有有有有有有有有有有有答案有有有有有有有有有有有有本资料全部来源于网上希望大家能够共享欢迎补充、修订2006.5: . O Cl O G +中国科学院1986 年硕士学位研究生入学考试试题有机化学一,填充题(共 10 分,每个空框 1 分),写出下列合成步骤空框中的化学结构或反应条件(每个空框,可能有几种试剂) 1. Me Me OA B Me Me COOMe Me OC Me Me Me O2. D H N H Me Me Me NH 2I Hg(OAc)2 Me BF 3 Et 2O EtOH COOMe O N F E 155℃,2h 195℃,1.5h JMe Me Me N H HON O O 二,(共 20 分,每题 4 分)用常见试剂,完成下列合成 NHN H1. OHC COOH2.13CO 2 Cl Cl 13Ph C CH3.4.C SOS CHOMe 5. CH 3COCH 2CH 2CH 2COCH 3 Me 三,反应机理(共 12 分,每题 4 分): 1. 反应: PhCH 2Cl OHPhCH 2可能有两种机理,即:SN1 PhCH 2Cl slow PhCH 2H Hfast OH PhCH 2OH SN2 OHC Cl PhCH 2OH + Cl Ph请设计至少两个不同的实验,来确证这一反应是按哪种机理进行的 。
O O +BA (: 2. 解释反应机理:MeO MeCHCl 2Na 2CO 3,DMSO 85℃H O H Cl Me H3. 解释反应机理:OHCMet -BuOK t -BuOHH HO CMeO四,共 8 分,每个空框 2 分。
中科院2003-2009物化试题

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:物理化学(甲)考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
下列一些基本常数供解题时参考:普朗克常数h = 6.626 × 10-34 J·S;玻兹曼常数k B = 1.381× 10-23 J·K-1;摩尔气体常数R = 8.314 J·mol-1·K-1;法拉第常数F = 96500 C·mol-1一、是非题(每小题1分,共15分)(判断下列各题是否正确,正确用“√”表示,错误用“×”表示)1、气体的压力是在单位时间内撞击在单位表面上的分子所发生的动量的变化。
2、公式PVγ=常数,适用于理想气体的绝热可逆变化。
3、一定量的某实际气体,向真空中绝热膨胀以后,系统的P和V的乘积变小,温度降低,则此过程的ΔU < 0,ΔS > 0 。
4、将低沸点的A和高沸点的B两种纯液体组成液态完全互溶的气液平衡体系。
在一定温度下,将液体B加入体系中时,测得体系的压力增大,说明此系统具有最大正偏差。
5、水的三相点就是水的冰点。
6、溶剂服从拉乌尔定律、溶质服从亨利定律的溶液,称为理想稀溶液。
7、当反应A(s)→B(s)+D(g)达到化学平衡时,系统的自由度f = 3。
8、在合成氨反应中,惰性气体的存在不影响平衡常数,但影响平衡组成。
9、能量零点选择不同,则内能的值也不同。
10、无论是定位系统或非定位系统,最概然分布的公式是一样的。
11、对任一种有液接的浓差电池,加盐桥比不加盐桥的电动势大。
12、反应A + B = 2 C + 2 D 不可能是基元反应。
13、在同一温度下的同一基元反应,随着不同浓度单位,k (速率常数)有不同数值,从)exp()exp(RTH R S h T k k m r m r B θθ≠≠Δ−Δ=看,主要是因所取的标准态不同所引起的。
张祖德《无机化学》修订版辅导用书-名校考研真题-第9章 配位化合物【圣才出品】

心原子(或离子)键合而产生的异构现象。
11.下列配离子中,分裂能∆O 最大的是( )。[中国科学院 2009 研] A.[Cr(NH3)6]3+ B.[Co(NH3)6]3+ C.[Rh(NH3)6]3+ D.[Ir(NH3)6]3+ 【答案】D 【解析】相同配体,同一中心元素,高价离子比低价∆O 大;同一族,第三过渡系>第 二过渡系>第一过渡系。
8.在[ 5 -C5H5
3 Ni3
3 -CO
]Z
2
中,z 值为(Ni—Ni 之间存在单键)(
国科学院 2009、2010 研]
)。[中
A.-2
B.-1
C.0
D.+1
ቤተ መጻሕፍቲ ባይዱ
【答案】D
9.下列八面体配离子中,不属于变形八面体的是( )。[中国科学院 2009 研] A.Cr(H2O)62+ B.Mn(H2O)62+ C.Fe(H2O)62+ D.Co(H2O)62+ 【答案】B
12.下列物种中,金属 Fe 的氧化数为-1 的是(NO 以直线型与 Fe 连接)( )。 [中国科学院 2009 研]
A.Fe(CO)5 B.Fe(NO)2(CO)2 C.[Fe4(NO)7S3]-
5 / 18
圣才电子书
D.Fe(SCH3)2(NO)4
十万种考研考证电子书、题库视频学习平 台
相应的配离子为无色;其他情况下配离子都有颜色。A 项,为绿色;B 项,为无色;C 项,
为深蓝色;D 项,为黄色。
4.配合物[Ni(en)3]Cl2 中镍的价态和配位数分别是( )。[北京交通大学 2015 研] A.+2,3 B.+3,6 C.+2,6 D.+3,3 【答案】D 【解析】Cl 为-1 价,en 为乙二胺,电中性,故镍的价态为+2 价;乙二胺分子中含 有两个配位 N 原子,故[Ni(en)3]Cl2 的配位数为 3×2=6。
2009年中科院有机化学真题及答案 (1)
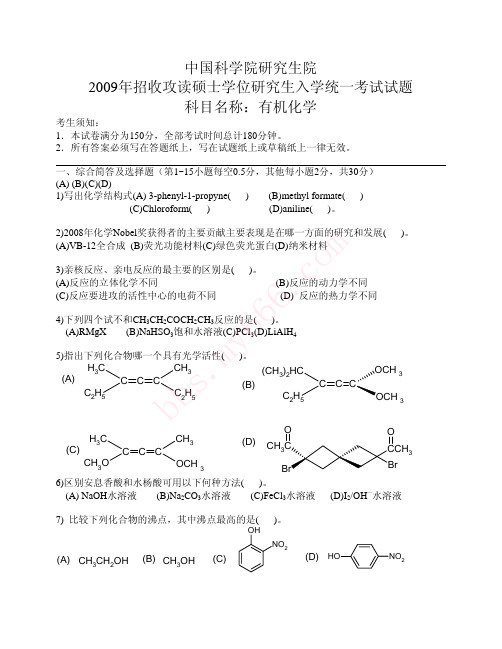
m 峰为 1740 cm-1,1.0 (3H,三重峰),1.3 (6H,双重峰),2.1 (2H,多重峰), co 4.2 (1H,三重峰),4.0 (4H,多重峰),推断该化合物的结构式,并指定谱图 . 各峰的归属。 666 3)(6 分)非环状某化合物A分子式为C7H12O2,其IR谱图在3000-170 y 0 cm-1处有吸收峰,UV于λ为200nm以上无吸收峰,在H2SO4存在下 m 加热得B和C,B和C互为异构体,分子式为C7H12O,B为主要产物,在 s. λ﹥258nm处有紫外吸收,而C在220nm处有紫外吸收,试推出A、B、 bb C的结构式。
1. A 的不饱和度=3,吸收 1mol 氢表明含一个双键、一个环和一个羰基
(1745); B 的氘交换表明有三个α氢;甲基在 A 中为单峰表明它连在双
键上,氢化后有一个相邻氢,所以 C 中为双峰;Baeyer-Villiger 氧化发生在
取代较多的一侧。各化合物的结构如下:
1745 CsH3
A
(A) CHO ( ) (B) CH=CH ( ) (C) OCH 3 ( ) (D) 苯上H ( )
二、写出下列反应的主要有机产物,或所需反应条件及原料或试剂(如有立体化学请注明) (每空2分,共30分)
1)
CH2 N
TsCl
CH2OH
Br
H
2)
Br Li
CuBr (
H3C
CH3
)
(
)
3)
O3
CH3SCH3
中科院历年考研试题及答案

中科院历年考研试题及答案模拟试题:中国科学院大学研究生入学考试模拟试题(自然科学类)一、选择题(每题2分,共20分)1. 下列关于原子结构的说法中,错误的是:A. 原子核由质子和中子组成B. 原子核几乎集中了原子所有质量C. 电子在原子核外以固定轨道运动D. 原子的化学性质主要由最外层电子数决定答案:C2. 根据热力学第一定律,下列说法正确的是:A. 能量守恒定律B. 能量可以无损失地完全转化为机械能C. 能量可以在不同形式之间转换,但总量不变D. 能量转换和传递的方向是不可逆的答案:C3. 在理想气体状态方程 PV = nRT 中,P、V、n、R、T 分别代表:A. 压力、体积、摩尔数、气体常数、温度B. 功率、速度、质量、电阻、时间C. 动量、体积、电荷数、辐射常数、温度D. 概率、体积、数量、相对论常数、时间答案:A4. 下列关于遗传的说法中,错误的是:A. 遗传信息存储在DNA分子中B. DNA分子由两条互补的链组成C. DNA分子中的碱基对只有A-T和C-G两种D. 基因突变一定会导致生物性状的改变答案:D5. 根据相对论,下列说法正确的是:A. 时间是绝对的,与观察者的运动状态无关B. 长度、时间和质量都会随着速度的增加而改变C. 光速在所有惯性参考系中都是相同的D. 物体的质量会随着速度的增加而减小答案:C6. 下列关于电磁波的说法中,错误的是:A. 电磁波可以在真空中传播B. 电磁波的传播速度等于光速C. 电磁波由变化的电场和磁场组成D. 电磁波的能量与频率成正比答案:D7. 在量子力学中,海森堡不确定性原理表明:A. 粒子的位置和动量可以同时准确测量B. 粒子的位置和动量不能同时准确测量C. 粒子的能量和时间可以同时准确测量D. 粒子的自旋和轨道角动量可以同时准确测量答案:B8. 下列关于化学反应速率的说法中,错误的是:A. 升高温度可以加快化学反应速率B. 增加反应物浓度可以加快化学反应速率C. 催化剂可以减慢化学反应速率D. 有气体参与的反应,增大压强可以加快反应速率答案:C9. 下列关于生态系统的说法中,错误的是:A. 生态系统中的物质循环是可逆的B. 生态系统中的能量流动是单向的C. 生态系统中的生物多样性对生态系统稳定性有重要作用D. 生态系统中的生物和非生物因素相互作用,共同维持生态平衡答案:A10. 下列关于地球自转和公转的说法中,错误的是:A. 地球自转产生昼夜更替B. 地球公转导致四季变化C. 地球自转和公转的方向都是自东向西D. 地球公转轨道是椭圆形的答案:C二、简答题(每题10分,共30分)11. 请简述牛顿第二定律的内容及其在物理学中的意义。
中科院1999-2009物化试题及答案

中科院1999-2009物化试题及答案一、1999年试题及答案1. 题目:计算下列反应在298K时的标准反应焓变:N2(g) + 3H2(g) → 2NH3(g)解答:首先,查找反应物和生成物的标准生成焓:N2(g): 0 kJ/molH2(g): 0 kJ/molNH3(g): -46.11 kJ/mol计算标准反应焓变:ΔH° = ΣΔHf°(生成物) - ΣΔHf°(反应物)= [2(-46.11) - (0 + 3×0)] kJ/mol= -92.22 kJ/mol2. 题目:根据下列反应的平衡常数K,计算反应的平衡常数Kp:N2(g) + 3H2(g) ⇌ 2NH3(g) K = 6.0×10^5解答:首先,根据K和Kp的关系:Kp = K(RT)^Δn其中,Δn为反应物和生成物的气体分子数之差,R为气体常数,T为温度。
对于该反应,Δn = 2 - 4 = -2。
代入数据计算Kp:Kp = 6.0×10^5 × (8.31×298)^(-2)≈ 1.2×10^(-4)二、2003年试题及答案1. 题目:某反应的活化能为100 kJ/mol,求在298K时的反应速率常数k。
解答:根据Arrhenius方程:k = A × e^(-Ea/RT)其中,A为指前因子,Ea为活化能,R为气体常数,T 为温度。
由于题目未给出指前因子,我们假设A=1。
代入数据计算k:k = e^(-100000/(8.31×298))≈ 3.7×10^(-17) s^-12. 题目:某电化学反应的电极反应为:Ag(s) + Cl^-(aq) → AgCl(s) + e^-当AgCl(s)的溶解度为1.56×10^-5 mol/L时,求AgCl(s)的溶度积Ksp。
解答:根据溶度积的定义:Ksp = [Ag^+][Cl^-]由于AgCl(s)的溶解度为1.56×10^-5 mol/L,因此[Ag^+] = [Cl^-] = 1.56×10^-5 mol/L。
中科院、中科大分析化学考研试题及答案汇编

(A)(1)、(2)和(3)
(B)(2)和(3)
(C)(1)、(2)、(3)和(4)
(D)(1)、(2)和(4)
20. 沉淀中包夹沉淀剂时,提高沉淀纯度的有效方法是 (A)稀沉淀剂多次洗涤 (B)陈化 (C)重结晶 (D)蒸馏水多次洗涤
二、填充题(共 30 分)
1. (本题 2 分)配制还原 Fe3+用 15%SnCl2 溶液时,正确的操作是_________。
是
(A)碱性条件下加 KCN 掩蔽 (B)加入硫脲掩蔽 Cu2+,加入二酮肟掩蔽 Ni2+
(C)加 NaOH 掩蔽
(D)在酸性条件下,加入三乙醇胺,再调到碱性
9. 当参与反应的两电对的电子转移数均为 2 时,为使反应完全度不小于 99.9%,两电
对的条件电位至少应大于
(A)0.09V (B)0.18V
6. 下列物质中,可以作为基准物质用来标定 KMnO4 浓度的是
(A)Na2CO3
(B)Na2C2O4 (C)KHC8H4ml 开始,原因是
(A)滴定时从 0.00ml 开始
(B)可减小称量误差
(C)避免体积读数的累积误差 (D)操作方便
8. 用 EDTA 法测定 Ca2+、Mg2+,若溶液中存在少量 Cu2+和 Ni2+离子,消除干扰的方法
分析化学
一、选择题(每小题 2 分,共 40 分)
1. 用部分失水的硼砂(Na2B4O7·10H2O)作基准标定 HCl,再使用此 HCl 作为标准溶
液测定 Na2CO3 含量。则 Na2CO3 测定结果较实际含量
(A)偏高
(B)偏低
(C)无法确定
(D)无影响
2. 在酸碱滴定中,总是选择强酸强碱作为滴定剂的原因是
张祖德《无机化学》修订版辅导用书-名校考研真题-第3章 酸碱理论与电离平衡【圣才出品】

8.下列各组酸的酸性排序错误的是( A.HI>HBr>HCl>HF B.HClO4>H2SO4>H3PO4>H4SiO4 C.HNO3>HNO2 D.H5IO6>HIO4 【答案】D
6.HAc 在液氨和液态氢氟酸中分别是( A.强酸和强碱 B.强酸和弱碱 C.弱酸和弱碱 D.弱酸和强碱 【答案】B
)。[中南大学 2013 研]
7.考虑下面反应:AgCl(s)+2S2O32-(aq)→Ag(S2O3)23-(aq)+Cl-(aq)。在反应中 起 Lewis 酸和 Lewis 碱作用的是( )。[厦门大学 2012 研]
5 / 23
圣才电子书
十万种考研考证电子书、题库视频学习平 台
2BrF3 ƒ BrF4-+BrF2+
(2)根据溶剂酸碱理论可知,在 BrF3 溶剂中,能电离出 BrF4-的物质为碱,能电离
出 BrF2+的物质为酸。BrF2AsF6 在该溶剂中
BrF2AsF6 ƒ BrF2++AsF6-
)。[华南理工大学 2016 研]
3.将浓度均为 0.1mol·L-1 的下列溶液稀释一倍,其 pH 基本不变的是( 南理工大学 2016 研]
A.NH4Cl B.NaF C.NH4Ac D.(NH4)2SO4 【答案】C
)。[华
4.下列物质的水解产物中既有酸又有碱的是( A.Mg3N2 B.SbCl5 C.POCl3 D.NCl3
所以在 BrF3 溶液中 BrF2AsF6 的行为是酸。
2.试解释为何 H2S 水溶液的酸性比水强,液体 H2S 却比水难电离?[武汉大学 2013 研]
中科院、中科大1997-2012年分析化学考研试题及答案汇编

9. (本题 3 分)在螯合物萃取体系中,影响其萃取效率的因素有_____、_____和____。
(A)(1)、(2)和(3)
(B)(2)和(3)
(C)(1)、(2)、(3)和(4)
(D)(1)、(2)和(4)
20. 沉淀中包夹沉淀剂时,提高沉淀纯度的有效方法是 (A)稀沉淀剂多次洗涤 (B)陈化 (C)重结晶 (D)蒸馏水多次洗涤
二、填充题(共 30 分)
1. (本题 2 分)配制还原 Fe3+用 15%SnCl2 溶液时,正确的操作是_________。
和 0.0010mol/L 硼酸(H3BO3)混合溶液,请计算 1) 滴定一氯乙酸至化学计量点时溶液的 pH 值?应选用何种指示剂?
2) 化学计量点时硼酸反应的百分率?
3) 滴定至 pH=7.60 时的终点误差。(HChl pKa=2.86,H3BO3 pKa=9.24)
指示剂
甲基橙
甲基红 溴百酚蓝 甲酚红
3.(本题 15 分)某同学先用 Na2CO3 标定 HCl 浓度,再以甲基橙为指示剂,用此 HCl 测定未知碱(NaOH)的含量,得到下列数据(mol·L-1):0.1020, 0.1022, 0.1015, 0.1024, 0.1016, 0.1021, 0.1020, 0.1028。如果试样的标准值为 0.1015mol·L-(1 置信水平为 95%)。
酚酞
变化范围(pH 值) 3.1~4.4 4.4~6.2 6.2~7.6 7.2~8.8 8.0~10.0
无机化学考研试题含答案已经整理好的

如有帮助欢迎下载支持一、单选题 第2章 热化学1、在下列反应中,Q p =Q v 的反应为( )(A )CaCO 3(s) →CaO(s)+CO 2(g) (B )N 2(g)+3H 2(g) →2NH 3(g)(C )C(s)+O 2(g) →CO 2(g) (D )2H 2(g)+O 2(g) →2H 2O (l )2、下列各反应的(298)值中,恰为化合物标准摩尔生成焓的是( )(A )2H(g)+ O 2(g)→H 2O (l ) (B )2H 2(g)+O 2(g)→2H 2O (l )(C )N 2(g)+3H 2(g)→2NH 3(g) (D )N 2(g) +H 2(g)→NH 3(g) 3、由下列数据确定CH 4(g)的为( )C(石墨)+O 2(g)=CO 2(g) =-393.5kJ·mol -1H 2(g)+ O 2(g)=H 2O (l) =-285.8kJ·mol -1CH 4(g)+2O 2(g)=CO 2(g)+2H 2O (l ) =-890.3kJ·mol -1 (A )211 kJ·mol -1; (B )-74.8kJ·mol -1;(C )890.3 kJ·mol -1; (D )缺条件,无法算。
4、已知:(1)C(s)+O 2(g)→CO(g), (1)= -110.5k J·mol -1(2)C(s)+O 2(g)→CO 2(g), (2)=-393.5k J·mol -1 则在标准状态下25℃时,1000L 的CO 的发热量是( )(A )504 k J·mol -1 (B )383 k J·mol -1 (C )22500 k J·mol -1 (D )1.16×104 k J·mol -15、某系统由A 态沿途径Ⅰ到B 态放热100J ,同时得到50J 的功;当系统由A 态沿途径Ⅱ到B 态做功80J 时,Q 为 ( )(A ) 70J (B ) 30J (C )-30J (D )-70J6、环境对系统作10kJ 的功,而系统失去5kJ 的热量给环境,则系统的内能变化为 ( )(A )-15kJ (B ) 5kJ (C ) -5kJ (D ) 15kJ7、表示CO 2生成热的反应是( )(A )CO (g )+ 1/2O 2(g )=CO 2(g )ΔrHmθ=-238.0kJ.mol-1(B )C (金刚石)+ O 2(g )=CO 2(g )ΔrHmθ=-395.4kJ.mol-1(C )2C (金刚石)+ 2O 2(g )=2CO 2(g )ΔrHmθ=-787.0kJ.mol-1(D )C (石墨)+ O 2(g )=CO 2(g )ΔrHmθ=-393.5kJ.mol-1二、填空题1、25℃下在恒容量热计中测得:1mol 液态C 6H 6完全燃烧生成液态H 2O 和气态CO 2时,放热3263.9kJ ,则△U 为-3263.9,若在恒压条件下,1mol 液态C 6H 6完全燃烧时的热效应为-3267.6。
2013年中国科学院大学无机化学考研试题

中国科学院中国科学院大学大学2013年招收攻读硕士学位研究生入学统一考试试题科目名称科目名称::无机化学考生须知考生须知::1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
一、选择题选择题 (以下各小题所列答案中只有一个是正确的以下各小题所列答案中只有一个是正确的。
共20小题,每小题2分,共40分。
)1. 下列物质的水溶液易变成黄色的是:(A) AgNO 3 (B) HBr (C) Na 2S (D) NH 4SCN2. 下列各元素中,第一电子亲和势代数值(A 1)最大的是:(A) Cl (B) Br (C) He (D) F3. 下列各物种中,属于N 2H 5+的共轭碱的是:(A) N 2H 4 (B) N 2H 5OH (C) N 2H 6+ (D) NH 34. Co 2+的价层电子构型是:(A) 3d 74s 2 (B) 3d 7 (C) 3d 54s 2 (D) 3d 105. 已知0.01 mol ·L −1某一元弱酸溶液的pH=4.55,则该弱酸的K a 为:(A) 7.95×10−8 (B) 8.59×10−7 (C) 5.79×10−2 (D) 9.75×10−36. 下列各组原子轨道中不能叠加成键的是:(A) p x -p x (B) p x -p y (C) s-p x (D) s-p z7. 某反应在标准状态和等温等压条件下,在任何温度都能自发进行的条件是:(A) ΔrH m Θ>0, ΔrS m Θ>0 (B) ΔrH m Θ<0, ΔrS m Θ<0(C) ΔrH m Θ>0, ΔrS m Θ<0 (D) ΔrH m Θ<0, ΔrS m Θ> 08. 反应N 2(气)+3 H 2 (气)=2 NH 3(气) ΔrH m Θ=−92 kJ ·mol −1,从热力学观点看要使 H 2(气)达到最大转化率,反应条件应该是:(A) 高温低压 (B) 低温低压 (C) 高温高压 (D) 低温高压9. 已知:ϕΘ(Cu 2+/ Cu)=+0.34 V ,ϕΘ(Cu +/ Cu)=+0.522 V , 那么ϕΘ(Cu 2+/ Cu +) 为:(A) +0.182 V (B) +0.158 V (C) +0.364 V (D) +0.862 V10. 在下面所列元素中,与氢能生成离子型氢化物的一类是:(A) 碱金属和钙、锶、钡 (B) 绝大多数活泼金属(C) 镧系金属元素(D) 过渡金属元素11. 互卤化物AX3中ClF3是最活泼的,但是液态BrF3导电性较好,原因是:(A) BrF3的摩尔质量大(B) BrF3较易挥发(C) BrF3较易解离为BrF2+、BrF4− (D) 导电性与浓度无关12. 干燥H2S气体,可选用的干燥剂是:(A) CuSO4(B) KOH (C) 浓H2SO4(D) P2O513. 叠氮酸的结构式是HN1=N2≡N3,1、2、3号氮原子采取的杂化类型分别为:(A) s p 3,s p,s p (B) s p 2,s p,s p(C) s p 3,s p,s p 2(D) s p 2,s p,s p 214.下列各元素的正三价离子的半径由大到小的正确排列顺序为:(A)Pm、Pr、Tb、Er (B) Pr、Pm、Er、Tb(C) Pr、Pm、Tb、Er (D) Pr、Tb、Pm、Er15. Au、Pt 分别与王水作用,关于其主要生成物,下列说法正确的是:(A) H[AuCl2]、H2[PtCl4],均有NO2(B) H[AuCl2]、H2[PtCl4],均有NO(C) H[AuCl4]、H2[PtCl6],均有NO2(D) H[AuCl4]、H2[PtCl6],均有NO16. 下列盐中,热稳定性顺序正确的是:(A) NaHCO3< BaCO3<Na2CO3(B) Na2CO3<NaHCO3< BaCO3(C) BaCO3<NaHCO3<Na2CO3(D) NaHCO3<Na2CO3< BaCO317. 在配体NH3,H2O,SCN−,CN−中,通常配位能力最强的是:(A) SCN− (B) NH3(C) H2O (D) CN−18. 下列有关硼酸的叙述中,正确的是:(A) 硼酸是三元路易斯酸(B) 硼酸在冷水中溶解度小,在热水中因部分氢键断裂而溶解度增大(C) 硼酸与多元醇发生酯化反应,产物的酸性减弱(D) 在硼酸中硼原子采取sp2和sp3杂化19. 21H+31H →42He+1n 此过程的反应类型是:(A) 裂变(B) 衰变(C) 聚变(D) 化合反应20. 在立方面心晶胞中,A原子占有顶点,B原子占有面心,X原子占有A、B 围成的所有四面体的空隙,则该化合物的化学式为:(A) ABX (B) AB2X4(C) AB3X8(D) AB3X4二、填空题( 共5小题,共30分)21.(每空每空1分)反应A+B→C的反应速率方程式为υ=k(c(A))1 / 2c(B)。
