配合物稳定常数
配合物的稳定常数

4—1、配合物的稳定常数 、 1.稳定常数 ------K f 稳定常数
Ag
+
θ
NH3H2O
Ag2O (黑褐色)
Cl -
这一实验结果 说明溶液中存在游 NH3H 离的Ag . 离的2O +Ag(NH3)2+
无 A gC l
+
I-
AgI
H 2S
Ag 2 S
既存在 Ag
[CN − ] = x = 3.47 × 10 −3 (mol ⋅ dm −3 )
2.50 × 0.40 = x2
解得: 解得: 显然AgI可以很好地 溶解在 溶解在KCN溶液中。 溶液中。 显然 溶液中 6.配位平衡与氧化还原平衡 配位平衡 ——计算形成配合物 ——计算形成配合物的衍生电极电势 [例9—12] 计算 例
0. 1 = 2 x
解得: 解得:
[Cu 2+ ] = 1.29 × 10 −10 (mol ⋅ dm −3 )
同理解得
0.10mol ⋅ dm −3Cu (en) 2+ 2
[Cu 2+ ] = 8.5 × 10 −8 mol ⋅ dm −3
显然稳定性: 显然稳定性
Cu(EDTA)2-﹥ Cu(en)22+
0.0591
因此
而K =
3+ 3 )6
3+ 2+ 3 ) 6 / Co ( NH 3 ) 6
= 0.056(V )
(2)假设 )假设Co(NH3)6 中与空气中的O 发生如下反应: 中与空气中的 2发生如下反应:
3、配位平衡 与电离平衡 、 θ θ − − − K θ 与K a 或K θ 与K b之间的关系 f f
分光光度法测的配合物的稳定常数

I I 0 e kcd
(6.2)
式中:K 为吸收系数,对于一定溶质、溶剂及一定波长的入射光 K 为常数,C 为溶液浓度, d 为盛样溶液的液槽的透光厚度。 由(6.2)式可得:
ln
I0 kcd I
(6.3)
I0 I k 称透射比 , 令 A lg 0 , 则得: A cd 。从公式可看出:在固定液槽厚度 d 和 I I 2 . 303
分光光度法测的配合物的稳定 常数
一、目的与要求
1.掌握连续法测定配合物组成及稳定常 数的方法; 2.掌握分光光度计的使用方法; 3.用分光光度法中的连续变化法测的 Fe+3与钛铁试剂形成配合物的组成及稳 定常数。
二、实验原理
溶液中金属离子M和配位体L形成配合物,其反 应式为: M nL MLn 当达到络合平衡时:
入射光波长的条件下,吸光度 A 与溶液浓度 c 成正比,选择入射光的波长,使它对物质既 有一定的灵敏度,又使溶液中其它物质的吸收干扰为最小。作吸光度 A 对被测物质 c 的关 系曲线,测定未知浓度物质的吸光度,即能从 A~c 关系上求得相应的浓度值,这是光度法 的定量分析的基础。
0.50 0.45 0.40 0.35
1. 分光光度法的实验原理: 让可见光中各种波长单色光分别、依次透过有机物或无机物的溶液,其中某些波长的 光即被吸收,使得透过的光形成吸收谱带。如图 П-6-1 所示,这种吸收谱带对于结构不同 的物质具有不同的特性,因而就可以对不同产物进行鉴定分析。 根据比尔定律,一定波长的入射光强 I0 与透射光强 I 之间的关系:
若溶液中只有配合物具有颜色,则溶液的吸光度 A 和的含量成正比,作 A-xV 图,从 曲线的极大值位置即可直接求出 n。但在配制成的溶液中除络合外,尚有金属离子 M 和配 体 L 与配合物在同一波长λ 最大 中也存在着一定程度的吸收。因此所观察到的吸光度 A 并 不是完全由配合物 MLn 吸收所引起,必须加以校正,其校正方法如下: 作为实验测得的吸光度 A 对溶液组成(包括金属离子浓度为零和配位体浓度为零两点)的 图,联结金属离子浓度为零及配位体浓度为零的二点的直线如图 П-6-3 所示,则直线上所 表示的不同组成吸光度数值 A0 ,可以认为是由于金属离子 M 和配位体 L 吸收所引起,因 此把实验所观察到的吸光度 A'减去对应组成上的该直线读得的吸光度数值 A0 所得的差 值:Δ A=A’-A0 ,就是该溶液组成下浓度的吸光度数值。作此吸光度Δ A-xV 曲线,如图 П-6-4 所示。曲线极大值所对应的溶液组成就是配合物组成。用这个方法测定配合物组成 时,必须在所选择的波长范围内只有 MLn 一种配合物有吸收,而金属离子 M 和配位体 L 等都不吸收和极少吸收, 只有在这种条件下, A-xV 曲线上的极大点所对应的组成才是所求 配合物组成。
配合物条件稳定常数计算公式

配合物条件稳定常数计算公式配合物是指两种或两种以上物质组成的化合物,其中包含有多种不同的原子或分子,通常表示为AXn的形式,其中A表示核心物质,X表示配体,n表示配体的数量。
配合物的稳定性取决于其条件稳定常数的大小,条件稳定常数(Condition Stability Constant,简称Kc)是指在一定温度下,配合物在平衡状态下,各组分浓度之比的乘积与平衡常数之比。
计算配合物条件稳定常数的公式如下:Kc = [AXn]c / ([A]c [X]c^n)其中,[AXn]c表示配合物浓度,[A]c表示核心物质浓度,[X]c表示配体浓度,n表示配体的数量。
例如,计算铁蓝蛋白(Fe(III)Tptz)的条件稳定常数:Fe(III)Tptz的结构式为Fe(III)(Tptz)3,则Kc = [Fe(III)(Tptz)3]c / ([Fe(III)]c [Tptz]c^3)如果[Fe(III)(Tptz)3]c = 0.1 mol/L,[Fe(III)]c = 0.2 mol/L,[Tptz]c = 0.3 mol/L,则Kc = 0.1 / (0.2 * (0.3^3)) = 0.025根据条件稳定常数的大小可以判断配合物的稳定性。
如果Kc大于1,则配合物相对稳定;如果Kc小于1,则配合物相对不稳定。
在实际应用中,条件稳定常数是一个很重要的指标,它可以用来表示配合物在特定条件下的稳定性,并且在化学反应平衡计算中也有着重要的应用。
例如,在配合物的合成过程中,如果想要获得稳定的配合物,就可以通过控制反应条件,使得条件稳定常数达到较大的值;如果想要解除配合物,就可以通过改变反应条件,使得条件稳定常数达到较小的值。
总之,配合物条件稳定常数是一个重要的指标,它可以用来表示配合物在特定条件下的稳定性,并且在化学反应平衡计算中也有着重要的应用。
第5章 配合物在溶液中的稳定性 27ye

CH3
以上两配体与Fe2+的配合能力就因空间位阻而不同。
问:以下三种配体与金属离子形成配离子的稳定性大小?
CH3
N
OH
N OH
CH3 OH
N
4.3 Lewis电子酸碱理论及硬软酸碱理论 (HSAB) 与配合物的稳定性
Lewis 电子酸碱理论是一个广泛的理论,它完全不考虑溶 剂。在Lewis酸碱反应中,一种粒子的电子对用来与另一种粒 子形成共价键。“供给”电子对的粒子是碱,而“接受”电 子对的粒子是酸。反应可以写成: A(酸) +:B(碱) A←:B 显然,路易斯酸应该有空的价轨道,这种轨道可以是轨道 ,也可以是轨道。而路易斯碱应该有多余的电子对,这些电 子可以是电子,也可以是电子: 右图示出Lewis酸碱 的可能轨道重叠,左 边是酸的空轨道的情 形(空轨道的情形未 画出)。
4.2 配离子在溶液中稳定性的一些规律
配离子稳定性的大小首先与其内因即组成配离子 的中心离子的性质、配体的性质以及中心离子与 配体之间的相互作用有关;
其次,外部因素如温度、压力及溶液中离子强度
等对配离子的稳定性也有一定的影响。本节我们 就影响配离子稳定性的因素做些讨论。
一、中心原子的结构和性质的影响
具体地说,硬酸中接受电子的原子较小、正电荷高,其价 电子轨道不易变形 (即硬酸是受体原子对外层电子的吸引力强 的酸)。 像Al3+离子以及BF3之类的化合物都是硬酸的例子。 软酸中接受电子的原子较大、正电荷数目低或者为0, 以易 变形的价电子轨道去接受电子 (即软酸是受体原子对外层电子 的吸引力弱的酸)。 金属原子、Hg2+离子及InCl3之类化合物即是典型的软酸。 硬碱和软碱可以按照同样的原理处理:
许多路易斯酸碱反应的实质是酸碱的传递反应: 如: B:+B’:→A = B:→A+:B’ (碱的置换) A+B:→A’ = B:→A+A’ (酸的置换) B:→A+B’:→A’ = B:→A’+B’:→A (酸碱同时传递)
27、何谓配合物的稳定常数

何谓配合物的稳定常数
在溶液中,金属离子M n+与配位剂Y 4
的配位反应如下:
M n+ + Y 4 ⇌ M Y n-4 当配位反应达到平衡时:K My =]
][[][44-+-Y M MY n n 式中:][4-n MY ——金属离子与EDTA 形成的配合物的浓度;
[Y 4-]——未配位的EDTA 阴离子的浓度;
[M n+
]——未配位的游离的金属离子的浓度。
K My 是配合物的稳定常数,也叫形成常数。
配合物的稳定常数越大,表示形成的配合物越稳定。
由于稳定常数只考虑了溶液中金属离子(M n+)、配位剂阴离子(Y 4)和配合物(MY n-4)三者之间的平衡关系,没有考虑酸度等因素对配位平衡的影响,因此,它不能说明配合物的实际稳定程度。
配合物的稳定常数的数值通常很大,为了方便,常用其对数值表示。
例如: 69.842210]
][[][2==-+--Y Mg MgY K MgY 69.8lg 2=-MgY。
配合物的稳定常数的测定

配合物的组成和不稳定常数的测定(物理化学 李俊)一、目的要求1. 掌握用分光光度法测定配合物组成及稳定常数的基本原理和方法。
2. 通过实验,掌握测量原理和分光光度计的使用方法, 二、实验原理1,用等摩尔连续递变法测定配合物的组成“递变法” 实际上是一种物理化学分析方法。
可用来研究当两个组分混合时, 是否发生化 合,配合,缔合等作用,以及测定两者之间的化学比。
其原理是 :在保持总浓度不变的前提 下,依次逐渐改变体系中两个组分的比值,并测定不同摩尔分数时的某一物理化学参量。
在本实验中就是测定不同摩尔分数时溶液的光密度值 D ,作光密度对摩尔分数的曲线 图,如图 3- 1,所示。
从曲线上光密度的极大值 D 极大所对应的摩尔分数值,即可求出配位数n 值。
为了配制溶浓时方便,通常取相同摩尔浓度的金属离子 M 溶液和配位体 L 溶液。
在维持总体积不变的条件下, 按不同的体积比配成一系列混合溶液。
这样体积比亦就是摩尔 分数之比。
若溶液中只有配合物 MLn 具有颜色,则溶液的 D 与 MLn 的含量成正比。
从 D-X 图上曲线 的极大位置即可直接求出 n ,但当配制成的溶液中除配合物外, 尚有金属离子 M 及配位体 L 与配合物在同一波长 λ最大 下也存在一定程度的吸收时,所观察到的光密度 D 并不完全由配 合物 MLn 的吸收所引起, 必须加以校正。
所以选择适当的波长范围, 仅使配合物设X L 为D极大时L 溶液的体积分数M 溶液的体积分数为 则配合物的配MLn 有吸收,M 和L 都不吸收或极少吸收。
2.配合物平衡常数的测定假定配合物中心离子浓度不变,而渐增加配位体浓度,随着配位体浓度的改变,中心离子被配成MLn ,溶液的光密度值 D 不断升高。
当中心离子被完全配合后,如继续增加配位体的浓度,则溶液的光密度值 D 趋于恒定,如图3-2。
设配合物在稀溶液中有如下解离平衡存在:最初浓度平衡浓度式中,n-配位数,已由实验确定;a-解离度:C-配合物未解离时的浓度(在本实验中亦为M 完全配合时的配合物浓度)。
配合物稳定常数

配合物稳定常数————————————————————————————————作者:————————————————————————————————日期:ﻩ配合物稳定常数Stability Constants of Coordination Compounds络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I ≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数Stability Constants ofMetalIon-InorganicCoordinationCompounds序号(No.) 配位体(Ligand)金属离子(Metalion)配位体数目n(Number of ligand)lgβn1NH3Ag+ 1,2 3.24,7.05Au3+ 4 10.3Cd2+1,2,3,4,5,6 2.65,4.75,6.19,7.12,6.80,5.14Co2+1,2,3,4,5,6 2.11,3.74,4.79,5.55,5.73,5.11Co3+1,2,3,4,5,6 6.7,14.0,20.1,25.7,30.8,35.2Cu+1,2 5.93,10.86Cu2+1,2,3,4,5 4.31,7.98,11.02,13.32,12.86Fe2+1,21.4,2.2Hg2+1,2,3,4 8.8,17.5,18.5,19.28Mn2+1,2 0.8,1.3Ni2+1,2,3,4,5,62.80,5.04,6.77,7.96,8.71,8.74Pd2+1,2,3,4 9.6,18.5,26.0,32.8Pt2+ 6 35.3Zn2+1,2,3,4 2.37,4.81,7.31,9.462 Br-Ag+1,2,3,4 4.38,7.33,8.00,8.73Bi3+1,2,3,4,5,6 2.37,4.20,5.90,7.30,8.20,8.30Cd2+1,2,3,4 1.75,2.34,3.32,3.70,Ce3+10.42Cu+ 2 5.89Cu2+10.30Hg2+1,2,3,49.05,17.32,19.74,21.00In3+1,2 1.30,1.88Pb2+1,2,3,4 1.77,2.60,3.00,2.30Pd2+1,2,3,4 5.17,9.42,12.70,14.90Rh3+2,3,4,5,6 14.3,16.3,17.6,18.4,17.2Sc3+1,2 2.08,3.08Sn2+1,2,3 1.11,1.81,1.46Tl3+1,2,3,4,5,6 9.7,16.6,21.2,23.9,29.2,31.6U4+ 1 0.18Y3+ 1 1.323Cl-Ag+1,2,4 3.04,5.04,5.30Bi3+1,2,3,42.44,4.7,5.0,5.6Cd2+1,2,3,4 1.95,2.50,2.60,2.80Co3+11.42Cu+2,3 5.5,5.7Cu2+1,20.1,-0.6Fe2+ 1 1.17Fe3+29.8Hg2+1,2,3,4 6.74,13.22,14.07,15.07In3+1,2,3,4 1.62,2.44,1.70,1.60Pb2+1,2,3 1.42,2.23,3.23Pd2+1,2,3,4 6.1,10.7,13.1,15.7Pt2+2,3,4 11.5,14.5,16.0Sb3+1,2,3,4 2.26,3.49,4.18,4.72Sn2+1,2,3,41.51,2.24,2.03,1.48Tl3+1,2,3,48.14,13.60,15.78,18.00Th4+1,21.38,0.38Zn2+1,2,3,4 0.43,0.61,0.53,0.20Zr4+1,2,3,40.9,1.3,1.5,1.24 CN-Ag+2,3,4 21.1,21.7,20.6Au+ 2 38.3Cd2+1,2,3,45.48,10.60,15.23,18.78Cu+2,3,4 24.0,28.59,30.30Fe2+635.0Fe3+ 6 42.0Hg2+ 4 41.4Ni2+431.3Zn2+1,2,3,4 5.3,11.70,16.70,21.605F-Al3+1,2,3,4,5,6 6.11,11.12,15.00,18.00,19.40,19.80Be2+1,2,3,4 4.99,8.80,11.60,13.10Bi3+ 1 1.42Co2+ 1 0.4Cr3+1,2,3 4.36,8.70,11.20Cu2+10.9Fe2+10.8Fe3+1,2,3,5 5.28,9.30,12.06,15.77Ga3+1,2,3 4.49,8.00,10.50Hf4+1,2,3,4,5,69.0,16.5,23.1,28.8,34.0,38.0Hg2+1 1.03In3+1,2,3,4 3.70,6.40,8.60,9.80Mg2+1 1.30Mn2+1 5.48Ni2+10.50Pb2+1,2 1.44,2.54Sb3+1,2,3,4 3.0,5.7,8.3,10.9Sn2+1,2,3 4.08,6.68,9.50Th4+1,2,3,48.44,15.08,19.80,23.20TiO2+1,2,3,4 5.4,9.8,13.7,18.0Zn2+10.78Zr4+1,2,3,4,5,69.4,17.2,23.7,29.5,33.5,38.36I-Ag+1,2,3 6.58,11.74,13.68Bi3+1,4,5,6 3.63,14.95,16.80,18.80Cd2+1,2,3,4 2.10,3.43,4.49,5.41Cu+28.85Fe3+11.88Hg2+1,2,3,412.87,23.82,27.60,29.83Pb2+1,2,3,42.00,3.15,3.92,4.47Pd2+424.5Tl+1,2,30.72,0.90,1.08Tl3+1,2,3,411.41,20.88,27.60,31.82 7OH-Ag+1,22.0,3.99Al3+1,49.27,33.03As3+1,2,3,414.33,18.73,20.60,21.20Be2+1,2,39.7,14.0,15.2Bi3+1,2,412.7,15.8,35.2Ca2+11.3Cd2+1,2,3,4 4.17,8.33,9.02,8.62Ce3+14.6Ce4+1,213.28,26.46Co2+1,2,3,4 4.3,8.4,9.7,10.2Cr3+1,2,410.1,17.8,29.9Cu2+1,2,3,47.0,13.68,17.00,18.5Fe2+1,2,3,45.56,9.77,9.67,8.58Fe3+1,2,311.87,21.17,29.67Hg2+1,2,310.6,21.8,20.9In3+1,2,3,410.0,20.2,29.6,38.9Mg2+12.58Mn2+1,3 3.9,8.3Ni2+1,2,34.97,8.55,11.33Pa4+1,2,3,414.04,27.84,40.7,51.4Pb2+1,2,37.82,10.85,14.58Pd2+1,213.0,25.8Sb3+2,3,424.3,36.7,38.3Sc3+18.9Sn2+110.4Th3+1,212.86,25.37Ti3+112.71Zn2+1,2,3,4 4.40,11.30,14.14,17.66Zr4+1,2,3,414.3,28.3,41.9,55.38NO3-Ba2+10.92Bi3+1 1.26Ca2+10.28Cd2+10.40Fe3+1 1.0Hg2+10.35Pb2+11.18Tl+10.33Tl3+10.929P2O74-Ba2+14.6Ca2+1 4.6Cd3+15.6Co2+1 6.1Cu2+1,26.7,9.0Hg2+212.38Mg2+1 5.7Ni2+1,2 5.8,7.4Pb2+1,27.3,10.15Zn2+1,28.7,11.010SCN-Ag+1,2,3,44.6,7.57,9.08,10.08Bi3+1,2,3,4,5,6 1.67,3.00,4.00,4.80,5.50,6.10Cd2+1,2,3,41.39,1.98,2.58,3.6Cr3+1,21.87,2.98Cu+1,212.11,5.18Cu2+1,2 1.90,3.00Fe3+1,2,3,4,5,6 2.21,3.64,5.00,6.30,6.20,6.10Hg2+1,2,3,49.08,16.86,19.70,21.70Ni2+1,2,3 1.18,1.64,1.81Pb2+1,2,30.78,0.99,1.00Sn2+1,2,31.17,1.77,1.74Th4+1,21.08,1.78Zn2+1,2,3,41.33,1.91,2.00,1.6011S2O32-Ag+1,28.82,13.46Cd2+1,2 3.92,6.44Cu+1,2,310.27,12.22,13.84Fe3+1 2.10Hg2+2,3,429.44,31.90,33.24Pb2+2,35.13,6.35 12SO42-Ag+11.3Ba2+1 2.7Bi3+1,2,3,4,51.98,3.41,4.08,4.34,4.60Fe3+1,2 4.04,5.38Hg2+1,21.34,2.40In3+1,2,31.78,1.88,2.36Ni2+1 2.4Pb2+12.75Pr3+1,2 3.62,4.92Th4+1,23.32,5.50Zr4+1,2,3 3.79,6.64,7.77ﻬ金属-有机配位体配合物的稳定常数(表中离子强度都是在有限的范围内,I≈0。
紫外光谱法测定配合物的稳定常数

紫外光谱法测定配合物的稳定常数
定义配合物组成及其稳定常数的测定定量分析结构分析定性分析
应用范围定义紫外光谱是分子中某些价电子吸收了一定波长的电磁波,由低能级跃近到高能级而产生的一种光谱,也称之为电子光谱编辑本段原理
当分子中的电子吸收能量后会从基态跃迁到激发态,然后放出能量(辐射出特征谱线)。
回到基态而辐射出特征普线的波长在紫外区中就叫做紫外光谱目前使用的紫外光谱仪波长范围是200~800nm.其基本原理是用不同波长的近紫外光(200~400nm)依次照一定浓度的被测样品溶液时,就会发现部分波长的光被吸收。
如果以波长入为横坐标(单位nm),吸收度(absorbance)A 为纵坐标作图即得到紫外光谱(ultra violet spectra,简称UV)编辑本段应用范围
定性分析在有机化合物的定性分析中,紫外一可见光谱适用于不饱和有机化合物,尤其是共钜体系的鉴定,以此推断未知物的骨架结构。
此外,可配合红外光谱、核磁共振波谱法和质谱法进行定性鉴定和结构分析,因此它仍不失为是一种有用的辅助方法。
一般有两种定性分析方法,比较吸收光谱曲线和用经验规则计算最大吸收波长amax,然后与实测值进行比较。
1。
化学五大平衡常数

化学五大平衡常数化学五大平衡常数是指酸解离常数、碱解离常数、水解常数、金属离子配合物稳定常数、氧化还原电极电位常数。
这些常数经常出现在化学反应的研究中,相应的数值反映了不同平衡反应的强度和趋势。
下面将就这些平衡常数逐一展开阐述。
1. 酸解离常数(Ka)酸解离常数是指为了溶解H+离子而发生的酸溶解反应,其平衡常数表达式为 Ka=[H+][A-]/ [HA]。
在一定温度和溶剂中,Ka越大,酸性就越强,说明酸越容易给出H+离子,溶液的pH值会降低。
而Ka值越小,则说明酸性越弱,酸解离反应越难发生。
2. 碱解离常数(Kb)碱解离常数是指为了溶解OH-离子而发生的碱溶解反应,其平衡常数表达式为Kb=[OH-][BH+]/ [B]。
同样地,在一定温度和溶剂中,Kb越大,碱性就越强,说明碱越容易给出OH-离子,溶液的pH值会升高。
而Kb值越小,则说明碱性越弱,碱解离反应越难发生。
3. 水解常数(Kw)水解常数是指水在溶液中自身发生水解反应,平衡常数表达式为Kw=[H+][OH-]。
其中,Kw在25℃下大约为1.0×10^-14,是温度不变的常数。
当溶液中酸性强时,[H+]大,[OH-]小,反之亦然。
这方面比较特殊的情况是在中性溶液下,[H+]=[OH-]=1.0×10^-7,pH=7。
4. 金属离子配合物稳定常数(Kf)金属离子与配位体反应生成配合物时,稳定常数Kf反映了这种反应的强度和趋势。
金属离子配合物稳定程度越高,Kf值就越大,反之亦然。
配合物对某些应用如化学分析和工业化学等方面也比较重要。
5. 氧化还原电极电位常数(E)氧化还原电极的电位可以用氧化还原电极电位来描述,其表达式为:E=E°- (RT/nF)lnQ。
其中,E°是氧化还原反应在标准状态下的电极电位,R为气体常数,T为温度(K),n为电子数,F为法拉第常数,Q为反应物浓度的乘积。
通常来说,当E>0,则反应趋势为氧化,是氧化反应;当E<0,则反应趋势为还原,是还原反应。
配合物组成及稳定常数的测定实验报告

配合物组成及稳定常数的测定【摘要】本实验的目的是掌握用等摩尔连续递变法测定配合物组成及稳定常数的方法。
采用摩尔系列法和分光光度法,测定了配合物的组成。
实验结果表明铁与钛铁配合物的n=2,稳定常数K=6.605×108,结果说明,实验方法正确,实验较为成功。
【前言】本实验测定Fe3+-钛铁配合物的配位数和稳定常数1.用等摩尔系列法测定配合物的组成:在一定温度下,对于配合物的生成反应:M+nL⇌ML n其中M为中心离子或原子,L为配体。
该反应的标准平衡常数即该配合物的稳定常数与平衡系统中个物质浓度之间的关系可以表示为:K’=(C MLn/CΘ)(C M/CΘ)(C L/CΘ)n所以,c MLn/cΘ=K′(C M/CΘ)(C L/CΘ)n在保持溶液中M和L的总浓度为常数即c M,0+c L,0=C (常数)的前提下,配制一系列c M,0和c L,0不同的溶液,并测定它们的吸光度。
若以吸光度对配体的摩尔分数作图,则从图上最大吸收峰处可以求得配合物的组成n值。
n = C L/C M= 1/f - 1 (f为M的浓度分数)在此基础上,可以确定该配合物的组成,这就是等摩尔系列法。
需要注意:在配位平衡系统中,配位体的存在形式有可能是多种多样的。
2.消除背景吸光度:由于中心离子和配体对此波长也有一定的吸收度,所以当配位反应达到平衡后,由于溶液中仍有未反应的反应物,故实测吸光度A为配合物与未反应物的吸光度之和。
因此要得到准确的配合物吸光度,就需要消除反应物带来的误差即消除背景误差。
【正文】一、仪器和试剂722S可见分光光度计、容量瓶22个、100ml烧杯8个、带刻度移液管6个、胶头滴管4个;0.0050mol∙L−1、0.0005 mol∙L−1硫酸高铁铵溶液,0.0025mol∙L−1、0.0005 mol∙L−1铁钛试剂溶液,pH=4.8的HAc-NH4Ac缓冲溶液。
二、实验方法1.配制溶液:将22个100ml容量瓶分为2个系列,每个系列按1~11编号。
配合物稳定常数的测定

配合物稳定常数的测定
配合物稳定常数是判断溶液中配合物稳定性的重要数据。
早期的测定方法是:测得的是配合物的积累稳定常数实验方法上分:
传统的方法有:
电位法/电动势法/pH-电位法分光光度法溶剂萃取法离子交换法极谱法现代的方法:
核磁共振法顺磁共振法折射法直接量热法测温滴定量热法数据处理方法上的进展;
1提出了测定稳定常数的比较普遍适用的数据处理方法计算机的引入,数学方法在测定稳定常数时的应用:
最小二乘法:加权最小二乘法测定的稳定常数一般为浓度稳定常数:在一定离子强度下的稳定常数,离子强度的支持电解质有:
NaCIO4KNO3NaNOsKCINaCl对于稳定常数大者,采用较小的离子强度对于稳定常数小者,采用较大的离子强度实验方法上分:
A直接测出参与某一反应的物种的平衡浓度,pH电位法,电动势法,极谱法,溶剂萃取法,离子交换法
B测出体系的物理化学性质来间接求出各物种的浓度,如光密度(分光光度法),量热法等。
本课程主要介绍电动势法和pH一电位法。
第一节用于测定配离子稳定常数时的函数用有关的实验方法测定配离子的稳定常数时,将有关数据,通过适当的函数,与待求的稳定常数联系起来,经过一定的数据处理,有图解或计算可求出稳定常数。
— 1 —。
2013-第五章--配合物的稳定性

与反应对应的形成常数叫逐级稳定常数,分别用
k1、k2、k3和 k4表示。
K稳=k1·k2·k3·k4
lg
K稳=Klgfθ1k1+lgk2+lgk3+lgk4
2. 稳定常数的应用
① 判断配位反应进行的方向
Ag(NH3)2+ +2CN -
Ag(CN)2- + 2NH3
查表求
Kf Ag(NH3)2+ = 1.7×107 Kf Ag(CN)2- = 1.0×1021
5-1. 配合物的稳定常数 1.配合物的稳定常数和不稳定常数
稳定常数:
Cu2++4NH3
Cu(NH3)42+
K稳=
[Cu(NH3)42+] [Cu2+][NH3]4
不稳定常数: Cu(NH3)42+ Cu2++4NH3
1 K不稳 = ——
K稳
K不稳= [Cu2+][NH3]4 [Cu(NH3)42+]
K = 5.8×1013平衡常数很大,说明上述反应很完全。
② 计算溶液中有关离子的浓度
③ 讨论难溶盐生成或溶解的可能性
④ 计算电极电势
① 判断配位反应进行的方向
Ag(NH3)2+ +2CN -
Ag(CN)2- + 2NH3
可以看作是 下列两个反 应的总和:
Ag(NH3)2+ Ag++2CN-
Ag++2NH3 Kd Ag(NH3)2+ Ag(CN)2- Kf Ag(CN)2-
[Cu(H2O)3NH3]2+ + H2O
[Cu(H2O)3NH3]2+ + NH3
[Cu(H2O)2(NH3)2]2+ + H2O
2.2.3.2 认识配合物的稳定性

[H6Y 2 ] [H5Y ] [Y 4 ] [NY ] [Y 4 ] [Y 4 ]
[Y 4 ]
[Y 4 ]
[Y 4 ]
Y Y(H) Y(N) 1
(2)金属离子的副反应和副反应系数
M的副反应:辅助配位效应
羟基配位效应 配位效应
学习情境三:铅铋合金中 铅铋的分析
二、 配合物稳定常数
1. 稳定常数(形成常数)
Cu2 4NH3
[Cu(NH3 )4 ]2
K稳
[Cu(NH3)24 ] [Cu2 ][NH3]4
K 稳 :配合物的稳定常数
。
K稳值越大,配离子越稳定。
2. 不稳定常数(离解常数)
[Cu(NH3 )4 ]2
1.66 Ca2+ 10.69 Zn2+ 16.50 Th4+ 23.2
Li+
2.79 Mn2+ 14.04 Pb2+ 18.04 Cr3+ 23.4
Ag+
7.32 Fe2+ 14.33 Ni2+ 18.67 Fe3+ 25.1
Ba2+
7.76 Ce3+ 15.98 Cu2+ 18.80 V3+
25.90
107.31 103.00 109.46 104.00 3.1105
pH
11 lg Zn(0H )
5.4
, Zn(OH )
2.5 105
Zn Zn(NH3 ) Zn(OH ) 1 5.6 105
(3)条件稳定常数(表观稳定常数,有效稳定
Sr2+
8.63 Co2+ 16.3 Hg2+ 21.8 Bi3+ 27.94
(整理)配合物稳定常数

配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值
lgαY(H) Values of EDTA
精品文档
精品文档。
配合物稳定常数
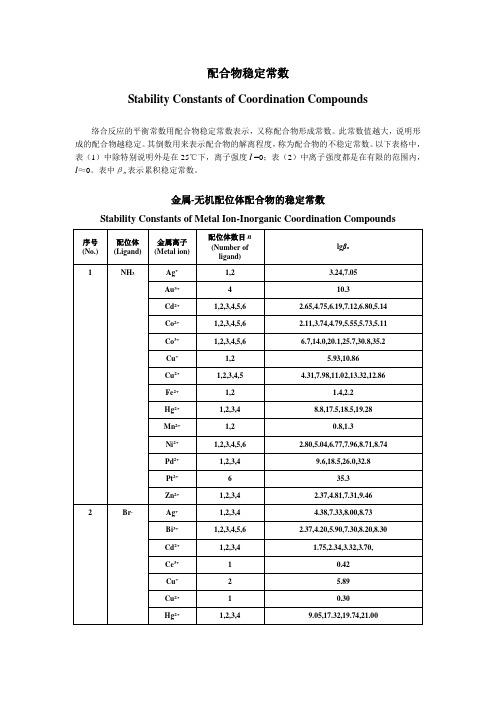
配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值lgαY(H) Values of EDTA。
配合物的不稳定常数和稳定常数

多齿配体──与中心离子结合(配位)的配 位原子不止一个的配位体称多齿配体。如: 乙 二 胺 ( * NH2─CH2─CH2─H2N* ) ( 双 齿 配 体)、氨基三乙酸( * N(CH3COO*H)3 ) ( 四齿 酸体 ) 、 EDTA (四乙酸乙二胺)(六齿配体) 二、配位数 4与中心原子结合的配位原子的数 O 目称为中心原子的配位数。如: O 配位数= 配位原子数 2+:Cu2+的配位数是4 [Cu(NH ) ] 3 4 C—CH2—N—CH2—CH2—N—CH2—C 单齿配体: [Fe(H2O)6]3+:Fe3+的配位数是6。 O =配体数 O 配位数 3-:Co3+的配位数是 [Co(en) ] 2 6。 3 2 双齿配体: 一般说来,金属离子的半径越大, 配位数=配体数× 2(Y4-)的结构简式 EDTA 电荷越高,配位数越大。
§1 §2 §3 §4
配体的 分类
单齿配体──指只有一个配位原子的配体。 如NH3、H2O、卤离子等
三、配合物的 中心原子 配合物依 据中心原 子的分类
提供空价电子轨道与配位体形成配位 键的金属离子可原子称为配合物的形 成体(又称中心离子或中心原子)。
单核配合物──只有一个中心原子的配合物 称单核配合物。如 [Cu(NH3)4]SO4 多核配合物──含有不止一个中心原子的 配合物称多核配合物。
解得: x=1.28×10-9 (mol·L-1) 答:溶液中Ag+离子的平衡浓度是1.28×10-9 mol·L-1
§1 §2 §3 §4
三、讨论难溶 盐生成或溶解 的可能性 例2 解: <1> AgBr <2> Ag++2NH3 <1>+<2>得: AgBr+2NH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属-无机配位体配合物的稳定常数(25℃)Stability Constants of Metal Ion-Inorganic Coordination Compounds序号(No.)配位体(Ligand)金属离子(Metalion)配位体数目n(Number ofligand)lgβn1 NH3Ag+ 1,2 3.24,7.05Au3+ 4 10.3Cd2+1,2,3,4,5,6 2.65,4.75,6.19,7.12,6.80,5.14Co2+1,2,3,4,5,6 2.11,3.74,4.79,5.55,5.73,5.11Co3+1,2,3,4,5,6 6.7,14.0,20.1,25.7,30.8,35.2Cu+1,2 5.93,10.86Cu2+ 1,2,3,4,5 4.31,7.98,11.02,13.32,12.86Fe2+1,2 1.4,2.2Hg2+1,2,3,4 8.8,17.5,18.5,19.28Mn2+1,2 0.8,1.3Ni2+1,2,3,4,5,6 2.80,5.04,6.77,7.96,8.71,8.74Pd2+1,2,3,4 9.6,18.5,26.0,32.8Pt2+ 6 35.3Zn2+1,2,3,4 2.37,4.81,7.31,9.462 Br-Ag+1,2,3,4 4.38,7.33,8.00,8.73Bi3+1,2,3,4,5,6 2.37,4.20,5.90,7.30,8.20,8.30Cd2+1,2,3,4 1.75,2.34,3.32,3.70,Ce3+ 1 0.42Cu+ 2 5.89Cu2+ 1 0.30Hg2+1,2,3,4 9.05,17.32,19.74,21.00In3+1,2 1.30,1.88Pb2+1,2,3,4 1.77,2.60,3.00,2.30Pd2+1,2,3,4 5.17,9.42,12.70,14.90Rh3+2,3,4,5,6 14.3,16.3,17.6,18.4,17.2Sc3+1,2 2.08,3.08Sn2+1,2,3 1.11,1.81,1.46Tl3+1,2,3,4,5,6 9.7,16.6,21.2,23.9,29.2,31.6U4+ 1 0.18Y3+ 1 1.323 Cl-Ag+1,2,4 3.04,5.04,5.30Bi3+1,2,3,4 2.44,4.7,5.0,5.6Cd2+1,2,3,4 1.95,2.50,2.60,2.80Co3+ 1 1.42Cu+2,3 5.5,5.7Cu2+1,2 0.1, -0.6Fe2+ 1 1.17Fe3+ 2 9.8Hg2+1,2,3,4 6.74,13.22,14.07,15.07In3+1,2,3,4 1.62,2.44,1.70,1.60Pb2+1,2,3 1.42,2.23,3.23Pd2+1,2,3,4 6.1,10.7,13.1,15.7Pt2+2,3,4 11.5,14.5,16.0Sb3+1,2,3,4 2.26,3.49,4.18,4.72Sn2+1,2,3,4 1.51,2.24,2.03,1.48Tl3+1,2,3,4 8.14,13.60,15.78,18.00Th4+1,2 1.38,0.38Zn2+1,2,3,4 0.43,0.61,0.53,0.20Zr4+1,2,3,4 0.9,1.3,1.5,1.24 CN-Ag+2,3,4 21.1,21.7,20.6Au+ 2 38.3Cd2+1,2,3,4 5.48,10.60,15.23,18.78Cu+2,3,4 24.0,28.59,30.30Fe2+ 6 35.0Fe3+ 6 42.0Hg2+ 4 41.4Ni2+ 4 31.3Zn2+1,2,3,4 5.3,11.70,16.70,21.605 F-Al3+1,2,3,4,5,6 6.11,11.12,15.00,18.00,19.40,19.80Be2+1,2,3,4 4.99,8.80,11.60,13.10Bi3+ 1 1.42Co2+ 1 0.4Cr3+1,2,3 4.36,8.70,11.20Cu2+ 1 0.9Fe2+ 1 0.8Fe3+1,2,3,5 5.28,9.30,12.06,15.77Ga3+1,2,3 4.49,8.00,10.50Hf4+1,2,3,4,5,6 9.0,16.5,23.1,28.8,34.0,38.0Hg2+ 1 1.03In3+1,2,3,4 3.70,6.40,8.60,9.80Mg2+ 1 1.30Mn2+ 1 5.48Ni2+ 1 0.50Pb2+1,2 1.44,2.54Sb3+1,2,3,4 3.0,5.7,8.3,10.9Sn2+1,2,3 4.08,6.68,9.50Th4+1,2,3,4 8.44,15.08,19.80,23.20TiO2+1,2,3,4 5.4,9.8,13.7,18.0Zn2+ 1 0.78Zr4+1,2,3,4,5,6 9.4,17.2,23.7,29.5,33.5,38.3 6 I-Ag+1,2,3 6.58,11.74,13.68Bi3+1,4,5,6 3.63,14.95,16.80,18.80Cd2+1,2,3,4 2.10,3.43,4.49,5.41Cu+ 2 8.85Fe3+ 1 1.88Hg2+1,2,3,4 12.87,23.82,27.60,29.83Pb2+1,2,3,4 2.00,3.15,3.92,4.47Pd2+ 4 24.5Tl+1,2,3 0.72,0.90,1.08Tl3+1,2,3,4 11.41,20.88,27.60,31.82 7 OH-Ag+1,2 2.0,3.99Al3+1,4 9.27,33.03As3+1,2,3,4 14.33,18.73,20.60,21.20Be2+1,2,3 9.7,14.0,15.2Bi3+1,2,4 12.7,15.8,35.2Ca2+ 1 1.3Cd2+1,2,3,4 4.17,8.33,9.02,8.62Ce3+ 1 4.6Ce4+1,2 13.28,26.46Co2+1,2,3,4 4.3,8.4,9.7,10.2Cr3+1,2,4 10.1,17.8,29.9Cu2+1,2,3,4 7.0,13.68,17.00,18.5Fe2+1,2,3,4 5.56,9.77,9.67,8.58Fe3+1,2,3 11.87,21.17,29.67Hg2+1,2,3 10.6,21.8,20.9In3+1,2,3,4 10.0,20.2,29.6,38.9Mg2+ 1 2.58Mn2+1,3 3.9,8.3Ni2+1,2,3 4.97,8.55,11.33Pa4+1,2,3,4 14.04,27.84,40.7,51.4Pb2+1,2,3 7.82,10.85,14.58Pd2+1,2 13.0,25.8Sb3+2,3,4 24.3,36.7,38.3Sc3+ 1 8.9Sn2+ 1 10.4Th3+1,2 12.86,25.37Ti3+ 1 12.71Zn2+1,2,3,4 4.40,11.30,14.14,17.66Zr4+1,2,3,4 14.3,28.3,41.9,55.3 8 NO3-Ba2+ 1 0.92Bi3+ 1 1.26Ca2+ 1 0.28Cd2+ 1 0.40Fe3+ 1 1.0Hg2+ 1 0.35Pb2+ 1 1.18Tl+ 1 0.33Tl3+ 1 0.929 P2O74-Ba2+ 1 4.6Ca2+ 1 4.6Cd3+ 1 5.6Co2+ 1 6.1Cu2+1,2 6.7,9.0Hg2+ 2 12.38Mg2+ 1 5.7Ni2+1,2 5.8,7.4Pb2+1,2 7.3,10.15Zn2+1,2 8.7,11.010 SCN-Ag+1,2,3,4 4.6,7.57,9.08,10.08Bi3+1,2,3,4,5,6 1.67,3.00,4.00,4.80,5.50,6.10Cd2+1,2,3,4 1.39,1.98,2.58,3.6Cr3+1,2 1.87,2.98Cu+1,2 12.11,5.18Cu2+1,2 1.90,3.00Fe3+1,2,3,4,5,6 2.21,3.64,5.00,6.30,6.20,6.10Hg2+1,2,3,4 9.08,16.86,19.70,21.70Ni2+1,2,3 1.18,1.64,1.81Pb2+1,2,3 0.78,0.99,1.00Sn2+1,2,3 1.17,1.77,1.74Th4+1,2 1.08,1.78Zn2+1,2,3,4 1.33,1.91,2.00,1.6011 S2O32-Ag+1,2 8.82,13.46Cd2+1,2 3.92,6.44Cu+1,2,3 10.27,12.22,13.84Fe3+ 1 2.10Hg2+2,3,4 29.44,31.90,33.24Pb2+2,3 5.13,6.3512 SO42-Ag+ 1 1.3Ba2+ 1 2.7Bi3+1,2,3,4,5 1.98,3.41,4.08,4.34,4.60Fe3+1,2 4.04,5.38Hg2+1,2 1.34,2.40In3+1,2,3 1.78,1.88,2.36Ni2+ 1 2.4Pb2+ 1 2.75Pr3+1,2 3.62,4.92Th4+1,2 3.32,5.50Zr4+1,2,3 3.79,6.64,7.77 金属-有机配位体配合物的稳定常数(25℃)(表中离子强度都是在有限的范围内,I≈0。
)Stability Constants of Metal Ion-Organic Coordination Compounds序号(No.) 配位体(Ligand) 金属离子(Metal ion)配位体数目n(Numberofligand)lgβn1 乙二胺四乙酸(EDTA)[(HOOCCH2)2NCH2]2Ag+ 1 7.32 Al3+ 1 16.11 Ba2+ 1 7.78 Be2+ 1 9.3 Bi3+ 1 22.8 Ca2+ 1 11.0 Cd2+ 1 16.4 Co2+ 1 16.31 Co3+ 1 36.0 Cr3+ 1 23.0 Cu2+ 1 18.7 Fe2+ 1 14.83 Fe3+ 1 24.23 Ga3+ 1 20.25 Hg2+ 1 21.80 In3+ 1 24.95 Li+ 1 2.79 Mg2+ 1 8.64 Mn2+ 1 13.8 Mo(V) 1 6.36Na+ 1 1.66 Ni2+ 1 18.56 Pb2+ 1 18.3 Pd2+ 1 18.5 Sc2+ 1 23.1 Sn2+ 1 22.1 Sr2+ 1 8.80 Th4+ 1 23.2 TiO2+ 1 17.3 Tl3+ 1 22.5 U4+ 1 17.50 VO2+ 1 18.0 Y3+ 1 18.32 Zn2+ 1 16.4Zr4+ 1 19.42 乙酸(Acetic acid)CH3COOHAg+1,2 0.73,0.64Ba2+ 1 0.41Ca2+ 1 0.6Cd2+1,2,3 1.5,2.3,2.4Ce3+1,2,3,4 1.68,2.69,3.13,3.18 Co2+1,2 1.5,1.9Cr3+1,2,3 4.63,7.08,9.60 Cu2+(20℃) 1,2 2.16,3.20 In3+1,2,3,4 3.50,5.95,7.90,9.08Ni2+1,2 1.12,1.81Pb2+1,2,3,4 2.52,4.0,6.4,8.5 Sn2+1,2,3 3.3,6.0,7.3Tl3+1,2,3,4 6.17,11.28,15.10,18.3 Zn2+ 1 1.53 乙酰丙酮(Acetyl acetone)CH3COCH2CH3Al3+(30℃) 1,2 8.6,15.5 Cd2+1,2 3.84,6.66Co2+1,2 5.40,9.54Cr2+1,2 5.96,11.7Cu2+1,2 8.27,16.34Fe2+1,2 5.07,8.67Fe3+1,2,3 11.4,22.1,26.7Hg2+ 2 21.5Mg2+1,2 3.65,6.27Mn2+1,2 4.24,7.35Mn3+ 3 3.86Ni2+(20℃) 1,2,3 6.06,10.77,13.09 Pb2+ 2 6.32Pd2+(30℃) 1,2 16.2,27.1 Th4+1,2,3,4 8.8,16.2,22.5,26.7 Ti3+1,2,3 10.43,18.82,24.90 V2+1,2,3 5.4,10.2,14.7 Zn2+(30℃) 1,2 4.98,8.81 Zr4+1,2,3,4 8.4,16.0,23.2,30.14 草酸(Oxalic acid)HOOCCOOH Ag+ 1 2.41Al3+1,2,3 7.26,13.0,16.3 Ba2+ 1 2.31Ca2+ 1 3.0Cd2+1,2 3.52,5.77 Co2+1,2,3 4.79,6.7,9.7 Cu2+1,2 6.23,10.27 Fe2+1,2,3 2.9,4.52,5.22 Fe3+1,2,3 9.4,16.2,20.2 Hg2+ 1 9.66Mg2+1,2 3.43,4.38Mn2+1,2 3.97,5.80Mn3+1,2,3 9.98,16.57,19.42 Ni2+1,2,3 5.3,7.64,~8.5Pb2+1,2 4.91,6.76Sc3+1,2,3,4 6.86,11.31,14.32,16.70 Th4+ 4 24.48Zn2+1,2,3 4.89,7.60,8.15Zr4+1,2,3,4 9.80,17.14,20.86,21.155 乳酸(Lactic acid)CH3CHOHCOOH Ba2+ 1 0.64 Ca2+ 1 1.42 Cd2+ 1 1.70 Co2+ 1 1.90 Cu2+1,2 3.02,4.85 Fe3+ 1 7.1 Mg2+ 1 1.37 Mn2+ 1 1.43 Ni2+ 1 2.22 Pb2+1,2 2.40,3.80 Sc2+ 1 5.2 Th4+ 1 5.5 Zn2+1,2 2.20,3.756 水杨酸(Salicylic acid)C6H4(OH)COOHAl3+ 1 14.11Cd2+ 1 5.55Co2+1,2 6.72,11.42Cr2+1,2 8.4,15.3Cu2+1,2 10.60,18.45Fe2+1,2 6.55,11.25Mn2+1,2 5.90,9.80Ni2+1,2 6.95,11.75Th4+1,2,3,4 4.25,7.60,10.05,11.60 TiO2+ 1 6.09V2+ 1 6.3Zn2+ 1 6.857 磺基水杨酸(5-sulfosalicylic Al3+(0.1mol/L) 1,2,3 13.20,22.83,28.89 Be2+(0.1mol/L) 1,2 11.71,20.81acid)HO3SC6H3(OH)COOH Cd2+(0.1mol/L) 1,2 16.68,29.08 Co2+(0.1mol/L) 1,2 6.13,9.82Cr3+(0.1mol/L) 1 9.56Cu2+(0.1mol/L) 1,2 9.52,16.45 Fe2+(0.1mol/L) 1,2 5.9,9.9Fe3+(0.1mol/L) 1,2,3 14.64,25.18,32.12 Mn2+(0.1mol/L) 1,2 5.24,8.24Ni2+(0.1mol/L) 1,2 6.42,10.24 Zn2+(0.1mol/L) 1,2 6.05,10.658 酒石酸(Tartaric acid)(HOOCCHOH)2Ba2+ 2 1.62Bi3+ 3 8.30Ca2+1,2 2.98,9.01Cd2+ 1 2.8Co2+ 1 2.1Cu2+1,2,3,4 3.2,5.11,4.78,6.51 Fe3+ 1 7.49Hg2+ 1 7.0Mg2+ 2 1.36Mn2+ 1 2.49Ni2+ 1 2.06Pb2+1,3 3.78,4.7Sn2+ 1 5.2Zn2+1,2 2.68,8.329 丁二酸(Butanedioic acid)HOOCCH2CH2COOH Ba2+ 1 2.08 Be2+ 1 3.08 Ca2+ 1 2.0 Cd2+ 1 2.2 Co2+ 1 2.22 Cu2+ 1 3.33 Fe3+ 1 7.49 Hg2+ 2 7.28 Mg2+ 1 1.20 Mn2+ 1 2.26 Ni2+ 1 2.36 Pb2+ 1 2.8 Zn2+ 1 1.610 硫脲(Thiourea)H2NC(═S)NH2Ag+1,2 7.4,13.1Bi3+ 6 11.9Cd2+1,2,3,4 0.6,1.6,2.6,4.6 Cu+3,4 13.0,15.4 Hg2+2,3,4 22.1,24.7,26.8 Pb2+1,2,3,4 1.4,3.1,4.7,8.311 乙二胺(Ethyoenediamine)H2NCH2CH2NH2Ag+1,2 4.70,7.70 Cd2+(20℃) 1,2,3 5.47,10.09,12.09 Co2+1,2,3 5.91,10.64,13.94 Co3+1,2,3 18.7,34.9,48.69 Cr2+1,2 5.15,9.19Cu+ 2 10.8Cu2+1,2,3 10.67,20.0,21.0 Fe2+1,2,3 4.34,7.65,9.70 Hg2+1,2 14.3,23.3Mg2+ 1 0.37Mn2+1,2,3 2.73,4.79,5.67 Ni2+1,2,3 7.52,13.84,18.33 Pd2+ 2 26.90V2+1,2 4.6,7.5Zn2+1,2,3 5.77,10.83,14.1112 吡啶(Pyridine)C5H5N Ag+1,2 1.97,4.35Cd2+1,2,3,4 1.40,1.95,2.27,2.50 Co2+1,2 1.14,1.54Cu2+1,2,3,4 2.59,4.33,5.93,6.54 Fe2+ 1 0.71Hg2+1,2,3 5.1,10.0,10.4 Mn2+1,2,3,4 1.92,2.77,3.37,3.50 Zn2+1,2,3,4 1.41,1.11,1.61,1.9313 甘氨酸(Glycin)H2NCH2COOHAg+1,2 3.41,6.89Ba2+ 1 0.77Ca2+ 1 1.38Cd2+1,2 4.74,8.60Co2+1,2,3 5.23,9.25,10.76 Cu2+1,2,3 8.60,15.54,16.27 Fe2+(20℃) 1,2 4.3,7.8Hg2+1,2 10.3,19.2 Mg2+1,2 3.44,6.46 Mn2+1,2 3.6,6.6Ni2+1,2,3 6.18,11.14,15.0 Pb2+1,2 5.47,8.92 Pd2+1,2 9.12,17.55 Zn2+1,2 5.52,9.9614 2-甲基-8-羟基喹啉(50%二噁烷)(8-Hydroxy-2-methylquinoline)Cd2+1,2,3 9.00,9.00,16.60 Ce3+ 1 7.71Co2+1,2 9.63,18.50 Cu2+1,2 12.48,24.00 Fe2+1,2 8.75,17.10 Mg2+1,2 5.24,9.64 Mn2+1,2 7.44,13.99 Ni2+1,2 9.41,17.76 Pb2+1,2 10.30,18.50 UO22+1,2 9.4,17.0 Zn2+1,2 9.82,18.72EDTA的lgαY(H)值lgαY(H) Values of EDTApH lgαY(H)pH lgαY(H)pH lgαY(H)pH lgαY(H)pH lgαY(H) 0.0 23.64 2.5 11.90 5.0 6.45 7.5 2.78 10.0 0.45 0.1 23.06 2.6 11.62 5.1 6.26 7.6 2.68 10.1 0.39 0.2 22.47 2.7 11.35 5.2 6.07 7.7 2.57 10.2 0.33 0.3 21.89 2.8 11.09 5.3 5.88 7.8 2.47 10.3 0.28 0.4 21.32 2.9 10.84 5.4 5.69 7.9 2.37 10.4 0.24 0.5 20.75 3.0 10.60 5.5 5.51 8.0 2.27 10.5 0.20 0.6 20.18 3.1 10.37 5.6 5.33 8.1 2.17 10.6 0.16 0.7 19.62 3.2 10.14 5.7 5.15 8.2 2.07 10.7 0.13 0.8 19.08 3.3 9.92 5.8 4.98 8.3 1.97 10.8 0.110.9 18.54 3.4 9.70 5.9 4.81 8.4 1.87 10.9 0.091.0 18.01 3.5 9.48 6.0 4.65 8.5 1.77 11.0 0.07 1.1 17.49 3.6 9.27 6.1 4.49 8.6 1.67 11.1 0.06 1.2 16.98 3.7 9.06 6.2 4.34 8.7 1.57 11.2 0.05 1.3 16.49 3.8 8.85 6.3 4.20 8.8 1.48 11.3 0.04 1.4 16.02 3.9 8.65 6.4 4.06 8.9 1.38 11.4 0.03 1.5 15.55 4.0 8.44 6.5 3.92 9.0 1.28 11.5 0.02 1.6 15.11 4.1 8.24 6.6 3.79 9.1 1.19 11.6 0.021.7 14.68 4.2 8.04 6.7 3.67 9.2 1.10 11.7 0.02 1.8 14.27 4.3 7.84 6.8 3.55 9.3 1.01 11.8 0.011.9 13.88 4.4 7.64 6.9 3.43 9.4 0.92 11.9 0.012.0 13.514.5 7.44 7.0 3.32 9.5 0.83 12.0 0.01 2.1 13.16 4.6 7.24 7.1 3.21 9.6 0.75 12.1 0.01 2.2 12.82 4.7 7.04 7.2 3.10 9.7 0.67 12.2 0.005 2.3 12.50 4.8 6.84 7.3 2.99 9.8 0.59 13.0 0.0008 2.4 12.19 4.9 6.65 7.4 2.88 9.9 0.52 13.9 0.0001。
