南昌大学有机化学10-11醇、醚、酚
南昌大学2010-2011-1期末有机化学考试试卷(C)及答案(适用于化学系)
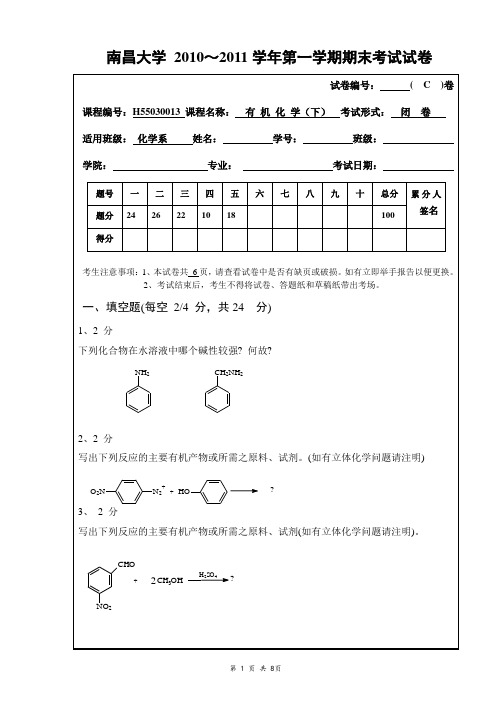
南昌大学2010~2011学年第一学期期末考试试卷O O H B r 2,P N H 3Et南昌大学 2010~2011学年第一学期期末考试试卷(C )答案及评分细则一、 填空题(24分)1. 苯甲胺的碱性强,因为苯胺中氮原子上的孤对电子与苯环共轭,使得氮原子上的孤对电子不易给出,所以碱性更弱。
答对2分答错或不答0分2.答对2分答错或不答0分3. .答对2分答错或不答0分4.CH 3CH(OH)SO 3Na 答对2分答错或不答0分5. PhCH(NH 2)COOH 答对4分答错或不答0分6.ClCH=CH 2,CH 3CH 2N(CH 3)2 答对2分答错或不答0分7. CH 3CH 2COOH + CO 2 答对2分答错或不答0分8. C 6H 5CHCH 23OOH答对2分答错或不答0分9.NMgBrH NCH 3H NCH 3答对4分答错或不答0分10.CH 3CH 2CONHCH 3答对2分答错或不答0分二、 选择题(26分)1.D2.C3.D4.D5.A6. B7. A8.C9.D 10.D 11.C 12.A 13.C 每题答对2分答错或不答0分三、 合成题(22分) 1.CH 3Cl 2CH 2ClMg Et 2OCH 2MgCl HCH COCH CH 2CCH 3OHCH 31)每步2分,共6分O 2NN NOH 2CH(OCH 3)22.NO 2Fe HClNH 22Fe HCl NH 2BrNaNO 2HClN 2+BrNBrNH 2N++0弱前四步每步1分最后一步2分,共6分3. HCCH++2CH 3CHOOH -CH 3CH=CHCHO H 2 / NiCH 3CH 2CH 2CH 2OH第一步2分,其余各步1分,共4分4. [参解](1)a-H 卤化 (2)NaCN (3) H 3+O (4)乙醇酯化 前两步各2分,后两步各1分,共6分四、 机理题(10分) 1.每步各3分,共6分五、 推结构题(18分) 1.ACH 3CH-C-CH 2CH 3CH 3OB.H 3C CHH 3CCHCH 2CH 3OHC.H 3C CH 3CCHCH 2CH 3D.CH 3CH 2CHOE.CH 3COCH 3写对D2分,其余1分,共6分2..A.CH 2COOH CH 2COOHB.OOOC.H 2C H 2C COCH3COCH 3OOD.CH 2CH 2OH CH 2CH 2OH推出A ,B 各2分,推出C,D 各1分,共6分。
南昌大学有机化学10-11醇、醚、酚
6)、亚硝化、重氮盐偶合反应
OH
+ NaNO2 + H2SO4 0-5oC ON
OH
对位产物
O +N N 重氮盐
O
NN
偶氮化合物
3、其它一些反应
1)、酯化、成醚反应
酯化反应(类似于醇): O
OH + CH3CCl
Et3N (三乙胺)
成醚反应:
OH
OH + RX
OR
RX:1、2级活泼卤代烷,或活泼芳香卤代烃
H2O
OH
重氮盐的制备将在胺一章中讲述
第三节:醚
一、醚的结构与命名 1、结构:
O
R
R1
SP3杂化,R、R1可以相同(简单醚), 可以不同(混合醚)
2、命名
非环状醚:
CH3CH2OCH2CH3 CH3OCH2CH2CH3
普通: (二)乙醚
甲(基)丙(基)醚
系统: 乙氧基乙烷
1-甲氧基丙烷
CH3OCH2CH2OCH3 普通: 乙二醇二甲醚
选含羟基的最长的碳链为主链,从羟基一端开始编号,其它 同烷烃的命名
二、醇的物理性质
沸点:高于同分子量的烃、卤代烃;同分子量下,随支 链的增加沸点降低。
溶解性:C1-C3与水混溶,同分子量下支链多, 水溶性好;良溶剂。
三、醇的化学性质
1、酸碱性
ROH
RC CNa (or RLi, NaNH2)
RO
CH3OH > RCH2OH > R2CHOH > R3COH
OH
OH
+ CH3(CH2)4CO2H ZnCl2
OH
HO
O C(CH2)4CH3
有机化学- 醇、酚、醚、硫醇

OH
O
2-辛酮 (96%)
用于鉴别:常用K2Cr2O7和KMnO4催化。反应发生,
则KMnO4由紫红变为无色, K2Cr2O7由橙红变为绿色
人体内含羟基化合物在酶的作用下
发生生物氧化。
• 第一步,肝脏里的乙醇脱 氢酶(ADH)把酒精转变为 乙醛。
• 第二步,肝脏里的乙醛脱 氢酶(ALDH)把乙醛转变 为乙酸。
OH
Cl
仲丁醇
(3)g-氯丙醇
-CH2-OH 苯甲醇(苄醇)
2.系统命名法 • 选择含-OH的最长碳链作主链,按主链碳原子个数
称“某醇”,编号应使 –OH 所连的C有较小编号, 羟基的位次写在醇名之前。
CH3CH CHCH2OH CH3 CH3
2,3-二甲基-1-丁醇
CH3-CH2-CH2-CH-CH2-CH3 2-乙基-1-戊醇 CH2OH
OH OH 顺-1,2-环戊二醇
3.俗名
甲醇 乙醇 丙三醇 苯甲醇 环己六醇
木醇 酒精 甘油 苄醇 肌醇
具有视神经毒性,10毫升致盲 30毫升致死。
利用其可使蛋白质脱水变性凝 固的原理,用于杀菌。
含羟基多,具有吸湿性,用于 护肤产品、润滑剂、助溶剂。
具有微弱的麻醉功能和防腐性能
促进脂肪代谢,治疗脂肪肝。
(二) 醇与无机酸反应
1. 与氢卤酸反应
R-OH + H-X
+
RR--O-XH++HX2O-
H
不同的HX以及不同类型的醇反应速度不同:
HI > HBr > HCl (HF一般不反应)
叔醇 > 仲醇 > 伯醇 > CH3OH
常用无水氯化锌的浓盐酸溶液(Lucas 试剂) 鉴别伯、仲、叔三类醇:
大学有机化学------醇酚醚

4 - 戊 烯 -2 - 醇
3-苯基-2-丙烯醇
C H 3 -C H -C H 2 -C H -C H 2 -C H -C H 3 OH C H 2O H OH
4-羟甲基-2,6-庚二醇
§1.3 醇的结构
H R C sp
3
sp O
10 8. 9 °
3
sp 3 杂 化 O 原子为 sp 3 由于在 杂化轨道上有未共用电子对, 两 对 之 间 产 生 斥 力 , 使 得 ∠ C- O- H小 于
此反应是定量定性地进行的,可用来定量测 定1,2-二醇的含量(非邻二醇无此反应 )。
α-羟基醛或α-羟基酮也都可以被 HIO4 氧化, 其中羰基被氧化成为羧酸或CO2。
7.多元醇螯合物的生成
C H2- O H C H- O H + C H2- O H C u (O H ) 2 C H2- O C H- O C H2- O H Cu + 2 H 2O
§1.5 化学性质
醇的化学性质主要由羟基官能团所决定,同 时也受到烃基的一定影响,从化学键来看,反 应的部位有 C—OH、O—H、和C—H。
R H δ C H 氧化反应 δ O δ H 酸性,生成酯 形成 C , 发生取代及消除 反应
分子中的C—O 键和O—H 键都是极性键,因 而醇分子中有两个反应中心。 又由于受C—O 键 极性的影响,使得α—H 具有一定的活性,所以 醇的反应都发生在这三个部位上。
C H 3C H 2O N a + H 2O C H 3C H 2O H + N aO H
醇的反应活性:
CH3OH > 伯醇(乙醇) > 仲醇 > 叔醇
2.与氢卤酸反应—羟基被卤素取代
有机化学第八章醇、酚、醚
H2O + HCl
ROH + HCl
H3O+ + Cl
RO+H2
+
_ Cl
钅羊离子
低级醇能与氯化钙形成络合物,如CaCl2·4CH3OH, CaCl2 ·4C2H5OH
第八章 醇、酚、醚
07:26
Ⅰ.醇
17
化学性质
似水性的另一表现:低级醇能与氯化钙形成络合物, 如CaCl2·4CH3OH, CaCl2 ·4C2H5OH。类似“结晶 水”,这里把在结晶中的醇叫做“结晶醇”。故不能 使用氯钙来除去醇中所含有的水。
CH3CH2Cl
RH RCl ROH
第八章 醇、酚、醚
07:26
分子量
46 30 44 64.5
沸点(℃)
78.5 -98 -42
12
Ⅰ.醇
12
物理性质
醇的沸点高,其原因是醇的分子间氢键
R
R
O
O
H
H
H
O
R 氢键
20 kJ/mol
第八章 醇、酚、醚
07:26
Ⅰ.醇
13
4. 溶解度(Solubility)
R'
C CH CH2+ 2 HIO4
OH OH OH
R C R' + H C OH + H C
O
酮
O
酸
O
醛
R C R' + H C OH + H C H
O
O
O
第八章 醇、酚、醚
07:26
Ⅰ.醇
40
O OH CC
化学性质
-羟基醛或-羟基酮
有机化学第十章醇酚醚

B、脱水过程可能重排。
(CH3)3CCHCH3 OH
85%
H3PO4
(CH3)2C=C(CH3)2 80%
+ 0.4%
+ (CH3)2CHC=CH2 20%
CH3
(CH3)3CCH=CH2
2019/1/16
CH3 CH3CH2CHCH2OH
H
CH3 CH3CH2CHCH2 伯碳正离子 -H CH3 CH3CH2-C=CH2
3)在制备叔丁醇钾时常用KH。
2019/1/16
2、与Mg、Al作用
C2H5OH
+Mg
Mg(C2H5O)2 H2O
+ H2 +
Mg(OH)2
C2H5OH
在实验室常用醇镁来除去乙醇中的水分制备 无水乙醇。
(CH3)2CHOH (CH3)3COH
+ Al +Al
(CH3)2CHO 3 Al (CH3)3CO
3Al +H2
+
H2
异丙醇铝、叔丁醇铝在有机合成中常作催 化剂、还原剂。
2019/1/16
二、与卤化试剂作用 1、与HX作用
ROH +HX RX
+ H2O
注意:A、HX的活性:HI>HBr>HCl。 B、醇的活性:烯丙式、苄卤式>3°ROH >2°ROH>1°ROH。
ZnCl2 (CH3)3CCl +H2O r.t 2 CH3CH2CHCH3 + HCl(n) ZnCl CH3CH2CHCH3 +H2O r.t OH Cl 2 X¼¸ С ʱ Ò² ² » » ë × Ç CH3CH2CH2CH2OH + HCl(n) ZnCl r.t (CH3)3COH
有机化学第8章醇、酚、醚

4
5
6
Байду номын сангаас
7.2.1 酚的分类和命名
酚的命名练习
3-乙基苯酚
4-硝基-2-萘酚
3-甲氧基苯酚
练习
3-羟基苯甲酸
4-羟基苯磺酸
间羟基苯甲酸
对羟基苯磺酸
3-氨基苯酚
酚的命名练习
苯酚
2,4,6-三甲基苯酚 (BHA)
对苯二酚(几奴你)
石碳酸
甲苯酚 煤酚,来苏儿
α-萘酚
γ-蒽酚
结构
酚的命名
3-乙基苯酚
从本章开始讨论烃的含氧衍生物。
醇和酚—可认为是水分子中的氢原子被烃基所取代的化合物。
无论在有机合成上或者在工农业生产上,醇、酚、醚都占有重要的地位。
O-H
OH
A
r
OH
介绍醇
第8章 醇和酚
水分子中的一个氢原子被脂肪烃基取代为醇。 水分子中的一个氢原子被芳香烃基取代为酚。
绍介醇的分类
醇的分类及命名
同分异构
(5-甲基-2-异丙基-1-环己醇)
--碳链异构
构造异构
CH3-CH2-CH2-CH2-OH CH3-CH-CH2-OH
OH
CH3-CH2-CH2-CH2-OH CH3-CH2-O-CH2-CH3
官能团异构
CH3-CH2-CH2-CH2-OH CH3-CH-CH2-CH3
位置异构
CH3
介绍醇的物理性质
醇的同分异构的类型
9.2 醇的物理性质
C4以下的直链醇为具有酒味液体。 C12以上的直链醇为无色无味的蜡状固体。 低级直链饱和一元醇的沸点比相对分子质量相近的烷烃的沸点高得多。
亲水基:-OH,-COOH,-NH2,-SO3H
南昌大学2010-2011-2有机化学期末考试试卷(B)及答案剖析

南昌大学 2010~2011 学年第二学期期末考试试卷试卷编号:6046 (B )卷课程编号:Z5503B301 程名称:有机化学(上)考试形式:闭卷适用班级:09化学、09应化1、2 姓名:学号:班级:学院:理学院专业:考试日期:题号一二三四五总分累分人签名题分66 7 12 8 7 100得分考生注意事项:1、本试卷共13页,请查看试卷中是否有缺页或破损。
如有立即举手报告以便更换。
2、考试结束后,考生不得将试卷、答题纸和草稿纸带出考场。
一、选择题:(每小题1.2分,共55小题,66分)得分评阅人1.在1H NMR中左边物质的哪一种质子将被观察为二重峰?(A),a (B),b (C),c (D),d (E), e2.下列哪种物质为该反应的主要产物?3.下列哪种物质更倾向于以s-反式存在?4.下列哪种物质为该反应的主要产物?5.下列哪种物质为该反应的主要产物?6.下列哪种物质为该反应的碳正离子重排主要产物7.下列哪两种是环己烯溴化过程中的链增长步骤?(A), I 和II (B), I 和IV (C), I 和V (D), II 和V (E), III和IV8.实现这个转换可采用下列哪种方法?9.实现这个转换可采用下列哪种方法?10.下列哪种为该反应系列的主要产物?与其邻位异构体与其邻位异构体11.这个物质(R)-3-溴-5-羟基戊酸经氧化后产生3-溴戊二酸,该3-溴戊二酸是:(A) 两个不等量的非对映异构体的混合物(B) 外消旋混合物(C) 单一的纯的对映体(D) 一个内消旋化合物(E) 一个非手性化合物12.下列化合物哪种发生单分子消除更容易?13.下列哪种是该亲核取代反应的主要产物?14.下列哪种是该化合物的IUPAC名字?(A),2-(1-甲基乙基)-3-丁基-戊烷(D),2,3-二-甲基-4-乙基辛烷(B),2-异丙基-3-丁基戊烷(E),2-异十二烷(C),3-乙基-2-异丙基庚烷15.上述两种结构是(A)相同的(B) 同一化合物的两种构象(C) 对映体(D)非对映异构体(E) 构造异构体16.下列哪种反应式得到的产物是该反应的主要产物?17.下列哪种中间体是该反应中生成最快的?18.下列哪种化合物是非手性的?19.通过Diels-Alder反应制得该物质,下列哪种是最好的原料组合?20.下列哪种是该反应的关键中间体?21.上述物质与碘化钠的丙酮溶液反应性顺序是:22.下列哪种方法是合成左边这个物质的最佳?23.(8550)下面化合物中,哪一根键最长?CH3CH CH2CH C CHA B C D24. (8551)Lindlar 试剂的组成是什么?A B CDCrO 3Pd -BaSO 4Hg(OAc)2/THF HCl+ZnCl 2//NN25. (8552) 预测CH 3CCCH 2CH 3在酸催化下与水加成后,生成下述产物中的哪一种? A 一种酮 B 一种醛C 两种酮的混合物D 一种二元醇 26. (8553)根据化合物的酸碱性,下列反应不能发生的是:A B C RC CH CNa NH 3RONa R 'C ROH CH 3C H 2ONaOH +RC +NH 2+CHR 'C CNa+CNa+CH 3C CH+DHCAg(NH 3)2NO 3AgCCAgCH+(白色)27. (8902)下列反应机理说明正确的是:++AB CDCH 3CHCH 2BrCH 3CH 3OH CH 3CH CH 2OCH 3CH 3CH 3CH CH 3CH 3OCH 3S N 1CH 3I +-OHCH 3OH +-I --+NaOHC HBrC 6H 5CH 3CHOHC 6H 5CH 3+H 2OC 6H 5CH CH 3OH(+)-(R)-C 6H 5CH CH 3BrS N 2S N 1S N 128. (8914)下列哪些化合物不能用来制备Grinard 试剂?(1)(2)(3)(4)(5)BrCH 2COOHBrOBr CH 3CC CH 2ICH 3CH CH 2CH 2Br NH 2(A ) 1,3,4 (B )1,2(C )1,3,5 (D )3,529. (8878)丙烷二氯代时,得四种产物。
有机知识重点笔记

南昌大学知识重点首页授课教师 xx 课程名称 有机化学 课次编号 授课日期授课年级本科生授课方式 讲 授 授课内容 第6章 醇、酚、醚学 时 数41、熟练掌握醇、酚、醚的化学性质2、了解1,2-环氧化合物的反应1、醇、酚、醚的分类与命名2、醇的化学性质(重点)3、酚的化学性质(重点)4、 醚的化学性质5、 重要的醇、酚、醚6、 1,2-环氧化合物的反应书后练习教 学 目 的(含重点、难点)主 要 内容 复习思考题教研室意见参考文献教 材教学 内 容备 注第六章 醇、酚、醚概述:醇、酚和醚都是烃的含氧衍生物。
有的在医药上用作消毒剂、麻醉剂、溶剂,有的是有机化合物的常用原料。
第一节 醇一、醇的分类和命名1、 根据分子中烃基的不同,分为饱和醇、不饱和醇、脂肪醇、脂环醇及芳香醇等。
2、 根据羟基所连的碳原子的种类,分别称为伯、仲或叔醇。
3、根据羟基数目的多少,分为一元醇、二元醇、三元醇等。
含两个或两个以上羟基的醇又称为多元醇。
4、简单的一元醇多用普通命名法。
5、不饱和醇的命名:应选择既包括连接羟基的碳,又包括碳碳重键的两个碳原子都在内的最长碳链作为主链,叫做某烯(或炔)醇。
从靠近羟基的一端开始把碳链编号,并分别指出羟基、双键或三键的位置。
6、脂环醇的命名:当羟基与环上碳原子相连时,根据环上碳原子的数目叫做环某醇。
如环上还有其它取代基,则将环上碳原子从羟基所连碳开始编号。
7、芳香醇的命名:通常把链醇作为母体,芳烃基作为取代基。
8、多元醇的系统命名法:选择连有尽可能多的羟基的碳链作主链。
二、醇的物理性质由于羟基的存在,醇分子间可以形成氢键,故醇的沸点比相对分子质量相近的烷烃高得多,并随相对分子质量的增加而呈规律性的增高。
多元醇随着羟基的增多,形成氢键数目也就增多,所以多元醇具有更高的沸点。
三、醇的化学性质◆ 结构特点:CCO H....O-H 键极性大,可作为 酸。
R-OH RO H -++ 质子化为 H H O ..+故可发生亲核取代反应。
《有机化学(第二版)》第7章:醇、酚、醚

H 快
+
(CH3)3C
OH2
+
_H O
2
质质杂丁
慢
(CH3)3C
+
Br 快
-
(CH3)3C
Br
稳定性:叔碳正离子>仲碳正离子> 稳定性:叔碳正离子>仲碳正离子>伯碳正离子 反应活性为:叔醇>仲醇> 反应活性为:叔醇>仲醇>伯醇 历程: 伯醇为 SN2 历程:
R .. OH
H
H
R ③
β C H
α C H
O
C- 键断裂(取代反应 消除反应) 取代反应, ② C-O 键断裂(取代反应,消除反应) 氧化反应), - 消除反应 消除反应) ③ α-H(氧化反应 ,β-H(消除反应 - 氧化反应
分子中的 C-O 键和 O-H 键都是极性键,因而醇分子中有两个反 - - 键都是极性键, 应中心。 应中心。 又由于受 C-O 键极性的影响,使得 -H 具有一定的活性, - 键极性的影响,使得α- 具有一定的活性, 所以醇的反应发生在这三个部位上。 所以醇的反应发生在这三个部位上。
19:46
第六章
醇、酚、醚
19:46
醇和酚可以看成是烃中的氢被羟基 - 醇和酚可以看成是烃中的氢被羟基(- OH)代换 羟基 代换 的产物,醚可以看成是烃中的氢被烃氧基 烃氧基( OR)代换 的产物,醚可以看成是烃中的氢被烃氧基(- OR)代换 的产物。醇、酚、醚又可以看成是水的衍生物。 的产物。 醚又可以看成是水的衍生物。
CH2 H CH2 OH
H2SO4 , 170℃ ℃ 或 Al2O3 , 360℃ ℃
CH2
CH2 + H2O
醇的分子内脱水反应遵循札依采夫规则, 醇的分子内脱水反应遵循札依采夫规则,主要生成双键碳上取 代基较多的烯烃。 代基较多的烯烃。
大学有机化学第十章醇酚醚

(80%) Saytzeff 产物
C. 用Al2O3为催化剂时,醇在高温气相条件下脱水,
往往不发生重排反应。
C H3 C H3 C C H C H3
Al2O3 气 相
C H3 C H3 C C H3 (主要产物 ) C H= C H2 + H2O
C H3 O H
2. 分子间脱水
醇的分子间脱水生成醚(反应是SN反应)
CH3CH2CH2CH2I + H2O
H2SO4 ZnCl2
+ HBr (48%) + HCl
CH3CH2CH2CH2Br + H2O CH3CH2CH2CH2Cl + H2O
特别地:
Lucas试剂(无水ZnCl2与浓HCl配制的溶液)鉴别 六个碳以下的伯、仲、叔醇(烯丙式醇)
现象 R3C-OH
R3C-Cl
反应的立体化学特征:醇的α- 碳原子的构型保持。
R'
α
Cl C OH + Cl S O
R'
R'
δ
R H
SOCl2 α C HCl
R
O
δ
α
S O
SO2
R H
C
Cl
H Cl
ii. 与PX3 , PX5反应
ROH
+
PX 3
RX + H3PO 3
(X=Cl 、 Br、I)
优点:不发生重排
因为反应是按SN2历程进行,不生成碳正离子中间体。
3. 醛、酮还原制醇
C O [H] CH OH
[H]: 催化氢化、NaBH4、LiAlH4、 Al[OCH(CH3)2]3等
CH3CH2CH2CHO O CH3CH2-C-CH3 NaBH4 H2O NaBH4 H2O CH3CH2CH2CH2OH 85% CH3CH2-CH-CH3 OH 87%
有机化学10醇酚醚

CH2=CH
OH
6
5
4-丙基-5-己烯-1-醇
3 21
-CH=CHCH2-OH 3-苯基-2-丙烯醇
如果为多元醇-----选择含尽可能多-OH的最长碳 链为母体。
CH3 CH3 CH3 — C — C—CH3
OH OH
2,3-二甲基-2,3-丁二醇
1CH2OH CH3CH2 -2C-CH2OH
3CH2OH
H
反应实质是SN2取代历程
醇分子间脱水和分子内脱水是两种互相竞争的反应。
较低温度——取代-----有利于生成醚(~140℃) 较高温度—消---除--—有利于生成烯烃(~170 ℃ )
4. 酯的生成
醇和无机酸、有机酸作用,生成相应的酯
与有机酸反应: O
C2H5OH + CH3-C-OH
O
H+
CH3-C-O-C2H5 + H2O
酸性
HOH pka:
>
CH3OH
> CH3CH2OH
> (CH3)2CHOH
> (CH3)3COH
15.7
16
18
18
19
碱性 -OH < CH3O ˉ < CH3CH2Oˉ < (CH3)2CHOˉ < (CH3)3COˉ
钠与其他活泼金属如镁、铝、铝汞齐(Al-Hg)、镁 汞齐(Mg-Hg)等在较高温度下作用生成醇镁、醇铝。
原因------主要是 分子间形成氢键。
CH3CH2OH
b.P. 78.5℃
HOCH2CH2OH b.P. 198℃
3. 水溶性
① 低级醇(C1 ~ C3)能与水混溶
② 从C4开始,随C 溶解度
H
R
有机化学基础知识点整理醇酚醚的结构与性质

有机化学基础知识点整理醇酚醚的结构与性质醇酚醚的结构与性质有机化学中,醇、酚和醚都是常见的官能团,它们具有不同的结构和性质。
本文将对醇酚醚的结构和性质进行整理和讨论。
一、醇的结构与性质醇(Alcohol)是由一个或多个氢原子被羟基(OH)取代的碳链所组成的有机化合物。
根据羟基(OH)的位置和数量的不同,醇分为一元醇、二元醇、三元醇等。
常见的醇有甲醇、乙醇、丙醇等。
1. 醇的结构:醇分子的结构中,羟基(OH)通过共价键与碳原子连接。
根据羟基的位置,醇分为原位醇和侧链醇两种。
原位醇是羟基直接连接在主碳链上,侧链醇是羟基连接在侧链上。
例如,乙醇的结构式为CH3CH2OH,羟基直接连接在碳链上。
2. 醇的性质:(1)溶解性:低碳醇(一元醇和二元醇)在水中具有良好的溶解性,随着碳链的增加,溶解度降低。
这是因为羟基与水分子之间形成氢键,促使其溶解。
但长碳链醇的溶解度较低,因为疏水性增强。
(2)酸碱性:醇分子中的羟基能够释放H+,具有一定的酸性。
例如,乙醇在碱性条件下能够与氢氧根(OH-)发生反应生成乙醇盐。
(3)氧化性:醇的氧化性较强。
一元醇可以被氧化为相应的醛或酸,二元醇可以被氧化为相应的酮。
二、酚的结构与性质酚(Phenol)是一个芳香核上带有羟基(OH)的有机化合物。
酚分子结构中,羟基和芳香环直接连接。
常见的酚有苯酚、邻苯二酚等。
1. 酚的结构:酚分子中,羟基(OH)与苯环的碳原子通过共价键相连。
例如,苯酚的结构式为C6H5OH。
2. 酚的性质:(1)溶解性:酚在水中有限度的溶解,但较低碳醇溶解度差。
这是因为酚分子中的羟基通过氢键与水分子作用,但芳香环的疏水性增强溶解度降低。
(2)酸碱性:酚是一种弱酸,其羟基能够释放H+。
酚能够与碱发生中和反应,生成相应的酚盐。
(3)亲电性:酚具有较强的亲电性,能够与亲电试剂发生取代反应。
酚的取代反应主要发生在氧原子周围。
三、醚的结构与性质醚(Ether)是由两个碳原子中间用氧原子连接的有机化合物。
大一有机化学醇酚醚知识点

大一有机化学醇酚醚知识点有机化学是化学中的一个重要分支,研究的是有机物的结构、性质、组成、反应、合成等方面的内容。
大一的学生在学习有机化学时,会接触到很多基础知识,其中就包括醇酚醚的相关知识。
本文将从醇、酚和醚的定义、性质与合成等方面分析和讨论这些知识点。
首先,我们来了解一下醇的概念。
醇是指一类含有羟基(OH基团)的有机化合物,常见的有甲醇、乙醇、丙醇等。
醇的命名规则一般是根据碳原子数目以及羟基的位置进行命名。
例如,乙醇由两个碳原子和一个羟基组成,因此它的化学式是C2H5OH。
醇的性质与其结构有关。
由于醇分子中含有羟基,因此醇分子具有较强的极性。
这使得醇能够形成氢键,使得醇分子之间的相互作用较强。
醇的氢键可以使得醇的沸点、溶解度等性质较醚、酚等有机化合物要高。
此外,醇还具有酸碱性质。
由于醇中羟基上的氢原子可以脱离,形成氧负离子,所以醇可以与碱发生酸碱中和反应。
接下来,我们来探讨一下酚的知识点。
酚是指一类含有苯环上一个或多个羟基(OH基团)的有机化合物,常见的有苯酚、间甲酚、邻酚等。
酚的命名规则与醇类似,也是根据苯环上的位置进行命名。
例如,苯酚由苯环上的一个羟基组成,因此它的化学式是C6H5OH。
酚的性质与醇类似,也具有较强的极性和酸碱性质。
由于酚分子中含有苯环,使得酚分子结构更加稳定,其沸点和熔点较醇类物质要高。
酚还具有很强的溶解性,可以溶解在水中。
最后,我们来了解一下醚的知识要点。
醚是一类含有两个有机基团(烃基)的有机化合物,中间以氧原子连接,常见的有乙醚、甲醚、二甲醚等。
醚的命名一般是按照两个烃基的名称进行命名。
例如,乙醚由两个乙基基团组成,因此它的化学式是C2H5OC2H5。
醚的性质与醇和酚有所不同。
醚分子中的氧原子与两个有机基团连接,形成了一个与醇和酚不同的分子结构。
这使得醚的极性较醇和酚要小,其沸点和溶解度常常比醇和酚低。
此外,醚还具有较高的挥发性和不良燃烧性。
至此,我们对大一有机化学中的醇、酚和醚有了初步的了解。
有机化学 醇、酚醚10

注意:醇可以与PI3(或PBr3),PCl5或SOCl2反应生 成相应的卤烷,而不发生重排:
3ROH + PI3
3RI + P(OH)3
(P + I2 或Br2)
ROH + PCl5
RCl + POCl3 + HCl
ROH + SOCl2
RCl + SO2 + HCl
6.3.3 与无机酸的反应 •与硫酸、硝酸、磷酸等也可反应,生成无机酸酯:
第六章 醇、酚、醚
• 醇和醚都是烃的含氧衍生物。它们可看成是水分子
中的氢原子被烃基取代的化合物。
H—O—H
R—OH R—O—R’
水
醇
醚
• 硫和氧同属于周期表中第VI A族,因此,有机含硫化 合物与有机含氧化合物有一些相似的性质。
(一)醇
•6.1 醇的结构、分类、异构和命名 6.1.1 醇的结构
•官能团:羟基(—OH)(又称醇羟基)。 • 氧原子的电子构型:1s22s22px22py12pz1。
• 低级醇为具有酒味的无色透明液体。
• C12以上的直链醇为固体。 • 低级直链饱和一元醇的沸点比相对分子质量相近的 烷烃的沸点高得多。
(醇分子间氢键缔合)
R
R
O
HO
H
HO
HO
R
R
• 直链伯醇的沸点最高,带支链的醇的沸点要低些, 支链越多,沸点越低。
正丁醇 > 异丁醇 > 仲丁醇 > 叔丁醇
沸点: 117.7℃ 108℃ 99.5℃ 82.5℃
RCH2-OH + HCl ZnCl2 RCH2Cl + H2O
• 由伯醇制备相应的卤烷(碘烷除外),一般用卤化钠和 浓硫酸为试剂:
南昌大学2010-2011-2有机化学期末考试试卷(B)及答案

南昌大学 2010~2011 学年第二学期期末考试试卷试卷编号:6046 (B )卷课程编号:Z5503B301 程名称:有机化学(上)考试形式:闭卷适用班级:09化学、09应化1、2 姓名:学号:班级:学院:理学院专业:考试日期:题号一二三四五总分累分人签名题分66 7 12 8 7 100得分考生注意事项:1、本试卷共13页,请查看试卷中是否有缺页或破损。
如有立即举手报告以便更换。
2、考试结束后,考生不得将试卷、答题纸和草稿纸带出考场。
一、选择题:(每小题1.2分,共55小题,66分)得分评阅人1.在1H NMR中左边物质的哪一种质子将被观察为二重峰?(A),a (B),b (C),c (D),d (E), e2.下列哪种物质为该反应的主要产物?3.下列哪种物质更倾向于以s-反式存在?4.下列哪种物质为该反应的主要产物?5.下列哪种物质为该反应的主要产物?6.下列哪种物质为该反应的碳正离子重排主要产物7.下列哪两种是环己烯溴化过程中的链增长步骤?(A), I 和II (B), I 和IV (C), I 和V (D), II 和V (E), III和IV8.实现这个转换可采用下列哪种方法?9.实现这个转换可采用下列哪种方法?10.下列哪种为该反应系列的主要产物?与其邻位异构体与其邻位异构体11.这个物质(R)-3-溴-5-羟基戊酸经氧化后产生3-溴戊二酸,该3-溴戊二酸是:(A) 两个不等量的非对映异构体的混合物(B) 外消旋混合物(C) 单一的纯的对映体(D) 一个内消旋化合物(E) 一个非手性化合物12.下列化合物哪种发生单分子消除更容易?13.下列哪种是该亲核取代反应的主要产物?14.下列哪种是该化合物的IUPAC名字?(A),2-(1-甲基乙基)-3-丁基-戊烷(D),2,3-二-甲基-4-乙基辛烷(B),2-异丙基-3-丁基戊烷(E),2-异十二烷(C),3-乙基-2-异丙基庚烷15.上述两种结构是(A)相同的(B) 同一化合物的两种构象(C) 对映体(D)非对映异构体(E) 构造异构体16.下列哪种反应式得到的产物是该反应的主要产物?17.下列哪种中间体是该反应中生成最快的?18.下列哪种化合物是非手性的?19.通过Diels-Alder反应制得该物质,下列哪种是最好的原料组合?20.下列哪种是该反应的关键中间体?21.上述物质与碘化钠的丙酮溶液反应性顺序是:22.下列哪种方法是合成左边这个物质的最佳?23.(8550)下面化合物中,哪一根键最长?C H3C H C H2C H C C HA B C D24. (8551)Lindlar 试剂的组成是什么?A B C DCrO 3P d -BaSO 4Hg(OAc)2/THF HCl+ZnCl 2//NN25. (8552) 预测CH 3CCCH 2CH 3在酸催化下与水加成后,生成下述产物中的哪一种?A 一种酮B 一种醛C 两种酮的混合物D 一种二元醇 26. (8553)根据化合物的酸碱性,下列反应不能发生的是:A B CRC CH CNa NH 3RONa R 'C ROHCH 3CH 2ONaOH +RC +NH 2+CHR 'C CNa+CNa +CH 3C CH +DHCAg(N H 3)2NO 3AgC CAgCH +(白色)27. (8902)下列反应机理说明正确的是:++AB CDCH 3CHCH 2BrCH 3CH 3OH CH 3CHCH 2OCH 3CH 3CH 3CHCH 3CH 3OCH 3S N 1CH 3I +-OHCH 3OH +-I --+NaOHC HBrC 6H 5CH 3C HOH C 6H 5CH 3+H 2OC 6H 5CHCH 3OH(+)-(R)-C 6H 5CHCH 3BrS N 2S N 1S N 128. (8914)下列哪些化合物不能用来制备Grinard 试剂?(1)(2)(3)(4)(5)BrCH 2COOHBrOBr CH 3CCCH 2ICH 3CH CH 2CH 2Br NH 2(A ) 1,3,4 (B )1,2(C )1,3,5 (D )3,529. (8878)丙烷二氯代时,得四种产物。
有机化学(第二版)第十章 醇 酚 醚

10. 10.3 物理性质
状态: 一、状态:
C4以下:无色有酒精气味的液态; C5-C11:具不愉快气味的油状液态; C12以上:无色的蜡状固体;二元醇和多元醇具 甜味,故乙二醇有时称甘醇。
二、沸点
缔合:是靠分子间相互吸引而产生的一种特 殊键-氢键。 由于分子间或分子中的氢原子和两个含 有未共享电子对而且电负性很强的原子互相 吸引而形成的键。例如O、N、F等。 聚合:是指分子靠化学作用而形成的共价键 或离子键使分子结合在一起。
优点: 1)SOCl2的bp.低,可蒸馏除去过量的SOCl2 2)副产物SO2,HCl均为气体
三、与无机酸的反应
ROH
+
H OSO3H
ROSO3H
+
OH2
蒸蒸 2 CH3OSO3H (CH3)2SO4
+
H2SO4
ROH
+
(CH3)2SO4
ROCH3
+
H2SO4
醇也能与硝酸作用生成硝酸酯,硝酸酯受 热会发生爆炸,∴多元醇的硝酸酯都是烈 性炸药。
+
.H2
+
.H2
[O] RCH2OH RCHO
[O]
RCOOH
为使1º醇氧化控制在醛阶段,常选用一些 选择性的氧化剂: • ① Sarrett试剂: CrO3.py • ②Jones试剂:CrO3.H2SO4 • ③ 活性MnO2 氧化醇到醛, 不氧化双键
10. 10.6 硫醇
一、性质 1、弱酸性
在同系列中醇的bp.也是随C数的增加而有 规律的上升,并且在同C数的一元饱和醇中, bp.也是随支链的增多而降低。
三、结晶醇 与水相似,低级醇也能与某些无机盐类形成 结晶状分子化合物。它们不溶于有机溶剂而 溶于水。利用这一性质可使醇与其它化合物 分开,或从反应产物中除去醇类。例如:乙 醚中杂有乙醇+CaCl2。 注意:在制备低级醇时不能使用无水CaCl2 作干燥剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
bp (oC)
O N
O OH
100
溶解度(100ml水) 0.2g
NO2 HO
194 1.35g
HO
NO2
分解 1.69g
三、酚的化学性质
1、酸性
酚的酸性比醇强但比碳酸的酸性弱(Pka=10)
OH
ONa
NaOH
H2O
ONa CO2 H2O
OH NaHCO3
CH3CH2OH NaOH
不反应
酚的邻对位上连有供电子基团时,酚的酸性变弱;连有 吸电子基团时酸性变强
Cl3CCH2OH > ClCH2CH2OH > CH3CH2CH2OH
碱性:ROH + H
ROH2
2、亲核取代反应 1)与HX的反应
ROH + HX
烷基的影响 :
RX + H2O
CH2OH CH2=CHCH2OH 3o > 2o > 1o < CH3OH
ROH H ROH2
X
SN1
RX
R + H2O
OH C CH3
H (C6H5)3COH
3、由羰基化合物还原制备
O R C R' 醛、酮
NaBH4 (or LiAlH4)
OH R CH R' 一、二级醇
O R C OR' (OH) LiAlH4
酯、酸
R CH2OH 一级醇
4、由卤代烷水解制备
NaOH
CH2=CHCH2Cl
CH2=CHCH2OH
O C O S Cl Cl C
+ HCl (SN2为主)
COH + PCl3
(RO)3P
RCl
+ HCl
4)、与磺酰氯的反应
O
O
ROH + ClOS
CH3
ROS
CH3
O
O
对甲苯磺酸基是个很好的离去基团,利用此反应可以 用醇为原料合成卤代烃
3、消除反应:E1机制,扎伊切夫规则,重排
CH3CH2CHCH3
O2N
OH +
NO2 OH
约15% Yield
30-40% Yield
OH HO3S
浓 HNO3
SO3H
OH
O2N
NO2
苦味酸 NO2
3)、磺化:可逆,可以用做保护基
OH
浓H2SO4
20oC 100oC
OH +
SO3H 50% 90%
OH SO3H 稀H2SO4
苯酚
50% 10%
4)、付氏烷基化、酰基化反应
O O CCH3
l Claisen重排:主要上邻位,若邻位有取代 基,重排到对位
14
OH + ClCH2CH=CH2
NaOH
14
O CH2CH=CH2
OH
14
CH2CH=CH2
200oC
O
O
O
H
OH
2)、氧化反应 (了解)
OH CrO3
H
O
OH
Ag2O
OH
OH
[O]
O 对苯醌 O
邻苯醌 O O
OH
OH
+ CH3(CH2)4CO2H ZnCl2
OH
HO
O C(CH2)4CH3
Fries重排:分子间重排
O
OH
Ac2O
O CCH3
AlCl3 160oC
AlCl3 25oC
OH O CCH3
OH
O CCH3
5)、Kolbe 和Reimer-Tiemann反应
Kolbe Reaction:
Na2CO3
6)、亚硝化、重氮盐偶合反应
OH
+ NaNO2 + H2SO4 0-5oC ON
OH
对位产物
O +N N 重氮盐
O
NN
偶氮化合物
3、其它一些反应
1)、酯化、成醚反应
酯ቤተ መጻሕፍቲ ባይዱ反应(类似于醇): O
OH + CH3CCl
Et3N (三乙胺)
成醚反应:
OH
OH + RX
OR
RX:1、2级活泼卤代烷,或活泼芳香卤代烃
H2O
OH
重氮盐的制备将在胺一章中讲述
第三节:醚
一、醚的结构与命名 1、结构:
O
R
R1
SP3杂化,R、R1可以相同(简单醚), 可以不同(混合醚)
2、命名
非环状醚:
CH3CH2OCH2CH3 CH3OCH2CH2CH3
普通: (二)乙醚
甲(基)丙(基)醚
系统: 乙氧基乙烷
1-甲氧基丙烷
CH3OCH2CH2OCH3 普通: 乙二醇二甲醚
Mg
Br
乙醚
HCHO
MgBr
H
MgBr
H
O
CH2CH2OH
CH2OH
二级醇
O CH2MgCl + HC
O
H
CH2 C
2 CH3CHCH2MgBr + HCO2C2H5
CH3
甲酸酯
H (CH3CHCH2)2CHOH CH3
(R2CHOH, 对称的二级醇)
三级醇
CH3MgBr +
2
MgBr +
O
C
H
CO2C2H5
CrO3 or Na2Cr2O7 / H (H2SO4, HClO4, AcOH...)
Py2 CrO3 Py:
N
PCC (Pyridinium Chlorochromate)
H3C
CH(CH3)2 OH
Na2Cr2O7 H2SO4/H2O
70oC
H3C
OH
CrO3/H2SO4/H2O 丙酮 25oC
第十章:醇、醚、酚
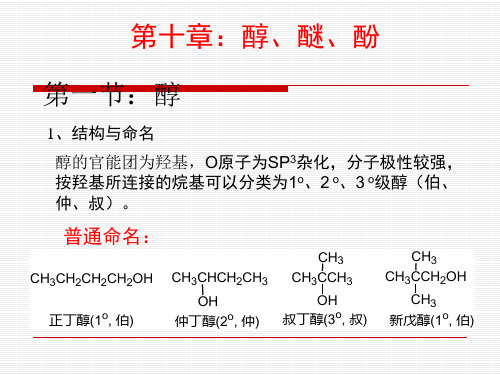
第一节:醇
1、结构与命名
醇的官能团为羟基,O原子为SP3杂化,分子极性较强, 按羟基所连接的烷基可以分类为1o、2 o、3 o级醇(伯、 仲、叔)。
普通命名:
CH3CH2CH2CH2OH 正丁醇(1o, 伯)
CH3CHCH2CH3
OH 仲丁醇(2o, 仲)
CH3 CH3CCH3
OH 叔丁醇(3o, 叔)
60% H2SO4 100oC
OH
H3C C
H C
H
CH3
CH3 H3C C CH3
OH
20% H2SO4 90oC
H3C C CH2 H3C
消除反应得到取代较多的烯烃,称为扎伊切夫规则
4、酯化反应
O
O
C2H5OH
+ CH3COH
H
CH3COC2H5 + H2O
O
O
O
C2H5OH + CH3CCl 或 (CH3C)2O Base CH3COC2H5
第二节:酚
一、酚的结构与命名
H
O: SP2杂化(近似), OH呈强给电 子性,存在烯醇式-酮式互变异构。
u = 1.6D
HH
OH
O H = 66.9 kJ/mol
OH CH3 C CH2
O CH3 C CH3 H = -58.6 kJ/mol
酚的命名
OH
OH
CH3
间甲酚
CH3
对甲酚
OH
Me C(CH3)3
其它:与浓H2SO4, HNO3等
5、醇的氧化反应
1)、用KMnO4,MnO2, K2Cr2O7或CrO3氧化
KMnO4:可用于由某些醇合成酸
CH3CH2CH2OH
KMnO4 OH
H
O
CH3CH2COH
O CH3CH2CH
OH
CH3CHCH3
KMnO4 OH
O CH3CCH3
伯醇生成酸 、仲醇生成酮
H3C
CH3 C OH CH3
KMnO4 OH
KMnO4 H
H3C C
H3C
CH2
O CH3CCH3 + CO2
MnO2:用于苯甲醇、烯丙醇等的氧化
CH=CHCH2OH MnO2
CH=CHCHO
O CH3CH2CHCCH2CH3
OH
MnO2
O CH3CH2CCCH2CH3
O
K2Cr2O7或CrO3:常用于由醇合成醛、酮
CH3 CH3CCH2OH
CH3 新戊醇(1o, 伯)
系统命名:
H
H
CC
H3C
CHCH2OH
CH2CH2CH2CH3
(Z)-2-丁基-3-戊烯-1-醇
Cl CH2CH2OH
2-(3-氯苯基)乙醇
CH3CHCH2NH2 OH
1-氨基-2-丙醇
HOCH2CH2OH 乙二醇
HOCH2CH2CH2OH 1,3-丙三醇
2-甲基-4-叔丁基-苯酚
O2N
OH
HO 4-硝基间苯二酚 or 4-硝基-1,3-苯二酚
Cl
OH
H3CO 6-甲氧基-7-氯-2-萘酚
or 6-甲氧基-7-氯--萘酚
HO
CO2H
对羟基苯甲酸 or 4-羟基苯甲酸
二、酚的物理性质
l 低熔点固体或高沸点液体。 溶解性:在水中有一定的溶解度, 苯酚9g/100mlH2O。
OH
120-150oC, 0.5MP
K2CO3 200-250oC, 0.5MP
OH CO2Na H
OH
H
CO2K
OH CO2H
OH
CO2H
反应机制: O OCO
