化工原理课件 (5)
化工原理课件第五章 蒸馏

Q FcP (T tF )
FcP (T te ) (1 q)Fr
T
te
(1
q)
r cp
tF-原料液的温度℃ T-通过加热器后原料液的温度℃
te-分离器中的平均温度℃ F-原料液流量Kmol/h
cp-原料液平均比热KJ/(Kmol. ℃) r-平均汽化潜热
三、气液平衡关系
理想溶液:
x
A
A
p
1.2.2 非理想物系的气液平衡
1.具有正偏差的溶液 一般正偏差:pA>pA理, pB>pB理。
乙醇-水溶液相图 正偏差溶液:x=0.894,最低恒沸点,78.15℃
2. 具有负偏差的溶液 一般负偏差 pA<pA理, pB<pB理。
硝酸-水溶液相图 负偏差溶液:x=0.383,最高恒沸点,121.9℃
组分: A、B 一、相律分 析: 变量 : t、p、xA、 yA
相数: 气相、液相
自由度:f c 2 2
C:独立组分数
Ø:相数
一定压力下:液相(气相)组成xA(yA)与温度t存在一 一对应关系气液组成之间xA~yA存在一一对应关系
二、两组分理想物系气液平衡函数关系 1. 拉乌尔定律( Raoult’s Law)
xF,y,x--分别为原料液、气相与液相产 品的组成,摩尔分率。
y
FxF Wx D
F
F W
xF
W F W
x
q W 液化分率 F
=1 1 q
xF
q 1 q
x
qx q 1
q
1
1
xF
平率衡为蒸馏中气液相平衡组q 成的关系。通过(xF, xF )斜
化工原理下册课件第5章 干燥(湿物料的性质)

影响降速阶段的因素: • 干燥速率主要决定于物料本身的结构、形状和大小
(水分在物料内部的迁移速率)。而与空气的性质 关系很小。
三、临界含水量
临界含水量=f(物料的性质、厚度、干燥速率、干燥器 的种类、干燥操作条件)
无孔吸水性材料XC>多孔材料XC 厚度增加 XC 分散越细, 干燥面积 XC 恒速段干燥速率 XC
定时测定物料的质量变化,并记录每一时间间隔D内 的物料的质量变化DW及表面温度q,直到物料的质量
恒定为止。此时物料所含的水分即为该条件下的平衡 水分。
干燥曲线和干燥速率曲线
AB和A’B的区别:AB段是在物料初始温度小于空 气的湿球温度,而A’B段则是物料的初始温度大于 空气的湿球温度
• AB(或A’B)段: AB为湿物料不稳定的加热过程。 该过程的时间很短, 将其作为恒速干燥的一部分。 X下降,θ增加至空气的湿球温度。
生产中为保证产品质量,降低XC 措施:减小物料的厚度
非结合水分:包括机械地附着于固体表面的水分,如 物料表面的吸附水分、较大孔隙中的水分等。
特点:物料中非结合水分与物料的结合力弱,其蒸汽 压与同温度下纯水的饱和蒸汽压相同,干燥过程中除 去非结合水分较容易。
ቤተ መጻሕፍቲ ባይዱ强调:
物料的结合水分和非结合水分的划分只取决于物料
本身的性质,而与干燥介质的状态无关;
平衡水分与自由水分则还取决于干燥介质的状态。
二、结合水分(bound water)与非结合水分(unbound water)
划分依据:根据物料与水分结合力的状况 结合水分: 包括物料细胞壁内的水分、物料内毛细 管中的水分、及以结晶水的形态存在于固体物料之中 的水分等。
《化工原理》课件

学习资源
1 教材推荐
2 参考书目
除了《化工原理》教材外, 我们还推荐以下参考教材, 有助于更深入地理解化工 原理。
在课程中提供的参考书目 中,您可以找络资源
我们提供一些网络资源, 供学生进一步学习化工原 理和实际应用。
推荐使用《化工原理》教材, 该教材详细解释了化工原理 的基本概念和实际应用。
重要概念
1 反应原理
了解不同类型的化学反应和它们的原理,如 合成反应、分解反应和酸碱反应。
2 质量守恒与能量守恒
理解质量守恒定律和能量守恒定律,并学会 在化工过程中应用。
3 化学平衡
4 反应动力学
学习如何计算和控制化学反应中的平衡常数, 以及如何进行反应平衡的优化。
《化工原理》PPT课件
欢迎来到《化工原理》PPT课件!本课程将介绍化工基本原理和实际应用,帮 助您理解化工流程和反应动力学。
课程介绍
课程目标
掌握化工基本原理,理解反 应动力学,培养化工工艺设 计的能力。
课程概述
介绍化工原理相关的重要概 念和实际应用,涵盖质量守 恒、能量守恒和化学平衡等 方面。
教材介绍
掌握反应速率和化学动力学的概念,了解如 何改变反应速率和提高反应效率。
实际应用
化工工艺流程
了解化工工艺流程的基本原理,包括物料流动、反 应控制和产品分离等关键步骤。
催化剂的应用
探索催化剂在化工过程中的重要作用,了解如何选 择和使用催化剂以提高反应效率。
课程评估
课堂作业 期中考试 期末考试
通过完成课堂作业,巩固对课程知识的理解和应 用能力。 进行期中考试,评估学生对化工原理的掌握程度。
化工原理蒸馏课件5

4.操作型计算的类型(1)(P288 例7-6)
Nm
D W
zF
xw
R
q
N M 平衡曲线
设xD
精馏段、提馏段操作线方程 重设xD
Nm’=Nm ?
输出
二)精馏塔的操作 1.保持操作稳定,使塔内各处汽液组成和温度 稳定,料液在塔内汽液组成与其相同的位置加 入避免不同组成的物流的混合,是保持最佳操 作状态的基本条件。 2.保持精馏装置进、出物料平衡是保证塔稳定 操作的必要条件。
Rmin 与此对应 NT 全回流 NT N min
1
3.简捷法的步骤:
R Rmin N N min , R 1 N 1
六 Gilliland 快速估值法
4.研究条件:吉利兰图是用8个物系在下面的条件 下逐板计算得出的结果绘制,这些条件见下表。 组分数目 进料状态 2~11 5
四.加料状态的影响和加料板位置 L L I iF q F I i
过冷液体 q>1 饱和液体(泡点)q=1 汽液混合物 0<q<1 饱和蒸汽 q=0 过热蒸汽 q<0 (4)精馏段与提馏段的 汽液流量之间的关系 L' L qF
V V (1 q) F
'
二)精馏段和提馏段操作线的交点 -----q线方程 精: yn 1 提:
xD ye Rmin Rmin 1 xD xe Rmin x D ye ye xe
(xe,ye)由平衡线和q线(或者
精馏段操作线)联立求解确定。
对非理想溶液最小回流比确定:
平衡线下凹,出现拐点,只能图解。
最小回流比--解析求解
xe ye 平衡线:ye= , xe= 1 ( 1) xe + ( 1) ye
化工原理ppt课件
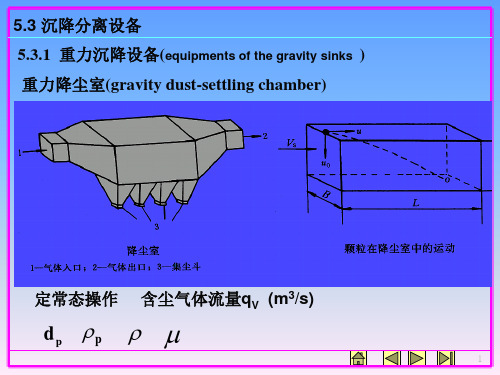
B
•
•••••
• •
H
u hor izont al
qV BH
设在水平方向上,颗粒与气体流同速。
工程处理方法:寻找颗粒得以分离的条件,从时间上考虑。
((停沉rseemt留降tlain时时ingin间间dgu::rdau颗trioa粒nti)o随n同)t 气流uh在t 降尘h室为中颗的粒时距间离段底平 r面的u距horL离izontal
A
B
D
B D 4
ui
qV A B
ui 的大小影响到器内进口旋涡、锥形底口灰 卷起情况、气流经过设备的总压降均有关。
27
两种常用旋风分离器的各部位尺寸比例
28
根据实验气体旋转圈数N一般去3-5. 例1:已知含尘气体中尘粒速度为2300kg/m3.气体温度为500℃, µ=0.036cp流量为1000m3/h.采用某种形式的旋风分离器,D=400mm, B=D/4,A=D/2,H=2D,d=D/2.试估算临界直dpc(即dmin)
16
2
理 论 上 :i
dp d pc
两边同时取自然对数:
lni
2 ln d p d pc
d p d pc 注意:dmin或者d pc指能够100%被沉降分离的最小颗粒粒径。
17
5.3.2 离心沉降(centrifugal settling) 和 离心沉降设备
在离心力的作用下,使流体中的颗粒产生沉降运动(离心力 方向上的运动),称为离心沉降。
分离器。以旋风分离器为例,分析离心分离设备的工作原理、 生产指标与设备尺寸、操作条件的关系。
处理物料为含尘气体,连续稳定的操作状况。
21
(1)旋风分离器的构造及工作状态
南京理工化工原理课件5 --蒸 馏

蒸 馏
第一节 概述
蒸馏是分离液体混合物的典型单元操 作。这种操
作是利用液体混合物中各组分挥发度不同的特性 而实现分离的目的。
蒸馏按操作是否连续可分为连续蒸馏和间歇蒸馏。
按蒸馏方法可分为简单蒸馏、平衡蒸馏、精馏和
特殊精馏等。
按操作压强可分为常压、加压和减压精馏 。
第二节 两组分理想物系气液平衡
E NT NP 100%
3.塔高的确定
Z =(NP-1)·T H
二、塔径的计算
V
D
4
D 2u
4V u
5-5-8 两组分精馏的其它类型
(1)直接蒸气加热;
(2)多侧线进料或出料; (3)塔顶为分凝器; (4)回收塔。
一、直接蒸汽加热 总物料 : L′+V0=V′+W
易挥发组分
L′xm′+V0y0=V′ym+1′+Wxw
一、进料热状况的影响
A
B
冷液
泡点 饱和液体 气液混合 平衡
C
DLeabharlann 露点饱和蒸汽E 过热蒸汽
1.q与五种进料的关系
q
L L F
进料中液相所占的比例
L L qF
V V 1 q F
泡点进料
q 1
L´=F+L
V´=V
平衡进料
0 q 1
L´=qF+L
V´=V-(1-q)F
R R 1 xD R 1
yn 1
xn
xD
x
5.5.2
提馏段操作线方程推导
y
xD R 1
xW
ym 1 L' L W
'
化工原理第四版课件(第五章吸收)

第五章:吸收 概述气液相平衡吸收过程的传质速率吸收塔的计算填料塔第一节:概述一、吸收吸收的定义:吸收是利用气态均相混合物中各组分在吸收剂中溶解度的差异来实现分离的单元操作。
吸收的目的:I.回收或捕获气体混合物中的有用物质,以制取产品II.除去工艺气体中的有害成分,使气体净化,以便进一步加工处理III.除去工业放空尾气中的有害气体,以免环境污染。
二、工业吸收了解工业生产中吸收及解吸过程、所需条件和典型设备例子工业上从合成氨原料混合气体中回收CO2乙醇胺脱硫法•需要解决的问题1.选择合适的溶剂2.提供适当的传质设备3.溶剂的再生三、溶剂的选择1.对溶质较大的溶解度;2.良好的选择性;3.温度变化的敏感性;4.蒸汽压要低;5.良好的化学稳定性;6.较低的黏度且不易生泡;7.廉价、无毒、易得、不易燃烧等经济和安全条件。
四、吸收的分类按有无化学反应:物理吸收和化学吸收按溶质气体的浓度:低浓度和高浓度吸收按溶质气体组分的数目:单组分和多组分吸收按有无热效应:等温和非等温吸收本章只讨论低浓度、单组分、等温的物理吸收过程。
五、吸收操作的经济性(费用)气液两相流经设备的能量损耗;溶剂的挥发及变质损失;溶剂的再生费用。
√六、吸收设备第二节:气液相平衡一、平衡溶解度恒温、恒压下,相互接触的气液两相的浓度不变时,气液两相之间的浓度关系。
气液两相组成的浓度分别用物质的摩尔分数来表示,即y= n i /Σn y 、x= n i /Σn x:气液两相中惰性组分的量不变,溶质与惰性组分摩尔比。
yy Y −=1xx X −=11.气体的溶解度气体在溶液中的溶解平衡是一个动态平衡,该平衡的存在是有条件的;平衡时气相中溶质的分压——平衡分压(或饱和分压),液相中溶质的浓度——平衡浓度(或饱和浓度),也即是气体在溶液中的溶解度;气体的溶解度是一定条件下吸收进行的极限程度;温度和压力对吸收操作有重要的影响;加压和降温对吸收有利;升温和降压对解吸有利。
化工原理课件第五章 吸收

η=
被吸收的溶质量 进塔气体的溶质量
Y1 Y 2 Y1
Y2=Y1(1-η)
qn,v Y1 Y2 条件所规定
X2 一般为吸收工艺
qn ,l ,m qn,v
Y1 Y2 X1* X 2
Y1 Y2
Y1 m
X
2
qn,l=(1.1~1.5)qn,l,m
2020/7/16
16
5-14 填料层高度的计算
溶解度随温度和溶质气体的分压不同而不同,平衡时溶质在 气相中的分压称为平衡分压。溶质组分在两相中的组成服从 相平衡关系。
加压和降温有利于吸收操作,反之,升温和减压对解吸有利。 但加压、减压费用太高一般不采用。
2020/7/16
6
5-2 亨利定律
亨利定律
当总压不高(一般小于500KPa)时,在一定温度下,稀溶液上 方气相中溶质的平衡分压与其在液相中的浓度之间存在着如下 的关系:
一、 填料层高度的基本计算式
填料层高度计算涉及物料衡算、传质 速率和相平衡关系。我们前面介绍的 所有传质速率方程都适用于稳定操作 的吸收塔中的"某一横截面",而不能用 于全塔。
该微元内,吸收质的传递量dG为:
dG qn,vdY qn,ldX
由吸收速率方程可知,该微元内,气相
和液相吸收质的变化量dG为:
在相内(气相或液相)传质方式包括分子扩散和湍流扩散。
分子扩散:当流体内部某一组分存在浓度差时,因微观的分 子热运动使组分从浓度高处传递到较低处,这种现象称为分 子扩散。
湍流扩散:当流体流动或搅拌时,由于流体质点的宏观运动
(湍流),使组分从浓度高处向低处移动,这种现象称为湍
流扩散。在湍流状态下,流体内部产生旋涡,故又称为涡流
化工原理课件5.颗粒的沉降和流态化

ut
dP2(P )g 18
2 Re P
500,阿仑区
,ut
0.781
d
1.6 P
(
P
0.4
0.6
)
g
0.714
当dp ,500 ReP 2105,牛顿(Newton )定律区 ,
ut 1.74
dP (P )g
与u无关。
5. 颗粒的沉降和流态化
5.2.2 静止流体中颗粒的自由沉降
前提:P
一、沉降的加速阶段:设初始速度等于0。
在沉降过程中颗粒的受力如下:
Fb
1、体积力:重力场:Fg mg
离心力:Fg
其中:对于球形颗粒:m
mr2
1 d
2、浮力:重力场:Fb
m
p
6
g
3
p
p
离心力:Fb
m
p
r 2
3、曳力:FD
Ap
1 2
u 2
FD Fg
5. 颗粒的沉降和流态化
5.2.2 静止流体中颗粒的自由沉降
度,曳力减小。
5、非球形:曳力系数比同体积球形颗粒为大, ut减少。
返回
5. 颗粒的沉降和流态化
5.3 沉降分离设备
基础:颗粒在外力作用下产生沉降运动,具有两 相 p 为前提。悬浮颗粒的直径越大,两相的密 度差越大,使用沉降分离方法的效果就越好。
根据作用于颗粒上的外力不同,沉降分离设备 可分为重力沉降和离心沉降两大类。
二、沉降的等速阶段
u曳力项 ,du d
du
d
0, 此时恒定u
ut
球形颗粒:
du
d
(P )g P
3 4d P P
化工原理下册课件第5章 干燥(湿空气的湿度图 (焓湿图))

二、 等焓线(等I线) 一组与水平线倾斜135°的直线 。读数范围0~
680kJ/kg绝干气。 三、 干球温度线(等t线)
固定总压下,给定不同的温度t值,以H为自变量,I为因变量, 根据I=(1.88t+2490)H+1.01t作出的曲线。当空气的干球温度t不变 时,I与H成直线关系,故在I-H图中对应不同的t,可作出许多 等t线。 各种不同温度的等温线,其斜率为(1.88t+2490),故温度 愈高,其斜率愈大。因此,成直线的等t线并不互相平行。
p
0
二、确定湿空气的状态点 (1)湿空气的干球温度t和湿球温度tw,70,30 ℃(a) (2)湿空气的干球温度t和露点td, 70,20 ℃ (b)
(3)湿空气的干球温度t和相对湿度j,70 ℃,20% (c)
例【5-3】:已知湿空气的总压为101.3kN/m2 , 湿度为 H=0.02 kg水/kg干空气,干球温度为70oC。试用I-H图 求解:
5.2.2 湿空气的湿度图 (焓湿图)
在工程计算中,常用的是以湿空气的焓值I为纵坐 标,湿度H为横坐标的焓湿图,即I-H图。
图上共有五种线,图上任一点都代表一定温度t和
湿度H的湿空气状态。
等湿度线(等H线): 等焓线(等I线): 等温线(等t线): 等相对湿度线(等j线) 水蒸汽分压线:
一、等湿度线(等H线) 一组与纵轴平行的直线。在同一条等H线上,湿空气
三、湿空气的状态变化过程 1、加热与冷却过程 加热:湿空气的加热与冷却
属等压过程,p不变,H不 变,AB线为一垂直线,沿 等H线由A到达B点,温度
升高,空气的j下降,干燥
能力上升。 冷却与加热过程相反
化工原理课件第五章 传热

温度场的通式
温度场的通式:
t f x, y, z,
式中: t —— 某点的温度,k;
X,y,z —— 这点的空间坐标;
θ —— 时间,s。
若在稳定温度场中, 表示式为:
t f x, y, z
稳定温度场和不稳定温度场
(1)不稳定温度场 —— 温度随时间而改变 的温度场,称为:不稳定温度场 。
称为:传热速率,用Q表示,单位:J/s, 即w(瓦)。
(三)辐射
1、辐射——是一种以电磁波传递能量的现象。 物体可以由不同原因发出辐射能。
2、热辐射——物体因热而发出辐射能的过程, 称为:热辐射radiation。
3、 只要物体的绝对温度大于 0K,便会不停地 将热量以电磁波的形式传递出去,同时也不断 地将其他物体辐射来的能量转为热量。辐射与 吸收能 量的差额转变为低温物体的热量。但 是,只有物体具有较高温度时, 辐射才为主 要形式。
传热面上不同局部面积的热通量可以不同。
3、热流量Q与热通量q的关系
式中:
q dQ dA
Q——热流量,单位为:J/s,即w(瓦) 。
q——热通量(热流密度),单位为:J/(m2·s),即 w/m2。
A——传热面积, m2 。
热流量Q与热通量q的关系
(1)热通量q基于微元面dA,热通量q可以 用于局部地区。
1、热源——电热、饱和水蒸汽、烟道气、高 温载体等。
2、冷源——冷却水、空气、冷却盐水等。 冷却水——河水、海水、井水等。
二、传热的三种基本方式
• 1、热传导(导热) • 2、对流 • 3、辐射
(一)热传导(简称:导热)
1、热传导——热量从物体内部温度较高
的部分传递到温度较低的部分或者传递到与 之接触的另一物体的过程,称为:热传导, 简称:导热conduction。
化工原理流体静力学课件5-阻力计算
⑤ 进口阻力损失:容器
流体 (a)
管 = 0.5
(a)
(b) 流体 (b)
⑥ 出口阻力损失:管
容器 = 1
Yang Yanzhao
SHANDONG UNIVERSITY
2. 当量长度法
le u hf d 2
/
2
J kg
le – 当量长度,m d – 与管件相连的管路内径
Yang Yanzhao
1.09 10
取
5
0.2 mm
0.2 mm 0.002 d 吸 100 mm
Yang Yanzhao
SHANDONG UNIVERSITY
查 0.025
H f吸
2 u吸 l ( 0.75 0.5) d 2g
H f吸
20 m (0.823m s ) (0.025 0.75 0.5) 0.1 m 2 9.81m s -2
A
B
②
如何通过实验装置测量直管段阻力损
失?并画出实验装置图。
Yang Yanzhao
SHANDONG UNIVERSITY
将式 (1) 代入式 (2) 得:
4l hf d
4 l hf d
(3)
2 u2 2 u 2
令
8 2 — 摩擦系数 u J l u2 hf (4) kg d 2
SHANDONG UNIVERSITY
例1-8 有一套管式换热器,内管为 25 mm1.5 mm,外管为45 mm2.0 mm。套管环隙通以冷却用的盐水,其 流量为2.5 t∙h-1, =1150 kg∙m-3, =1.210-3 Pas。试判断该盐水的流动型 态。 解: de = 41 mm – 25 mm = 16 mm
《化工原理课件PPT》

反应器工艺控制
探讨化工反应器的工艺控制方 法和策略,以实现理想的反应 效果。
化工与环境保护
1 绿色化工的概念
了解绿色化工的原理和目标,探索可 持续发展的化工工艺。
2 废物处理与资源回收
研究废物处理方法和资源回收技术, 以实现环境友好的化工生产。
解析蒸馏的原理和操作,探讨不同类型的蒸馏 工艺。
结晶和结晶工艺
研究结晶的原理和条件,学习如何设计和控制 结晶工艺。
其他分离纯化技术
介绍其他常用的分离纯化技术,如吸附、过滤 和离心等。
化工反应器的设计与工艺
反应器的类型
研究不同类型的化工反应器, 如批量反应器、连续流动反应 器和固定床反应器。
反应器的设计原理
3 环境影响评估
探索化工工艺对环境的影响评估方法,以减少对生态系统的损害。
化工原理课件PPT
化工原理课件PPT 大纲:介绍化工原理的概念和作用,化学反应与热力学基础, 化学平衡的计算与应用,反应动力学的基本理论。
化学反应与热力学基础
1 速率与能量变化
了解化学反应速率的测量方法,并探 究能量在化学反应中的转化过程。
2 巨正则系综和简正则系综
通过统计力学的概念来研究热力学性 质和化学平衡条件。
固-液-气体系的物质传递
固-液传质
研究固-液传质过程,如溶剂浸提 和吸附等。
气体吸收
探索气体吸收的原理和机制,解 析不同条件下的吸收过程。
萃取和蒸馏
学习萃取和蒸馏的原理和应用, 研究不同类型的分离工艺。
工业材料与化学品的分离纯化
萃取工艺
介绍萃取工艺的基本原理和步骤,探讨不同类 型的萃取剂。
化工原理蒸发课件

第三节 单效蒸发的工艺计算
(2)改善蒸发器内液体的流动状况 这方面的工作主要有:其一是设法提高蒸发器循环速度,其二是
在蒸发器管内装入多种形式的湍流元件。前者的重要性在于它不仅能 提高沸腾传热系数,同时还能降低单程气化率,从而减轻加热壁面的 结构现象。后者的出发点,则是使液体增加湍动,以提高传热系数。 还有资料报道向蒸发器管内通入适量不凝性气体,增加湍动,以提高 传热系数。
由于引起循环运动的原因不同,分为自然循环型和强制循环型两类。
自然循环型:由于溶液受热程度不同产生密度差引起。 强制循环型:依靠外力迫使溶液沿一个方向作循环运动 。
1.中央循环管式(标准式)蒸发器
加热蒸汽:加热室管束环隙内 溶液:加热室管束及中央循环管内, 受热时,由于中央循环管单位体积 溶液受热面小,使得溶液形成由中 央循环管下降,而由其余加热管上 升的循环流动。
二、蒸发器的辅助设备
(一)除沫器(汽液分离器)
蒸发操作时产生的二次 蒸汽,在分离室与液体分离 后,仍夹带大量液滴,尤其 是处理易产生泡沫的液体, 夹带更为严重。为了防止产 品损失或冷却水被污染,常 在蒸发器内(或外)设除尘 器。
图中(a)~(d)直 接安装在蒸发器顶部,(e )~(g)安装在蒸发器外 部。
1. 升膜蒸发器
原理:溶液预热到接近沸点时由蒸发器 底部送入,进入加热管时立即受热沸腾 汽化,溶液在高速上升的二次蒸汽带动 下,沿管壁边呈膜状向上流动边蒸发。 到达分离室后,完成液与二次蒸汽分离 后由分离室底部排出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
yn1
R R 1
xn
xD R 1
yn1
qnL qqnF qnL qqnF qnW
xn
qnL
qnW qqnF
qnW
xW
yq
q q 1 xq
zF q 1
理论塔板数的计算
(1)逐板计算法;(2)图解法;(3)简捷法
进料位置的讨论 q 的影响 回流比的影响
全回流与最少理论板数
7.9.2 萃取精馏
加入的第三组份能显著改变两组分间的相对挥发度,且本 身的挥发性很小,这种精馏方法称为萃取精馏。 该第三组分称为萃取剂。
典型实例:苯—环已烷的分离.
81
80.5
80
Temperature C
T-xy for C6H6/CYCLO-01
T-x 1.0133 bar T-y 1.0133 bar
0
0.2
0.4
0.6
0.8
1
Liquid/Vapor Molefrac C6H6
79.5
对萃取剂的基本要求:
(1)选择性强;
(2)溶解度大; (3)挥发性小; (4)其它经济、安全要求。 恒沸精馏和萃取精馏的比较 : (1)第三组分选择范围 恒沸精馏:与被分离组分形成最低恒沸物,选择相对难。 萃取精馏:选择范围要广得多。
反应
C3H6 C6H6 C9H12
丙烯
分离
特点: ① 生成产物及时移出反应区,化学平衡向有利方向移动,可提高反应的转化 率和选择性。 ② 由于生成的产物及时移出,使得反应物总浓度提高,有利于加快反应速率。 ③ 利用了反应热,降低了精馏过程的能耗。 ④ 反应器与精馏塔合二为一,节省了设备投资。
C3H6 C6H6 C9H12
(2)故障诊断 ① 塔的一端产品不合格
首先考虑塔的采出量是否满足物料衡算关系:
xD
qnF zF qnD
措施:调整采出量,使之与分离要求相匹配。
② 塔两端产品不合格
a) 生产负荷的影响 塔的进料流量——处理能力或生产负荷。 生产负荷不能超过对应工况下塔的最大生产能力。
措施:减少进料量,增大回流比。
b) 进料条件的影响 进料条件包括进料量、组成及热状态。 进料热状态的影响:
一般过冷5~10℃
qnL RqnD
7.5.7 精馏过程优化与分析
优化
进料位置 回流比 操作压力 理论板数 热进料状态参数
(1)诊断分析步骤
① 充分调查,收集数据; ② 应用物料衡算的关系检验精馏塔采出量的合理性。如果采 出不合理,就不可能使塔两端产品同时达到要求。 ③应用热力学原理,如相平衡关系,分析塔内温度、压力、 组成等分布的合理性。 ④应用理论级及塔板效率的基本概念,分析影响分离能力的 主要原因。 ⑤考查塔板的水力学性能,分析影响塔生产能力和分离能力 的原因。
无水乙醇:39.5kmol/h
分层 水:30kmol/h 乙醇:30.5kmol/h
精馏:水:5.4kmol/h 乙醇:30.5kmol/h
(2)对挟带剂的基本要求 ① 能形成最低恒沸物,且与塔底组分之间有较大的相对挥发度; ② 恒沸物中挟带剂的组成要小,降低挟带剂用量;
③ 恒沸物本身应易于分离; ④ 经济、安全。
Temperature C 82.5 87.5 92.5 97.5 102.5
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 Liquid/Vapor Molefrac ETHAN-01
原料:100kmol/h70%,乙醇、水
二元恒沸物: 水+乙醇 最低恒沸点78.15℃, 89.4%.
7.5.7 精馏过程优化与分析
优化
进料位置 回流比 操作压力 理论板数 热进料状态参数
(1)诊断分析步骤
① 充分调查,收集数据; ② 应用物料衡算的关系检验精馏塔采出量的合理性。如果采 出不合理,就不可能使塔两端产品同时达到要求。 ③应用热力学原理,如相平衡关系,分析塔内温度、压力、 组成等分布的合理性。 ④应用理论级及塔板效率的基本概念,分析影响分离能力的 主要原因。 ⑤考查塔板的水力学性能,分析影响塔生产能力和分离能力 的原因。
xD
(1) 理论板数确定
以最苛刻工况为设计依据 当釜液组成为 xW
塔顶产品组成为 xD 确定此时的适宜回流比R
(1) 理论板数确定
确定此时的适宜回流比R
Rm in
xD yWe yWe xWe
适宜回流比的选择是 一个经济问题
R终
根据最小回流比Rmin,选定适宜回流比R,图解理论板数NT。
② 操作型计算 恒定产品组成的间歇精馏的操作型计算:
q=1
0<q<1
措施:调整进料位置,适当提高回流比。
c) 理论板数的影响 塔的分离能力取决于理论塔板数和各板分离能力。 措施:提高理论板数或提高操作回流比。
d) 回流比的影响 回流比接近最小回流比时,塔内各板分离能力降低,导致
产品质量不合格。 措施:提高理论板数或提高操作回流比。
e )辅助设备和公用工程的影响 主要辅助设备包括再沸器和冷凝器,有时包括中间再沸器
Temperature C 140.4 140.55 140.7 140.85 141
0
0.2
0.4
0.6
0.8
1
Liquid/Vapor Massf rac ISOPR-01
T-xy for M-XYL-01/P-XYL-01
T-x 1.0 kPa T-y 1.0 kPa
T-xy for M-XYL-01/P-XYL-01
Rm in
xDi xDi
yWi xWi
③ 根据Rmin确定适宜操作回流比R;
④ 图解理论板数N。
(2)设计校核——操作型计算
计算平均组成:
xD
nF xF
nWe nD
xWe
参照简单蒸馏
ln
nF
xF
dxW
nWe xWe xD xW
若计算平均组成大于规定平均组成,则设计可行,否则,
重新给定初值进行迭代计算。
q=1
0<q<1
措施:调整进料位置,适当提高回流比。
c) 理论板数的影响 塔的分离能力取决于理论塔板数和各板分离能力。 措施:提高理论板数或提高操作回流比。
d) 回流比的影响 回流比接近最小回流比时,塔内各板分离能力降低,导致
产品质量不合格。 措施:提高理论板数或提高操作回流比。
e )辅助设备和公用工程的影响 主要辅助设备包括再沸器和冷凝器,有时包括中间再沸器
精馏过程节能技术:
(1)精馏塔设计和操作参数的优化 ① 适宜回流比和理论板数的选择; ② 适宜进料位置的选择; ③ 进料热状态的选择; ④ 操作压力的选择。
④ 塔温变化 ——塔压恒定,塔两端温度同时下降
原因: ◇ 塔顶采出量有所减少; ◇ 进料中易挥发组分含量有所增加; ◇ 进料量增加,而采出量未增加。
7.7 间歇精馏
连续精馏的局限
产品组成经常变化 批量小 混合物中产品种类多
间歇精馏
间歇精馏
流程及设备
qnD , xD
连续精馏的局限
qnF , zF
产品组成经常变化 批量小 混合物中产品种类多
(2)故障诊断 ① 塔的一端产品不合格
首先考虑塔的采出量是否满足物料衡算关系:
xD
qnF zF qnD
措施:调整采出量,使之与分离要求相匹配。
② 塔两端产品不合格
a) 生产负荷的影响 塔的进料流量——处理能力或生产负荷。 生产负荷不能超过对应工况下塔的最大生产能力。
措施:减少进料量,增大回流比。
b) 进料条件的影响 进料条件包括进料量、组成及热状态。 进料热状态的影响:
ቤተ መጻሕፍቲ ባይዱ
最小回流比
Rm in
xD ye ye xe
总板效率 ET 单板效率(Murphree 效率)
EmV
yi, j yi, j
yi, j1 yi, j1
复杂塔精馏
水蒸气直接加热的蒸馏 侧线采出 多股进料
EmL
xi, j1 xi, j xi, j1 xi, j
回收塔 分凝器
7.6.6 过冷回流
PIC
(2)能量消耗 恒沸精馏: 挟带剂以气态离塔,消耗的潜热较多。 萃取精馏:萃取剂基本不汽化,较经济。
(3)操作方式 萃取精馏:不能简单地用于间歇操作。 恒沸精馏:无此限制。
(4)热敏性物料 恒沸精馏的操作温度一般低于萃取精馏, 适于分离热敏性物料。
7.9.3 反应精馏
在特定的条件下,将反应过程与精馏过程进行集成,使 反应与精馏在蒸馏设备中同时进行的技术。
和中间冷凝器。 公用工程主要指加热蒸汽、冷却水或冷剂。
(2) 塔压的选择 塔压高:
③ 塔压差波动——生产负荷大时出现,且塔压差持续上升
原因: △ 由于工况改变引起塔内温度变化,导致“淹塔”; △ 对深冷系统,可能形成“冻堵”; △ 对易聚合、易结焦的体系,可能造成液流不畅; △ 刚检修开车时,确认塔内无固体杂物堵塞; △ 改造后,降液管面积或底隙过小设计。
理论板数不变,保证塔顶馏分组成不变,每一瞬间R要变化
7.7.2. 恒定回流比的间歇精馏
特点:塔顶产品组成不断降低; 釜液中组成也不断降低。
qnD , xD qnF , zF
qnW2 , xW2
已知: qnF zF 要求: xWe xD 规
求 :R N
计算过程:① 设定最初馏出液组成初值; ② 确定Rmin;
和中间冷凝器。 公用工程主要指加热蒸汽、冷却水或冷剂。
③ 塔压波动——生产负荷大时出现,且塔压差持续上升
原因: △ 由于工况改变引起塔内温度变化,导致“淹塔”; △ 对深冷系统,可能形成“冻堵”; △ 对易聚合、易结焦的体系,可能造成液流不畅; △ 刚检修开车时,确认塔内无固体杂物堵塞; △ 改造后,降液管面积或底隙过小设计。
