高考化学热化学试题汇编
热化学方程式和盖斯定律(2013-2014高考题汇编)

热化学方程式与盖斯定律2013--2014全国高考题汇编(2014·全国卷Ⅰ)28、已知:甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)△H2=-29.1KJ·mol-1乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))△H3=+50.7KJ·mol-1 则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=KJ·mol-1 (2014·重庆卷)⒍已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-12C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( )A.-332 B.-118 C.+350 D.+130(2014·广东卷)31.(16分)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① 1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g) ∆H1=-47.3kJ∙mol-1② CaSO4(s)+CO(g)⇋CaO(s)+CO2(g) +SO2(g) ∆H2=+210.5kJ∙mol-1③ CO(g)⇋1/2C(s)+1/2CO2(g) ∆H3=-86.2kJ∙mol-1反应2CaSO4(s)+7CO(g)⇋CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)的∆H=___________(用∆H1、∆H2和∆H3表示)(2014·江苏卷)10.已知:C(s)+O2(g)=CO2(g) △H1 CO2(g)+C(s)=2CO(g) △H2 2CO(g)+O2(g)=2CO2(g) △H34Fe(s)+3O3(g)=2Fe2O3(s) △H43 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5下列关于上述反应焓变的判断正确的是()A.△H1>0,△H3<0 B.△H2>0,△H4>0 C.△H1=△H2+△H3D.△H3=△H4+△H5 [2013∙海南卷∙5]已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H12 H2(g)+ O2(g)=2H2O(g) △H2C(s)+ O2(g)=CO2(g) △H3则反应4C 3H 5(ONO 2)3(l)=12CO 2(g)+10H 2O(g) + O 2(g) +6N 2(g)的△H 为( )A .12△H 3+5△H 2-2△H 1B .2△H 1-5△H 2-12△H 3C .12△H 3-5△H 2-2△H 1D .△H 1-5△H 2-12△H 3[2013高考∙江苏卷∙20]白磷(P 4)可由Ca 3(PO 4)2、焦炭和SiO 2 在一定条件下反应获得。
专题28 反应热计算——键能(学生版)十年(2013-2022)高考化学真题分项汇编(全国通用)

专题28反应热计算——键能1.【2022年6月浙江卷】标准状态下,下列物质气态时的相对能量如下表:物质(g)OHHOHOO2H 2O 22H O 2H O能量/-1kJ mol ⋅2492183910136-242-可根据22HO(g)+HO(g)=H O (g)计算出22H O 中氧氧单键的键能为-1214kJ mol ⋅。
下列说法不正..确.的是A .2H 的键能为-1436kJ mol ⋅B .2O 的键能大于22H O 中氧氧单键的键能的两倍C .解离氧氧单键所需能量:22HOO<H O D .-1222H O(g)+O(g)=H O (g)ΔH=-143kJ mol⋅2.(2021.1·浙江真题)已知共价键的键能与热化学方程式信息如下表:共价键H-H H-O 键能/(kJ·mol -1)436463热化学方程式2H 2(g)+O 2(g)=2H 2O(g)ΔH =-482kJ·mol -1则2O(g)=O 2(g)的ΔH 为A .428kJ·mol -1B .-428kJ·mol -1C .498kJ·mol -1D .-498kJ·mol -13.(2010·湖南高考真题)己知:HCN(aq)与NaOH(aq)反应的-1H=-12.1kJ mol ⋅ ;HCl(aq)与NaOH(aq)反应的-1H=-55.6kJ mol ⋅ 。
则HCN 在水溶液中电离的H 等于A .-1-67.7kJ mol ⋅B .-1-43.5kJ mol ⋅C .-1+43.5kJ mol ⋅D .-1+67.7kJ mol ⋅4.(2016·海南高考真题)油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:C 57H 104O 6(s)+80O 2(g)=57CO 2(g)+52H 2O(l)。
已知燃烧1kg 该化合物释放出热量3.8×104kJ 。
2024全国高考真题化学汇编:认识晶体
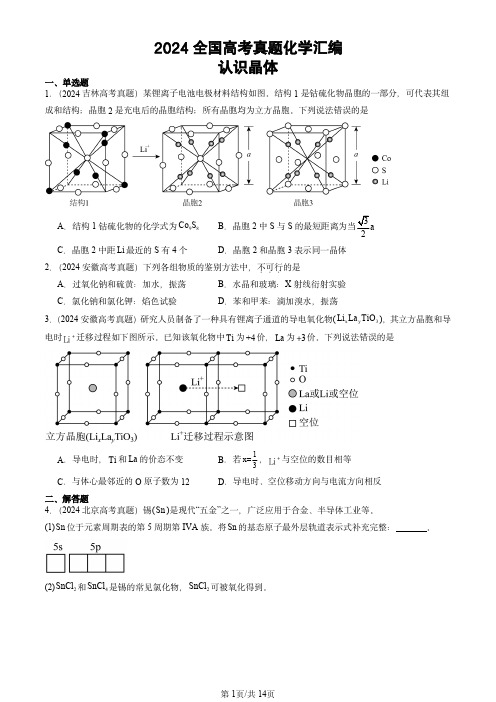
2024全国高考真题化学汇编认识晶体一、单选题1.(2024吉林高考真题)某锂离子电池电极材料结构如图。
结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。
下列说法错误的是A .结构1钴硫化物的化学式为98Co SB .晶胞2中S 与S 的最短距离为当3a 2C .晶胞2中距Li 最近的S 有4个D .晶胞2和晶胞3表示同一晶体2.(2024安徽高考真题)下列各组物质的鉴别方法中,不可行...的是A .过氧化钠和硫黄:加水,振荡B .水晶和玻璃:X 射线衍射实验C .氯化钠和氯化钾:焰色试验D .苯和甲苯:滴加溴水,振荡3.(2024安徽高考真题)研究人员制备了一种具有锂离子通道的导电氧化物(x y 3Li La TiO ),其立方晶胞和导电时+Li 迁移过程如下图所示。
已知该氧化物中Ti 为+4价,La 为3 价。
下列说法错误的是A .导电时,Ti 和La 的价态不变B .若1x=3,+Li 与空位的数目相等C .与体心最邻近的O 原子数为12D .导电时、空位移动方向与电流方向相反二、解答题4.(2024北京高考真题)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第5周期第IVA 族。
将Sn 的基态原子最外层轨道表示式补充完整:。
(2)2SnCl 和4SnCl 是锡的常见氯化物,2SnCl 可被氧化得到。
①2SnCl 分子的VSEPR 模型名称是。
②4SnCl 的Sn Cl —键是由锡的轨道与氯的3p 轨道重叠形成σ键。
(3)白锡和灰锡是单质Sn 的常见同素异形体。
二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn 原子周围与它最近且距离相等的Sn 原子有个。
②若白锡和灰锡的晶胞体积分别为31v nm 和32v nm ,则白锡和灰锡晶体的密度之比是。
(4)单质Sn 的制备:将2SnO 与焦炭充分混合后,于惰性气氛中加热至800C ,由于固体之间反应慢,未明显发生反应。
高考化学一轮复习 专题《热化学方程式》-人教版高三全册化学试题

《热化学方程式》一、选择题(每小题4分,每小题有1~2个正确选项)1.由氢气和氧气反应生成1mol 水蒸气放热241.8kJ ,则反应2H 2(g)+O 2(g)=====点燃2H 2O(g)的ΔH 为( )A .-483.6kJ·mol -1B .-241.8kJ·mol -1C .-120.6kJ·mol -1D .+241.8kJ·mol -12.下列说法或表示方法正确的是( )A .等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多B .由C(石墨)===C(金刚石);ΔH =+1.90kJ·mol -1可知,金刚石比石墨稳定C .在101kPa 时,2gH 2完全燃烧生成液态水,放出285.8kJ 热量,氢气燃烧的热化学方程式表示为:2H 2(g)+O 2(g)===2H 2O(l);ΔH =-285.8kJ·mol -1D .在稀溶液中,H +(aq)+OH -(aq)===H 2O(l);ΔH =-57.3kJ·mol -1,若将含0.5mol H 2SO 4的浓硫酸与含1mol NaOH 的溶液混合,放出的热量大于57.3kJ3.分析下面的能量变化示意图,下列热化学方程式正确的是( )A .2A(g)+B(g)===2C(g);ΔH =a (a >0)B .2A(g)+B(g)===2C(g);ΔH =a (a <0)C .2A +B===2C ;ΔH =a (a <0)D .2C===2A +B ;ΔH =a (a >0)4.常温下14g CO 在足量O 2中充分燃烧,放出141.3kJ 的热,则CO 燃烧的热化学方程式为( ) A .2CO(g)+O 2(g)===2CO 2(g);ΔH =-141.3kJ·mol -1B .CO(g)+12O 2===CO 2;ΔH =-141.3kJ·mol -1C .CO(g)+12O 2(g)===CO 2(g);ΔH =-282.6kJ·mol -1D.12CO(g)+14O 2(g)===12CO 2(g);ΔH =-141.3kJ·mol -1 5.沼气是一种能源,它的主要成分是CH 4。
2022-2023三年高考化学真题分类汇编 高中化学必修二

2022-2023三年高考化学真题分类汇编高中化学必修二一、物质的分类和性质1. 元素的分类和性质2. 合金的制备和应用3. 化合物的命名和表示方法4. 化合物的性质及应用5. 化学方程式的基本概念和应用二、物质的组成和结构1. 原子结构和元素周期表2. 原子的结构和性质3. 分子的结构和性质4. 离子的结构和性质5. 组成物质的微观结构和宏观性质三、化学反应1. 化学反应基本概念和基本类型2. 化学平衡及其条件3. 酸碱中和反应及其应用4. 氧化还原反应及其应用5. 电解质溶液和非电解质溶液的电离度四、化学能变化和热力学1. 化学能的概念和计算2. 化学反应的能量变化和影响因素3. 热化学方程式和反应热4. 热力学第一定律和第二定律5. 化学能转换与能源利用五、原子核化学1. 原子核的组成和结构2. 放射性及其应用3. 核反应和核能利用4. 放射性同位素的探测和应用5. 核能的环境效应和防护六、化学品及其应用1. 化学品的分类和性质2. 常见化学品的生产和应用3. 化学品的安全应用和储存4. 化学品的环境污染和防治5. 化学品的绿色生产和应用七、化学实验与化学工艺1. 常见化学实验基本操作和仪器使用2. 常见化学实验的操作步骤和注意事项3. 化学实验的定量分析和质量控制4. 化学工艺流程和技术5. 化学实验和化学工艺中的安全与环保以上是2022-2023三年高考化学真题分类汇编的内容总结,涵盖了高中化学必修二的各个知识点。
希望对你的学习有所帮助!。
专题29 反应热计算——盖斯定律学生版)十年(2013-2022)高考化学真题分项汇编(全国通用)
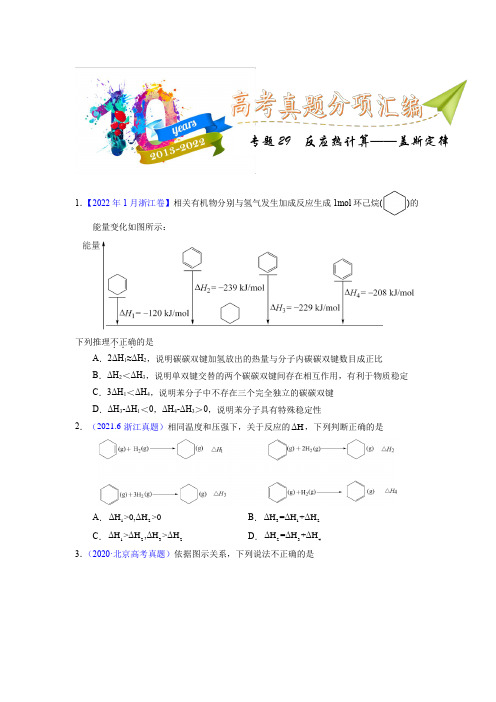
1.【2022年1月浙江卷】相关有机物分别与氢气发生加成反应生成1mol 环己烷()的能量变化如图所示:下列推理不正确...的是 A .2ΔH 1≈ΔH 2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比 B .ΔH 2<ΔH 3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定 C .3ΔH 1<ΔH 4,说明苯分子中不存在三个完全独立的碳碳双键 D .ΔH 3-ΔH 1<0,ΔH 4-ΔH 3>0,说明苯分子具有特殊稳定性2.(2021.6·浙江真题)相同温度和压强下,关于反应的ΔH ,下列判断正确的是A .12ΔH >0,ΔH >0B .312ΔH =ΔH +ΔHC .3212>ΔH ,ΔH ΔH >ΔHD .423=ΔH H +ΔΔH3.(2020·北京高考真题)依据图示关系,下列说法不正确的是专题29 反应热计算——盖斯定律A .石墨燃烧是放热反应B .1molC(石墨)和1molCO 分别在足量O 2中燃烧,全部转化为CO 2,前者放热多C .C(石墨)+CO 2(g)=2CO(g) ΔH =ΔH 1-ΔH 2D .化学反应的ΔH ,只与反应体系的始态和终态有关,与反应途径无关 4.(2018·浙江高考真题)氢卤酸的能量关系如图所示下列说法正确的是A .已知HF 气体溶于水放热,则HF 的△H 1<0B .相同条件下,HCl 的△H 2比HBr 的小C .相同条件下,HCl 的△H 3+△H 4比HI 的大D .一定条件下,气态原子生成1molH-X 键放出akJ 能量,则该条件下△H 2=+akJ/mol 5.(2020·浙江高考真题)关于下列ΔH 的判断正确的是( )CO 32−(aq )+H +(aq )=HCO 3−(aq ) ΔH 1CO 32-(aq )+H 2O (l )⇌ HCO 3−(aq )+OH −(aq ) ΔH 2OH −(aq )+H +(aq )=H 2O (l ) ΔH 3OH −(aq )+CH 3COOH (aq )=CH 3COO −(aq )+H 2O (l ) ΔH 4 A .ΔH 1<0 ΔH 2<0B .ΔH 1<ΔH 2C .ΔH 3<0 ΔH 4>0D .ΔH 3>ΔH 46.(2015·重庆高考真题)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S (s )+2KNO 3(s )+3C (s )=K 2S (s )+N 2(g )+3CO 2(g ) ΔH=x kJ·mol -1 已知碳的燃烧热ΔH 1=a kJ·mol -1S (s )+2K (s )=K 2S (s ) ΔH 2=b kJ·mol -12K (s )+N 2(g )+3O 2(g )=2KNO 3(s ) ΔH 3=c kJ·mol -1 则x 为A .3a+b -cB .c+3a -bC .a+b -cD .c+a -b7.(2017·浙江高考真题)根据2Ca(OH)/CaO 体系的能量循环图:下列说法正确的是:A .5ΔH >0B .12ΔH ΔH 0+=C .342ΔH ΔH ΔH =+D .12345ΔH ΔH ΔH ΔH ΔH 0++++=8.(2014·江苏高考真题)已知:C(s)+O 2(g)=CO 2(g) △H 1 CO 2(g)+C(s)=2CO(g) △H 2 2CO(g)+O 2(g)=2CO 2(g) △H 3 4Fe(s)+3O 3(g)=2Fe 2O 3(s) △H 43 CO(g)+Fe 2O 3(s)=3CO 2(g)+2Fe(s) △H 5 下列关于上述反应焓变的判断正确的是A .△H 1>0,△H 3<0B .△H 2>0,△H 4>0C .△H 1=△H 2+△H 3D .△H 3=△H 4+△H 59.(2008·宁夏高考真题)已知H 2(g)、C 2H 4(g)和C 2H 5OH (1)的燃烧热分别是-285.8kJ·mol -1、-1411.0kJ·mol -1和-1366.8kJ·mol -1,则由C 2H 4(g)和H 2O(l)反应生成C 2H 5OH(l)的△H 为( ) A .-44.2kJ·mol -1 B .+44.2kJ·mlo -1 C .-330kJ·mol -1D .+330kJ·mlo -110.(2013·全国高考真题)在1200℃时,天然气脱硫工艺中会发生下列反应①H 2S(g)+32O 2(g)=SO 2(g)+H 2O(g) △H 1 ②2H 2S(g)+SO 2(g)=32S 2(g)+2H 2O(g) △H 2 ③H 2S(g)+12O 2(g)=S(g)+H 2O(g) △H 3 ④2S(g) =S 2(g) △H 4则△H 4的正确表达式为( )A .△H 4=2/3(△H 1+△H 2-3△H 3)B .△H 4=2/3(3△H 3-△H 1-△H 2)C .△H 4=3/2(△H 1+△H 2-3△H 3)D .△H 4=3/2(△H 1-△H 2-3△H 3)11.(2014·全国高考真题)室温下,将1mol 的CuSO 4·5H 2O(s)溶于水会使溶液温度降低,热效应为△H 1,将1mol 的CuSO 4(s)溶于水会使溶液温度升高,热效应为△H 2;CuSO 4·5H 2O 受热分解的化学方程式为:CuSO 4·5H 2O(s)CuSO 4(s)+5H 2O(l),热效应为△H 3。
2023年高考化学真题分类汇编—化学反应机理、原理

2023年高考化学真题分类汇编—化学反应机理、原理(真题部分)146.(2023湖南14)N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
我国科学家合成的某Ru(Ⅱ)催化剂(用[L−Ru−NH3]+表示)能高效电催化氧化NH3合成N2H4,其反应机理如图所示。
下列说法错误的是A.Ru(Ⅱ)被氧化至Ru(Ⅲ)后,配体NH3失去质子能力增强B.M中Ru的化合价为+3C.该过程有非极性键的形成D.该过程的总反应式:4NH3−2e−=N2H4+2NH4+147.(2023新课标12)“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH 与NH3转化为肼(NH2NH2),其反应历程如下所示。
下列说法错误的是A.NH2OH、NH3和H2O均为极性分子B.反应涉及N-H、N-O键断裂和N-N键生成C.催化中心的Fe2+被氧化为Fe3+,后又被还原为Fe2+D.将NH2OH替换为ND2OD,反应可得ND2ND2148.(2023广东15)催化剂Ⅰ和Ⅱ均能催化反应R(g)⇌P(g)。
反应历程(下图)中,M为中间产物。
其它条件相同时,下列说法不正确的是A.使用Ⅰ和Ⅱ,反应历程都分4步进行B.反应达平衡时,升高温度,R的浓度增大C.使用Ⅱ时,反应体系更快达到平衡D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大149.(2023河北6)在恒温恒容密闭容器中充入一定量W(g),发生如下反应:反应②和③的速率方程分别为v2=k2c2(X)和v3=k3c(Z),其中k2、k3分别为反应②和③的速率常数,反应③的活化能大于反应②。
测得W(g)的浓度随时间的变化如下表。
下列说法正确的是A.0~2min内,X的平均反应速率为0.080mol⋅L−1⋅min−1B.若增大容器容积,平衡时Y的产率增大C.若k2=k3,平衡时c(Z)=c(X)D.若升高温度,平衡时c(Z)减小150.(2023.6浙江14)一定条件下,1-苯基丙炔(Ph-C≡C-CH)可与HCl发生催3化加成,反应如下:反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确...的是A.反应焓变:反应I>反应ⅡB.反应活化能:反应I<反应ⅡC.增加HCl浓度可增加平衡时产物Ⅱ和产物I的比例D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ三、化学反应原理151.(2023海南7)各相关物质的燃烧热数据如下表。
高考热化学真题及解析

高考热化学复习题1、(09年天津理综·6)已知:2CO(g)+O 2(g)=2CO 2(g) ΔH=-566 kJ/molNa 2O 2(s)+CO 2(g)=Na 2CO 3(s)+ 21O (g)2 ΔH=-226 kJ/mol根据以上热化学方程式判断,下列说法正确的是A .CO 的燃烧热为283 kJB .右图可表示由CO 生成CO 2的反应过程和能量关系C .2Na 2O 2(s)+2CO 2(s)=2Na 2CO 3(s)+O 2(g) ΔH >-452 kJ/molD .CO(g)与Na 2O 2(s)反应放出509 kJ 热量时,电子转移数为6.02×10232、(09年宁夏理综·28)(14分)2SO 2(g)+O 2(g) 2SO 3(g)反应过程的能量变化如图所示。
已知1mol SO 2(g)氧化为1mol SO 3的ΔH =—99kJ·mol —1.请回答下列问题:(1)图中A 、C 分别表示 、 ,E 的大小对该反应的反应热有无影响? 。
该反应通常用V 2O 5作催化剂,加V 2O 5会使图中B 点升高还是降低? ,理由是 ;(2)图中△H = KJ·mol —1;(3)V 2O 5的催化循环机理可能为:V 2O 5氧化SO 2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。
写出该催化循环机理的化学方程式 ;(4)如果反应速率v (SO 2)为0.05 mol·L —1·min —1,则v (O 2)= mol·L —1·min —1、v (SO 3)= mol·L —1·min —1;(5)已知单质硫的燃烧热为296 KJ·mol —1,计算由S(s)生成3 molSO 3(g)的△H (要求计算过程)。
3、(09年四川理综·9)25 ℃,101 k Pa 时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol ,辛烷的燃烧热为5518 kJ/mol 。
高考化学各地试题汇编反应热

2009届高考化学各地试题汇编:反应热1.(山东省烟台市2008—2009学年度高三第一学期学段检测化学试题)已知25℃101kPa下,石墨和金刚石燃烧的热化学方程式如下C(石墨)+O2(g)CO2(g); △H=-393.51kJ·mol-1C(金刚石)+O2(g)CO2(g); △H=-395.41kJ·mol-1下列关于C(石墨)C(金刚石)的焓变△H及有关叙述正确的是( A )A.△H >0;等质量时石墨能量比金刚石低B.△H >0;等质量时石墨能量比金刚石高C.△H <0;等质量时石墨能量比金刚石低D.△H <0;等质量时石墨能量比金刚石高2.(山东省烟台市2008—2009学年度高三第一学期学段检测化学试题)化学用语是学习化学的重要工具。
下列用来表示物质变化的化学用语错误的是( D )A.钢铁电化府蚀时,负极反应为:Fe Fe2++2e-B.AlCl3水解的离子方程式:Al3++3H2O Al(OH)3+3H+C.NaOH(aq)与NaHCO3(aq)反应离子方程式:HCO3-+OH CO32-+H2OD.氢气燃烧的热化学方程式为2H2(g)+O2(g) 2H2O(g); △H=571.6kJ·mol-13.(山东省烟台市2008—2009学年度高三第一学期学段检测化学试题)在理论上不能用于设计原电池的化学反应是( A )A.Al(OH)3(s)+NaOH(aq) NaAl(OH)4(aq);△H<0B.CH3CH2OH(l)+3O2(g)→2Co2(g)+3H2O(l); △H<0C.4Fe(OH)2(s)+2H2O(l)+O2(g) 4Fe(OH)3; △H<0D.H2(g)+Cl2(g) 2HCl(g); △H<04、(山东省诸城市补习学校12月份统考化学试题)(10分)下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:(1)通入乙醇的惰性电极的电极反应式为。
2024全国高考真题化学汇编:化学反应与能量转化章节综合
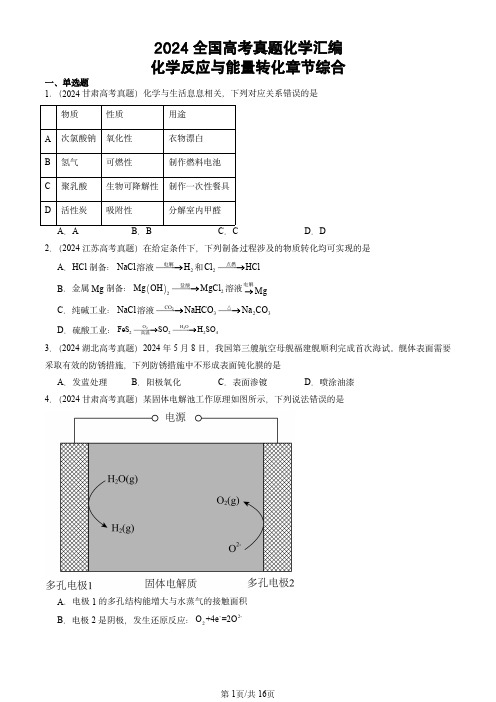
2024全国高考真题化学汇编化学反应与能量转化章节综合一、单选题1.(2024甘肃高考真题)化学与生活息息相关,下列对应关系错误的是物质性质用途A次氯酸钠氧化性衣物漂白B氢气可燃性制作燃料电池C聚乳酸生物可降解性制作一次性餐具D 活性炭吸附性分解室内甲醛A .A B .B C .C D .D2.(2024江苏高考真题)在给定条件下,下列制备过程涉及的物质转化均可实现的是A .HCl 制备:NaCl 溶液2H电解和2Cl HCl 点燃B .金属Mg 制备: 22Mg OH MgCl 盐酸溶液Mg 电解C .纯碱工业:NaCl 溶液2CO 323NaHCO Na CO △D .硫酸工业:22O H O2224FeS SO H SO 高温3.(2024湖北高考真题)2024年5月8日,我国第三艘航空母舰福建舰顺利完成首次海试。
舰体表面需要采取有效的防锈措施,下列防锈措施中不形成表面钝化膜的是A .发蓝处理B .阳极氧化C .表面渗镀D .喷涂油漆4.(2024甘肃高考真题)某固体电解池工作原理如图所示,下列说法错误的是A .电极1的多孔结构能增大与水蒸气的接触面积B .电极2是阴极,发生还原反应:-2-2O +4e =2OC .工作时2-O 从多孔电极1迁移到多孔电极2D .理论上电源提供-2mole 能分解21molH O5.(2024吉林高考真题)某工厂利用铜屑脱除锌浸出液中的-Cl 并制备Zn ,流程如下“脱氯”步骤仅Cu 元素化合价发生改变。
下列说法正确的是锌浸出液中相关成分(其他成分无干扰)离子2+Zn 2+Cu -Cl 浓度 -1g L 1450.031A .“浸铜”时应加入足量22H O ,确保铜屑溶解完全B .“浸铜”反应:+2+22222Cu+4H +H O 2Cu +H +2H OC .“脱氯”反应:2+-Cu+Cu +2Cl 2CuClD .脱氯液净化后电解,可在阳极得到Zn6.(2024山东高考真题)以不同材料修饰的Pt 为电极,一定浓度的NaBr 溶液为电解液,采用电解和催化相结合的循环方式,可实现高效制2H 和2O ,装置如图所示。
2014年—2023年高考化学化学反应的热效应真题汇编+答案

2014年—2023年高考化学化学反应的热效应真题汇编+答案(真题部分)1.(2023浙江1月选考,14,3分)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确...的是()A.E6-E3=E5-E2B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1C.相同条件下,O3的平衡转化率:历程Ⅱ>历程ⅠD.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g)O2(g)+Cl(g)ΔH=(E5-E4) kJ·mol-12.(2022湖南,12,4分)(双选)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:下列有关四种不同反应进程的说法正确的是()A.进程Ⅰ是放热反应B.平衡时P的产率:Ⅱ>ⅠC.生成P的速率:Ⅲ>ⅡD.进程Ⅳ中,Z没有催化作用3.(2022江苏,6,3分)周期表中ⅣA族元素及其化合物应用广泛。
甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6(H2SiF6在水中完全电离为H+和Si F62−);1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅—锗。
我国古代就掌握了青铜(铜—锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。
下列化学反应表示正确的是()A.SiO2与HF溶液反应:SiO2+6HF2H++Si F62−+2H2OB.高温下H2还原GeS2:GeS2+H2Ge+2H2SC.铅蓄电池放电时的正极反应:Pb-2e-+S O42−PbSO4D.甲烷的燃烧:CH4(g)+2O2(g)CO2(g)+2H2O(g)ΔH=890.3 kJ·mol-14.(2022浙江6月选考,18,2分)标准状态下,下列物质气态时的相对能量如下表:可根据HO(g)+HO(g)H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·mol-1。
高考试题汇编——热化学

高考化学试题汇编——热化学1.[2015重庆理综化学]黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO 3(s)+3C(s)==K 2S(s)+N 2(g)+3CO 2(g) ΔH = x kJ·mol -1已知硫的燃烧热ΔH 1= a kJ·mol -1 S(s)+2K(s)==K 2S(s) ΔH 2= b kJ·mol -12K(s)+N 2(g)+3O 2(g)==2KNO 3(s) ΔH 3= c kJ·mol -1 则x 为( )A .3a +b -cB .c +3a -bC .a +b -cD .c +a -b2.[2015海南化学]己知丙烷的燃烧热△H =-2215KJ·mol -1,若一定量的丙烷完全燃烧后生成1.8g 水,则放出的热量约为( )A .55 kJ B .220 kJ C . 550 kJ D .1108 kJ3.[2015江苏化学]下列说法正确的是( )A .分子式为C 2H 6O 的有机化合物性质相同B .相同条件下,等质量的碳按a 、b 两种途径完全转化,途径a比途径b 放出更多热能 途径a : CCO+H 2 CO 2+H 2O 途径b :C CO 2 C .在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数D .通过化学变化可以直接将水转变为汽油4.[2015上海化学]已知H 2O 2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。
下列说法正确的是( )A .加入催化剂,减小了反应的热效应B .加入催化剂,可提高H 2O 2的平衡转化率C .H 2O 2分解的热化学方程式:H 2O 2 → H 2O + O 2 + QD .反应物的总能量高于生成物的总能量5.[2014·重庆卷] 已知:C(s)+H 2O(g)===CO(g)+H 2(g) ΔH =a kJ·mol -12C(s)+O 2(g)===2CO(g)ΔH =-220 kJ·mol -1 H ‒H 、O=O 和O ‒H 键的键能分别为436 kJ·mol -1、496 kJ·mol -1和462 kJ·mol -1,则a 为( ) A .-332 B .-118 C .+350 D .+1306.[2014·新课标全国卷Ⅰ] 已知分解1 mol H 2O 2放出热量98 kJ 。
2024全国高考真题化学汇编:离子键、配位键与金属键

2024全国高考真题化学汇编离子键、配位键与金属键一、单选题1.(2024浙江高考真题)物质微观结构决定宏观性质,进而影响用途。
下列结构或性质不能解释....其用途的是选项结构或性质用途A 石墨呈层状结构,层间以范德华力结合石墨可用作润滑剂B2SO 具有氧化性2SO 可用作漂白剂C聚丙烯酸钠()中含有亲水基团聚丙烯酸钠可用于制备高吸水性树脂D冠醚18-冠-6空腔直径(260~320pm )与+K 直径(276pm )接近冠醚18-冠-6可识别+K ,能增大4KMnO 在有机溶剂中的溶解度A .AB .BC .CD .D2.(2024甘肃高考真题)兴趣小组设计了从AgCl 中提取Ag 的实验方案,下列说法正确的是A .还原性:Ag>Cu>FeB .按上述方案消耗1molFe 可回收1molAgC .反应①的离子方程式是 2++2++344Cu NH +4H =Cu +4NH D .溶液①中的金属离子是2+Fe 3.(2024安徽高考真题)某催化剂结构简式如图所示。
下列说法错误的是A .该物质中Ni 为+2价B .基态原子的第一电离能:Cl>PC .该物质中C 和P 均采取2sp 杂化D .基态Ni 原子价电子排布式为823d 4s 4.(2024安徽高考真题)仅用下表提供的试剂和用品,不能..实现相应实验目的的是选实验目的试剂用品项A比较镁和铝的金属性强弱2MgCl 溶液、3AlCl 溶液、氨水试管、胶头滴管B 制备乙酸乙酯乙醇、乙酸、浓硫酸、饱和23Na CO 溶液试管、橡胶塞、导管、乳胶管铁架台(带铁夹)、碎瓷片、酒精灯、火柴C制备 344Cu NH SO 溶液4CuSO 溶液、氨水试管、胶头滴管D利用盐类水解制备3Fe(OH)胶体饱和3FeCl 溶液、蒸馏水烧杯、胶头滴管、石棉网、三脚架、酒精灯、火柴A .AB .BC .CD .D5.(2024全国高考真题)我国科学家最近研究的一种无机盐 362Y Z(WX)纳米药物具有高效的细胞内亚铁离子捕获和抗氧化能力。
2009—2012年高考化学试题汇编—热化学(无答案)

2009—2012年高考化学试题分类汇编—化学反应中的能量变化2012年高考化学试题1.(2012江苏∙10)下列有关说法正确的是A .CaCO 3(s)=CaO(s)+CO 2(g)室温下不能自发进行,说明该反应的△H <0B .镀铜铁制品镀层受损后,铁制品比受损前更容易生锈C .N 2(g)+3H 2(g)2NH 3(g) △H <0,其他条件不变时升高温度,反应速率V(H 2)和氢气的平衡转化率均增大D .水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应2.(2012安徽∙7)科学家最近研究出一种环保、安全的储氢方法,其原理可表示为: NaHCO 3+H 2HCOONa+H 2O 下列有关说法正确的是A .储氢、释氢过程均无能量变化B .NaHCO 3、HCOONa 均含有离子键和共价键C .储氢过程中,NaHCO 3被氧化D .释氢过程中,每消耗0.1molH 2O 放出2.24L 的H 23.(2012江苏∙4)某反应的反应过程中能量变化如右图所示(图中E 1表示正反应的活化能,E 2表示逆反应的活化能)。
下列有关叙述正确的是A .该反应为放热反应B .催化剂能改变反应的焓变C .催化剂能降低反应的活化能D .逆反应的活化能大于正反应的活化能4.(2012浙江∙12)下列说法正确的是:A .在100 ℃、101 kPa 条件下,液态水的气化热为40.69 kJ·mol -1,则H 2O(g)H 2O(l) 的ΔH = 40.69 kJ·mol -1B .已知MgCO 3的K sp = 6.82 × 10-6,则所有含有固体MgCO 3的溶液中,都有c (Mg 2+) =c (CO 32-),且c (Mg 2+) · c (CO 32-) = 6.82 × 10-6C .已知:储氢 释氢则可以计算出反应C H 3(g)+3H 2C H 3(g)的ΔH 为-384 kJ·mol -1 D .常温下,在0.10 mol·L -1的NH 3·H 2O 溶液中加入少量NH 4Cl 晶体,能使NH 3·H 2O 的电离度降低,溶液的pH 减小12.肼(H 2NNH 2)是一种高能燃料,有关化学反应的能量变化如题12所示,已知断裂1mol化学键所需的能量(kJ ):N=N 为942、O=O 为500、N −N 为154,则断裂1molN −H 键所需的能量(KJ )是A .194B .391C .516D .6585.(2012安徽∙12)氢氟酸是一种弱酸,可用来刻蚀玻璃。
2024全国高考真题化学汇编:化学反应的速率

2024全国高考真题化学汇编化学反应的速率一、单选题(2024江苏高考真题)催化剂能改变化学反应速率而不改变反应的焓变,常见催化剂有金属及其氧化物、酸和碱等。
催化反应广泛存在,如豆科植物固氮、石墨制金刚石、2CO 和2H 制33CH OCH (二甲醚)、25V O 催化氧化2SO 等。
催化剂有选择性,如24C H 与2O 反应用Ag 催化生成(环氧乙烷)、用22CuCl /PdCl 催化生成3CH CHO 。
催化作用能消除污染和影响环境,如汽车尾气处理、废水中3NO 电催化生成2N 、氯自由基催化3O 分解形成臭氧空洞。
我国在石油催化领域领先世界,高效、经济、绿色是未来催化剂研究的发展方向。
完成下列小题。
1.下列说法正确的是A .豆科植物固氮过程中,固氮酶能提高该反应的活化能B .24C H 与2O 反应中,Ag 催化能提高生成3CH CHO 的选择性C .22H O 制2O 反应中,2MnO 能加快化学反应速率D .2SO 与2O 反应中,25V O 能减小该反应的焓变2.下列化学反应表示正确的是A .汽车尾气处理:222NO 4CON 4CO 催化剂B .3NO 电催化为2N 的阳极反应:3222NO 12H 10e N 6H OC .硝酸工业中3NH 的氧化反应:32224NH +3O 2N +6H OΔ催化剂D .2CO 和2H 催化制二甲醚:22332O 2CO H CH OC 3H 6H 催化剂高温、高压3.下列有关反应描述正确的是A .32CH CH OH 催化氧化为3CH CHO ,32CH CH OH 断裂C-O 键B .氟氯烃破坏臭氧层,氟氯烃产生的氯自由基改变3O 分解的历程C .丁烷催化裂化为乙烷和乙烯,丁烷断裂σ键和π键D .石墨转化为金刚石,碳原子轨道的杂化类型由3sp 转变为2sp 4.(2024安徽高考真题)某温度下,在密闭容器中充入一定量的X (g ),发生下列反应: 1X(g)Y(g)ΔH <0 , 2Y(g)Z(g)ΔH <0 ,测得各气体浓度与反应时间的关系如图所示。
高考化学热化学试题汇编完整版

高考化学热化学试题汇编HUA system office room 【HUA16H-TTMS2A-HUAS8Q8-HUAH1688】高考化学热化学试题汇编(00年—08年)一、选择题1、(2000年山西卷—14)今有如下3个热化学方程式:H 2(g)+ O 2(g)=H 2O(g) ΔH=a KJ·mol -1 H 2(g)+ O 2(g)=H 2O(l) ΔH=b KJ·mol -1 2H 2(g)+O 2(g)=2H 2O(l) ΔH=c KJ·mol -1 关于它们的下列表述正确的是( )A.它们都是吸热反应B.a 、b 和c 均为正值C.a=b D .2b=c2、(2002年天津卷—9)沼气是一种能源,它的主要成分是CH 4。
0.5molCH 4完全燃烧生成CO 2和H 2O 时,放出445kJ 热量,则下列热化学方程式中正确的是A. 2CH 4(g )+4O 2(g )=2CO 2(g )+4H 2O (l );ΔH=+890kJ·mol -1B. CH 4(g )+2O 2(g )=CO 2(g )+2H 2O (l ); ΔH=+890kJ·mol -1C. CH 4(g )+4O 2(g )=CO 2(g )+2H 2O (l ); ΔH=-890kJ·mol -1D. 1/2CH 4(g )+O 2(g )=1/2CO 2(g )+H 2O (l ); ΔH=-890kJ·mol -13、(03江苏卷—4)已知在25℃,101kPa 下,lgC 8H 18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。
表示上述反应的热化学方程式正确的是 ( )A. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1B. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1C. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1D. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-14、(03全国新课程卷—13)已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是()A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-15、(04全国卷Ⅳ—12)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是()A.CH3OH(l)+1.5O2(g) CO2(g)+2H2O(l);△H=+725.8 kJ/molB.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=-1452 kJ/molC.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=-725.8 kJ/molD.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=+1452 kJ/mol6、(04全国卷Ⅲ—8)已知:(l)H2(g) +0.5O2(g) =H2O(g);△H1=a kJ·1mol(2)2H2(g) +O2(g) =2H2O(g);△H2=b kJ·1mol-(3)H2(g) +0.5O2(g)=H2O(l);△H3=c kJ·1mol-(4)2H2(g) +O2(g) =2H2O(l); △H4=d kJ·1mol-下列关系式中正确的是A. a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>07、(04全国卷Ⅱ—13)已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨) + O2(g) === CO2(g) △H = -393.51kJ·mol-1C(金刚石) + O2(g) === CO2(g) △H = -395.41kJ·mol-1据此判断,下列说法中正确的是()A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高8、(04广东卷—17)已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g水时放出的热量是()A、26.0kJB、51.9kJC、155.8kJD、467.3kJ9、(04上海卷—7)实验室制取下列气体,其反应放热的是()A.由无水醋酸钠制CH 4B.由乙醇制C 2H 4 C .由电石制C 2H 2 D.由氯酸钾制O 210、(05江苏4)氢气(H 2)、一氧化碳(CO )、辛烷(C 8H 18)、甲烷(CH 4)的热化学方程式分别为:H 2(g) + 1/2O 2(g) = H 2O(l);△H = —285.8 kJ/molCO(g) + 1/2O 2(g) = CO 2(g);△H = —283.0 kJ/molC 8H 18(l) + 25/2O 2(g) = 8CO 2(g) + 9 H 2O(l);△H = —5518 kJ/molCH 4(g) + 2 O 2(g) = CO 2(g) + 2 H 2O(l);△H = —890.3 kJ/mol相同质量的H 2、CO 、C 8H 18、CH 4完全燃烧时,放出热量最少的是( )A .H 2(g)B .CO(g)C .C 8H 18(l)D .CH 4(g)11、(05全国卷Ⅰ13)已知充分燃烧a g 乙炔气体时生成1 mol 二氧化碳气体和液态水,并放出热量b kJ ,则乙炔燃烧的热化学方程式正确的是 ( )A .2C 2H 2(g )+5O 2(g ) 4CO 2(g )+2H 2O (l );△H=-4b kJ/molB .C 2H 2(g )+25O 2(g ) 2CO 2(g )+H 2O (l );△H=2b kJ/mol C .2C 2H 2(g )+5O 2(g ) 4CO 2(g )+2H 2O (l );△H=-2b kJ/molD .2C 2H 2(g )+5O 2(g ) 4CO 2(g )+2H 2O (l );△H=b kJ/mol12、(06重庆卷10)25℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol 、285.8 kJ/mol 、890.3 kJ/mol 、2800 kJ/mol,则下列热化学方程式正确的是( )A. C(s)+0.5O 2(g)=CO(g);△H =-393.5 kJ/molB. 2H 2(g)+O 2(g)=2H 2O(g);△H =+571.6 kJ/molC. CH 4g)+2O 2(g)=CO 2(g)+2H 2O(g);△H =-890.3 kJ/molD . 0.5C 6H 12O 6(s )+3O 2(g)=3CO 2(g)+3H 2O(l);△H = -1400 kJ/mol13、(06江苏卷8)下列各组热化学方程式中,化学反应的△H 前者大于后者的是( )①C(s)+O 2(g)===CO 2(g);△H 1 C(s)+12O 2(g)===CO(g);△H 2②S(s)+O 2(g)===SO 2(g);△H 3 S(g)+O 2(g)===SO 2(g);△H 4③H 2(g)+12O 2(g)===H 2O(l);△H 5 2H 2(g)+O 2(g)===2H 2O(l);△H 6④CaCO 3(s)===CaO(s)+CO 2(g);△H 7 CaO(s)+H 2O(l)===Ca(OH)2(s);△H 8A .① B.④ C .②③④ D.①②③14、(06天津13)已知反应:①101KPa 时,2C(s)+O 2(g)=2CO(g);△H=-221kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol下列结论正确的是()A.碳的燃烧热大于110.5kJ/molB.①的反应热为221kJ/molC.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/molD.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3KJ热量15.(2007年高考广东化学卷—16)灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学热化学试题汇编文档编制序号:[KKIDT-LLE0828-LLETD298-POI08]高考化学热化学试题汇编(00年—08年)一、选择题1、(2000年山西卷—14)今有如下3个热化学方程式:H2(g)+ O2(g)=H2O(g) ΔH=a KJ·mol-1H2(g)+ O2(g)=H2O(l) ΔH=b KJ·mol-12H2(g)+O2(g)=2H2O(l) ΔH=c KJ·mol-1关于它们的下列表述正确的是()A.它们都是吸热反应、b和c均为正值 =b =c2、(2002年天津卷—9)沼气是一种能源,它的主要成分是CH4。
完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式中正确的是A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l);ΔH=+890kJ·mol-1B. CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=+890kJ·mol-1C. CH4(g)+4O2(g)=CO2(g)+2H2O(l);ΔH=-890kJ·mol-1D. 1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l);ΔH=-890kJ·mol-13、(03江苏卷—4)已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出热量。
表示上述反应的热化学方程式正确的是()A. C8H18(1)+(g)=8CO2(g)+9H2O(g);△H=-·mol-1B. C8H18(1)+(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1C. C8H18(1)+(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1D. C8H18(1)+(g)=8CO2(g)+9H2O(1);△H=-·mol-14、(03全国新课程卷—13)已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ 热量,下列热化学方程式正确的是()A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-15、(04全国卷Ⅳ—12)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热,下列热化学方程式正确的是()A.CH3OH(l)+(g) CO2(g)+2H2O(l);△H=+ kJ/molB.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=-1452 kJ/molC.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=- kJ/molD.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=+1452 kJ/mol6、(04全国卷Ⅲ—8)已知:(l)H2(g) +(g) =H2O(g);△H1=a kJ·1mol-(2)2H2(g) +O2(g) =2H2O(g);△H2=b kJ·1mol-(3)H2(g) +(g)=H2O(l);△H3=c kJ·1mol-(4)2H2(g) +O2(g) =2H2O(l); △H4=d kJ·1mol-下列关系式中正确的是A. a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>07、(04全国卷Ⅱ—13)已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨) + O2(g) === CO2(g) △H = - ·mol-1C(金刚石) + O2(g) === CO2(g) △H = - ·mol-1据此判断,下列说法中正确的是()A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高8、(04广东卷—17)已知葡萄糖的燃烧热是2804kJ/mol ,当它氧化生成1g 水时放出的热量是( )A 、B 、C 、D 、9、(04上海卷—7)实验室制取下列气体,其反应放热的是( )A.由无水醋酸钠制CH 4B.由乙醇制C 2H 4 C .由电石制C 2H 2 D.由氯酸钾制O 210、(05江苏4)氢气(H 2)、一氧化碳(CO )、辛烷(C 8H 18)、甲烷(CH 4)的热化学方程式分别为:H 2(g) + 1/2O 2(g) = H 2O(l);△H = — kJ/molCO(g) + 1/2O 2(g) = CO 2(g);△H = — kJ/molC 8H 18(l) + 25/2O 2(g) = 8CO 2(g) + 9 H 2O(l);△H = —5518 kJ/molCH 4(g) + 2 O 2(g) = CO 2(g) + 2 H 2O(l);△H = — kJ/mol相同质量的H 2、CO 、C 8H 18、CH 4完全燃烧时,放出热量最少的是( )A .H 2(g)B .CO(g)C .C 8H 18(l)D .CH 4(g)11、(05全国卷Ⅰ13)已知充分燃烧a g 乙炔气体时生成1 mol 二氧化碳气体和液态水,并放出热量b kJ ,则乙炔燃烧的热化学方程式正确的是 ( )A .2C 2H 2(g )+5O 2(g ) 4CO 2(g )+2H 2O (l );△H=-4b kJ/molB .C 2H 2(g )+25O 2(g ) 2CO 2(g )+H 2O (l );△H=2b kJ/molC .2C 2H 2(g )+5O 2(g ) 4CO 2(g )+2H 2O (l );△H=-2b kJ/molD .2C 2H 2(g )+5O 2(g ) 4CO 2(g )+2H 2O (l );△H=b kJ/mol12、(06重庆卷10)25℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是 kJ/mol 、 kJ/mol 、 kJ/mol 、2800 kJ/mol,则下列热化学方程式正确的是( )A. C(s)+(g)=CO(g);△H = kJ/molB. 2H 2(g)+O 2(g)=2H 2O(g);△H =+ kJ/molC. CH 4g)+2O 2(g)=CO 2(g)+2H 2O(g);△H = kJ/molD . (s )+3O 2(g)=3CO 2(g)+3H 2O(l);△H = -1400 kJ/mol13、(06江苏卷8)下列各组热化学方程式中,化学反应的△H 前者大于后者的是( )①C(s)+O 2(g)===CO 2(g);△H 1 C(s)+12O 2(g)===CO(g);△H 2②S(s)+O 2(g)===SO 2(g);△H 3 S(g)+O 2(g)===SO 2(g);△H 4③H 2(g)+12O 2(g)===H 2O(l);△H 5 2H 2(g)+O 2(g)===2H 2O(l);△H 6④CaCO 3(s)===CaO(s)+CO 2(g);△H 7 CaO(s)+H 2O(l)===Ca(OH)2(s);△H 8A .①B .④C .②③④D .①②③14、(06天津13)已知反应:①101KPa 时,2C(s)+O 2(g)=2CO(g);△H =-221kJ/mol②稀溶液中,H +(aq)+OH -(aq)=H2O(l);△H =-mol 下列结论正确的是( )A .碳的燃烧热大于molB .①的反应热为221kJ/molC .稀硫酸与稀NaOH 溶液反应的中和热为-molD .稀醋酸与稀NaOH 溶液反应生成1mol 水,放出热量15.(2007年高考广东化学卷—16)灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s 、白)+2HCl(aq)=SnCl 2(aq)+H 2(g);H 1②Sn(s 、灰)+2HCl(aq)=SnCl 2(aq)+H 2(g);H 2③Sn(s 、灰)>13.2 ℃<Sn(s 、白);H 3=+ kJ/mol 下列说法正确的是( )(A) H 1>H 2 (B) 锡在常温下以灰锡状态存在(C) 灰锡转化为白锡的反应是放热反应(D) 锡制器皿长期处于低于 ℃的环境中,会自行毁坏16.(2007年海南卷—6)已知:(1)Zn(s)+1/2O2(g) = ZnO(s);H =- kJ/mol(2)2Ag(s)+1/2O2(g) = Ag2O(s);H =- kJ/mol则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的H等于( )(A)- kJ/mol (B)- kJ/mol(C)- kJ/mol (D) kJ/mol17.(2007年江苏卷—7)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g);H = + kJ·mol-1②CH 3OH(g)+1/2O2(g) = CO2(g)+2H2(g);H =- kJ·mol-1下列说法正确的是( )(A) CH3OH的燃烧热为 kJ·mol-1(B) 反应①中的能量变化如图所示(C) CH3OH转变成H2的过程一定要吸收能量(D)根据②推知反应:CH3OH(l)+1/2O2(g) = CO2(g)+2H2(g)的H>- kJ·mol-118.(2007年上海卷—14)已知:CH3CH2CH2CH3(g)+(g)4CO2(g)+5H2O(l);H =-2878 kJ(CH3)2CHCH3(g)+(g)4CO2(g)+5H2O(l);H =-2869 kJ下列说法正确的是( )(A)正丁烷分子储存的能量大于异丁烷分子(B) 正丁烷的稳定性大于异丁烷(C) 异丁烷转化为正丁烷的过程是一个放热过程(D) 异丁烷分子中的碳氢键比正丁烷的多19. (2007年全国卷II—9)已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量下列叙述正确的是( )(A)氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g) = 2HCl(g)(B)氢气和氯气反应生成2 mol氯化氢气体,反应的H = 183 kJ/mol(C)氢气和氯气反应生成2 mol氯化氢气体,反应的H =-183 kJ/mol(D)氢气和氯气反应生成1 mol氯化氢气体,反应的H =-183 kJ/mol20.(2007年重庆卷—13)已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )(A)920 kJ (B)557 kJ (C)436 kJ (D)188 kJ21.(2007年高考广东文基)下列说法正确的是( )(A)需要加热的化学反应都是吸热反应(B)中和反应都是放热反应(C)原电池是将电能转化为化学能的一种装置(D)水力发电是将化学能转化为电能的过程22.(2007年广东卷—14)将V1 mL mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
