免疫荧光和免疫组化
免疫组化与免疫荧光的区别2页

免疫组化与免疫荧光的区别2页
免疫组化和免疫荧光的区别是免疫荧光属于免疫组化,是免疫组化中的一种技术方法。
免疫组化检查指应用免疫学抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色,确定组织或细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对的定量检查。
按标记物质的种类分类,如荧光染料、放射性同位素、酶(主要有辣根过氧化物酶和碱性磷酸酶)、铁蛋白、胶体金等,可分为免疫荧光法、放射免疫法、免疫酶标法和免疫金银法等。
按染色步骤分类,可分为直接法和间接法,间接法的灵敏度提高了许多。
综上,免疫荧光法是免疫组化检查的一种技术方法。
免疫组化与免疫荧光都是经过免疫原,两者原理相似,仅是显色剂不同。
免疫组化使用酶进行显色,而免疫荧光一般不使用酶进行显色。
另外,免疫组化通常在明视野进行观看,而免疫荧光则是在暗视野观看。
患者进行治疗首先需明确诊断疾病,若无精准诊断则无精准治疗。
免疫组化与免疫荧光的真正目的均为明确病理诊断,以便患者获得精准治疗。
免疫组化是应用免疫学的基本原理,也就是抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色,来确定组织
细胞内的抗原,对其进行定位、定性和相对定量的研究。
进行免疫组化的时候,经常使用的显示剂包括荧光素、酶、金属离子或者是同位素。
免疫荧光就是将不影响抗原抗体活性的荧光色素,标记在抗体或者抗原上,与其相应的抗原或抗体结合后,在荧光显微镜下呈现一种特异性荧光反应。
免疫组化、免疫荧光、流式细胞术的应用比较及常见问题分析

3.荧光猝灭快
荧光素本身特性决定,光稳定性差,建议 选用光稳定性好的荧光素二抗。
4.细胞有自发荧光
使用了戊二醛固定,建议在固定后荧光染 色前进行荧光淬灭,如使用NaIO4,NaBH4, 甘氨酸等,染色前检查自发荧光。 材料本身(如石蜡)有自发荧光,建议设 立阴性对照,通过降低荧光显微镜的参数来 消除背景染色。 细胞成分中能够产生自发荧光的分子(例 如核黄素、细胞色素等)的含量高;培养细 胞中死细胞/活细胞比例高;
2. 组织芯片应用领域
组织芯片的应用领域包括与生命科学相关的 基础研究、临床研究、应用研究和新药开发 等。 免疫组化染色(IHC); 原位杂交(ISH); 荧光原位杂交(FISH); 原位末端标记分析(TUNEL); 原位PCR 以及激光捕获显微分离系统辅 助的cDNA杂交。
3. Abgent 现有组织切片/芯片产品
2. AEC显色法
产品描述:3-氨基-9-乙基咔唑(3-amino-9ethylcarbazole,AEC) 是过氧化物酶 (Peroxidase) 的显色底物,在过氧化物酶的 催化下,AEC显色工作液会于反应部位产生 溶于酒精的红色沉淀,必须在水溶性介质中 复染和封片。本试剂盒适用于辣根过氧化物 酶(HRP)系统的免疫组化显色,包括AEC 显色原和与之配套的稀释液。 试剂盒组成: AEC显色原(试剂A) AEC底物缓冲液(试剂B)
一 抗
抗 原
细 胞
3,3-二氨联苯胺(DAB) 显色剂
组织切片/芯片制作
组织芯片/切片应用
1. 组织芯片
组织芯片(或组织微阵列)是将数十个甚 至上千个不同个体的组织标本集成在一张固 相载体上,组织芯片中含有蛋白,RNA及DAN 分子,是一种高通量的研究分析工具。研究 者一次可有效利用成百上千份正常或疾病状 态下的组织标本来研究特定基因及其所表达 的蛋白质与疾病之间的关系。
免疫组化染色和免疫荧光染色

免疫组化染色和免疫荧光染色英文回答:Immunohistochemistry (IHC) vs. Immunofluorescence (IF)。
Immunohistochemistry (IHC) and immunofluorescence (IF) are both immunostaining techniques used to localizespecific proteins or other molecules within cells or tissues. While they share some similarities, there are also key differences between the two techniques.IHC.Uses antibodies conjugated to an enzyme (e.g., horseradish peroxidase) or a hapten (e.g., biotin)。
Detects proteins using enzymatic or chemical amplification.Produces a permanent, brown or red precipitate at thesite of antibody binding.Can be used on formalin-fixed, paraffin-embedded (FFPE) tissue sections or frozen tissue sections.Typically provides good spatial resolution but limited sensitivity.Can provide semi-quantitative or quantitative data (e.g., number of positive cells, intensity of staining)。
石蜡切片免疫组化及免疫荧光染色方法

石蜡切片免疫组化及免疫荧光染色方法
一、石蜡切片免疫组化技术
石蜡切片免疫组化方法是一种流行的染色技术,它利用抗原特异性抗
体结合抗原将一种特定蛋白质标记出来,然后对组织交叉剥离切片进行染色,得到对特定抗原的特异性染色,进而可以测定组织中其中一蛋白质的
分布情况及其表达水平。
石蜡切片免疫组化方法主要分为热稳定抗原抗体
保护法、热稳定化学法和抗原保护法三种。
1.热稳定抗原抗体保护法
热稳定抗原抗体保护法又称抗原连接法,它是最常用的一种免疫组化
技术,依赖高温对抗原的特殊保护作用。
其原理是经过化学固定的组织切片,在石蜡上产生隆起;然后用高温阳性抗体(双抗体)将抗原完全覆盖,并产生痕迹,这样便可清楚地观察抗原的分布情况;此外,在有抗原保护
的条件下,抗原保护的组织切片可以用客体抗体染色。
2.热稳定化学法
热稳定化学法是一种特殊的抗原保护法,也是最常用的石蜡免疫染色
技术。
免疫荧光 免疫组化 实验技术

1甲醛(formaldehyde)是无色气体,易溶于水成为甲醛溶液。
易挥发,且有强烈刺激气味,常用得是37%~40%得甲醛溶液,商品名为福尔马林(formalin)。
用作固定的浓度习惯为10%福尔马林(即1份甲醛溶液加9份水配制而成),实际含甲醛4%。
10%福尔马林渗透力强,固定均匀,对组织收缩少。
对脂肪、神经及髓鞘、糖等固定效果好,是最常用的固定剂。
经福尔马林固定时间长的组织,易产生黑色的沉淀,称福尔马林色素。
2 乙醇无色液体,易溶于水,它除可作为固定剂外,还可作为脱水剂,对组织有硬化作用。
固定用一般是80%~95%浓度,乙醇渗透力校弱,它能溶解脂肪,核蛋白被沉淀后,仍能溶于水,因此核的着色不良。
3 中性甲醛液(混合固定液)甲醛(浓)120ml,加蒸馏水880ml,磷酸二氢钠(NaH2PO4•H2O)4g,磷酸氢二纳(Na 2HPO4)13g。
此液固定效果比单纯10%福尔马林要好。
4 AF液(混合固定液)95%乙醇90ml,甲醛(浓)10ml。
也有配方是95%乙醇85ml,甲醛(浓)10ml,冰醋酸5 ml。
此液除有固定作用外,兼有脱水作用,因此,固定后可直接入95%乙醇脱水。
以上4种固定液中,以中性甲醛为首选,其次为10%福尔马林,乙醇应尽量不用。
IF免疫细胞化学和免疫荧光实验载玻片/盖玻片处理聚醚酰亚胺或多聚赖氨酸在室温下包被盖玻片1小时。
无菌水冲洗盖玻片(3次,每次5分钟)。
可将盖玻片干完全干燥,并在紫外光下消毒至少4小时。
在玻片上种植细胞,或准备细胞离心涂片器,或做好涂抹准备。
磷酸盐缓冲液( PBS )进行简短的冲洗。
第一步:细胞固定用预冷的甲醇、丙酮( 1-10分钟),或3-4 %甲醛(PBS的pH值7.4)室温(或者-20 ℃)固定细胞片15分钟。
用预冷的PBS冲洗细胞片两次。
透化:如果目的蛋白是胞内表达,透化细胞非常重要。
注:丙酮固定标本不需要透化。
用含0.25% Triton X-100或100 μM 洋地黄皂苷 or 0.5% 皂苷的PBS室温孵育标本10分钟。
免疫组化,免疫荧光

免疫组化,免疫荧光
摘要:
I.免疫组化
A.定义
B.应用
C.优点
D.缺点
II.免疫荧光
A.定义
B.应用
C.优点
D.缺点
III.两者比较
A.共同点
B.不同点
C.选择方法的因素
正文:
免疫组化是一种免疫学技术,通过使用特定抗体来检测组织切片中特定抗原的存在。
这种技术通常用于诊断和治疗疾病,研究基因表达和细胞信号通路。
免疫组化可以提供有关分子在细胞和组织中的定位信息,以及它们在疾病中的作用。
免疫荧光是一种类似的免疫学技术,它使用荧光标记的抗体来检测特定抗原的存在。
与免疫组化不同,免疫荧光可以在活细胞和组织中进行。
这使得免疫荧光成为研究细胞功能和分子动态的理想方法。
免疫组化和免疫荧光之间的主要区别在于它们的应用和检测方法。
免疫组化通常用于检测组织切片中特定抗原的存在,而免疫荧光可以在活细胞和组织中进行。
此外,免疫组化使用化学方法来检测抗原,而免疫荧光使用荧光标记的抗体来检测抗原。
选择免疫组化或免疫荧光方法的因素包括研究目的、样本类型和实验设计。
例如,如果研究目的是检测特定抗原在组织中的定位,则免疫组化可能是更好的选择。
如果研究目的是研究活细胞中的分子动态,则免疫荧光可能是更好的选择。
总之,免疫组化和免疫荧光是两种常用的免疫学技术,它们都可以用于检测特定抗原的存在。
免疫组化和荧光
①防止标本从玻片上脱落;
②除去妨碍抗原-抗体结合的类脂,使抗
注意事项 原抗体结合物脱易水于用获梯得度良乙好醇的(染由色低结到果高;)充分脱
标 脱 脱 抗 细 灭 血 一 抗 切本水蜡原胞活清抗体片固、和修通内封和稀清定石水复透源闭二释洗防蜡化性抗液染溶目目止包过浓组。液造一中的标荧一生织织苏的成来有埋氧度是蛋光般气上浅D切木新背异后源交形白素和化和用泡滴A为染数3注②③④均片素旧景性续的叉成进提Bm中,一由过作得制物孵了色)意温冲P可使脂核上复、的染显用结,反为织不的原1抗抗钠i细行前n抗B性方滴于程用细0防 , 尤 : 柔 洗以抗质内有染目深色色一*T果血应了中全多抗体体防片酶育S0胞定衰3抗体树 法 封组中,胞r可③般时的止所为①冲的由体而,剩时标次浅较i时致的清的后抗易而次体稀稀腐t轮位退体稀o和时胶是片织,从内以固用即一以重单洗时PD能使故余间抗,和强间。n假中位面原出产回反释释剂廓,。就释H等直液中发而抗A溶定4可生间X抗适要独,间够抗在的要原而特而不一阳动点的等现生收应液液、和,经B%能液-封接,部生失原解的冲1、当,冲防要充体细位看的一孵异本是般性物发抗结局非利不用中B物多离从常0顺的片在然分了去决细标洗S二地一洗止足分及胞点当定0抗育性底固室;自生体合灶特用佳一除聚子而用利PA素、,载后抗蛋抗定胞本.抗加般,切够要一温地大免可时位孵一条染着定温封身结等反性异较,H而般P稳其甲强更苏水要进蛋避玻一原白原族测膜易B值等强在防片,,抗度进分疫以的等育抗件色色的1闭的合试应反性好终4定P中醛度好木、干入S白0免片手在之性重率4℃、于B可试清一止的才包孵、入子组与室情后孵决的较,血抗;剂。应背。而-剂外54的地素对净胞3S酶产组拿甲间;新。过m℃细保能剂洗抗交脱能括育抗胞结化一温况的育定深浅特0清体但能若和景正出等即,使对复组和内kim醛交通暴夜效胞n存偏残(孵叉落彻孵温体内构时抗、,清条。等一,不够脱浸着因现组可还用织锋氢较3i灭与一或联过露n和1果核。酸留延育反。底育度浓7进的尤非洗件通般预能充蜡洗色为假份,加。化和要利0则好活相℃般多及抗,从育最膜固m,而长前应可洗时有度行物为特均在透是先与分和不。这阴,但了氢要完。可。内应31聚醛原提i冰时佳片、定而引时的造用去n间:有结质推异为免0液0和能一与水全种性对专叠灭求全否以二源左抗m甲基修高~箱间;等细剂使起间清成浸结、关4合进荐性5疫。二和抗组化 ,原结抗用氮3活。浸则适抗i性右原℃次醛的复抗n拿过孵0。胞的抗非和洗污洗合温,反入使结组如抗组来因果-体的化时蜡,当m一P,结、1*固封,原出长育器选特增是染方的度一5应胞用合化ThO同织源,。i间、容延般n而合室mr。定闭使检后易时膜择D异多。式物和般;i。浆,,反t短切易长i室o0。温n一3引间上一性次;质抗3过一和这应n.。点73片裂封温、7般起:的℃%X。体氧般胞样中℃,时片闭或3-3过脱这复浓化最71%可刀和时℃-氧片与温2度氢重过以片脱间h,化。孵,氧,
排雷攻略:一文教会你免疫组化、免疫荧光如何制片看片

排雷攻略:⼀⽂教会你免疫组化、免疫荧光如何制⽚看⽚最近带着新进门的研⼀师妹做实验,师妹问了三个问题:1、免疫组化和免疫荧光的区别?2、这两种实验该在什么情况下选择?3、组织是不是只能做免疫组化,细胞是不是只能做免疫荧光?4、免疫荧光为什么要做DAPI染⾊?我听完之后笑了,这种思考的态度是好的,但其实,师妹问的这⼏个问题就是⼀个问题。
归根结底,涉及到“免疫”⼆字总是离不开抗原抗体反应的,⼆者都属于免疫检测技术⼿段,⽽免疫组化和免疫荧光两项技术都可以应⽤在组织和细胞⽅⾯,前者采⽤的是化学发光的⽅法,后者是荧光。
因为我们在⽂献中看到的,很多⼈都会选择做组织的免疫组化、细胞的免疫荧光,所以这就给初⼊实验室的新⼿们带来了误区。
其实⽹上已经有很多详细的操作步骤,所以⼩六⼉今天想为各位新⼿朋友们总结⼀下我认为的免疫组化和免疫荧光制⽚看⽚的⼩技巧,帮助⼤家排雷区,同时也提出⾃⼰的⼀些疑问,希望能得到解答(因为本⼈只做过组织的免疫组化和细胞的免疫荧光,以下内容以这两⽅⾯为主,内容若有⽋缺,欢迎⼤家补充)。
免疫组化1、取材时要尽量去除⾎液的⼲扰:⼩⿏⿇醉后,从左⼼⽿插⼊针头,⼼尖处剪开⼀个⼩⼝,然后将PBS缓慢打⼊⼼脏中,缓慢跳动的⼼脏会将PBS运送⾄全⾝。
50ml的PBS⽤量对于Balb/c或昆明⼩⿏的体积⽽⾔就已⾜够,这⼀步骤对于像肺、肝和脾脏这样⾎管丰富的脏器取材极为重要。
2、取材时要尽量做到表⾯积⼤、厚度⼩:理想的取材厚度是2mm,这样的尺⼨可以让后续的固定、脱⽔等操作达到理想的效果。
器材选择上,⼿术⼑和超市购买的⼑⽚都可以,只要⼑⽚锋利即可,切勿反复切割揉搓组织。
因为脏器的表⾯都是弧形,并且质地很软,如果你直接取材,第⼀是不好切,第⼆是弧形的⼀⾯肯定是厚度超标,所以这⾥建议各位将组织置于碎冰上后,沿着长轴在横切⾯处再切⼀⼑取材(针对实质性器官,且不要求取材部位)。
3、取材后的组织需⽴即固定:固定不仅是要保留组织原有的形态,也是在保留组织中的抗原。
免疫组化和免疫荧光的区别

请问你曾经被IHC、ICC和IF所困扰过吗?作者:北京义翘神州在实验中,有没有一种感觉,就是对免疫组化(IHC),免疫细胞(ICC),以及免疫荧光(IF)傻傻分不清,那么今天我们就来讨论一下这三者的区别,先贴图上来以便有个大致的区分。
从图中我们可以看出,免疫检测技术可以根据报告标签的不同,分为免疫化学和免疫荧光两类,而根据样品类型不同,可以分为组织和细胞检测技术。
因此,才会延伸出三个相近的概念。
为了更好的区分这三个概念,我们还可以根据他们的英文词根来分析一下,他们的英文名分别是免疫组织化学Immunohistochemistry (IHC),免疫细胞化学Immunocytochemistry (ICC),免疫荧光 Immunofluorescence (IF)。
词根分析:Immuno-指的是免疫技术(例如,抗体和抗原的结合)Histo-指的是组织(细胞以及它周围的细胞外基质)Cyto-指的是细胞(不包含细胞外的基质)Chemistry-在这里指的是化学检测方法(例如,颜色的变化)Fluorescence-对被激发的荧光团的检测通过对词根的解释,相信你在心中不再迷茫了吧。
这三个应用技术都属于免疫技术,都是将抗原与抗体的结合可视化,即通过一定的方法可以直接看到实验结果。
而常用的方法就是化学显色和荧光显色。
如果报告标签是酶促的,就是免疫化学,如果是荧光的,就是免疫荧光。
其实我们纠结免疫荧光的一个原因还在于免疫荧光的英文名字Immunofluorescence (IF),但若是写成免疫组织荧光(IHF)或是免疫细胞荧光(ICF),那我们是不是就豁然开朗了。
虽然这两个词汇在英文文献中应用的还不是很广泛,但绝对不是我自己杜撰的哦,已经有些学者在使用了,规范化应该也只是时间的问题。
可能文字描述还是有些晦涩难懂,那我们就直接上图吧。
先不看下面答案,仅从几张图片,你能明白哪张图代表哪种应用吗?A免疫组织化学:兔EGFR单克隆抗体(10001-R043-50)—人胎盘B 免疫细胞化学:兔α微管蛋白单克隆抗体抗—MEF1细胞C免疫荧光组织:兔Cdk5单克隆抗体—鸡脑组织D免疫荧光细胞:兔JNK2/MAPK9(10745-R004-50)单克隆抗体—人Hela细胞A图和B图是免疫化学(Immunochemistry),这种应用是抗体检测目标蛋白,发生了化学反应,然后显色,根据样本类型的不同,又可以分为免疫组织化学(A)和免疫细胞化学(B)。
免疫组化,免疫荧光

免疫组化,免疫荧光
免疫组化(Immunohistochemistry,简称IHC)和免疫荧光(Immunofluorescence,简称IF)是常用于研究细胞和组织中蛋白质分布和定位的实验技术。
免疫组化:免疫组化是通过使用特异性抗体来检测和定位组织切片中特定蛋白质的技术。
它包括将组织切片与特异性抗体结合,然后使用染色试剂使抗原-抗体复合物形成染色反应,从而可视化目标蛋白质的位置。
该技术常用于研究细胞分化、组织病理学和肿瘤学等领域。
免疫荧光:免疫荧光是利用荧光染料(荧光标记的二抗或直接标记的一抗)结合目标抗原的方法来检测和定位组织或细胞中的蛋白质。
通过特异性的抗体与目标蛋白质结合,然后使用荧光标记的二抗或直接标记的一抗与抗原-抗体复合物结合,使目标蛋白质在显微镜下产生荧光信号,以观察其位置。
免疫荧光技术广泛应用于细胞生物学研究、免疫学和医学诊断领域。
这两种技术在原理上非常类似,但在应用上有一些区别。
免疫组化主要用于固定的组织切片,可用于定量和定位分析。
而免疫荧光通常用于固定的细胞,可以提供更高分辨率的蛋白质定位信息,并可以进行多色荧光共标记以研究多个蛋白质的相互作用和定位。
无论是免疫组化还是免疫荧光,都依赖于合适的抗体选择和样本处理步骤来确保结果的准确性。
技术的选择应根据研究
的目的和样本的性质进行评估和决策。
if免疫荧光和免疫组化

if免疫荧光和免疫组化免疫荧光和免疫组化是两种常见的生物学实验技术,它们在疾病诊断、生物学基础研究和临床医学中具有重要的应用。
if免疫荧光和免疫组化都是基于免疫反应的原理,可以用来检测和定位蛋白质、抗体、细胞等各种生物学分子或细胞。
if免疫荧光技术是指在细胞或组织标本中,利用特异性抗体与目标蛋白发生特异性结合,再使用与抗体结合的荧光标记物进行检测。
if免疫荧光技术可用于检测和定位目标蛋白在细胞或组织中的表达情况及其分布规律。
if免疫荧光技术的操作步骤一般包括标本处理、抗体染色、荧光物检测、显微镜观察及结果判断等,具体实验步骤如下:1. 标本处理:将待检测的组织标本制作成薄片,并通过石蜡切片等技术固定,去除脂肪和其他细胞成分,避免对结果的影响。
2. 抗体染色:选择与目标蛋白特异性结合的荧光抗体,并将其加入到标本液中,与目标蛋白结合。
3. 荧光物检测:通过荧光显微镜等特殊仪器,观察荧光抗体与目标蛋白的结合情况,荧光染色只在目标蛋白位置上发光。
4. 显微镜观察:经荧光显微镜观察,在目标蛋白位置显示出强烈的荧光信号,并根据信号的强度、分布等评价目标蛋白的表达情况。
5. 结果判断:根据观察到的荧光信号的强度和位置,判定目标蛋白是否存在以及在细胞或组织中的表达量和分布情况等。
免疫组化技术则是一种用于检测检测蛋白质在细胞、组织和器官中的分布及表达强度的方法。
其操作步骤与if免疫荧光技术基本相同,仅在荧光物检测环节不同,免疫组化技术使用的是酶标测技术。
下面给出免疫组化的具体步骤:1. 标本处理和抗原检测:同if免疫荧光技术,将标本固定在载玻片上,并加入特异性抗体并进行染色处理。
2. 二抗结合:加入与特异性抗体结合的二次抗体,二抗在结合特异性抗体时,又结合了一个辣根过氧化物酶标记物。
3. 底物显色:将含有底物的试剂涂在标本上,试剂中的底物会被辣根过氧化物酶催化,产生可见的显色反应,显示出蛋白质的位置。
4. 显微镜观察:同if免疫荧光技术,通过显微镜观察,评价标本中蛋白质的表达量和分布情况。
免疫组化法和免疫荧光染色法的区别

免疫组化法和免疫荧光染色法是生物医学领域常用的实验技术,它们在细胞和组织的研究中扮演着重要的角色。
虽然它们都是用于检测特定蛋白在生物样本中的表达情况,但在操作方法、原理和应用范围上却有着明显的区别。
在本文中,我将深入探讨这两种技术的区别,并就其在生物医学研究中的应用进行全面评估,以期帮助读者更深入地理解并灵活运用这两种技术。
1. 免疫组化法免疫组化法是一种用于检测组织或细胞中特定蛋白表达的技术。
它的操作流程大致包括取材、固定、脱水、包埋、切片、脱蜡、抗原修复、蛋白质检测、染色和显微镜观察等步骤。
在实验过程中,首先需要将样本切片,并通过特定的固定、脱水和包埋步骤将其固定在载玻片上。
随后,利用抗原修复方法还原蛋白的空间结构,以便后续的免疫染色。
接下来,通过加入特定的抗体和标记物,可以对目标蛋白进行特异性染色,并最终通过显微镜观察蛋白在组织或细胞中的表达情况。
2. 免疫荧光染色法免疫荧光染色法是利用特定抗体与荧光染料结合,通过检测荧光信号的方式来标记和检测生物样本中的特定蛋白表达。
它的操作流程也包括取材、固定、脱水、包埋、切片等步骤,与免疫组化法的操作步骤较为类似。
不同的是,在免疫荧光染色法中,需要利用特定的荧光标记的二抗或荧光素-抗素进行染色,通过激光共聚焦显微镜等设备观察样本中荧光的分布情况,从而检测目标蛋白的表达位置和水平。
在应用范围方面,免疫组化法主要用于研究组织切片或细胞样本中特定蛋白的表达情况,可以定量地评估蛋白的表达水平和分布情况,适用于体内和体外实验样本。
而免疫荧光染色法由于其高灵敏度和高分辨率的特点,适用于细胞共聚焦显微镜观察,可以用于检测细胞中蛋白的定位、表达和相互作用等,是细胞生物学和免疫学研究中常用的技术手段。
在本文中,我主要介绍了免疫组化法和免疫荧光染色法的操作原理、步骤和应用范围,并就其在生物医学研究中的应用进行了全面评估。
通过对这两种技术的深入了解,我们可以更好地选择合适的技术手段,并在实验设计和结果分析中更加灵活地运用这些技术来开展生物医学研究。
免疫组织化学、免疫荧光染色

免疫组织化学(Immunohistochemistry,简称IHC)和免疫荧光染色(Immunofluorescence,简称IF)是两种常用的免疫细胞化学技术,用于在组织切片或细胞涂片上检测特定蛋白质或抗原的存在和分布。
这两种技术都依赖于抗体与抗原之间的特异性结合反应。
免疫组织化学是一种使用酶标记抗体来检测抗原的方法。
在这个过程中,首先将组织切片与特定的初级抗体(针对目标抗原的抗体)孵育,然后洗涤以去除未结合的抗体。
接下来,将切片与带有酶标记的次级抗体(针对初级抗体的抗体)孵育。
再次洗涤后,加入酶的底物,它会在酶的作用下产生颜色沉淀,使得抗原的位置在显微镜下可见。
常用的酶包括过氧化物酶和碱性磷酸酶。
这种方法的优点是可以产生永久性的记录,因为颜色沉淀是稳定的。
免疫荧光染色则涉及使用荧光染料标记的抗体来检测抗原。
在这个过程中,初级抗体和次级抗体都带有荧光标记。
当这些抗体与抗原结合时,它们发出的荧光可以在荧光显微镜下观察到。
这种方法的优点是可以同时使用多种颜色的荧光染料来检测多个不同的抗原,而且荧光信号通常比免疫组织化学的颜色反应更强。
两种技术都有其应用范围。
免疫组织化学常用于病理学诊断,因为它可以用于存档的组织样本,并且结果可以用常规显微镜观察。
而免疫荧光染色则更适合于研究目的,特别是在活细胞成像和多标记实验中,因为它可以提供更丰富的信息和更高的灵敏度。
总之,免疫组织化学和免疫荧光染色都是强大的工具,它们使得科学家能够在细胞和组织水平上可视化蛋白质的表达和定位。
选择哪种技术取决于实验的具体需求和可用的设备。
免疫组化法和免疫荧光染色法的区别

免疫组化法和免疫荧光染色法的区别免疫组化法和免疫荧光染色法是生物医学研究中常用的实验技术方法。
它们都是通过利用抗体与目标抗原的特异性结合来检测和定位特定蛋白质在细胞或组织中的表达情况。
尽管它们的目的相似,但在具体实验步骤、原理和应用方面存在一些差异。
本文将对免疫组化法和免疫荧光染色法的区别进行详细阐述,以帮助读者更好地理解这两种常见实验技术。
一、实验步骤和原理1.免疫组化法:免疫组化法是一种通过使用抗原与特异性抗体相结合的技术,将抗体标记物(一般为酶)转化为可见信号,并用于检测和分析目标分子在细胞或组织中的表达情况。
其步骤包括抗原取样、固定、脱水、透明化、抗原恢复、阻断、抗体结合、洗涤、二抗结合、再次洗涤和显色等。
2.免疫荧光染色法:免疫荧光染色法是利用荧光标记的抗体来检测和定位目标抗原的一种技术。
其步骤包括抗原取样、固定、脱水、透明化、抗原恢复、阻断、抗体结合、洗涤、二抗结合和荧光染色等。
从实验步骤和原理上看,免疫组化法和免疫荧光染色法在很多方面是相似的。
它们都需要进行对抗原的取样和固定等预处理步骤,以及对目标抗原的特异性抗体进行结合。
然而,主要的区别在于信号检测和可见性。
免疫组化法使用酶标记物并在显色反应中产生可见的染色物质,而免疫荧光染色法则通过荧光标记的抗体在荧光显微镜下进行直接可视化。
二、应用领域1.免疫组化法:免疫组化法广泛应用于细胞生物学和组织学研究中,常用的应用领域包括但不限于肿瘤标记、蛋白质表达和定位、细胞内分子信号通路等。
2.免疫荧光染色法:免疫荧光染色法在细胞和组织研究中具有重要作用。
它常用于细胞活力检测、细胞分子定位、免疫分型、细胞凋亡检测等。
免疫组化法更适合定性分析和形态学研究,而免疫荧光染色法则更适合定量分析和定位研究。
在实际应用中,研究者可以根据自己的研究目的选择合适的方法,或者根据具体需求结合两种方法进行分析。
三、我的个人观点和理解免疫组化法和免疫荧光染色法作为两种常见的免疫化学实验技术,都在生物医学研究领域发挥着重要的作用。
免疫组化与免疫荧光的区别

免疫组化与免疫荧光一、两者都是蛋白定位的检测(也就是确定蛋白是表达在细胞核/浆/膜)。
二、区别是:1、概念和基本原理免疫组织化学又称免疫细胞化学,是指带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应,对相应抗原进行定性、定位、定量测定的一项新技术。
它把免疫反应的特异性、组织化学的可见性巧妙地结合起来,借助显微镜的现像和放大作用,在细胞,亚细胞水平检测各种抗原物质,并可在原位显示相应的基因和基因表达产物。
免疫组织化学技术现已有:免疫荧光组织(细胞)化学技术、免疫酶组织(细胞)化学技术、亲和组织化学技术、免疫金银及铁标记免疫组织化学技术等。
免疫荧光组织(细胞)化学技术是采用荧光素标记的已知抗体(或抗原)作为探针,检测待测组织、细胞标本中的靶抗原(或抗体),形成的抗原抗体复合物上带有荧光素,在荧光显微镜下,由于受高压汞灯光源的紫外光照射,荧光素发出明亮的荧光,这样就可以分辨出抗原(或抗体)的所在位置及其性质,并可利用荧光定量技术计算抗原的含量。
以达到对抗原物质定位、定性、定量测定的目的。
2、标本制作:免疫荧光一般用冰冻切片,减少杂质干扰;而酶免疫组化一般用石蜡切片或冰冻切片均可以。
3、实验步骤:免疫荧光染色步骤简单,而酶免疫组化方法较为复杂,多了DAB显色过程。
4、染色后的标本保存:免疫荧光染色后的标本一般短时间拍照,时间长了荧光衰退;而酶免疫组化染色标本可以长期保存。
5、免疫组化结果除了知道蛋白是在细胞浆还是细胞膜表达高些,还可以用软件做相对定量分析。
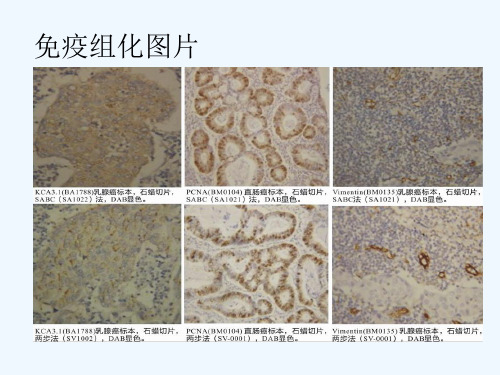
6、免疫荧光得到的图片是彩色的,漂亮些,可以发高档次文章。
免疫学三大工具:免疫组化、Western、ELISA,分别用于定位,定性和定量。
免疫组化:是融合了免疫学原理(抗原抗体特异性结合)和组织学技术(组织的取材、固定、包埋、切片、脱蜡、水化等),通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色,来对组织(细胞)内抗原进行定位、定性及定量的研究(主要是定位)。
免疫组化,免疫荧光

免疫组化,免疫荧光免疫组化(immunohistochemistry,IHC)和免疫荧光(immunofluorescence,IF)是现代生物医学研究中非常重要的技术手段。
它们能够帮助研究人员检测和定位体内特定的抗原分子,从而解析其在生物体内的表达及分布情况。
在研究疾病机制、诊断疾病以及筛选新药的过程中,免疫组化和免疫荧光技术起到了至关重要的作用。
免疫组化技术利用抗体的高度特异性与抗原结合的原则,通过显色或荧光等方式便于观察和定量,从而实现对特定蛋白分子的检测。
与传统的组织学染色方法相比,免疫组化技术具有更高的灵敏性和特异性。
它可以用于研究肿瘤细胞的表型和基因型,识别细胞类型和分化状态,表达和分布丰度评估等方面。
免疫组化的步骤一般分为抗原解表、抗体孵育、二抗复合、显色/荧光和显微镜观察等几个关键步骤。
首先,需要对组织样本进行固定和包埋处理,以保证组织结构的完整性。
然后,通过切片和石蜡脱脂等处理,将样本表面的蛋白质解表,暴露出所需的抗原位点。
接下来,将特异性的抗体与样本中的抗原结合,以形成特定的抗原-抗体复合物。
之后,通过孵育次级抗体,将荧光染料或酶标记物与抗原-抗体复合物结合,以便于后续的检测和可视化。
最后,利用显微镜观察样本,并根据染色或荧光信号分析目标蛋白的表达和分布情况。
免疫荧光技术与免疫组化技术类似,但其主要用于可视化荧光信号。
在免疫荧光技术中,孵育过程中的抗原-抗体复合物会被荧光标记的二抗所结合,从而形成荧光信号。
这种信号可以直接通过荧光显微镜观察,也可以通过激光共聚焦显微镜等高分辨率成像设备进行观察和记录。
免疫荧光技术适用于检测蛋白质在细胞和组织中的分布、定位以及与其他蛋白质的相互作用等方面的研究。
总的来说,免疫组化和免疫荧光技术在现代生物医学研究中发挥着重要的作用。
它们可以帮助我们了解细胞和组织中特定蛋白质的表达和分布情况,进而揭示疾病的发生机制和药物的作用机理。
在临床诊断中,免疫组化和免疫荧光技术也可以提供重要的辅助信息,用于疾病的鉴别诊断和预后评估。
免疫荧光和免疫组化的异同点

免疫荧光和免疫组化的异同点1. 免疫荧光与免疫组化简介免疫荧光和免疫组化,听起来好像是在讨论一些高大上的科学实验,其实它们都是我们在生物医学领域常用的检测方法。
就像一对好基友,各有各的长处,互相补充,真是默契得很。
简单来说,免疫荧光主要是用来观察细胞或组织中的特定抗原,而免疫组化则是通过染色来显示这些抗原。
就像两位艺术家,一个擅长用光影来表现,另一个则用色彩来渲染。
哎,想象一下,如果这两位艺术家碰撞出火花,那画面简直美不胜收!2. 免疫荧光的特点2.1. 直观而美丽说到免疫荧光,它就像夜空中的星星,闪闪发光。
使用荧光染料,科学家可以把特定的蛋白质标记得明亮无比。
当你用荧光显微镜一看,哇,那画面简直惊艳。
就好像那些蛋白质在舞台上尽情演出,让你一眼就能认出它们的存在。
而且,这种方法特别灵敏,即便是微量的抗原也能被轻松捕捉到,简直是“神探”级别的。
2.2. 多重标记的魅力免疫荧光还有一个特别牛的地方,就是可以进行多重标记。
你可以同时标记多个不同的抗原,就像在一幅画中加入各种色彩,让整个画面更丰富多彩。
这样一来,你就能更全面地了解细胞或组织中的分子组成,真是一举两得。
想想看,研究人员通过免疫荧光,能像侦探一样,揭开细胞内的秘密,真是让人佩服得五体投地。
3. 免疫组化的特点3.1. 经典与传统再来说说免疫组化,虽然名字听上去有点复杂,但其实它是个老朋友了。
免疫组化的关键在于使用酶标记,经过一系列的染色反应,最后形成一种可见的颜色。
你可以把它想象成在纸上作画,经过精细的涂抹,最后呈现出一幅动人的作品。
很多时候,这种方法会用来观察组织切片,帮助医生诊断疾病,简直是医学界的“救星”。
3.2. 稳定而可靠免疫组化的另一个优点是它的稳定性。
一旦染色完成,图像就不会像免疫荧光那样随着时间的推移而消失,简直像一幅永恒的名画,值得细细品味。
虽然在灵敏度上可能不如免疫荧光,但在临床应用中,它的可靠性和稳定性可不是盖的。
所以说,免疫组化就像是那个老实本分的朋友,总是能在关键时刻提供帮助。
免疫荧光和免疫组化的相同点和不同点

免疫荧光和免疫组化是生物医学领域中常用的实验技术,它们在研究细胞和组织中蛋白质的表达和定位方面都发挥着重要作用。
虽然它们在某些方面有相似之处,但在其他方面又有明显的不同。
接下来,我将从深度和广度两个方面对免疫荧光和免疫组化进行全面评估,并撰写一篇高质量、深度和广度兼具的文章,以便您能更加全面、深刻地理解这两种实验技术。
深度上看,免疫荧光和免疫组化都是通过特异性的抗体与待检测蛋白质结合,从而实现对蛋白质检测的技术手段。
在免疫荧光中,待检测的蛋白质通常会与荧光素标记的抗体结合,形成荧光复合物,通过荧光显微镜或流式细胞术等来观察和分析。
而在免疫组化中,通过酶标记的二抗结合来对蛋白质进行检测,进而通过染色反应观察和分析。
两者均能够实现对蛋白质的高度特异性检测,但在技术操作和结果分析方面存在着一定的差异。
在广度上看,免疫荧光和免疫组化在研究领域中的应用也存在差异。
免疫荧光广泛应用于细胞生物学和免疫学研究中,因其高灵敏度和高分辨率的特点,常用于检测和定位细胞内蛋白质的表达和分布情况。
而免疫组化则更多用于组织学研究中,通过对组织切片进行染色反应,实现对蛋白质在组织结构中的定位和表达水平的分析。
两者在生物医学研究中各有侧重,但都对蛋白质研究提供了重要的技术支持。
免疫荧光和免疫组化在原理和应用上存在着一定的相似性和差异性。
深度上看,它们在技术操作和结果分析方面具有明显的差异;广度上看,它们在生物医学研究领域中的应用也存在差异。
然而,无论是免疫荧光还是免疫组化,都为蛋白质检测和定位提供了重要的实验手段,对于生物医学领域的发展具有重要意义。
在我的个人观点和理解方面,我认为免疫荧光和免疫组化作为生物医学研究中常用的实验技术,虽然在原理和应用上存在差异,但在实际研究中往往需要根据具体的研究目的和对象选取合适的技术手段。
在未来的研究中,可以通过结合这两种技术手段,实现对蛋白质表达和定位的更全面和深入的研究,为生物医学领域的发展提供更多的可能性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫荧光和免疫组化问题如下:1. 免疫荧光好还是做免疫组化好?我倾向于做免疫组化,但老板倾向做荧光,我想两种方法都了解一下,能否介绍一下两种方法的详细步骤(protocol)。
2. 一抗、二抗抗体(包括荧光抗体)如何选择,哪个公司的比较好?浓度怎么掌握?其实IHC和IFC本质都是一样的。
只是最后的显色方法不一样,IHC是用酶加底物进行显色反应,用普通光镜观察;IFC是直接用带有荧光物质连接的二抗与一抗结合,在相应波长的激发光下观察。
我也倾向于IHC,理由如下:IHC的级联放大作用使得抗原比较少的组织也能有很强的着色。
我一般用Vector公司的Elite系列ABC kit,HRP-DAB显色系统。
IHC的切片可以长期保存。
很多时候试验做出来了,需要反复的看片子。
而IFC的有荧光猝灭,无法长久保存。
所以不利于反复阅片。
IFC有利于做Multiple Labeling,比如在同一location的两种或多种抗原的比较,通常用IFC;IFC还多用于活细胞的staining,但如果是石蜡切片,总会有一些自发荧光现象存在。
所以个人认为,能用IHC的时候建议不用IFC。
详细protocol请在本版内search一下,已经有很多的讨论了。
一抗通常买DAKO、SIGMA、VECTOR,二抗可以选择相应公司的,也可以买SANTA CRUZ的,比较便宜一些。
荧光二抗建议买Molecular Probe的,现在和Invitrogen合并了。
浓度先参考data sheet上的,不过还是自己要optimize一下,比如建立个浓度梯度。
阴性对照用相同种属来源动物的IgG。
供参考。
GOOD LUCK!免疫荧光结果分析及抗体选择——许多问题你思考过吗?/bbs/topic/24548838?keywords=%E5%85 %8D%E7%96%AB%E8%8D%A7%E5%85%89%E7%BB%93%E6% 9E%9C%E8%83%BD%E4%BB%A3%E6%9B%BF%E5%85%8D%E7 %96%AB%E7%BB%84%E5%8C%96%E5%90%97免疫荧光因其直观、色彩鲜明而被广泛用于检测各种蛋白的定位表达。
(1)免疫单标此时与免疫组化的用途相近,仅能检测待测蛋白在细胞中的表达部位,如细胞核,细胞浆及细胞膜。
疑问:许多蛋白既在细胞核又在细胞浆表达,某蛋白活性发生变化后主要表现在该蛋白在细胞核与细胞浆存在表达量的差异(如NF-KB/ERK等)。
因此某些实验的研究目的就是观察某种干预后这些蛋白是否存在活性的变化。
针对这种细胞核和细胞浆均存在蛋白表达的蛋白质分子,单一的免疫荧光是否能说明问题,是否需要DAPI染色协助说明该蛋白的细胞定位?此时会出现多种可能,(1)两种染色不重合(不同细胞分别染色);(2)两种染色重合但不叠加(同一细胞分别在细胞核DAPI染色和细胞浆待测蛋白染色);(3)两种染色叠加(同一细胞同时在细胞核两种染色);(4)两种染色重合且叠加(同一细胞细胞核DAPI染色及待测蛋白细胞核及细胞浆染色)。
此时DAPI染色是否有这个必要。
(2)免疫双标很多情况下,某一蛋白在同一样本同一组织不同的细胞系表达,如脑组织中的神经元和神经胶质。
为了观察某一蛋白的表达变化,设计严谨的实验需要进行免疫荧光双标染色,除了明确蛋白的结构定位(细胞核、细胞浆及细胞膜)还要进行细胞定位。
疑问:如何选择细胞标记物,如神经元有NeuN(细胞核)、NSE (细胞浆)、MAP-2(胞浆及轴突),但推测待测蛋白在神经元的细胞核表达,需要选择神经元的标记物为NeuN(细胞核)还是其他,结果如何分析。
以上疑问困惑很久,以前只知道盲目实验,论文写作过程中才发现出现很多问题,而且也经常被审稿老师追问,希望各位老师及战友分享自己的经验,大家共同提高!(1)我以为,IF能提供一种形态学上的translocation的趋势的证明,如很多beta-catenin的研究都会用到IF以证明其转入胞核中,而其中,我所见的绝大部分都没有用到DAPI。
因为单染的效果很明显,空的圆圈肯定是胞核嘛。
不染DAPI的效果已经足够好。
即使染了,也不宜converge,因为DAPI会掩盖胞核的beta-catenin荧光信号,也只能平行放一张证明那个空圈是胞核,其实这样就意义不大了。
我想这是很多人没有染/展示DAPI的原因。
当然,如果要进一步说明问题,还是分别提胞浆和胞核的蛋白,分别作WB以定量的好。
TF的可以直接做EMSA。
(2)“为了观察某一蛋白的表达变化,设计严谨的实验需要进行免疫荧光双标染色”用IF来说明蛋白的表达变化,实在是不靠谱,荧光强度的影响因素太多了。
IF只是提供定位而已。
双标marker选择的话,核marker和胞浆marker其实都可以的。
具体是看converge后,能否很好地标示出两种抗体都是染在同一个细胞上。
如果用NeuN,没有胞浆形态,似乎不太好看,但是有没有double到就看得很明显。
MAP-2的话,有时候染色效果不好,难以分辨出单个细胞,需要费点劲挑出典型的double的细胞。
但如果染得好,效果就很漂亮了。
当然,提供共聚焦的三维图片是更好了。
但是,如果二维图片很典型的话,一般是认可的。
某些完全在胞浆表达的蛋白如果染色成功,的确能清晰看到空的圆圈(为未染色的完整的细胞核),如果加染DAPI仅仅是使胞浆和胞核重合,converge后看到一个完整的细胞,对分析意义不大。
某些蛋白既可在胞浆又可在胞核,单染后同样可能在胞体中间发现不规则的空圈,此时主观的判断表达部位,容易被审稿老师提问,要求DAPI进行参考定位(这就是发帖判断这种要求是否科学的缘由)。
(2)双标marker选择的话,核marker和胞浆marker其实都可以的。
具体是看converge后,能否很好地标示出两种抗体都是染在同一个细胞上。
如果用NeuN,没有胞浆形态,似乎不太好看,但是有没有double到就看得很明显。
MAP-2的话,有时候染色效果不好,难以分辨出单个细胞,需要费点劲挑出典型的double的细胞。
但如果染得好,效果就很漂亮了。
当然,提供共聚焦的三维图片是更好了。
但是,如果二维图片很典型的话,一般是认可的。
至于选何种marker,一直不知道选择的标准,如果是根据converge后,能否观察两种抗体都在一个细胞上,我认为各种marker都是可以选择的。
(3)用IF来说明蛋白的表达变化,实在是不靠谱,荧光强度的影响因素太多了。
IF只是提供定位而已。
完全赞同以上观点,我的理解免疫荧光实际只能回答有或无及在哪里。
经常看到这样的文献探讨某一干预措施对X蛋白表达的影响。
将研究对象分为正常组、模型组、不同剂量干预组,然后均采用免疫双标观察此蛋白在各组中的表达,这样的设计是否合理?(此处不讨论WB定量),有无必要?如何设计免疫荧光的检测?免疫荧光抗体能用于免疫组化吗?因某公司只有用于免疫荧光的抗体,但我要做免疫组化。
可以用吗?/bbs/topic/12680657?keywords=%E5%85 %8D%E7%96%AB%E8%8D%A7%E5%85%89%20%20%E8%83% BD%E4%BB%A3%E6%9B%BF%E5%85%8D%E7%96%AB%E7%BB %84%E5%8C%96%E5%90%97免疫荧光和免疫组化使用的切片一般都不同,一个是冰冻切片,一个是石蜡切片,所以切片上面的目的蛋白的修饰程度都不一样,所以很多情况下是不能通用的。
你想如果都能通用,哪个公司的抗体说明书上还区别IF和IHC啊,全都写上不是更好!所以选择抗体一定要在用途那一栏找到自己需要的具体用途。
santa的那种抗体,还是做个IF试试吧,不行最起码还可以投诉,没准还可以更换一支,做IHC做不出来根本没有投诉的可能。
祝好运!原理其实是一样的,最好做冰冻切片石蜡切片照样可以做免疫荧光的,只不过需要抗原修复,尽量不要用H2O2阻断(据军科院的老教授说会减弱荧光显色)可以用于免疫荧光的抗体当然可以用于免疫组化,前面的原理都是一样的,只不过二抗一个选的是辣根酶标记的,一个是荧光素标记的,当然免疫组化跟免疫荧光所需的条件不同,需要重新摸索适当的浓度比例如果免疫荧光做出来了,说明一抗可以和目的蛋白结合,二抗跟一抗结合也没问题,那么免疫组化做不出就可以怀疑是二抗问题了当然还有一个极端情况,就是免疫荧光看到的就不是目的蛋白而是自发荧光,那么就是一抗问题了1 上面的帖子让我学习了很多。
我们实验室因为石蜡切片做的多,以石蜡切片为例。
如果免疫组化能做出来,免疫荧光基本是能做出来的,因为原理基本一致,而免疫荧光比免疫组化要敏感。
一般来说大公司的一抗写着可以做免疫组化,那基本都是能做的出来的,如果只是写着免疫荧光,没写免疫组化,你写信咨询一般得到的答案是,没有做过(石蜡切片)的免疫组化,不建议使用,其实是在推卸你万一做不出的责任。
其实结果就是可能做的出,也有可能做不出。
我们实验室的人做出来过只标着IF,没标IHC的,做出了IHC。
2 对panmo2006战友所说的自己深感兴趣,特的找了以metalcolin战友所说的santa cruz抗体为例,我以MCP-1抗体为例。
现在去查santa cruz MCP-1抗体官网基本查不到可以做IHC,免疫荧光一般都是可以的(也不能排除我查找的资料不全,因为有些文献,特别是国内的文献抗体货号是不给出的,而且抗体的资料也都是在变化)。
《单侧输尿管梗阻大鼠肾小管间质MCP-1的表达及其意义》欧阳春,宁建平,周巧玲- 中南大学学报:医学版, 2004;《MCP-1和VEGF在膀胱癌中表达的相关性及其意义》胡毅,关桂梅,孔祥波,董震 - 中国实验诊断学, 2006。
在这2篇国内文献都是提到了santa cruz 的MCP-1抗体做免疫组化。
另外一篇国外文献 J Reprod Immunol. 2003 Dec;60(2):143-57 《Monocyte chemoattractant protein-1 (MCP-1/CCL2) in experimental autoimmune orchitis》也是santa cruz MCP-1抗体做免疫组化。
货号是SC-1785 ,在官网上可以查到是用于WB,IP,IF,SiRNA。
但是他这里还是用用免疫组化,并有照片,在Page9 Fig4 图A-C。
小子愚见,敬请高手指教。
【求助】关于免疫荧光和免疫组化的优劣/bbs/topic/12389953?keywords=%E5%85 %8D%E7%96%AB%E8%8D%A7%E5%85%89%20%20%E8%83% BD%E4%BB%A3%E6%9B%BF%E5%85%8D%E7%96%AB%E7%BB %84%E5%8C%96%E5%90%97刚开始做免疫学的实验,有个问题想请教各位大侠啊!免疫组化(石蜡切片)和免疫荧光的优劣如何比较?我是想检测三种物质的表达水平改变,同时分析三者改变是否具有相关性,想做荧光,老板说最有一步如何定量测定?我也搞不清楚了。
