钒电池电解液中不同价态钒的分光光度分析
分光光度法与滴定法测定V3+VO2+混合溶液钒离子浓度的对比研究

分光光度法与滴定法测定V3+/VO2+混合溶液钒离子浓度的对比研究作者:赵金玲何虹祥赵焕来源:《当代化工》2020年第10期摘要:采用分光光度法,分别建立V3+和VO2+的标准曲线,并针对钒电池常用的V3+/VO2+混合溶液,测定未知样品V3+和VO2+的浓度,再进行加和获得总钒浓度。
同时,采用氧化还原滴定方法,获得未知溶液的总钒浓度,对二者进行对比分析。
结果表明:分光光度法與滴定法获得的总钒浓度差异较小,平均为0.008 mol·L-1;以分光光度法为基准,测定样品相对标准偏差(n=6)为1.012 8%,可以满足钒电池电解液中钒离子浓度快速准确分析的需要。
关键词:钒电池;钒离子;分光光度法;V3+/VO2+中图分类号:TQ 016.1 文献标识码: A 文章编号: 1671-0460(2020)10-2361-04Abstract: The standard curves of V3+ and VO2+ were established respectively by spectrophotometry, and the concentrations of V3+ and VO2+ of unknown samples were measured for the V3+ and VO2+ mixed solution of VRFB. Then the total vanadium concentration was obtained by adding the concentrations of V3+ and VO2+. At the same time, the total vanadium concentration of unknown solution was obtained by oxidation-reduction titration. The results showed that the obtained difference of the total vanadium ion concentration between spectrophotometry and titration method was small, with an average of 0.008 mol·L-1. The relative standard deviation (n = 6) was 1.012 8% based on spectrophotometry, which can meet the needs of vanadium ion concentration analysis in vanadium battery electrolyte.Key words: Vanadium battery; Electrolyte; Valence state; Spectrophotometry风能、太阳能等清洁能源的有效利用是应对世界能源危机与环境污染的有效手段。
分光光度法测定钒及其在

分光光度法测定钒及其在工业、环境、生物、土壤样品中的应用摘要利用钒与D P C H的直接显色反应,建立了灵敏度高、选择性好的分光光度测定微量钒的新方法。
在0.0001–0.001M H2S O4或p H为 4.0~5.5微酸丙酮介质中,钒(Ⅴ)与D P C H反应生成一紫红色络合物,络合物的最大吸收波长位于540n m,表观摩尔吸光系数和灵敏度分别为4.23⨯104L⋅m o l-1⋅㎝-1,10n g⋅㎝-2。
线形范围为0.1~30µg/m L。
配合物的组成比为V:D P C H=1:3。
显色反应瞬间完成,在48小时内吸光度保持稳定。
对于1µg/m L的钒,研究了超过50多种阳离子和阴离子和复合试剂的干扰。
此方法成功应用于合金钢铁材料,环境污水,人血和尿等生物样,含V(Ⅴ)和V (Ⅳ)的溶液和复杂合配合。
此方法具有较高的精确度和准确度。
关键词:分光光度法;钒的测定;D P C H;合金;钢铁;环境;生物样品;土壤样1.引言钒中毒是一种工业危害,环境学家已经断言钒作为一种潜在危险化学物质能对植物、农作物和整个农业体系造成严重破坏。
高含量的钒据说存在于化石燃料,例如原油,燃料,油品,煤和褐炭。
这些燃料释放的钒进入空气中,然后沉淀于土壤中。
有许多钒中毒的事例,如紧张压抑,咳嗽,呕吐,腹泻,贫血和肺癌等,这些症状有时是致命的。
最近,钒被定为城市环境污染的指标元素,尤其是空气污染。
实验研究和免疫学证据表明钒在预防心脏病方面发挥有益的作用。
S h a m b e r g e r指出环境中钒含量多的国家人们心脏病死亡率较低。
环境样品中的钒测定方法有中子活化法,电感耦合等离子体原子发射光谱法,原子吸收光谱法和分光光度法。
前两个方法在常规分析中成本和仪器造价均高。
原子吸收光谱法灵敏度低,易受样品基础条件的影响,溶剂萃取法的灵敏度高但操作性差。
因此在微量级精确测定方面使用简便灵活的方法是极为重要的。
分光光度法测定水中钒全量的改进

分光光度法测定水中钒全量的改进魏清清;杨金燕【摘要】In order to seek a fast ,safe and high detection precision testing method of vanadium in water ,three spectropho-tometric methods are used to samples with differences chromogenic agent in differences wavelength ,compare with the appli-cability ,merits and demerits of three kinds of methods .The experimental results show the best linearity relationship and the smallest deviation can be achieved with H3PO4 (1∶1) as the chromogenic agent under the wavelength of 380 nm .This im-proved spectrophotometry method is simple ,with good precision and accuracy ,and the detection range is 50 - 500 mg/L , which is suitable for the determination of vanadium in water .%为了寻求一种快速、安全、检测精度高的水体重金属钒检测方法,采用分光光度法分别测定样品以3种不同的显色体系在不同波长条件下的吸光度值,比较3种方法的优缺点及适用性。
研究结果表明,以体积比为1∶1的磷酸溶液作为显色剂,在波长为380 nm条件下,实验结果线性最好、偏差最小。
X射线荧光光谱法对钒氧化物中不同价态钒的定量分析
2017年07月X射线荧光光谱法对钒氧化物中不同价态钒的定量分析沈菲(河钢承钢检验检测中心,河北承德067000)朱建岩(河钢承钢钒钛事业部,河北承德067000)摘要:X射线荧光光谱法是一种常见的光谱分析技术,在元素种类的确定和元素含量的定量分析中非常常见,采用高分辨的X射线荧光光谱仪就可以对各种钒氧化物中不同的价态钒发射谱进行测定,本文主要采用X射线荧光光谱法对V2O3、V2O4和V2O5中不同价态的钒进行定量分析,旨在为人们提供一定的参考。
1X射线荧光光谱法定量分析的原理当采用X射线照射原子核时,原子核的内层电子能量和X射线的能量在相同的数量级,内层电子共振就会吸收X射线的辐射能量,发生跃迁,此时内层电子轨道上就会留下一个空穴,测定方法简单,得到的谱线简单,灵敏度高,在金属元素的测定中效果良好,在生物制品、环境科学和医学领域中均得到了广泛的应用。
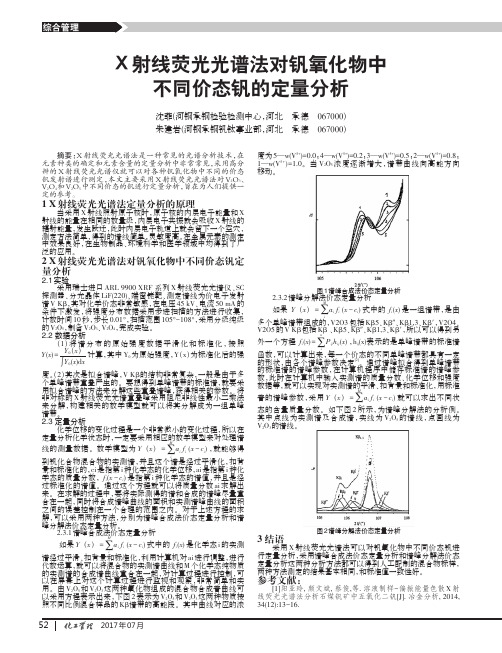
2X射线荧光光谱法对钒氧化物中不同价态钒定量分析2.1实验采用瑞士进口ARL9900XRF系列X射线荧光光谱仪、SC探测器、分光晶体LiF(220)、端窗铑靶、测定谱线为价电子发射谱V Kβ,其对化学价态非常敏感,在电压45kV、电流50mA的条件下激发,将强度分布数据采用步进扫描的方法进行收集,计数时间10秒,步长0.01°,扫描范围105°-108°,采用分级纯级的V2O5,制备V2O3、V2O4,完成实验。
2.2数据分析(1)将谱分布的原始强度数据平滑化和标准化,按照Y(x)=Y0(x)∫Y0(x)d x计算,其中Y0为原始强度,Y(x)为标准化后的强度。
(2)其次是拟合谱峰,V Kβ的结构非常复杂,一般是由于多个单峰谱带重叠产生的。
要想得到单峰谱带的标准谱,就要采用拟合谱峰的方法来分解这些重叠谱峰,获得相关的参数。
将非对称的X射线荧光光谱重叠峰采用阻尼非线性最小二乘法来分解,构建相关的数学模型就可以将其分解成为一组单峰谱带。
全钒氧化还原液流电池文献综述 (1)

全钒氧化还原液流电池通过阅读了一些关于全钒氧化还原液流电池的文献,我们实验小组对其做了一个总结。
我们从六个方面介绍:一、全钒氧化还原液流电池的简述;二、电解液的制备方法;三、电解液的优化;四、全钒氧化还原液流电池氧化还原动力学;五、钒电池充电过程中的副反应;六、实验方法简介。
一、全钒氧化还原液流电池的简述1.1 组成及概述钒电池是单金属系统的氧化还原液流电池,它主要由电极、液流电解质、电池隔膜、储液槽、反应电堆等组成。
不同价态的钒离子溶液分别作为正负极活性物质,通过外接泵把溶液从储液槽压入电池堆体内完成电化学反应之后,溶液又回到储液槽液态的活性物质不断循环流动。
选择合适的电极材料,可以提高钒氧化还原的电化学活性,最终实现钒电池能量效率的提高,钒电池电极材料有碳素类的如石墨、碳布、碳毡等,也有金属类的如 Pb 、Ti 等,还有导电聚合物或者聚合物混合物复合电极,有时,还要对电极的表面进行处理,以提高其性能。
适用于钒电池的隔膜必须是亲水性的,允许 H+自由通过,但是又要求必须能抑制正负极电解液中不同价态的钒离子的相互混合,避免了电池内部短路。
抑制了电池的自放电,从而延长了电池的寿命,这就要求选用具有良好导电性和选择性的离子交换膜。
一般选用交换 H+的阳离子交换膜,也有用 Nafion 膜的,但价格较贵。
钒电池采用钒的不同价态离子溶液作为电解液其中混合有硫酸作为支持电解质,钒电池的正极物质为V5+溶液,负极物质为V4+溶液,钒电池的溶液既是电极活性物质又是电解液,要求要能够长期稳定,存在并且要有好的化学活性,同时希望能尽量提高溶液的浓度以增加单位体积的储能能力。
1.2优点1) 电池的额定功率和额定能量是独立的,功率大小取决于电池堆,能量大小取决于电解液的体积和浓度,在使用中可以通过调节电解液的量来随意调节电池的容量;2) 在钒电池充放电期间电池内部只发生液相反应,不像普通电池那样有复杂的可引起电池电流中断或短路的固相反应,因此使用起来安全,性能可靠;3) 电池的保存期无限,储存寿命长,因为钒电池的电解液是循环使用的,不存在变质问题,只是长期使用后,电池隔膜电阻有所增加;4) 钒电池可实现真正意义上的深放电,钒电池的电化学反应是液相反应,可100%充放循环而不会影响电池性能;5) 钒电池电化学反应迅速,可快速充电及大电流密度放电;6) 钒电池具有类似于燃料电池的结构特点,它的反应电堆与储存电解液的槽体是相独立的,可通过更换电解液来实现能量的瞬间补充。
钒电池电解液中不同价态钒的分光光度分析

第31卷,第10期 光谱学与光谱分析Vol .31,No .10,pp2839-28422011年10月 Spectro sco py and Spectr al Analy sisO cto be r ,2011 钒电池电解液中不同价态钒的分光光度分析陈富于1,陈 晖2,侯绍宇2,刘建国1*,严川伟11.中国科学院金属研究所金属腐蚀与防护国家重点实验室,辽宁沈阳 1100162.沈阳科金新材料有限公司,辽宁沈阳 110015摘 要 采用先还原后络合的方法,利用草酸将V (Ⅴ)离子还原并形成络合物,使得全钒氧化还原液流电池(钒电池)电解液的四种价态离子在紫外可见光范围内均具有不同的特征吸收峰。
基于此建立了钒电池电解液中不同价态钒离子的光度分析方法,实现对钒离子定性、定量测定。
不同价态钒离子标准曲线线性相关系数都大于0.9990,线性范围分别为0.326~2.445,0.326~2.445,0.720~5.403,1.784~13.437g ·L -1,测定样品相对标准偏差(n =6)为0.594%~3.535%,满足钒电池电解液中钒离子价态分析的需要。
关键词 钒电池;钒离子;价态分析;分光光度法中图分类号:O 657.3 文献标识码:A D OI :10.3964/j .issn .1000-0593(2011)10-2839-04 收稿日期:2011-01-05,修订日期:2011-04-15 基金项目:国家重点基础研究发展(973计划)项目(2010CB227203)和国家自然科学基金项目(21003141)资助 作者简介:陈富于,女,1981年生,中国科学院金属研究所博士研究生 e -mail :fychen @im r .ac .cn*通讯联系人 e -mail :jg l iu @imr .ac .cn引 言 钒电池[1-11]作为一种新型能量存储系统,具有可快速和大容量充放电、功率和容量可调等特性,是解决风能、太阳能存储的理想储能电源。
钒电池电解液的电位滴定分析

作者简介:田 波(1971-),女,辽宁营口人,中国科学院金属研究所博士生,主要从事钒电池研究;严川伟(1963-),男,黑龙江人,中国科学院金属研究所研究员,主要从事电化学研究;屈 庆(1971-),男,安徽人,中国科学院金属研究所博士生,主要从事电化学研究;李 华(1976-),女,辽宁海城人,中国科学院金属研究所硕士生,主要从事钒电池研究;王福会(1960-),男,辽宁阜新人,中国科学院金属研究所研究员,博士生导师,主要从事电化学及高温氧化研究。
・测试与分析・钒电池电解液的电位滴定分析田 波,严川伟,屈 庆,李 华,王福会(中国科学院金属研究所金属腐蚀与防护国家重点实验室,辽宁沈阳110016)摘要:介绍了全钒氧化还原液流电池(以下简称钒电池)电解液中钒价态的电位滴定分析方法。
该法适用于钒电池电解液中V (Ⅱ)、V (Ⅲ)、V (Ⅳ)、V (Ⅴ)及总钒的测定。
结果表明,所测各价态钒及总钒的相对标准偏差(N =6)均不超过2.09%,可满足钒电池电解液中钒价态的分析需要。
关键词:钒电池; 钒价态; 电位滴定中图分类号:TM912.9 文献标识码:A 文章编号:1001-1579(2003)04-0261-03Potentiometric titration analysis of electrolyte of vanadium batteryTIAN Bo ,YAN Chuan 2wei ,QU Qing ,L I Hua ,WAN G Fu 2hui(S tate Key L aboratory f or Corrosion and Protection ,Institute of Metal Research ,Chinese Academy of Sciences ,S henyang ,L iaoning 110016,China )Abstract :Potentiometric titration analysis method for determining oxidation states of vanadium in the electrolyte of all vanadiumredox flow battery (vanadium battery )was established.It could be used to analyze V (Ⅱ),V (Ⅲ),V (Ⅳ),V (Ⅴ)and V all ions in the anolyte and catholyte of the battery.RSD (N =6)of the results was no more than 2.09%.The method was eas y to carry out with good reproducibility and satisfactory for quantitative determination of oxidation states of vanadium.K ey w ords :vanadium battery ; oxidation states of vanadium ; potentiometric titration 钒电池是化学储能电源技术的最新发展,它采用不同价态钒离子溶液作为正负极活性物质,其反应为:正极 V 4+充电放电5++e负极 V3++e充电放电2+钒电池与常规蓄电池相比具有更高的优势[1-3]:能量以电解液形式储存;功率由电堆大小决定;深放电100%对电池组无危害;储存寿命长;可通过更换电解液方式实现“瞬间充电”以及充放电无复杂固相变化等。
分光光度法测定全钒液流电池钒电解液中磷含量的不确定度评定

2017年01月分光光度法测定全钒液流电池钒电解液中磷含量的不确定度评定刘月菊张鹏姜雪莲(大连博融新材料有限公司,辽宁大连116450)摘要:本文叙述了铋磷钼蓝分光光度法测定全钒液流电池钒电解液中磷含量测定的不确定度评定方法。
通过对溶液配制过程和仪器测定过程的各种不确定度影响因素的评估,建立了全钒液流电池钒电解液中磷含量测定的不确定度评定数学模型,从而为测定的准确性提供了理论基础。
关键词:不确定度;分光光度法;全钒液流电池,钒电解液;磷全钒液流电池(Vanadium Redox Battery,缩写为VRB)[1],是一种液态氧化还原电池,也是一种新型清洁能源存储装置[2]。
与其他类型电池相比,具有功率大、寿命长、可靠性高、操作和维修费用少等明显的技术优势[3],因此在储能行业具备无可估量的发展潜力,甚至有可能将改变未来的能源格局。
而钒电解液组成成份含量的高低、杂质的含量,以及添加剂的用量会严重影响电池中膜及电极的寿命。
因此其成分检测方法,备受重视。
全钒液流电池电解液是硫酸、硫酸钒(V2(SO4)3)和硫酸氧钒(VOSO4)的混合溶液,在其中添加磷酸可以提高电池电解液的性能。
因此准确测定钒电解液中的磷含量,对全钒液流电池的性能提高和商业推广十分重要。
使用铋磷钼蓝分光光度法测定电解液中的磷含量,快速、准确、高效的满足了电解液大规模生产的要求。
而测量不确定度是与测量结果相关联的参数,它表征了可以合理的赋予被测对象的数值的分散程度。
由于其具有广泛的应用性与实用性,因此对测量不确定度的评定非常重要。
本文主要针对铋磷钼蓝分光光度法测定钒电解液中磷含量的测量结果不确定度进行了分析和评估。
1实验部分1.1原理在硝酸介质中,磷酸中的磷与铋及钼酸铵生成络合物,以抗坏血酸还原成磷钼蓝,于分光光度计700nm处,测量其吸光度。
测量方法依据标准:GB/T24583.5-2009。
1.2主要仪器设备T6紫外-可见分光光度计和30mm比色皿;2mL移液管;50mL、500mL、1000mL容量瓶。
容量法测定氧化钒中的各种价态钒[1]
![容量法测定氧化钒中的各种价态钒[1]](https://img.taocdn.com/s3/m/83734b194a7302768e99399c.png)
容量法测定氧化钒中的各种价态钒徐本平3 易桂华 钟 华 张爱萍 徐亚筠 庞万里(攀枝花钢铁究院检测中心,攀枝花617000)摘 要 用NaOH 溶液处理样品,分离V Φ然后以Fe Χ滴定测定之。
定量加入过量的V Φ到上述残渣中并用H 2S O 4溶解,用Fe Χ滴定,计算出V Χ、V ∆的含量。
V Ε的测定是通过从总钒量中扣除V Χ、V ∆、V Φ的含量得到。
V Χ、V ∆和V Φ的回收率均大于96%,其8次测定结果的相对标准偏差分别为:9.8%、0.4%、1.2%;本法快速、简便,在实际应用中效果良好。
关键词 钒,价态分析,容量法 2001212220收稿;2002206217接受1 引 言为了更好的利用钒的资源,开发钒合金新的中间原料V 2O 3,对于该物料中价态钒的分析,尚无合适的方法可用。
近年来,关于价态钒的分析研究较多,大部分方法[1~8]还停留在纯理论阶段,没有实际应用,有些方法虽有应用,只适应于单一价态的物料或简单的溶液样品,对于固体样品中各种价态钒(V Χ、V ∆、V Ε、V Φ)共存时的测定方法,尚不多见。
本文所研究的物料主要含钒、氧等成分,V 2O 3占大部分。
同时测定各种不同价态的钒,其难点在于:低价钒不稳定极易被氧化且与高价物的反应不易控制。
本文采用NaOH 溶液分离样品中的V Φ后,将残渣加入过量V Φ,利用Fe Χ返滴定V Φ就可测出V Χ+V ∆,再根据等物质的量规则计算,可求出V Χ和V ∆的含量。
有效地解决了这一分析难题。
2 实验部分2.1 主要化学试剂及仪器设备硫酸(1+1)溶液;磷酸(1+1)溶液;N 2苯基邻氨基苯甲酸指示剂(0.2%溶液);硫2磷混酸(1∶1∶2);五氧化二钒(基准,分析纯,上海试剂总厂);氢氧化钠(分析纯,重庆化学试剂总厂)。
亚铁标准溶液(C Fe Χ=0.5m ol Πl );V Χ+V ∆标准溶液;V ∆+V Ε标准溶液。
L0422型离心机。
全钒氧化还原液流电池电解液_王刚

2
钒电解液的制备
[8 , 9 ]
SkyllasKazacos 课 题 组 最初, 将硫酸氧钒 ( VOSO4 ) 直 接 溶 解 于 H2 SO4 中 制 得 了 1. 5 —
·1104·
化
学
进
展
第 25 卷
2 mol / L的 V ( Ⅳ ) 电解液。 由于 VOSO4 价格昂贵, 因此该方法一般用于实验室研究, 不适合大规模推 广。研究者把目光转向了其他更加价廉的含钒化合 物 原 料,比 如 石 煤、V2 O5 、V2 O3 、偏 钒 酸 铵 ( NH4 VO3 ) 。改用 V2 O5 或 NH4 VO3 为原料直接溶 解在硫酸中制备电解液, 虽然降低了成本, 但它们在 无法获得高浓度的钒电解液。 硫酸中的溶解性很差, V2 O5 溶解在 2 mol / L 的稀硫酸 比如, 室温条件下, 中, 最高浓度只能达到 0. 1 mol / L; NH4 VO3 溶解在 2 mol / L 的 稀 硫 酸 中,最 高 浓 度 也 只 能 达 到 0. 27 mol / L。 Kaneko 等[10]将 NH4 VO3 直接溶解于稀 硫酸中, 然后通过反复多次交替添加 NH4 VO3 和浓 硫酸制备了浓度为 3. 4 mol / L 的钒电解液。 但这种 方法耗时较长, 操作复杂, 不适合工业生产。为了弥 补直接溶解法的不足, 目前一般采用化学合成法和 电解法制备钒电解液。 2. 1 化学合成法 在适 化学合成法是以钒氧化物或钒盐为原料, 量的硫酸溶液中, 通过加热或加入还原剂的方式将 高价难溶钒化合物还原为低价易溶钒化合物 , 从而 制得一定浓度的钒电解液。 SkyllasKazacos 为了降低钒电解液的制备成本, 课题组放弃了直接使用 VOSO4 为原料制备, 而改用 廉价的 V2 O5 或 NH4 VO3 等钒化合物为原料制备, 作 了一 些 开 创 性 的 研 究。 他 们 详 细 研 究 了 V2 O5 、 NH4 VO3 等钒化合物的溶解过程, 并向其硫酸溶液 中通入 SO2 或加入草酸等还原剂制备各种价态的钒 电解液, 该方法可以极大地降低钒电解液的制备成 [11 ] 本 。他们还通过控制 V2 O3 和 V2 O5 粉末的表面 积和粒度, 将 V2 O3 和 V2 O5 直接混合溶于硫酸中, 利用它们之间的氧化还原反应制备了一定比例的 1 —6 mol / L 的V( Ⅲ) / V ( Ⅳ ) 混合电解液[12]。 该方 法直接以 V2 O3 为还原剂, 避免了因使用其他类型 。 还原剂而引入杂质 这种方法制备的电解液有望直 接应 用 于 钒 电 池。 彭 声 谦 等 从石煤中提取 V2 O5 , 然后通过化学还原法利用 H2 SO3 还原 V2 O5 制备了 V ( Ⅳ ) 电解液, 使钒电解液的原料成本进一 步 降 低 。 崔 旭 梅 和 陈 孝 娥 等 通 过 煅 烧 V2 O3 和 H2 SO4 混合物再溶解的方法制得了 V( Ⅲ) 和 V ( Ⅳ ) , 离子浓度之比正好为 1∶ 1 的电解液 极大地简 化了后期操作, 提高了制备电解液的效率。 吴雄伟 以分析纯的 V2 O5 为原料, 利用 H2 O2 还原的 方法制备了 1. 6 —2. 0 mol / L 的钒电解液。 该方法 等 避免了使用有毒的 SO2 , 更加环保, 但由于双氧水的
全钒液流电池荷电状态的分析与监测

第34卷第2期2006年4月浙江工业大学学报J OURNAL OF ZH E J IAN G UN IV ERSIT Y OF TECHNOLO GYVol.34No.2Apr.2006收稿日期:2005210212基金项目:国家自然科学基金资助项目(90510001)作者简介:王文红(1966-),浙江杭州人,副教授,博士研究生,研究方向为化学电源.全钒液流电池荷电状态的分析与监测王文红,王新东(北京科技大学冶金与生态工程学院,北京100083)摘要:液流电池是一种新型的电化学储能系统,正负极全使用钒盐溶液的称为全钒液流电池,简称钒电池.其荷电状态100%时电池的开路电压可达1.5V.用充放电实验研究全钒液流电池的性能时,有必要确定在充放电过程中电池的荷电状态.钒电池中各种价态离子含量的测定方法有电位滴定和分光光度法,确定正负极溶液中各价态离子含量就可知电池荷电状态.本实验提出用开路电压监测荷电状态的方法.在正负极反应达热力学平衡时电池的开路电压等于电池电动势,利用Nernst 方程可求得电池的荷电状态,而且这种测量方法简单,不会造成电池的容量损失,具有实用价值.由紫外2可见光谱证实电解液中的V (Ⅴ)主要以单体形式存在.关键词:荷电状态;开路电压;全钒氧化还原液流电池中图分类号:O643 文献标识码:A文章编号:100624303(2006)022*******Analysis and measurement of SOC in the vanadium flow batteryWAN G Wen 2hong ,WAN G Xin 2dong(School of metallurgical and ecological engineering ,University of science and technology Beijing ,Beijing 100083,China )Abstract :A redox flow battery (RFB )is a novel elect rochemical power supply in which t he chem 2ical species participating in t he electrode reaction are soluble.The all 2vanadium redox flow batter 2ies (V 2RFB )employ V (Ⅱ)/V (Ⅲ)and V (Ⅳ)/V (Ⅴ)redo x couples for t he negative and po sitive half 2cells and give an attainable open circuit voltage (OCV )of approximately 1.5V at 100%state of charge (SOC ).It is essential to determine t he SOC of a vanadium redox flow cell during t he charge/discharge cycling.The analysis met hods include potentiomet ric titration and spect rop ho 2tomet ry.Knowing t he concent ration of vanadium ions we can determine t he SOC of t he cell.In t his paper ,t he open current potential (OCP )is used to evaluate t he SOC.When t he reaction of anode and cat hode is in t hermodynamic balance ,t he OCP is equal to t he electromotive force of t he cell ,and can be used to calculate t he SOC by using Nernst 2Equation.The met hod t hat is easy and leads to no lo ss of t he capability of cells is usef ul for t he st udy of flow cells.The UV 2Vis absorp 2tion spect ra confirms t hat t he formation of V (Ⅴ)species are monomers.K ey w ords :State of charge (SOC );open current potential (OCP );vanadium redox flow cell 全钒氧化还原液流电池(V 2RFB ,All Vanadi 2um Redox 2Flow Battery )以钒离子溶液作为电极活性物质,通过改变正负极活性物质中不同价态钒离子的比例来储存和释放电能.不同价态离子所占比例不同,决定了电极活性物质的化学位,也决定了电池放电量的大小[123].其电极反应为正极 VO2++2H++e disch arge VO2++H2O(1) E0=1.004V负极 V2+-e disch arge V3+(2) E0=-0.255V充电反应是上述反应的逆反应.电池的荷电状态SOC(State of charge)是被用来反映电池的剩余容量状况的参数,其数值上定义为电池剩余容量占电池容量的比值[4]SOC=Q c/C I(3)式中:Q c为电池剩余的容量;C I为电池以恒定电流放电时所具有的容量.SOC为1表示电池处于充满电状态,SOC为0表示电池已处于全放电状态.液流电池的电极活性物质是溶液中的离子,确定正极和负极电解液中VO2+/VO2+和V2+/V3+各离子的含量和所占的比例就可以确定钒电池的荷电状态.确定溶液中二到五价态钒离子含量的方法主要有紫外2可见分光光度法和电位滴定法[5].钒电池的电解液浓度均在1.0mol/L以上,如果用分光光度法分析,就得稀释试样几百倍,增加了分析的复杂性和不准确性.电位滴定法可以用K2Cr2O7标准溶液滴定V2+,V3+,VO2+和VO2+离子,操作简便.但对于充放电过程中的电池,电位滴定操作复杂,而且会使负极溶液与空气接触,造成容量损失和分析误差.对于二次电池有多种估算SOC的方法,可归纳为电量累积法、电阻测量法和电压测量法3种基本类型.本实验采用电压测量法,用开路电压OCP (Open current potential)测量液流电池的荷电状态,利用Nernst方程确定开路电压与SOC的对应关系,并由电解液的吸收光谱确定五价钒离子的存在形式.把电压测量法的结果与电位滴定计算SOC 和电量累计法确定的SOC的结果进行了比较.1 实 验1.1 仪器和药品美国EG&G电化学综合测试仪,MUL TIM ER U T53型数字电压表(内阻10MΩ),p HS23C型酸度计,自制钒液流电池样机,P GEN ERAL Tu21901型紫外2可见分光光度计.阳极和阴极均为实验室自制石墨基复合电极[6],电极面积12.5cm2.隔膜为Nafion117膜.电解液为V2O5电解制得,正负极电解液体积都是15mL.V2O5,K2Cr2O7标准溶液,磷酸,Fe(Ⅱ)标准溶液,高锰酸钾等,以上药品均为分析纯.1.2 充放电实验和钒离子浓度的测定开始充电时,阳极电解液为2mol/L VOSO4,阴极为2mol/L V(Ⅲ),支持电解液为3mol/L H2SO4,此时电池的SOC为0.用EG&G电化学综合测试仪恒流充放电.充电电流为0.2A,充电一段时间后,停止充电,待开路电压稳定后,用数字电压表测开路电压.同时用电位滴定法测定V2+,V3+和VO2+,VO2+离子的含量.当阳极液中检测不到VO2+,阴极液中检测不到V3+时为全充满.放电电流为0.1A,每放电一段时间,停止放电并测定开路电压.同时取样用电位滴定法测各价钒离子含量,与开路电压推算的SOC值对比.记录恒流充放电的时间,用已充或放的电量估算SOC.用酸度计测量电解液的p H值.充放电过程中两极溶液通以氩气以消除浓差极化和防止二价钒离子被空气氧化.1.3 紫外2可见光吸收光谱V2O5溶于不同浓度的硫酸中,配制1~9mol/L H2SO4+0.1mol/L V(Ⅴ)溶液,其中V(Ⅴ)的浓度为2mol/L,在波长400~800nm范围内测试吸收光谱.2 结果与讨论2.1 电解液中不同价态钒离子的存在形式对于实验室电池样机,其支持电解液硫酸的浓度为2~3mol/L.钒离子在这个浓度的支持电解液中溶解度较好,可长期稳定存在,而且电解液的电导率在3mol/L硫酸溶液中更高[7],正极溶液电导率从2mol/L硫酸溶液中的2790S/m升高到3mol/ L中的3700S/m,负极溶液电导率从1420S/m升高到3000S/m.若硫酸浓度高于3mol/L,电解液的电导率会更大,但是V(Ⅳ)和V(Ⅴ)在更高浓度硫酸中会聚合成VO3+,V2O33+等,这种基团空间位阻大,造成更大的电化学极化.该实验用3mol/L H2SO4溶液为支持电解液.在硫酸溶液中,2价和3价钒离子均为水合离子[V(H2O)6]2+和[V(H2O)6]3+形式存在,所以在做热力学计算时,可以用V2+和V3+的形式计算.但V(Ⅳ)和V(Ⅴ)在水溶液中容易水解,在酸性溶液中4价钒离子存在形式为[VO(H2O)5]2+.5价钒在强酸溶液中有多种存在形式,在高浓度H2SO4・21・浙江工业大学学报第34卷(10~16mol/L )中,V 2O 34+成为主要存在形式,以及更复杂的存在形式V 2O 33+等.这两种离子的结构简图为图1.N Kausar [7]通过Raman 光谱分析当H 2SO 4浓度在4mol/L 以上时,可与硫酸根形成二聚合物(图2),有一个V O 双键断裂,V 与O 的孤对电子形成p 2π共轭,与单体相比能量分布平均,其吸收光谱与未形成二聚物的相比应发生红移.由图3的吸收光谱可以看出2mol/L V (Ⅴ)在5~9mol/L 硫酸介质中d 2d吸收峰向长波方向移动,而硫酸浓度在3mol/L 及更低的吸收光谱没有同样的移动,说明溶液中尚无二聚体存在.因此,对于本实验所采用的电解液,计算热力学关系用VO 2+和VO 2+的浓度计算.在3mol/L H 2SO 4溶中,V (Ⅱ)/V (Ⅲ)的标准还原电势是-0.291V ,V (Ⅳ)/V (Ⅴ)电对的标准电势是1.0V [8212].V H 2O O H 2OH 2OH 2O H 2O V H 2O H 2O OOH 2O H 2O 图1 浓度低于4mol/L 硫酸中VO 2+和VO 2+的存在形式简图图2 浓硫酸溶液中V (Ⅴ)二聚体结构简图a 21mol/L H 2SO 4;b 23mol/L H 2SO 4;c 25mol/L H 2SO 4;d 27mol/L H 2SO 4;e 29mol/L H 2SO 4图3 不同浓度硫酸溶液中2molV (Ⅴ)的紫外2可见吸收光谱2.2 开路电压与SOC 的关系电池的开路电压,一般均小于它的电动势.只有当电池的两极体系均达到热力学平衡状态时,开路电压才等于电池的电动势.液流电池充电过程中,由于电池的极化作用,电池的充电电压大于电池的电动势,放电电压小于电池的电动势.当电池处于开路状态,电池两边离子浓度不再变化,电池达到了热力学平衡状态,此时测得的开路电压即为电池的电动势.根据Nernst 方程,原电池的电动势E =OCP =Φ正-Φ负=1.004-(-0.291)-0.0592lg[VO 2+][V 3+][VO 2+][H +]2[V 2+]对于负半电池,SOC n =[V 2+][V 2+]+[V 3+],故 1-1SOC n =[V 3+][V 2+];对于正半电池,SOC p =[VO +2][VO +2]+[VO 2+],故 1-1SOC p =[VO +2][VO 2+]当正极和负极用同样浓度的电解液且近似认为两边反应动力学平衡,SOC n =SOC p =SOC代入上式,OCP =1.291-0.0592lg1SOC-121[H ]2(4)根据式(4),用钒电池稳定状态的开路电压计算SOC.2.3 游离H +浓度的确定钒电池的电解液中存在以下平衡[12]12V 2O 5+H +=VO 2++12H 2O K S =0.218±0.02(5)VO 2++HSO 4-=VO 2SO 4-+H +K S =9.32±0.43(6)当电池的支持电解液为3mol/L H 2SO 4时,其一级离解可认为是完全离解,第二级离解为部分离解,出于运算方便,只考虑硫酸的一级离解,VO 2+浓度为2mol/L ,离解出的游离H +浓度受式(5)和(6)平衡的影响,经计算为4.7mol/L.并计算游离H +浓度.p H 测量结果与理论计算相符.故将[H +]=4.7mol/L 代入(4)式计算SOC.2.4 计算值和实验数据比较数字电压表测得的开路电压和用电位滴定确定的SOC 列于表1中.由表1知,电池正极和负极荷・121・第2期王文红,等:全钒液流电池荷电状态的分析与监测电状态不平衡,在充电过程中,VO 2+VO +2的速度较快,而V 3+的还原受电池内未排尽空气的影响导致充电速度慢;放电时,V 2+V 3+的速度较快,而VO 2+基团因为有较大的空间位阻,到达电极表面速度相对慢,反应速度低于负极的速度.电位滴定的结果证实了这一点.表1 用开路电压和电位滴定求得的SOC 比较开路电压/V 由开路电压求得的SOC/%电位滴定确定的SOC/%正极负极0.64000充电过程1.247.12161.312032171.3962.778591.4582.489811.6599.61001001.4163.98961放电过程1.3644.963431.214.21502 表2是电量累积法和电压测量法的比较.电池电动势从充放电曲线(图4)可知.在恒流充放电时表2 充放电时间与SOC 的关系时间/h 充电放电电池电动势/V 开路电压/V由电量计算SOC/%充电放电1 1.380.64224.883 1.554 1.24174.644 1.651 1.39799.5251.897 1.65>1001 1.311 1.27575.1220.681.20350.24图4 实验室电池样机的充放电曲线由充电或放电电量所计算的SOC ,与开路电压测量的结果比较,虽然电量累积法检测SOC 方法比较简单,但未能根据放电率对电池SOC 进行修正,没有考虑放电电流对容量的影响因素有可恢复性,而且随着电池运行时间的增加,电量累计法估计SOC 的误差会越来越大.因此,电量累计法的可靠性低于开路电压测量法.3 结 论用开路电压测定钒电池的荷电状态,方法简单,可有效地判断电池的充放电程度,并可用于判断电池的充电效率;电池正极和负极使用同样的石墨基复合电极时,钒电池正极和负极的充放电反应动力学不平衡,在充电过程中,VO 2+VO +2的速度较快;放电时,V 2+V 3+的速度较快,电池的荷电状态取决于动力学过程较慢的一方.开路电压与SOC 的关系式为OCP =1.291-0.0592lg 1SOC -121[H ]2,当支持电解液为3mol/L 硫酸,[H +]浓度为4.7mol/L.参考文献:[1] J O ERISSEN L ,GARCH E J ,FABJ AN C ,et al.Possible useof vanadium redox 2flow batteries for energy storage in small geids and stand 2alone photovoltaic systems [J ].J PowerSources ,2004,(127):982104.[2] KAZACOS M ,CH EN G M ,SKY LLAS K M.Vanadium redoxcell electrolyte optimization studies [J ].J Appl Electrochem ,1990,(20):4632467.[3] FABJ IAN C ,GARCH E J ,HARRER B ,et al.The vanadiumredox 2battery :An efficient storage unit for photovoltaic sys 2tems[J ].Elect rochimica Acta ,2001,(47):8252831.[4] 胡恒生,王慧,杨宝华,等.蓄电池荷电状态判别方法的探讨[J ].电源技术,2004,(28):4312435.[5] 田波,严川伟,屈庆,等.钒电池电解液的电位滴定分析[J ].电池,2003,(33):2592263.[6] 黄可龙,伍秋美,刘素琴,等.钒氧化还原液流电池石墨-炭黑复合电极性能[J ].电源技术,2004,(28):91293.[7] KAUSAR N ,HOWE R ,SKY LLAS K M.Raman spectrosco 2py studies of concentrated vanadium redox battery positive e 2lectrolytes[J ].J Appl Eletrochem ,2001,(31):132721332.[8] SUN B ,SKY LLAS K M.Modification of graphite electrode mate 2rials for vanadium redox flow battery application —Ⅱacid treatment[J ].Electrochimica Acta ,1992,37(13):245922465.[9] SUN B ,SKY LLAS K M.Modification of graphite electrodematerials for vanadium redox flow battery application —ⅠThermal t reat ment [J ].Electrochimica Acta ,1992,37(7):125321260.[10] SUM E ,R YCHCIK M ,SKY LLAS K M.Investigation oft he V (Ⅳ)/V (Ⅴ)system for use in t he positive half 2cell of a redox battery[J ].J Power Sources ,1985,(16):85295.[11] GA T TRELL M ,PAR K J ,MADOU GALL B.Study of t hemechanism of t he vanadium 4+/5+redox reaction in acidicsolutions[J ].J Electochem Soc ,2004,(151):1232132.[12] ORIJ I G ,KA TA YAMA Y ,MIU RA T.Investigation on V(Ⅳ)/V (Ⅴ)species in a vanadium redox flow battery [J ].Electrochimica Acta ,2004,(49):309123095.(责任编辑:翁爱湘)・221・浙江工业大学学报第34卷。
X-荧光光谱法分析钒铁中的钒

没有 测 试 碳 的 晶体 , 所 以采 用 高频 红外 测 试 , 在 试
样描 述 时 输 入碳 含 量 , 再 归 一 化计 算 得 出结 果 , 试
验证 明分 析结果 可靠 , 能满 足生 产需 求 。
4 ) 分析 结 果 的 准 确 性 测 试 。用 国家 标 样 验 证
及对 生 产 试 样 采 用 本 法 和 化 学 法 G B / r 8 7 0 4 . 5— 2 0 0 7 对 比, 进行 分 析 结果 的准 确 性 实 验 , 比对 数 据
谱仪几何 因子等基本参数, 再进行试样 比对, 结果可靠, 符合分析要求。 关键 词 : 基本 参数 法 ; 钒铁 ; 压片; X一荧光光 谱
。 前 言
现在 采用 x一荧 光 测 试 钒 铁 基 本 上 采 用 化 学 分析 方法 , 分 析时 间长 , 耗 时耗 力 , 运 用 x一荧 光 分
l ‘ 4
硫 仪测 试钒 铁 的碳含 量 。 将 制好 的分析 样 品 放入 x荧 光 光谱 仪 的分 析 样 品盒 中 , 执 行 钒 铁 的 分析 程 序 , 查 看 结 果 时设 置 好 试样 的各 个参 数 , 归一 化计算 试样 的含 量 。
析有一定的难度 , 压片标准曲线法基体干扰严重 ,
本可 以忽 略 不 计 , 其 中的碳 元 素 , 因 为我 们 仪 器 中
2 6
出 全
次进 行分 析 , 如表 3所示 。
2 0 1 5 年 2 月 第 一 期
5 ) 分析 结 果 的精 密 度 测 试 。 同一 试 样 制 备 三
表 3 精 密度 测试 结果 V %
洁, 并 在 非分 析面 贴上标 签 , 编号。
钒电池用电解液价态钒的电位滴定分析

口〕 7 6 1 』 U
5 1 0 1 5 2 0 2 5
5 1 0 1 5 2 0 2 5
礴 酸 / m l
磷 酸 / m l
图2 - b确酸对滴定结果影响曲线
F i g . 2 - b E f f e c t t o r e s u I i s o f H , P 氏
1 . 3 . 4 V ( I I ) N( I ) 体系:
T V ( I V ) = T v a 一 兀 ( I I I )
在氮气保护条件下滴定, 操作步骤同V ( I V ) N( I I I ) 体系。 则电 解液中V ( I I ) 浓度为:
1 . 0 x V " 0. - 1 x 凡一 兀 总 T V ( I I ) = V
突跃范围 增大, 从而减小终点误差。彭声谦等人[ [ 3 ] 研究 结果 表明 当 磷酸浓度大于 6 m o 1 - L " 1 时, 亚铁离子可以 将V ( W ) 离子还原到VI I ) 离子,因此在滴定过程中 要尽量使磷酸浓度小 于6 m o 1 . L - 1 以 避免V( W) 离子 与 亚 铁 离 子反 应。
万方数据
中国 ・ 长沙
2 )5 X ( 年5 月
中国 储能电池与动力电 池及其关键材料学术研讨会
分析结果显示,总钒及价态钒分析结果的精确度高,相对标准偏差 R s D不超过 2 . 1 %; 在误差允许范围内与其他方法分析价态钒的浓度结果相同,表 1 。
衰 1不闷体系价态帆分析结果( n 二 5 )
3 .结论
以 硫酸亚铁按溶液为滴定液的电位滴定是一种易于操作、 安全可靠、 行之有效的价态钒
分析方法,它能够满足钒电池用电解液价态钒分析的需要。
参考文献 ( 略)
电位滴定法测定钒电池电解液中不同价态的钒

理化检验-化学分册 P TCA (PA R T B :C H EM.ANAL.)2007年第43卷12知识与经验电位滴定法测定钒电池电解液中不同价态的钒刘素琴1,桑 玉1,李林德2,黄可龙1(1.中南大学化学化工学院功能材料化学研究所,长沙410083; 2.攀枝花钢铁研究院成都分院,成都610016)中图分类号:O657.31 文献标识码:B 文章编号:100124020(2007)1221077202 钒电池是以钒离子溶液为正负极活性物质的蓄电池[1,2]。
钒各种价态的化学行为都很活跃,其中VO +2/VO 2+及V 3+/V 2+两电对电位相差约为1.25V 。
钒电池的工作原理如下:正极: V (Ⅳ)→V (Ⅴ)+e 充电 V (Ⅴ)→V (Ⅳ)-e 放电负极: V (Ⅲ)+e →V (Ⅱ)充电 V (Ⅱ)-e →V (Ⅲ)放电基于钒电池具有优于其它氧化还原电池的特点,如无交叉污染、反应速度快、可深度放电、易于增减电池功率和容量等,因而有着广泛的用途,如电网调峰、应急电源、动力电源等。
由于钒电池正负极的活性物质均为钒离子,钒离子的电化学反应程度决定着电池的充放电效率,因此有必要建立一种经济、简便、安全、有效的价态钒分析方法。
价态钒的分析方法主要有发射光谱法和电位滴定法等,目前钒电池用电解液中价态钒的分析以电位滴定为主,但报道的均是使用毒性较强、对人体危害较大的重铬酸钾作为滴定剂[3,4],而且操作相对繁琐。
本法提出了一种以硫酸亚铁铵溶液为滴定剂的安全、简便、有效的各种价态钒的电位滴定分析方法。
1 试验部分1.1 分析原理在强酸性介质中,4种价态钒离子不能3种以上共存,高价钒与低价钒氧化还原反应,这个反应是完全的也是定量的。
因此本法以下面三个化学反应方程式为理论依据:V (Ⅴ)+Fe (Ⅱ)V (Ⅳ)+Fe (Ⅲ)(1)V (Ⅴ)+V(Ⅲ)V (Ⅳ) (2)V (Ⅴ)+V (Ⅱ)V (Ⅳ) (3)1.2 主要仪器与试剂收稿日期62823ZDJ 2AA 型自动电位滴定仪。
钒电池电解液荷电状态的快速测定方法

t h ev a n a d i u mi o ni ss e p a r e t e l yc o mp a r e db yt i t r a t i o na n ds p e c t r o p h o t o me t r i cme t h o d ,a n db o t ho f t h ed e t e c . 1 %. t i o ne r r o r i sl e s s t h a n0 K e yWo r d s :v a n a d i u mb a t t e r y ;e l e c t r o l y t e ;c h a r g es t a t e ;d e t e r mi n a t i o nme t h o d
( 1 .C h e n g d eX i n x i nV a n a d i u mT i t a n i u mE n e r g yS t o r a g eT e c h n o l o g yC o . ,L t d . ,C h e n g d e ,H e b e i , 0 6 7 0 0 2 ; 2 .V a n a d i u ma n dt i t a n i u md e p a r t me n t o f H B I SG r o u pC h e n g s t e e l C o mp a n y ,C h e n g d e ,H e b e i ,0 6 7 0 0 2 ) A b s t r a c t :T h ev a l e n c eo f v a n a d i u mi s+ 5 ,+ 4 ,+ 3 ,a n d+ 2d u r i n gt h eo p e r a t i o np r o c e s s o f v a n a d i u mb a t t e r y .V a n a d i u mi o n sp r e s e n t d i f f e r e n t c o l o r s i nd i f f e r e n t v a l e n c es t a t e s .A c c o r d i n gt ot h el a wo f t h ea b s o r p ,t h ec o n c e n t r a t i o no f v a n a d i u mi o n s a t d i f f e r e n t t i o np e a k so f d i f f e r e n t c o l o r s o l u t i o n s a t s p e c i f i cw a v e l e n g t h s v a l e n c ys t a t e s i sd e t e c t e db ys p e c t r o p h o t o me t r y ,t h u s t h ec h a r g es t a t eo f e l e c t r o l y t ei sq u i c k l ya n da c c u r a t e l y 9 9 % d e t e r mi n e d .T h er e c o v e r yr a t eo f t h et e s t me t h o di s 1 0 1 %.A t t h es a met i me ,t h ed e t e c t i o ne r r o r o f
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第31卷,第10期 光谱学与光谱分析Vol .31,No .10,pp2839-28422011年10月 Spectro sco py and Spectr al Analy sisO cto be r ,2011 钒电池电解液中不同价态钒的分光光度分析陈富于1,陈 晖2,侯绍宇2,刘建国1*,严川伟11.中国科学院金属研究所金属腐蚀与防护国家重点实验室,辽宁沈阳 1100162.沈阳科金新材料有限公司,辽宁沈阳 110015摘 要 采用先还原后络合的方法,利用草酸将V (Ⅴ)离子还原并形成络合物,使得全钒氧化还原液流电池(钒电池)电解液的四种价态离子在紫外可见光范围内均具有不同的特征吸收峰。
基于此建立了钒电池电解液中不同价态钒离子的光度分析方法,实现对钒离子定性、定量测定。
不同价态钒离子标准曲线线性相关系数都大于0.9990,线性范围分别为0.326~2.445,0.326~2.445,0.720~5.403,1.784~13.437g ·L -1,测定样品相对标准偏差(n =6)为0.594%~3.535%,满足钒电池电解液中钒离子价态分析的需要。
关键词 钒电池;钒离子;价态分析;分光光度法中图分类号:O 657.3 文献标识码:A D OI :10.3964/j .issn .1000-0593(2011)10-2839-04 收稿日期:2011-01-05,修订日期:2011-04-15 基金项目:国家重点基础研究发展(973计划)项目(2010CB227203)和国家自然科学基金项目(21003141)资助 作者简介:陈富于,女,1981年生,中国科学院金属研究所博士研究生 e -mail :fychen @im r .ac .cn*通讯联系人 e -mail :jg l iu @imr .ac .cn引 言 钒电池[1-11]作为一种新型能量存储系统,具有可快速和大容量充放电、功率和容量可调等特性,是解决风能、太阳能存储的理想储能电源。
钒电解液是钒电池能量存储与转换的核心,钒离子的浓度及其变化直接影响到电池的荷电状态和电解液的稳定性。
钒电池正极电解液使用V (Ⅳ)和V (Ⅴ)离子的混合溶液,负极电解液则为V (Ⅱ)和V (Ⅲ)离子的混合溶液。
因此定性和定量分析电解液中各价态钒离子浓度,对于钒电池储能系统的实时监控、运行控制以及系统设计与维护都至关重要。
基于不同价态钒离子具有不同氧化还原电位的特性,已经发展了钒离子浓度分析的电位滴定方法[12-14],但系统的钒离子分光光度分析方法报道较少,其原因之一就是V (Ⅴ)在紫外可见光区无特征吸收峰。
本文采用络合还原法,利用草酸将V (Ⅴ)离子还原并形成络合物,实现钒电解液的四种价态离子在紫外可见光范围内均具有不同的特征吸收峰,基于此建立了钒离子的定性、定量测定方法,该方法操作简便,准确度高。
1 实验部分1.1 主要仪器与试剂紫外-可见分光光度计(T U -1900,北京普析通用仪器有限责任公司);兰电电池测试系统(BT1-40,武汉兰电电子有限公司)。
偏钒酸铵(高纯,天津市光复精细化工研究所),草酸(优级纯,国药集团化学试剂有限公司),浓硫酸(优级纯,沈阳经济技术开发区试剂厂),硫酸氧钒(分析纯,上海绿源精细化工厂):两次重结晶。
实验过程中使用的水为超纯水。
1.2 方法1.2.1 V (Ⅳ)钒离子的定量分析(1)标准溶液的制备硫酸氧钒二次重结晶后,根据重量分析法中的沉淀法[15](利用Ba 2+沉淀硫酸氧钒中SO 2-4)确定硫酸氧钒中结晶水n =3.06。
准确称取重结晶后的硫酸氧钒4.3628g 于烧杯中,加少量水,移取10mL 浓硫酸,搅拌至固体完全溶解,冷却后转移至100mL 容量瓶中定容,得0.2mol ·L -1V (Ⅳ)硫酸氧钒溶液。
(2)吸收峰的确定对(1)中0.2mo l ·L -1V (Ⅳ)硫酸氧钒溶液进行全谱扫描,扫描波长范围:200~900nm ,确定特征吸收峰和最大吸收波长。
(3)标准曲线的确定用(1)中0.2mo l ·L -1V (Ⅳ)硫酸氧钒溶液在最大吸收波长处做标准曲线。
1.2.2 V (Ⅲ)钒离子的定量分析(1)标准溶液的制备使用自组装电池,电极材料为聚丙烯腈基石墨毡,集流板为自制导电塑料板,正负极电解液由N afio n212隔膜隔开。
将1.5mol·L-1的硫酸氧钒溶液分别装入电池正负极,正负极溶液体积比1∶1,采用表1充电制度充电。
充电结束后取负极V(Ⅲ)溶液,稀释至0.4mol·L-1。
(2)吸收峰的确定对(1)中0.4mo l·L-1V(Ⅲ)溶液进行全谱扫描,扫描波长范围:200~900nm,确定特征吸收峰和最大吸收波长。
(3)标准曲线的确定用(1)中0.4mol·L-1V(Ⅲ)溶液在最大吸收波长处做标准曲线。
Table1 System of charging步骤1静置/s5步骤2恒流充电恒流充电恒流充电电流1680m A电流840m A电流280m A截止电压/V截止电压/V截止电压/V1.751.751.75步骤3停止1.2.3 V(Ⅱ)钒离子的定量分析(1)标准溶液的制备使用自组装电池(同1.2.2所述),正负极溶液体积比2: 1,采用表1充电制度。
充电结束后取负极溶液,得1.5 mol·L-1V(Ⅱ)钒溶液。
(2)吸收峰的确定对(1)中1.5mol·L-1V(Ⅱ)溶液进行全谱扫描,扫描波长范围:200~900nm,确定特征吸收峰。
由于V(Ⅱ)不能稳定存在于空气中,在取液过程中有部分V(Ⅱ)被氧化为V (Ⅲ),吸收光谱中同时存在V(Ⅱ)和V(Ⅲ)特征吸收峰。
(3)标准曲线的确定在V(Ⅱ)最大吸收波长处做V(Ⅱ)标准曲线。
取液过程中有部分V(Ⅱ)氧化为V(Ⅲ),制作V(Ⅱ)标准曲线的五个浓度点要利用V(Ⅲ)标准曲线扣除其中被氧化为V(Ⅲ)的V (Ⅱ)浓度。
1.2.4 V(Ⅴ)钒离子的定量分析V(Ⅴ)的硫酸溶液在紫外可见光范围没有特征吸收峰,不能直接定量测定。
本文采用向V(Ⅴ)溶液中加入过量的草酸,使V(Ⅴ)完全还原且还原产物与草酸充分络合的方法,测定此络合物的浓度即得原V(Ⅴ)浓度。
(1)标准溶液的制备准确称取2.3396g高纯偏钒酸铵于烧杯中,加少量水,移取10mL浓硫酸,搅拌至固体完全溶解,冷却后转移至100mL容量瓶中定容,摇匀。
将上述溶液转移至烧杯中,加入优级纯草酸,移取上层溶液50mL至100mL容量瓶中,得0.2mol·L-1V(Ⅳ)与草酸的络合物溶液,稳定72h后备用。
(2)吸收峰的确定对(1)中稳定72h后的络合物溶液进行全谱扫描,扫描波长范围:200~900nm,确定特征吸收峰和最大吸收波长。
(3)标准曲线的确定用(1)中溶液在最大吸收波长处做标准曲线。
1.2.5 不同价态钒离子的定性分析对于未知价态的电解液,先对其全谱扫描,将其谱图与1.2.1~1.2.4中确定的不同价态钒离子的特征吸收峰作比对,即可确定未知溶液中钒离子价态或价态的组合。
1.3 未知电解液浓度的测定对于已知价态电解液,若其中不含V(Ⅴ),只需将溶液稀释至相应标准曲线线性范围内,测定吸光度并确定浓度;若含V(Ⅴ),则先将溶液稀释至V(Ⅳ)标准曲线线性范围内,测定吸光度并确定V(Ⅳ)浓度,然后向其中加入过量草酸,72h后测定总钒浓度,扣除V(Ⅳ)浓度,即为V(Ⅴ)浓度。
对于未知价态电解液,先按1.2.5的方法对其进行定性分析。
再按上述方法进行定量测定。
2 结果与讨论2.1 硫酸和草酸吸收光谱图1和图2分别为2mol·L-1硫酸和0.5mol·L-1草2840光谱学与光谱分析 第31卷酸在200~900nm 的吸收光谱,由图知,硫酸和草酸水溶液在200~900nm 范围内无特征吸收峰,对本文中钒离子的定性、定量测定没有影响。
2.2 草酸用量和反应时间的确定由于V (Ⅴ)浓度的测定需使V (Ⅴ)被完全还原且还原产物V (Ⅳ)与草酸充分络合,故草酸应过量,且反应时间足够。
图3为不同反应时间下,0.02mo l ·L -1偏钒酸铵溶液中加入不同浓度草酸时吸光度随草酸浓度的变化曲线,从图中曲线看出,草酸浓度大于等于0.08mol ·L -1、反应时间为72h ,吸光度趋于稳定。
即:建立标准曲线时,草酸与偏钒酸铵的比例应大于等于4∶1,反应时间为72h。
Fig .3 Influence of the oxalic acid contentand reaction tim e on absorbance2.3 各价态钒离子最大吸收波长表2为根据图4确定的不同价态钒离子的最大吸收波长(λmax )。
V (Ⅲ)有两个特征吸收峰,分别在400和605nm 处,取最大吸收峰400nm 做标准曲线;V (Ⅱ)扫描光谱中有三个吸收峰,其中400和600nm 是V (Ⅱ)氧化产物V (Ⅲ)的吸收峰,847nm 是V (Ⅱ)特征吸收峰。
Table 2 Maximum a bsorption peaks of differentvalence state of vanadium ionsV 离子价态λma x /nm V 离子价态λmax /nm V (Ⅴ)780V (Ⅳ)765V (Ⅲ)400V (Ⅱ)847Fig .4 Characteristic absorption peaks of differentvalence state of vanadium ions 2.4 标准曲线根据朗伯—比尔定量[16]:A =εbc ,其中A 为吸光度;ε为摩尔吸光系数;b 为样品光程(1cm );c 为样品浓度,得不同价态钒离子标准曲线的回归方程、摩尔吸光系数(ε)、线性相关系数(R )及线性范围,见表3。
Ta ble 3 Standard curves of different valence state of vanadium ions价态回归方程ε/(L ·m ol -1·cm -1)R 线性范围/(g ·L -1)V (Ⅴ)A =0.477c +0.014724.2880.99990.326~2.445V (Ⅳ)A =0.345c +0.0051017.5740.99990.326~2.445V (Ⅲ)A =0.221c +0.054011.2581.00000.720~5.403V (Ⅱ)A =0.0625c +0.0006953.1840.99921.784~13.437Table 4 Determination of samples样品测量次数平均值/(g ·L -1)S d RSD /%V (Ⅴ)61.5000.0001450.964V (Ⅳ)61.6220.0003151.944V (Ⅲ)63.1790.0001890.594V (Ⅱ)65.8430.002073.5352.5 未知样品浓度的测定对正极电解液中V (Ⅴ)和V (Ⅳ)分别测定6次,V (Ⅴ)测定平均值1.500g ·L -1,标准偏差(S d )为0.000145,相对标准偏差(RSD )为0.964%;V (Ⅳ)测定平均值1.622g ·L -1,标准偏差(S d )为0.000315,相对标准偏差(RSD )为1.944%。
