第7章 电泳技术
临床生物化学检验-第7章 临床酶学检验技术

酶活性的国际单位定义; 酶活性测定的连续监测法的概念、计算和分 类;酶活性测定的影响因素及最适条件的确定原则。
血清酶变化的病理机制;酶动力学参数的含义;电泳法和免疫抑制法 测定同工酶的原理。
酶蛋白质量测定的优点;定时法测定临床常用诊断酶的原理和评价; 同工酶的其他检测方法。
2
第一阶段(1908 ~ 1950) :利用化学和有机化学的反应原理测定酶促反应生成量或底物消耗量定 时法测定AMY (1908年, Wohlgemuth)、 LPS、ALP、ACP等几种酶。
2. 国际酶学委员会将每种酶用4个数字加以系统编号: 数字前冠以EC ,数字之间用黑点 隔开。第一个数字表示酶的类别 ,第二个表示亚类 ,第三个表示亚-亚类 ,第四个表示 酶的编号序数:如EC1.1.1.27 LD (乳酸脱氢酶)。
3. 同工酶:催化相同化学反应, 但酶蛋白的分子结构、理化性质乃至免疫学性质不同的
心梗、肌病、颅脑损伤、肿瘤 心梗、肌病、肺梗死、肝病、肿瘤 肝胆疾病、骨病、妊娠、结肠炎、肿瘤
红细胞、前列腺、溶酶体 γ-GT1、 γ-GT2、 γ-GT3、γ-GT4
前列腺癌、血液病、骨肿瘤 肝癌、梗阻性黄疸
P-AMY(P1、P2、P3)、S-AMY(S1、 S2、 S3、S4) ALT、 mALT AST、 mAST
18
连续监测法(continuous monitoring assay): 在多个时间点连续测定产物生成量或底物消耗量 ,选取线性期的速率来
计算酶活性 ,又称速率法。将酶与底物在特定条件 (缓冲液、温度等) 下孵育 ,每隔一定时间 (2s∼60s) 连续测定酶促反应过程中某一底物或产物的特征信 号的变化 ,从而计算出每分钟的信号变化速率 ,求 出酶活性浓度。 尤其适合在自动化分析仪上使用
第七章蛋白质的分离

第七章蛋白质的分离、纯化与表征一、是非题1 一个蛋白质样品,在某一条件下用电泳检查,显示一条带。
因此说明,该样品是纯的()2 逆流分溶和纸层析,这两个分离氨基酸的方法是基于同一原理()3 蛋白质的SDS聚丙稀酰胺凝胶电泳和圆盘电泳是两种完全不同的技术()4 凝胶过滤法可用于测定蛋白质的分子量,分子量小的蛋白质先流出柱,分子量大的后流出柱()5 蛋白质在小于等电点的PH溶液中,向阳极移动,而在大于等电点的PH溶液中,将向阴极移动()6 电泳和等电聚焦都是根据蛋白质的电荷不同,即酸碱性质不同的两种分离蛋白质混合物的方法()二、填空题1 现欲分离某蛋白质溶液中的四个蛋白质成分,它们分子量和等电点列于表内蛋白质成分Mr pIA 12000 10B 62000 4C 28000 7D 9000 5如不考虑次要因素,它们在葡聚糖凝胶G-75柱上分离时,流出的先后次序将是:最先,,其次,最后流出的蛋白质是如选用羧甲基纤维素柱分离上面四种蛋白质,并用盐浓度梯度洗脱,流出的先后次序将是:、、、2 分离蛋白质混合物的各种方法主要根据蛋白质在溶液中的下列性质,,,3 蛋白质时两性电介质,当溶液的PH在其等电点以上时蛋白质分子带电荷,而PH在等电点一下时,带电荷三、选择题1.下列哪种方法可得到蛋白质的“指纹”图谱?A.酸水解,然后凝胶过滤B.彻底碱水解并用离子交换层析测定氨基酸的组成C.用氨肽酶降解并测定被释放的氨基酸的组成D.用胰蛋白酶降解,然后进行纸层析和纸电泳E.用2,4-二硝基氟苯处理蛋白质2.若用电泳分离Gly-Lys、Asp-Val和Ala-His三种二肽,在下列哪个pH条件下电泳最为合适?A.pH2以下B.pH2~4C.pH7~9D.pH10~12E.pH12以上3.进行疏水吸附层析时,以下哪种条件比较合理A.在有机溶剂存在时上柱,低盐溶液洗脱B.在有机溶剂存在时上柱,高盐溶液洗脱C.低盐条件下上柱,高盐溶液洗脱D.高盐溶液上柱,按低盐,水和有机溶剂顺序洗脱。
生物工程下游技术思考题答案

一.绪论1、从某一动物培养的细胞中分离某一抗体(一蛋白的代表)的一般工艺过程。
答:生物工程下游技术的一般工艺过程(p12)2、分离纯化某一酶制剂的主要步骤和结果如下表:((2)亲和层析的原理是什么?3、产品的分离提取工艺应考虑那些因素?答:生物分离过纯化过程的选择准则(P16)①步聚少,成本低②次序合理③产品规格(注射,非注射)④生产规模⑤物料组成⑥产品形式固体:适当结晶,液体:适当浓缩⑦产品稳定性⑧物性溶解度,分子电荷,分子大小,功能团,稳定性,挥发性⑨危害性⑩废水处理第二章发酵液预处理1.沉降速度离心的原理。
(p15)答:沉降速度法:主要用于分离沉降系数不同的物质。
2.沉降平衡离心的原理。
(p15)答:沉降平衡法:用于分离密度不同的物质。
如梯度密度离心。
3.差速离心的概念。
(p15)答:采用不同的转速将沉降系数不同的物质分开的方法。
4. rpm与RCF的换算关系。
5.已知某一离心机的转子半径为25cm,转速为1200r/min,计算相对离心力为多大?第三章细胞破碎1除去发酵液杂蛋白质的常用方法有那些?答:杂蛋白质的除去(p6)(1) 沉淀法:蛋白质是两性物质,在酸性溶液中,能与一些阴离子(三氯乙酸盐、水扬酸盐)形成沉淀;在碱性溶液中,能与一些阳离子(Ag+、Cu2+、Zn2+、Fe3+等)形成沉淀。
(2) 变性法:使蛋白质变性的方法很多,如:加热,调节pH,有机溶剂,表面活性剂等。
其中最常用的是加热法。
(3) 吸附法:加入某些吸附剂或沉淀剂吸附杂蛋白质而除去。
2产品的分离提取工艺应考虑那些因素?答:(1) 是胞内产物还是胞外产物;(2) 原料中产物和主要杂质浓度;(3) 产物和主要杂质的物理化学特性及差异;(4) 产品用途和质量标准;(5) 产品的市场价格;(6) 废液的处理方法等。
3发酵液过滤与分离的困难的原因及解决方法。
答:第一节发酵液过滤特性的改变微生物发酵液的特性可归纳为: (P3)①发酵产物浓度较低,大多为1%一10%,悬浮液中大部分是水;②悬浮物颗粒小,相对密度与液相相差不大;③固体粒子可压缩性大;④液相粘度大,大多为非牛顿型流体;⑤性质不稳定,随时间变化,如易受空气氧化、微生物污染、蛋白酶水解等作用的影响。
二维电泳原理和方法

如果样本较多地集中在高端和低端pH梯度,或者在较窄的pH梯度内分离大量蛋白质, 应使用Ettan IPGphor Manifold胶条槽和7、11、13、18或24 cm的Байду номын сангаасmmobiline DryStrip干胶条,上 样可采用样品杯、溶胀盘、或纸桥,详见2.3~2.5节。
MultiphorⅡ电泳系统(图7)具有多种功能,可进行几种不同的电泳。对于双向电泳,它既 可用于第一向IEF电泳,也可用于第二向SDS-PAGE电泳。干胶条进行溶胀时既可以含有样本, 也可以不含样本,溶胀在溶胀盘内进行。溶胀后,胶条被转移到电泳仪上进行第一向等电聚焦 (IEF)。
MultiphorⅡ电泳系统。这两种系统均可以通过升级配件而进一步改善 IEF 电泳性能。 Ettan IPGphor3 等电聚焦系统(图 1)是一种 IEF 电泳专用系统,电泳在 Immobiline DryStrip
干胶条上进行,该系统已经过升级,操作简单,可轻松完成第一向电泳分离。Ettan IPGphor3 等电聚焦系统的一贯特点是高速,可重复性好,高通量。该系统配备了高安全性的高压电源(根
概述
关于本手册
本手册旨在介绍高分辨率双向(2-D)电泳的操作方法。 本手册共分七章: 第一章介绍样品制备和蛋白定量的方法。 第二章具体介绍双向电泳中第一向的操作过程,重点介绍EttanTM IPGphorTM 3等电聚焦系 统。 第三章包括采用各种垂直凝胶电泳系统进行固相pH梯度(IPG)胶条的第二向电泳的一般方 法。 第四章介绍使用平板Multiphor TM Ⅱ电泳系统进行第一向和第二向电泳的方法。 第五章讨论双向电泳结果的图像与分析。 第六章介绍双向荧光差异凝胶电泳(2-D DIGE)的优势与使用技术。 第七章描述双向凝胶电泳的常见问题与解决方法。涉及具体技术的故障排除方法请见相关 章节。 本手册介绍的操作程序使用Amersham Biosciences公司的产品,该公司现为GE Healthcare公 司的一部分(下文均称GE Healthcare)。备选设备及照片见表1。产品订购信息见第155页。 根据样本类型和研究性质的不同,本手册所介绍的操作步骤可能须调整或优化。
搪瓷7

流动涂搪是一种适合于大规模生产的涂搪方法。 这种涂搪操作不是把底坯浸在釉浆里,而是悬 挂在驱动链上;吊在链条上的底坯经过适当位 置的喷口时,釉浆流在上面。多余的釉浆流回 到泵里。这种涂搪作业适用于大批量,并且品 种完全一致的产品,由于安置在一定部位的釉 浆喷口仅对底坯外表面涂搪,釉浆利用率也较 高。 必须严格控制流动涂搪的流变性。经过循环, 釉浆的屈数值通常会升高。从贮存罐中流出的 釉浆在调整其屈数值之前要经过一个磁性分离 器加以过筛处理,然后再回到泵里去。
(4)电泳要点 ①夹持触点要小,并夹在非主要面上。 ②电极网的密度及其与铁坯间距直接影响粉 层厚度。密度大或距离近,则粉层厚;反之 则粉层薄。 ③电泳过程中釉浆浓度降低,pH值上升,温 度升高,铁离子浓度增大,粉坯质量变坏。 烧成后,瓷面呈现点、线状缺陷,色泽变黄。 因此,要经常补充新粉,加人缓冲剂(如硼 砂等)以稳定pH值;同时采用降温和除铁等 措施,以提高电泳质量。
干粉静电涂搪的原理如图7-1所示。
底坯接地作正极,搪瓷材料粉末经过7~10万伏的负压 喷枪使瓷粉带负电,在电场的作用下,喷向底坯,并 在上面沉积。
干粉静电涂层最初于六十年代初应用于有机涂 料,借鉴了有机涂层中的成功经验,干粉静电 涂搪于七十年代初引起了搪瓷材料工艺学家的 注意,并且于1976年首先在欧美等先进国家进 入实用化阶段。 至1980年,美国、法国已经各有了5~6条生产 线,日本、西班牙也建立了第一条生产线,八 十年代,干粉静电涂搪在各工业国家已大大普 及. 至1987年,生产线总数已超过了100条,用于 生产微波炉,洗碟机、热水器、洗衣机等家用 电器,并逐浙扩展到橱房用具、墙面板等。
由于不需要粘土和电介质等磨加物,粉 末涂搪熔化后瓷层的光泽和耐酸性能都 得到了改善。钛白釉可以与一些黑色底 釉一起使用。由于不可能磨加着色氧化 物,彩色制品一般采用本身含有颜色的 瓷釉。
第七章_蛋白质分分离纯化和表征09

(三)根据电荷不同的纯化方法
电泳 :在外电场的作用下,带电颗粒向着与其电性相反的 电极移动,这种现象称为电泳。 原则上按电泳的原理来分,可分为: 自由界面电泳 区带电泳 滤纸电泳和薄膜电泳(醋酸纤维素薄膜、聚酰胺薄膜) 粉末电泳(淀粉、纤维素粉、硅胶粉,粉末与适当溶剂调 和,铺板) 细丝电泳,如尼龙丝和其它人造丝电泳,这是一类微量电 泳 凝胶电泳,最常用的支持介质是聚丙烯酰胺凝胶和琼脂糖 凝胶
几种蛋白质等电点
二、蛋白质的分子大小与分子量的测定
蛋白质的分子量的范围:
6×103~1×106 Da
测定蛋白质相对分子量的原理和方法
(一)根据化学组成测定最低相对分子量 用化学分析方法测出蛋白质中某一微量元素的 含量。并假设蛋白质分子中含有一个被测元素的原 子,则可由此计算出蛋白质的最低分子量。 例:肌红蛋白和血红蛋白含铁量均为0.335%, 计算二者的相对分子质量。
溶剂的密度(g/cm3)
(四)凝胶过滤法测定Mr
凝胶过滤(层析)可按照蛋白质分子量大小进行分离 的技术,同时可以测定蛋白质分子量。 蛋白质通过凝胶柱的速度即洗脱体积与其分子量有关: 先测得几种标准蛋白质的 Ve (Ve为洗脱体积) ,并 以其分子量对数对Ve作图得 一直线,再测出待测样品的 Ve,查标准曲线即可确定分 子量,并以其分子量对数对 Ve作图得一直线,再测出待 测样品的Ve,查标准曲线即 可确定分子量。
① 盐析法(salting out) : 中性盐(NH4SO4,NaSO4,NaCl等)→ 蛋白质脱去水 化层。 优点:不引起蛋白质变性。
盐溶(salting in):稀盐溶液中蛋白质溶解度增 加的现象。
② 有机溶剂沉淀法: 极性有机溶剂(甲醇,乙醇,丙酮)→脱去水化层以及 降低介电常数 而增加带电质点间的相互作用。 条件:低温操作,缩短时间。
毛细管电泳操作手册(英文)

20
配置选项 图 16 P/ACE MDQ 配置选项对话框(分析选项)
分析选项定义重新处理数据时采用的软件功能。 PDA 允许分析 PDA 检测器的多通道数据。 System Suitability 可自动查看结果。未选择的结果可实时更新。 Qualitative Analysis 允许以迁移时间,相对迁移时间或迁移率。 Caesar Integration 用于检测峰的开始和结束。当基线突然跃迁或信噪比较低时非 常有用。如果未选择,峰的开始和结束基于斜率阀值。
在 MECC 中,当把离子型表面活性剂加入缓冲液中,并且其浓度足够大时 这种表面活性剂的单体就结合在一起,形成一个球体我们称其为胶束。目前,以 十二烷基硫酸钠(SDS)使用最为普遍。
在 MECC 的系统中存在两个相:流动的水相和起到固定相作用的胶束相, 被分离物在这两个相之间分配,由于它们在胶束中具有保留能力而产生不同的保 留时间。和区带电泳一样,缓冲液在管别壁处形成正电,使其显示强烈的向负极 移动的电渗流,而 SDS 胶束由于其外壳带负电性具有向正极迁移的倾向。一般 情况下,电渗流的速度大于胶束的迁移速度。因此,迫使胶束最终以较低的速度 向负极移动。我们把这个移动的胶束固定相也称之“准固定相”。
图 6 UV 测器光纤的连接方式示意图
10
图 7 PDA 检测器光纤的连接方式示意图
11
第七章 毛细管电泳法

特
点
近似通用,常规应用 灵敏,但试样通常要衍生 高灵敏度,价格昂贵,要衍生化 通用性 选择性,灵敏度高,微量 仪器复杂,可获结构信息, 质量灵敏度高 灵敏度高,操作有特殊要求
放射
10-9-10-11
第七章 高效毛细管电泳 分析法
high performance capillary electrophoresis,HPCE
电场强度
第7章 毛细管电泳
7-1 毛细管电泳的原理
2 电泳和电渗
1. 2.
电渗流的意义
3.
电泳过程中,伴随着电渗现象 电渗流的速度比电泳速度快5-7倍 利用电渗流可将正、负离子或中性分子一起向同 一方向,产生差速迁移,在一次电泳操作中同时 完成正、负离子的分离分析
分情况而论
电渗流是毛细管电泳分离的重要参数 控制电渗流的大小和方向,可提高毛细管电 泳分离的效率、重现性、分离度。
第7章 毛细管电泳
7-2 分离模式
5 毛细管等电聚焦 CIEF: 建立在不同蛋白质或多肽之间等 电点(pI值)差异基础上的分离方 法。 蛋白质的等电点(pI): 指蛋白质分子的表观电荷数为零 时的pH值。
第7章 毛细管电泳
5 毛细管等电聚焦 方法:
1.
2.
3.
进样-等电聚焦-检测 先将脱盐的试样(蛋白质)以≥1%的浓度与两性电 解质溶液混合,用压力进样充入毛细管柱(阳极端), 置于阳极电解质溶液如H3PO4中,检测端为阴极端,置 于阴极电解质如NaOH中。 施加电压,进行电泳实验。两性电解质离子形成pH的 位置梯度,而蛋白质在迁移时会在其等电点的pH区域 内停止移动。这样pI不同的蛋白质各组分会在毛细管 内很窄的不同pH区域内聚焦. 在阳、阴极电解液中加入盐如NaCI或NaOH,破坏pH梯 度,使各组分蛋白质重新带电,在电场力作用下发生 迁移、检测,使不同组分的蛋白质得到分离。
电泳常见问题及方法

由于电泳涂装方法的独特性,所产生的漆膜弊病虽与一般漆膜病相同,但病因及防治方法不同,有些弊病是电泳涂装独有。
在本章中将常见的电泳涂装漆膜弊病及病因和防治方法介绍如下:1颗粒(疙瘩)在烘干后的电泳漆膜表面上,存在有手感粗糙的(或肉眼可见的)较硬的粒子,称为颗粒。
产生原因:(1)电泳槽液有沉淀物,凝聚物或其它异物,槽液过滤不良。
(2)电泳后冲洗液脏或冲洗水中含漆浓度过高。
(3)烘干炉脏,落上颗粒状的污物。
(4)进入电泳槽的被涂物不洁净,磷化后的水洗不净。
(5)涂装环境脏。
防治方法:(1)减少尘埃带入量,加强电泳槽液的过滤。
所有循环的漆液应全部经过滤装置,推荐用25um精度的过滤袋过滤,加强搅拌防止沉淀,消除槽内的“死角”和裸露金属处,严控PH值和碱性物质,防止树脂析出或凝聚。
(2)提高后冲洗水的清洁度,电泳后冲洗的水中固体份要尽量低,保持后槽向前槽溢流补充。
清洗液要过滤,减少泡沫。
(3)清理烘干室,清理空气过滤器,检查平衡系统和漏气情况。
(4)加强磷化后的冲洗、要洗净浮在工件表面上的磷化残渣。
检查去离子水循环水洗槽的过滤器是否堵塞,防止被涂物表面的二次污染。
(5)涂装环境应保持清洁。
磷化至电泳槽之间和电泳后沥干(进入烘干室前)应间壁,检查并消除空气的尘埃源。
注:槽液中污物基准测定:取槽液1公斤,用500目的滤网过滤后,残渣量应少于10mg。
2.陷穴(缩孔)由外界造成被涂物表面,磷化膜或电泳湿漆膜上附有尘埃、油等,或在漆膜中混有与电泳涂料不相溶的粒子,它们成为陷穴中心,并造成烘干初期的流展能力不均衡而产生火山口状的凹坑,直径通常为0.5—3.0mm,不露底的称为陷穴、凹洼,露底的称为缩孔。
产生原因:(1)槽液中混入异物(油分、灰尘),油飘浮在电泳槽液表面或乳化在槽液中。
(2)被涂物被异物污染(如灰尘、运输链上掉落的润滑油、油性铁粉、面漆尘埃、吹干用的压缩空气中有油污)。
(3)前处理脱脂不良,磷化膜上有油污。
基因工程第七章 重组子的筛选和鉴定

固相支 持滤膜
一抗
待测基因 产物蛋白
125I标记的二抗
固相支 持滤膜
一抗
待测基因 产物蛋白
二抗
125I 标记的二 抗结合蛋白
固相支 持滤膜
待测基因 产物蛋白
一抗 125I标记的二抗
固相支 持滤膜
待测基因 产物蛋白
二抗上连着一种酶(辣根过氧化物酶、碱性磷酸 酶、过氧化物酶、脲酶等)。
(4)显色反应
加入无色的底物,被二抗上所带的酶催化反应 转变成有色物质(或发光)。
(5)比色
在特殊的分光光度仪(酶标仪)上比色,打印出结 果。
3、ELISA的局限性 有效,但敏感性、特异性稍差(主要取决于 一抗的特异性)。 必须与其他方法一起综合考虑。
将外源DNA片段插在EcoRI
位点,则: 非重组子呈Ampr、Tetr 重组子呈Ampr、Tetr
Apr
将外源DNA片段插在BamHI 位点,则:
非重组子呈Ampr、Tetr 重组子呈Ampr、Tets
(二)、显色筛选法
1、基本原理
显色筛选法可以区分转化子与非转化子,也 可区分重组子与非重组子。其原理是:载体分子 上携带某种显色酶基因,其表达产物能使细胞产 生颜色反应,从而易于辨认和挑选,如大肠杆菌 质粒pUC18携带的lacZ’基因(蓝色反应)、链霉 菌质粒pIJ702携带的melC基因(黑色反应)等。
离质粒DNA并对其进行电泳,带有外源基因的重 组DNA分子的迁移率要低于无外源基因的质粒分 子。 2、操作:
将含有质粒的单重菌落细胞破碎,提取其质粒 D断N含A有,插用入分琼序子脂列量糖的凝重胶组组克电质泳粒,空。观载察体其电泳图谱,判
化工原理第7章详解

第二节 相组成的表示方法
6.1.2.相组成表示法
1.质量分率与摩尔分率 质量分率:在混合物中某组分的质量占 混合物总质量的分率。
wA
=
mA m
摩尔分率:在混合物中某组分的摩尔数
占混合物总摩尔数的分率。
气相: 液相:
yA
=
nA n
xA
=
nA n
yA + yB + ⋅⋅⋅yN = 1
xA + xB + ⋅⋅⋅xN = 1
期中考试及试卷分析 第九章 蒸馏
第十章 简单的介绍干燥
课程实习 停课进行课程设计 期末复习
第七章 传质与分离过程概论
重点:传质分离方法的选择 相组成的表示方法 相之间对流传质模型 各种传质机理和传质方式的理解 传质设备的基本类型和性能要求
难点:双膜理论 溶质渗透理论 表面更新理论
第一节 概述
• 7.1.1 传质分离方法
依据分离原理不同,传质分为两种
平衡分离
速率分离
平衡分离过程系借助分离 媒介(如热能、溶剂、吸 附剂等)使均相混合物系 统变为两相体系,再以混 合物中各组分在处于平衡 的两相中分配关系的差异 为依据而实现分离。根据 两相状态的不同,平衡分 离过程可分为如下几类:
速率分离过程是指借助某种推 动力,如浓度差、压力差、温 度差、电位差等的作用,某些 情况下在选择性透过膜的配合 下,利用各组分扩散速度的差 异而实现混合物的分离操作。 这类过程的特点是所处理的物 料和产品通常属于同一相态, 仅有组成的差别。
平衡分离
(1)气液传质过程 (2)液液传质过程 (3)液固传质过程 (4)气固传质过程
在平衡分离过程中, 组分在两相中的组成关系常用分配 系数(又称相平衡比)来表示,即
蛋白质电泳技术

蛋白质电泳技术
蛋白质电泳技术是一种分析液体或提取物中蛋白质的方法,可用于蛋白质的分离、分子量测定和纯度鉴定等。
百泰派克生物科技提供基于SDS-PAGE(sodium
dodecyl sulfate polyacrylamide gel electrophoresis)和双向电泳(two-dimensional electrophoresis,2-DE)等的蛋白质分离和分析服务。
电泳技术
电泳(electrophoresis,EP)是电泳现象的简称,指的是带电颗粒在电场作用下,向着与其电性相反的电极移动的现象。
利用带电粒子在电场中移动速度不同而达到分离粒子的技术称为电泳技术。
电泳法可以用少量样品以多种有或没有支持介质的方式进行,例如十二烷基硫酸钠聚丙烯酰氨凝胶电泳(SDS-PAGE)、自由流电泳、
等电聚焦电泳、等速电泳、亲和电泳、免疫电泳、对流电泳和毛细管电泳。
蛋白质电泳技术。
蛋白质电泳技术
蛋白质电泳技术常用于分离和分析蛋白质。
根据支持介质的不同,蛋白质电泳技术的种类有醋酸纤维素薄膜电泳、琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳、等电聚焦电泳和毛细管电泳等。
其中,等电聚焦电泳与SDS-PAGE结合又形成二维凝胶电泳(也称双向电泳,2-DE),可用于更好的分离蛋白质。
在2-DE的基础上又发展有双向荧光差异显示凝胶电泳(Two-dimensional fluorescence difference gel
electrophoresis,2D-DIGE),可在同一块胶上同时分离多个分别由不同荧光标记的样品。
2020年秋冬智慧树知道网课《生物药物分析与检验(山东联盟)》课后章节测试答案

第一章测试1【判断题】(10分)生物药物分析是药物分析的一个分支,是运用运用化学、物理化学或生物化学的方法和技术研究生物药物及其制剂质量控制方法的学科。
A.错B.对2【判断题】(10分)药典是国家对药物质量标准及其检验方法所做的技术规定,是药物生产、监控、供应、使用及管理部门共同遵循的法令。
A.错B.对3【判断题】(10分)2015版《中国药典》分为三部,首次将通则、药用辅料单独作为《中国药典》第三部。
A.错B.对4【单选题】(10分)为了保证药品临床试验资料的科学性、可靠性和重现性,涉及新药临床研究的所有人员都必须执行哪一项规定?A.GSPB.GCPC.GLPD.GMP5【判断题】(10分)天然生化药物指的是从生物体中获得的天然存在的生化活性物质。
A.错B.对6【单选题】(10分)抗生素属于哪一类药物?A.核酸类药物B.微生物药物C.多糖类药物D.天然生化药物7【判断题】(10分)生物药物检验工作的基本程序一般为取样、鉴别、检查、含量测定,最后完成检验报告。
A.错B.对8【判断题】(10分)分析任何药品,首先是取样,要从大量的样品中取出少量样品进行分析,可以由检验人员随意抽取。
A.对B.错9【判断题】(10分)药品检验过程及结果必须要有完整的原始记录,实验数据也必须真实,不得涂改。
A.对B.错10【判断题】(10分)生物药物对酸、碱、重金属、热等理化因素的变化较为敏感,各种理化因素的变化容易对其生物活性产生影响。
A.错B.对第二章测试1【判断题】(10分)酶分析法包括酶法分析和酶活力测定两种类型。
A.对B.错2【判断题】(10分)在通常的酶活力测定时总要先制备酶反应进程曲线和酶浓度曲线两条曲线。
A.错B.对3【判断题】(10分)在实际酶活测定中一般以测定底物的减少量为准。
A.对B.错4【判断题】(10分)酶活力测定过程中,检验酶反应和测定系统是否正确的标准是测得的反应速度必须和反应时间有线性的比例关系。
机械制造工艺学课件第7章 精密、超精密及微细加工工艺

第7章 精密、超精密及微细加工工艺
➢ 精密、超精密磨削和磨料加工
超精密磨削和磨料加工是利用细粒度的磨粒和微 粉主要对黑色金属、硬脆材料等进行加工,可分为固 结磨料和游离磨料两大类加工方式。
固结磨料加工主要有:超精密砂轮磨削和超硬材 料微粉砂轮磨削、超精密砂带磨削、ELID 磨削、双 端面精密磨削以及电泳磨削等。
第7章 精密、超精密及微细加工工艺
第7章 精密、超精密及微细加工工艺
7.1 概述
现代制造业持续不断地致力于提高加工精度和加
工表面质量,主要目标是提高产品性能、质量和可靠性
,改善零件的互换性,提高装配效率。超精密加工技术
是精加工的重要手段,在提高机电产品的性能、质量和
发展高新技术方面都有着至关重要的作用,因此,该技
第7章 精密、超精密及微细加工工艺
游离磨料类加工是指在加工时磨粒或微粉成游离状态,如研磨时的研磨 剂、抛光时的抛光液,其中的磨粒或微粉在加工时不是固结在一起的。 游离磨料加工的典型方法是超精密研磨与抛光加工。
① 超精密研磨技术
研磨是在被加工表面和研具之间置以游离磨料和润滑液,使被加工表面
和研具产生相对运动并加压,磨料产生切削、挤压作用,从而去除表面
7
第7章 精密、超精密及微细加工工艺
② 超精密砂带磨削技术 随着砂带制作质量的迅速提高,砂带上砂粒的等高性和 微刃性较好,并采用带有一定弹性的接触轮材料,使砂 带磨削具有磨削、研磨和抛光的多重作用,从而可以达 到高精度和低表面粗糙度值。
砂带磨削机构示意图
8
第7章 精密、超精密及微细加工工艺
③ ELID(电解在线修整)超精密镜面磨削技术
术是衡量一个国家先进制造技术水平的重要指标之一,
7第七章 免疫电泳技术

第七章免疫电泳技术本章考点1.概述2.免疫电泳技术3.应用免疫电泳技术是根据抗原及抗体反应的高度特异性,电泳技术的高分辨力和具有微量、快速的特点,将凝胶内电泳与免疫扩散相结合的一项免疫学技术。
第一节基本原理一、原理免疫电泳技术实质上是在直流电场作用下的凝胶扩散试验。
它的原理是将凝胶扩散置于直流电场中,在一定的条件下,抗原及抗体离解成为带正电或负电的电子,在电场中向异相电荷的电极移动,所带净电荷量越多、颗粒越小,泳动速度越快,反之则慢。
由于电流加速了抗原、抗体的运行速度,缩短了两者结合的时间,加快了沉淀现象的产生。
当有多种带电荷的物质电泳时,由于静电荷不同,而区分成不同区带,使抗原决定簇不同的成分得以区分。
影响因素有:①电场强度;②溶液pH;③离子强度;④电渗等。
二、电解质和蛋白质的电离特性、电泳迁移率、电渗蛋白质的基本单位是氨基酸,在水溶液中具有两性电离特性,当缓冲液pH与蛋白质等电点(PI)相当时呈电中性,无电泳迁移性;缓冲液pH大于蛋白质等电点(PI)时带正电荷,向阴极端移动;缓冲液pH小于蛋白质等电点(PI)时带负电荷,向阳极端移动。
在同一电场条件下,各种带电粒子在单位时间内的移动距离称电泳迁移率。
在电场中液体对固体可出现相对移动,产生电渗现象。
电渗不影响蛋白质的分离,但影响其原点位置。
影响因素有:①电场强度;②溶液pH;③离子强度;④电渗。
三、常用载体有琼脂和琼脂糖凝胶。
其特点是提高了敏感性及反应速度,并可将带电性不同的组分区分开。
第二节常用技术免疫电泳常用技术有:1.对流免疫电泳:对流免疫电泳原理是将双向扩散试验与电泳相结合的定向加速的免疫扩散技术。
在琼脂板上打两排孔,左侧各加入待测抗原,右侧孔内加入相应抗体,抗原在阴极侧,抗体在阳极侧。
通电后,在pH8.4缓冲液中带负电荷的蛋白质抗原泳向阳极抗体侧,而抗体借电渗作用流向阴极侧,在两者之间或抗体侧形成沉淀线。
本法敏感度比双向扩散试验高8~16倍。
7,第六章电泳

1 名词解释
电泳、不连续凝胶电泳
2 SDS-聚丙烯酰胺凝胶电泳原理。
3 采用电泳技术如何测定蛋白质分子量?如何测 定蛋白质等电点?
• 90年代又推出了分辨率极高的高效毛细管电泳。 多年来科学家们对电泳结果的分析做了大量的工 作,建立了各种实验方法,电泳后对分离物质可 以用染色、扫描、紫外吸收、放射自显影、生物 活性测定等方法进行分析,得到所需数据。
1.2 电泳速度 a)自由溶液中的电泳速度 静电引力: f=EZ 阻力: f '=6πrηv 当f=f '时,泳动速度为
分离特性 利用不连续电泳分离蛋白质,可改 变各种操作参数优化分离过程。例如, 调节pH值可改变荷电量Z,调节凝胶浓 度可改变迁移率,调节电压可改变电泳 速度等。因此,选择适当的操作条件, 可进行各种蛋白质的分离。
2.3 等电点聚焦
a)原理 一般的区带电泳利用溶质迁移率的差别进行 分离,而等电点聚焦(IEF)利用蛋白质和氨基酸 等两性电解质具有等电点,在等电点的pH下呈电 中性,不发生泳动的特点进行电泳分离。在电泳 设备中首先调配连续的pH梯度,然后使蛋白质在 电场作用下泳动到等于各自等电点的pH区域,从 而形成具有不同等电点的蛋白质区带。
3.2 等电பைடு நூலகம்聚焦
IEF的分离对象:蛋白质、两性分子 IEF操作的关键:是调配稳定的连续pH梯度, 一般采用氨基酸混合物或氨基聚合羧酸的缓冲 溶液调配pH梯度,前者的生物相容性好,但形 成的pH梯度稳定性较差;后者的聚合物含有许 多正负电荷,且与蛋白质的等电点范围相同, 缓冲能力强,pH梯度较为稳定,称为载体两性 电解质。 应用:分离、分析、pI测定
b)装置
线圈型装置:将Ampholine装入长软管中,并 将软管在水平方向上卷成线圈状,软管两 端加电压,使溶质发生电泳。电泳结束后, 剪断软管,回收分离软管中的组分。 柱式等电聚焦仪不使用密度梯度来稳定pH梯 度,而是将待分离样品和两性电解质混合 后,装入一长的塑料管中并在圆柱上绕上 螺旋,然后进行电泳操作。
第七章第六节
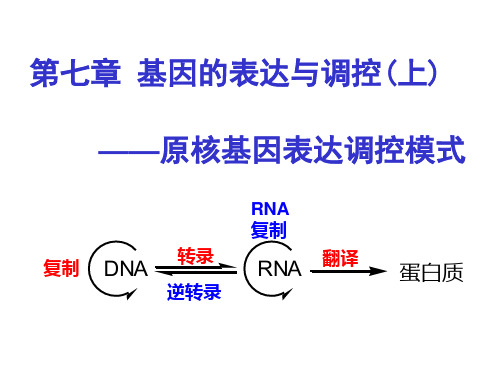
(B) 转录延长调节
(C) 转录激活调节
(D) 翻译水平调节
(E) 转录/翻译调节
(A) Lac阻遏蛋白 (B) RNA聚合酶
(C) 环一磷酸腺苷
(D) CAP-cAMP (E)异构乳糖 9、与O序列结合 A
10、与P序列结合 B 11、 与CAP结合 C 12、与CAP位点结合
D
13、乳糖、阿拉伯糖、色氨酸等小分子物质在
GTP+ATP→pppGpp+AMP→ppGpp ppGpp的主要作用可能是影响RNA聚合酶与启动子结合的专
一性,从而成为细胞内严紧控制的关键。当细胞缺乏氨基酸
时产生ppGpp,可在很大范围内做出应急反应,如抑制核糖 体和其他大分子的合成,活化某些氨基酸操纵子的转录表达, 抑制与氨基酸运转无关的转运系统,活化蛋白水解酶等。
3、简述Trp操纵子的调控机制。
名词解释: 操纵子、基因表达与基因调控、组成型表达与适应型表达、弱化 子(衰减子)、结构基因与调节基因
RNA(mRNA—interfering complementary RNA,
micRNA)。
☆ 基因调控不只是通过蛋白与核酸的相互作用而实 现
四、 反义RNA的调节作用
• 反义RNA主要通过以下三种方式调控翻译: • 1、反义RNA与mRNA上核糖体结合位点结合,使核糖体 脱落,使得翻译不能起始。 • 2、反义RNA可与目的基因的5 ’UTR或翻译起始区的 Shine-Dalgarno序列结合,使mRNA不能与核糖体有效 地结合,从而阻止蛋白质的合成。 • 3、反义RNA也可与mRNA结合,形成双螺旋结构,由于 所形成的双螺旋结构成为内切酶的特异底物,使与其 结合的RNA变得不稳定。
第六节
《基因工程》 第七章 重组子选择筛选与分析

第十八页,共四十四页。
③ 卡那霉素 (kanamycin, Kn或 Kan): 含Kan抗性基因菌体转译一种能修饰Kn的 酶,阻碍Kn对核糖体的干扰(gānrǎo)。 四环素(tetracymic, Tc或 Tet): 含Tc抗性基因的菌体转译一种能改变细菌膜的蛋白, 防止Tc 进入细胞后干扰细菌蛋白质的合成。
⑥ 链霉素(strentomycin, Sm或 Str): 含Str 抗性基因的菌体转译一种能修 饰Sm的酶,抑制Sm与核糖体结合。
第三页,共四十四页。
1.根据载体选择标记初步筛选转化子
载体DNA分子上通常携带了一定的选择遗传标记基因,可进行转化 子或重组子初步筛选。做法(zuòfǎ)是将转化处理后的菌液(包括对照处理) 适量涂布在选择培养基上,在最适生长温度条件下培养一定时间,观察 菌落生长情况,即可挑选出转化子。
对于受体细胞而言,通常用LB培养基,在LB 培养基中加入适量的某种 选择物,即为选择培养基。选择物是由载体DNA分子上携带的选择标记基因 所决定。
3) Immunological screening for expressed genes (Western blotting)
4) Analysis of cloned genes (Restriction mapping, DNA sequencing)
2
第二页,共四十四页。
第一节 转基因筛选(shāixuǎn)和选择的方法
(1)抗药性筛选法 (2)插入失活筛选法 (3)插入表达筛选法
第四页,共四十四页。
(1)抗药性筛选
这是利用载体DNA分子上的抗药性筛选标记进行筛选的方法。主要用于 重组质粒DNA分子的转化子筛选。重组质粒DNA分子携带特定的抗药性 选择标记基因,在含有相应选择药物的选择培养基上正常生长。 ① 氨苄青霉素(ampicillin,Ap 或Amp): 含bla基因的菌体能转译 -丙酰胺酶 (-lactarnase),可降解Ap。 ② 氯霉素 (chloramphenicol, Cm 或 Cmp): 含 cat基因的菌体能转译氯霉素乙酰 转酰酶 (chloramphenicol acetyltransferase),使Cm乙酰化而失效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钟青萍讲授
32
绘制标准曲线: 按下式计算相对迁移率:
蛋白样品距加样端迁移距离(cm) 相对迁移率 =
溴酚蓝区带中心距加样端距离(cm)
以每个蛋白标准的分子量对数对它的相对 迁移率作图得标准曲线,量出未知蛋白的 迁移率即可测出其分于量,这样的标难曲 线只对同一块凝胶上的样品的分子量测定 才具有可靠性。
• 由于聚丙烯酰胺凝胶电泳(PAGE)是多孔介 质,其孔径大小与生物大分子具有相似的数量 级,能主动参与生物分子的分离,具有分子筛 效应。
• PAGE可以用圆盘电泳、垂直电泳或水平电泳
17
钟青萍讲授
18
3
聚丙烯酰胺凝胶电泳中的分子筛效应
• 凝胶中的大分子分离取决于它的电荷、尺 寸和形状
• 凝胶的这种用于分离不同尺寸分子的特性 是由于它的尺寸筛分能力(size sieving capacity),这种现象被称为分子筛效应 (molecular sieving effect)
• 电泳转移装置:利用低电压,大电流的直 流电场,使凝胶电泳的分离区带或电泳斑 点转移到特定的膜上,如PVDF膜
• 电泳洗脱仪:回收样品
• 凝胶扫描和摄录装置:对电泳区带进行扫 描,从而给出定量的结果。
钟青萍讲授
13
钟青萍讲授
14
钟青萍讲授
15
钟青萍讲授
16
钟青萍讲授
Ⅰ常规聚丙烯酰胺凝胶电泳
原理:
• 在使用聚丙烯酰胺凝胶电泳进行蛋白质分离 时,在电泳过程中不仅取决于蛋白质的电荷密 度,还取决于蛋白质的尺寸和形状。
钟青萍讲授
26
PAGE的具体操作过程
• 制胶:确定凝胶配方(凝胶、引发剂、增速剂的浓 度和缓冲液),使用灌胶模具灌胶;
• 样品准备:选择合适的样品缓冲液、确定合适的样 品浓度(1~2mg/L,考染),加样(溴酚蓝);
• 电泳:4~6小时,待溴酚蓝前沿到达阳极底部;
• 检测:紫外扫描或染色(考马斯亮蓝R-250、银染 色—灵敏度比考染高100倍、荧光探针);
• 琼脂糖凝胶孔径较大,0.075%琼脂糖的孔径为 800nm,可以分析百万道尔顿分子量的大分 子,但分辨率较凝胶电泳低。
• 机械强度高:可以在浓度1%以下使用;
• 无毒; • 染色、脱色程序简单,背景色较低; • 热可逆性; • 生物中性:一般不与生物材料结合。
钟青萍讲授
10
电泳系统的基本组成
• 电泳槽:是凝胶电泳系统的核心部分,管式电泳 槽、垂直板电泳槽、水平板电泳槽
• 系统pH值:酸性条件、碱性条件均可,但仍然存在 一个最佳pH值,以获得最佳的聚合结果。
• 温度:低温下聚合导致凝胶变脆和混浊;适当提高 温度可以是凝胶透明而有弹性。
• 分子氧:分子氧存在会阻碍凝胶的化学聚合;抽气
• 系统纯度:金属离子会影响凝胶的聚合
钟青萍讲授
9
B.琼脂糖凝胶的性能、结构与特点
其优点如下:
钟青萍讲授
5
区带电泳的主要技术
• 区带电泳是在半固相或胶状介质上加一个点或 一薄层样品溶液,然后加电场,分子在支持介 质上或支持介质中迁移。
• 具有支持介质的区带电泳具有防止电泳过程中 的对流和扩散,可使被分离的成分得到最大分 辨率的分离
• 区带电泳中的常用技术 纸电泳、硝酸纤维素薄膜电泳、凝胶电泳
钟青萍讲授
31
未知蛋白质分子量的测定
• 基于SDS-PAGE的原理,可利用SDSPAGE进行未知蛋白质的分子量测定。
• 以不同分子量的标准蛋白进行SDS-PAGE 电泳得到不同标准蛋白的电泳迁移率,制 作标准校正曲线,然后对未知蛋白在相同 条件下进行SDS-PAGE电泳,测定相对迁 移率,从标准曲线得到相应的分子量。
钟青萍讲授
40
用于等电聚焦的主要载体两性电解质
• Ampholine ,Pharmalyte
• 瑞典LKB公司,瑞典Pharmacia 公司 ,上 海东风试剂厂等
• 不同的产品有不同的pH梯度范围
• 由许多脂肪族的多氨基多羧基的异构体和 同系物组成,它们具有连续改变的氨基与 羧基比
钟青萍讲授
41
pH梯度的形成
• 一般选择缓冲液的离子强度为0.01~0.1 mol/L之间
钟青萍讲授
23
凝胶浓度的选择
• 由于PAGE电泳分离不仅取决于蛋白质的电荷 密度,而且取决于分子的大小、形状。因此, 具有凝胶的分子筛效应(即凝胶的孔径与电泳 的分辨率、电泳速度密切相关) 。
• 凝胶浓度太大,孔径小于样品分子尺寸,电泳 时蛋白质分子不能进入凝胶,样品仍留在加样 位置。
• 电泳迁移率只与分子量有关。
钟青萍讲授
30
5
蛋白质样品用SDS处理后亚基的解聚 和分子形状的改变
形状近似于雪茄烟形状的长椭园棒,不同蛋白质的SDS复合物的短轴 长度都一样(约为18Å,即1.8nm),而长轴则随蛋白质分子量成正 比地变化。这样的SDS-蛋白质复合物,在凝胶电泳中的迁移率,不
再受蛋白质原有电荷和形状的影响,
• 蛋白质分子的解聚:
• SDS是一种阴离子去污剂,作为变性剂和助 溶性试剂,能断裂分子内和分子间的氢键, 使分子去折叠,破坏蛋白质分子的二级、三 级结构。
• 强还原剂,如二硫苏糖醇、β-巯基乙醇能使 半胱氨酸残基之间的二硫键断裂。
钟青萍讲授
29
SDS-PAGE 的原理
• 在样品和凝胶中加入SDS和还原剂后,蛋白质 分子被解聚为组成它们的多肽链,解聚后的氨 基酸侧链与SDS结合后,形成带负电的蛋白 质-SDS胶束,所带电荷远远超过了蛋白质原 有的电荷量,消除了不同分子间的电荷差异; 同时,蛋白质-SDS聚合体的形状也基本相 同,这就消除了分子形状对迁移率的影响。
• 照相、凝胶干燥:
• 定量测定:
钟青萍讲授
27
Ⅱ SDS 聚丙烯酰胺凝胶电泳
• 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳 (SDS-PAGE)
• 主要用于测定蛋白质亚基分子量以及未知 蛋白质分子量的测定。
• 特点:设备简单、操作简便、测定快速、 重复性高、样品无需纯化。
钟青萍讲授
28
SDS-PAGE 的原理
钟青萍讲授
21
缓冲系统的选择原则
• 通常选择pH 8.0~9.5的缓冲液,常用的缓 冲液有:
• Tris-甘氨酸(pH 8.3~9.5) • Tris-硼酸(pH 8.3~9.3) • Tris-醋酸(pH 7.2~8.5)
钟青萍讲授
22
缓冲系统的离子强度的选择
• 离子强度不宜过高,此时电泳速度快; 但也不可过低,必须具有一定的缓冲能 力,过低的离子强度容易导致蛋白质絮 凝。
• 利用等电聚焦技术分离、分析的对象仅限 于蛋白质和两性分子。
钟青萍讲授
36
6
工作原理
• 蛋白质的等电点 蛋白质最主要的特性是它的带电行为,它们在不 同的pH环境中带不同数量的正电或负电,只是 在某一pH时,蛋白质的净电荷为0,此pH即为 该蛋白的等电点(isoelectric point pI)。
钟青萍讲授
34
样品活性恢复方法
• 在凝胶中恢复活性: 只有单体蛋白、有相同亚基组成的蛋白 才能够使用这种恢复方式;异丙醇、醋 酸、水(5/2/13)去除SDS,然后以缓 冲清洗;
• 洗脱后,在自由溶液中恢复活性: 透析袋
钟青萍讲授
35
Ⅲ 等电聚焦电泳
• 等电聚焦(isoelectrofocusing), IEF: 利用蛋白质分子或其它两性分子的等电点 不同,在一个稳定的、连续的、线性的pH 梯度中进行蛋白质的分离和分析。
• 凝胶浓度太小,孔径太大,样品中各种蛋白质 分子均随缓冲液推进,不能得到很好的分离。
钟青萍讲授
24
4
凝胶浓度与分子量大小的关系
凝胶浓度 (C=2.6%)
5 10 15 20
分子量范围 (kDa)
30~200 15~100 10~50
2~15
凝胶浓度 (C=5%)
5 10 15 20
分子量范围 (kDa)
• 当引入电场时,载体两性电解质分子将 向阴极或阳极迁移,带有最低等电点的 分子(带最多负电)将最快地向阳极移 动;当它达到净电荷为0的位置时才停 止,这个位置靠近阳极,由于它具有高 的缓冲能力,使环境溶液的pH等于分子 本身的pI。
钟青萍讲授
42
7
• pI稍大一些的低pI的载体两性电解质(带 其次多的负电)也向阳极移动,直到它的 净电荷减少到0才停止。同样的,其周围 环境溶液pH值也等于它本身的pI。
• 带电粒子在电场中的迁移方式主要依据 分子尺寸大小和形状、分子所带电荷等 特性。
钟青萍讲授
3
钟青萍讲授
4
电泳迁移率
• 电泳迁移率(mobilit源自):在电位强度E的 影响下,带电颗粒在时间t中的迁移距离 (单位电场强度下的泳动速度)。
m= d t⋅E
• 其单位是cm2·sec-1 ·V-1
• 电泳迁移率的不同提供了从混合物中分离 不同物质的基础
钟青萍讲授
19
分子筛效应
+
A
B
-
C
图中A,B,C均为阳离子,在直流电场作用下电泳示意图
分子量大小依次为MA=MB>MC,所带电荷量相同 QA=QB=QC。
钟青萍讲授
20
电泳前的准备工作
• 缓冲系统的选择: (1)保证蛋白质的溶解性能、稳定性以及
生物活性的保持;
(2)从理论上讲PAGE可以在任何pH进 行,但实际上过酸或过碱的条件下将发生 某种水解,因此,pH应限制在3~10之 间。
60~700 22~280 10~200 5~150
钟青萍讲授
25
凝胶浓度的选择
