溶解度专题
溶解度计算专题练习001A及答案

溶解度计算专题练习001(A卷)(总分:100.0 考试时间:107分钟)学校________________________ 班级_______________ 准考证号________________ 姓名___________ 得分_____一、选择题一(只有一个正确答案):本大题共8小题,从第1小题到第8小题每题1.0分小计8.0分;共计8.0分。
1、影响硝酸钾溶解度大小的因素是[ ]A.溶质的质量B.溶剂的体积C.溶剂的温度D.溶液的压强2、当打开汽水瓶盖时,就有气体冒出,此时有关的下列说法中不正确的是[ ] A.溶液的溶质的量减少B.溶液的溶质的量不变C.溶解度减少D.饱和溶液变为不饱和溶液3、t3时,将A、B、C三种固体物质分别溶于100g水中,刚好都制成了饱和溶液(它们均不与水反应),它们的溶解度随温度而变化的曲线如图所示,以下说法正确的是[ ]A.t3时,A溶液的质量分数最小B.t2时,A、C两种溶液的质量分数相等C.t1时,三种溶液的质量分数相等D.C溶液的质量分数最小4、将某温度下接近饱和的溶液变为饱和溶液,下列的方法中正确的一组是[ ]①降低温度②长高温度③温度不变时加入晶体④温度不变时加适量的水⑤蒸发一定量水,再恢复到原温度A.①②③B.②④⑤C.①③⑤D.①③④5、实验室电解水时,常在水中加入少量硫酸以增强水的导电性.若用9%的硫酸50g通直流电进行电解水,过一段时间后,溶液中溶质硫酸的质量分数变为10%,则被电解的水的质量为[ ] A.10g B.7gC.5g D.3g6、下列叙述正确的是[ ] A.在饱和溶液中再加入任何物质都不可能溶解B.不改变溶剂的量,饱和溶液不可能变成不饱和溶液C.某种溶液可以是稀溶液,但同时又可以是饱和溶液D.浓溶液中溶解的溶质多,这时的溶液肯定是饱和溶液7、实验室里用已知溶质的质量分数的浓盐酸(密度已知),配制一定溶质的质量分数的稀盐酸。
初中化学溶解度简答题专题训练含答案

初中化学溶解度简答题专题训练含答案姓名:__________ 班级:__________考号:__________一、简答题(共15题)1、从微观角度说明为什么在溶液中进行的化学反应比较快?并举例说明这一道理在实验室或日常生活中的应用.2、试用三种不同的方法将不饱和石灰水变为饱和石灰水.3、厨房有两瓶白色固体分别为食盐和蔗糖,请你选择合适的方法加以区分.4、化学与生活密切相关.(1)夏天天气炎热时,鱼塘里的鱼为什么总是接近水面游动?(2)废弃塑料的急剧增加会带来“白色污染”,请你为解决“白色污染”问题提出一条合理化建议.(3)有些胃药中含有氢氧化镁,它起什么作用?5、汽水中溶有较多的二氧化碳,称为碳酸饮料.(1)打开汽水瓶盖时,汽水泡沫会自动喷出,请解释其中的原因.(2)喝了汽水后,常常会打嗝,请解释其中的原因.6、目前市场上销售的汽水饮料大多数是碳酸饮料,其中溶有二氧化碳气体.打开汽水瓶盖时,汽水会自动喷出来.原因是什么?喝了汽水后,常常会打嗝.原因是什么?7、 19.下表列出了硝酸钾在不同温度下的溶解度。
(1)从上表你可以得到什么信息(写一条即可)?(2)20℃时,欲使一定量的硝酸钾不饱和溶液变为饱和溶液,可采取哪两种措施?8、小华用热水配制了大半烧杯硝酸钾的饱和溶液,让一个较大的塑料块浮在液面上,然后小华让溶液冷却至室温(已知溶液的温度约为60℃,室温为20℃)。
请你说出小华会看到的两个现象,并用学过的理化知识解释。
9、家庭饲养金鱼,常常向鱼缸里通入空气,目的是____________________,天气闷热时,鱼塘里的鱼会接近水面游动的原因是______________________________。
10、汽水中溶有较多的二氧化碳,称为碳酸饮料.(1)打开汽水瓶盖时,汽水泡沫会自动喷出,请解释其中的原因.(2)喝了汽水后,常常会打嗝,请解释其中的原因.11、若将少量生石灰加入到某氢氧化钙的饱和溶液中,保持温度不变,所得溶液的质量和溶质的质量分数与原溶液相比会有变化吗?(有变化的需要指出是变大还是变小)12、把20℃的282g硝酸钾饱和溶液加热,升温到60℃,需要加入多少克硝酸钾才能使溶液重新达到饱和?(已知20℃时硝酸钾的溶解度为31.6g,60℃时为110g)。
溶解度48题专题练习
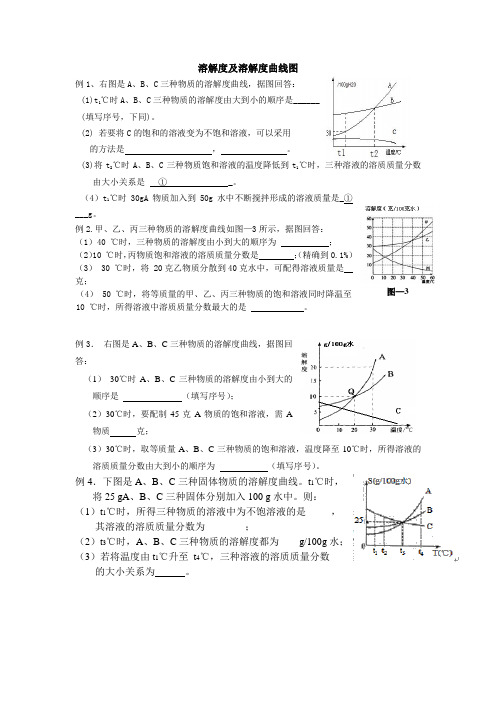
溶解度及溶解度曲线图例1、右图是A 、B 、C 三种物质的溶解度曲线,据图回答: (1)t 1℃时A 、B 、C 三种物质的溶解度由大到小的顺序是______ (填写序号,下同)。
(2) 若要将C 的饱和的溶液变为不饱和溶液,可以采用 的方法是 , 。
(3)将t 2℃时A 、B 、C 三种物质饱和溶液的温度降低到t 1℃时,三种溶液的溶质质量分数由大小关系是 ① _。
(4)t 1℃时30gA 物质加入到50g 水中不断搅拌形成的溶液质量是_①___g 。
例2.甲、乙、丙三种物质的溶解度曲线如图—3所示,据图回答: (1)40 ℃时,三种物质的溶解度由小到大的顺序为 ; (2)10 ℃时,丙物质饱和溶液的溶质质量分数是 ;(精确到0.1%) (3) 30 ℃时,将 20克乙物质分散到40克水中,可配得溶液质量是 克;(4) 50 ℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10 ℃时,所得溶液中溶质质量分数最大的是 。
例3. 右图是A 、B 、C 三种物质的溶解度曲线,据图回答:(1) 30℃时A 、B 、C 三种物质的溶解度由小到大的顺序是 (填写序号);(2)30℃时,要配制45克A 物质的饱和溶液,需A 物质 克;(3)30℃时,取等质量A 、B 、C 三种物质的饱和溶液,温度降至10℃时,所得溶液的溶质质量分数由大到小的顺序为 (填写序号)。
例4.下图是A 、B 、C 三种固体物质的溶解度曲线。
t 1℃时, 将25 gA 、B 、C 三种固体分别加入100 g 水中。
则: (1)t 1℃时,所得三种物质的溶液中为不饱溶液的是_____, 其溶液的溶质质量分数为________;(2)t 3℃时,A 、B 、C 三种物质的溶解度都为____g/100g 水; (3)若将温度由t 1℃升至 t 4℃,三种溶液的溶质质量分数的大小关系为 。
图—3溶解度及溶解度曲线图(专题一) 2011-4-281、右图是A 、B 、C 三种物质的溶解度曲线,据图回答: (1)t 1℃时A 、B 、C 三种物质的溶解度由大到小的顺序是______ (填写序号,下同)。
溶解度计算专题练习(含答案)

#溶解度计算专题练习3(含答案)基础练习1.食盐的溶解度是36g,这句话最主要的错误是未指明()A.100g水中B.是否达到饱和状态C.温度D.36g为最大量2.在一定温度时,某物质的饱和溶液中加入一些水后,溶质的溶解度()A.变小B.变大C.不变 D.不一定变<3.与固体溶解度无关的因素是()A.溶质和溶剂的量 B.溶液的温度C.溶质的性质 D.溶剂的性质4.当温度升高时,其溶解度降低的物质是()A.硝酸钾B.氯化钠 C.氢氧化钙 D.氧气5.溶解度曲线图可表示的意义是()①同一种物质在不同温度下的溶解度大小②不同种物质在同一温度时的不同溶解度数值<③物质溶解度受温度变化影响大小④比较某一温度下各种物质溶解度的大小A.全部B.①②C.①②③ D.①②④6.氯化钠溶解度曲线是()A.一条略为上升的曲线B.一条略为上升的直线C.一条陡峭上升的曲线D.一条略为下降的曲线7.在0℃,压强为101kPa时,1L水里最多能溶解5L气体A,则0℃时,A压强的溶解度为()A.5L B.5 C.500L D.<8.在20℃时,氧气的溶解度为,其含义是()A.20℃时,100g水中溶解氧气形成饱和溶液B.20℃时,1体积的水中最多溶解体积的氧气C.20℃时,压强为101kPa时,1体积水最多能溶解氧气D.20℃时,氧气压强为101kPa时,1体积水最多能溶解体积的氧气9.增大气体在水中的溶解度可采用的方法有:①增大压强;②减小压强;③升高温度;④降低温度,其中可行的是()A.①③B.②③C.①④ D.②④、10.已知硝酸钾的溶解度随着温度升高而增大,有下列方法:A.升高温度B.降低温度 C.加水 D.加硝酸钾(1)能使接近饱和的硝酸钾溶液变成饱和溶液的方法是________(填序号,下同);(2)能使饱和的硝酸钾溶液变成不饱和溶液的方法是________;(3)能增大硝酸钾溶解度的方法是________;(4)能减小硝酸钾溶解度的方法是________。
溶解度计算专题复习有答案

溶解度计算专题复习有答案溶解度计算题1. 已知一定温度下,饱和溶液中溶质的质量和溶剂的质量。
求该温度下的溶解度。
(1)把20℃时53.6克氯化钾饱和溶液蒸干,得到13.6克氯化钾。
求20℃时,氯化钾的溶解度? 溶解度为34克(2)20℃时,把4克氯化钠固体放入11克水中,恰好形成饱和溶液。
求20℃时,氯化钠的溶解度? 溶解度为36.4克2. 已知某温度时物质的溶解度,求此温度下饱和溶液中的溶质或溶剂的质量。
例如:把100克20℃时硝酸钾的饱和溶液蒸干,得到24克硝酸钾。
则:(1)若配制350克20℃的硝酸钾的饱和溶液,需硝酸钾和水各多少克?(2)若将78克硝酸钾配成20℃时的饱和溶液,需水多少克?x=84g y=266g z=247g【典型例题】[例1] 已知氯化铵在30℃时的溶解度为45.8克。
30℃时将68.7克氯化铵配制成400克的溶液,通过计算:(1)溶液是否饱和?(2)若不饱和,为了使其饱和,可用下面的方法:①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液?②加溶质法:需再加入多少克氯化铵,溶液才能成为饱和溶液?(1)是不饱和溶液。
(2)①181.3g ②83.0g[例2] t℃时,硝酸钠的溶解度是25g,现向盛有200g 10%硝酸钠溶液的烧杯中,加入30g 硝酸钠固体,则此时烧杯中( D )A. 溶液质量是230gB. 溶质质量是50gC. 溶剂质量是170gD. 溶质质量是45g [例3] 将两杯20℃时的食盐饱和溶液,甲为500g,乙为1000g,在温度不变的情况下分别蒸发掉15g水,析出的食盐晶体的质量( A )A. 甲=乙B. 甲<乙C. 甲>乙D. 无法判断[例4] 现有500g20℃的A物质溶液,若保持温度不变,蒸发掉20g水后,有5gA 析出,若再蒸发掉20g水后,又有7gA 析出,则在20℃时A物质的溶解度是__35g_。
[例5] t℃,将一定量A(不含结晶水)的不饱和溶液分成三等份,分别加热蒸发水,然后冷却至t℃,已知三份溶液分别蒸发水10g、20g、30g,析出A依次为ag、bg、cg,则a、b、c三者之间的关系是( B )A. c=a+bB. c=2b-aC. c=2a+bD. c=2a-b[例6] 20℃时,将一定质量的硝酸铵完全溶解于100g水中,将所得溶液分成两等份,其中一份蒸发18.75g水,可使溶液饱和,另一份加入36g 硝酸铵也达饱和,求⑴20℃时,硝酸铵的溶解度。
2023年中考真题专题溶解度

中考真题专题汇编——溶解度1.(深圳)下图是甲、乙两种固体物质(不含结晶水)旳溶解度曲线。
下列说法对旳旳是(C)A、甲旳溶解度不小于乙旳溶解度B、a1℃时,甲、乙饱和溶液旳温度升温至a2℃时,均有固体析出C、a2℃时,M点对应旳甲溶液不饱和D、a2℃时,乙饱和溶液旳质量分数为20%2.(随州)如图,是甲、乙两种固体物质旳溶解度曲线,下列说法对旳旳是( D )A. 20℃时,甲、乙两种固体物质旳溶解度都是30B. 40℃时,甲旳饱和溶液中溶质质量分数为50%C. 40℃时,将50g乙物质所有溶于水中,恰好能得到150g乙旳饱和溶液D.将130g 20℃甲旳饱和溶液升温到40℃,最多还能溶解甲物质20g3.(孝感)甲、乙两种固体物质(均不含结晶水)旳溶解度曲线如右图所示。
下列说法对旳旳是(B)A. t1℃时,甲旳溶解度不小于乙旳溶解度B.t2℃时,乙旳饱和溶液升温或降温均会析出晶体C.乙溶液从t3℃降温到t1℃,乙溶液中旳溶质质量分数会发生变化D. t3℃时,50g水中加入40g旳甲物质充足溶解可得到90g甲旳饱和溶液4.(苏州)氯化钠和硝酸钾两种固体旳溶解度曲线如右图所示。
下列说法对旳旳是(C)A.硝酸钾旳溶解度不小于氯化钠旳溶解度B.常用冷却结晶旳措施从氯化钠溶液中获得其晶体C.40℃时,将35 g硝酸钾晶体放入50 g水中,充足搅拌后,所得溶液旳溶质质量分数为39.0%D.将20℃旳硝酸钾饱和溶液升温至60℃,溶液旳溶质质量分数增大(忽视水分蒸发)5.(宿迁)右图是甲、乙、丙三种固体物质(均不含结晶水)旳溶解度曲线,下列说法对旳旳是(C)A.t1℃时,甲与丙两种物质旳饱和溶液中溶质质量相似B. 乙中混有少许甲时,应采用降温结晶旳措施提纯乙C.甲属于易溶物质D.t2℃时,30g甲能溶解于50g水中形成80g溶液6.(临沂)甲、乙两种固体物质旳溶解度曲线如右图所示。
下列说法对旳旳是( D )A. 20℃时,甲溶液中溶质旳质量分数一定比乙溶液旳大B.将40℃时甲旳一定量饱和溶液降温至20℃,溶液质量不变C.甲旳溶解度不小于乙旳溶解度D. 40℃时,分别在100g水中各加入30g甲、乙,同步降温至20℃,甲、乙溶液均为饱和溶液7.(泰安)量旳硝酸钾和氣化钾分别加入到各盛有100g水旳两个烧杯中,充足搅拌后现象如图1所示,硝酸钾和氣化钾旳瑢解度曲线如图2所示。
初中化学溶解度计算题专题训练含答案

初中化学溶解度计算题专题训练含答案姓名:__________ 班级:__________考号:__________一、计算题(共10题)1、将 80g 质量分数为 20% 的氯化钠溶液稀释成质量分数为 10% 的氯化钠溶液,需加水的质量为 _______ 。
2、把20℃时53.6克氯化钾饱和溶液蒸干,得到13.6克氯化钾。
求20℃时,氯化钾的溶解度?3、20℃时,把4克氯化钠固体放入11克水中,恰好形成饱和溶液。
求20℃时,氯化钠的溶解度?4、已知硝酸钾在不同温度下的溶解度入下表:现有20℃时硝酸钾饱和溶液100g,若将其升温至60℃,还需加入多少克硝酸钾才能饱和?若降温至10℃,可得饱和溶液多少克?5、已知15℃时碘化钾的溶解度为140g,计算在该温度下250g水中最多能溶解多少克碘化钾?6、有60℃时A物质的溶液100g,若温度不变,蒸发掉10g水时,有4gA的晶体析出(不含结晶水),再蒸发掉10g水时,又有6gA的晶体析出,求60℃时A物质的溶解度是多少克。
7、已知30℃时硝酸钾的溶解度为45.8g。
在这温度时,某硝酸钾溶液500g中溶有硝酸钾137.4g。
如果蒸发掉90g水后,再冷却到30℃,可析出多少克硝酸钾?8、在20℃时某物质的不饱和溶液50g,平均分成两等份。
一份中加入0.7g该物质,另一份蒸发掉5g水,结果两份溶液都达饱和。
那么该物质在此温度下的溶解度为多少克?9、一定温度下质量分数为a%的硝酸钾溶液,将其分成两份,一份等温蒸发10g水,的溶解度为多少?得0.5g晶体;另一份等温蒸发12.5g水得1.5g晶体,该温度下KNO310、黄铜是铜和锌的合金。
向一定质量的黄铜样品中加入154.7g稀硫酸,恰好完全反应,产生0.2g氢气。
(1)求所用稀硫酸的溶质质量分数(2)除了可求出稀硫酸的溶质质量分数外,你还能求出的化学量有。
(填序号)①锌的质量②铜的质量分数③锌的质量分数④硫酸锌的质量⑤硫酸溶液的体积⑥反应后溶液溶质质量分数============参考答案============一、计算题1、解:需要加入水的质量为x80g×20%= ( 80g+ x )×10%x =80g答:需要加入水的质量为 80g 。
中考化学溶解度专题复习

1、下表是KNO 3、NaCl在不同温度下的溶解度(单位:g/100g水)温度0102030405060708090100(℃)KNO313.320.93245.86485.5110138169202246 NaCl35.735.83636.336.63737.337.838.43939.8①以上两种物质溶解度的变化受温度影响较大的是________。
②30℃时,KNO3的溶解度是___________。
③KNO3溶液中含有少量NaCl时,可通过____________的方法提纯。
④对③析出的晶体和剩余溶液描述正确的是________(填写编号)。
Ⅰ.剩余溶液一定是KNO3饱和溶液Ⅱ.剩余溶液一定是NaCl不饱和溶液Ⅲ.上述方法可以将两者完全分离Ⅳ.析出的晶体中只含有KNO3⑤在一定温度下,将含69gKNO3、18gNaCl的混合物完全溶解在50g水中。
改变温度使KNO3析出,NaCl不析出,则温度T(℃)的范围是_____________(硝酸钾和氯化钠溶解度互不影响)。
2、溶解度可表示物质溶解性的大小。
①右下图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
Ⅰ.20℃时,甲的溶解度________(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙________(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。
请填写下表。
烧杯中的溶质烧杯中固体的变化甲_____________________________乙固体逐渐减少至全部溶解丙_____________________________②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡。
由此可见,压强越小,CO2的溶解度越_________。
为增大CO2的溶解度,可采用的一种方法是________。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如右图所示,图中t1对应的温度为40℃,则t2对应的温度________(填编号)。
2024年中考化学二轮专题复习:溶解度相关计算

2024年中考化学二轮专题复习:溶解度相关计算一、选择题1.线上学习,居家实验。
小明查阅资料后,利用食盐、纯碱等进行溶液相关实验的探究,不考虑食盐中除氯化钠外其它物质的影响,他的做法或思考正确的是A.食盐的溶解度大于纯碱B.25℃时,将纯碱加入适量水中至不再溶解,此时溶质的质量分数为30%C.纯碱的饱和溶液从25℃升温到50℃,先无晶体析出,后有晶体析出D.含有食盐的饱和纯碱溶液,降温后析出晶体,可用白醋区分晶体中有无碳酸钠2.甲、乙两种物质的溶解度曲线如图所示。
下列说法正确的是A.甲的溶解度大于乙的溶解度B.40℃时,38g乙溶于50g水中,得到88g的溶液C.T℃时等质量甲、乙两种饱和溶液中含有等质量的溶质D.80℃甲、乙饱和溶液降温至20℃,甲析出的晶体多于乙3.X、Y的溶解度曲线如图所示,下列说法正确的是A.t2℃时,Y的溶解度比X的溶解度大B.t1℃时,X、Y两种饱和溶液的溶质质量分数都是20%C.升高温度,Y的饱和溶液有溶质析出D.t2℃时,若X、Y的饱和溶液质量相等,则溶液中溶质的质量X>Y4.我国航天员王亚平在太空演示“冰雪”实验中,过饱和醋酸钠溶液形成的“液球”在接触绳子的一端后瞬间变成温热的“冰球”。
如图是醋酸钠的溶解度曲线,下列说法正确的是A.过饱和醋酸钠溶液结晶过程吸收热量B.图中P点所表示的醋酸钠溶液是不饱和溶液C.40℃时,饱和醋酸钠溶液的溶质质量分数是65.6%D.将A点的醋酸钠饱和溶液降温至20℃,溶质的质量分数增大5.如图是醋酸钠的溶解度曲线,下列说法正确的是A.40℃时,醋酸钠的溶解度为65.6B.将A点的饱和溶液升温至60℃,没有晶体析出C.40℃时,饱和醋酸钠溶液的溶质质量分数是65.6%D.0℃时,100g饱和醋酸钠溶液的中含有溶质为36.2g6.KNO3、KCl可用作钾肥,对大豆的生长具有重要的作用。
KNO3、KCl的溶解度随温度变化的曲线如图所示,下列有关说法正确的是A.a点表示在18℃时,KCl和KNO3的溶解度相同B.在70℃时,将238gKNO3的饱和溶液降温至40℃,析出74gKNO3C.d点对应的KNO3溶液为饱和溶液D.e点对应的KCl饱和溶液中溶质的质量分数为40%7.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是()A.A点表示20℃时甲、乙溶解度相等B.甲中混有少量乙,可用冷却热饱和溶液的方法提纯甲C.30℃时,45g甲物质完全溶解到100g水中得到145g溶液D.10℃时甲、丙的饱和溶液升温至30℃,其溶质质量分数均不变8.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是A.T1℃时,加水可使乙溶液从M 点状态变为N 点状态B.T2℃时,甲和丙的饱和溶液中溶质质量分数相等C.T3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为80gD.将T3℃时100g丙的饱和溶液降温至T1℃,应再加入15g 丙才能恰好达到饱和状态9.如图是a、b、c三种物质的溶解度曲线,下列说法错误的是A.在t1℃时,a、c两物质溶解度相同B.a物质的溶解度随温度升高而增大C.a、b和c这三种物质的溶解度大小为a>b>cD.t2℃时,将50克a物质加入100克水中充分溶解后,所得溶液的质量是140g 10.下列说法正确的是A.将100gKCl饱和溶液蒸干得到25g固体,则KCl在该温度下的溶解度为25gB.升高温度溶液中可能析出溶质C.所有的溶液都具有均一、稳定性,且是无色透明的D.洗洁精、汽油均能洗去油污,二者去油污原理相同11.A、B、C三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是()A.t2℃时,A、B两种溶液中溶质的质量分数相同B.t1℃时,三种物质的溶解度从大到小关系:B>C>AC.t1℃时,30g固体A放入50g水中充分溶解,形成饱和溶液65gD.要从B溶液中得到B固体,通常采用蒸发溶剂的方法12.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是A.t1℃时,甲、乙两物质的溶解度大小关系:甲>乙B.t2℃时,等质量的甲、乙溶液中,溶质的质量一定相等C.将t3℃时甲、乙溶液降温至t1℃,一定可以得到甲、乙的饱和溶液D.t3℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法二、填空与简答13.如图甲是a、b、c三种固体物质的溶解度曲线图。
2024年中考化学专题训练——溶解度

2024年中考化学专题训练——溶解度一、选择题1.要将饱和的KNO3溶液变成不饱和溶液,下列措施中不正确的是A.加水B.升高温度C.与另一不饱和KNO3溶液混合D.加KNO3晶体2.要使二氧化碳气体大量溶解在水里,可以采用的方法是A.降温加压B.升温加压C.降温减压D.升温减压3.不能影响物质溶解度大小的因素为A.温度高低B.溶质、溶剂的量C.溶剂种类D.溶质种类4.下列叙述正确的是A.在饱和溶液中再加入任何物质都不可能溶解B.只有增加溶剂的质量,饱和溶液才可能变成不饱和溶液C.某种溶液可以是稀溶液,但同时又是饱和溶液D.浓溶液一定是饱和溶液5.利用海水晒盐的原理是A.海水受热分解B.升高温度,降低氯化钠在水中的溶解度C.温度升高,使食盐的溶解度增大D.利用阳光和风蒸发水分,使氯化钠成晶体析出6.a、b、c、d四只烧杯中分别盛有10℃、T1℃、T2℃、T3℃不同温度的水各100g,分别向其中加入50g硝酸钾,充分溶解后的情况如下图所示,下列有关判断正确的是A.T1℃<T2℃<T3℃B.T2℃时,硝酸钾的溶解度为50g/100g水C.a、b、c三只烧杯中的溶液都是饱和溶液D.四只烧杯中溶液的溶质质量分数大小关系为:a<b<c=d7.某同学自制汽水(如下图)并记录了心得,下列记录正确的是A.℃中溶质和溶液质量比为1:50B.℃中溶液为碳酸氢钠的不饱和溶液C.℃摇匀放入冰箱后气泡增多D.℃摇匀放入冰箱后有碳酸氢钠析出8.如图为KC1和Na2CO3的溶解度曲线,下列说法错误的是A.T2℃时,Na2CO3饱和溶液质量分数为49.0%B.将两物质的饱和溶液由T1℃升温至T4℃,均无固体析出C.T4℃时,分别将等质量的KC1和Na2CO3溶于水配成饱和溶液,所得溶液的质量前者小于后者D.若KCl溶液中含有少量Na2CO3,可采取蒸发浓缩控制温度T3℃以上降温结晶、过滤等操作提纯9.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是A.甲、乙物质是易溶物质B.t1℃时,甲和丙的饱和溶液中所含溶质质量相等C.将接近饱和的丙溶液变成该温度下的饱和溶液,可采用加入丙物质的方法D.若将t2℃时三种物质等质量的饱和溶液分别降温到t1℃,则析出晶体质量关系是甲>乙>丙10.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是A.NaCl的溶解度一定大于KNO3B.NaCl的溶解度受温度影响的程度比KNO3大C.40℃时,100gKNO3饱和溶液中含有63.9gKNO3D.将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g二、实验题11.下表为硝酸钾和氯化钠的部分溶解度数据,某同学进行了如图的溶解实验。
专题5溶解度及溶解度曲线(课件)-2023年中考化学新课标一轮复习

36 × 64
A.该溶液是饱和溶液
64g水中最多溶解NaCl:
= 23.04g
100
B.溶液中Na+和Cl-个数一定相等 得到饱和溶液的质量:
C.溶液质量为100克
64+23.04=87.04(g)
溶质、溶剂的质量比:36∶100 = 9∶25
D.溶质与溶剂质量比为 9∶25
考点突破
6.我国古代提纯焰硝(含KNO3和少量NaCl、CaCl2等)工艺的主要过程示意如图所示。
专题5
溶解度及溶NE
溶解度
溶液的浓度
1、溶液的浓度常用溶质的 质量分数
来表示,即溶质的质量与溶液的质量
比。
溶质质量
(1)溶质质量分数(%)=
×100%
溶液质量
溶剂质量
注意: ① 溶液质量 = 溶质质量
+
;
② 溶质的质量是指已经溶解在水中的那一部分溶质的质量。
溶解度
③ 饱和溶液中溶质质量分数(%)=
,
(3)由图可知,a、b两物质的溶解度受温度影响
较大的是 a 。
考点突破:比较溶解度大小,一定要指明温度。
考点突破
2.(1)1 ℃时,100g水中最多溶解 20
g物
质c恰好形成饱和溶液;
(2)2 ℃时,向50g水中加入30g物质a,充
分溶解后,得到的溶液是 饱和
(填“饱和”
或“不饱和”)溶液,此时溶液的质量为 g。
硝酸钾 ;、氯化铵等
; 氯化钠
。氢氧化钙
气体的溶解度
减小
减小
结晶
不大
较大
考点突破
1.室温时,向25g某固体中分批次加人水,充分搅拌,结果如图所示(保持温
初三化学溶解度专题复习题(含答案)汇总

溶解度专题复习一、溶液的形成1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液(2)溶液的基本特征:均一性、稳定性注意:a、溶液不一定无色,如CuSO4溶液为蓝色FeSO4溶液为浅绿色Fe2(SO4)3溶液为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量= 溶质的质量+ 溶剂的质量溶液的体积<溶质的体积+ 溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)2、溶质和溶剂的判断(1)固体、气体溶于液体时,固体、气体是溶剂;(2)两种液体相溶时,量多的是溶剂,量少的是溶质。
(3)溶液中若有水存在,无论水的量多还是量少,水都是溶剂。
(4)在不指明溶剂时,溶剂一般是水。
3、饱和溶液、不饱和溶液(1)概念:饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下、一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
(2)判断方法:要确定某一溶液是否饱和,只要看在一定温度下有没有不能继续溶解的剩余溶质存在,如有,且溶质的质量不再减少,则为该溶质的饱和溶液;否则为该溶质不饱和溶液。
(3注:①Ca(OH)2②最可靠的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如NH4NO3溶解溶解放热:如NaOH溶解、浓H2SO4溶解溶解没有明显热现象:如NaCl 二、溶解度1、固体的溶解度(1)溶解度的定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:溶解度的单位:克(2)溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度升高而升高;如KNO3少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度升高而降低。
初中化学溶解度综合题专题训练含答案

初中化学溶解度综合题专题训练含答案姓名:__________ 班级:__________考号:__________一、综合题(共3题)1、溶液与人类生产、生活密切相关。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①时,A、B、C三种物质的溶解度由大到小的顺序是_____。
②A、B、C三种物质中,溶解度随温度升高而减小的是_____。
③时,完全溶解ag A物质最少需要水的质量是_____ g。
④时,相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量_____B的饱和溶液中所含水的质量(填“大于”、“等于”或“小于”)(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、玻璃棒、_____和滤纸。
(3)在实验室中,配制溶质质量分数为的氯化钠溶液45g,需要氯化钠固体的质量是_____g。
将的氯化钠济配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是_____g。
2、我国古代纺织业常将草木灰(主要成分K2CO3)和生石灰在水中混合,用上层清液漂白织物。
(资料)①K2CO3+ Ca(OH)2= CaCO3↓ + 2KOH②Ca(OH)2、K2CO3和 KOH 的部分溶解度如下表:温度/℃0 10 20 30 50溶解度/g Ca(OH)20.18 0.17 0.16 0.15 0.14K2CO3107 109 110 114 121 KOH 97 103 112 126 140(1)20℃时,100 g 水中最多可溶解 K2CO3的质量是__________g,溶质的质量分数为 50% 的KOH 溶液属于 ___________溶液(填“饱和”或“不饱和”)。
(2)某温度时,向一定量的饱和氢氧化钙溶液中加入少量生石灰,恢复到原温度,某些量随时间变化的关系如图所示。
则纵坐标可能表示的是____________(填序号)a溶质的质量 b溶质的质量分数 c 氢氧化钙的溶解度 d溶剂的质量 e溶液的质量(3)20℃时,将 1.38 g K2CO3固体放入 100 g 水中,并加入一定量的氢氧化钙,搅拌使其充分反应,恢复到原温度,过滤,得到质量为 1.5 g 的固体。
初中化学溶解度选择题专题训练含答案

初中化学溶解度选择题专题训练含答案姓名:__________ 班级:__________考号:__________一、选择题(共20题)1、在“ 粗盐中难溶性杂质的去除” 实验中,下列实验步骤的正确顺序是A .①②③B .②①③C .③②①D .②③①2、20 ℃ 时,取甲、乙、丙、丁四种纯净物各20 g ,分别加入到四个各盛有50 g 水的烧杯中,充分溶解,其溶解情况如下表:物质甲乙丙丁未溶解固体的质量4.2 2 0 9.2/g下列说法正确的是A .所得四杯溶液都是饱和溶液B .丁溶液的溶质质量分数最大C .20 ℃时四种物质溶解度的关系为:丙>乙>甲>丁D .四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液3、下列关于氯化钠溶解度的说法正确的是A . 100g 水中溶解 30gNaCl 达到饱和状态,则 NaCl 的溶解度为 30gB .20 ℃ 时,可把 30gNaCl 溶解在 100 g 水中,所以20℃ 时, NaCl 的溶解度为 30gC .20 ℃ 时,把 30gNaCl 溶解在水里制成饱和溶液,所以20 ℃ 时, NaCl 的溶解度为30gD .20 ℃ 时, 100g 水中溶解 36gNaCl 恰好达到饱和,则20 ℃ 时 NaCl 的溶解度为 36g4、下列有关粗盐提纯实验中的相关装置和操作,正确的是A .溶解粗盐B .过滤食盐水C .蒸发食盐水D .冷却蒸发皿5、若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验()A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁6、气体的溶解度与气体性质、溶剂有关,还与外界条件有关。
“打开汽水瓶盖,汽水会自动喷出来”这种现象与下列外界条件存在主要关系的是( )A.压强B.温度C.汽水瓶D.光照7、下列说法不正确的是( )A.硝酸铵固体溶于水是吸热过程B.乙醇与水混合可形成溶液C.饱和溶液的质量分数一定大于不饱和溶液的质量分数D.氯化钠溶液能够导电是因为溶液中存在自由移动的离子8、打开汽水瓶盖会有大量气泡冒出,产生这一现象的原因是二氧化碳的溶解度随()A.压强增大而减小 B.压强减小而减小C.温度升高而升高 D.温度降低而减小9、打开啤酒瓶盖时,你会发现啤酒会自动喷出,喝了啤酒后又常常会打嗝,这说明气体溶解性与外界的压强和温度有关,下列关于气体溶解度说法不正确的是A、压强减少,气体溶解度增大B、压强减小,气体溶解度减小C、温度升高,气体溶解度减小D、温度降低,气体溶解度增大10、调味剂是重要的食品添加剂,将下列调味剂加入水中,不能形成溶液的是()A.食盐 B.蔗糖 C.味精 D.芝麻油11、将适量的下列物质溶解于水的过程中,会使溶液的温度显著降低的是()A、浓硫酸B、硝酸铵C、火碱D、蔗糖12、20 ℃时,50 g水中溶解了A物质5.5 g恰好达到饱和,则A物质属于( )。
专题溶解度(高三化学复习人教版)

专题5 溶解度一、溶解度的概念1.固体的溶解度:在一定温度下,某物质在100g 溶剂里达到饱和状态时所溶解的克数。
(1)公式:S=溶剂的质量溶质的质量×100 (克) (2)影响因素:大多数固体的溶解度随温度的升高而增大,如硝酸钾;只有少数物质的溶解度受温度影响很小,如氯化钠;有极少数物质的溶解度随温度升高而减小,如消石灰。
2.气体的溶解度:在一定温度,1.01×105Pa 下,1体积的水里达饱和时,所溶解的气体的体积数(指换算成标准状况下的体积数)。
影响因素:气体的溶解度随温度的升高而减小,随压强增大而增大。
二、关于溶解度的计算1、若温度不变,在饱和溶液中蒸发溶剂或加入溶剂时,析出或溶解溶质的质量x :溶剂变化的质量x =100溶解度 练习1 T ℃时,足量A 的溶液分别蒸发一定量水后,再恢复至T ℃。
若蒸发2g 水时,无溶质析出,若蒸发4g 水时,析出溶质1g ,若蒸发6g 水时,析出溶质3g 。
则该温度下A 的溶解度为(上述析出的溶质不带有结晶水) ( )A. 33.3gB. 100gC. 50gD. 25g2、若溶剂不变,只改变饱和溶液温度,求析出或溶解溶质的质量x :溶液中溶剂的质量x =100两溶解度之差 或 原饱和溶液的质量x =原溶液的溶解度两溶解度之差 100 练习2 某盐在30℃时的溶解度为50g ,在20℃时的溶解度为20g 。
(1)若将100g30℃时的饱和溶液从30℃冷却至20℃,析出无水晶体的质量为 ( )A. 1gB. 10gC. 16gD. 20g(2)若将100g 质量分数为30%的该盐溶液从30℃冷却至20℃,析出无水晶体的质量为( )A. 1gB. 10gC. 16gD. 20g3、溶剂和温度均改变时,求析出或溶解溶质的质量x :练习3 60℃某盐的溶解度为40g ,现有140g60℃此盐的饱和溶液,蒸发掉20g 水,再降温到10℃,可析出无水晶体20g ,则该盐在10℃时的溶解度为 ( )A. 10gB. 15gC. 18gD. 25g4、加入或析出的溶质带有结晶水:练习4 在一定温度下,向饱和硫酸铜溶液中加入ag 无水硫酸铜粉末,搅拌,静置后析出bg CuSO 4•5H 2O 晶体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对于曲线下部面积上的任何点,依其数据配制的溶 液为对应温度时的不饱和溶液;曲线上部面积上的 点,依其数据配制的溶液为对应温度时的饱和溶液, 且溶质有剩余。要使不饱和溶液(曲线下部的一点) 变成对应温度下的饱和溶液,有三种方法:
两条溶解度曲线的交点便是该店所示的温 度下两物质的溶解度相同,此时两种物质
饱和溶液的溶质质量分数也相同。
第一类:大部分固体物质的溶解度随温度的升高而升高,曲线 为“陡升型”,如硝酸铵。 第二类:少数固体物质的溶解度随温度的升高变化不明显,曲 线为“缓升型”,如氯化钠。
第三类:极少数固体物质的溶解度随温度的升高而降低,曲线
为“下降型”,如氢氧化钙
2018中考
溶 液
定义: 特征:均一、稳定 组成:溶质、溶剂 扩散过程:吸热 决定溶液的温 溶解过程: 度变化 水合过程:放热 乳化现象 饱和溶液 分类 不饱和溶液
溶 解 度 固体溶解度 定义 影响因素 溶解度曲线 定义 影响因素 解释与应用 定义 数学表达式 溶液的稀释问题
气体溶解度
溶质的质量分数
溶液的配制
实验用品:天平、烧杯、玻璃棒、药、量筒 实验步骤:计算、称量、溶解
溶解度曲线上的点有三个方面的作用: ①根据已知温度查出有关物质的溶解度。
10
②根据物质的溶解度查出对应的温度。 ③可比较相同温度下不同物质溶解度的大小或饱 和溶液中溶质质量分数的大小。
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温 度的变化情况。曲线的坡度越大,说明溶解度受温度影响越 大;反之,说明受温度影响较小。溶解度曲线作用体现于如 下三个方面: ①根据溶解度曲线,可以看出物质的溶解度随着温度的变化 情况。 ②根据溶解度曲线,比较在一定温度范围内的物质的溶解度 大小。 ③根据溶解度曲线,选择分离某些可溶性混合物的方法
