中医药大学远程教育《无机化学Z》作业答案
北京中医药大学远程教育学院作业 无机化学Z

作业1 A型题:1. A.2. [1分] B.略有增大3. 一定温度下难溶电解质有关离子浓度的幂的乘积称为溶度积 [1分] B.饱和溶液中4. 盐效应能使难溶电解质的电离度 [1分] A.增大5. 在H2S饱和溶液中,下列表达式哪个是错误的?Ka1θ、Ka2θ表示H2S一、二级电离常数 [1分] A.[ H+ ] = 2 [ S2- ]6. [1分] A.先产生AgCl沉淀7. 在HAc溶液中加入NaCl,使HAc电离度增大,这种现象称为 [1分] C.盐效应8. 沉淀溶解的条件 [1分] C.9. 可以作为衡量缓冲溶液能力大小的是 [1分] D.缓冲容量10. 下列说法正确的是 [1分] C.同一弱电解质的溶液,浓度小的,电离度大11. A.12. B.4.7513. 一元弱酸强碱盐的水解常数可以表示为 [1分] A.14. [1分] B.15. 对于缓冲能力较大的缓冲溶液,它们的pH值最主要是由下列哪一种因素决定 [1分] A.缓冲(共轭)对之间的电离常数16. H3PO4的三级电离常数分别是Ka1θ、Ka2θ、Ka3θ,总电离平衡常数为Kaθ下列那些表达式是正确的? B.Kaθ =Ka1θ+Ka2θ+Ka3θ17. E.18. [1分] A.使更多的AgCl沉淀19. HAc的电离常数为Kaθ,在HAc溶液中加入NaAc固体,将使 [1分] C.pH值升高20. [1分] A.HAc —NaAC21. [1分] D.1.3%22. 下列溶液哪个是缓冲溶液 [1分] A.23. [1分] B.24. 沉淀完全的标准一般认为是 [1分] A.25. [1分] A.26. [1分] A.8227. [1分] A.9.2528. [1分] B.略有增大29. [1分] C.30. [1分] E.这些都不是31. NaAc固体加到HAc溶液中去,将使HAc的 [1分] D.电离度减小32. 同离子效应能使难溶强电解质的溶液变 [1分] B.减小33. 在HAc溶液中加入固体NaCl,使其溶解,可使 [1分] B.HAc电离度增大34. [1分] A.酸碱反应35. [1分] D.36. [1分] B.37. [1分] C.38. C.离子间的相互牵制39. 在NaHCO3溶液中。
无机化学课后习题参考答案大全【优秀】

无机化学课后习题参考答案大全【优秀】(文档可以直接使用,也可根据实际需要修订后使用,可编辑推荐下载)无机化学课后习题参考答案大全第一章原子结构与元素周期系 (1)第二章分子结构 (4)第三章晶体结构 (6)第4章酸碱平衡 (9)第五章化学热力学基础 (15)第六章化学平衡常数 (16)第七章化学动力学基础 (23)第八章水溶液 (29)第9章配合物 (32)第十章沉淀平衡 (34)第11章电化学基础 (39)第12章配位平衡 (43)第13章卤素 (44)第14章氧族元素 (46)第15章氮磷砷 (48)第16章碳硅硼 (51)第17章S区金属(碱金属与碱土金属) (55)第18章过渡元素(一) (58)第18章过渡元素(二) (63)第19章镧系与锕系金属 (66)第一章原子结构与元素周期系1-1:区分下列概念(1) 质量数和相对原子质量(2) 连续光谱和线状光谱(3) 定态、基态和激发态(4) 顺磁性和逆磁性(5) 波长、波数和频率(6) 经典力学轨道和波动力学轨道(7) 电子的粒性与波性(8) 核电荷和有效核电荷答:(1) 质量数:指同位数原子核中质子数和中子数之和, 是接近同位素量的整数。
相对原子质量:符号为Ar,被定义为元素的平均原子质量与核素12C 原子质量的1/12 之比,代替“原子量”概念(后者已被废弃);量纲为1(注意相对概念)。
(2) 连续光谱: 波长连续分布的光谱。
炽热的固体、液体或高压气体往往发射连续光谱。
电子和离子复合时,以及高速带电离子在加速场中运动时亦能发射这种光谱。
线状光谱:彼此分立、波长恒定的谱线。
原子受激发(高温、电孤等)时,电子由低能级轨道跃迁到高能级轨道,回到低能级时产生发射光谱(不同原子具有各自特征波长的谱线)。
(3) 定态是由固定轨道延伸出来的一个概念。
电子只能沿若干条固定轨道运动,意味着原子只能处于与那些轨道对应的能态,所有这些允许能态统称为定态。
主量子数为1 的定态叫基态,其余的定态都是激发态。
中医药大学《无机化学》考试辅导试题及答案

北京中医药大学《无机化学》考试辅导试题及答案用离子-电子法配平并完成下列反应答:1.2Fe3+ + 2I-= 2Fe2+ + I22.2MnO4-+ 3SO32-+H2O = 2MnO2 + 3SO42-+ 2OH—3.Cu2+ + Zn = Cu+ Zn2+4.Cr2O72-+3S2-+14H+ =2Cr3++3S +7 H2O5.2MnO4-+ 5SO32-+ 6H+= 2Mn2+ + 5SO42-+3 H2O6.2MnO4— + SO32-+ 2OH—= 2MnO42—+ SO42-+ H2O简答题1. 一种钠盐A,在A的水溶液中加入稀盐酸产生刺激性气体B。
A的水溶液在酸性中能使KMnO4溶液腿色,得到无色溶液C。
若在A的水溶液中通入Cl2得溶液D,在D中加入AgNO3溶液产生白色沉淀E,若在E中加入NH3水,震荡后得到无色溶液F。
指出A、B、C、D、E、F各为何物。
答:A、Na2SO3B、SO2C、Mn2+D、Cl-E、AgClF、[Ag(NH)2]+2.根据配合物的价键理论,指出下列配离子中,中心离子和配体的配位情况(即画出中心离子杂化后价电子排布、指出杂化轨道类型及空间构型)。
(1)[FeF6]3-μ= 5.92 B.M.(2)[Fe(CN)6]3-μ= 1.73 B.M.答:(1)Fe3+ 3d53d轨道有5个单电子sp3d2杂化八面体(2)Fe3+ 3d53d轨道有1个单电子d2sp3杂化八面体3.有四种试剂:Na2SO4、Na2SO3、Na2S2O3、Na2S,它们的标签已脱落,请设计只加一种试剂的简便方法鉴别它们,并写出有关配平的离子反应方程式。
答:加稀HCl (略)4.根据配合物的价键理论,确定下列配离子是内轨型还是外轨型,说明理由。
(1) [Fe(H2O)6]3-(Fe3+3d 5)μ= 5.92 B.M.(2) [Mn(CN)6] 4-(Mn2+3d 5)μ= 1.73 B.M.答:(1)μ= 5.92 B.M 则n=5Fe3+ 3d53d轨道有5个单电子sp3d2杂化八面体(2)μ= 1.73B.M 则n=1Fe3+ 3d53d轨道有1个单电子d2sp3杂化八面体5.现有一种含结晶水的淡绿色晶体A,将其配成溶液,若加入BaCl2溶液,则产生不溶于酸的白色沉淀B,若加入NaOH溶液,则生成白色胶状沉淀C并很快变成红棕色沉淀D,再加入盐酸,此红棕色沉淀又溶解,滴入硫氰化钾溶液显深红色溶液E。
无机化学在线作业答案

1.溶胶发生电泳时,向某一方向定向移动的是()。
A胶核
B吸附层
C胶团
D胶粒
正确答案:D
单选题
2.误差的正确定义是()。
A测量值与其算术平均值之差
B含有误差之值与真值之差
C测量值与其真值之差
D错误值与其真值之差
正确答案:C
单选题
3.属于随机误差的是()。
A滴定终点与化学计量点不一致
B把滴定管的读数22.45读成22.46
正确错误
正确答案:对
判断题54.色散力存在于非极性分子之间,取向力存在于极性分子之间。()
正确错误
正确答案:错
D (B)和(C)的混合颜色
正确答案:D
单选题
15.下列原子轨道不存在的是()。
A 2d
B 8s
C 4f
D 7p
正确答案:A
单选题
16.在沉淀反应中,加入易溶电解质会使沉淀的溶解度增加,该现象称为()。
A同离子效应
B盐效应
效应
D络合效应
正确答案:B
单选题
17.以下四个量子数(n、l、m、ms)的组合何者是合理的()。
A(2,2,0,-1/2)
B(2,1,0,-1/2)
C(2,1,2,+1/2)
D(1,2,1,+1/2)
正确答案:B
单选题
18.下列元素的电负性大小顺序正确的是()。
A B>C>N>O>F
B F>Cl>Br>I
C Si>P>S>Cl
D Te>Se>S>O
正确答案:B
单选题
19.19号元素K基态最外层电子的四个量子数为()。
药学无机化学试题及答案

药学无机化学试题及答案一、选择题(每题2分,共20分)1. 以下哪项不是无机化合物的特点?A. 含有碳元素B. 大多数无机化合物是离子化合物C. 通常具有高熔点和高沸点D. 容易形成晶体2. 根据元素周期表,下列元素中属于非金属元素的是:A. 锂(Li)B. 钠(Na)C. 氧(O)D. 铁(Fe)3. 以下哪种化合物不是盐类?A. 硫酸钠B. 硝酸钾C. 氢氧化钠D. 碳酸钙4. 根据离子键理论,下列哪种情况离子键最强?A. 离子半径大B. 离子电荷高C. 离子半径小D. 离子电荷低5. 以下哪种反应不是氧化还原反应?A. 铁与氧气反应生成铁的氧化物B. 氢气与氧气反应生成水C. 碳酸钠与盐酸反应生成氯化钠、水和二氧化碳D. 铜与硝酸银反应生成硝酸铜和银二、填空题(每空2分,共20分)6. 原子序数为11的元素是_________。
7. 元素周期表中,第IA族元素的特点是具有_________个价电子。
8. 根据路易斯酸碱理论,能给出质子的物质是_________。
9. 硫酸的化学式为H2SO4,其中S的氧化态为_________。
10. 根据酸碱质子理论,能结合质子的物质是_________。
三、简答题(每题10分,共30分)11. 简述什么是配位化合物,并给出一个例子。
12. 描述什么是酸碱中和反应,并解释其原理。
13. 解释什么是氧化数,并给出一个具体元素的氧化数计算例子。
四、计算题(每题15分,共30分)14. 某溶液中含有0.01摩尔的NaOH,若用0.02摩尔/升的HCl溶液滴定至终点,求消耗的HCl溶液体积。
15. 已知某化合物的化学式为Fe2O3,求其摩尔质量,并计算1摩尔Fe2O3中含有多少摩尔的铁原子。
答案:一、选择题1. A2. C3. C4. B5. C二、填空题6. 钠(Na)7. 一8. 酸9. +610. 碱三、简答题11. 配位化合物是由中心金属离子或原子与配体通过配位键结合形成的化合物。
北京中医药大学远程教育《无机化学Z》作业4答案

A型题:1. Cu(I)在下例哪种情况下稳定A.低温B.酸中C.干态D.水溶液中E.加氧化剂2. 加入NaOH,得不到氧化物的是A.Cu2+B.Ag+C.Hg2+D.Hg22+E.HgCl23. 在MnSO4溶液中滴加NaOH后,在空气中放置可以观察到的现象是A.开始为白色胶状沉淀→棕色沉淀B.开始生成白色沉淀→黄色沉淀→棕色沉淀→黑色沉淀C.开始生成白色沉淀→变灰绿色沉淀→棕色沉淀D.黄色沉淀→黑色沉淀E.黑色沉淀→白色沉淀4. 在下列化合物中,氢键表现最强的是A.NH3B.H2OC.H2SD.HClE.HBr5. sp3杂化可以描述下列那一种分子中共价键的形成A.H2O2B.HClO4C.NH3D.H2OE.四种分子都可以6. 主成分含铁的中药是A.芒硝B.朱砂C.赭石D.轻粉E.雄黄7. 盛放AgNO3的滴瓶口中常有灰黑色物质,主要是A.AgNO3在空气中被氧化B.由于Ag+发生歧化反应C.由于日光作用,AgNO3慢慢分解的结果 D.AgNO3水解的结果 E.以上都不是8. 在K2CrO4溶液中,加入H2SO4,然后再加H2O2。
实验可观察到的现象是A.由黄色→橙色→兰色→绿色并有气泡产生B.由绿色→黄色→兰色C.由无色→黄色→兰色D.由紫色→绿色→黄色E.以上都不对9. 单质碘在水中的溶解度很小,但在KI或其它碘化物的溶液中碘的溶解度增大,这是因为A.发生了离解反应B.发生了配位反应C.发生了氧化还原反应D.发生了盐效应E.发生了水解反应10. 下列各酸中何者为酸性最强的酸A.H2SO4B.HClO4C.HBrO4D.HIO4E.HCl11. 实验室中配制FeSO4溶液须A.加稀H2SO4与铁屑B.加铁屑C.加浓H2SO4D.加浓H2SO4与铁屑E.加稀H2SO412. 下列硫化物能溶于浓盐酸的是A.CuSB.Ag2SC.HgSD.CdSE.都不溶13. 下列物质中水解度最大的是A.FeCl2B.FeCl3C.BaCl2D.PCl3E.NaCl14. Pb2+离子的电子构型是A.8电子构型B.18电子构型C.18+2电子构型D.9~17电子构型E.2电子构型15. 硼酸的分子式为H3BO3,所以它是A.三元酸B.二元酸C.一元弱酸D.一元强酸E.三元弱酸16. 中药胆矾的主要成分是A.CuCl2·H2OB.FeSO4·7H2OC.CuSO4D.Cu(OH)2·CuCO3E.CuSO4·5H2O17. 下列物质中热稳定性最好的是A.Ca(HCO3)2B.CaCO3C.BaCO3D.H2CO3E.MgCO318. 在酸性溶液中欲将Mn2+氧化为MnO4-,在下列氧化剂中应选择A.PbO2B.Cl2C.K2CrO7D.H2O2E.KClO319. 下列化合物属于两性氧化物的是A.Na2OB.Al2O3C.CO2D.SO3E.CaO20. 实验证明,在中性介质中,KMnO4与Na2SO3的反应,它们的产物是A.MnO42-、SO42-B.Mn2+、SO42-C.MnO2、SO2D.Mn2+、HSO3-E.MnO2、SO42-21. 用来检验Fe2+离子的试剂是下列试剂中的哪一种A.H2SB.NH4CNSC.K4Fe(CN)6D.K3Fe(CN)6E.NaOH22. 在水溶液中易自发歧化的是A.Fe2+B.Hg22+C.Cu+D.Hg2+E.Cr3+23. 只能溶于王水的是A.CuSB.Ag2SC.CuID.HgSE.Hg2S24.A.紫色B.肉色C.棕色D.无色E.绿色25. 下列物质中酸性最弱的是A.H3PO4B.HClO4C.H3AsO4D.H3AsO3E.HCl26. 过氧化氢中氧原子是采用何种杂化轨道成键A.spB.sp2C.sp3D.dsp2E.sp3d27. 能溶于Na2S溶液的是A.CuSB.Ag2SC.CuID.HgSE.Hg2S28. 在铬(III)盐溶液中加过量碱溶液其存在形式为A.Cr(OH)3B.Cr3+C.CrO2-D.CrO42-E.Cr2O72-29. 硝酸钾的热分解产物是A.KNO2和O2B.K2O、N2O和O2C.K、N2O和O2D.K、N2O、O2和H2OE.K、N2和H2O30. 在用H2SO4酸化的锰酸钾溶液中,加入过氧化氢时,过氧化氢起什么作用A.起氧化剂作用B.起还原剂作用C.还原硫酸D.分解成氢和氧E.起催化作用31. 下列哪一种酸能于玻璃反应A.H2SO4B.HNO3C.HFD.HClO4E.HCl32. 下列硫化物能溶于稀盐酸的是A.ZnSB.CuSC.Ag2SD.HgSE.CdS33. 下列哪一族离子在中性条件下通入H2S都不生成硫化物沉淀A.Fe2+、Mg2+B.Ca2+、Co2+C.Ag+、Pb2+D.Mg2+、Ca2+E.Ag+、Sn2+34. 在水溶液中都具有颜色的离子是A.Cu2+、Na+、Al3+B.Fe2+、Co2+、Mg2+C.Cr3+、Fe2+、Cu2+D.Mn2+、Zn2+、Cd2+E.AsO43-、MnO4-、Cl-35. 可以使Hg22+歧化的方法是A.加硝酸B.加Hg2+的沉淀剂C.加Hg2+的配位剂D.加还原剂E.以上方法都不行36. 硝酸分子中有一个π键,可表示为A. B. C.D. E.37. p区元素含氧酸既可做氧化剂,又能做为还原剂的是A.HNO3B.H3PO4C.HNO2D.HClO4E.H2HO438. 下列氢化物中沸点最低的是A.HClB.HBrC.HID.HFE.H2OB型题:A.FB.HC.CsD.AtE.O39. 电负性最高的元素是A B C D E40. 电负性最低的元素是A B C D EA.砖红色沉淀生成B.棕色沉淀生成C.白色沉淀生成D.黄色沉淀生成E.没有沉淀生成41. 向K2Cr2O7溶液中加入Pb2+,则有A B C D E42. 向K2Cr2O7溶液中加入Ag+,则有A B C D EA.AgNO3B.K2Cr2O7C.HgCl2D.FeSO4·7H2OE.CaSO4·5H2O43. 应避光保存的是A B C D E44. 在空气中不稳定的是A B C D EA.Mn2+B.Cd2+C.Pb2+D.Hg2+E.Zn2+45. 上述离子中,加入Na2S溶液后,产生黄色沉淀的是A B C D E46. 上述离子中。
中医药大学远程教育《有机化学Z》作业及答案

北京中医药大学远程教育学院有机化学各章习题第一章 绪论一、 指出以下化合物所含官能团的名称CHCH 3CH 3CH1. 双键 CH 3CH 2Cl2. 卤基CH 3CH 3CHOH3. 羟基2氨基5.CH 3CH 3CCH 3O羰基 CH 3O CH 6. 醛基CH 3CH 2C OOH 7. 羧基NO 28.硝基CH 3CH 2CH 3O9. 醚基 CH 3CH 2CN 10. 氰基二、 按照开库勒及古柏尔等所提出的经典有机化合物结构理论,写出以下分子式的各种可能结构式CO 21. C 4H 102. C 2H 7N 3. CH 2O 24.1. O=C=O2.3. 4.第二章 烷烃一、 命名以下化合物(CH 3)CHCH 2CH 2CH 321. 2-甲基戊烷CH 3CH 2C(CH 3)2CH 2CH 32. 3, 3-二甲基戊烷 (C 2H 5)2C(CH 3)CH 2CH 33. 3-甲基-3-乙基戊烷CH 3CH 2CH(CH 3)CH(CH 3)CH(CH 3)24. 2, 3, 4-三甲基己烷 CH 3CH 2CH(CH 3)CH 2CHCH 2CH 3CH 2CH 3CH 25. 3-甲基-5-乙基辛烷(CH 3)3CCH 2C(CH 3)26. 2, 2, 4-三甲基戊烷 (CH 3)2CHCH 2CH 2CH(CH 2CH 3)27. 2-甲基-5-乙基庚烷 (CH 3)2CHCH(CH 3)CH 2C(CH 2CH 3)2CH 38. 2, 3, 5-三甲基-5-乙基庚烷 (CH 3)2CHC(C 2H 5)2CH 2CH 2CH 39. 2-甲基-3, 3-二乙基己烷CH 3CH 10.CH 2CH 3CHCH 3CH 2CH 2CH CH 3CH 33-甲基-4-异丙基庚烷二、 写出以下化合物的系统名称1.2.3.丙烷 丁烷 异丁烷4.5.6.2, 2-二甲基丙烷 2, 3-二甲基丁烷 3-乙基戊烷三、写出以下化合物的结构式 1. 2,2,3,3—四甲基戊烷2. 2,3—二甲基丁烷3. 3,4,4,5—四甲基庚烷4. 3,4—二甲基—4—乙基庚烷5. 2,4—二甲基—4—乙基庚烷6. 2,5—二甲基己烷7. 2—甲基—3—乙基戊烷8. 2,2,4—三甲基戊烷9. 3,4—二氯—2,5—二甲基己烷 10. 5—〔1,2—二甲基丙基〕—6—甲基十二烷第三章 烯烃一、 用系统命名法命名以下化合物CH 3CH 2CH 2CCH 2CH 3CH 21. 2-乙基-1-戊烯CH 3CH 2CCH 32.CH 22-甲基丁烯CH 3CHCH 2CH CHCH 3CHCHCH 3CH 33. 6-甲基-4-乙基-2-庚烯CH 3CH 2CHCHCH 2CH 2CH 34. 3-庚烯二、 写出以下化合物的结构式1. 四乙基乙烯2. 对称二乙基乙烯3. 不对称甲基乙基乙烯4. 2,3,3,4—四甲基—1—戊烯三、 完成以下反响式,写出主要产物的结构式第四章 炔烃和二烯烃一、 用系统命名法命名以下化合物CH 3CCCH 31. 2-丁炔 CHCCH 2CH 32. 1-丁炔CH 3CHCH 2CCHCH 33. 4-甲基-1-戊炔CH 2CHCH 2CH 2CCH 4. 1-己烯-5炔CH 3CCH 3CCH 3CHCH 25. 3, 4-二甲基-1, 3-戊二烯CH 3CC C CHCH 2CH 3CHCH 26. 4-乙烯基-4-庚烯-2-炔CH 3HC3HCC CC CH 3CH 3CH 37. 2, 2, 5-三甲基-3-己炔C CC CH 3CH 3CH 3CH 28.4,4-二甲基-1-苯基-1-戊炔二、 写出以下化合物的结构式1. 4—甲基—2—戊炔2. 3—甲基—3—戊烯—1—炔3. 二异丙基乙炔4. 1,5—己二炔5. 1—溴—1—丁炔6. 乙烯基乙炔7. 4—十二碳烯—2—炔8. 3—甲基—3—戊烯—1—炔三、 完成以下反响式,写出主要产物的结构式第五章 脂肪烃一、 用系统命名法命名以下化合物1. 4-环丙基-1-丁烯2.5-甲基-4-环丙基-2-庚烯二、写出以下化合物的结构式1. 环己基环己烷2. 二螺[5,1,6,2]十六烷第六章 芳香烃一、 命名以下化合物C CH 3CH 3CH 31.CH 3Cl2.C 2H 5NO 23.NO 2NO 24.COOH叔丁基苯 4-氯甲苯 4-硝基乙苯 3, 4-二硝基苯甲酸CH 2OH5.CCHCH 3CH 36.7.苯甲醇 2-苯基-2-丁烯 环己基苯二、 写出以下化合物的结构式1. 间二硝基苯2. 对溴硝基苯3. 对羟基苯甲酸4. 2,4,6—三硝基苯酚5. 对氯苄氯6. 3,5—二硝基苯甲酸三、 完成以下反响式四、 以苯为原料合成以下化合物ClCH 31.ClNO 22.CNO 2OH O SO 3H3.4.CH(CH 3)2CCH 3O第七章卤代烷烃一、命名以下化合物1.CH3CH CH CHCH3CH3Cl CH31.2,4—3—氯—二甲基戊烷CH3CH CH CHCH3CH3ClCH32.3, 4-二甲基-2-氯戊烷CH2CH2CH2CH2BrBr3.1,5—二溴戊烷Cl4.1—氯环戊烷氯代环戊烷CHCl35.三氯甲烷〔氯仿〕二、写出以下化合物的结构式1. 烯丙基溴2. 1—氯—2—苯基—乙烷3. 间—氯乙苯4. 4—溴—2—甲基—3—乙基戊烷5. 3—氯环己烯第八章 醇、酚、醚一、 命名以下化合物CH 3OH1.3—甲基环己醇OH 3HC2.1—甲基环戊醇1.CH 3CCH 2CH 2CH 3OHCH 2CH 33. 3—甲基—3—己醇CH 3CH 2CH 2CH 2CH 2CH 2OH 4. 1—己醇CH 3CHCH 2CH 2CH 3OH5. 2—戊醇二、写出以下化合物的结构式 1. 甲基乙基醚2. 乙基异丙基醚3. 戊醇—24. 4—甲基环己醇5. 邻氯苯酚三、完成以下反响式,写出主要产物的结构式CHCH 2CH 2OH CH 3CH 3PBr 1.OHSOCl 22.CH 2OHHONaOH/H 2O3.CH 3CH 2CH 2CH 2OH[O]4.CH 3CH 2CHOH CH 3HCl(ZnCl 25.+第九章 醛、酮、醌一、 用系统命名法命名以下化合物CH 3CH 2CH 2CH 2CH 2C OH 1.己醛CH 3CH 2CHCH 2CH 2CH 2CHCH 3O2. 5—甲基庚醛CH 3CHCH 2CH 2CH 2CHCH 3O3. 5—甲基己醛CH 3C OCH 2CH 2CH 34. 2—戊酮 戊酮—2CH 3CHCH 2CCH 3O5.CH 34—甲基—2—戊酮OO 6.对苯醌OO 7.邻苯醌二、写出以下化合物的结构式1. 2—甲基乙醛2. 异丁醛3. 3—甲基辛醛4. 3—甲基庚酮—25. 氨基脲6. 苯甲醛7. 环己酮8. 苯乙醛三、完成以下反响式,写出主要产物的结构式CHO + Br1.CHO+ I 2 + NaOH2.(不反响)CHO+ NaBH 3.4.CH 3CH 2CH 2CCH 3O+ HCN5.CH 3CH 2CCH 2CH 3O+ H 2N OH6.CH 3CH 2CH 2CCH 2CH 3O+ H 2NNHCH 3CH 2CH 2CCH 2CH 3N NHCH 3CH 2CHOKMnO 47.8.CH 3CH 2CH 2CH 2CH 2C O+ NaHSO 3H第十章 羧酸及其衍生物一、 用系统命名法命名以下化合物OHOCH 3CHCHCH 2CH 2CH 2C H 3C CH 31. 5,6—二甲基庚酸OOH CH 3CH 2CH 2CH 2CH 2CH 2C2. 庚酸OHCH 33.OCH 2C C 2—甲基丙烯酸4.CH 3CH 2CHCOClBr2—溴丁酰氯C C 5.O O O邻苯二甲酸酐OCH 2CH 3CH 3C CH 2C O 6.O乙酰乙酸乙酯CH 3CH 3CH 2C O7.NHN —甲基丙酰胺CH 3CH 2CCH 3O8.CO O乙丙酸酐二、写出以下化合物的结构式1. 3—甲基庚酸2. 2—甲基—3—乙基辛酸3. 丁二酸酐4. 邻苯二甲酸酐5. 丙酸乙酯6. N ,N —二乙基乙酰胺7. 异丁酰氯8. 邻甲基苯甲酰溴三、完成以下反响式,写出主要产物的结构式CH 3CH 3COOH + HOCH 2CH1.2.CH 3CH 2C CH 3CH 2COO+ HOCH 2CH 33.OO C C OH OHHCOCH 2CH 2CH 3O4. + NH 3C OO CH 3H 3CC O5.+CH 2OHOCH 3C Cl +HOCH 2CH 2CH 6.OCH 3CH 2CNH 2+CH 3CH 2CH 2OH7.OCH 2OHC8.+OH+第十一章 取代羧酸一、 用系统命名法命名以下化合物CH 3CHCH 2CHCCH 3ClOHO1. 2—氯—4—甲基戊酸CHCCH 3ClOO2.CH 2CH 3CH 3CH 2CH 2C2—氯—3—甲基己酸乙酯CHC OHO3.CH 3CH 2NH 22—氨基丁酸CCH 3OO4.CH 2CH 2CHCH 3CH 2CHCH 3CH 32—甲基丁酸异戊酯CH 2COCH 25.O苯乙酸苯甲酯二、写出以下化合物的结构式1. 乙酰乙酸乙酯2. 苯甲酸苯酯3. 3—氯丁酸乙酯4. α—氨基戊酸5. β—甲基戊酰氯三、完成以下反响式,写出主要产物的结构式1.Cl+ H 2OOH CH 3CH 2CHCOCOHO2.CH 3CCH 2CH 2OCOH O3.CH 3CH 2+OH4.+OCH 2CH 3CH 3CCH 2C OO Br 2/Cl 2NHCH 3CCH 2COCH 2CH 3OO +H 2N5.NH5.OCH 2CH 3NHOHCCH 3CH 2C O第十二章 糖类1. 葡萄糖的半羧醛羟基是〔A 〕。
无机化学课后习题答案

无机化学课后习题答案无机化学是化学科学的一个重要分支,研究无机物质的性质、组成、结构和变化规律。
学习无机化学时,课后习题是巩固知识和检验学习效果的重要手段。
本文将为大家提供一些无机化学课后习题的答案,希望能够帮助大家更好地理解和掌握相关知识。
1. 以下哪个元素的原子半径最大?答案:铯(Cs)。
根据周期表可知,原子半径随着周期数的增加而递增,而在同一周期内,原子半径随着原子序数的增加而递减。
铯位于第6周期,原子序数为55,因此原子半径最大。
2. 以下哪个元素的电负性最大?答案:氟(F)。
电负性是原子吸引和保持共价键中电子的能力,氟的电负性最大,因此它能够吸引和保持共价键中的电子最强。
3. 以下哪个离子的电荷最大?答案:氧(O2-)。
氧是周期表上最电负的元素之一,当它获得两个电子形成O2-离子时,电荷最大。
4. 以下哪个化合物是无机酸?答案:硫酸(H2SO4)。
无机酸是指在水中能够释放出H+离子的化合物,硫酸是一种无机酸。
5. 以下哪个化合物是无机盐?答案:氯化钠(NaCl)。
无机盐是由阳离子和阴离子组成的化合物,氯化钠是一种无机盐。
6. 以下哪个化合物是金属氧化物?答案:氧化铁(Fe2O3)。
金属氧化物是由金属和氧元素组成的化合物,氧化铁是一种金属氧化物。
7. 以下哪个化合物是非金属氧化物?答案:二氧化碳(CO2)。
非金属氧化物是由非金属和氧元素组成的化合物,二氧化碳是一种非金属氧化物。
8. 以下哪个化合物是酸性氧化物?答案:二氧化硫(SO2)。
酸性氧化物是指在水中能够形成酸的氧化物,二氧化硫是一种酸性氧化物。
9. 以下哪个化合物是碱性氧化物?答案:氢氧化钠(NaOH)。
碱性氧化物是指在水中能够形成碱的氧化物,氢氧化钠是一种碱性氧化物。
10. 以下哪个化合物是氢氧化物?答案:氢氧化钠(NaOH)。
氢氧化物是由金属离子和氢氧根离子(OH-)组成的化合物,氢氧化钠是一种氢氧化物。
通过以上习题的答案,我们可以巩固和加深对无机化学知识的理解。
无机化学Z答案

⽆机化学Z答案---精品---《⽆机化学》专科辅导资料A 型题:1. NaAc 固体加到HAc 溶液中去,将使HAc 的 D.电离度减⼩ 2. 强电解质溶液的表观电离度总是⼩于100%,原因是 B.正负离⼦互相吸引3. ⼀种酸的强弱可⽤下列哪⼀种数据来衡量 C.电离常数4. 已知NH 3·H 2O 的θb K= 10—4.75,将0.2 mol ·L —1的NH 3·H 2O 和0.2 mol ·L —1的NH 4Cl 等体积混合,溶液的pH 值为 A .9.25 5. 计算⽆机多元弱酸的酸度时D .θ1a K /θ2a K ≥104时,可以按⼀元弱酸处理 6. 有⼀难溶电解质AB,在⽔溶液中达到溶解平衡,设平衡时[A] = X ·mol ·L —1,[B] = Y ·mol ·L —1,则θSP K 可表达为 B .θSP K = X ·Y 7. 在下列分⼦中元素氧化值为+7的是 D .(NH 4)2S 2O 8 8. 已知:BrO 4— +0.93 BrO 3—+0.54 BrO —+0.54 Br 2 +1.07 Br — 能发⽣歧化反应的是 C .Br 2 9. 电⼦运动具有波动性B .电⼦衍射实验可以证实 10.下列各组量⼦数哪组是正确的 D .n =4 l =3 m =0 m s =+1/211. 中⼼原⼦采取sp 2杂化,空间构型为平⾯三⾓形的是 C .BF 3 12. 泡⾥原理(pauli )指的是 B .在同⼀原⼦⾥,不能有四个量⼦数完全相同的电⼦13.ψ2的物理意义是D 代表原⼦在该点(r 、θ、j )出现的概率密度,即单位微体积中电⼦出现的概率 14.⽔分⼦间产⽣的作⽤⼒是哪⼀种 E. 取向⼒+⾊散⼒+诱导⼒+氢键15.当n = 3时,?则该电⼦层最多可容纳的电⼦数 B.18个电⼦16.在 HAc 溶液中加⼊ NaCl 固体振荡后 B. 溶液的pH 值降低17.铁的原⼦序数是26,Fe(Ⅲ)离⼦的电⼦层结构在基态时是下列哪种构型 D. [Ar] ↑↑↑↑↑ 18.在下列哪⼀种物质中,氧的氧化值与⽔的氧的氧化值不同 D. H 2O 219、在饱和H 2S(θ1a K =1.32×10-7,θ2aK = 7.08×10-15)⽔溶液中,何者浓度最⼩ C. S 2-20.难溶物 AgCl 的溶解度为 s (mol·L -1),其θSP K 等于E. s 221.下列配体中,何种配体是螯合剂 D. NH 2CH 2CH 2NH 2 22.实际浓度为0.1 mol·L -1的NaCl 溶液,其有效浓度为0.078 mol·L -1,对此现象最恰当的解释是:C .离⼦间的相互牵制 23.原电池中负极发⽣的是A .氧化反应 24.氨分⼦间产⽣的作⽤⼒是E. 取向⼒+⾊散⼒+诱导⼒+氢键 25.HAc 溶液中,加少量固体NaAc 后,则B. 溶液酸度下降 26.0.1mol·L -1的H 2S(θ1a K =9.1×10-8,θ2a K =1.1×10-12)⽔溶液中,浓度最⼤的是:A. H 2S27.温度⼀定时,决定某弱酸及其盐缓冲溶液pH 值的主要因素是:D.弱酸和其盐的浓度⽐28.π键的特征是 D.原⼦轨道以平⾏⽅式重叠,重叠部分通过⼀个键轴平⾯,具有镜⾯反对称29.下列有关分步沉淀叙述中正确的是A.J θ先达到溶度积者先沉淀出来。
北京中医药大学远程教育《无机化学Z》作业3答案

A型题:1. 下列配合物属于外轨型的是A. B. C. D.E.2.A.3B.6C.2D.4E.53.A.sp3B.sp2C.dsp2D.sp3d2E.sp3d4.A. B. C. D.E.5. 液态水中,水分子之间存在A.取向力B.诱导力和色散力C.取向力和氢键D.氢键E.四种力都存在6. PCl5分子的空间构型是A.四面体形B.三角锥形C.四方形D.平面三角形E.三角双锥形7. 组成为CrCl3·6H2O的配合物,其溶液中加入AgNO3后有2/3的Cl-沉淀析出,则该配合物的结构式为A. B. C.D. E.8.A.3.74×10-18B.2.1×1025C.4.76×1026D.8.1×1020E.2.0×10-259.A.3和4B.1和4C.3和0D.1和0E.2和010. 下列晶体中,熔化时需破坏共价键的是A.HFB.AgC.K2OD.SiO2E.NaCl11. 下列分子的中心原子采用sp3等性杂化的是A.NH3B.NO3C.BeCl2D.PH3E.CH412.A.1B.2C.3D.4E.513. NH3溶于水后,分子间产生的作用力有A.取向力和色散力B.取向力和诱导力C.诱导力和色散力D.取向力、诱导力和色散力E.取向力、诱导力、色散力和氢键14.A.正四面体、正四面体B.平面正方形、平面正方形C.正四面体、三角双锥D.正四面体、平面正方形 E.平面正方形、正四面体15.A.0B.1C.3D.5E.416. 下列说法错误的是A.化学键中,没有百分之百的离子键,也没有百分之百的共价键B.由共用电子形成的化学键叫共价键 C. 离子键有方向性和饱和性 D.晶体中的微粒在三维空间有规则地排列,并具有一定的几何形状叫晶格 E.NaCl是离子型化合物17. 下列各化学键中,极性最小的是A.O—FB.H—FC.C—FD.C—FE.Na—F18. 下列分子中,偶极矩最大的是A.HClB.HBrC.HFD.HIE.NO19. 下列元素中,其化合物常具有颜色的是A.碱金属B.碱土金属C.过渡元素D.惰性气体E.p区元素20. 下列说法正确的是A.NaCl是食盐的分子式B.共价键仅存在于共价型化合物中C.凡是盐都是离子型化合物D.离子晶体一般都有较高的熔点和沸点E.水中不存在氢键21. 水的反常熔、沸点归因于A.范德华力B.配位键C.离子键D.氢键E.电离常数小22. 下列分子或离子具有顺磁性的是A. N2B.O2C.F2D.O22-E.H223.A.0B.M B.4.9 B.MC.1.7 B.M.D.3.9 B.ME.5.9BM24. 下列各对配离子的稳定性的相对大小,不正确的是A. B. C.D. E.以上都不正确25.A.0.19VB.0.38VC.-0.55VD.1.28VE.-0.38 V26. 下列物质或溶液是无色的是A. B. C. D.E.27. 非极性分子与非极性分子之间存在A.取向力B.诱导力C.色散力D.氢键E.离子键28. HF的沸点比HCl高,主要是由于前者A.共价键牢固B.分子量小C.有色散力D.分子间有氢键E.诱导力29. 形成外轨型配合物时,中心原子不可能采取的杂化方式是A.d2sp3B.sp3C.spD.sp3d2E.sp3d30. 下列配体中,可与中心原子形成螯合物的是-B.NH3C.NH2CH2CH2NH2D.CH3NH2E.S2O32-31. 在液氧中,氧分子中存在的作用力是A.诱导力B.色散力C.取向力D.诱导力和色散力E.诱导力、色散力和氢键32.A.二氯·四硫氰酸根合铬(Ⅲ)酸铵B.四硫氰酸根二氯合铬(Ⅲ)酸铵C.异硫氰酸根·二氯合铬(Ⅲ)酸铵 D.氯·四异硫氰根合铬(Ⅲ)酸铵 E.二氯合铬(Ⅲ)·四硫氰酸铵33. O2–的分子轨道电子排布式正确的是A.B.C.D.E.34. ClO3-中氯原子采取的杂化方式是A. B. C.D. E.35. 下列分子中偶极矩等于零的是A.CHCl3B.H2SC.NH3l4E.PCl336. 根据晶体场理论,高自旋配合物具有的性质是A.分裂能>成键能B.分裂能<成对能C.分裂能>成对能D.电离能>成对能E.分裂能=成对能37. 下列例子中可作为双基配体的是A.C2O42-B.S2O32-C.H2Y2--E.SCN-38. 下列分子或离子中,具有直线形结构的是A.SO2B.C2H4C.BeCl2D.NO2E.H2O39. 下列化合物中,存在分子间氢键的是A. B. C.D. E.以上都不存在分子间氢键40. 下列分子或离子具有反磁性的是A.O2-B.F2C.B2D.N2+E.H2+B型题:A.键级=1B.键级=1.5C.键级=2D.键级=2.5E.键级=341. O2-离子的键级是A B C D E42. O2+离子的键级是A B C D EA. B. C. D. E.43.A B C D E44.A B C D EA.配体的酸效应B.d—d跃迁C.金属离子的水解效应D.配合物的稳定常数E.水的离子积45. 增加酸度,配合物稳定性增强,这种现象一般称为A B C D E46. 过渡元素配合物大多显有颜色,这种现象可解释为A B C D EA.V形B.三角形C.四面体D.直线形E.八面体形47. C2H2的空间构型是A B C D E48. AlCl3的空间构型是A B C D EA. B. C. D. E.49. 属螯合物的是A B C D E50. 属多核配合物的是A B C D EA. B. C. D.E.51. 在BCl3分子中,中心原子采取的杂化轨道类型是A B C D E52. SF6中,中心原子采取的杂化轨道类型是A B C D EA.F2分子B.B2分子C.C2分子D.N2分子E.O2分子53.A B C D E54.A B C D EA. B. C. D.E.55.A B C D E56.A B C D EA.HClB.COC.CO2D.N2E.HF57.A B C D E58.A B C D EA. B. C.D. E.59. 配体的取代反应是A B C D E60. 反应为氧化还原反应的是A B C D E。
山东中医大期末考试无机化学(高起专)复习题及答案

无机化学(高起专)作业及期末考试复习题库注:找到所考试题直接看该试题所有题目和答案即可。
查找按键:Ctrl+F一、单选题整理:超越高度1.(1.5分)配置SnCl2溶液时,为了防止其水解应该加入()A.HClB.NaOHC.HNO3D.NaCl参考答案:A2.(1.5分)[CoCl(NH3)5]Cl2的正确命名是()A.二氯化五氨一氯合钴(Ⅲ)B.一氯•五氨合钴(Ⅲ)化二氯C.二氯化一氯•五氨合钴(Ⅲ)D.三氯化五氨合钴(Ⅲ)参考答案:C3.(1.5分)Na原子的分区是()A.f区B.p区C.d区D.s区参考答案:D4.(1.5分)电子云指的是()A.核外电子运动的一种固定状态B.波函数C.核外电子概率密度分布的形象化表示D.核外电子运动的固定轨道参考答案:C5.(1.5分)描述原子轨道在空间不同角度的取向是()A.主量子数nB.角量子数lC.磁量子数mD.自旋量子数ms参考答案:C6.(1.5分)下列氢键中最强的是()A.S—H…OB.N—H…NC.F—H…FD.C—H…N参考答案:C7.(1.5分)将锌片浸入含有0.01mol•L-1的Zn2+溶液中,已知锌电极的标准电极电势为-0.762V,则此时锌电极的电极电势为()A. -0.762VB. -0.801VC. -0.821VD. -0.703V参考答案:C8.(1.5分)下列含氧酸既能做氧化剂又能做还原剂的是()A.H3PO4B.HNO2C.H2S2O8D.HIO4参考答案:B9.(1.5分)某元素的价电子构型为3d84s2,则该元素为()A.MgB.ZnC.NiD.Ca参考答案:C10.(1.5分)当pH=1.0时,氢电极的电极电势是()A.0.000VB.0.030VC. -0.030VD. -0.059V参考答案:D11.(1.5分)HF反常的熔、沸点及弱酸性归因于()A.分子间作用力B.配位键C.离子键D.氢键参考答案:D12.(1.5分)具有极性键的非极性分子()A.P4B.H2SC.BCl3D.CHCl3参考答案:C13.(1.5分)在近中性溶液中,当适量的KMnO4与Na2SO3反应时出现的现象是()A.棕色沉淀B.紫色褪去C.绿色溶液D.紫红色溶液参考答案:A14.(1.5分)已知多电子原子中,下列各电子具有如下量子数,其中能量最低的是()A.2,0,0,-1/2B.3,2,2,+1/2C.3,1,1,-1/2D.2,1,1,-1/2参考答案:A15.(1.5分)在等浓度的Cl-、Br-、I- 混合液中滴加稀AgNO3溶液,沉淀顺序是()A.AgCl、AgBr、AgIB.AgI、AgBr、AgClC.AgBr、AgCl、AgID.AgBr、AgI、AgCl参考答案:B16.(1.5分)在AgBr饱合溶液中,有AgBr固体存在,当加入等体积的下列哪一种溶液时会使AgBr的溶解度更大一些()A.1mol/LNaBrB.1mol/ L AgNO3C.2mol/L NaNO3D.1mol/L NaNO3参考答案:C17.(1.5分)当基态原子第六电子层只有2个电子时,原子的第五电子层的电子数()A.肯定为8个电子B.肯定为18个电子C.肯定为8-18个电子D.肯定为8-32个电子参考答案:C18.(1.5分)碘水中,碘分子与水分子之间存在的作用力是()A.取向力和诱导力B.诱导力和色散力C.取向力D.取向力和色散力参考答案:B19.(1.5分)下列化合物在浓氨水中溶解度最大的是()A.AgIB.AgClC.AgBrD.Ag2S参考答案:B20.(1.5分)向原电池(-)Zn│Zn2+(1mol/L)‖Cu2+(1mol/L)│Cu(+)的正极中加入浓氨水,则该电池的电动势将()A.增大B.减小C.不变D.先减小后增大参考答案:B21.(1.5分)当主量子数n=4时,最多可容纳的电子数为()A.6B.9C.18D.32参考答案:D22.(1.5分)下列分子中偶极矩等于零的是()A.CHCl3B.H2OC.NH3D.BF3参考答案:D23.(1.5分)关于杂化轨道的说法正确的是()A.凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合而成的C.sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键参考答案:C24.(1.5分)在下列离子中,还原能力最强的是()A.F-B.Br-C.Cl-D.I-参考答案:D25.(1.5分)下列分子或离子中,中心原子采用sp杂化轨道成键的是()A.CO2B.C2H4C.SO3D.NO参考答案:A26.(1.5分)实验室中配制KCN溶液时,为了防止KCN水解,应先加()A.HClB.KClC.KOHD.H2O参考答案:C27.(1.5分)下列叙述正确的是()A.溶度积大的难溶盐,其溶解度肯定大。
中医药大学远程教育《有机化学Z》作业及答案
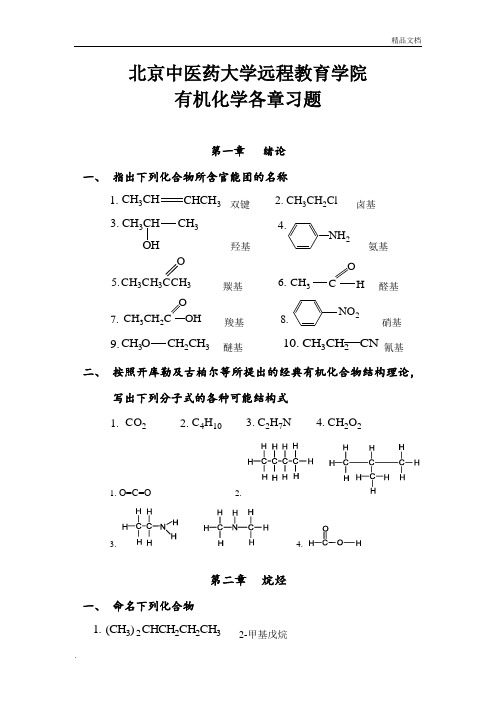
北京中医药大学远程教育学院有机化学各章习题第一章 绪论一、 指出下列化合物所含官能团的名称CHCH 3CH 3CH 1. 双键 CH 3CH 2Cl 2. 卤基 CH 3CH 3CHOH3. 羟基2氨基5.CH 3CH 3CCH 3O羰基 CH 3OCH 6. 醛基CH 3CH 2C OOH 7. 羧基NO 28.硝基CH 3CH 2CH 3O9. 醚基 CH 3CH 2CN 10. 氰基二、 按照开库勒及古柏尔等所提出的经典有机化合物结构理论,写出下列分子式的各种可能结构式CO 21. C 4H 102. C 2H 7N 3. CH 2O 24.1. O=C=O2.3. 4.第二章 烷烃一、 命名下列化合物(CH 3)CHCH 2CH 2CH 321. 2-甲基戊烷CH 3CH 2C(CH 3)2CH 2CH 32. 3, 3-二甲基戊烷(C 2H 5)2C(CH 3)CH 2CH 33. 3-甲基-3-乙基戊烷CH 3CH 2CH(CH 3)CH(CH 3)CH(CH 3)24. 2, 3, 4-三甲基己烷CH 3CH 2CH(CH 3)CH 2CHCH 2CH 3CH 2CH 3CH 25. 3-甲基-5-乙基辛烷(CH 3)3CCH 2C(CH 3)26. 2, 2, 4-三甲基戊烷 (CH 3)2CHCH 2CH 2CH(CH 2CH 3)27. 2-甲基-5-乙基庚烷 (CH 3)2CHCH(CH 3)CH 2C(CH 2CH 3)2CH 38. 2, 3, 5-三甲基-5-乙基庚烷 (CH 3)2CHC(C 2H 5)2CH 2CH 2CH 39. 2-甲基-3, 3-二乙基己烷CH 3CH 10.CH 2CH 3CHCH 3CH 2CH 2CH 3CH 33-甲基-4-异丙基庚烷二、 写出下列化合物的系统名称1.2.3.丙烷 丁烷 异丁烷4.5.6.2, 2-二甲基丙烷 2, 3-二甲基丁烷 3-乙基戊烷三、写出下列化合物的结构式 1. 2,2,3,3—四甲基戊烷2. 2,3—二甲基丁烷3. 3,4,4,5—四甲基庚烷4. 3,4—二甲基—4—乙基庚烷5. 2,4—二甲基—4—乙基庚烷6. 2,5—二甲基己烷7. 2—甲基—3—乙基戊烷8. 2,2,4—三甲基戊烷9. 3,4—二氯—2,5—二甲基己烷 10. 5—(1,2—二甲基丙基)—6—甲基十二烷第三章 烯烃一、 用系统命名法命名下列化合物CH 3CH 2CH 2CCH 2CH 321. 2-乙基-1-戊烯CH 3CH 2CCH 32.CH 22-甲基丁烯CH 3CHCH 2CH CHCH 3CHCHCH 333. 6-甲基-4-乙基-2-庚烯CH 3CH 2CHCHCH 2CH 2CH 34. 3-庚烯二、 写出下列化合物的结构式1. 四乙基乙烯2. 对称二乙基乙烯3. 不对称甲基乙基乙烯4. 2,3,3,4—四甲基—1—戊烯三、 完成下列反应式,写出主要产物的结构式第四章 炔烃和二烯烃一、 用系统命名法命名下列化合物CH 3CCCH 31. 2-丁炔 CHCCH 2CH 32. 1-丁炔CH 3CHCH 2CCHCH 33. 4-甲基-1-戊炔CH 2CHCH 2CH 2CCH 4. 1-己烯-5炔CH 3CH 3CCH 3CHCH 25. 3, 4-二甲基-1, 3-戊二烯CH 3CC C CHCH 2CH 3CHCH 26. 4-乙烯基-4-庚烯-2-炔CH 3HC3HCC CC CH 3CH 3CH 37. 2, 2, 5-三甲基-3-己炔C CC CH 3CH 3CH 3CH 28.4,4-二甲基-1-苯基-1-戊炔二、 写出下列化合物的结构式1. 4—甲基—2—戊炔2. 3—甲基—3—戊烯—1—炔3. 二异丙基乙炔4. 1,5—己二炔5. 1—溴—1—丁炔6. 乙烯基乙炔7. 4—十二碳烯—2—炔8. 3—甲基—3—戊烯—1—炔三、 完成下列反应式,写出主要产物的结构式第五章 脂肪烃一、 用系统命名法命名下列化合物1.4-环丙基-1-丁烯2.5-甲基-4-环丙基-2-庚烯二、写出下列化合物的结构式1. 环己基环己烷2. 二螺[5,1,6,2]十六烷第六章 芳香烃一、 命名下列化合物C CH 3CH 3CH 31.CH 3Cl2.C 2H 5NO 23.NO 2NO 24.COOH叔丁基苯 4-氯甲苯 4-硝基乙苯 3, 4-二硝基苯甲酸CH 2OH5.CCHCH 3CH 36.7.苯甲醇 2-苯基-2-丁烯 环己基苯二、 写出下列化合物的结构式1. 间二硝基苯2. 对溴硝基苯3. 对羟基苯甲酸4. 2,4,6—三硝基苯酚5. 对氯苄氯6. 3,5—二硝基苯甲酸三、 完成下列反应式四、 以苯为原料合成下列化合物ClCH 31.ClNO 22.CNO 2OH O SO 3H3.4.CH(CH 3)2CCH 3O第七章卤代烷烃一、命名下列化合物1.CH3CH CH CHCH3CH3Cl CH31.2,4—3—氯—二甲基戊烷CH3CH CH CHCH3CH3ClCH32.3, 4-二甲基-2-氯戊烷CH2CH2CH2CH2BrBr3.1,5—二溴戊烷Cl4.1—氯环戊烷氯代环戊烷CHC l35.三氯甲烷(氯仿)二、写出下列化合物的结构式1. 烯丙基溴2. 1—氯—2—苯基—乙烷3. 间—氯乙苯4. 4—溴—2—甲基—3—乙基戊烷5. 3—氯环己烯第八章 醇、酚、醚一、 命名下列化合物3OH1.3—甲基环己醇OH 3HC2.1—甲基环戊醇1.CH 3CCH 2CH 2CH 3OHCH 2CH 33. 3—甲基—3—己醇CH 3CH 2CH 2CH 2CH 2CH 2OH 4. 1—己醇CH 3CHCH 2CH 2CH 3OH5. 2—戊醇二、写出下列化合物的结构式 1. 甲基乙基醚2. 乙基异丙基醚3. 戊醇—24. 4—甲基环己醇5. 邻氯苯酚三、完成下列反应式,写出主要产物的结构式CHCH 2CH 2OH CH 3CH 3PBr 1.OHSOCl 22.CH 2OHHONaOH/H 2O3.CH 3CH 2CH 2CH 2OH[O]4.CH 3CH 2CHOH CH 3HCl(ZnCl 2)5.+第九章 醛、酮、醌一、 用系统命名法命名下列化合物CH 3CH 2CH 2CH 2CH 2COH 1.己醛CH 3CH 2CHCH 2CH 2CH 2C H3O2. 5—甲基庚醛CH 3CHCH 2CH 2CH 2CHCH 3O3. 5—甲基己醛CH 3C OCH 2CH 2CH 34. 2—戊酮 戊酮—2CH 3CHCH 23O5.CH 34—甲基—2—戊酮O O 6.对苯醌OO 7.邻苯醌二、写出下列化合物的结构式1. 2—甲基乙醛2. 异丁醛3. 3—甲基辛醛4. 3—甲基庚酮—25. 氨基脲6. 苯甲醛7. 环己酮8. 苯乙醛三、完成下列反应式,写出主要产物的结构式CHO + Br乙酸1.CHO+ I 2 + NaOH2.(不反应)CHO+ NaBH 3.4.CH 3CH 2CH 2CCH 3O+ HCN5.CH 3CH 2CCH 2CH 3O+ H 2N OH6.CH 3CH 2CH 2CCH 2CH 3O+ H 2NNHCH 3CH 2CH 2CCH 2CH 3N NHCH 3CH 2CHOKMnO 47.8.CH 3CH 2CH 2CH 2CH 2O+ NaHSO 3H第十章 羧酸及其衍生物一、 用系统命名法命名下列化合物OHOCH 3CHCHCH 2CH 2CH 2C H 3C CH 31. 5,6—二甲基庚酸OOH CH 3CH 2CH 2CH 2CH 2CH 2C2. 庚酸OHCH 33.OCH 2C C 2—甲基丙烯酸4.CH 3CH 2CHCOClBr2—溴丁酰氯C C 5.O O O邻苯二甲酸酐OCH 2CH 3CH 3C CH 2C O 6.O乙酰乙酸乙酯CH 3CH 3CH 2C O7.NHN —甲基丙酰胺CH 3CH 2CCH 3O8.CO O乙丙酸酐二、写出下列化合物的结构式1. 3—甲基庚酸2. 2—甲基—3—乙基辛酸3. 丁二酸酐4. 邻苯二甲酸酐5. 丙酸乙酯6. N ,N —二乙基乙酰胺7. 异丁酰氯8. 邻甲基苯甲酰溴三、完成下列反应式,写出主要产物的结构式CH 3CH 3COOH + HOCH 2CH1.2.CH 3CH 2C CH 3CH 2COO+ HOCH 2CH 33.OOC C OH OHHCOCH 2CH 2CH 3O4. + NH 3C OO CH 3H 3CC O5.+CH 2OHOCH 3CCl +HOCH 2CH 2CH 6.OCH 3CH 2CNH 2+CH 3CH 2CH 2OH7.OCH 2OHC8.+OH+第十一章 取代羧酸一、 用系统命名法命名下列化合物CH 3CHCH 2CHCCH 3ClOHO1. 2—氯—4—甲基戊酸CHCCH 3ClOO2.CH 2CH 3CH 3CH 2CH 2C2—氯—3—甲基己酸乙酯CHC OHO3.CH 3CH 222—氨基丁酸CCH 3OO4.CH 2CH 2CHCH 3CH 2CHCH 3CH 32—甲基丁酸异戊酯CH 2COCH 25.O 苯乙酸苯甲酯二、写出下列化合物的结构式1. 乙酰乙酸乙酯2. 苯甲酸苯酯3. 3—氯丁酸乙酯4. α—氨基戊酸5. β—甲基戊酰氯三、完成下列反应式,写出主要产物的结构式1.Cl+ H 2O OH CH 3CH 2CHCOCOHO2.CH 3CCH 2CH 2OCOH O3.CH 3CH 2+OH4.+OCH 2CH 3CH 3CCH 2OO Br 2/Cl 2NHCH 3CCH 2COCH 2CH 3OO +H 2N5.NH5.OCH 2CH 3NHOHCCH 3CH 2C O第十二章 糖类1. 葡萄糖的半羧醛羟基是(A )。
北京中医药大学远程教学教育《无机化学Z》课后复习1规范标准答案

A 型题:1.启酬5加到饱和的鉅口晰中会4. 磁式MgQHb +亦「=耐芒+2阳加0化学平衝救尤%5. 下列溶液哪个是缓冲溶液尺 A ^l 尬记・ MH25 M +0.1 血乩・ L^HAc^O mlQ B u.2mol ・ L _1 Ma.0H23 ml+0」tnol ・ L^HA^D ml「 c tU mhL- C MaC125 n!+0.2 tn ol • L _1MH 4C150 ml「c 由于NCT 和昨+离子之1间的引力而曾。
直備的滔解JEQ D 履平衡直/1(Q I 盘/ 3)+ cr (aq)移向由右方.2.沉淀完全的标准一般认为是可A 「二上匚 X —「「・「「B.被沉注的离子在f 容緞中剩余浓度AiLmoi ・L t c.被沉淀的离子衽溶液中乘谢农區血1・L0 D.被沉粽的禽子禹容液中乘廉蔽度在IO-5 -10-5讹・LE.以上均非3.向500 ml O.liRdl- L _1KC1溶液中加500 nl 0.1 m d • L _,AgNO 3>形朕的混舍沼液中NO 厂 的济度是F A.菖B.0H 「 陛c 滅何0u. 2 mol ■ L 1E .52k A .•肿心『k B .曲/加巨尹翹加鋅A.使更多的AgCI 沉淀B降低氏股1的疋即僞E.以上都不是C DLJ.l molnl-HJ.lmd ・ 17也血c 23 2 0.1 mol ・ L_1NaOH25 ml-W.l mol ・ L _l HAc2J ml6.对于缓冲能力较大的缓冲溶液,它们的 pH 值最主要是由下列哪一种因素决定1RFjRT1RTB.缓冲对的浓度比C.溶液的温度AD.溶液的总浓度「 E.溶液的活度7. 盐效应能使难溶电解质的电离度8. ・陆的度芮它的落度积是 「A . 4 乂 Z 广 B Y K粧 c.3』X 10'11Q D .梵6 X 1沖rE .S X 1严己知Str 叫 也因CrO*疋$・1」小0川9. 在含有等液厦的CO?-和①一的泯合潯液中逐滴加入密6时,所发生的现辣是"A.先产生AgCl 沉淀广B . 盘啄口沉浣l C.两者同时产生沉淀區D.两者都不产生沉淀□ E.两者同时水解10. 在HAc 溶液中加入NaCI ,使HAc 电离度增大,这种现象称为11. 可以作为衡量缓冲溶液能力大小的是12. 沉淀溶解的条件「A 便溶版中离子浓度爲诜方乘积严〉號 广B I®飜中离子浓®S 次方乘积鬲9A •缓冲(共轭)对之间的电离常数 C.盐效应D.同离子效应E.缓冲作用A.缓冲对B.缓冲比 .缓冲溶液浓度 D.缓冲容量 E.缓冲溶液总量A.增大B.减小C.无影响D.先增大,后减小E.先减小,后增大.水解作用*鱼C 便溶瓶中离子浓度竊怛方乘讯护 <氐°Q D.便i 飜中禽子i 繼竊文方乘积/一席之间p E.以上均非14. 匚需5在O.lrnol ・L-l NaNO3中的®8?度比它在纯水中的溶解度15. 如果g 心口)承的饱和洛液的浓度xuxi 严就1・「具疋r 嵐A. L1決血中 广B. 1-2天gY 广C . l.s X)C D . 1丄 x 丄严 广 E . 1.0 x io _w16. HAc 的电离常数为 Ka 0,在HAc 溶液中加入NaAc 固体,将使17. 一元弱酸强碱盐的水解常数可以表示为18. 在HAc 溶液中加入固体 NaCI ,使其溶解,可使已孙AgAS 和AgClffl^^别齿10 X 1严1和1.0 x 10'^,向一舍有匚心谕 19. CT 的®阪中加入AgHS ,则()广人人奈心先沉淀出来厂B 銚先沉淀出来19-tlffi 质子论,皿站的共瘢是A C .HP 屮「D .PO FA.略有减少E.无法判断A.Ka 0变大區B.Ka 0变小E HAc 的电离度增大A. B.A.溶液酸性降低B.HAc 电离度增大C.HAc 电离度减小D.醋酸溶解度增大E.没有影13.B .H 时B.略有增大C.相等D.小C.pH 值升高D.PH 值降低E陰J 空七C C.包典心 部倾淀后,總d 才开始沉淀 t D. AgCl 先况淙韶分云A/心开始沉涯 F E 离子的浓庫积先!±^&;首先沉淀20. NaAc 固体加到HAc 溶液中去,将使 HAc 的21.实師法度为0」mcl-L-^MaClS^其有效浓度* 0 .078 mol • L -1,对此现竦最冶当的解E.以上说法都不对22. H 3PO 4的三级电离常数分别是 Ka i e 、Ka 2e 、Ka 3e ,总电离平衡常数为 Ka e ,。
无机化学在线作业答案

单选题1.溶胶发生电泳时,向某一方向定向移动的是()。
• A 胶核• B 吸附层• C 胶团• D 胶粒正确答案:D单选题2.误差的正确定义是()。
• A 测量值与其算术平均值之差• B 含有误差之值与真值之差• C 测量值与其真值之差• D 错误值与其真值之差正确答案:C单选题3.属于随机误差的是()。
• A 滴定终点与化学计量点不一致• B 把滴定管的读数22.45读成22.46• C 用纯度为98%的CaCO3标定EDTA标准溶液的浓度• D 称量时把1g的砝码看成2g正确答案:B单选题4.称取同样质量的两种难挥发的电解质A和B,分别溶解在1升水中,测得A溶液的凝固点比B溶液的凝固点低,则()。
• A B的分子量小于A的分子量• B A的分子量和B的分子量相同• C B的分子量大于A的分子量正确答案:C单选题5.最易于形成配离子的金属元素位于周期表中的()。
• A p区• B d区和ds区• C s区和p区• D s区正确答案:B单选题6.两成键原子的原子轨道沿核间连线以“肩并肩”方式重叠形成()。
• A σ键• B 离子键• C Π键• D 氢键正确答案:C单选题7.从精密度好就可以断定分析结果可靠的前提是()。
• A 随机误差小• B 系统误差小• C 平均偏差小• D 标准偏差小正确答案:B单选题8.在配制FeCl3溶液时,为防止溶液产生沉淀,应采取的措施是()。
• A 加碱• B 加酸• C 多加水• D 加热正确答案:B单选题9.下列说法错误的是()。
• A 方法误差属于系统误差• B 系统误差又称可测误差• C 系统误差服从正态分布• D 系统误差具有单向性正确答案:C单选题10.在定量分析中,精密度与准确度之间的关系是()。
• A 精密度高,准确度必然高• B 准确度高,精密度也就高• C 精密度是保证准确度的前提• D 准确度是保证精密度的前提正确答案:C单选题11.HCl和H2O两分子间形成的分子间作用力有()。
北京中医药大学远程教育《有机化学Z》综合复习题答案

北京中医药大学远程教育学院有机化学综合复习题一、选择题1.下列化合物中能与多伦Tollen试剂发生银镜反应的是:A2.下列化合物中有旋光性的是:C,DA.CH32CHCH2CH2CH2CH2OHB.CH3COCH2CH3C.CH3CH2CHCH3 CH2OHD.CH3CHClCOOH3.丁烷的构象中,能量最低的是:CA.全重叠式B.部分重叠式C.对位交叉式D.邻位交叉式4.下列化合物中能与水分子形成氢键的是:B,DA.CH3CH2CH2CH2CH2CH2ClB.CH3CH2CH2CHOC.CH3CH2CH2CH2CH2CH2CH3D.CH3CH2CH2CH2CH2OH5.顺反异构体的表示方法是:BA.+/-B.Z/EC.R/SD.D/L6.下列化合物中能发生碘仿反应的是:B,CA.HCHOB.CH3CH2CH2COCH3C.CH3CH2CH2CHOHCH3D.CH3OH7.与卢卡斯lucas试剂发生反应速度最快的是:BA.CH32CHOHB.CH33COHC.CH3CHOHCH2CH2CH3D.CH3CH2CH2CH2OH8.与卢卡斯lucas试剂发生反应速度最慢的是:DA.CH32CHOHB.CH33COHC.CH3CHOHCH2CH2CH3D.CH3CH2CH2CH2OH9.在芳香烃取代反应中,起致活作用的基因是:B,D10.在芳香烃取代反应中,起致钝作用的基因是:A11.下列化合物中能与KMnO4 水溶液反应的是:D12.下列化合物中能与AgNO3水溶液反应最快的是:CA.氯仿B.氯苯C.氯化苄D.氯乙烷13.Cl中的氯原子不活泼,是因为氯原子与苯环发生了:AA.P─π共轭B.π─π共轭C.α─π超共轭D.α─P超共轭14.下列化合物中能与溴水发生白色沉淀的是:B,CA.乙炔B.苯酚C.苯胺D.乙烯15.判断化合物具有旋光性的条件是:DA.分子的偶极距等于零B.分子中有无对称因素C.分子中有无互变异构体D.分子中有无手性碳16.最稳定的自由基中间体是:D17.能与溴水发生使其褪色的反应是:BA.果糖B.葡萄糖C.蔗糖D.淀粉18.F-C反应通常在:DA.无水乙醚中进行B.低温条件下进行C.Fe粉加盐酸D.无水三氯化铝催化下进行19.乙酰乙酸乙酯与FeCl3溶液显紫色,因为它具有: BA.旋光异构现象B.互变异构现象C.同分异构现象D.顺反异构现象20.葡萄糖的半羧醛羟基是:AA. C1OHB. C2OHC. C3OHD. C4OHE. C6OH21.下列化合物不能与重氮苯发生偶联反应的是:B22.格氏试剂是:B, C二、写出下列化合物的结构式1.N,N—二丁基苯乙酰胺2.N—甲基—N—异丙基苯乙胺3.N—乙基苯甲胺4.异丁酸丙酯5.丙酸异丙酯6.氯化三乙正丙胺7.β—萘乙酰胺8.α—甲基戊酐9.4,6—二羟基嘧啶10.3—吲哚乙酸11.丁二酰氯12.3,5—二甲基吡啶13.3—甲基邻苯二甲酸酐14.乙烯基乙炔15.乙基异丙基乙炔16.甲基乙基乙炔17.3,5—二溴—2—硝基甲苯18.2—硝基—对甲苯酚19.2—硝基—对甲苯磺酸20.R—2—丁醇21.S—2—丁硫醇22.苯基叔丁基醚23.苯甲基丁基醚24. 2,4—己二酮25. 3—苯基丙烯醛26. 环己醇27. β,β′—二溴乙醚28. 1,3—丁二烯29. 3—甲基辛醛30. 呋喃甲醛三、 用系统命名法命名下列化合物CH 2CH 2CH 2CH 2CH 2CH 31.CHCH 3CHO 2—甲基辛醛2.CHCH 3CH 2CH 2CH 3CH 2—己烯 3.CH CH 3CH 2CH 3CH 2 2—戊烯4.C C CH 3CH 2CH 3 2—戊炔OHCH 2CH 2CH 2CHCH 2CH 35.CH 3CH 2 3—辛醇CHCH 2CH 2CH 2CH 36.CH 3CH 2Br3—溴庚烷7.环己烯8.螺〔2,4〕庚烷CH 2CHCH 2CHO 10. 3—丁烯醛11.萘OH 12.萘酚13.菲14.OCH 2CH 3苯乙酯15.COOH苯甲酸16.CH 2COOH苯乙酸217.2O22,3-二硝基苯肼H18.N六氢吡啶19.C O CH2O苯甲酸苯甲酯20.C NHCH2CH3CH2ON-乙基苯乙酰胺21.N吡啶22.N喹啉H23.N吡咯24.S噻吩OHN 25.N 对羟基偶氮苯NH 2N 26.N 对氨基偶氮苯 OH27.BrBrBr 2,4,6-三溴苯酚N CH 328.CH 2CH 3N-甲基-N-乙基苯胺CHO29.O 2-呋喃甲醛30.CH 3CH 2C OCH 2CH 2CH 2CH 3O丙酸丁酯四、 完成下列反应,写出主要产物的结构式五、 由所给指定原料完成下列化合物1. 由乙酰乙酸乙酯合成3—甲基—2—戊酮解:3-甲基-2-戊酮可看成是一个甲基和一个乙基二取代的丙酮;按照先大后小的原则,先引入乙基,后引入甲基,经酮式分解,即得所需产物;2. 由乙酰乙酸乙酯合成α—甲基戊酸3. 由乙酰乙酸乙酯合成3—乙基—2—己酮4.由乙酰乙酸乙酯合成2—乙基庚酸5.由丙二酸二乙酯合成戊酸6.由格氏试剂合成辛醇—47.由苯合成对溴苯甲酸8.由苯合成间溴苯甲酸9.由苯合成2—溴—4—硝基甲苯10.由苯合成3—氯—4—异丙基苯磺酸11.由苯合成3—甲基—4—溴苯甲酸12.由苯合成3—乙基—4—氯苯甲酸13.由苯合成3—溴—4—叔丁基苯磺酸14.由苯合成2—苯基—4—硝基乙苯15.由苯合成2—苯基—4—磺酸基苯甲酸六、有机化学实验基本操作1.回流解:①冷凝管的选用:回流时多选用球形冷凝管,若反应混合物沸点很低或其中有毒性大的原料或溶剂时,可选用蛇形冷凝管;②热浴的选用:回流加热前应先放入沸石,根据瓶内液体的沸腾温度,可选用水浴、油浴、空气浴或电热套加热等方式;③回流速率:回流速率应控制在液体蒸气浸润不超过两个球为宜④隔绝潮气的回流装置:某些有机化学反应中水汽的存在会影响反应的正常进行如使用格氏试剂、无水三氯化铝来制备化合物的实验,则需在球形冷凝管顶端加干燥管干燥管内填装颗粒状的干燥剂;⑤有气体吸收装置的回流:此操作适用于反应时有水溶性气体如氯化氢、溴化氢、二氧化硫等气体产生的实验⑥其它回流装置:a有分水器的回流如正丁醚合成;b有搅拌器和滴加液体反应物装置的回流回流提取法操作:可以根据所需提取化合物的类型采用各种相应的溶剂,取适量粉碎后的药材放于烧瓶内,加入溶剂高于药材约2厘米,总体积不能超过烧瓶容量的2/3,加热回流提取三次,第一次回流时间约2小时,第二、三次各1小时;回流提取法适用于对热稳定的化合物的提取,加热提取效率较高;2.蒸馏解:蒸馏操作是化学实验中常用的实验技术,一般应用于下列几方面:①分离液体混合物,仅对混合物中各成分的沸点有较大的差别时才能达到较有效的分离;②测定纯化合物的沸点;③提纯,通过蒸馏含有少量杂质的物质,提高其纯度;④回收溶剂,或蒸出部分溶剂以浓缩溶液;蒸馏实验操作:a、加料:将待蒸馏液通过玻璃漏斗小心倒入蒸馏瓶中,要注意不使液体从支管流出;加入几粒助沸物,安好温度计,温度计应安装在通向冷凝管的侧口部位;再一次检查仪器的各部分连接是否紧密和妥善;b、加热:用水冷凝管时,先由冷凝管下口缓缓通入冷水,自上口流出引至水槽中,然后开始加热;加热时可以看见蒸馏瓶中的液体逐渐沸腾,蒸气逐渐上升;温度计的读数也略有上升;当蒸气的顶端到达温度计水银球部位时,温度计读数就急剧上升;这时应适当调小煤气灯的火焰或降低加热电炉或电热套的电压,使加热速度略为减慢,蒸气顶端停留在原处,使瓶颈上部和温度计受热,让水银球上液滴和蒸气温度达到平衡;然后再稍稍加大火焰,进行蒸馏;控制加热温度,调节蒸馏速度,通常以每秒1~2滴为宜;在整个蒸馏过程中,应使温度计水银球上常有被冷凝的液滴;此时蒸馏的温度即为液体与蒸气平衡时的温度,温度计的读数就是液体馏出物的沸点;蒸馏时加热的火焰不能太大,否则会在蒸馏瓶的颈部造成过热现象,使一部分液体的蒸气直接受到火焰的热量,这样由温度计读得的沸点就会偏高;另一方面,蒸馏也不能进行得太慢,否则由于温度计的水银球不能被馏出液蒸气充分浸润使温度计上所读得的沸点偏低或不规范;c、观察沸点及收集馏液:进行蒸馏前,至少要准备两个接受瓶;因为在达到预期物质的沸点之前,带有沸点较低的液体先蒸出;这部分馏液称为“前馏分”或“馏头”;前馏分蒸完,温度趋于稳定后,蒸出的就是较纯的物质,这时应更换一个洁净干燥的接受瓶接受,记下这部分液体开始馏出时和最后一滴时温度计的读数,即是该馏分的沸程沸点范围;一般液体中或多或少地含有一些高沸点杂质,在所需要的馏分蒸出后,若再继续升高加热温度,温度计的读数会显着升高,若维持原来的加热温度,就不会再有馏液蒸出,温度会突然下降;这时就应停止蒸馏;即使杂质含量极少,也不要蒸干,以免蒸馏瓶破裂及发生其他意外事故;d、蒸馏完毕,应先停止加热,然后停止通水,拆下仪器;拆除仪器的顺序和装配的顺序相反,先取下接受器,然后拆下尾接管、冷凝管、蒸馏头和蒸馏瓶等;操作时要注意:⑴在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸;⑵温度计水银球的位置应与支管口下缘位于同一水平线上;⑶蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于1/3;⑷冷凝管中冷却水从下口进,上口出;⑸加热温度不能超过混合物中沸点最高物质的沸点;3.分馏解:分馏操作:⑴选用合适的热浴加热,当液体沸腾后及时调节浴温,使蒸气在分馏柱内慢慢上升,约10~15min后蒸气到达柱顶可用手摸柱壁,若柱温明显升高甚至烫手时,表明蒸气已到达柱顶,同时可观察到温度计的水银球上出现了液滴⑵当有馏出液滴出后,调节浴温,控制馏速每2~3秒1滴;⑶待低沸点液体蒸完后,再渐渐升高温度,按沸点收集第一、第二……组分的馏出液,收集完各组分后,停止分馏;注意事项:⑴分馏一定要缓慢进行,要控制好恒定的蒸馏速度;⑵选择合适的回流比,使有相当量的液体自分馏柱流回烧瓶中;⑶分馏柱的外围应用石棉绳包住以尽量减少分馏柱的热量散失和波动;⑷为了分出较纯的组分,可进行第二次分馏;4.减压蒸馏减压蒸馏操作:⑴安装仪器完毕后检查系统压力;若达不到所要求的压力则分段检查各部分尤其是各连接口处,并在解除真空后,用熔融的石蜡密封,直至达到所需的真空;⑵慢慢旋开安全瓶上活塞,放入空气,直到内外压力相等为止;⑶加入液体于克氏蒸馏烧瓶中液体体积﹤烧瓶容积的1/2关好安全瓶上的活塞,开泵抽气,调节毛细管导入空气,使液体中有连续平稳的小气泡通过;⑷开启冷凝水,选用合适的热浴加热蒸馏;此时应注意:a、克氏蒸馏烧瓶的圆球部位至少应有2/3浸入浴液中;b、浴液中放一温度计,控制浴温比待蒸馏液体的沸点约高20~30℃使馏速1~2滴/sc、经常注意瓶颈上的温度计和压力的读数;d、记录压力、沸点等数据;e、若有需要,小心转动多尾接液管,收集不同馏分;⑸蒸馏完毕,除去热源,慢慢旋开毛细管上的螺旋夹,并慢慢打开安全瓶上的活塞,平衡内外压力,使测压计的水银柱缓慢地恢复原状,然后关闭抽气泵;注意事项:1关闭抽气泵前,若过快旋开螺旋夹和安全瓶上的活塞,则水银柱会很快上升,有冲破压力计的可能;2若不待内外压力平衡就关闭抽气泵,外压会使油泵中的油反倒吸入干燥塔;3减压蒸馏过程中务必戴上护目眼镜;5.重结晶解:重结晶提纯法的一般操作方法:选择溶剂→溶解固体→热过滤除杂质→晶体析出→抽滤,洗涤晶体→干燥1选择溶剂应特别注意:a、溶剂与被提纯的有机物不反应b、被提纯的有机物易溶于热溶剂中不易溶于冷溶剂中c、溶剂对杂质的溶解大很大杂质留在母液中或很小热过滤时除去杂质d、价廉易得,毒性低2溶解固体a、一般使用所需溶剂量的120%左右的溶剂;b、若使用有机易燃、低沸点或有毒溶剂,应在锥形瓶上装置回流冷凝管3热过滤除杂质a、必须熄灭火源再进行热过滤b、过滤前要把短颈玻璃漏斗在烘箱中预先烘热c、过滤前先用少量热溶剂润湿折叠滤纸,以免干滤纸吸收溶剂,使结晶析出堵塞漏斗颈d、过滤时,漏斗上应盖上表面皿,以减少溶剂的挥发e、应用毛巾等物包住热的容器,以免烫伤或忙乱4晶体折出a、不要急冷和剧烈搅动滤液,以免晶体过细,使晶体因表面积大而吸附杂质多b、若溶液不结晶,可投"晶种"或用玻棒摩擦器壁5抽滤洗涤晶体a、抽滤接近完毕时,用玻璃钉挤压晶体,以尽量除去母液b、布氏漏斗中的晶体要用少量溶剂洗涤,以除去存在于晶体表面的母液6.升华解:最简单的常压升华装置如下图所示;在蒸发皿中放置粗产物,上面覆盖一张刺有许多小孔的滤纸;然后将大小合适的玻璃漏斗倒盖在上面,漏斗的颈部塞有玻璃毛或脱脂棉,以减少蒸汽逸出;在石棉网上渐渐加热蒸发皿最好能用沙浴或其它热浴,小心调节火焰,控制浴温低于被升华物质的熔点,使其慢慢升华,蒸汽通过滤纸小孔上升,冷却后凝结在滤纸上或漏斗壁上;必要时外壁可用湿布冷却;。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A型题:
1.
A.使更多的AgCl沉淀
B.
C.
D. E.以上都不是。
2. 沉淀完全的标准一般认为是
A.
B.
C.
D. E.以上均非
3.
A. B. C.
D. E.
4.
A. B. C. D.
E.
5. 下列溶液哪个是缓冲溶液
A.
B.
C.
D.
E.
6. 对于缓冲能力较大的缓冲溶液,它们的pH值最主要是由下列哪一种因素决定
A.缓冲(共轭)对之间的电离常数
B.缓冲对的浓度比
C.溶液的温度
D.溶液的总浓度
E.溶液的活度
7. 盐效应能使难溶电解质的电离度
A.增大
B.减小
C.无影响
D.先增大,后减小
E.先减小,后增大
8.
A. B. C.
D. E.
9.
A.先产生AgCl沉淀
B.
C.两者同时产生沉淀
D.两者都不产生
沉淀 E.两者同时水解
10. 在HAc溶液中加入NaCl,使HAc电离度增大,这种现象称为
A.酸效应
B.水解作用
C.盐效应
D.同离子效应
E.缓冲作用
11. 可以作为衡量缓冲溶液能力大小的是
A.缓冲对
B.缓冲比
C.缓冲溶液浓度
D.缓冲容量
E.缓冲溶液总量
12. 沉淀溶解的条件
A.
B.
C.
D. E.以上均非
13.
A. B. C.
D. E.
14.
A.略有减少
B.略有增大
C.相等
D.小
E.无法判断
15.
A. B. C.
D. E.
16. HAc的电离常数为Kaθ,在HAc溶液中加入NaAc固体,将使
A.Kaθ变大
B.Kaθ变小
C.pH值升高
D.pH值降低
E.HAc的电离度增大
17. 一元弱酸强碱盐的水解常数可以表示为
A. B. C. D.
E.
18. 在HAc溶液中加入固体NaCl,使其溶解,可使
A.溶液酸性降低
B.HAc电离度增大
C.HAc电离度减小
D.醋酸溶解度增大
E.没有影响
19.
A. B.
C.
D.
E.
20. NaAc固体加到HAc溶液中去,将使HAc的
A.Kaθ变大
B.Kaθ变小
C.电离度增大
D.电离度减小
E.HAc—的水解度增大
21.
A.NaCl部分电离
B.NaCl与水发生了反应
C.离子间的相互牵制
D. E.以上说法都不对
22. H3PO4的三级电离常数分别是Ka1θ、Ka2θ、Ka3θ,总电离平衡常数为Kaθ,。
下列那些表达式是正确的?
A.Kaθ =Ka1θ·Ka2θ·Ka3θ
B.Kaθ =Ka1θ+Ka2θ+Ka3θ
C.Kaθ =Ka1θ·Ka2θ/Ka3θ
D.Kaθ =3(Ka1
θ·Ka2θ·Ka3θ) E.Kaθ =3(Ka1θ·Ka2θ·Ka3θ)
23.
A. B. C.
D. E.
24.
A. B. C.
D. E.
25.
A.略有减少
B.略有增大
C.相等
D.小
E.无法判断
26.
A. B. C.
D. E.
27. 在NaHCO3溶液中。
要使CO32-离子的浓度显著增大最好的办法是
A.加HCl
B.加NaOH
C.加KCl
D.加H2CO3
E.加H2O
28.
A.13
B.0.13
C.1.3
D.1.3%
E.13%
29.
A.82
B.1/82
C.相等
D.50
E.1/50
30. 一定温度下难溶电解质有关离子浓度的幂的乘积称为溶度积
A.稀溶液
B.饱和溶液中
C.溶液中
D.平衡溶液
E.以上都不是
31.
A.HAc —NaAC
B.
C.HCN—NaCN
D.HAc—NaCN
E.
32.
A. B. C.
D. E.这些都不是
33.
A. B. C. D.
E.
34. 下列说法正确的是
A. B. C.同一弱电解质的
溶液,浓度小的,电离度大 D.同一弱电解质的溶液,浓度大的,电离常数小 E.电离度大的弱电解质溶液,电离出的离子浓度
35.
A.酸碱反应
B.配位反应
C.氧化还原反应
D.电解反应
E.分解反应
36.
A. B. C.
D. E.
37. 同离子效应能使难溶强电解质的溶液变
A.增大
B.减小
C.不变
D.先增大,后减小
E.先减小,后增大
38.
A.9.20
B.4.75
C.9.37
D.2.37
E.2.87
39.
A.9.25
B.4.75
C.2.38
D.2.88
E.11.12
40. 在H2S饱和溶液中,下列表达式哪个是错误的?Ka1θ、Ka2θ表示H2S一、二级电离常数
A.[ H+ ] = 2 [ S2- ]
B.[ H+ ]2 [ S2- ]= Ka1θ ·Ka2θ [H2S]
C.Kwθ = [ H+ ] [ OH- ]
D.[H2S]/
([ H+ ]2 [ S2- ]) = 1/ (Ka1θ ·Ka2θ ) E.
B型题:
A. B. C. D. E.
41. 浓度不影响其水解的是
A B C D E
42. 加酸可抑制其水解的是
A B C D E
A. B.
C. D.
E.
43. 酸溶反应的平衡常数大小取决于
A B C D E
44. 酸溶反应进行得就越彻底取决于
A B C D E
A.越大
B.越小
C.保持不变
D.逐渐变大
E.以上说法都不对
45. 沉淀转化反应中,沉淀转化反应就越难进行说明平衡常数
A B C D E
46. 沉淀转化达平衡常数时,此时平衡常数
A B C D E
A. B. C. D.
E.
47. 近似计算弱碱强酸盐溶液pH值的通式是
A B C D E
48. 近似计算NaHCO3溶液pH值的通式是
A B C D E
A.增大
B.无变化
C.降低
D.增大的数据项等
E.以上均非
49. 盐效应可使难溶电解质的溶解度
A B C D E
50. 盐效应可使弱电解质的电离度
A B C D E
A. B. C.
D. E.
51. 不发生水解的盐是
A B C D E
52. 水解最严重的盐是
A B C D E
A.同离子效应
B.水解效应
C.酸效应
D.盐效应
E.螯和效应
53.
A B C D E
54.
A B C D E
A.沉淀量增多
B.沉淀量减少
C.沉淀量先减少再增多
D.沉淀量先增多再减少
E.沉淀量无明显变化
55.
A B C D E
56.
A B C D E
A. B. C. D.
E.
57. 酸度最大的应是
A B C D E
58. 碱度最大的应是
A B C D E
A. B. C.
D. E.以上均非
59.
A B C D E
60.
A B C D E。
