ISO13485医疗器械质量管理体系认证的流程
iso13485医疗器械质量管理体系设计和开发及风险管理流程图

设计和开发的流程图
设计和开发流程主要内容
6设计和开发确认3产品注册
2临床试验和性能试验
1实际和模拟环境中使用
1设计和开发策划1将设计和开发分成几个阶段
2编制设计和开发计划
3每阶段人员的职责和权限
1评审结果是否满足要求
2评审材料、加工和技术可行性
3提出问题、解决措施
4设计和开发评审2设计和开发输入1预期用途
5包装、标记要求4风险管理的输出3其他必备要求
2法律法规要求
6对输入进行评审,定期更新5设计和开发验证1试验、比较、检验
7设计和开发更改
5顾客和供方的要求4风险管理的要求3制造、安装和服务的困难
2识别出的疏漏和错误
1评审、验证和确认要求更改
7评价更改对产品的影响
6功能和性能的改进3设计和开发输出1技术资料、指导文件
5接收准则4采购、生产和服务信息3输出评审,满足输入要求
2阶段产品和最终产品
设计和开发过程风险管理流程图。
医疗器械ISO13485体系认证

医疗器械ISO13485体系认证1.质量管理体系建立和维护:组织必须建立和维护一个有效的质量管理体系,以确保产品质量的一致性和符合法规要求。
这包括质量方针和目标的制定、质量手册和程序的编写以及内部培训和教育等。
2.合规性评审和法规要求:组织必须定期评审法规和标准的变化,并确保其产品和服务符合相关法规的要求。
这包括产品注册、技术文件的编制和提交、风险管理计划的制定等。
3.管理责任:管理层必须对质量管理体系的有效性和持续改进承担责任,并确保资源的合理配置和有效使用。
这包括制定质量目标、进行管理评审、为质量管理体系提供必要的资源等。
4.资源管理:组织必须确保拥有适当的资源来支持产品的开发、制造和销售过程。
这包括人员的资质和培训、设备和设施的合理布局和管理、供应商的评估和选择等。
5.产品实施要求:组织必须确保在产品设计、制造和销售过程中符合相关要求。
这包括风险管理、设计开发和验证、供应链管理、物流和售后服务等。
6.文件控制:组织必须确保相关文件的编制、审查、修改、分发和保留过程的有效控制。
这包括质量手册、程序文件、工作指导书等。
7.记录保留:组织必须确保记录的合理保留和管理,以便能够对产品历史和质量问题进行追溯和分析。
这包括产品检验、工作记录、不合格品处理记录等。
8.内部审计:组织必须定期进行内部审核,以评估质量管理体系是否符合标准要求,并提出改进措施。
这包括内部审核计划的制定、审核员的培训和执行、审核结果的跟踪和验证等。
9.纠正措施和预防措施:组织必须对质量问题和不合格品进行纠正措施和预防措施的制定和实施。
这包括不合格品处理、客户投诉和事故调查、风险评估和管理等。
2023年ISO13485医疗器械质量管理体系管理评审全套资料

医疗器械管理体系内部管理评审全套资料➢内部管理评审管理程序➢内部管理评审报告(12-33页)X X X 股份有限公司2023年ISO13485:2016医疗器械管理体系认证文件文件编制 编制日期 年月日文件接收部门 □总经理 □管 代 □行政部 □品质部 □物流部 □财务部 □业务部 □文件审核 审核日期 年月日文件批准 批准日期 年月日文件编号 受控状态 接收人员 发布日期 2023年 02 月 20 日 ☑受控 □非受控 发放编号程序文件更改履历表序号 更改人 更改原因 更改内容 版本号管理评审管理程序1.目的通过编制管理评审程序文件,明确管理评审流程,确保最高管理者按已文件化的策划时间间隔评审组织的质量管理体系,以确认运行中的ISO13485 医疗器械质量管理体系是否具有适宜性、充分性和有效性,并通过对管理评审输出结果改进项和变更项的完成以实现对医疗器械质量管理体系的持续改进。
2.范围适用于公司对质量管理体系的运行情况进行的管理评审管理。
3.职责3.1 总经理主持管理评审并做出决策;3.2 管理者代表负责向总经理报告质量管理体系的运行情况,向总经理提出召开管理评审会议的建议,协助改进措施的制订与实施;3.3 质量部负责管理评审会议的具体组织工作及会议决策的落实;3.4 各部门负责提供本部门有关管理评审输入所需的资料及上次管理评审提出的改进措施完成情况的资料、参加会议及决策措施的实施。
4.工作程序4.1质量部制定评审计划4.1.1管理评审每年至少一次。
若因市场发生重大变化、组织机构发生重大变化、产品质量发生重大问题、质量法规和质量标准发生重大改变、顾客严重投诉时,由管理者代表提议、总经理决定,适时增加管理评审。
4.1.2评审计划内容包括:评审频次、时间、评审范围、参加部门和人员、地点,明确输入要求和责任单位。
4.2管理者代表审核管理评审计划,总经理批准管理评审计划。
4.3评审输入4.3.1 反馈;4.3.2 抱怨处理;4.3.3 向监管机构的报告;4.3.4 审核;4.3.5 过程的监视和测量;4.3.6 产品的监视和测量;4.3.7 纠正措施;4.3.8 预防措施;4.3.9 以往管理评审的跟踪措施;4.3.10 影响质量管理体系的变更;4.3.11 改进的建议;4.3.12 适用的新的或修订的法规要求。
管理评审控制程序(ISO13485)

LO目的对公司质量管理体系的适宜性、充分性和有效性进行评审,确保公司质量管理体系持续、有效地满足1809001:2008.IS013485:2012标准、医疗器械生产质量管理规范(试行)、医疗器械生产质量管理规范无菌医疗器械实施细则(试行)的要求和实现公司质量方针、质量目标。
2.0范围本程序适用于公司管理层对质量管理体系的适宜性、充分性和有效性进行正式评价。
3.0定义评审:为确定主题事项的适宜性、充分性和有效性,以达到规定的目标所进行的活动。
4.0权责4.1总经理负责主持管理评审,并批准管理评审报告。
4.2管理者代表负责组织制订管理评审计划和管理评审总结报告,监督管理评审采取措施的实施和验证其效果。
4.3各部门负责人员参与管理评审会议,制定本职责范围内管理评审措施的制定和组织实施。
5.0程序5.1评审计划5.1.1管理评审会议一般每12个月召开一次,但是除了每年的例行评审外,出现以下情况时,公司员工和相关部门可向管理者代表提出追加评审的要求,如果管理者代表及总经理同意,可进行追加评审:a)当市场需求发生重大变化时;b)当顾客或相关方有重大投诉或不良事件发生时;C)当出现严重不合格品或发生重大的质量事故时;d)当法律法规、标准及其他要求出现重大修改时;e)当公司管理体制、组织机构、产品范围、生产地址、资源配置等发生重大变化时;f)即将进行第二、三方审核或法律、法规规定的审核时。
5.1.2管理者代表应在召开管理评审会议前一个月,组织制定管理评审计划,确定管理评审的会议议程、评审内容,参加评审部门和人员,管理评审计划经总经理批准后,提前半个月下发相关部门和人员。
5.1.3各参加评审人员和部门应提前准备评审所需的相关报告、信息、数据,统一交品质部收集,汇总管理者代表确认后提交管理评审。
5.2评审输入管理评审内容包括如下内容(不限于此):5.2.1审核结果,包括第一、第二、第三方质量管理体系审核、产品质量审核等的结果。
ISO13485体系内审和管理评审知识及流程-已转换

体系内审和管理评审基础知识及流程目录contents132内部审核4管理评审纠正和预防措施管理体系审核概论PART ONE管理体系审核概论什么是审核?◆审核:即为获得审核证据并对其进行客观的评价,以确定满足审核准则的程度所进行的系统的、独立的并形成文件的过程 。
◆质量管理体系审核:为获得质量管理体系审核证据并对其进行客观评价,以确定满足质量管理体系准则的程度所进行的系统的、独立的并形成文件的过程。
当两个或两个以上审核机构合作,共同审核同一个受审核方时,这种情况称为“联合审核”。
1.1过程是否被识别并适当规定;职责是否已经被分配; 程序是否得到实施和保持;在实施所要求的结果方面,过程是否有效。
审核的特点:被审核的质量管理体系必须是正规的。
是一种正式有序的活动(系统性)是一种独立的活动(独立性)是形成文件的过程是一种抽样过程1.2即第一方审核:由组织自己或以组织的名义进行。
目的:1、依据质量管理体系标准来评价组织自身的质量管理体系是否满足规定的要求。
2、验证组织自身的质量管理体系是否持续满足规定的要求并正在运行;3、作为重要的管理手段和自我改进的机制,及时发现问题,进行纠正或预防,使体系不断改进、不断完善;4、在第二、三方审核前作好准备内部审核外部审核包含:第二方审核由组织的相关方或由其他人员以相关方的名义进行。
目的:1、当有建立合同关系的意向时,对供方进行初步评价。
2、作为制定或调整合格供方的依据之一。
第三方审核由外部独立的组织进行,这类组织提供符合要求的认证或注册。
目的:1、决定受审核方质量管理体系是否可以注册/认证。
2、提高受审核组织的声誉,增强竞争力。
1.3体系覆盖的所有产品、过程和场所。
申请的产品范围及其涉及的过程和场所。
限制于顾客所购的产品范围、及其所涉及的过程和场所 。
内部审核PART TWO2.1现场审核实施阶段纠正和预防措施的跟踪和验证阶段审核策划和准备阶段10审核组长管理者代表审核组长审核组长审核组审核组长审核员质管部门负责部门/人提出内审制定审核计划编制检查表首次会议现场审核末次会议编制审核报告跟踪审核步骤内审的阶段准备阶段P现场审核阶段D总结阶段C 跟踪验证阶段A质量管理体系内部审核流程图2.2审核的策划与准备:•组成审核组•审核范围的确定•文件审查•初访(必要时)•制定审核计划•编制检查表第一阶段审核策划:即一个组织对其内部在一年内应进行的所有审核活动作出安排,审核策划的结果形成文件就是审核方案。
iso13485质量认证管理体系

iso13485质量认证管理体系ISO 13485质量认证管理体系ISO 13485质量认证管理体系,全称ISO 13485:2016医疗器械质量管理体系--要求的国际标准,是针对医疗器械制造商和供应商所设置的标准,目的是确保医疗器械产品的安全性和有效性。
本文将介绍ISO 13485质量认证管理体系的概念、主要要求和实施步骤。
1. 概念ISO 13485质量认证管理体系是一种基于风险管理和过程控制的质量管理体系,旨在确保医疗器械在设计、开发、生产、安装和服务过程中的一致性和合规性。
该体系的实施能够帮助组织提高产品质量、增强客户满意度、降低风险和成本,并进一步提升市场竞争力。
2. 主要要求ISO 13485质量管理体系对医疗器械制造商和供应商提出了一系列要求,主要包括以下几个方面:2.1 管理责任组织应建立和维护质量管理体系,并确保适当的资源和管理承诺以支持该体系的有效实施。
高层管理应对体系的运行负有最终责任,并参与设定质量目标和政策。
2.2 资源管理组织应确定和提供必要的资源,包括人力、设施和设备,以支持产品的设计、开发、生产和监控。
此外,还需要制定培训计划,确保员工具备执行相关任务的能力。
2.3 设计和开发针对设计和开发过程,组织应建立并执行适当的规划、验证、验证和验证活动,以确保产品满足预期需求。
同时,还需要记录设计和开发过程的相关信息,并建立必要的变更控制程序。
2.4 过程控制组织应确定并控制与产品质量相关的各个过程,确保它们在整个生命周期中的一致性和合规性。
这包括从采购原材料到产品交付的供应链管理,以及生产、装配、包装、标签和存储等方面的控制。
2.5 监测和测量通过建立监测和测量活动,组织可以及时获取产品和过程的相关数据,以评估质量绩效并采取必要的纠正措施。
同时,还需要建立产品标识和溯源的要求,保证产品的追溯性和唯一性。
2.6 核查和验证组织应执行内部和外部的审核活动,以确保质量管理体系的有效性和符合性。
iso13485质量认证管理体系

iso13485质量认证管理体系ISO 13485质量认证管理体系ISO 13485是国际标准化组织(ISO)制定的一种针对医疗器械行业的质量认证体系标准。
该标准要求医疗器械制造商和供应商建立一套完整的质量管理体系,以确保其产品和服务符合法律法规的要求,并满足用户的期望。
本文将就ISO 13485质量认证管理体系进行探讨。
一、质量管理体系的基本要求1.1 质量目标和策略根据ISO 13485标准的要求,企业应建立明确的质量目标和策略,以指导企业在各个环节的质量管理工作。
质量目标应明确、具体,并与企业的战略目标相一致。
质量策略应包括质量管理的整体方针和具体措施,以确保质量目标的实现。
1.2 组织结构和职责为了有效管理质量,企业应建立适合的组织结构和明确的职责分工。
各个部门和岗位应明确自己的职责和权限,以确保质量管理的有效实施。
此外,企业应指定合适的管理代表,负责协调和监督质量管理体系的实施和持续改进。
1.3 质量手册和程序文件企业应编制质量手册和程序文件,详细描述质量管理体系的各项要求和流程,并将其有效地传达给组织内的相关人员。
质量手册应包括质量政策、目标和策略,程序文件应规定具体的操作流程和控制要求。
这样可以确保各个环节的操作都能按照标准要求进行,减少错误和风险。
1.4 资源管理企业应确保有足够的资源来支持质量管理体系的实施。
包括人力资源、物质资源、技术资源等。
另外,企业还需要建立适当的培训计划,提高员工的专业水平和意识,以确保他们能够胜任自己的工作,并对质量管理体系有所了解和支持。
二、质量管理的关键要素2.1 风险管理ISO 13485要求企业应进行风险管理,包括对产品的风险评估和控制。
企业应对产品的各种潜在风险进行识别和分析,并采取相应的控制措施来减少和管理这些风险。
这样可以降低产品的安全风险和质量问题的发生概率,保证产品的安全和可靠性。
2.2 设计开发控制对于涉及产品设计和开发的企业来说,ISO 13485要求其建立有效的设计开发控制过程,以确保设计的合理性和可行性。
iso13485认证管理体系

iso13485认证管理体系ISO 13485认证管理体系随着全球医疗器械市场的不断增长,对医疗器械制造商和供应商的质量和安全要求也越来越高。
为了提供安全可靠的医疗器械产品和服务,许多制造商和供应商选择通过实施ISO 13485认证管理体系来确保其产品和服务符合相关的法规和技术要求。
ISO 13485是国际标准化组织(ISO)开发的一项专门针对医疗器械行业的认证标准。
它基于ISO 9001质量管理系统,并结合了医疗器械行业的特殊要求和规范。
通过实施ISO 13485认证管理体系,企业能够建立一套完善的质量管理体系,确保其产品和服务的质量和安全可靠性。
ISO 13485认证管理体系的实施过程通常包括以下几个主要步骤:1. 了解标准要求:企业需详细了解ISO 13485标准的要求和适用范围,包括质量管理体系的建立、文件控制、内部审核、管理评审等方面的内容。
2. 制定计划:企业需要根据其自身情况和目标,制定ISO 13485认证管理体系实施的计划。
计划需要包括建立文件、培训人员、开展内部审核等具体措施。
3. 文档编制:企业需要编制一系列文档,包括质量手册、程序文件、工作指导书等,以确保各项工作按照标准要求进行。
4. 培训与实施:企业需要对员工进行相关的ISO 13485标准培训,使其了解标准要求和各项工作的具体操作。
同时,还需要实施各项措施,如过程控制、记录管理等。
5. 内部审核:企业需要定期进行内部审核,评估ISO 13485认证管理体系的实施情况和有效性。
通过内部审核,及时发现并纠正问题,确保体系的持续改进。
6. 管理评审与认证:企业需要定期召开管理评审会议,对ISO 13485认证管理体系进行评估和改进。
当企业认为自身已经符合ISO 13485标准的要求时,可以选择申请第三方认证机构的认证。
通过ISO 13485认证管理体系的实施和认证,企业能够实现以下几个方面的好处:1. 提高质量:ISO 13485认证管理体系要求企业建立完善的质量管理体系,强调风险管理和过程控制,能够有效提升产品和服务的质量。
最新ISO13485-2016医疗器械管理体系全套文件(质量手册及程序文件)

ISO13485:2016医疗器械质量管理体系全套文件(手册及程序文件)XXX有限公司ISO13485:2016质量管理手册2017年10月09日发布 2017年10月09日实施目录0.1、前言及引言0.2、管理者代表任命书0.3、质量手册发布令110.4、质量手册发布令1. 范围1.1 总则1.2 应用2. 规范性引用文件3. 术语和定义4 .质量管理体系4.1 总要求4.2 文件要求4.2.1 总则4.2.2 质量手册4.2.3 医疗器械文件4.2.3 文件控制4.2.4 记录控制5.管理职责5.1 管理承诺5.2 以顾客为关注焦点5.3 质量方针5.4 策划5.4.1 质量目标5.4.2 质量管理体系的策划5.5 职责、权限和沟通5.5.1 职责和权限5.5.2管理者代表5.6 管理评审5.6.1 总则5.6.2 评审输入5.6.3 评审输出6 .资源管理6.1 资源提供6.2 人力资源6.3 基础设施6.4 工作环境和污染控制7 .产品实现7.1 产品实现的策划7.2 与顾客有关的过程7.2.1 与产品有关的要求的确定 7.2.2 与产品有关要求的评审 7.2.3 沟通7.3 设计和开发7.3.1总则7.3.2 设计和开发策划7.3.3 设计和开发输入7.3.4 设计和开发输出7.3.5 设计和开发评审7.3.6 设计和开发验证7.3.7 设计和开发确认7.3.8 设计和开发转换7.3.9 设计和开发更改的控制 7.3.10 设计和开发文档7.4 采购7.4.1采购过程7.4.2 采购信息7.4.3采购产品的验证7.5 生产和服务提供7.5.1 生产和服务提供的控制7.5.2 产品的清洁7.5.3 安装活动7.5.4 服务活动7.5.5 无菌医疗器械的专用要求7.5.6 生产和服务提供过程的确认7.5.7 灭菌过程和无菌屏障系统确认的专用要求 7.5.8 标识7.5.9 可追溯性7.5.10 顾客财产7.5.11产品防护7.6 监视和测量设备的控制8 .测量、分析和改进8.1 总则8.2 监视和测量8.2.1 反馈8.2.2 抱怨处理8.2.3向监管机构报告8.2.4内部审核8.2.5 过程的监视和测量8.2.6 产品的监视和测量8.3 不合格品控制8.3.1 总则8.3.2 交付前发现不合格品的响应措施 8.3.3 交付后发现的不合格品的响应措施8.4 数据分析8.5 改进8.5.1 总则8.5.2 纠正措施8.5.3 预防措施9 .MDD要求9.1 总则9.2 适用范围9.3 职责9.4 程序要求附录A 公司质量目标附录B 各部门目标分解附录C 职责分配表附录D 程序文件清单附录E 组织架构图附录F YY/T 0287-2017 和GB/T19001-2016 对应关系表0.2、前言及简述本文件为XX市XXXX有限公司之质量手册,详述本公司为符合顾客之要求所提供之质量、保证。
iso13485认证管理体系

iso13485认证管理体系ISO 13485认证管理体系ISO 13485认证是一种全球公认的医疗器械质量管理体系认证,它适用于医疗器械制造商、供应商和相关服务提供商。
这项认证要求组织建立和持续改进质量管理体系,以确保产品的安全性和合规性,提高顾客满意度,并满足监管机构的要求。
本文将介绍ISO 13485认证管理体系的基本概念、要求和实施步骤。
一、概述ISO 13485认证是基于ISO 9001质量管理体系标准的要求,但专门适用于医疗器械行业。
该认证的目的是确保医疗器械制造商或供应商在整个生命周期中,从研发到售后服务,持续提供符合法规和客户要求的安全、可靠的产品和服务。
二、要求ISO 13485认证管理体系要求组织遵守以下核心要素:1. 质量管理体系组织必须建立、实施和维护一个有效的质量管理体系,包括规定和记录各项质量管理和运营流程。
2. 管理责任组织的管理层应确定和实施质量政策,并确保其与组织的目标相一致。
他们还应确保资源的分配,推动质量目标的实现,并监督体系的维护和改进。
3. 设备和环境组织必须确保设备和环境的有效管理,以满足产品质量要求,并提供一个符合卫生和安全标准的工作环境。
4. 产品实施组织必须采取措施,确保产品设计、开发、制造和服务活动的合规性。
这包括产品的标识、跟踪、记录和验证,以及供应链的有效管理。
5. 测量、分析和持续改进组织应采用适当的测量和分析方法,监控和评估质量指标,并定期进行管理评审。
他们还必须采取纠正和预防措施来解决不符合和改进机会。
三、实施步骤要成功实施ISO 13485认证管理体系,组织可以按照以下步骤进行:1. 确定需求和制定计划组织应了解ISO 13485标准的要求,并评估现有体系与标准的差距。
随后,他们可以为实施认证制定详细计划,并确定相应的资源。
2. 设计和实施质量管理体系组织应根据ISO 13485标准的要求,设计和建立适用于其业务的质量管理体系。
这包括确定和记录核心过程、业务流程和管理流程。
ISO13485医疗器械质量管理体系认证的流程

ISO13485医疗器械管理体系认证分为初次认证、年度监督检查和复评认证等,具体流程如下:一、初次认证1、企业将填写好的《ISO13485认证分申请表》,认证中心收到申请认证材料后,会对文件进行初审,符合要求后发放《受理通知书》。
2、现场检查一周前将检查组组成和检查计划正式报企业确认。
3、现场检查按环境标志产品保障措施指南的要求和相对应的环境标志产品认证技术要求进行。
4、检查组根据企业申请材料、现场检查情况、产品环境行为检验报告撰写环境标志产品综合评价报告,提交技术委员会审查。
5、认证中心收到技术委员会审查意见后,汇总审查意见。
6、认证中心向认证合格企业颁发环境标志认证证书,组织公告和宣传。
7、获证企业如需标识,可向认证中心订购;如有特殊印制要求,应向认证中心提出申请并备案。
8、年度监督审核每年一次。
二、年度监督检查1、认证中心根据企业认证证书发放时间,制订年检计划,提前向企业下发年检通知。
企业按合同要求缴纳年度监督管理费,认证中心组成检查组,到企业进行现场检查工作。
2、现场检查时,对需要进行检验的产品,由检查组负责对申请认证的产品进行抽样并封样,送指定的检验机构检验。
3、检查组根据企业材料、检查报告、产品检验报告撰写综合评价报告,报认证中心总经理批准。
4、年度监督检查每年一次。
三、复评认证3年到期的企业,应重新填写《ISO13485认证分申请表》,连同有关材料报认证中心。
其余认证程序同初次认证。
认证所需材料1.申请方授权代表签署的产品质量认证申请书、质量体系认证申请书;2.申请单位质量手册,必要时提供企业的程序文件;3.申请认证的产品或质量体系覆盖的产品标准;4.申请方声明执行的标准;5.医疗器械产品注册证(复印件);6.产品生产全过程情况总结,产品生产流程及特殊过程、关键过程说明;7.近三年产品销售情况及用户反馈信息;8.主要外购、外协件清单;9.其他材料,如企业产品目录、产品简介、产品宣传材料等;为其提供过认证咨询的组织和人员的信息。
iso13485质量认证管理体系

iso13485质量认证管理体系ISO13485是一种国际标准,用于评估医疗器械制造商的质量管理体系是否符合相关要求。
这项认证体系的建立和实施,对于确保医疗器械质量的可靠性具有重要意义。
本文将从ISO13485的核心要素、意义和实施过程等方面进行探讨。
在医疗器械制造业中,质量是关乎人类生命健康的一项重要因素。
医疗器械的质量管理必须做到严谨、有效,以确保器械的安全性和可靠性。
ISO13485质量认证管理体系为医疗器械制造商提供了一套科学、规范的质量管理体系,通过对企业的各个环节进行全方位的评估和监控,达到规范管理、质量可控的目标。
ISO13485的核心要素包括:质量管理体系、产品设计和开发、采购、生产和服务以及监测和改进等方面。
首先,质量管理体系是整个认证体系的基石,企业需要建立并完善一套符合标准要求的质量管理制度。
其次,产品设计和开发环节需要确保产品的可靠性和安全性,包括设计评审、验证、验证和出厂检验等环节。
采购过程需要选择合格的供应商,以确保原材料的质量和稳定性。
生产和服务环节需要严格控制生产过程,确保产品的一致性和稳定性。
最后,企业还需要建立监测和改进机制,对质量管理体系进行持续监控和改进,以确保质量的持续改进和满足客户需求。
ISO13485质量认证管理体系对企业具有重要意义。
首先,ISO13485认证可以提高企业的竞争力。
认证过程中,企业需要对自身的各个环节进行全面评估和改进,提高管理水平和效率,从而提升企业的整体竞争力。
其次,认证可以增强产品的市场信任度。
医疗器械是一项特殊的产品,产品质量的可信性和安全性直接关系到人类的健康和生命。
通过ISO13485认证,企业可以获得市场的认可和信任,提升产品的市场竞争力。
再次,认证可以帮助企业规范管理,提高质量的可控性。
通过建立和实施ISO13485质量管理体系,企业可以规范管理流程,降低质量风险,提高质量的稳定性和可靠性。
最后,认证可以促进企业的持续改进。
iso13485医疗器械质量管理体系质量方针、目标及程序文件医疗器械质量管理制度(制度范本、doc格

iso13485医疗器械质量管理体系质量方针、目标及程序文件医疗器械质量管理制度(制度范本、doc格式)医疗器械质量管理制度一、首营企业、首营品种的质量审核制度1、“首营品种”指本企业向某一医疗器械生产企业首次购进的医疗器械产品.2、首营企业的质量审核,必须提供加盖生产单位原印章的医疗器械生产许可证、营业执照、税务登记等证照复印件,销售人员须提供加盖企业原印章和企业法定代表人印章或签字的委托授权书,并标明委托授权范围及有效期,销售人员身份证复印件,还应提供企业质量认证情况的有关证明。
3、首营品种须审核该产品的质量标准、和《医疗器械产品注册证》的复印件及产品合格证、出产检验报告书、包装、说明书、样品以及价格批文等。
4、购进首营品种或从首营企业进货时,业务部门应详细填写首营品种或首营企业审批表,连同以上所列资料及样品报质管部审核。
5、质管部对业务部门填报的审批表及相关资料和样品进行审核合格后,报企业分管质量负责人审批,方可开展业务往来并购进商品。
6、质管部将审核批准的首营品种、首营企业审批表及相关资料存档备查。
二、质量验收的管理制度1、商品质量验收由质量管理机构的专职质量验收员负责验收。
2、公司质管部验收员应依据有关标准及合同对一、二、三类及一次性使用无菌医疗器械质量进行逐批验收、并有翔实记录.各项检查、验收记录应完整规范,并在验收合格的入库凭证、付款凭证上签章。
3、验收时应在验收养护室进行,验收抽取的样品应具有代表性,经营品种的质量验证方法,包括无菌、无热源等项目的检查。
4、验收时对产品的包装、标签、说明书以及有关要求的证明进行逐一检查。
5、验收首营品种,应有首批到货产品同批号的产品检验报告书。
6、对验收抽取的整件商品,应加贴明显的验收抽样标记,进行复原封箱。
7、保管员应该熟悉医疗器械质量性能及储存条件,凭验收员签字或盖章的入库凭证入库。
验收员对质量异常、标志模糊等不符合验收标准的商品应拒收,并填写拒收报告单,报质管部审核并签署处理意见,通知业务购进部门联系处理。
ISO13485-2016医疗质量管理体系全套程序文件
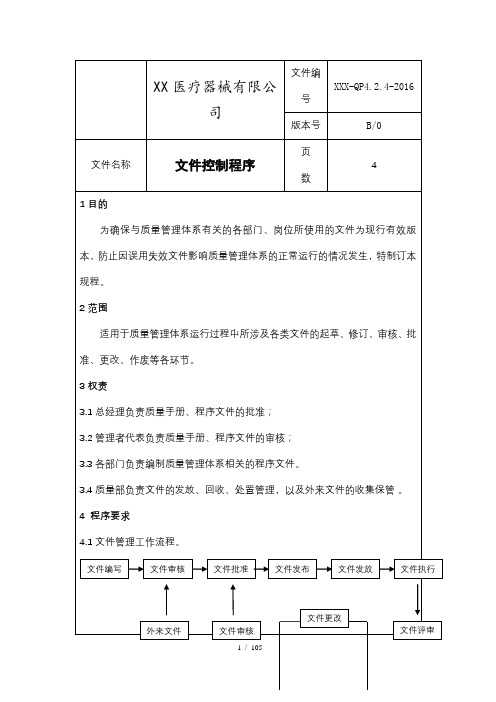
3.3 各部门负责质量记录表样的设计、更改以及已填质量记录定期收集、整理、
保管本部门的质量记录确保需要时提供证据。
4 程序要求
4.1 记录的填写
4.1.1 记录填写要及时、真实、内容完整、字迹清晰,不得随意涂改;如有空白
7 / 105
2016 年 2 月
项目,将该空白项用斜线自左下至右上划去“ ”或用文字说明(如:无、以下 空白等);各相关栏目负责人签名不允许空白。 4.1.2 如因笔误或计算错误要修改原数据,应用单杠划去原数据“如:2016 年 1 月”,在其上方填写更改后的数据,加盖更改人的印章或签署更改人的姓名及 日期加以标注。 4.2 记录的保存、保护 各部门负责人每月把本部门产生的记录分类,按时间顺序整理好,存放于通风、 干燥的地方,所有的记录应保持清洁、字迹清晰。按规定的期限保存记录,记 录的保管应便于查找 4.3 记录的编目 质量部负责将公司所有与质量管理体系运行有关的记录表样汇总,编制《记录 清单》,包括名称编号、保存期、使用部门等内容,收集所有记录表样,进行 备案存档。按文件控制程序控制。各部门编制本部《记录清单》,作为本部门 记录管理附件。 4.4 记录发放、借阅和复制 4.4.1 记录空白表模板,有质量部下发各部门保存适用版本。 4.4.2 保存的已填报记录应便于检索,需借阅或复制要经相应部门负责人批准, 登记备案,及时反还。 4.5 记录的传递 当记录需在公司内(外)部进行传递时,必须按规定的时间及范围进行传递。 4.6 记录的销毁处理 质量记录的保存期:进货检验记录和销售记录应当保存至医疗器械有效期二
ISO13485过程确认程序(含表格)

过程确认程序(YY/T0287-2017 idt ISO13485-2016)1.目的和适用范围1.1目的当生产和服务提供过程的输出不能由后续的监视或测量加以验证,并因此使问题仅在产品使用后或服务交付后才显现时,应对这样的过程进行确认,确认应证实这些过程具有稳定地实现产品性能要求的能力,特制定本程序。
1.2适用范围适用于产品特殊过程、关键工序以及计算机软件的确认。
1.3发放范围本公司各职能部门。
2.规范性引用文件下列文件中条款通过本程序引用而成为本程序的条款,其最新版本适用于本程序。
质量手册GB/T19001-2016 idt ISO9001-2015质量管理体系要求YY/T0287-2017idt ISO13485-2016医疗器械质量管理体系用于法规的要求YY/T0316-2016医疗器械风险管理对医疗器械的应用医疗器械生产质量管理规范(总局公告2014年第64号)(2015年3月1日起施行)医疗器械生产质量管理规范附录无菌医疗器械(2015年第101号)(2015年10月1日起实施)医疗器械生产质量管理规范无菌医疗器械现场检查指导原则(食药监械监〔2015〕218号附件2)(2015年9月25日发布实施)辐照灭菌过程确认控制程序环氧乙烷灭菌过程确认控制程序计算机软件确认管理制度3.组织和职责3.1主责部门本程序的主责部门为生技部,主管领导为管理者代表。
——生技部负责按照法规和标准要求建立本程序;——生技部负责特殊过程、关键工序的确立、策划和组织实施确认;——生技部负责组织计算机软件的确认;——管理者代表负责确认过程的协调和各项审批。
3.2相关部门各部门配合生计部做好过程确认的各项事务。
4.步骤和方法4.1确立确认过程点生技部应将需要确认的过程视为特殊过程,对产品质量有重大影响的工序作为关键工序,并保留确认的结果和结论以及确认所采取的必要措施的记录。
4.2确认过程的流程4.2.1确认方案生技部应召集相关部门会议,对确认点和确认方案进行讨论,为过程的评审和批准规定准则,并对方案的编制进行分工和安排,必要时进行培训。
iso13485质量认证管理体系

iso13485质量认证管理体系ISO 13485是一种国际标准,用于规范医疗器械行业的质量管理体系。
该标准的主要目的是确保医疗器械制造商提供安全有效的产品,并符合相关法规和客户要求。
本文将探讨ISO 13485质量认证管理体系的重要性、应用和实施过程。
一、ISO 13485质量认证管理体系的重要性ISO 13485标准为医疗器械制造商提供了一个全面的质量管理框架。
该体系包括了质量目标的制定、质量手册和程序的编写、质量记录的管理以及内部审核和管理评审等方面。
通过实施ISO 13485质量认证管理体系,医疗器械制造商可以有效地管理其质量风险,减少产品缺陷和不合格品,提高产品质量和客户满意度。
二、应用ISO 13485质量认证管理体系的范围ISO 13485适用于医疗器械制造商、供应商、经销商以及其他与医疗器械相关的组织。
不论是大型医疗器械制造商还是小型供应商,都可以通过实施ISO 13485质量认证管理体系来提升其质量管理水平。
此外,该体系也适用于医疗器械相关的服务提供商,如维修、保养和售后服务等。
三、实施ISO 13485质量认证管理体系的步骤实施ISO 13485质量认证管理体系需要一系列的步骤和活动。
首先,组织需要进行现场评估,评估其现有的质量管理体系和对ISO 13485的符合程度。
然后,根据评估结果编制质量管理手册和程序文件,并建立质量记录和报告系统。
接下来,对组织的人员进行培训,以确保他们理解和遵守质量管理体系的要求。
最后,进行内部审核和管理评审,以验证和改进质量管理体系的有效性。
四、ISO 13485质量认证管理体系的优势实施ISO 13485质量认证管理体系可以带来多方面的优势。
首先,它有助于提高产品质量,并减少产品缺陷和不合格品的发生。
其次,它能够提高组织的运作效率和流程控制,减少资源浪费和成本。
此外,该体系还有助于满足法规和客户要求,提升企业形象和市场竞争力。
五、ISO 13485质量认证管理体系的持续改进持续改进是ISO 13485质量认证管理体系的核心原则之一。
ISO13485管理体系审核

ISO13485管理体系审核1. 引言ISO 13485是一个国际标准,对医疗器械行业的质量管理体系进行了规范。
为确保医疗器械产品的质量和安全性,组织需要进行定期的管理体系审核。
本文将介绍ISO13485管理体系审核的目的、步骤和注意事项。
2. 目的ISO13485管理体系审核的主要目的是评估组织的质量管理体系是否符合ISO13485标准的要求。
通过审核,组织能够发现管理体系中的不足之处,并采取相应的措施进行改进,以确保医疗器械产品的质量和安全性。
3. 步骤ISO13485管理体系审核一般包括以下步骤:3.1. 准备阶段在进行管理体系审核之前,组织需要进行准备工作。
首先,组织应明确审核的目标和范围,并制定相应的审核计划。
然后,组织需要组建一支审核团队,包括审核员和技术专家。
最后,组织应准备审核所需的文件和记录,如管理体系文件、工作指导书、数据记录等。
3.2. 开始审核审核团队在开始审核之前,应与组织的管理层进行沟通,了解组织的运作情况和管理体系的实施情况。
然后,审核团队开始实施审核计划,根据ISO13485标准的要求,对组织的管理体系进行评估。
审核过程中,团队将与组织的员工进行面谈、检查文件和记录,并观察工作场所的实际情况。
3.3. 结果评定审核团队在完成对组织的评估后,将对评估结果进行评定。
根据ISO13485标准的要求,团队将对组织的管理体系中是否存在不符合要求的情况进行判断,然后确定相应的评定结果。
3.4. 编写报告审核团队在评定结果后,将编写审核报告。
报告中应包括对组织的评估结果、存在的问题和建议的改进措施等内容。
报告应详细、准确地反映出组织的管理体系状况。
3.5. 审核复核组织在接收审核报告后,应针对存在的问题和改进措施进行跟踪和复核。
组织应制定相应的改进计划,并在一定时间内完成改进。
4. 注意事项在进行ISO13485管理体系审核时,需要注意以下事项:4.1. 保持客观和公正审核团队在进行审核时,应保持客观和公正的态度,不受个人偏见的影响。
医疗器械认证流程

医疗器械认证流程医疗器械认证包括.1、产品安全认证.2、质量管理体系认证医疗器械怎样取得“安全认证标志”.以下以取得CE认证为例说明:.产品要顺利通过产品要顺利通过产品要顺利通过产品要顺利通过CE认证认证认证认证,需要做好三方面的工作需要做好三方面的工作需要做好三方面的工作需要做好三方面的工作。
其一,收集与认证产品有关的欧盟技术法规和欧盟(EN)标准,通过消化、吸收、纳入企业产品标准。
其二,企业严格按照以上产品标准组织生产,也就是把上述技术法规和EN标准的要求,贯彻到企业产品的设计开发和生产制造的全过程。
第三,企业必须按照ISO9000+ISO13485标准建和维护质量体系,并取得ISO9000+ISO13485认证。
CE认证应遵循的欧盟技术法规和认证应遵循的欧盟技术法规和认证应遵循的欧盟技术法规和认证应遵循的欧盟技术法规和EN标准标准标准标准。
对于目前欧盟已发布的18类工业产品指令,从这些指令的结构看,它们可分为垂直指令和水平指令。
垂直指令是以具体产品为对象,如医疗器械指令;水平指令适用于各种产品系列,如电磁兼容性指令,它适用于全部电器及电子零部件产品。
对于医疗器械,适用的指令有第十四项、第一项和第五项,即:93/42/EEC医疗器械指令、73/23/EEC低电压(LVD)指令和89/336/EEC电磁兼容性(EMC)指令。
支持这些指令支持这些指令支持这些指令支持这些指令的欧盟标准是的欧盟标准是的欧盟标准是的欧盟标准是:.(1)EN60601-1医用电气设备第一部分:安全通用要求;.(2)EN60601-1-1医用电气设备第一部分:安全通用要求及第一号修正;.(3)EN60601-2-11医用电气设备第二部分:γ射束治疗设备安全专用要求;.(4)EN60601-1-2医用电气设备第一部分:安全通用要求1.2节并行标准电磁兼容性——要求和测试。
其中第(1)、(2)、(3)项标准是医疗器械低电压(LVD)测试的依据:第(4)项标准是医疗器械电磁兼容性(EMC)测试的依据。
ISO13485认证简介

ISO13485认证简介该标准自1996年发布以来,得到全世界广泛的实施和应用,新版ISO13485标准于2003年7月3日正式发布。
与ISO9001:2000标准不同,ISO13485:2003是适用于法规环境下的管理标准:从名称上即明确是用于法规的质量管理体系要求。
医疗器械在国际上不仅只是一般的上市商品在商业环境中运行,它还要受到国家和地区法律、法规的监督管理,如美国的FDA、欧盟的MDD(欧盟医疗器械指令)、中国的《医疗器械监管条例》。
因此,该标准必须受法律约束,在法规环境下运行,同时必须充分考虑医疗器械产品的风险,要求在医疗器械产品实现全过程中进行风险管理。
所以除了专用要求外,可以说ISO13485实际上是医疗器械法规环境下的ISO9001。
目前美国、加拿大和欧洲普遍以ISO 9001,、EN 46001或ISO 13485作为质量保证体系的要求,建立医疗器械质量保证体系均以这些标准为基础。
医疗器械要进入北美,欧洲或亚洲不同国家的市场,应遵守相应的法规要求。
ISO13485认证的发展随着历史的发展,ISO组织在此基础上又将此标准进行了修订,升级为ISO13485:2003.目前大多数医疗设备生产厂家在建立质量管理体系时,开始把ISO9001:2000版+ISO13485:2003版+CE认证作为一揽子解决方案来考虑。
医疗器械行业一直将ISO 13485标准(我国等同转换标准号为YY/T0287)作为质量管理体系认证的依据。
这个标准是在ISO 9001: 1994标准的基础上,增加了医疗器械行业的特殊要求制定的,也就是所谓1+1的标准。
因此,满足ISO 13485标准也就符合ISO 9001: 1994标准的要求。
ISO 9001:2000标准颁布以后,ISO/TC 210又颁布了新的ISO 13485: 2003标准(我国等同转换的YY/T 0287-200X标准正在报批).ISO13485标准适用范围本标准适用于进行医疗器械的设计和开发、生产、安装和服务或相关服务的设计、开发和提供等相关行业。
iso13485认证管理体系

iso13485认证管理体系ISO 13485认证管理体系ISO 13485是一种国际标准,用于规范医疗器械制造商的质量管理体系。
该标准要求制造商在整个生产过程中遵循一系列严格的质量控制标准,以确保其产品符合国际标准和客户的要求。
本文将介绍ISO 13485认证管理体系的重要性、实施步骤以及如何获得认证。
一、ISO 13485认证管理体系的重要性ISO 13485认证管理体系是医疗器械制造商的质量管理体系的国际标准。
该标准要求制造商在整个生产过程中遵循一系列严格的质量控制标准,以确保其产品符合国际标准和客户的要求。
ISO 13485认证管理体系的实施可以帮助制造商提高产品质量、降低成本、提高客户满意度、增强市场竞争力。
二、ISO 13485认证管理体系的实施步骤1. 制定质量管理手册制定质量管理手册是ISO 13485认证管理体系实施的第一步。
质量管理手册是一个文件,其中包含了制造商的质量管理体系的所有要素和程序。
质量管理手册应该包括以下内容:- 公司简介- 质量方针和目标- 质量管理体系的范围- 质量管理体系的组织结构- 质量管理体系的程序和要素- 质量管理体系的文件和记录2. 制定程序和工作指导书制定程序和工作指导书是ISO 13485认证管理体系实施的第二步。
程序和工作指导书是文件,其中包含了制造商的质量管理体系的所有程序和工作指导。
程序和工作指导书应该包括以下内容:- 质量管理体系的程序和要素- 工作指导书和操作指南- 质量管理体系的文件和记录3. 实施质量管理体系实施质量管理体系是ISO 13485认证管理体系实施的第三步。
实施质量管理体系包括以下内容:- 培训员工- 实施程序和工作指导书- 实施质量管理体系的文件和记录4. 进行内部审核进行内部审核是ISO 13485认证管理体系实施的第四步。
内部审核是一个过程,其中制造商的内部审核员对质量管理体系进行审核,以确保其符合ISO 13485标准的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ISO13485中文叫“医疗器械质量管理体系用于法规的要求”由于医疗器械是救死扶伤、防病治病的特殊产品,仅按ISO9000标准的通用要求来规范是不够的,为此ISO组织颁布了ISO13485:1996版标准(YY/T0287 和YY/T0288),对医疗器械生产企业的质量管理体系提出了专用要求,为医疗器械的质量达到安全有效起到了很好的促进作用。
2017年11月为止的执行版本是ISO13485:2016《医疗器械质量管理体系用于法规的要求》。
名称和内容相较以前版本有所改变。
ISO13485认证分为初次认证、年度监督检查和复评认证等,具体如下:
一、初次认证
1、企业将填写好的《ISO13485认证分申请表》,认证中心收到申请认证材料后,会对文件进行初审,符合要求后发放《受理通知书》。
2、现场检查一周前将检查组组成和检查计划正式报企业确认。
3、现场检查按环境标志产品保障措施指南的要求和相对应的环境标志产品认证技术要求进行。
4、检查组根据企业申请材料、现场检查情况、产品环境行为检验报告撰写环境标志产品综合评价报告,提交技术委员会审查。
5、认证中心收到技术委员会审查意见后,汇总审查意见。
6、认证中心向认证合格企业颁发环境标志认证证书,组织公告和宣传。
7、获证企业如需标识,可向认证中心订购;如有特殊印制要求,应向认证中心提出申请并备案。
8、年度监督审核每年一次。
二、年度监督检查
1、认证中心根据企业认证证书发放时间,制订年检计划,提前向企业下发年检通知。
企业按合同要求缴纳年度监督管理费,认证中心组成检查组,到企业进行现场检查工作。
2、现场检查时,对需要进行检验的产品,由检查组负责对申请认证的产品进行抽样并封样,送指定的检验机构检验。
3、检查组根据企业材料、检查报告、产品检验报告撰写综合评价报告,报认证中心总经理批准。
4、年度监督检查每年一次。
三、复评认证3年到期的企业,应重新填写《ISO13485认证分申请表》,连同有关材料报认证中心。
其余认证程序同初次认证。
认证材料
1.申请方授权代表签署的产品质量认证申请书、质量体系认证申请书;
2.申请单位质量手册,必要时提供企业的程序文件;
3.申请认证的产品或质量体系覆盖的产品标准;
4.申请方声明执行的标准;
5.医疗器械产品注册证(复印件);
6.产品生产全过程情况总结,产品生产流程及特殊过程、关键过程说明;
7.近三年产品销售情况及用户反馈信息;
8.主要外购、外协件清单;
9.其他材料,如企业产品目录、产品简介、产品宣传材料等;为其提供过认证咨询的组织和人员的信息。
3、张小娴说:当时间过去,我们忘记了我们曾经义无反顾地爱过一个人,忘记了他的温柔,忘记了他为我做的一切。
我对他再没有感觉,我不再爱他了。
为甚么会这样?原来我们的爱情败给了岁月。
首先是爱情使你忘记时间,然后是时间使你忘记爱情。
4、张小娴说:思念一个人,不必天天见,不必互相拥有或相互毁灭,不是朝思暮想,而是一天总想起他几次。
听不到他的声音时,会担心他。
一个人在外地时,会想念和他一起的时光。
5、张小娴说:爱情,原来是含笑饮毒酒。
6、张小娴说:不被人珍视的爱情,就只是个羞耻的笑话。
7、张小娴说:寂寞的人,感冒会拖得特别的久,因为她自己也不想痊愈。
8、张小娴:女人放弃一个跟不上她的男人,是有志气。
男人放弃一个跟不上他的女人,则是无义。
9、张小娴说:清醒一点吧,世上没有未完的事,只有未死的心。
10、张小娴说:遗憾,也是一种幸福。
因为还有令你遗憾的事情。
11、张小娴说:失望,有时候也是一种幸福。
因为有所期待,所以才会失望。
因为有爱,才会有期待。
所以纵使失望也是一种幸福,虽然这种幸福有点痛。
12、张小娴说:突然觉得很委屈。
我对你微笑,转身的刹那,终于难过成你不知道的样子。
13、张小娴说:做一个诚实的孩子。
喜欢一个人,不到一定程度,不要轻易去说喜欢。
因为你的一句轻浮的话,很可能悲伤另一个人一段时光。
也有的,将会是,一生。
14、张小娴说:如果没有很大把握,又或者没有坚定地信念,请不要说太长久的承诺。
相爱时叫承诺,不爱的时候呢?也不是谎言吧。
毕竟爱着的时候就算说了地久天长,相信也是出自真心。
只不过后来的离开,不是自己能把握的。
15、张小娴说:如果爱的足够深,又或者是用情深的人,那个曾经伤害过TA的人有天肯回头了,TA还是会很没骨气很没出息地接受。
因为爱,因为忘不了。
16、张小娴说:爱情结束后,请选择“沉默”.你可以喊三两最好的朋友去K歌,使劲吼,就唱那首“其实不想走,其实我想留”,然后在某个时间点突然嚎啕大哭。
就算你是男生,也没什么丢人的,不难过只能说你没有真心爱过。
17、张小娴说:不要在爱情结束后,把那个你曾经爱过的人到处指责,将TA说的一无是处。
没必要的,既然留不住心,不如留下那份感情的纯洁度,蒙了尘,也就减损了回忆的价值。
18、张小娴说:你以为不可失去的人,原来并非不可失去,你流干了眼泪,自有另一个人逗你欢笑,你伤心欲绝,然后发现不爱你的人,根本不值得你为之伤心,今天回首,何尝不是一个喜剧?情尽时,自有另一番新境界,所有的悲哀也不过是历史。
19、张小娴说:爱情总是想象比现实美丽,相逢如是,告别亦如是。
我们以为爱得很深、很深,来日岁月,会让你知道,它不过很浅、很浅。
最深最重的爱,必须和时日一起成长。
20、张小娴说:开始的开始总是甜蜜的后来就有了厌倦、习惯、背弃、寂寞、绝望和冷笑曾经渴望与一个人长相厮守,后来,多么庆幸自己离开了曾几何时,在一段短暂的时光里,我们以为自己深深的爱着的一个人。
后来,我们才知道那不是爱,那只是对自己说谎。
21、张小娴说:时间会让你了解爱情,时间能够证明爱情,也能够把爱推翻。
没有一种悲伤是不能被时间减轻的。
如果时间不可以令你忘记那些不该记住的人,我们失去的岁月又有什么意义?如果所有的悲哀、痛苦、失败都是假的,那该多好?可惜,世上有很多假情假义,自己的痛苦、失败、悲哀,却偏偏总是真的。
22、张小娴说:一个钱币最美丽的状态,不是静止,而是当它像陀螺一样转动的时候,没人知道,即将转出来的那一面,是快乐或痛苦,是爱还是恨。
快乐和痛苦,爱和恨,总是不停纠缠。
所谓缘分,也和发明一样吧,都是源于偶然。
爱情也是一种发明,需要不断改良。
只是,这种发明跟其他发明不一样,它没有专利权,随时会给人抢走。
23、张小娴说:在最有感觉的时候,她没有停下脚步,那么,也不必在一起走完那段路之后,回头去寻找那些散落在地上的感觉,路已经走完。
爱情中最伤感的时刻是后期的冷淡,一个曾经爱过你的人,忽然离你很远,咫尺之隔,却是天涯。
曾经轰轰烈烈,曾经千回百转,曾经沾沾自喜,曾经柔肠寸断。
到了最后,最悲哀的分手竟然是悄无声息。
24、张小娴说:有相逢就有别离,可是每个人都害怕别离。
大家都知道,最后一次的别离就是死亡。
我们口里说“天下无不散之宴席”,心里却舍不得喝掉手中的酒,还想再唱一支歌,再唱一支歌。
你可不可以不走?
25、张小娴说:世上最凄绝的距离是两个人本来距离很远,互不相识,忽然有一天,他们相识,相爱。
距离变得很近。
然后有一天,不再相爱了,本来很近的两个人,变得很远,甚至比以前更远。
