常见化学元素性质 全
化学元素性质大全
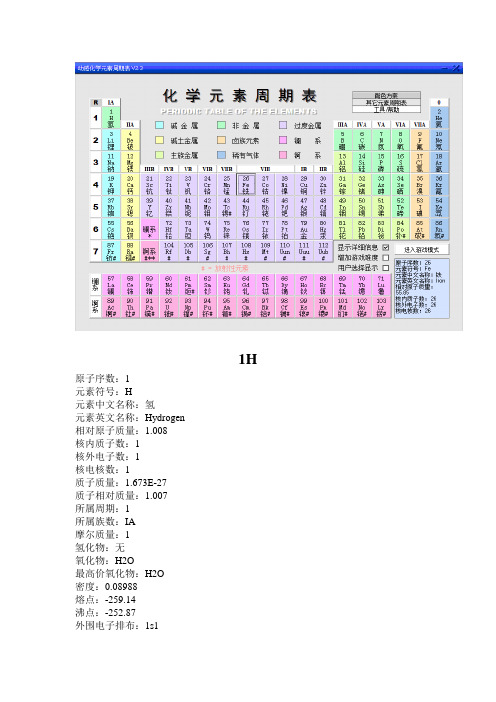
1H 原子序数:1元素符号:H元素中文名称:氢元素英文名称:Hydrogen相对原子质量:1.008核内质子数:1核外电子数:1核电核数:1质子质量:1.673E-27质子相对质量:1.007所属周期:1所属族数:IA摩尔质量:1氢化物:无氧化物:H2O最高价氧化物:H2O密度:0.08988熔点:-259.14沸点:-252.87外围电子排布:1s1核外电子排布:1颜色和状态:无色气体原子半径:0.79常见化合价+1,-1发现人:卡文迪许发现时间和地点:1766 英格兰元素来源:在地球上和地球大气中只存在极稀少的游离状态氢,锌与稀盐酸反映制取是一种办法,电解水方法。
元素用途:导热能力特别强,跟氧化合成水。
氢气球。
氢能源。
工业制法:电解水2H2O=O2+2H2实验室制法:锌与稀盐酸反映Zn+2HCl=ZnCl2+H2其他化合物:H2O-水H2S-硫化氢HCl-氯化氢HBr-氢溴酸H2SO4-硫酸NH3-氨气CH4-甲烷扩展介绍:利用氢的同位素氘和氚的原子核聚变时产生的能进行杀伤和破坏的炸弹,其威力比原子弹大得多2He原子序数:2元素符号:He元素中文名称:氦元素英文名称:Helium相对原子质量:4.003核内质子数:2核外电子数:2核电核数:2质子质量:3.346E-27质子相对质量:2.014所属周期:1所属族数:0摩尔质量:4氢化物:氧化物:密度:0.1785熔点:-272.0沸点:-268.6外围电子排布:1s2核外电子排布:2颜色和状态:无色气体原子半径:0.49常见化合价:0发现人:严森、洛克耶、拉姆塞、克利夫发现时间和地点:1895 苏格兰/瑞典元素来源:存在于整个宇宙中元素用途:可用来填充灯泡和霓虹灯管,亦用来制造泡沫塑料。
液态氦常用做冷却剂工业制法:实验室制法:其他化合物:扩展介绍:一种极轻的无色惰性气态元素,是所有气体中最难液化的,存在于整个宇宙中,但只在某些天然气中含有在经济上值得提取的量,主要用于填充飞艇和气球3Li原子序数:3元素符号:Li元素中文名称:锂元素英文名称:Lithium相对原子质量:6.941核内质子数:3核外电子数:3核电核数:3质子质量:5.019E-27质子相对质量:3.021所属周期:2所属族数:IA摩尔质量:7氢化物:LiH氧化物:Li2O最高价氧化物:Li2O密度:0.534熔点:180.5沸点:1347.0外围电子排布:2s1核外电子排布:2,1颜色和状态:银白色金属原子半径:2.05常见化合价+1发现人:阿尔费德森发现时间和地点:1817 瑞典元素来源:电解熔融的锂盐(LiCl)制取元素用途:造锂电池,可应用在原子能工业上,亦可制造特种合金、特种玻璃等。
初中化学元素性质概述

初中化学元素性质概述化学元素是构成物质的基本单元,它们具有不同的性质和特征。
在初中化学学习中,我们需要了解和掌握各个元素的性质,这将对我们理解化学反应和物质变化有着重要的作用。
本文将对初中化学元素的性质进行概述。
一、元素的物理性质1. 金属元素:金属元素具有良好的导电性、导热性和延展性。
它们通常是固体的,具有金属光泽和高密度。
常见的金属元素有铁、铜、锌等。
2. 非金属元素:非金属元素通常具有较差的导电性和导热性,一般是气体、液体或者固体。
它们通常没有金属光泽,而是呈现出不同的颜色。
常见的非金属元素有氧、氮、氢等。
3. 半金属元素:半金属元素具有金属和非金属元素的一些性质,既能导电又能半导体或者绝缘体,它们常用于电子产业。
硅、锑等是常见的半金属元素。
二、元素的化学性质1. 金属元素的化学性质:金属元素容易失去电子形成正离子,具有较强的还原性。
常见的金属元素在与非金属元素反应时往往会失去电子。
金属元素与酸反应可以生成盐和释放氢气。
2. 非金属元素的化学性质:非金属元素通常会接受电子形成负离子,具有较强的氧化性。
非金属元素与金属元素反应时通常会得到电子。
非金属元素与氧气反应可以生成氧化物。
3. 半金属元素的化学性质:半金属元素的化学性质介于金属元素和非金属元素之间。
半金属元素既能失去电子形成正离子,也可以接受电子形成负离子。
三、物质的性质和元素的特征1. 元素组成的物质通常具有特征性质:物质的性质往往与其组成元素的性质有关。
例如,氧气是由两个氧元素组成的,具有无色、无味、质轻和易燃的性质;氮气由两个氮元素组成,具有无色、无味、质轻和不燃的性质。
2. 化合物的性质由元素比例决定:化合物是由两个或多个不同元素的原子按照一定的比例组成的。
化合物的性质往往由组成该化合物的元素的性质和比例决定。
例如,氯化钠是由一个钠元素和一个氯元素组成的,具有味咸和易溶于水的性质。
3. 混合物的性质与元素性质相互影响:混合物是由两个或多个不同元素或化合物的物质混合而成,每个组成部分的性质保持不变。
化学常见化学元素及其性质

化学常见化学元素及其性质化学元素是构成物质的基本单位,它们具有独特的性质和特征。
本文将介绍一些常见的化学元素以及它们的一些重要性质。
1. 氢(H)氢是宇宙中最常见的元素之一,它常以分子态(H₂)存在。
氢是一种无色、无味、无毒的气体,在高温下会燃烧。
氢是轻量级元素,它在化学反应中常作为电子的供体参与。
同时,氢还是制备氨、氢气等重要化学物质的原料。
2. 氧(O)氧是地球上最丰富的元素之一,常以二氧化物(O₂)的形式存在。
氧是一种无色、无味的气体,对生命起着重要的作用。
氧是许多燃烧反应的必需品,也是生物体进行呼吸和能量产生的关键。
氧还参与许多化学反应,如氧化反应等。
3. 碳(C)碳是一种非金属元素,它是生命的基本元素,常以纤维、石墨和金刚石等形式存在。
碳是一种非常稳定的元素,它具有高熔点和高沸点。
碳是有机化学的基础,几乎所有的有机物都包含碳。
碳还能形成多种化合物,如二氧化碳和甲烷等。
4. 氮(N)氮是空气中占比最高的元素之一,常以氮气(N₂)的形式存在。
氮是无色、无味的气体,对生命体来说是不可或缺的。
氮是许多生物分子的组成部分,如蛋白质和核酸。
氮在化学反应中常参与氧化和还原反应,同时也是许多农业和工业过程的重要原料。
5. 铁(Fe)铁是地球上最常见的金属元素之一,它通常以铁矿石的形式存在。
铁是一种有色的金属,它具有良好的导电性和导热性。
铁是建筑、机械和制造业的重要材料,同时也是生命体内血红蛋白的主要组成部分。
6. 铜(Cu)铜是一种有色金属,常以铜矿石的形式存在。
铜具有良好的导电性和导热性,是许多电子和电器产品的主要材料之一。
铜还具有良好的抗菌性能,在医疗和食品工业中有广泛应用。
7. 金(Au)金是一种珍贵的贵金属,它以黄色的形式存在。
金是具有高度稳定性的金属,具有良好的韧性和延展性。
由于其独特的性质和稀缺性,金被广泛用于珠宝首饰、货币和高端电子产品中。
总结:化学元素是构成物质的基本单位,每个元素都具有独特的性质和特征。
初中化学八种元素基本特性

初中化学八种元素基本特性化学是研究物质组成、结构、性质以及变化规律的科学,其中元素是构成物质的基本单位。
初中化学通常会介绍一些常见的元素及其基本特性。
本文将介绍八种初中化学常见的元素以及它们的基本特性。
1. 氢 (H)- 符号:H- 原子序数:1- 原子量:1.008- 物态:气体- 导电性:不导电- 化学性质:与氧气反应生成水2. 氧 (O)- 符号:O- 原子序数:8- 原子量:15.999- 物态:气体- 导电性:不导电- 化学性质:支持燃烧和呼吸3. 碳 (C)- 符号:C- 原子序数:6- 原子量:12.011- 物态:固体- 导电性:不导电- 化学性质:作为有机化合物的基础,能形成多种化合物4. 氮 (N)- 符号:N- 原子序数:7- 原子量:14.007- 物态:气体- 导电性:不导电- 化学性质:构成空气中的主要成分,能形成多种化合物,如氨气5. 铁 (Fe)- 符号:Fe- 原子序数:26- 原子量:55.845- 物态:固体- 导电性:导电- 化学性质:易氧化,与氧气反应生成氧化铁6. 钙 (Ca)- 符号:Ca- 原子序数:20- 原子量:40.078- 物态:固体- 导电性:导电- 化学性质:是人体骨骼和牙齿中的重要成分,也是许多生物体内的必需元素7. 氯 (Cl)- 符号:Cl- 原子序数:17- 原子量:35.453- 物态:气体- 导电性:不导电- 化学性质:常以负离子的形式存在,与钠等金属形成盐类8. 硫 (S)- 符号:S- 原子序数:16- 原子量:32.06- 物态:固体- 导电性:不导电- 化学性质:能形成二价和六价化合物,如二氧化硫和硫酸这些是初中化学中常见的八种元素及其基本特性。
深入理解这些元素的特性有助于我们对物质及其性质的认识。
化学常见元素的化学性质

化学常见元素的化学性质化学常见元素是指在自然界中较为广泛存在的元素,它们具有丰富的化学性质,包括原子结构、电子构型以及化合价等。
本文将对一些常见元素的化学性质进行介绍。
一、氧气(O)氧气是自然界中最常见的元素之一,具有高度活泼的化学性质,主要表现为氧化性。
氧分子中两个氧原子间的共用电子对构成氧键,使得氧分子比较稳定。
在许多化学反应中,氧气可以与其他物质直接发生反应,产生氧化产物。
例如,氧气与金属反应可生成金属氧化物,与非金属反应可生成氧化酸等。
二、氮气(N)氮气是大气中主要成分之一,其化学性质较为稳定。
氮气分子中三个氮原子间的共用电子对构成稳定的氮键。
氮气本身不易与其他物质反应,但在高温高压条件下,氮气能与氢气反应生成氨气(NH3),并通过该反应制造合成氨的工业过程。
三、碳(C)碳是生命的基础元素之一,具有丰富的化学性质。
碳元素具有四个价电子,能形成共价键和独特的碳链结构,因此能够与其他元素形成极为复杂的化合物。
碳的化学性质对构成有机化合物至关重要,生命体内的蛋白质、碳水化合物以及核酸等都是由碳构成的。
四、氢气(H)氢气是宇宙中最丰富的元素之一,其化学性质也较为活泼。
氢元素只有一个价电子,因此它会与其他元素发生共价键形成化合物。
氢气是一种很好的还原剂,它可以与氧气反应生成水,同时氢气还可以与非金属形成各种氢化物,如氨气(NH3)、氢氯酸(HCl)等。
五、石碱金属(钠Na、钾K)石碱金属具有非常活泼的化学性质,在常温常压下与氧气、水等反应非常剧烈。
它们都是单质金属,能够与水发生剧烈反应生成氢气,并产生碱性溶液。
此外,它们也常用于与非金属元素形成化合物,如与氧气反应生成金属氧化物以及与卤素(如氯Cl、溴Br)形成盐等。
六、卤素(氟F、氯Cl、溴Br、碘I)卤素是具有较强反应性的元素,常见于自然界中的化合物中。
其中氯和溴在水溶液中呈现淡黄色或黄色,碘则呈现紫色。
卤素的性质变化由上至下逐渐减弱,例如氟具有最强的氧化性,而碘的氧化性相对较弱。
常见化学元素性质全

常见化学元素性质全化学元素是组成物质的基本单位。
每个元素都有其独特的性质,包括物理性质和化学性质。
下面是常见化学元素的一些性质的简要概述。
1.氢(H):氢是宇宙中最常见的元素之一、物理上,氢是一种无色、无臭的气体。
化学上,氢是一种高度活性的元素,它与氧气反应产生水,并与多种元素形成化合物。
2.氧(O):氧是地球上最丰富的元素之一、它是一种无色、无味、无臭的气体。
氧是生物体进行呼吸和燃烧所必需的。
此外,氧还可以形成许多化合物,如水和二氧化碳等。
3.碳(C):碳是生命的基础。
它存在于地壳、大气和水中,并组成有机物的基础。
碳具有高熔点和高沸点,可以在高温下形成钻石。
此外,碳还可以形成多种化合物,如甲烷、乙烯和乙醇等。
4.氮(N):氮是大气中最常见的元素之一、它是一种无色、无臭的气体。
氮在生物体中扮演着重要的角色,如构成蛋白质和核酸等生物分子。
此外,氮还可以形成许多氮化物化合物。
5.卤素:卤素包括氯(Cl)、溴(Br)、碘(I)和氟(F)等元素。
它们都是高度活性的化学元素,通常以配子的形式存在。
卤素可以形成很多盐类化合物,并在生物体中起重要的作用,如维持酸碱平衡。
6.金属元素:金属元素具有良好的电导性和热导性。
典型的金属元素包括铁(Fe)、铜(Cu)、铝(Al)和锌(Zn)等。
金属元素在工业、建筑和电子行业中有广泛的应用。
7.半金属元素:半金属元素是介于金属和非金属之间的元素,具有金属和非金属元素的一些性质。
典型的半金属元素包括硅(Si)、锑(Sb)和硒(Se)等。
8.非金属元素:非金属元素通常不具有良好的电导性和热导性。
典型的非金属元素包括氢(H)、氧(O)、氮(N)和碳(C)等。
非金属元素在生物体内扮演着重要的角色,并且常常与金属元素形成化合物。
9.过渡金属元素:过渡金属元素位于元素周期表的中间区域。
它们具有良好的导电性和热导性,并且在催化、电池和合金制备等方面具有广泛的应用。
典型的过渡金属元素包括铁(Fe)、铜(Cu)、锰(Mn)和钼(Mo)等。
初中化学常见元素的符号及其性质

初中化学常见元素的符号及其性质化学是一门关于物质组成、性质及其变化的科学,而元素是构成物质的基本单位。
初中化学课程中,我们需要熟悉并了解一些常见元素及其符号和性质。
本文将按照元素符号的字母顺序,介绍一些常见元素的符号及其性质。
1. 氧元素(O)氧元素是自然界中最常见的元素之一,它的符号是O。
氧气是一种无色、无味、无臭的气体,能使火焰燃烧更旺盛。
氧气是支持燃烧的气体,许多化学反应都必须消耗氧气。
氧气也是生物呼吸过程中必需的。
2. 碳元素(C)碳元素是生命的基础,它的符号是C。
碳是一种非金属元素,具有很高的熔点和沸点。
它是有机物的主要元素,与氢、氧等元素结合形成无数的有机化合物。
身体的蛋白质、脂肪和糖类等都含有碳元素。
3. 氮元素(N)氮元素的符号是N,它是自然界中广泛存在的元素之一。
氮气是一种无色、无臭的气体,在空气中占据很大比例。
氮气不像氧气那样能支持燃烧和生物呼吸,但它在植物生长过程中起着重要的作用。
4. 氢元素(H)氢元素的符号是H,它是最轻的元素之一。
氢气是一种无色、无味、无臭的气体,是宇宙中最丰富的原子。
氢元素是构成水的重要成分,也是常见的燃料之一。
5. 铁元素(Fe)铁元素的符号是Fe,它是一种常见的过渡金属元素。
铁是一种坚硬的、有磁性的金属,具有良好的导电和导热性能。
铁元素在建筑、制造和冶金等行业中广泛应用。
6. 锌元素(Zn)锌元素的符号是Zn,它是一种质地较软的金属。
锌具有良好的耐腐蚀性,在防止铁制品生锈方面起到重要的作用。
锌也是人体所需的微量元素之一。
7. 铜元素(Cu)铜元素的符号是Cu,它是一种良好的导电材料。
铜是一种坚硬的金属,具有良好的导热性和可塑性。
由于这些特性,铜被广泛应用于电线、管道和电子产品等领域。
8. 氯元素(Cl)氯元素的符号是Cl,它是一种易挥发的、有毒的非金属元素。
氯气是一种黄绿色的气体,在化学实验室中常用于消毒和漂白。
氯元素还与钠元素结合形成食盐,是我们日常饮食中必需的。
化学学科常见元素及其性质

化学学科常见元素及其性质化学学科是一门研究物质的组成、性质、结构和变化规律的科学。
在化学学科中,元素是构成物质的基本单位。
元素是由原子组成的,每种元素都具有独特的性质和特征。
在本文中,我们将探讨一些常见的元素及其性质。
1. 氢(H)氢是宇宙中最常见的元素之一。
它是一种无色、无味、无臭的气体。
氢具有低密度和高燃烧性。
它是许多化合物的组成部分,如水(H2O)和氨(NH3)。
氢也可以作为燃料使用,用于产生能量。
2. 氧(O)氧是地球上最常见的元素之一。
它是一种无色、无味、无臭的气体。
氧是生物体呼吸所需的气体,它参与了许多生物过程,如有机物的氧化和能量的产生。
氧也可以与其他元素形成化合物,如二氧化碳(CO2)和水(H2O)。
3. 碳(C)碳是生命的基础元素之一。
它是一种固体,具有黑色外观。
碳是有机物的主要组成部分,如葡萄糖、脂肪和蛋白质。
碳还可以形成大量的化合物,如二氧化碳(CO2)和甲烷(CH4)。
4. 氮(N)氮是大气中的主要成分之一。
它是一种无色、无味、无臭的气体。
氮是生物体中蛋白质和核酸的组成部分。
氮也可以与其他元素形成化合物,如氨(NH3)和硝酸盐(NO3-)。
5. 铁(Fe)铁是地球上最常见的金属之一。
它是一种固体,具有银白色外观。
铁是许多物质的重要组成部分,如钢和铁矿石。
铁还具有良好的导电性和磁性。
6. 铜(Cu)铜是一种常见的金属。
它是一种固体,具有红褐色外观。
铜是良好的导电体,广泛应用于电线和电路板制造。
铜还具有抗菌性能,常用于制作铜器和医疗器械。
7. 氯(Cl)氯是一种常见的非金属元素。
它是一种黄绿色气体。
氯是许多化学物质的重要组成部分,如盐酸(HCl)和氯化钠(NaCl)。
氯也具有消毒和杀菌的作用,常用于水处理和游泳池消毒。
8. 钙(Ca)钙是地壳中含量最丰富的金属元素之一。
它是一种银白色金属。
钙是骨骼和牙齿的主要成分,也参与了神经传导和肌肉收缩等生物过程。
钙还广泛应用于建筑材料、肥料和药物制造。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H 核内无中子;原子半径最小;在IA族中,但属非金属;唯一能形成裸露阳离子的非金属元素。
最外层电子数=电子总数=电子层数=周期数=主族序数。
H2为最轻的气体。
第ⅠA族中能形成共价化合物的元素;在化合物中其数目改变,质量分数变化不大;与O可生成两种液体(H2O、H2O2)。
He最外层电子数(2个)是电子层数的2倍,是最轻的稀有气体,一般不参加反应。
Li最轻的金属(密度最小的金属)。
最外层电子数=电子层数的一半(1/2)=次外层电子数的一半(1/2);次外层电子数=电子层数;周期数=主族序数的2倍。
唯一不能形成过氧化物的碱金属元素。
密保存于石蜡中。
Be相同质量情况下与酸反应放出H2最多的金属;最高价氧化物及其水化物既能与强酸反应又能与强碱反应。
最外层电子数=电子层数=次外层电子数=核外电子总数的一半(1/2);周期数=主族序数。
B最外层电子数比次外层电子数多1。
硼酸(H3BO3)可用于洗涤不小心溅在皮肤上的碱液的药品;硼砂(Na2B4O7•10H20)为制硼酸盐玻璃的材料。
C 12C作为相对原子质量的标准;气态氢化物含氢量最高;是形成化合物最多的元素;金刚石是天然矿物中最硬的物质;石墨是一种有金属光泽且能导电的混合晶体单质。
次外层电子数=电子层数=最外层电子数的一半(1/2);主族序数=周期数的2倍;最高正价=最
低负价的绝对值。
CO2通入石灰水生成沉淀再消失;CO2灭火;CO2充汽水。
氧化物CO、CO2;简单氢化物CH4,正四面体结构,键角109°28′;最高价含氧酸H2CO3;
N氮元素是植物所需的三大元素之一;气态氢化物水溶液呈碱性且溶解度最大;气态氢化物可以与其最高价氧化物对应水化物发生化合反应;液态时可以做致冷剂;其单质化学性质较稳定,可用于填充灯泡、储存粮食和焊接金属的保护气;HNO3为实验室中常备的三大强酸之一。
最外层电子数比次外层多3个;最高正价与负价绝对值之差为2。
氢化物NH3;氧化物形式最多(6种);含氧酸有HNO3,HNO2;气态氢化物水溶液唯一呈碱性;常见离子化合物NH4C1中含配位键;NH4+正四面体结构;HNO3与金属不产生氢气。
O地壳中含量最多的元素;气态氢化物(H20)常温下呈液态;单质有两种同素异形体,它们对生物的生存均有重大意义。
最外层电子数=次外层电子数的3倍=电子层数的3倍;主族序数=周期数的3倍;周期数与主族序数之和为8;最高正价与负价绝对值之差为4。
外层电子是次外层的三倍;地壳含量最多;空气体积的21%;与金属生成金属氧化物;H2O2、H2O、Na2O2等化合物特殊形式;O2能助燃。
F是最活泼的非金属元素,能与稀有气体反应,无正价;其单质与水剧烈反应是唯一能放出O2的非金属;氟单质与其氢化物均有剧毒,
氢化物的水溶液为弱酸性,能腐蚀玻璃。
最外层电子数比次外层多5个,最高正价与负价绝对值之差为6;同周期中原子半径最小(除H 外的前18号元素中原子半径最小的元素)。
除H外前18号元素原子半径最小;无正价;不能被任何物质氧化;能与水反应置换出水中的氧;CaF2难溶,AgF能溶于水;没有含氧酸;HF为弱酸。
Ne最外层电子数=次外层电子数的4倍=电子层数的4倍,化学性质极不活泼。
Na可与冷水剧烈反应,放出M,密度比水小,常保存在煤油中;焰色反应为黄色。
最外层电子数=K层电子数的1/2;周期数=主族序数的3倍。
前18号元素中原子半径最大的元素且金属活动性最强。
它的一种氧化物Na2O2具有强氧化性,常用作供氧剂。
前18号元素原子半径最大;碱为NaOH;Na2O、Na2O2等特殊物质;Na2O2漂白及与H2O、CO2反应放O2;与K的合金是原子能反应堆的导热材料。
Mg最外层电子数=最内层电子数,次外层电子数=最外层电子数的4倍,L层电子数为K层和M层电子总数的2倍。
Mg(OH)2难溶性中强碱;Mg遇冷水难反应,遇热水能放H2;MgCl2苦卤;MgSO4泻盐。
Al Al是地壳中含量居第三位的元素且是含量最多的金属元素;最高价氧化物及其水化物既能与强酸反应又能与强碱反应;Al在冷的浓H2S04和冷的浓HNO3中钝化,A12(SO4),是泡沫灭火器的主要成
分;明矾[KAl(S04)2•12H20]常作净水剂。
最外层电子数=电子层数;最外层电子数比最内层电子数多1,比次外层电子数少5;主族序数=周期数。
;A1是两性金属;A12O3是两性氧化物;Al(OH)3是两性氢氧化物;地壳中含量最多的金属;KAl(SO4)2•12H2O明矾净水;A12(SO4)3与NaHCO3灭火。
Si地壳中含量居第二位的元素;虽不活泼但自然界中无游离态,人工能制得的纯度最高的单质,且是良好的半导体材料;最高价氧化物对应水化物(H4Si04)是一种难溶酸;Si02为硅酸盐水泥和玻璃的主要成分。
最外层电子数=K层电子数的2倍,最外层电子数=次外层电子数的一半(1/2),L层电子数为K层和M层电子数的积;最高正价=最低负价的绝对值。
SiO2唯一原子晶体氧化物(中学课本内);气态氢化物SiH4;含氧酸有H4SiO4,H2SiO3比碳酸弱,是唯一难溶酸;硅酸盐水泥,玻璃的主要成分是SiO2。
P它是植物所需的三大元素之一;常见的磷单质有白磷和红磷两种,互为同素异形体,白磷的着火点较低且极易自燃。
最外层电子数比次外层少3个,,L层电子数比K层和M层电子数的和多1;最高正价与负价绝对值之差为2。
PH3鬼火燃烧;P4白磷分子晶体,键角为60°;对应酸H3PO4、HPO3等,磷酸通常为固体
S S单质为淡黄色固体,是黑火药的主要成分之一;其氢化物(H2S)有臭鸡蛋气味,S02是一种大气污染气体,可形成“酸雨”,且二者在常温下就能发生反应生成单质S;H2S04为实验室中常备的三大强
酸之一。
最外层电子数=电子层数的2倍=最内层电子数的3倍,最外层电子数+最内层电子数=次外层电子数;最高正价与负价绝对值之差为4。
1~18号元素中离子半径最大硫铁矿(黄色)FeS2中S呈-1价;SO2、SO3中S各占50%和40%;H2SO4与NaCl制取HCl;NaHSO4与NaCl反应制得HCl;
硫黄通常为黄色晶体粉末,易溶于CS2;S用于除去液态金属Hg。
C1 Cl为非常活泼的非金属元素,Cl2为黄绿色有剧毒的气体;气态氢化物的水溶液和最高价氧化物对应水化物均为强酸,且后者为无机含氧酸中最强的酸,HCl为实验室中常备的三大强酸之一;单质的水溶液有漂白性,常用于自来水的消毒。
最外层电子数比次外层电子数少1;最高正价与负价绝对值之差为6。
含氧酸HClO、HClO2、HClO3、HClO4;HClO4比硫酸还强;HCl与MnO2制C12;电解饱和食盐水制C12,C12使湿润的淀粉KI试纸变蓝。
Ar单质性质稳定,一般不参加化学反应,常用于焊接金属的保护气及填充灯泡。
最外层电子数=次外层电子数=最内层电子数的4倍=8。
