基础化学复习题库
基础化学复习题

一、选择题1.下列关于电子云的说法不正确的是( )A. 电子云是描述核外某空间电子出现的几率密度的概念;B. 电子云是│ψ│2的数学图形;C. 电子云有多种图形,黑点图只是其中一种;D. 电子就象云雾一样在原子核周围运动,故称为电子云.2.下列说法不正确的是( )A. 氢原子中,电子的能量只取决于主量子数n;B. 多电子原子中,电子的能量不仅与n有关,还与l有关;C. 波函数由四个量子数确定;D. m s=±½表示电子的自旋有两种方式.3.n=4时m的最大取值为( )A. 4B. ±4C. 3D. 04.2p轨道的磁量子数可能有( )A. 1.2B. 0.1.2C. 1.2.3D. 0.+1.-15.原子中电子的描述不可能的量子数组合是( )A. 1.0.0.+½B. 3.1.1.-½C. 2.2.0.-½D. 4.3.-3.-½6.下列电负性大小顺序错误的是( )A. H>LiB. P<NC. Si>CD. Cl>Br7.下列说法错误的是( )A、电子的钻穿效应越强,电子能量越低;B、电子所受屏蔽效应越强,电子能量越低;C、n值相同,l越小,则钻穿效应越强;D、屏蔽效应和钻穿效应的结果引起能级交错.8.关于影响屏蔽常数σ大小的因素,正确的说法是( )A. 被屏蔽电子的l值越小,σ值越大;B. 屏蔽电子的n值越小,σ值越大;C. 被屏蔽电子离核越远,σ值越大;D. 屏蔽电子的数目越少,σ值越大;9.基态原子的核外电子在原子轨道上的能量大小关系不正确的是()A. 3s>2sB. 3p>3sC. 4s>3dD. 3d>3s10.下列关于原子半径的周期性变化描述不严谨的是()A.元素的原子半径随元素原子序数的递增呈周期性变化B.同周期元素随着原子序数的递增,元素的原子半径自左到右逐渐减小C.同主族元素随着原子序数的递增,元素的原子半径自上而下逐渐增大D.电子层数相同时,有效核电荷数越大,对外层电子的吸引作用越强11.下列各离子的电子排列式错误的是()A. Na+1s22s22p6B. F¯1s22s22p6C N3+ 1s22s22p6 D. O2¯1s22s22p612.下列有关认识正确的是()A.各电子亚层的原子轨道数量按s、p、d、f的顺序分别为1、3、5、7 B.各电子层的电子亚层能级都是从s能级开始至f能级结束C.各电子层含有的电子亚层数为n-1D.各电子层含有的电子数量为2n213.Ca原子的电子排布式写成1s22s22p63s23p63d2,其违背了()A.能量最低原理B.能量守恒原理C.泡利不相容原理D.洪特规则14.共价键最可能存在于()。
化学基础复习题(附答案)

化学基础复习题(附答案)一、单选题(共100题,每题1分,共100分)1、下列化合物中,不能发生酯化反应的是A、HCOOHB、CH3COOHC、CH3CH2OHD、CH3CHO正确答案:D2、能与浓溴水反应生成白色沉淀的是()A、乙烯B、苯酚C、乙醇D、苯正确答案:B3、乙醇沸点(78.3℃)与分子量相等的甲醚沸点(-23.4℃)相比高得多是由于 ( )A、乙醇能形成分子间氢键,甲醚不能B、甲醚能与水形成氢键C、甲醚能形成分子间氢键,乙醇不能D、乙醇能与水形成氢键,甲醚不能正确答案:A4、分子中含有碳碳双键的是( )A、苯B、丙烯C、乙炔D、聚乙烯正确答案:B5、下列使蛋白质变性的物理方法是( )A、紫外线照射B、加重金属盐C、加酸D、加有机溶剂正确答案:A6、一定温度下,加水稀释弱酸,数值将减小的是( )B、αC、pHD、[H+]正确答案:D7、与溶液渗透压大小有关的因素是A、溶质颗粒的大小B、溶质的颗粒总数C、溶质的性质D、溶剂的性质正确答案:B8、欲配制PH=4.50的缓冲溶液,若用HAc及NaAc配制,则c(HAc)及c(NaAc)的浓度之比为(HAc的pKa=4.76)( )A、4.76/1B、1/4.76C、1.78/1D、1/1.78正确答案:C9、下列哪项不属于羧酸衍生物()A、乳酸B、甲酸乙酯C、乙酰胺D、乙酸酐正确答案:A10、苯酚俗称()A、石炭酸B、溴苯C、苄醇D、甘油正确答案:A11、在常温下,pH=6的溶液与pOH=6的溶液相比,其氢离子浓度A、高10倍B、高2倍C、高100倍正确答案:C12、单糖与浓酸和α-萘酚反应能显紫色,这一鉴定糖的反应叫( )A、糖脎反应B、Seliwanoff反应C、成苷反应D、Molish反应正确答案:D13、下列不能做为配位体的物质是( )A、C6H5NH2B、CH3NH2C、NH4+D、NH3正确答案:C14、为了保证某工作液的PH值为4--5,应选用( )缓冲对配制缓冲溶液。
基础化学复习题
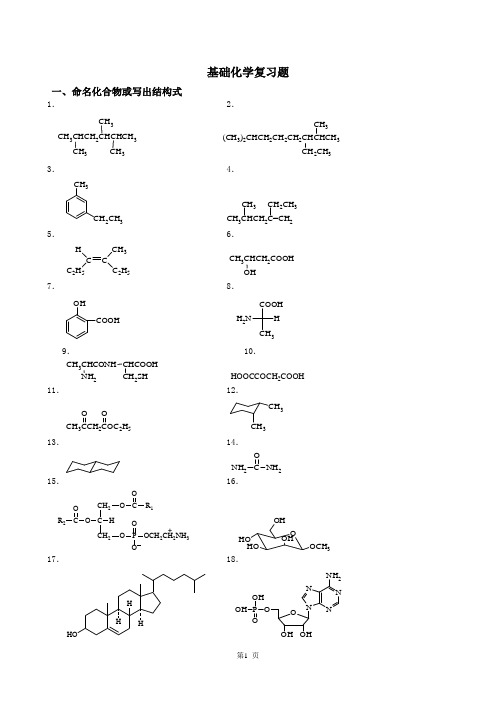
基础化学复习题一、命名化合物或写出结构式1. 2.CH 3CHCH 2CHCHCH 3CH 3CH 3CH 3(CH 3)2CHCH 2CH 2CH 2CHCHCH 3CH 2CH 3CH 33. 4.CH 3CH 2CH 3 CH 3CHCH 2C=CH 2CH 3CH 2CH 35. 6.C C H C 2H 53C 2H 5CH 3CHCH 2COOHOH7. 8.OHCOOHCOOHH 2NH CH 39. 10.CH 3CHCONH NH 2CHCOOHCH 2SH HOOCCOCH 2COOH11. 12.CH 3CCH 2COC 2H 5O OCH 3CH 313. 14. C NH 2NH 2O15. 16.CH 2C CH 2O O COR 1HO C P OCH 2CH 2NH 3O OO R 2+O HOHOOHOCH 3OH17. 18.HHH HONNNN NH 2OOHOH OOP OH OH19.苯酚 20.顺-2-丁烯 21.丙酮 22.乙酰苯胺 23.柠檬酸24.乙酸乙酯 25.阿司匹林 26.油酸 27.卵磷脂 28.葡萄糖29.半胱氨酸 30.赖氨酸二、是非题(正确的打✓,错误的打×)1.烷烃分子都是非极性分子。
()2.环己烷有两种构象,一种是椅式构象,一种是船式构象。
()3.在过氧化物存在下,烯烃与氯化氢的加成遵循马氏规则。
()4.凡是双键碳原子都是sp2杂化。
()5.乙烷有两种构象,一种是重叠式构象,一种是交叉式构象。
()6.碳原子的类型分为伯、仲、叔、季碳,氢原子的类型也分为伯、仲、叔、季氢。
()7.具有旋光性的物质一定存在对映异构现象。
()8.一对对映体的混合物能用蒸馏的办法分开。
()9.左旋2-丁醇和右旋2-丁醇的混合液可用蒸馏方法分开。
()10.只有一个手性碳原子的分子一定具有旋光性。
()11.一个分子结构中含有3个手性碳原子,则这个分子一定是手性分子。
基础化学题库

第二章原子结构一、选择题1、在多电子原子中,决定电子能量的量子数为()A、nB、n、l、mC、n、l、m、mD、n、ls2、在多电子原子中,决定电子原子轨道的量子数为()A、nB、n、l、mC、n、l、m、mD、n、ls3、在多电子原子中,决定电子运动状态的量子数为()D、n、lA、nB、n、l、mC、n、l、m、ms4、下列多电子原子能级能量最高的是()A、n=1,l=0B、n=2,l=0C、n=4,l=0D、n=3,l=25、下列各元素的基态原子的电子排布式违背了能量最低原理的是()A、C 1s22s32p1B、Li 1s22p1C、N 1s22s22px22py1D、O 1s22s22p46、2Px代表的意义是()A、Px轨道上有2个电子B、2个Px轨道C、Px轨道可以有两种伸展方向D、第二电子层上沿X轴方向伸展的P轨道7、在下列各电子亚层中,能容纳电子数最多的是()A、3dB、4pC、6sD、4f8、描述3S电子运动状态的量子数正确的一套是()A、(3,2,0,+1/2)B、(3,0,0,-1/2)C、(3,1,0,+1/2)D、(3,1,1,-1/2)9、下列各元素的基态原子的电子排布式违背了鲍利不相容原理的是()A、C 1s22s32p1B、Li 1s22p1C、N 1s22s22px22py1D、O 1s22s22p410列各元素的基态原子的电子排布式违背了洪特规则的是()A、C 1s22s32p1B、Li 1s22p1C、N 1s22s22px22py1D、O 1s22s22p411、描述2p运动状态的量子数正确的一套是()A、(2,1,0,1/2)B、(2,1,2,1/2)C、(2,0,1,1/2)D、(2,2,1,1/2)12、指出4d能级有几个轨道()A、1B、2C、4D、513、指出4f能级有几个轨道()A、2B、3C、7D、914、某基态原子的某电子量子数组合是(2,0,0,+1/2),它的轨道符号是()A、2sB、2PxC、2PyD、2Pz15、在多电子原子中,决定电子层的量子数为()D、n、lA、nB、n、l、mC、n、l、m、ms16、某一电子有下列成套量子数(n,l,m,m),其中不可能存在的是()sA、(3,2,2,1/2)B、(3,1,-1,1/2)C、(1,0,0,1/2)D、(2,-1,0,1/2)17、基态26Fe原子的最后填充的电子的四个量子数分别为()A、3,0,0,+1/2B、3,1,1,+1/2C、.3,2,0,+1/2D、4,0,0,+1/218、某一电子有下列成套量子数(n,l,m,ms),其中不可能存在的是()A、(3,3,2,1/2)B、(3,1,-1,1/2)C、(1,0,0,1/2)D、(2, 1,0,1/2)19、某一电子有下列成套量子数(n,l,m,ms),其中不可能存在的是()A、(3,2,2,1/2)B、(3,1,-1,1/2)C、(1,0,1,1/2)D、(2, 1,0,1/2)20、表示原子轨道角度分布的函数是()A、R(r)B、Y(Θ,r)C、. R(r) 2D、Y(Θ,r)221、同一原子中,可能存在下列量子数的两个电子()A、(1,1,0,+2/1 )和(1,0,0,-2/1 )B、(2,0,1,+2/1 )和(2,0,0,-2/1 )C、(3,2,0,-2/1 )和(3,2,1,-2/1 )D、(1,0,0,-2/1 )和(1,0,0,-2/1 )22、下列状态中不是基态的是()A、通常条件的气体H。
基础化学试题库(附参考答案)

基础化学试题库(附参考答案)一、判断题(共100题,每题1分,共100分)1.在实验室里,倾注和使用易燃、易爆物时,附近不得有明火。
A、正确B、错误正确答案:A2.缓冲溶液的缓冲能力是无限的。
A、正确B、错误正确答案:B3.当某弱酸稀释时,其解离度增大,溶液的酸度也增大。
A、正确B、错误正确答案:B4.用Na2C2O4标定KMnO4,需加热到70~80℃,在HCl介质中进行。
A、正确B、错误正确答案:B5.将0.1mol/LHAc稀释为0.05mol/L时,H+浓度也减小为原来的一半。
A、正确B、错误正确答案:B6.对于同类型的难容电解质,在一定的温度下,Ksp越小。
其溶解能力越小。
A、正确B、错误7.某物质如果含有6.02×1023个粒子,它的物质的量就是1mol。
A、正确B、错误正确答案:A8.由于溶液的体积随温度变化而变化,所以物质的量浓度也随温度的变化而改变。
A、正确B、错误正确答案:A9.标准物质在分析中主要用于分析仪器的校准和分析方法的评价。
A、正确B、错误正确答案:A10.质量百分比浓度是溶液的质量与溶质的质量的百分比。
A、正确B、错误正确答案:B11.在滴定分析中一般利用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定,这一点称为化学计量点。
A、正确B、错误正确答案:B12.将醋酸溶液加水稀释一倍,则溶液中的氢离子浓度就减少到原来的二分之一。
A、正确B、错误13.溶液的体积随温度变化而变化,但物质的量浓度不受温度变化的影响。
A、正确B、错误正确答案:B14.实验中,应根据分析任务、分析方法对分析结果准确度的要求等选用不同等级的试剂。
A、正确B、错误正确答案:A15.定量分析中产生的系统误差是可以校正的误差。
A、正确B、错误正确答案:A16.EDTA滴定某金属离子有一允许的最高酸度(PH值),溶液的PH 再增大就不能准确滴定该金属离子了。
A、正确B、错误正确答案:B17.在溶解过程中,溶质和溶剂的体积之和一定就是溶液的体积。
基础化学复习题

基础化学复习题work Information Technology Company.2020YEAR基础化学复习题单项选择题1. 理想气体绝热自由膨胀时,则 BA . 0U ∆>,0S ∆=B .0U ∆=,0S ∆>C . 0U ∆>,0S ∆>D .0U ∆=,0S ∆= 2.下面关于标准摩尔生成焓的描述中,不正确的是 CA.生成反应中的单质必须是稳定的相态单质B.稳态单质的标准摩尔生成焓被定为零C.生成反应的温度必须是298.15KD.生成反应中各物质所达到的压力必须是100KPa3. 理想气体在可逆的绝热膨胀过程中是 BA . 内能增加B . 熵不变C . 熵增大D . 温度不变 4. 封闭系统中吉布斯函数G 与热力学U 的关系是 DA. G > UB. G < UC. G = UD. 无固定关系A. 零级反应 B . 一级反应 C . 二级反应 D . 三级反应5.工作在100℃和25℃的两个大热源间的卡诺机其效率是 AA . 20%B . 25%C . 75%D . 100%6.若将人作为一个体系,则该体系是 CA .孤立体系 B.封闭体系 C.敞开体系 D.半封闭系统7.在100℃,101.325 kPa 下,1 mol 水全部向真空气化为100℃,101.325 kPa 的水蒸气,则该过程为 BA . ΔG < 0,不可逆B . ΔG = 0,不可逆C . ΔG > 0,不可逆D . ΔG < 0,可逆 8. 液态水在100℃及101.325 kPa 下汽化,则该过程的 DA . ΔH = 0B . ΔS = 0C . ΔA = 0D . ΔG = 09.对于封闭体系的热力学 , 下列各组状态函数之间的关系正确的是 B A . A > U B . A < U C . G < U D . H< A10. 下列各式表示偏摩尔量的是 AA . )(..(B A n P T B A n U≠⎪⎭⎫ ⎝⎛∂∂ B . )(..S (B A n P B A n H ≠⎪⎭⎫ ⎝⎛∂∂ C . )(..(B A n V T B A n A≠⎪⎭⎫ ⎝⎛∂∂ D . )(..B (B A n P T B A n ≠⎪⎭⎫ ⎝⎛∂∂μ 11.刚性绝热箱内发生一化学反应,则反应体系是 AA.孤立体系B.敞开体系C.封闭体系D.绝热体系 12. 已知反应C (s )+O 2(g) →CO 2 (g)的ΔH ,下列说法中不正确的是 C A . ΔH 为CO 2(g)的生成热 B . ΔH 为C (S )的燃烧热 C . ΔH 与反应的ΔU 数值不等 D . ΔH 与反应的ΔU 数值相等13.封闭系统中吉布斯函数A 与热力学U 的关系为 BA . A > UB . A < UC . A = UD . 无固定关系14. 热力学第三定律可以表示是 BA . 在0K 时,任何晶体的熵等于零B . 在0K 时,纯物质完美晶体的熵等于零C. 在0℃时,任何晶体的熵等于零 D . 在0℃时,完美晶体的熵等于零 15. 一级反应完成99.9%所需时间是完成50%所需时间是 C A . 2倍 B . 5倍 C . 10倍 D . 20倍 16. 选出下列性质参数中属于容量性质的量是 CA . 温度TB . 浓度cC . 体积VD . 压力p17. 在恒温,恒压下,已知反应A →2B 和2A →C 的反应热分别为ΔH 1和ΔH 2,则反应C →4B 的反应热ΔH 3是 DA .2ΔH 1+ΔH 2B . ΔH 2-2ΔH 1C . ΔH 1+ΔH 2D . 2ΔH 1-ΔH 2 18. 不挥发的溶质溶于溶剂中形成溶液之后将会引起C A . 熔点升高 B . 沸点降低C . 蒸汽压降低D . 总是放出热量19.下列是化学势的是 C A . )(..(B A n P T B A n U≠⎪⎭⎫ ⎝⎛∂∂ B . )(..(B A n P T B A n H ≠⎪⎭⎫ ⎝⎛∂∂ C . )(..(B A n V T B A n A≠⎪⎭⎫ ⎝⎛∂∂ D . )(..(B A n V T B A n G ≠⎪⎭⎫ ⎝⎛∂∂ 20. 在 - 10 °C, 101.325kPa 下,水的化学式势μ(水)与冰的化学势μ(冰)的大小关系应为 CA . μ(水)=μ(冰)B . μ(水) >μ(冰)C . μ(水) <μ(冰)D . 无法确定21. 理想气体从状态p 1V 1T 自由膨胀至p 2V 2T 。
化学基础习题库及答案

化学基础习题库及答案一、单选题(共100题,每题1分,共100分)1、下列化合物能与托伦试剂反应生成银镜的是()A、丙酸B、丙酮C、甲醇D、甲酸正确答案:D2、下列化合物中酸性最强的是()A、α-羟基丙酸B、β-羟基丙酸C、丙酸D、α,β-二羟基丙酸正确答案:D3、在氨溶液中加入少量盐酸,使:( )。
A、溶液OH-浓度变小B、NH3的Kb变大C、NH3的α增大D、pH值保持不变正确答案:C4、下列说法正确的是:()A、增大反应物的浓度,平衡向生成物浓度增大的方向移动。
B、有气体存在的可逆反应,该变压强,都会使化学平衡移动。
C、加热能使吸热反应速率加快,放热反应速率减慢,平衡向吸热反应方向移动。
D、凡能影响反应速率的因素,都能使化学平衡移动正确答案:A5、下列可用来区分葡萄糖和果糖的是( )A、斐林试剂B、苯肼C、托伦试剂D、赛利凡诺夫试剂正确答案:D6、 CH3CH2CH2CH3与CH3CH(CH3)2是什么异构体?( )A、碳架异构B、位置异构C、官能团异构D、互变异构正确答案:A7、既能发生水解反应,又能发生银镜反应的物质是()A、麦芽糖B、蔗糖C、丙酸甲酯D、葡萄糖甲苷正确答案:A8、欲使蛋白质沉淀而不变性,应选用( )A、浓硫酸B、重金属盐C、甲醛D、硫酸铵正确答案:B9、人体血浆中最重要的缓冲对是A、H2PO4 — HPO42-B、HCO3 — CO32-C、H2CO3 — HCO3-D、HPO42 — PO43-正确答案:C10、下列试剂中,常用于糖尿病患者尿液中葡萄糖含量检查的是( )A、FeCl3B、溴水C、班氏试剂D、茚三酮溶液正确答案:C11、医用生理盐水的质量浓度是多少?A、8g/LB、10g/LC、9g/LD、7g/L正确答案:C12、有关简单的饱和链烃的叙述:①都是易燃物;②特征反应都是取代反应;③相邻两个烷烃在分子上组成相差一个甲基。
正确的是( )A、②和③B、①和②C、①D、①和③正确答案:B13、可以用来判断油脂不饱和程度的是( )A、酸值B、皂化值C、碘值D、密度正确答案:C14、某缓冲溶液的共轭碱的Kb=1.0×10-6,从理论上推算该缓冲溶液的缓冲范围是( )A、5~7B、6~8C、7~9D、5~6正确答案:C15、 HPO42-的共轭酸是( )A、H2PO4-B、OH-C、H3PO4D、PO43-正确答案:A16、下列哪种物质具有致癌性( )A、蒽B、菲C、萘D、苯并芘正确答案:D17、下列有机物分子中不含有羧基的是()A、苯甲酸B、过氧乙酸C、乳酸D、苯酚正确答案:D18、人的肠胃不能消化的多糖是. ( )A、纤维素B、糖原C、右旋糖酐D、淀粉正确答案:A19、将淀粉碘化钾混合溶液装在半透膜中,浸泡在盛有蒸馏水的烧杯中,过一段时间后取出杯中液体进行试验,不能证明半透膜有破损的是:( )A、加入碘水变蓝B、加入碘化钠不变蓝C、加入FeCl3 溶液变蓝D、加入溴水变蓝正确答案:B20、下列化合物中无顺反异构现象的是()A、2-氯-2-丁烯B、2-甲基-2-丁烯C、3-甲基-2-戊烯D、2-丁烯正确答案:B21、下列不属于有机物的是 ( )A、HCOOHB、C2H4C、CH3OHD、HCN正确答案:D22、不能配制 pH = 7 左右的缓冲溶液的共轭酸碱混合物是( ) (已知HClO :K = 3.4 × 10-8 H2CO3 :K1 = 4.2 × 10-7 ,K2 = 5.6 × 10-11 H3PO4 :K1 = 7.6 × 10-3 ,K2 = 6.3 × 10-8 ,K3 = 4.4 × 10-13)A、NaHCO3-Na2CO3B、NaH2PO4-Na2HPO4C、HClO-NaClOD、H2CO3-NaHCO3正确答案:A23、构成蛋白质的基本单位是( )A、多肽B、β-氨基酸C、α-氨基酸D、肽链正确答案:C24、β-醇酸加热脱水生成( )。
大一基础化学复习题

基础化学复习题第一章溶液和胶体一、选择题1、将98%的市售浓硫酸500ml缓慢加入200g水中,所得到的硫酸溶液的质量百分浓度为(C)A 49%B 24.5%C 80.5%D 70%2、糖水的凝固点为(C)A 0℃B 高于0℃C 低于0℃D 难以判断3、下列0.1mol/L溶液的凝固点最高的是( B)A KClB CH3COOHC HClD K2SO44、在温度为375K时,沸水的压力应为(C )A 1000KPaB 10KPaC 高于100KPaD 低于100KPa5、在200g水中含有9g某非电解质溶液,其凝固点为-0.465℃,则溶液的摩尔质量为(D )A 135B 172.4C 90D 1806、某温度时,具有相同体积相同渗透压的甲醛和葡萄糖溶液中,甲醛和葡萄糖的质量比为(B )A 6:1B 1:6C 1:3D 3:17、胶体溶液中决定溶胶电性的物质时(B )A胶团B电位离子C反离子D胶粒8现有蔗糖,氯化钠,氯化钙三种溶液,它们的浓度均为0.1mol/L,则渗透压由高到低的顺序是(B )A CaCl2 < NaCl<C12H22O11B C12H22O11< NaCl < CaCl2C NaCl< C12H22O11<CaCl2D C12H22O11<CaCl2< NaCl9质量分数为5.8%NaCl溶液产生的渗透压接近:( C )(M(葡萄糖)=180g/mol,M(蔗糖)=342g/mol,M(NaCl)=58.5g/mol)A 5.8% 蔗糖溶液B 5.8% 葡萄糖C 2.0mol/L蔗糖溶液D 1.0mol/L葡萄糖溶液10在下列溶液组成标度的表示方法中,与温度有关的是( A )A 物质的量浓度B 质量分数C 物质的量分数D 质量摩尔浓度11非电解质稀溶液的蒸汽压下降,沸点升高和凝固点下降的数值取决于(B )A溶质的本性 B 溶液的质量摩尔浓度 C 溶液的体积 D 溶液的温度12 在等量的水中,分别加入质量相同的葡萄糖(M=180),蔗糖(M=342),KCl(M=74.5),CaCl2(M=111),其蒸汽压下降最少的是(A )A蔗糖溶液 B KCl溶液 C CaCl2 溶液D葡萄糖溶液13.某温度下,1mol/L糖水的饱和蒸汽压为P1,1mol/L的盐水的饱和蒸汽压为P2,则( B)A P2>P1B P2<P1C P2=P1D 无法判断二判断题1.由于溶液中溶质和溶剂的量是一定的,所以温度变化不影响溶液的浓度(×)2.难挥发非电解质稀溶液的依数性,不仅与溶液的浓度成正比,而且与溶质的种类有关(×)3.难挥发非电解质稀溶液在凝固时实际上是溶剂分子凝固(√)4.植物在较高温度下耐干旱是因为细胞液的蒸汽压下降所致(√)5. 渗透压力比较高的溶液,其渗透浓度也一定比较大(√)三填空题1 溶液的沸点升高是由于其蒸汽压 降低 的结果。
基础化学试题库与答案

基础化学试题库与答案一、判断题(共100题,每题1分,共100分)1.游离金属指示剂本身的颜色一定要和与金属离子形成的配合物颜色有差别。
A、正确B、错误正确答案:A2.溶解度在1~10g之间的物质叫微溶物质。
A、正确B、错误正确答案:B3.当某弱酸稀释时,其解离度增大,溶液的酸度也增大。
A、正确B、错误正确答案:B4.配制硫酸、盐酸和硝酸溶液时都应将酸注入水中。
A、正确B、错误正确答案:A5.影响氧化还原反应速度的主要因素有反应物的浓度、酸度、温度和催化剂。
A、正确B、错误正确答案:A6.在实验室里,倾注和使用易燃、易爆物时,附近不得有明火。
A、正确B、错误正确答案:A7.分析天平的稳定性越好,灵敏度越高。
A、正确B、错误正确答案:B8.缓冲溶液的缓冲容量大小只与缓冲比有关。
A、正确B、错误正确答案:B9.EDTA标准溶液采用间接法配制,原因是EDTA溶液不稳定。
A、正确B、错误正确答案:B10.凡是优级纯的物质都可用于直接法配制标准溶液。
A、正确B、错误正确答案:B11.由于K2Cr2O7容易提纯,干燥后可作为基准物直接配制标准溶液,不必标定。
A、正确B、错误正确答案:A12.由于K2Cr207容易提纯,干燥后可作为基准物自接配制标准液,不必标定。
A、正确B、错误正确答案:A13.酸碱指示剂的变色与溶液中的氢离子浓度无关。
A、正确B、错误正确答案:B14.炔烃的熔点、沸点比相应的烯烃高,密度稍大。
A、正确B、错误正确答案:A15.所有的烷烃分子都可以用普通命名法命名。
A、正确B、错误正确答案:B16.对于同类型的难容电解质,在一定的温度下,Ksp越小。
其溶解能力越小。
A、正确B、错误正确答案:A17.从分析天平称量所得的数据,应保留小数点后四位有效字。
A、正确B、错误正确答案:A18.凡是基准物质,使用之前都需进行干燥(恒重)处理。
A、正确B、错误正确答案:A19.生理盐水的浓度为0.9%,是指每100mL溶液中含0.9g的氯化钠。
大学基础化学题库及答案

大学基础化学题库及答案一、选择题1. 化学元素周期表中,元素按照什么顺序排列?A. 原子量B. 原子序数C. 电子数D. 质子数答案:B2. 下列哪种化合物是共价化合物?A. NaClB. CaOC. H2OD. FeS答案:C3. 摩尔质量的单位是:A. 克B. 千克C. 克/摩尔D. 千克/摩尔答案:C二、填空题1. 原子的核外电子排布遵循______原则,电子在原子核外按照能量的高低,依次填充在不同的能级上。
答案:能量最低2. 化学键分为______、______和金属键三种基本类型。
答案:离子键、共价键3. 1摩尔任何物质所包含的粒子数都等于阿伏伽德罗常数,其数值为______。
答案:6.02×10^23三、简答题1. 什么是化学反应的平衡常数?答案:化学反应的平衡常数是一个衡量化学反应在平衡状态下各物质浓度比的量,它只与温度有关,而与反应物和生成物的浓度无关。
2. 什么是酸碱中和反应?请简述其基本原理。
答案:酸碱中和反应是指酸和碱在一定条件下发生反应,生成盐和水的过程。
其基本原理是酸中的氢离子(H+)与碱中的氢氧根离子(OH-)结合生成水,同时酸和碱中的其他离子结合形成盐。
四、计算题1. 如果有1.5摩尔的硫酸(H2SO4),计算其含有的硫酸根离子(SO4^2-)的物质的量。
答案:硫酸根离子的物质的量为1.5摩尔硫酸中的硫酸根离子数量。
因为每个硫酸分子含有一个硫酸根离子,所以硫酸根离子的物质的量等于硫酸的物质的量,即1.5摩尔。
2. 已知某溶液中NaCl的物质的量浓度为0.1摩尔/升,求1升该溶液中含有的Na+和Cl-的粒子数。
答案:NaCl完全解离为Na+和Cl-,所以1升溶液中Na+和Cl-的物质的量均为0.1摩尔。
根据阿伏伽德罗常数,0.1摩尔的粒子数为0.1 × 6.02×10^23 = 6.02×10^22个。
五、实验题1. 描述如何使用滴定法测定溶液的pH值。
基础化学题库(题库+标准答案)

第二章稀溶液依数性练习题一、就是非题(共10题)1、溶液得沸点就是指溶液沸腾温度不变时得温度。
( )2、溶液与纯溶剂相比沸点升高、凝固点降低就是由于溶剂摩尔分数减小引起得。
( )3、等物质得量硝酸钾与碳酸钾分别加入等量得水中,该两溶液得蒸气压下降值相等。
( )4、凡就是浓度相等得溶液都就是等渗溶液。
( )5、溶液得蒸气压下降与沸点升高仅适用于难挥发得非电解质溶质,而凝固点降低及渗透压则不受此限制。
( )6、电解质浓溶液也有依数性变化规律,但不符合拉乌尔定律得定量关系。
( )7、一定量得电解质加入纯水中,此溶液得沸点一定高于100℃,但无法定律计算。
( )8、任何两种溶液用半透膜隔开,都有渗透现象发生。
( )9、分散质粒子大小在合适得范围内,高度分散在液体介质中就能形成稳定得溶胶。
( )10、 AlCl3、MgCl2、KCl三种电解质对负溶胶得聚沉值依次减小。
( )二、选择题 ( 共11题 )1、以下论述正确得就是(A)饱与溶液一定就是浓溶液(B)甲醇就是易挥发性液体,溶于水后水溶液凝固点不能降低(C)强电解质溶液得活度系数皆小于1(D)质量摩尔浓度数值不受温度变化2、已知乙醇与苯得密度分别为0、800 g·cm3与0、900 g·cm3,若将86、3cm3乙醇与 901 cm3苯互溶, 则此溶液中乙醇得质量摩尔浓度为( )(A) 1、52 mol·dm3 (B) 1、67 mol·dm3(C) 1、71 mol·kg1 (D) 1、85 mol·kg13、 2、5 g 某聚合物溶于 100 cm3水中, 20℃时得渗透压为 100 Pa, 则该聚合物得相对分子质量就是( )(A) 6、1×102 (B) 4、1×104 (C) 6、1×105 (D) 2、2×1064、 1、0 mol·dm3蔗糖得水溶液、1、0mol·dm3乙醇得水溶液与1、0 mol·dm3乙醇得苯溶液, 这三种溶液具有相同得性质就是 ( )(A) 渗透压 (B) 凝固点(C) 沸点 (D) 以上三种性质都不相同5、 1、17 % 得 NaCl 溶液产生得渗透压接近于( )(相对原子质量: Na 23, Cl 35、5) (A) 1、17 % 葡萄糖溶液 (B) 1、17 % 蔗糖溶液(C) 0、20 mol·dm3葡萄糖溶液 (D) 0、40 mol·dm3蔗糖溶液6、同温同浓度得下列水溶液中, 使溶液沸点升高最多得溶质就是( )(A) CuSO4 (B) K2SO4(C) Al2(SO4)3(D) KAl(SO4)27、要使溶液得凝固点降低 1、00℃ , 必须向 200 g 水中加入 CaCl2得物质得量就是(水得K f=1、86 K·kg·mol1)( )(A) 1、08 mol (B) 0、108 mol (C) 0、0540 mol (D) 0、0358 mol8、某难挥发非电解质稀溶液得沸点为 100、400℃ , 则其凝固点为 ( ) (水得K b= 0、512 K·kg·mol1, K f= 1、86 K·kg·mol1)(A) 0、110℃ (B) 0、400℃ (C) 0、746℃ (D) 1、45℃9、与纯溶剂相比,溶液得蒸气压( )(A) 一定降低(B) 一定升高(C) 不变(D) 需根据实际情况做出判断,若溶质就是挥发性很大得化合物就不一定降低10、 60℃时, 180 g水中溶有 180 g葡萄糖, 已知60℃时水得蒸气压为19、9kPa, C6H12O6得相对分子质量为 180, 则此水溶液得蒸气压应为( )(A) 1、81 kPa (B) 9、95 kPa (C) 15、9 kPa (D) 18、1 kPa11、若氨水得质量摩尔浓度为 mmol·kg1,则其中NH3得摩尔分数为( ) mm(A) ───── (B) ──────────1000/18 [(100017m)/18]+mm(C) ─────── (D) 不确定(1000/18) + m三、填空题 ( 共 8题 )1、 (2 分)体温为 37℃时, 血液得渗透压为 775 kPa, 此时与血液具有相同渗透压得葡萄糖(相对分子质量为 180)静脉注射液得浓度应为 __________________ g·dm3。
基础化学题库(题库+标准答案)

基础化学题库(题库+标准答案)第⼆章稀溶液依数性练习题⼀、是⾮题(共10题)1. 溶液的沸点是指溶液沸腾温度不变时的温度。
()2. 溶液与纯溶剂相⽐沸点升⾼、凝固点降低是由于溶剂摩尔分数减⼩引起的。
()3. 等物质的量硝酸钾和碳酸钾分别加⼊等量的⽔中,该两溶液的蒸⽓压下降值相等。
()4. 凡是浓度相等的溶液都是等渗溶液。
()5. 溶液的蒸⽓压下降和沸点升⾼仅适⽤于难挥发的⾮电解质溶质,⽽凝固点降低及渗透压则不受此限制。
()6. 电解质浓溶液也有依数性变化规律,但不符合拉乌尔定律的定量关系。
()7. ⼀定量的电解质加⼊纯⽔中,此溶液的沸点⼀定⾼于100℃,但⽆法定律计算。
()8. 任何两种溶液⽤半透膜隔开,都有渗透现象发⽣。
()9. 分散质粒⼦⼤⼩在合适的范围内,⾼度分散在液体介质中就能形成稳定的溶胶。
()10. AlCl3、MgCl2、KCl三种电解质对负溶胶的聚沉值依次减⼩。
()⼆、选择题( 共11题)1. 以下论述正确的是---------------------------------------------------------------------------()(A)饱和溶液⼀定是浓溶液(B)甲醇是易挥发性液体,溶于⽔后⽔溶液凝固点不能降低(C)强电解质溶液的活度系数皆⼩于1(D)质量摩尔浓度数值不受温度变化2. 已知⼄醇和苯的密度分别为g·cm-3和g·cm-3,若将⼄醇和901 cm3苯互溶, 则此溶液中⼄醇的质量摩尔浓度为-----------------------------------------------------( )(A) mol·dm-3(B) mol·dm-3(C) mol·kg-1(D) mol·kg-13. g 某聚合物溶于100 cm3⽔中, 20℃时的渗透压为100 Pa, 则该聚合物的相对分⼦质量是----------------------------------------------------------------------------------------------------( )(A) ×102(B) ×104(C) ×105(D) ×1064. mol·dm-3蔗糖的⽔溶液、·dm-3⼄醇的⽔溶液和mol·dm-3⼄醇的苯溶液, 这三种溶液具有相同的性质是-----------------------------------------------------------------( )(A) 渗透压(B) 凝固点(C) 沸点(D) 以上三种性质都不相同5. % 的NaCl 溶液产⽣的渗透压接近于-----------------------------------------------( )(相对原⼦质量: Na 23, Cl(A) % 葡萄糖溶液(B) % 蔗糖溶液(C) mol·dm-3葡萄糖溶液(D) mol·dm-3蔗糖溶液6. 同温同浓度的下列⽔溶液中, 使溶液沸点升⾼最多的溶质是--------------------------( )(A) CuSO4(B) K2SO4(C) Al2(SO4)3(D) KAl(SO4)27.要使溶液的凝固点降低℃, 必须向200 g ⽔中加⼊CaCl2的物质的量是(⽔的K f= K·kg·mol-1)--------------------------------------------------------------------------------( )(A) mol (B) mol (C) mol (D) mol8.某难挥发⾮电解质稀溶液的沸点为℃, 则其凝固点为---------------------( )(⽔的K b= K·kg·mol-1, K f= K·kg·mol-1)(A) ℃(B) ℃(C) ℃(D) ℃9. 与纯溶剂相⽐,溶液的蒸⽓压-----------------------------------------------------------------( )(A) ⼀定降低(B) ⼀定升⾼(C) 不变(D) 需根据实际情况做出判断,若溶质是挥发性很⼤的化合物就不⼀定降低10. 60℃时, 180 g⽔中溶有180 g葡萄糖, 已知60℃时⽔的蒸⽓压为kPa, C6H12O6的相对分⼦质量为180, 则此⽔溶液的蒸⽓压应为------------------------------------------------( )(A) kPa (B) kPa (C) kPa (D) kPa11. 若氨⽔的质量摩尔浓度为mmol·kg-1,则其中NH3的摩尔分数为---------------------( )mm(A) ─────(B) ──────────1000/18 [(1000-17m)/18]+mm(C) ───────(D) 不确定(1000/18) + m三、填空题( 共8题)1. (2 分)体温为37℃时, ⾎液的渗透压为775 kPa, 此时与⾎液具有相同渗透压的葡萄糖(相对分⼦质量为180)静脉注射液的浓度应为__________________ g·dm-3。
大一基础化学复习题

基础化学复习题第一章溶液和胶体一、选择题1、将98%的市售浓硫酸500ml缓慢加入200g水中,所得到的硫酸溶液的质量百分浓度为(C)A 49%B 24.5%C 80.5%D 70%2、糖水的凝固点为(C)A 0℃B 高于0℃C 低于0℃D 难以判断3、下列0.1mol/L溶液的凝固点最高的是( B)A KClB CH3COOHC HClD K2SO44、在温度为375K时,沸水的压力应为(C )A 1000KPaB 10KPaC 高于100KPaD 低于100KPa5、在200g水中含有9g某非电解质溶液,其凝固点为-0.465℃,则溶液的摩尔质量为(D )A 135B 172.4C 90D 1806、某温度时,具有相同体积相同渗透压的甲醛和葡萄糖溶液中,甲醛和葡萄糖的质量比为(B )A 6:1B 1:6C 1:3D 3:17、胶体溶液中决定溶胶电性的物质时(B )A胶团B电位离子C反离子D胶粒8现有蔗糖,氯化钠,氯化钙三种溶液,它们的浓度均为0.1mol/L,则渗透压由高到低的顺序是(B )A CaCl2 < NaCl<C12H22O11B C12H22O11< NaCl < CaCl2C NaCl< C12H22O11<CaCl2D C12H22O11<CaCl2< NaCl9质量分数为5.8%NaCl溶液产生的渗透压接近:( C )(M(葡萄糖)=180g/mol,M(蔗糖)=342g/mol,M(NaCl)=58.5g/mol)A 5.8% 蔗糖溶液B 5.8% 葡萄糖C 2.0mol/L蔗糖溶液D 1.0mol/L葡萄糖溶液10在下列溶液组成标度的表示方法中,与温度有关的是( A )A 物质的量浓度B 质量分数C 物质的量分数D 质量摩尔浓度11非电解质稀溶液的蒸汽压下降,沸点升高和凝固点下降的数值取决于(B )A溶质的本性 B 溶液的质量摩尔浓度 C 溶液的体积 D 溶液的温度12 在等量的水中,分别加入质量相同的葡萄糖(M=180),蔗糖(M=342),KCl(M=74.5),CaCl2(M=111),其蒸汽压下降最少的是(A )A蔗糖溶液 B KCl溶液 C CaCl2 溶液D葡萄糖溶液13.某温度下,1mol/L糖水的饱和蒸汽压为P1,1mol/L的盐水的饱和蒸汽压为P2,则( B)A P2>P1B P2<P1C P2=P1D 无法判断二判断题1.由于溶液中溶质和溶剂的量是一定的,所以温度变化不影响溶液的浓度(×)2.难挥发非电解质稀溶液的依数性,不仅与溶液的浓度成正比,而且与溶质的种类有关(×)3.难挥发非电解质稀溶液在凝固时实际上是溶剂分子凝固(√)4.植物在较高温度下耐干旱是因为细胞液的蒸汽压下降所致(√)5. 渗透压力比较高的溶液,其渗透浓度也一定比较大(√)三填空题1 溶液的沸点升高是由于其蒸汽压 降低 的结果。
初中化学基础知识题库

初中化学基础知识题库1. 物质的分类题目一:下列物质中,属于化合物的是()。
A. 氧气B. 水C. 汞D. 铁题目二:以下物质中,属于元素的是()。
A. 氩气B. 酒精C. 水银D. 盐题目三:以下物质中,属于混合物的是()。
A. 纯净水B. 二氧化碳C. 食盐水D. 铝2. 原子结构题目一:原子核的组成部分是()。
A. 质子和中子B. 质子和电子C. 电子和中子D. 电子和质子题目二:电子的质量与()相比可以忽略不计。
A. 质子B. 中子C. 原子核D. A、B和C均非常小题目三:原子序数等于()。
A. 质子数B. 中子数C. 质子数加中子数D. 电子数3. 元素周期表题目一:下列元素中,属于金属的是()。
A. 锌B. 溴C. 氧D. 硫题目二:钠的原子结构中,电子的排布顺序是()。
A. 2, 8, 1B. 1, 8, 2C. 2, 1, 8D. 1, 2, 8题目三:以下元素中,不属于同一周期的是()。
A. 氧B. 氮C. 氟D. 氖4. 化学反应题目一:下列化学反应中,属于氧化反应的是()。
A. 铁与硫反应生成硫化铁B. 氢气与氧气反应生成水C. 金属与酸反应生成盐和氢气D. 烧烤时木炭与氧气反应生成二氧化碳和水题目二:燃烧是一种()反应。
A. 氧化B. 还原C. 中和D. 合成题目三:在化学反应中,反应物转化为生成物需要克服的能量最低点称为()。
A. 活化能B. 反应速率C. 化学平衡D. 焓变5. 酸碱中和反应题目一:下列物质中,属于强碱的是()。
A. 醋酸B. 氨水C. 酒精D. 氢氧化钠题目二:下列物质中,属于弱酸的是()。
A. 盐酸B. 硫酸C. 醋酸D. 氢氟酸题目三:酸和碱中和反应的生成物是()。
A. 水和盐B. 水和氧气C. 水和碳酸D. 水和氨以上为初中化学基础知识题库的一部分,希望能对你的学习有所帮助。
请根据题目选择正确的答案。
《基础化学》复习题

《基础化学Ⅱ》复习题一、选择题1、下列有机基团叫做异丁基的是( )CH 3CH 2CH 2CH 2(CH 3)2CHCH 2CH 3CHCH 2CH 3(CH 3)3CA B C D2、将下列化合物按沸点降低的顺序排列正确的是( )①丁烷 ②己烷 ③3-甲基戊烷 ④2-甲基丁烷 ⑤2,3-二甲基丁烷 A ②>③>⑤>④>① B ③>②>⑤>④>① C ①>③>⑤>④>② D ②>③>④>⑤>① 3、下列碳正离子中,最稳定的是( )A CH 2=CH —CH 2+B CH 3—CH 2—CH 2+C CH 3—CH +—CH 3 D CH 2=CH —CH +—CH 34、结构CH 3CH==C (CH 3)2的烃中,下列哪种碳类型是不存在的( ) A 伯碳原子 B 仲碳原子 C 叔碳原子 D 季碳原子5、下列各组物质中,用Br 2/CCl 4试剂不能加以区别的是( )A 环丙烷和丙烷B 环已烯和环已烷C 1—丁炔和1—丁烯D 苯和苯乙烯6、分子式为C 4H 8化合物结构中,其中属于烯烃(包括顺反异构体)有( ) A 3种 B 4种 C 5种 D 6种7、按照“次序规则”基团大小的比较方法,下列四种基团中,其中最大的是( ) A —OH B —CH 2CH 3 C —COOH D —NO 2 8、正丁烷最稳定的构象是( )9、下列有机物结构中不存在顺反异构体的物质是( )CH 3CH=CH-CH 3CHBr=CH-CH 3CH 3H 3C (CH 3)2C=CHCH 3A B C D10、(反)1,2—二甲基环己烷最稳定的构象是( )11、在室温下往下列化合物中加AgNO 3醇溶液,即可生成沉淀的是( ) A 氯苯 B1-氯乙烷 C 苄氯 D1-氯丙烯 12、下列化合物在AgNO 3/C 2H 5OH 体系中最不易生成沉淀的是( )A CH 3ClB H 2C=CH-ClC CH 3CH 2ClD CH 2=CHCH 2-X13、下列关于卤代烃亲核取代反应历程特点描述,属于S N 2反应的特点是( ) A 反应速率与碱的的浓度无关 B 反应分两步进行 C 反应过程中生成活性中间体碳正离子 D 产物的构型完全转化 14、下列有机物发生硝化反应时,活性由强到弱顺序正确的是( ) NO 2ClOHCH 3④②③①A ①>②>③>④B ④>③>②>①C ③>④>②>①D ①>②>④>③ 15、下列物质名称叫做(R )-2-溴丁烷的是( )16、根据休克尔规则,下列化合物具有芳香性的的是( )17、将下列化合物的沸点最高的是 ( )A CH 3CH 2COOHB CH 3CH 2CH 2OHC CH 3CH 2CHOD CH 2CH 2CH 3 18、下列化合物碱性最强的是( )NH 2NH 2NH 2NH 2ABCDCH 3NO 219、下面化合物中,不能发生卤仿反应的是( )A CH 3CH(OH)CH 2CH 2CH 3B CH 3CH 2CH 2OHC CH 3COCH 2CH 2COCH 3D C 6H 5COCH 3 20、下列二元羧酸受热不放出CO 2的是 ( )A.COOH B. CH 2COOH C.CH 2COOH 2COOHD.(CH 2)5COOH COOH21、将RCH==CHCOOH 还原成RCH==CHCH 2OH 的还原剂是( )A LiAlH 4B Zn —Hg/HClC Zn+HClD Na+C 2H 5OH 22、可用来鉴别CH 3CHO 和CH 3COCH 3的试剂是( )A 2,4-二硝基苯肼B 托伦试剂C NaHSO 3D I 2+NaOH 23、氯化重氮苯与下列化合物发生偶联反应时,最难反应的是( )NH 2NH 2NHCH 3NH 2ABCDCH 3NO 224、下列化合物属于单糖的是 ( )A 蔗糖B 乳糖C 糖原D 核糖 25、亲电取代反应活性最大的是 ( )A 吡咯B 苯C 噻吩 D.呋喃 26、与NaHSO 3反应速率最小的是 ( )A Ph 2COB CH 3CHOC HCHOD PhCHO27、下列化合物酸性最弱的是( )COOH COOHCOOHCOOHO-CH 3CH 3NO 2ABCD28、下列物质中碱性最强的是A 对甲苯胺B 苄胺C 2,4-二硝基苯胺D 对硝基苯胺 29、下列化合物易发生水解反应的是 ( )CH 3ClClNO 2NO 2ClO 2Cl.. D.C.B A30、下列物质中水解反应速度最快的是( )A CH 3COClB CH 3CONHCH 3C (CH 3CO)2OD CH 3COOC 2H 531、反-1-甲基-3-叔丁基环己烷的优势构象为( )CH 3C(CH 3)3C(CH 3)3C(CH 3)3C(CH 3)3CH 3CH 3CH 3A B C D32、下列描述不.属于S N 1反应特征的是( ) A 中间体是正碳离子 B 叔卤代烷比仲卤代烷反应快 C 产物的绝对构型完全转化 D 有重排产物生成 33、下列几种还原剂,不能把酯还原成醇的是 ( )A Na +C 2H 5OHB NaBH 4C LiAlH 4 DH 2/Pt 34、下列化合物与HCN 发生亲核加成反应活性最小的是( )C-CH 2CH 3CH 3CH 2-C-CH 3CH 3CH 2CHOCH 3CHOOOAB C D35、下列碳负离子稳定性最高的是( )(CH 3)3C-CH 3CH 2CH 2-(CH 3)2CH--CH 3A B C D36、下列化合物没有旋光性的是( )A:B:C:D:COOHCOOHOH OH H HCOOH CH 2OHOH HOH H COOHCH 2OHOH H OH HCOOH COOHOH HOH H37、下列化合物碱性最弱的是( ).A CH 3CH 2NH 2B NH 3C CH 3CONH 2D PhNH 2 38、下列化合物酸性最强的是( )A CH 3COOHB CH 3CHClCOOHC Cl 3CCOOHD ClCH 2CH 2COOH 39、下列酸与醇在酸催化下成酯,反应速率最快的是( ) A (CH 3)3CCOOH 与 HOC 2H 5 B CH 3CH 2COOH 与HOC 2H 5 C (CH 3)2CHCOOH 与HOC 2H 5 D CH 3CH 2COOH 与HOCH 2CH 2CH 3 40、下列化合物中不具有芳香性的是( )A 吡咯B 噻吩C 吡啶D 四氢呋喃 41、下列化合物发生氨解反应时活性最小的是( )CH 3COOC 2H 5C 6H 5COCl(CH 3CO)2OCH 3CONHCH 3A CB D42、下列化合物中,沸点最低的是( )A 3,3-二甲基戊烷B 正庚烷C 2-甲基庚烷D 2-甲基己烷 43、下列化合物中,酸性最强的是( )A CH 3CH 2OHBC 6H 5OH C H 2CO 3D CH 3COOH 44、下列化合物中 ,碱性最弱的是( )A 甲胺B 三甲胺C 苯胺D 氨 45、下列化合物,发生硝化反应时活性最大的是( )SO 3HNH 2CH 3Cl ACBD46、下列化合物是手性分子的是( )A CB D HH COOH CH 3HCH 3Cl 3C 2H 5H COOC 2H 52CH 3HCH 2CH 3Cl CH 347、鉴别环丙烷、丙烯与丙炔三种物质,需要的试剂和顺序是( ) A Br 2的CCl 4溶液,KMnO 4溶液 B AgNO 3的氨溶液,KMnO 4溶液 C HgSO 4/H 2SO 4,KMnO 4溶液 D Br 2的CCl 4溶液,AgNO 3的氨溶液 48、下列化合物在浓碱作用下,不能发生Cannizzaro (歧化)反应的是 ( )OCHO CHO(CH 3)3CHO(CH 3)2CHCHOA BC D49、下列化合物与FeCl 3溶液不显色的是( )A 对苯醌B 对甲苯酚C 乙酰乙酸乙酯D 2,4-戊二酮 50、下列化合物在水中溶解度最大的是( )A 乙二醇B 环已酮C 正丁醇D 苯 51、下列烯烃中,存在顺反异构的是( ) CH 3CH 3CH 3CH=C(CH 3)2ClCH=CHCH 3A CB DCH 3CH 2=CHCH 2CH 352、下列化合物中,酸性最强的是( )A CH 2 BrCH 2CH 2COOHB CH 3CHBrCH 2COOHC CH 3CH 2CHBrCOOHD CH 3CH 2CH 2COOH 53、下列羧酸衍生物与甲醇反应时,活性最强的是( )A 乙酐B 乙酰氯C 乙酰胺D 乙酸乙酯 54、下列化合物发生亲核加成反应时,活性最强的是( )A 甲醛B 乙醛C 丙酮D 苯甲醛 55、可用来鉴别苯甲醛和丙醛的试剂是( )A I 2+NaOHB 托伦试剂C 2,4-二硝基苯肼D 斐林试剂 56、下列四种化合物,其中α-H 活性最差的是( )A 丙酮B 乙酸C 乙醛D 丙醛 57、下列物质,受热生成环戊酮的是 ( )A 丁二酸B 戊二酸C 己二酸D 庚二酸 58、下列四种氯代烃,S N 1和S N 2反应活性均最低的是( )A CH 3CH 2CH 2ClB CH 3CH=CHClC CH 2=CHCH 2ClD (CH 3)2CHCl59、下列化合物芳香性最强的是 ( )A 噻吩B 吡啶C 吡咯D 苯 60、下列化合物中,沸点高低顺序排列正确的是( )①乙醇 ②乙醛 ③乙酸 ④乙烷 A ①②③④ B ①③②④ C ③①②④ D ③②①④ 61、下列化合物中 ,碱性最强的是( )NH 2O 2NNHCH 3ClNH 2CH 2NH 2A C BD62、下列化合物中能发生碘仿反应的是( )A 乙醇B 正戊醛C 3-戊酮D 环戊酮 63、下列芳香酸,酸性最强的是( )ACBDCOOH CH 3COOHCOOHBrCOOHNO 264、将RCOCH 2COOH 还原成RCH 2CH 2COOH 的还原剂是( )A Zn+HClB Zn —Hg/HClC LiAlH 4D Na+C 2H 5OH 65、下列羰基化合物与羟氨(NH 2-OH )发生反应时,速度最快的是( )66、(R )—2—溴丁烷与(S )—2—溴丁烷相比较,哪种性质不同( ) A 密度 B 旋光度 C 化学性质 D 折光率 67、下列四个反应按历程分类,属于亲核取代历程的是( )A CH 3ONa + CH 3Cl CH 3-O-CH 3 + NaClB CH 3CH 2OH CH 2=CH 2 + H 2OC CH 2=CH 2 + Br 2 CH 2Br-CH 2BrD CH 3CH 3 + Cl 2 CH 3CH 2Cl + HCl68、实现下列转化,最好的线路是( )ClSO 3HNO 2O 2NA 先硝化,再磺化,最后卤代B 先磺化,再硝化,最后卤代C 先卤代,再磺化,最后硝化D 先卤代,再硝化,最后磺化 69、下列化合物能溶于稀NaOH 溶液的是( )A 苯甲醚B 氯乙烯C 对硝基苯酚D 溴苯70、分子式为C 9H 12的芳香烃,氧化是生成三元羧酸,硝化时只有一种一元硝基化合物,则该化合物的结构为( )CH 3H 3CCH 3CH 3CH 3CH 3CH 3C 2H 5CH 3CH 3CH 3A CBD71、下列化合物与NaHSO 3发生亲核加成反应时,活性最大的是( ) A CH 3CHO B CH 3COCH 3 C ClCH 2CHO D CH 3COCH 2CH 372、下列物质中能进行重氮化反应的是 ( )A 苯胺 BN-甲基苯胺 C N ,N-二甲基苯胺 D 三乙胺73、下列化合物酯化反应速度由大到小的顺序,排列正确的是 ( ) a. CH 3COCl b. CH 3COOC 2H 5 c. CH 3CONH 2 d.(CH 3CO )2OA a >b >c >dB a >d >b >cC a >b >d >cD b >c >d >a 74、下列费歇尔投影式中属于S 构型的是( )HCl CH 3C 2H 5ClH CH 3C 2H 5H 3CCl HC 2H 5H 3CC 2H 5Cl H A C B D75、下列化合物中最容易与浓硫酸发生磺化反应的是 ( ) A 溴苯 B 硝基苯 C 甲苯 D 邻二甲苯 76、下列化合物的构象中最稳定的是( )3233(H 3C)23(H 3C)2323AB C D77、下列物质中酸性最强的是 ( )A 对叔丁基苯酚B 对氯苯酚C 对甲基苯酚D 对硝基苯酚 78、下列糖中不与吐伦试剂反应的是 ( )A 葡萄糖B 果糖C 蔗糖D 麦芽糖79、下列酯类化合物在碱性条件下水解反应(亲核取代)速度最大的是( )NO 2O-CH 3Cl COOCH 3COOCH 3COOCH 3COOCH 3ACBD80、下列化合物亲电取代反应活性最强的是( )A 喃呋B 噻吩C 吡咯D 苯 81、下列化合物与卢卡斯试剂反应最快的是( )A 正丁醇B 正丙醇 C2-丁醇 D2-甲基-2-丁醇82、不对称烯烃和HBr 在过氧化物存在下发生加成反应,生成反马氏规则加成产物,其反应机理是( ) A 自由基加成历程 B 亲核加成历程 C 亲电加成历程 D 自由基取代历程 83、下列化合物亲电取代反应发生在邻、对位,且反应活性比苯小的是( ) A苯胺 B硝基苯 C苯酚 D氯苯 84、下列各组化合物中,哪个是对映异构体( )H OH CHO CH 3HO CH 3CHO HH Br COOH CH 3H CH 3COOHHO H COOH CH 2OH HO CH 2OHCOOHH H 2N C 6H 5CH 3H 3CNH 2C 6H 5A C B D 和和和和85、下列化合物中碱性最弱的是( ) A B CDN NH 2NH 3CH 3NH 286、下列物质中,属于还原性二糖的是( )A 葡萄糖B 麦芽糖C 蔗糖D 果糖 87、下列化合物既能发生碘仿反应,又能和NaHSO 3加成的是:( )A CH 3COCH 2CH 3B CH 3CHOHCH 2CH 3C CH 3COC 6H 5D CH 3CH 2CH 2CHO二、命名下列化合物(CH 3)2CHC(CH 3)23)2CHCH 3CH=C(CH 3)CCH 2CH 3H 3CCH 2CH=CH 2BrCH 312345CH 3CH 2-C-N(C 2H 5)2OCH=CH-CHO(CH 3CH 2CO)2O OCHO OHCOOHH 3CN 2+Cl -CH 3CH 2CHCH 2CH-CHCH 3CH 3CH 3CH 2CH 2CH 3OHCH 3SO 3H OOCOOHH-C-N-CH 3O3C CO OO (CH 3)2CH-C-ClCH 3COCH 2COOC 2H 5NC COOCOOH O-CH 3SO 3HOHH 3CH 3C H CH 22CH 3CH 3CH 2-C-NH-CH 3(CH 3)2CH-C-CH 3CH 3-C-CH 2CH 2COOH(CH 3CH 2CH 2CO)2OCONH 2N 2+Br -CH 3OOCH 3CH=CHCOOHC O C O O6789101112131415161718192021222324252627282930C-NHCH 3OO 2N3C 2H C-BrH 3C-O O O OO NCH 2COOH(CH 3)2CH-O-CH 2CH=CH 2313233343536C C(H 3C)2HCBr2CH 2CH 3CH 3OH NO 2O 2NNO 2CH 3CH 2COOCH 2CH=CH 2N N(CH 3)4N +OH-CH 3CH 2COOHO 2N N-CH 3CH 3N=NHOHO 3S373839404142434445三、写出下列化合物的结构式1、(R )-2-氯丁烷的Fischer 投影式2、(Z )-3-甲基-2-戊烯3、乙烷稳定构象(用纽曼投影式表示)4、甲基环己烷的优势构象5、苄基6、 顺-1-甲基-4-叔丁基环己烷的稳定构象7、5-甲基-2-溴-3-己酮8、β-萘胺9、 β—D —吡喃葡萄糖(哈沃斯式) 10、偶氮苯 11、正丁烷的稳定构象(纽曼投影式) 12、(R )2—羟基丙酸 13、邻苯二甲酸甲乙酯 14、 N ,N —二甲基苯胺 15、对—甲基苯磺酰氯 16、 (Z)-3,4-二甲基-3-己烯 17、氢氧化四甲铵 18、甲酸异丙酯 19、β-羟基丁酸 20、N-乙基苯胺 21、4-硝基-1-萘酚 22、对,对-二羟基偶氮苯 23、(S )-2-甲基-1,2-二氯丁烷 24、 对-甲基苯磺酰氯 25、(反)-2-丁烯 26、苯丙烯酸(肉桂酸) 27、四氢呋喃28、对甲基氯化重氮苯 29、对-硝基-对羟基偶氮苯 30、3-(间甲氧苯基)丁醛 31、(R )-2-羟基丁二酸的费歇尔投影式 32、乙酰乙酸 33、1,4-萘二胺 34、顺丁烯二酸酐 35、α-(D )-吡喃葡萄糖的哈沃斯式 36、对甲基苯磺酰胺 37、水杨酸四、用简便的化学方法鉴别下列各组化合物1、1—丁炔、1—丁烯、甲基环丙烷、丁烷2、叔丁基氯、氯苯、氯代环己烷3、丙醛、丙酮、丙醇、异丙醇4、苯胺、苄胺、N-甲基苄胺5、吡啶、3—甲基吡啶、苯胺6、苯酚、苯甲醛、苯甲酸、苯7、戊酸、戊醛、2—戊酮、环己酮8、苯酚、苯甲醚、苯甲醇、苄氯9、丙醛、丙酮、苄醇和乙醇 10、邻甲苯胺 、N-甲基苯胺 、苯甲酸和水杨酸 11、甲醛、乙醛、2-戊酮、3-戊酮 12、2,4-戊二酮、邻羟基苯甲酸、2-羟基丙酸、苯酚13、苯胺、N-乙基苯胺、N ,N-二乙基苯胺 14、苯甲醛、戊醛、2-戊酮、环己酮、环己醇 15、丙胺、丙醛、丙酸和丙酮 16、苯乙酮、苯甲醇、2-氯苯酚、苄氯 17、苯甲醛、苯乙酮、苯甲酸、苯甲醇、苯酚 18、3-戊酮、正戊醛、2-戊酮、3-戊醇、2-戊醇五、完成下列反应的机理1、请用合理的机理解释(1)HCN 加成反应的活性是: 甲醛>乙醛>丙酮(2)不同醇与氢卤酸反应的活性次序为:叔醇>仲醇>伯醇 2、为下列反应事实提出合理的机理CH 3HOH3H +C CCH 3CH 3CH 3CH 3H 3CH 3C CH 3CH 3CH 2=C-CH-CH 3++80%20%0.4%CH 3-C C-CH 3CH 3-C-CH=CH 2CH 2=CH 2 + Br 2NaCl+H 2OCH 2-CH 2OHCH 2-CH 2CH 2-CH 2++CH 32OH CH 3+ HBr CH 3-CH-CH 2Br CH 3+CH 3-C-CH 3CH 3H OH CH 3C 2H 5HBrH Br CH 32H 5Br H CH 3C 2H 5+(S)(S)(R)+ HBrCH 2CH 3BrCH 3-C-CH 2OHCH 3CH 3H+CH 2=C-CH 2CH 3CH 3CH 3+CH 3-C=CH-CH 3(1)(2)(3)(4)(5)(6)六、按指定性由大小或由难易排列(1)与HCN 发生亲核加成反应活性大小H-C-HCH 3-C-HCH 3-C-CH 3O OO C-HO COC O CH 3a b cdef(2)按酸性增强的顺序排列a CH 3CH 2CHBrCOOHb CH 3CHBrCH 2COOHc CH 3CH 2CH 2COOHd C 6H 5OHe CH 3CH 2CH 2CH 2OHf H 2CO 3g Br 3CCOOHh H 2O (3)按次序规则,基团优先次序A CH 3CH 2-B CH 2=CH-C CH ≡C-D (CH 3)3C-E HO-F CH 3O- (4)碳正离子稳定性大小CH 3-CH-CH 3CH 3CH 2CH 2CH 2=CH-CH 2++++A B C D CH 2=CH-CH-CH 3CH 3+E(6)酸性强弱次序COOH COOHCOOHCOOH3NO 2ABCDCOOHNO 22E(7)自由基稳定性稳定大小AB C D C CH 33CCH 3H 3C CH 3CH 33CH 3(8)硝化反应活性大小NO 2CH 3OCH 3ClABCDE(9)S N 1反应活性CH 2BrCH 3CH 3BrBr CHBrCH 3BrAB CDE(10)烯烃稳定性A CH 3-CH=CH 2B CH 3CH=CHCH 3C (CH 3)2C=CH-CH 3D (CH 3)2C=C(CH 3)2(11)与HBr 反应的活性大小CH 3CH 2CH 2OHCH 3CHCH 3(CH 3)3C-OH CH 3OHA B C D OH(12)沸点高低次序A CH 3CH 2OHB CH 3COOHC CH 3OCH 3D CH 3CHOE CH 3CH 2CH 3 (13)S N 2反应活性大小CH 2BrCH 3CH 3BrBr CHBrCH 3BrAB CDE(14)消去反应活性大小CH 2CH 2CH 2OHCH 2CHCH 3CHCH 2CH 3C-CH 3CH-CH 2OH OHOHCH 3OHCH 3AB CD E七、推导结构题1、化合物A ,C 16H 16,能吸收1mol 氢,使Br 2/CCl 4溶液褪色,与KMnO 4酸性溶液作用生成苯二甲酸,该酸只有一种单溴代产物,给出A 的结构。
基础化学复习题

基础化学复习题—、填空题1对于一个确定的化学反应,化学反应速率常数只与有关。
2在BaSO4饱和溶液中加入NaC1则BaSO4的溶解度会增大,这种现象称为3共价键具有_ 性和方向性。
4命名[Cu(NH2)]SO4 和[Ni(CO)4]5.稀溶液的依数性适用于__ 、非电解质的稀溶液。
6用于配置标准溶液的基准物质应具备_ 、、物质组成与化学式完全符合和摩尔质量大等四个条件。
7.根据催化剂的性质可分为多相催化、均相催化、_ 、和酶催化等五种。
8、配置标准溶液的基准物质应具备、、和物质组成与化学式完全符合等四个条件。
9配合物[Fe(en)3]Cl3,其配位体是__ ,中心高子的配位数是,命名: _10、对于一个确定的化学反应,化学反应速率常数只与___ _有关。
11、分子间作用力主要有H键和范德华力,其中,范德华力有三类_ 、、12、写出下列各基态原子或离子的电子排布:N ,Fe ,Cr13、按照电子云重叠方式分,共价键分为__ _键和_ _键。
14维持人体血液PH=7.40+0.5的缓冲溶液主要成分有 _、等.15、高分子材料是由一种或几种简单的低分子化合物(称为_ )经_ 或而成。
16,在化学反应中凡(一步)直接完成的反应称为反应。
17.在BaSO4饱和溶液中加入NaC1则BaSO4的溶解度会 .这种现象称为盐效应。
18共价键具有饱和性和 _性。
19.命名K4[Fe(CN)]和[PtC12(NH3)2] _20.稀溶液的依数性适用于难挥发的、的稀溶液。
21滴定分析法的主要方式有直接、返滴、 __和 _四种。
22、CC14分子中心原子发生杂化,空间构型是分子。
23、在化学反应中凡(一步)直按完成的反应称为 _反应。
24、K4[Fe(CN)]其配位体是 _,中心高子是 _,中心高子的配位数是_25、被称为现代三大合成材料的是、、26、写出下列各基态原子或高子的电子排布: :K ,Fe2+,Cl-27、标准氢电极的电极电势是28、难挥发非电解质稀溶液具有通性,即: 、、和渗透压。
基础化学复习题(xin)

一、判断题11. 100.142-⋅=L mol c SO H ,则12150.042-⋅=L mol c SO H 。
×2.难挥发非电解质稀溶液的依数性不仅与溶质种类有关,而且与溶液的浓度成正比。
×3.难挥发非电解质稀溶液的蒸气压实际上是溶液中溶剂的蒸气压。
√一、判断题:2√3.一个反应体系达到平衡时的特征是正逆反应速率相等。
√4.催化剂只能缩短反应达到平衡的时间而不能改变平衡状态。
×5.酸性水溶液中不含OH -,碱性水溶液中不含H +。
√6.在一定温度下,改变溶液的pH ,水的离子积不变。
√9.电离度和电离常数都能表示电离程度的强弱。
一、 判断题3×1.AgCl 在水中溶解度很小,所以它的离子浓度也很小,说明AgCl 是弱电解质。
√2.溶度积的大小决定于物质的本性和温度,与浓度无关。
×4.控制一定的条件,沉淀反应可以达到绝对完全。
√6.难溶电解质的溶度积和溶解度都是表示其溶解能力的大小。
一、判断题4×2.NH 4+中,氮原子的氧化数为-3;ClO -中,氯原子的氧化数为+7。
√4.在设计原电池时,E Ө值大的电对应是正极,而E Ө值小的电对应为负极。
√5.原电池中盐桥的作用是盐桥中的电解质中和两个半电池中过剩的电荷。
√6.标准电极电势表中的E Ө值是以标准氢电极作参比电极而测得的标准电极电势值。
√7.电极电势大的氧化态物质氧化能力强,其还原态物质还原能力弱。
一、 判断题52.中心离子的配位数等于配合物中配位体的数目。
(⨯)4.配合物转化为沉淀时,难溶电解质的溶解度愈小,则愈易转化。
(√)5.配离子在任何情况下都能转化为另一种配离子。
(⨯)6.酸度对配合物稳定性无影响。
(⨯)一、 判断题 6√1.可以通过增加平行试验的次数减小测定过程中的偶然误差。
×2.NaOH 标准溶液可用直接配制法配制。
×3.偶然误差是由一些偶然因素的变动引起的,无法减小。
基础化学复习题

基础化学复习题一、填空题:1.理想气体的微观模型是 、 。
2.稀溶液的依数性包括_________、_________、_________、_________。
3.2mol 理想气体,在300K 、400kPa 下的体积V = 。
4.在300K 、400kPa 下,摩尔分数y B =0.40的5molA 、B 理想气体混合物。
其中A 气体的分压力p A = kPa 。
5. 在101.325kPa 的大气压力下,将蔗糖溶于纯水中所形成的稀溶液缓慢地降温时,先析出纯冰。
相对于纯水而言将会出现:蒸气压 、沸点 、凝固点 。
6.应用热力学基本原理研究化学变化及其与之有关的物理变化中能量转化规律的科学,称为 。
7.热力学系统性质就是它一系列宏观性质的总和,而这些描述系统状态的性质又称为 ;在n 、V 、T 、x B 中,属于广延性质的是 ,属于强度性质的是 。
9.基元反应 2NO + Cl 2 → 2NOCl 是_______分子反应,是_______级反应,其速率方程为________________________。
10.在密闭容器中进行2NO + 2H 2 = N 2 +2H 2O 的反应,其速率方程V=K .c 2(NO) .c (H 2),则压力增大到原来的2倍,反应速率增大 _____ 倍。
11.可逆反应 2A(g) + B(g) 2C(g) ;Δr H m θ< 0 。
反应达到平衡时,容器体积不变,增加B 的分压,则C 的分压 __________,A 的分压 ___________ ;减小容器的体积,B 的分压 ___________, K θ___________。
12.可逆反应: I2+H 22HI 在713K 时K θ=51,若将上式改写为 :21I 2 +21H 2 HI 则其K θ为 ______。
13.质子理论认为,凡能 质子的物质是酸,凡能 质子的物质是碱。
14.已知吡啶的θb K =1.7×10—9,则其共轭酸的θa K = ,已知氨水的θb K =1.8×10—5,则其共轭酸的θa K = 。
基础化学(单选题)试题库+答案

基础化学(单选题)试题库+答案一、单选题(共100题,每题1分,共100分)1、构成原子的微粒是()A、质子和电子B、原子核和原子C、原子核和电子D、原子核和中子正确答案:C2、中性溶液严格地讲是指()。
A、pH=7.0的溶液B、pH+pOH=14.0的溶液C、[H+]=[OH-]的溶液D、pOH=7.0的溶液正确答案:C3、一般分析实验和科学研究中适用()A、分析纯试剂B、实验试剂C、化学纯试剂试剂D、优级纯试剂正确答案:A4、0.1mol/L的下列溶液中,酸性最强的是()。
A、H3BO3(Ka=5.8×10-10)B、NH3·H2O(Kb=1.8×10-5)C、苯酚(Ka=1.1×10-10)D、HAc(Ka=1.8×10-5)正确答案:D5、H2PO4–的共轭碱是()。
A、PO43–B、HPO42–C、H3PO4D、OH–正确答案:B6、能准确量取溶液体积的是()。
A、锥形瓶B、量筒C、移液管D、烧杯正确答案:C7、影响化学反应平衡常数数值的因素是()A、产物浓度B、温度C、催化剂D、反应物浓度正确答案:B8、下列有机溶剂中,具有最大火灾危险的是()A、乙醚B、四氯化碳C、乙醇D、乙酸正确答案:A9、下列测定中,需要加热的有()。
A、KMnO4溶液滴定H2O2B、KMnO4溶液滴定H2C2O4C、银量法测定水中氯D、碘量法测定CuSO4正确答案:B10、由于易被氧化,在实验室不宜长期保存的溶液是()。
A、NaOH溶液B、石灰水C、Na2SO4溶液D、氢硫酸正确答案:D11、用纯水将下列溶液稀释10倍时,其中pH变化最小的是()A、NH3·H2O溶液(1.0mol/L)B、HAc溶液(1.0mol/L)C、HCl溶液(1.0mol/L)D、HAc(1.0mol/L)+NaAc(1.0mol/L)正确答案:D12、称为巯基的是()A、—SHB、—CNC、—OHD、—NH2正确答案:A13、若使HAc的解离度和溶液pH均减小,可向HAc溶液中加入()A、NaOHB、HClC、H2OD、NaAc正确答案:B14、根据酸碱质子理论,下列叙述中不正确的是()A、酸碱反应的实质是质子转移B、化合物中没有了盐的概念C、酸愈强,其共轭碱也愈强D、酸失去质子后就成为碱正确答案:C15、以下各组物质具有缓冲作用的是()。
大一化学基础题库及答案

大一化学基础题库及答案1. 题目:什么是摩尔质量?如何计算摩尔质量?答案:摩尔质量是指1摩尔物质的质量,单位是克/摩尔(g/mol)。
摩尔质量可以通过元素的相对原子质量(Ar)来计算,即摩尔质量 =相对原子质量× 1 g/mol。
2. 题目:请解释什么是化学平衡,并给出一个平衡常数的表达式。
答案:化学平衡是指在一个可逆反应中,正反应和逆反应同时进行,且速率相等,系统宏观上不再发生变化的状态。
平衡常数(K)表达式通常为:K = [C]^c[D]^d / [A]^a[B]^b,其中[A]、[B]、[C]、[D]是反应物和生成物的浓度,a、b、c、d是它们的系数。
3. 题目:什么是酸碱指示剂?请列举三种常见的酸碱指示剂。
答案:酸碱指示剂是一种在不同pH值下显示不同颜色的化学物质,用于测定溶液的酸碱性。
常见的酸碱指示剂包括:酚酞(Phenolphthalein),在pH 8.2-10.0之间颜色由无色变为粉红色;甲基橙(Methyl Orange),在pH 3.1-4.4之间颜色由红色变为黄色;溴酞(Bromothymol Blue),在pH 6.0-7.6之间颜色由黄色变为蓝色。
4. 题目:什么是红移和蓝移?它们在化学中有什么应用?答案:红移和蓝移是光谱学中的术语,指的是光谱线向长波(红端)或短波(蓝端)方向的移动。
在化学中,红移和蓝移可以用来研究分子间相互作用、分子结构变化以及化学反应的动态过程。
5. 题目:什么是溶液的浓度?请列举三种不同的浓度表示方法。
答案:溶液的浓度是指溶质在溶剂中的含量,通常用摩尔浓度(mol/L)、质量浓度(g/L)或体积浓度(v/v)来表示。
摩尔浓度是指单位体积溶液中所含溶质的摩尔数;质量浓度是指单位体积溶液中所含溶质的质量;体积浓度是指溶质体积与溶液总体积的比值。
6. 题目:什么是电离?请解释强电解质和弱电解质的区别。
答案:电离是指电解质在水溶液中分解成离子的过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4:在集气瓶里,将H2S和SO2两种气体充分混合后,可观察到得现象是()
A.有黄色粉末产生B.有棕色烟生成
C. 有红色沉淀生成 D. 有黑色固体生成
5.下列各组物质在一定条件下反应,其中生成+3价铁盐的是( )
A.铁和稀硫酸B.铁和氯化铜溶液C.铁和氯气D.铁和氧气
6:氨能用来表演喷泉实验,这是因为它( )
A.比空气轻B.是弱碱C.极易溶于水D.在空气中不燃烧
7:能溶解单质硅的是()
A.氢氧化钠溶液B.盐酸C.硫酸D.氨水
8:下列元素的原子中,电负性最大的是()
A. FB. OC. ND. C
9:下列物质中,不能用作漂白剂的是()
A. Na2O2B. H2O2C.HClOD. H2S
7. HNO3中溶解过量的NO2,可得到红棕色的发烟硝酸。( )
8. Al2S、Al2(CO)3这样的弱酸铝盐不能用湿法制取。( )
9.碱金属是活泼金属,是强还原剂;在同一族中,金属的活泼性自上而下逐渐减弱。( )
10. P有多种同素异形体,常见的有白磷和红磷。( )
1:臭氧层是一个保护层,但近来发现大气层上空臭氧逐渐减少,甚至出现了空洞。( )
11:氧的同素异形体是和,其中比氧化能力更强。
二、选择题
1:下列物质中酸性最强的是()
A.HClO4B. HClO3C. KClO3D. HClO
2:0.5mol Na2SO4中所含的Na+离子数为()
A.3.01×1023B.0.5C.6.02×1023D.1
3:用10g NaOH固体配制成0.5mol/L NaOH,所得溶液的体积是()
12:无水硫酸铜具有强吸水性,可以用来做剂。
1:碱金属位于元素周期表第族,最外层有个电子,包括、、、、、六种元素。
2:卤族元素中是周期表中电负性最强的元素。
3:臭氧的化学式是,具有,可用来作为消毒剂,净化剂,漂白剂。
4:在500ml NaOH溶液中含有2g NaOH,该溶液的物质的量浓度是。
5:S的两种氧化物是和,其中常温下是固体。
A.强氧化性B.不挥发性C.吸水性D.酸性
2:氨能用来表演喷泉实验,这是因为它()
A.比空气轻B.是弱碱C.极易溶于水D.在空气中不燃烧
3:盐酸的性质是( )
A.有酸性、无氧化性、无还原性
B.有酸性、有氧化性、有还原性
C.有酸性、无氧化性、有还原性
D.有酸性、有氧化性、无还原性
4:浓硫酸具有很多重要的性质,在与含有水分的蔗糖作用时不能显示的性质是()。
10:下列关于将金属钠放入CuSO4溶液中的说法中,不正确的是()
A.金属钠浮在溶液的上面B.金属钠在液面不停地游动并发出声音
C.有红色物质生成D.有蓝色沉淀生成
1:近年来,加“碘”食盐较少使用碘化钾,因其口感苦涩且在储藏和运输中易变化,目前代之加入的是()。
A. I2B. KIO C. NaIO D. KIO3
6:SiO2是晶体,Si-O键的键能很高,因此石英的硬度大,熔点高。
7:过氧化钠的化学式是,能够和CO2和H2O反应放出,因此可用作防毒面具,潜艇中的供氧剂。
8:Al位于周期表中第周期,第族。
9:F,Cl,Br,I对应的氢化物的化学式分别是、、、,其中
Cl的氢化物对应的水溶液称为。
10:N的主要氧化物有和。
2.为什么硫化氢水溶液在空气中放置时易变浑浊?
3.卤族元素处于周期表中什么位置?写出所有的卤族元素的元素符号。
1.卤族元素处于周期表中什么位置?写出所有的卤族元素的元素符号?
2.为什么向含有Fe2+的溶液中加入NaOH溶液后,有灰绿色沉淀生成,然后沉淀逐渐变成红褐色?
3.为什么不能用玻璃器皿储存氢氟酸?
C.有红色物质生成D.有蓝色沉淀生成
三、判断题
1. NaOH的摩尔质量是40g/mol。( )
2.高氯酸是酸性最强的无机含氧酸。( )
3.硫的化学性质比较活泼,既有氧化性又有还原性。( )
4.冷的浓硝酸能使Fe、Al发生钝化。( )
5.单位物质的量的气体所占的体积叫做气体摩尔体积,符号Vm( )
6.重铬酸钾在酸性溶液中是强氧化剂。( )
6:氨是一种具有气味的色气体。
7:和以体积比1:3的比例配制的混合液称为王水。
8:浓硫酸有性,可用来干燥Cl2、H2、CO2等气体。蔗糖放入浓硫酸中,发生“炭化”现象,这是由于浓硫酸有性。
9:氮的主要氧化物有和。
10:碱金属与氧能形成三种类型的重要氧化物,即氧化物、氧化物和
氧化物。
11:铜、银、金都有特征颜色,铜是色金属,银是色金属,金是色金属。
7:金属越活泼,硝酸的浓度越低,HNO3被还原后氮的氧化值越低。( )
8:单质硫俗称硫磺。( )
9:Fe是地壳中含量最多的元素。( )
10:K2Cr2O7,KMnO4是强氧化剂。( )
1:臭氧层能吸收太阳光的紫外辐射,是保护地球上生命免受太阳辐射的天然屏障。(系统瘫痪。()
2013-2014第一学期基础化学期末考试复习提纲
一、填空题
1:卤素在元素周期表的第族,最外层有个电子。包括、、、、五种元素。
2:在500ml NaOH溶液中含有2g NaOH,该溶液的物质的量浓度是。
3:氧的同素异形体是和,其中比氧化能力更强。
4:漂白粉的有效成分是。
5:过氧化氢是一种不造成二次污染的氧化剂,所以常用来做剂、剂。
五、计算题
欲配制0.1mol/L0.2mol/L0.4mol/L硫酸500mL,需要质量分数为98%的浓硫酸(密度为1.84g/cm3)多少毫升?
六、推断题:共10分
某几种物质有以下转化关系:
X粉末,加热
1 H2SO4
澄清石灰水
②
(1)A是,B是,C是,X粉末是。
(2)写出反应①的化学方程式。
(3)写出反应②的离子方程式。
2:氨能用来表演喷泉实验,这是因为它()
A.比空气轻B.是弱碱C.极易溶于水D.在空气中不燃烧
3:下列物质中,不能用作漂白剂的是()
A. Na2O2B. H2O2C.HClOD. H2S
4:下列气体中,既有氧化性又有还原性的是()。
A. H2S B. SO2C. SO3D. CO2
5:0.5mol Na2SO4中所含的Na+离子数为()
A.3.01×1023B.0.5C.6.02×1023D. 1
6:在实验室制备氯化氢时,经常采用向食盐里加入浓硫酸的方法,使用浓硫酸的理由是( )
A.浓硫酸具有脱水作用B.浓硫酸具有吸水作用
C.浓硫酸具有氧化作用D.浓硫酸是难挥发的酸
7:下列物质中属于不挥发性酸的是()。
A.H2S B. H3PO4C.HNO3D. HCl
3:碱金属比碱土金属活泼。( )
4:浓硫酸具有吸水性和强氧化性。( )
5:CO气体有毒。( )
6:白磷化学性质很活泼,在空气中可自燃。( )
7:石墨是原子晶体、金属晶体和分子晶体之间的一种过渡型的晶体。( )
8:Al是典型的两性元素,主要体现在它的单质、氧化物、氢氧化物都能和酸、碱作用。
( )
9:刚玉的主要成分是SiO2。( )
8:下列元素的原子中,电负性最大的是()
A.F B. OC. ND. C
9:能溶解单质硅的是()
A.氢氧化钠溶液B.盐酸C.硫酸D.氨水
10:用10g NaOH固体配制成0.5mol/L NaOH,所得溶液的体积是()
A0.5ml B. 5ml C. 50ml D. 500ml
1:工业上常用稀硫酸清洗铁表面的锈层,这是利用稀硫酸的()。
10:N2是两个N原子共用三对电子结合而成,其性质很稳定,常温下不易参加化学反应。
( )
四、简答题
1.为什么不能用玻璃器皿储存氢氟酸?
2.为什么硫化氢水溶液在空气中放置时易变浑浊?
3.碱金属位于周期表中什么位置?写出所有碱金属元素的元素符号。
1.为什么向含有Fe2+的溶液中加入NaOH溶液后,有灰绿色沉淀生成,然后沉淀逐渐变成红褐色?
A.酸性B.吸水性C.强氧化性D.脱水性
5:下列物质中酸性最强的是()
B.HClO4B. HClO3C. KClO3D. HClO
6:用10g NaOH固体配制成0.5mol/LNaOH,所得溶液的体积是()
B.0.5ml B. 5ml C. 50ml D. 500ml
7:在集气瓶里,将H2S和SO2两种气体充分混合后,可观察到得现象是()
11:是酸性最强的无机含氧酸。
1:C是周期表中第族元素,最外层有个电子。其最常见的氧化物是
和。试举出C的两种单质,。
2:硝酸最典型的性质是它的,能氧化C,S,Cu等多种非金属和金属。
3:氮族元素在元素周期表的第族,最外层都有个电子。包括、
等元素。
4:氢氧化钠的化学式是,NaHCO3俗称。
5:常温下,氯气是一种______色,有______气味的气体;溶于水所得溶液称______;氯水能使有色布条褪色,其中起主要作用的是______;氯水跟硝酸银溶液的反应中起主要作用的是______。
2:H2S是无色有臭鸡蛋气味的气体,有毒,是大气污染物之一。( )
3:HF能和SiO2作用,生成SiF4和H2O,其他氢卤酸则不能。( )
4:SCN-能和Fe3+形成红色配合物,化学检验中常用此反应鉴定Fe3+。( )
5:冷浓硫酸可以使Fe,Al钝化。( )
6:Al(OH)3属于两性物质,其碱性略强于酸性,属于弱碱。( )
A.有黄色粉末产生B.有棕色烟生成
C.有红色沉淀生成D.有黑色固体生成
8:能溶解单质硅的是()
