高中阶段常见元素的化合价(word版)
(word完整版)化合价表高中超级详细版口诀

部分元素的化合价H:1, -1Li,Na,K,Pb,Cs: 1Cu,Ag: 1,2,3Au: 1,3 Be,Mg,Ca,Zn,Sr,Cd,Ba,Ra: 2Hg: 1,2B,Al,Sc,Ga,Y,La,Pr-Lu, Ac(CH3COO-): 3In,Tl: 1,3C,Si,Ge,Sn,Pb: 2,4Ti,Zr: 2,3,4Ce,Hf,Th: 3,4N: -3,1,2,3,4,5P: -3,1,3,4,5As,Sb: -3,3,5Bi: 3,5V,Nb,Ta: 2,3,4,5Pa: 3,4,5O: -2,-1,2S,Se,Te: -2,2,4,6Po: 2,4,6Cr: 2,3,6Mo,W: 2,3,4,5,6U: 3,4,5,6F: -1Cl: -1,1,3,4,5,6,7Br,I: -1,1,3,5,7Mn: 2,3,4,6,7Tc,Re: 4,5,6,7Np,Pu: 3,4,5,6,7Xe: 1,4,6,8Ru: 2,3,4,5,6,7,8Fe,Os: 2,3,4,5,6,8Co,Ni,Pd: 2,3,4Rh, Ir,Pt: 2,3,4,5,6NH4: +1PO4: -3+1H, Li, Na, K, Rb, Cs, Cu, Ag, Au, Hg, In, Tl, N+2Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd,Hg, Cr, Mn, Fe, Co, Ni, Cu, C,Sn, Pb, N, S, O+3B, Al, Ga, In, Tl , Sc, Y,La-Lu, N, P, As, Sb, Bi, Cr,Fe, Co, Ni, Au;Ce+4C, Si, Ge, Sn, Pb, Ti, Zr, Hf,Ce, Th, Mn, Tb, N, S+5N, P, As, Sb, Bi, V, Nb, Ta+6S, Se, Te, Cr, Mo, W, U, Mn,Fe+7Cl, Br, I, Mn, Tc, Re+8Xe, Ru, Os-1F, Cl, Br, I, O-2O, S, Se, Te-3N, P, As, Sb特殊原子团化合价硝酸根NO3-: -1价亚硫酸根SO32-: -2价亚硫酸氢根HSO3-:-1价硫酸根SO42-: -2价 O -2,S +6碳酸根CO32-: -2价 O -2,C +4.氯酸根ClO3 -: -1 价 O -2,Cl +5.氢氧根OH-: -1价 O -2, H+1.铵根NH4+: +1 价 H +1, N-3.磷酸根PO43-:-3 价 O -2,P +5碳酸氢根HCO3-: -1价锰酸根MnO42-: -2价高锰酸根MnO4-: -1价超氧根O2-: -1价过氧根O22-: -2价(注意: 化学式相同, 但不是同一个根, 锰酸根中锰呈+6价,高锰酸根中锰呈+7价)氟、氯、溴、碘:-1(氢氟酸, 盐酸, 氢溴酸和氢碘酸的酸根)所以, 物质的化合价有的有多种。
常见元素化合价

常见元素化合价
一价氢氯钾钠银;
二价氧钙钡镁锌,
三铝四硅五价磷;
二三铁二四碳,
二四六硫都齐全;
铜汞二价最常见。
莫忘单质价为零。
常见原子团(酸根)化合价负一硝酸(NO3)氢氧根(OH),负二硫酸(SO4) 碳酸根(CO3),负三价是磷酸根(PO4),
只有正一是铵根(NH4)。
常见元素化合价
一价氢氯钾钠银;
二价氧钙钡镁锌,
三铝四硅五价磷;
二三铁二四碳,
二四六硫都齐全;
铜汞二价最常见。
莫忘单质价为零。
常见原子团(酸根)化合价负一硝酸(NO3)氢氧根(OH),负二硫酸(SO4)碳酸根(CO3),负三价是磷酸根(PO4),
只有正一是铵根(NH4)。
高中化学必背化合价

高中化学必背化合价高中化学必背化合价(一)
一价钾钠银氯氢。
二价氧钙钡镁锌。
三铝四硅五氮磷。
二三铁,二四碳。
二四六硫都齐全。
铜汞二价最常见。
负一氢氧硝酸根。
负二硫酸碳酸根
负三记住磷酸根。
正一价的是铵根。
高中化学必背化合价(二)
氢氯钾钠银正一价,钙钡镁锌正二价。
三铝四硅五氮磷,二三铁,二四碳。
二四六硫全都齐,铜以二价最常见。
单质零价永不变,氟氯溴碘负一价。
高中化学必背化合价(三)
氟氯溴碘钾钠银,氢亚铜汞一价寻。
氧汞亚铁镁钙钡,钨锰铝铜二价锌。
三价有铁磷和铝,四价碳硅五价磷。
硫之价数二四六,二四六七锰特熟。
高中常见化学元素化合价

学习必备欢迎下载
化学元素的化合价助记口诀
一价氢氯钠钾银,
二价氧钙钡镁锌,
三铝四硅五价磷,
二三铁,二四碳,
二四六硫都齐全,
铜汞二价最常见。
正一钾钠银氢铵
正二钙镁钡和锌
三铝四硅氧负二
一二铜二三铁二四碳
氟氯负一磷正五
氢氧根-1
硝酸根-1
硫酸根-2
碳酸根-2
一价氢氯(负)钾钠银
二价氧(负)钡钙镁锌
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全(-2、+4、+6)
铜汞二价最常见
莫忘单质价为零
最常见的有:氢正一,氧负二
学习必备欢迎下载
常见元素及原子团的化合价表。
常用元素化合价

常用元素化合价一、常见元素化合价口诀1. 一价钾钠氯氢银- 钾(K):+1价,例如在KCl(氯化钾)中。
- 钠(Na):+1价,如NaCl(氯化钠)。
- 氯(Cl): - 1价(在氯化物中常见),但氯还有其他化合价,如在HClO (次氯酸)中氯为 + 1价,在HClO₄(高氯酸)中氯为+7价等。
- 氢(H):+1价,如在H₂O(水)中,但在金属氢化物中氢为 - 1价,如NaH(氢化钠)。
- 银(Ag):+1价,例如AgNO₃(硝酸银)。
2. 二价氧钙钡镁锌- 氧(O): - 2价(在大多数化合物中),如CO₂(二氧化碳),但在过氧化物中氧为 - 1价,如H₂O₂(过氧化氢)。
- 钙(Ca):+2价,像CaCO₃(碳酸钙)。
- 钡(Ba):+2价,例如BaSO₄(硫酸钡)。
- 镁(Mg):+2价,如MgO(氧化镁)。
- 锌(Zn):+2价,如ZnSO₄(硫酸锌)。
3. 三铝四硅五价磷- 铝(Al):+3价,常见于Al₂O₃(氧化铝)等化合物。
- 硅(Si):+4价,例如SiO₂(二氧化硅)。
- 磷(P):+5价,如P₂O₅(五氧化二磷),但磷还有 - 3价,如PH₃(磷化氢)。
4. 二三铁,二四碳- 铁(Fe):有+2价和 + 3价。
+2价的铁称为亚铁,如FeCl₂(氯化亚铁);+3价的铁如FeCl₃(氯化铁)。
- 碳(C):有+2价和+4价。
+2价的碳如CO(一氧化碳),+4价的碳如CO₂(二氧化碳)。
5. 二四六硫都齐全- 硫(S): - 2价(如在H₂S(硫化氢)中)、+4价(如在SO₂(二氧化硫)中)、+6价(如在SO₃(三氧化硫)和H₂SO₄(硫酸)中)。
6. 铜汞二价最常见- 铜(Cu):有+1价和+2价,+2价最常见,如CuSO₄(硫酸铜),+1价的铜如Cu₂O(氧化亚铜)。
- 汞(Hg):+2价最常见,如HgO(氧化汞),汞也有+1价,如Hg₂Cl₂(氯化亚汞)。
二、特殊元素化合价情况1. 氮元素- 氮(N)的化合价比较复杂,有 - 3价(如NH₃(氨气))、+2价(如NO (一氧化氮))、+4价(如NO₂(二氧化氮))、+5价(如HNO₃(硝酸))等。
高中阶段常见元素的化合价(word版)
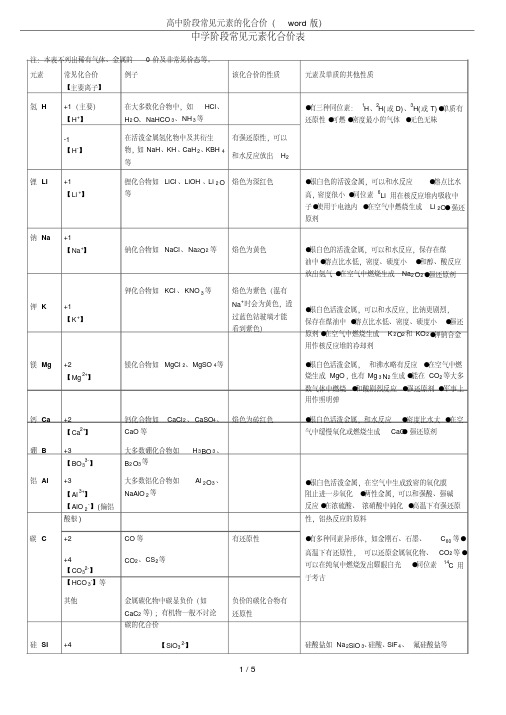
高中阶段常见元素的化合价(word 版)1 / 5中学阶段常见元素化合价表注:本表不列出稀有气体、金属的0 价及非常见价态等。
元素常见化合价【主要离子】例子该化合价的性质元素及单质的其他性质氢H+1(主要)【H +】在大多数化合物中,如HCl 、H 2 O 、NaHCO 3 、NH 3 等●有三种同位素:1H 、2H(或D)、3H(或T)●单质有还原性●可燃●密度最小的气体●无色无味-1 【H -】在活泼金属氢化物中及其衍生物,如NaH 、KH 、CaH 2 、KBH 4等有强还原性,可以和水反应放出H 2锂Li+1 【Li +】锂化合物如LiCl 、LiOH 、Li 2 O 等焰色为深红色●银白色的活泼金属,可以和水反应●熔点比水高,密度很小●同位素6Li 用在核反应堆内吸收中子●使用于电池内●在空气中燃烧生成Li 2 O ●强还原剂钠Na +1 【Na +】钠化合物如NaCl 、Na 2 O 2 等焰色为黄色●银白色的活泼金属,可以和水反应,保存在煤油中●熔点比水低,密度、硬度小●和醇、酸反应放出氢气●在空气中燃烧生成Na 2 O 2 ●强还原剂钾K +1 【K +】钾化合物如KCl 、KNO 3 等焰色为紫色(混有Na +时会为黄色,透过蓝色钴玻璃才能看到紫色)●银白色活泼金属,可以和水反应,比钠更剧烈,保存在煤油中●熔点比水低、密度、硬度小●强还原剂●在空气中燃烧生成K 2O 2 和KO 2●钾钠合金用作核反应堆的冷却剂镁Mg +2 【Mg 2+】镁化合物如MgCl 2 、MgSO 4 等●银白色活泼金属,和沸水略有反应●在空气中燃烧生成MgO ,也有Mg 3 N 2 生成●能在CO 2 等大多数气体中燃烧●和酸剧烈反应●强还原剂●军事上用作照明弹钙Ca +2 【Ca 2+】钙化合物如CaCl 2 、CaSO 4 、CaO 等焰色为砖红色●银白色活泼金属,和水反应●密度比水大●在空气中缓慢氧化或燃烧生成CaO ●强还原剂硼 B +3 【BO 33-】大多数硼化合物如H 3 BO 3 、B 2 O 3 等铝Al +3 【Al 3+】【AlO 2 -】(偏铝酸根)大多数铝化合物如Al 2 O 3 、NaAlO 2 等●银白色活泼金属,在空气中生成致密的氧化膜阻止进一步氧化●两性金属,可以和强酸、强碱反应●在浓硫酸、浓硝酸中钝化●高温下有强还原性,铝热反应的原料碳 C +2 CO 等有还原性●有多种同素异形体,如金刚石、石墨、C 60 等●高温下有还原性,可以还原金属氧化物、CO 2 等●+4 【CO 32-】【HCO 3 -】等CO 2 、CS 2 等可以在纯氧中燃烧发出耀眼白光●同位素14C 用于考古其他金属碳化物中碳显负价(如CaC 2 等);有机物一般不讨论碳的化合价负价的碳化合物有还原性硅Si +4【SiO 3 2-】硅酸盐如Na 2 S iO 3 、硅酸、SiF 4 、氟硅酸盐等。
化学常识:常见元素的化合价-精选学习文档

化学常识:常见元素的化合价
一、化学常识:高中化学知识点整理:常见元素的化合价
常见元素的化合价。
熟记常见元素的化合价,钾钠氢银正一价,钙镁锌钡正二价; 氟氯溴碘负一价,通常氧为负二价;铜汞正二铝正三,铁有正二和正三;
碳有正二和正四,硫有负二正四六。
二、高考化学必备知识点:高中化学知识点整理:常见元素的化合价
常见的原子团:SO42-CO32-NO3-OH-MnO4-MnO42-ClO3-PO43-HCO3-NH4+碳酸氢根(HCO3-)硫酸氢根(HSO4-)磷酸氢根(HPO42-)磷酸二氢根(H2PO4-)阳离子:Na+Mg2+Al3+、H+NH4+、Fe2+Fe3+Ca2+阴离子:O2-OH-S2-F2-
Cl-SO42-CO32-NO3-MnO4-MnO42-ClO3背诵化合价口诀:+1价钾钠银铵氢,+2价钡钙镁铜汞锌二三铁、二四碳,三铝四硅五价磷,氟、氯、溴、碘-1价氧硫-2要记清。
氢氧根、硝酸根(OH、NO3)-1价,硫酸根、碳酸根(SO4、CO3)-2价,化合物各元素化合价代数和为零,单质元素化合价是零。
注:铵是NH4原子团;+2价的铁叫“亚铁”;+1价的铜叫“亚铜”无氧时S为-2价,跟氧结合时+4或+6价。
SO32-原子团叫“亚硫酸根”无氧时Cl为-1价氢氦
锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙锰铁。
高中常见化学元素化合价(2)(2021年整理)

高中常见化学元素化合价(2)(word版可编辑修改)
编辑整理:
尊敬的读者朋友们:
这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中常见化学元素化合价(2)(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中常见化学元素化合价(2)(word版可编辑修改)的全部内容。
化学元素的化合价助记口诀
一价氢氯钠钾银,
二价氧钙钡镁锌,
三铝四硅五价磷,
二三铁,二四碳,
二四六硫都齐全,
铜汞二价最常见.
正一钾钠银氢铵
正二钙镁钡和锌
三铝四硅氧负二
一二铜二三铁二四碳
氟氯负一磷正五
氢氧根—1
硝酸根 -1
硫酸根 -2
碳酸根 -2
一价氢氯(负)钾钠银
二价氧(负)钡钙镁锌
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全(—2、+4、+6)铜汞二价最常见
莫忘单质价为零
最常见的有:氢正一,氧负二
高中常见化学元素化合价(2)(word版可编辑修改) 常见元素及原子团的化合价表。
常见化合价

本资料为word版本,可以直接编辑和打印,感谢您的下载常见化合价地点: ________________时间: ________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容躺常见化合价+1H, Li, Na, K, Rb, Cs, Cu, Ag, Au, Hg, In, Tl, N+2Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd, Hg, Cr, Mn, Fe, Co, Ni, Cu, C, Sn, Pb, N, S+3B,Al, Ga, In, T1 , Sc, Y, La~Lu, N, P, As, Sb, Bi, Cr, Fe, Co,Ni, Au; Ce化合价+4C,Si, Ge, Sn, Pb, Ti, Zr, Hf, Ce, Th, Mn, Tb, N, S+5N, P, As, Sb, Bi, V, Nb, Ta+6S, Se, Te, Cr, Mo, W, U, Mn, Fe+7Cl, Br, I, Mn, Tc, Re+8Xe, Ru, Os-1F, Cl, Br, I, 0, H, Rh-2O, S, Se, Te-3N, P, As, Sb特殊原子团化合价硝酸根X03-: -1价亚硫酸根S035 -2价亚硫酸氢根HS03-:-l价硫酸根 S04"2-: -2 价 0 -2, S +6碳酸根 C03"2-: -2 价 0 -2, C +4.氯酸根 C103 -: -1 价 0 -2, C1 +5.氢氧根 0H-: -1 价 0 -2, H +1.钱根 NH4+: +1 价 H +1, X -3.磷酸根 P0T3-: -3 价 0 -2, P +5碳酸氢根HC03-: -1价镭酸根Mn04"2-: -2价高镭酸根MnO4-: -1价超氧根02"2~: -2价(注意:化学式相同,但不是同一个根,猛酸根中猛呈+6价,高猛酸根中镭呈+7价)氟、氯、澳、碘:-1 (氢氟酸,盐酸,氢澳酸和氢碘酸的酸根)非金属元素的化合价由于金属元素的原子最外层电子数大多都少于4个,故在化学反应中易失去最外层电子而表现出正价,即金属元素的化合价一般为正(极少数金属能显示负化合价,如辛弟,在铢化ffilnSb中为-3化合价)。
常用元素化合价表

常用元素化合价表钾 K +1 氯 Cl -1,+1,+5,+7钠 Na +1 氧 O -2,-1银 Ag +1 硫 S -2,+4,+6钙 Ca +2 碳 C +2,+4镁 Mg +2 硅 Si +4钡 Ba +2 氮 N -3,+2,+3,+4,+5锌 Zn +2 磷 P -3,+3,+5铜 Cu +1,+2 硫酸根 SO4 -2铁 Fe +2,+3,碳酸根 CO3 -2铝 Al +3 硝酸根 NO3 -1锰 Mn +2,+4,+6,+7 氢氧根 OH -1氢 H +1 铵根 NH4 +1氟 F -1 磷酸根 PO4 -3 氯酸根 ClO3 -1(Cl +5价)关于化合价的口诀,方便大家记忆:氢+1,氧-2,银锂钠钾+l价,锌镁钙钡+2价,铝+3,硅+4.只遇金属或是氢,氮磷-3硫-2,氟氯溴碘总-1.可变价,不可怕,具体判断"和为零".单质为零要记清."亚铜" +1"铜" +2,"亚铁" +2"铁" +3,置换反应铁+2,复分解时价不变.关于化合价要准确记着金属元素化合价和原子团的化合价。
一般非金属元素化合价是让你求的,所以只需要你了解非金属元素一般显负价,当含氧时显正价就可以了。
具体是几不需要。
金属元素化合价口诀正一氢银和钠钾,正二钙钡镁锌汞,铜是一二,铁二三,铝的价态是正三。
原子团化合价口诀OH氢氧根-1价,NO3硝酸根-1价SO4硫酸根-2价CO3碳酸根-2价PO4磷酸根-3价NH4铵根+1价这种原子团化合价的记法便于掌握原子团的组成、名称、化合价。
我们的学生一般都背这个。
一价钾钠氯(-1)氢银,二钾氧(-2)钙钡镁锌三铝四硅五价磷二三铁,二四炭,二四六硫都齐全铜汞二价最常见一价高锰、氯、硝酸根二价锰、硫、碳酸根三价磷酸根这是我初三老师教的。
很好背快中考了吧,加油!温馨提示:最好仔细阅读后才下载使用,万分感谢!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中阶段常见元素的化合价(word 版)中学阶段常见元素化合价表注:本表不列出稀有气体、金属的 0 价及非常见价态等。
元素常见化合价 【主要离子】例子 该化合价的性质 元素及单质的其他性质氢 H+1(主要) 【H +】 在大多数化合物中,如 HCl 、 H 2 O 、NaHCO 3 、NH 3 等●有三种同位素:1H 、2H(或 D)、3H(或 T)●单质有 还原性●可燃●密度最小的气体●无色无味-1 【H -】在活泼金属氢化物中及其衍生 物,如 NaH 、KH 、CaH 2 、KBH 4 等有强还原性,可以 和水反应放出 H 2锂 Li +1 【Li +】锂化合物如 LiCl 、LiOH 、Li 2 O 等焰色为深红色 ●银白色的活泼金属,可以和水反应●熔点比水高,密度很小●同位素 6Li 用在核反应堆内吸收中子●使用于电池内●在空气中燃烧生成 Li 2 O●强还 原剂钠 Na +1 【Na +】钠化合物如 NaCl 、Na 2 O 2 等焰色为黄色●银白色的活泼金属,可以和水反应,保存在煤 油中●熔点比水低,密度、硬度小●和醇、酸反应 放出氢气●在空气中燃烧生成 Na 2 O 2 ●强还原剂钾 K+1 【K +】钾化合物如 KCl 、KNO 3 等 焰色为紫色(混有 Na +时会为黄色,透 过蓝色钴玻璃才能 看到紫色)●银白色活泼金属,可以和水反应,比钠更剧烈, 保存在煤油中●熔点比水低、密度、硬度小●强还 原剂●在空气中燃烧生成 K 2O 2 和 KO 2●钾钠合金 用作核反应堆的冷却剂镁 Mg +2 【Mg 2+】镁化合物如 MgCl 2 、MgSO 4 等 ●银白色活泼金属,和沸水略有反应●在空气中燃 烧生成 MgO ,也有 Mg 3 N 2 生成●能在 CO 2 等大多 数气体中燃烧●和酸剧烈反应●强还原剂●军事上 用作照明弹钙 Ca+2 【Ca 2+】钙化合物如 CaCl 2 、CaSO 4 、 CaO 等焰色为砖红色 ●银白色活泼金属,和水反应●密度比水大●在空 气中缓慢氧化或燃烧生成 CaO●强还原剂硼 B+3 【BO 33-】大多数硼化合物如 H 3 BO 3 、 B 2 O 3 等铝 Al +3 【Al 3+】 【AlO 2 -】(偏铝 酸根)大多数铝化合物如 Al 2 O 3 、 NaAlO 2 等●银白色活泼金属,在空气中生成致密的氧化膜 阻止进一步氧化●两性金属,可以和强酸、强碱 反应●在浓硫酸、浓硝酸中钝化●高温下有强还原 性,铝热反应的原料碳 C +2 CO 等 有还原性 ●有多种同素异形体,如金刚石、石墨、C 60 等● 高温下有还原性,可以还原金属氧化物、CO 2 等● +4 【CO 32-】 【HCO 3 -】等CO 2 、CS 2 等可以在纯氧中燃烧发出耀眼白光●同位素 14C 用 于考古其他 金属碳化物中碳显负价(如 CaC 2 等);有机物一般不讨论 碳的化合价负价的碳化合物有 还原性硅 Si +4【SiO 3 2-】硅酸盐如 Na 2 SiO 3 、硅酸、SiF 4 、 氟硅酸盐等高中阶段常见元素的化合价(word版)●半导体材料●用作电脑芯片●可以和碱反应放出氢气+3 SiHCl3-4【Si4-】某些硅化物如Mg2 Si、Ca2 Si等和水反应放出自燃性的硅烷氮N +5【NO3 -】硝酸及硝酸盐( 如KNO3 ) 、N2 O5 等硝酸根离子酸化后具有强氧化性●无色无味的气体,不支持燃烧●化学性质稳定●高温或放电时和O2 反应产生NO●和H2 高温高压在有催化剂的条件下化合成NH3 ●游离态氮转化+4 NO2 、N2 O4 等易歧化为化合态氮的过程叫做固氮●用作冷却、防腐、+3【NO2 -】亚硝酸及亚硝酸盐( 如NaNO2 )、N2 O3 等亚硝酸跟离子有致癌性保护气体+2 NO 等+1 N2 O 等-3【NH4 +】【N3-】氨气、铵盐(如NH4 C l)、氮化物(如Na3 N、Mg3 N2 等)NH3 溶于酸;铵盐和碱反应生成NH3 ;活泼金属氮化物和水反应放出NH3 ,生成碱其他【N3 -】叠氮化物(如NaN3 等)磷P +5(主要)磷酸及其盐(如H3 P O4 、HPO3 、无显著氧化性●有红磷、白磷(P4 )、黑磷等多种同素异形体●易【PO4 3-】【HPO4 2-】【H2 PO4 -】等K3 P O4 、NaH2 P O4 等)、P4 O10 、PCl5 、POCl3 等燃,在空气中燃烧生成P4 O10 ●白磷易自燃,剧毒,可溶于CS2 ●白磷烧伤应用硫酸铜溶液处理●用过白磷的仪器应灼烧●红磷受热升华,白磷熔化●和氧化剂混合易爆+3 【PO3 3-】等H3 P O3 、PCl3 等+1 次磷酸(H3 P O2 )及其盐有强还原性氧O -2氧化物如SO2 、CuO、I2 O5 等;最常见的价态●无色无味的气体,供给呼吸,助燃●最常见的同【O2-】【OH-】【……】-1【O22-】氢氧化物如KOH 等;大多数含氧酸及其盐如HClO4 、BaSO4等;……过氧化物如H2 O2 、Na2 O2 等和水反应放出氧气素异形体是臭氧(O3 ),有鱼腥臭味和很强的氧化性(常温下能将银、硫化铅等物质氧化),易被催化分解,受热易分解●在氧气中高压放电能产生臭氧●液氧为淡蓝色液体,固态为淡蓝色雪花状固体●绝大多数元素都存在氧的化合物●接近100%的纯氧能使人的呼吸停止其他【O2 -】【O3 -】等硫S +6 【SO4 2-】【S2 O82-】【S2 O72-】等超氧化物(如KO2 )、臭氧化物(如CsO3 )、HOF(此处0 价)等SO3 、H2 SO4 、硫酸盐、过硫酸盐、焦硫酸盐、SF6 等强氧化性;超氧化物、臭氧化物和水反应放出氧气●黄色固体,可燃,在空气中燃烧产生淡蓝色火焰,在纯氧中则为蓝紫色火焰●熔点低●和碱金属反应爆炸,研磨即可反应●能和一些不活泼金属如Cu、Hg 反应●溶于二硫化碳或碱金属硫化物溶+4 【SO3 2-】等SO2 、亚硫酸盐等+2 SCl2 等液中●硫的分子式为S8 ●硫有多种同分异构体●硫、碳、硝酸钾用一定的工艺混合可以制成黑火-2【S2-】硫化物(如K2S、H2S、Cu2 S、HgS 等)、硫取代氧的化合物等活泼金属硫化物和药酸反应产生H2 S;某些金属的硫化物则很稳定;还原性氟 F -1 氟化物(如CaF2 、HF、NH4 F、可溶性氟化物有●极毒的淡黄绿色气体,有芥末气味,化学性质【F-】【HF2-】【SiF6 2-】等NH4 HF2 、KHF2 、UF6 、XeF6等)、氟代含氧酸盐、含氟有机物等毒,直接接触可引起严重灼伤极其活泼●无正价●只有少数元素不能和氟直接化合●用于制造含氟高分子材料、制造农药、制造人造血液、分离铀的同位素氯Cl +7 【ClO4 -】高氯酸、高氯酸盐、Cl2 O7 等强氧化剂●剧毒的黄绿色气体,有刺激性气味,化学性质十分活泼●化合价多、氧化物不稳定●有漂白性●+5 【ClO3 -】氯酸、氯酸盐等强氧化剂+4 ClO2 等+3 【ClO2 -】亚氯酸、亚氯酸盐等易液化●可溶于水●用于有机合成,是重要的化工原料+2 ClO·+1 【ClO-】次氯酸、次氯酸盐、Cl2 O等强氧化剂-1 【Cl-】等氯化物等溴Br +7、+5、+4、+3、见“氯Cl”(溴、碘+1 价有BrX、溴酸盐有强氧化性●有毒的深红棕色重质液体,易挥发,有刺激性+1、-1 IX 等) 气味,化学性质活泼●溶于水、乙醇、四氯化碳、苯等●用于消毒碘I +7、+5、+3、+1、见“氯Cl”(次碘酸及其盐常温碘化物有较强的还●深紫色固体,有毒,易升华,有刺激性气味●受-1其他【I3 -】等不存在)碘溶于碘化物溶液中产生:I2 +I-=I3 -原性使淀粉变蓝;有较强的还原性热升华●用于消毒●溶于水、碘化物溶液、乙醇、四氯化碳、苯等铬Cr +6【CrO42-】CrO3 、CrO5 、铬酸盐(BaCrO4 、铬酸跟在酸性条件●银白色金属,十分坚硬●有丰富的价态,化合物【Cr2 O72-】(此价态常见)K2 C rO4 、Na2 C rO4 等)、重(chóng)铬酸盐(K2 C r2 O7 、(NH4 )2 C r2 O7 等)下转化为重铬酸根,碱性条件下逆转换。
氧化剂。
致癌。
颜色多样●用于制备强度大的合金,或用于金属防锈●在硝酸中钝化+5【Cr(O2 )43-】K3 C r(O2 )4 红褐色+4 CrO2 、K2 CrF6 等+3 【Cr3+ 】铬盐(如CrCl3 等)、Cr2 O3 、主要为绿色【CrO2 -】(此价态常见)NH4 Cr(SO4 )2 、次铬酸盐等+2【Cr2+】亚铬盐(如CrCl2 等)、CrO 等。
Cr2+ 和水反应放出H2锰Mn +7【MnO4 -】高锰酸及其盐(如KMnO4 等)、Mn2 O7有强氧化性, 不稳定。
紫色●活泼金属,活泼性在铝和锌之间●带有红色光泽的银白色金属,潮湿处易被氧化●用于制备合金+6 【MnO4 2-】锰酸盐+5 【MnO4 3-】锰(V)酸盐+4 MnO2 等和浓盐酸反应产生Cl2+3 MnF3 、Mn2 O3 、MnO(OH)+2 锰盐(如MnSO4 、MnCl2 等)、Mn(OH)2铁Fe +6 【FeO4 2-】高铁盐(如K2 F eO4 等)强氧化性,不稳定,●银白色具有磁性的金属,熔点很高●常用来制作+3 和+2 Fe3 O4 、Fe4 [Fe(CN)6 ]3 3+ 在酸中分解合金●在纯氧中可燃,发出耀眼白光,产生四氧化三铁●和水蒸汽高温反应产生四氧化三铁和氢气●和非氧化性酸、碘、硫反应生成二价铁●和+3 【Fe 】铁盐(如FeCl3 等)等有氧化性。
水溶液为黄色Cl2 、Br2 反应生成三价铁●在硝酸、浓硫酸中钝化+2 【Fe2+】亚铁盐(如FeCl2 等)、FeO 、FeS 等有还原性,易被氧化。
水溶液为浅绿色+1 Fe(NO)SO4钴Co +3 三价钴化合物(如Co2 O3 、亚硝酸钴钠等),Co3 O4 中含+2和+3 价的钴有强氧化性,能氧化盐酸、水等,在溶液中不稳定●有磁性的高熔点银白色金属●钴和酸、氯气反应只生成二价钴●常用来制作合金●60Co 用于放射医学+2(常见)【Co2+】二价钴化合物水溶液为红色镍Ni +3 三价镍化合物(如Ni2 O3 等)氧化性强于三价钴●有磁性的高熔点的银色金属●常用作催化剂(如250℃催化苯和氢气加成为环己烷)●常用作合金+2(常见)【Ni2+】二价镍化合物水溶液为碧绿色●63Ni 用作金属探伤●*Fe、Co、Ni 的二价离子还原性依次减弱、稳定性依次增强,三价离子稳定性依次减弱,氧化性依次增强铜Cu +2(主要)【Cu2+】铜盐(CuSO4 等) 、CuO 、Cu(OH)2 等蓝色●质地软、熔点高的紫红色金属●化学性质较稳定,但能被氯气、氧气、硝酸氧化+1 【Cu+】亚铜化合物(CuCl、Cu2 O 等) 在酸中歧化银Ag +1(主要)【Ag+】大多数银化合物(Ag2 O 、AgNO3 等)沉淀Cl-、Br-、I-、S2-等●银白色金属,化学性质稳定●易被硫、硫化氢腐蚀●熔点高金Au +3 【Au3+】等多数金化合物如Au2 O3 、HAuCl4 等●金黄色、化学性质稳定的贵金属,熔点1000 多摄氏度,比铜、铁软●金的纳米粉末为紫色●不溶于硝酸,但溶于王水、汞,易被氟气、氯气和氰+1 【Au+】【Au(CN)2 -】等锌Zn +2 【Zn2+】【Zn(OH)4 2-】亚金化合物,如AuCl 等锌化合物(ZnCl2 等) 溶于过量的强碱溶液化物侵蚀●银青色的活泼金属,熔点低●在空气中可以燃烧●常用作合金小练习:写出下列指定元素的化合价(3s 之内反应不过来就是该种元素还没过关)N2 H4 N:N2O4 N:CuCl Cu:K2FeO4 Fe:KClO3 Cl:Na2 S2 O3 S:KNO3 N:NO N:HClO Cl:KMnO4 Mn:MnO2 Mn:SO2 S:H2 S O4 S:NH3 N:Fe2 O3 Fe:。
