趋化因子生物活性的测定
《病原生物学》教学大纲

病原生物学(88学时)一、课程简介病原生物学是医学基础课程之一。
本课程有医学微生物学、基础免疫学与人体寄生虫学三门课程组成。
其目的是使学生掌握基本理论、基本知识和基本技术,了解本学科理论和技术的最新进展,应用所学知识对临床常见的免疫现象与免疫性疾病,传染病的发病机理,实验室检查和特异性防治作出解释;加深对病原生物与人体和环境间相互关系的理解,建立无菌观念,在消毒、隔离、预防、医院感染等工作中加以具体运用;为学习后续课程奠定必要的基础。
二、学时分配教学内容理论实践总计基础免疫学绪论 1 1抗原 2 2MHC 1 1免疫系统 2 2 4免疫球蛋白 2 2补体系统 1 2 3细胞因子 1 1免疫应答 2 2抗感染免疫 1 4 5超敏反应 3 3免疫学检测方法及其原理免疫学防治医学微生物绪论细菌总论细菌各论其他微生物病毒学人体寄生虫学总论线虫纲吸虫纲绦虫纲医学原虫医学节肢动物机动合计2217821024432164642111124221131221225543188三、教学内容和要求基础免疫学第1章免疫学绪论【目标】掌握免疫系统的功能,熟悉特异性免疫应答的特点,了解免疫的类型、免疫学发展简史及免疫学在临床实践中的应用。
【理论教学】1、免疫的基本概念2、免疫学发展简史3、免疫学在临床实践中的应用第2章抗原【目标】掌握抗原的概念;抗原的分类。
熟悉决定免疫原性的条件;抗原的特异性与交叉反应。
了解医学上重要的抗原。
【理论教学】第1节抗原的概念抗原的概念;抗原的两个基本性能:①免疫原性;②免疫反应性。
第2节决定免疫原性的条件1、异物性2、一定的理化性状3、分子构象与易接近性第3节抗原的特异性与交叉反应1、特异性2、共同抗原与交叉反应第4节抗原的类型与医学上重要的抗原1、根据抗原的性能分类:完全抗原、半抗原2、根据抗原激活B细胞是否依赖T细胞辅助分类:胸腺依赖性抗原、非胸腺依赖性抗原3、根据抗原的来源及与机体的亲缘关系分类:异种抗原、同种异性抗原、自身抗原、肿瘤抗原第3章主要组织相容性复合体【目标】熟悉HLA分子的分布及生物学功能。
广谱趋化作用抑制剂的体内筛选及其活性鉴定

只, 雌雄各半 , 经尾静脉注射 L S gk , P m / g分别在注 5 射后 13 5h , 、、 后 股静脉取血 , 制备血清后 ,u i x L mn e 液 相芯 片法 检 测 I一、 A T S MC — 三 种 趋 化 因 L8 R N E 、 Pl 子表达量 , 同时设空白对照组。结果显示 , 各时点趋
体展示技术经大 鼠体内筛选得到阳性噬菌体克 隆, 体内 回输 实验 、 经 趋化 抑制实验 和竞争结 合实验鉴定 噬菌 体克
隆的活性 , 提取生物活性较好的 1 个 阳性噬菌体克 隆的 D A进行 测序 , O N 据此推导 插入 的氨 基酸序列 。结果 经 过三轮体内筛 选 , 目的噬菌体得到 了有效富集 。对 1 个趋化抑制效果较好 的阳性 噬菌体进行测序 , 0 共得 到 5 序 个 列, 中 2 其 有 个序列 出现的频率均为 3% 。结论 0 肽; 该相关肽可作为抗炎药物的先导肽。
化 因子表达 量 明显 高 于注 射 前 ( P均 <00 ) 以 3 .5 , h时表 达量最 高 。证 实炎症 模 型建立 。
胞因子类 、 趋化 因子类 和前列腺素类 ) 能够促 进 白 细胞 从血液 向炎症 部 位 迁 移 。在 过 去 的十 多年 中 , 介 导 白细胞 迁移 的分 子信 号 网络研 究 有 较 大进 展 。 以趋化因子或其受体为靶 点的抑制剂成为研究热 点, 具有广谱抑制趋化作用 的分子药物将给炎症 的
室, 混匀后用血球计数板计数细胞个数 , 计算趋化抑 制率 。趋 化抑 制率 =( 1一实 验 组趋 化 到下 室 的 细 胞数/ 阳性对照组趋化到下室的细胞数)× 0 %。 10 16 竞争结合试验 调整大 鼠单个 核细胞密度为 . 1 1 m , 50 细胞悬液接种于 2 孔培养板 , × 0 l 0 l / 取 4 实验 组 提前 用 阳性 噬 菌 体 克 隆 在 4 o 件 下处 理 C条 3 i , 入 G P标 记 的 I一、 A T S MC 一 1 0rn 加 a F L8 R N E 、 P1 0
细胞生物学实验教程:细胞运动性检测实验详细介绍

一、细胞生物学实验教程:细胞运动性检测实验详细介绍细胞的运动是机体新陈代谢与基本生命特征之一。
在低等生物中,原始细胞通过变形与伪足活动趋近食物与远离伤害。
在高级生物体的生命活动中,细胞的定向迁移与胚胎形成、神经发育、免疫应答、器官成熟等密切有关。
人类的许多重大疾病及其治疗,如肿瘤转移,神经修复、干细胞功能再生等等都与细胞运动息息有关。
细胞的运动依靠于细胞骨架(Cytoskeleton),细胞骨架除了承担胞内的物质运输之外,也是构成细胞运动性的物质基础,比如肌动蛋白是细胞运动伪足中最要紧的结构单位。
当细胞感受到外界的刺激信息(如食物信号等),会伸出扁平的片层伪足,通过其前沿的不断延展与基部的收缩,与细胞与支撑物之间的吸附、解吸附的动态循环,朝向刺激源运动。
细胞的运动还具有粘附性(Adhesion)与趋向性(Polarization)的特点,不一致的粘附因子与细胞外基质(Extracellular Matrix)相互作用一方面决定了细胞运动的分子信号调控,同时与大量的趋化因子共同决定了不一致细胞的特定组织转移与偏好。
图1:细胞的定向迁移运动图2:细胞的运动性与细胞骨架蛋白图3:神经干细胞分化与神经元的定向迁移图4:原生癌细胞的迁移与侵袭图5:一个正在穿孔的肿瘤细胞的运动图6:恶性黑色素瘤细胞侵入机体正常组织图7:上皮细胞在伤口部位增殖,运动迁移,进行组织修复二、细胞运动性常用检测方法细胞运动性研究在发育生物学、神经生物学、癌症与干细胞生物学等诸多前沿科学领域具有重大研究意义。
然而长期以来细胞运动性检测是一个技术难点,目前常规可用于细胞运动性评估的要紧方法有:基于显微镜的形态观察(含荧光标记)、体外组织移植、细胞集落划痕与Boyden Chamber法,这些方法各有千秋,但都无法实现定量检测细胞定向迁移、癌细胞侵袭性与细胞粘附性等,最近罗氏公司推出的基于Boyden Chamber原理的微电子细胞芯片检测技术(xCELLigence)实现了定量、动态、无标记关于大规模细胞迁移、侵袭、粘附性的检测,同时还可同步检测包含细胞增殖、凋亡等多项细胞生理学功能。
趋化因子研究进展

(二) CCL21/SLC,CCL19/ELC和CCR7、CXCL13/BCA-1/BLC和CXCR5 协助T、B、DC细胞在周围免疫器官中正确定位并相互作用
T: CCR7; DC:CCR7; B: CCR7 、CXCR5; TFH:CXCR5
T区HEV:SLC、ELC; B滤泡区HEV:BCA;
36
37
(三)、趋化因子受体的表达
1、CKR有其相对特异的表达谱: CXCR4: Neu、Mo; CCR3: Eos、Bas; DARC:RBC
38
趋化因子受体、配体及靶细胞
39
2、CKR的表达具有时、空特异性: (1)在Th细胞的不同阶段,表达不同的CKR:
Naïve Th:CCR7, CXCR4; Th0: CCR7, CCR5, CXCR3 Th1: CCR5, CXCR3; Th2:CCR3,4,8, CXCR4
(3)其它具有趋化活性的细胞因子 IGF-1,FGF,HGF等细胞因子具有趋化活性,但它们 的主要作用不是趋化作用,不列为CKs。
23
(四)趋化因子的共同结构特点
1、CKs分子量小,在8-12KD之间; 2、蛋白质一级结构上具有同源性,CXC与CC 成员之
间:20%-30%;
24
3、多数CKs含有4个保守的Cys ,1,3位Cys、 2,4位 Cys形成功能必须的两对二硫键;
…ELRCXC……C……C… CXCL8/IL-8 等, 趋化Neu,不能趋化Mo;促进血管的生成。
非ELR CXC趋化因子:
…CXC……C……C… CXCL12/SDF-1等, 趋化Lymphocyte或HPC;抑制血管的生成。
同源性: CXC家族CK之间 :25%-90%。 染色体定位:
趋化因子在免疫反应中的作用机制

趋化因子在免疫反应中的作用机制人体免疫系统是由多种细胞和分子相互调控的复杂系统,其中趋化因子(chemokines)是一类重要的信号分子。
它们能够诱导相应的免疫细胞在体内定位到合适的组织位置,从而参与免疫反应。
本文将从趋化因子的定义、分类、结构和功能等方面详细介绍它们在免疫反应中的作用机制。
1. 趋化因子的定义和分类趋化因子是一类小分子(8-10 kDa)的信号蛋白,它们主要由体内的各种免疫细胞产生,能够作用于静止的免疫细胞并导致它们定向迁移。
根据它们对特定免疫细胞或组织的作用,趋化因子被分为CXC、CC、C等几类。
其中CXC趋化因子能够作用于粒细胞和某些类型的淋巴细胞;CC趋化因子能够作用于单核细胞和某些淋巴细胞;C趋化因子能够作用于树突状细胞和某些淋巴细胞。
2. 趋化因子的结构趋化因子通常由70-100个氨基酸组成,它们采取α螺旋形的结构。
它们的结构主要分为四部分:信号区、N末端区、C末端区和两个保守的半胱氨酸桥。
其中信号区不参与趋化活性,而N末端区可对其生物活性和特异性作出贡献。
两个半胱氨酸桥是它们的特征之一,它们使得趋化因子在三维空间上具有一定的稳定性和活性。
3. 趋化因子的功能趋化因子通过它们作用于受体的能力来参与免疫反应。
每种趋化因子在体内会结合到特定的受体上,受体引起下游信号通路的激活,随后可能介导细胞粘附、转移、活化、增殖、分化等一系列活动,从而在免疫反应中发挥重要作用。
其中CXC趋化因子能够作用于粒细胞和某些类型的淋巴细胞。
他们能够参与细胞粘附、粒细胞趋化、肿瘤细胞转移、血管生成和免疫反应等多个方面。
例如,IL-8是一种常见的CXC趋化因子,在体内能够促进中性粒细胞向肿瘤转移部位定向迁移,从而参与肿瘤的扩散。
CC趋化因子能够作用于单核细胞和某些淋巴细胞。
它们通过激活受体介导下游信号途径,在宿主防御和修复过程中发挥重要作用。
MCP-1是一个典型的CC趋化因子,它对单核细胞具有强烈的趋化作用,可以参与体内的炎症反应和血管粘在显著的相互作用。
巨噬细胞趋化因子鉴定

巨噬细胞趋化因子鉴定
巨噬细胞趋化因子的鉴定主要包括以下几个步骤:
1.确定检测方法:根据研究目的和实验条件,选择适合的检测方法,如免疫组织化学、免疫荧光染色、酶联免疫吸附试验等。
2.制备抗体:根据需要,可以制备特异性抗体,用于检测巨噬细胞趋化因子。
3.样品处理:将待检测的组织或细胞进行处理,如固定、包埋、切片等,以便后续的检测。
4.检测反应:根据选定的检测方法,进行检测反应。
例如,在免疫组织化学中,将抗体与组织或细胞中的巨噬细胞趋化因子结合,通过显色反应检测表达情况。
5.结果分析:对检测结果进行分析,如计数阳性细胞数、测量染色强度等,以评估巨噬细胞趋化因子的表达水平。
6.验证结果:为了确保检测结果的可靠性,可以进行一些验证实验,如使用不同的抗体或检测方法进行重复实验。
需要注意的是,巨噬细胞趋化因子的鉴定是一个相对复杂的过程,需要具备一定的实验技能和经验。
同时,在进行实验前,应确保实验操作符合相关法律法规和伦理规范,并遵循实验室安全规范。
在鉴定巨噬细胞趋化因子时,常用的方法有酶联免疫吸附试验(ELISA)、蛋白质印迹(Western Blot)和实时荧光定量PCR(Real-time PCR)等。
这些方法各有优缺点,可以根据具体的研究目的和实验条
件选择适合的方法。
例如,ELISA方法常用于检测细胞因子等蛋白质的浓度,蛋白质印迹则可以用于检测蛋白质的表达和修饰情况,而实时荧光定量PCR则可以用于检测基因的表达水平。
甲状腺癌患者血清,趋化因子及激素水平的测定价值

关键词 抗甲状腺球蛋白抗体#促甲状腺激素#白细胞介素 #@#水平测定#价值分析 中图分类号:]F#&;> 文献标识码:H 文章编号:>&F%O>>!AM!<!#U<&O<FGGO<# (><;#A&A^>&F%L>>!A;!<!#;<&;<#<
趋化因子受体CCR5模拟肽生物学活性的初步研究

实验研究
趋化 因子受体C R 模拟肽 生物学活性的初步研究 C5
郭 海 萍 郑 雪 燕
【 摘要】 目的 探讨趋 化 因子 受体 C R 模拟 短肽 (D C S FY Q 的生物 学作 用。方 法 用 Mr C5 H T SH P S ) s法检 测模拟肽 对淋 巴细胞 的增 殖抑制作 用。趋
化性 实验观察短肽 分别对 MI・Ⅸ、MI-0 及 R N E 趋 化作 用的影响 。结果 通过对 C R P1 P1 A TS C 5模拟短肽 (D C S FY Q 的活性 分析 ,发现 该 H T SH P S )
短肽 能抑制 P A 对 P C 的活化增殖作 用,2m /L时 ,抑制率达到 3 2 H MB s 0g m n %;且 能抑 制 P MC 对 R N E B s A T S的趋 化作用。结论 模拟肽 能够抑 制
状腺 功 能发生改变 ,也会使 下丘脑- 体. 垂 性腺轴变 化启动 ,而致使性
过早 成熟。
2性早 熟 的危 害 性早熟对儿童 的健康成 长和发育贻害无穷 。
性早熟 不仅使青春 期和生长 发育提前而导 致早恋 ,而且多伴有骨
食绿色食 品 ,绿色植物食 品含有多种 氨基 酸和矿物质 和微量元素 ,能 促进 骨骼发育和 肌肉的生 长 ,有利于身体 新陈代谢 ,有 利于污染物的
左右夭折 。
环境保 护是我 国的一项基本 国策。全社 会要 增强环境保 护意识 ,
要积 极研究和制 定对策 ,采取 积极有效 的措 施 ,积极做 好环境保护工 作 ,遏止环境 的进 一步恶 化,保护儿童身心 健康 ,拯救早 熟儿童 ,杜
绝早 熟现象 的发生 。 3 . 免滥用药物和滋补食 品 4避
要让儿童 早期接受健 康文化教育 ,接受传统 的 中华美德教 育 ,不
类风湿关节炎患者血清和关节液中趋化因子的测定及其意义

类风湿关节炎患者血清和关节液中趋化因子的测定及其意义【关键词】类风湿关节炎关节液中趋化因子的测定据最新统计,类风湿关节炎( rheumatoid arthritis, RA)在全世界的发病率为22~60/10万人口,在关节炎中它是致残率较高的疾病。
尽管类风湿关节炎的发病机制目前仍不十分明确,可是许多研究说明细胞因子作用于多种细胞而且彼此调剂形成一个网络,在类风湿关节炎的滑膜病变中起着核心作用[1]。
调剂活化正常T细胞表达和分泌因子(regulated on activation normal T cell expressed and secreted,RANTES)及SDF-1 (stromal cell-derived factor-1)均为炎症性趋化因子,具有调剂T淋巴细胞分化的功能。
作者对RA 患者血清和病变膝关节滑液中RANTES和SDF-1水平进行检测,并与外伤截肢者对照,旨在探讨其在RA发病中的作用。
1 资料与方式1.1 一样资料实验组血清及膝关节滑液取材于2002至2005年金华各医院风湿科初诊RA患者23例,均符合1987年美国风湿病协会修订的类风湿关节炎诊断标准。
对照组血清及膝关节滑液均为本院因外伤截肢患者共16例。
1.2 标本搜集抽取空肚外周静脉血5ml,以2500r/min离心15min,取血清,置于-20℃备检。
细针抽取关节滑液2ml,置于-80℃备检。
1.3 检测方式RANTES及SDF-1的检测采纳酶联免疫吸附实验(ELISA),操作依照R&D试剂盒说明书进行。
其要紧步骤为:别离向包被鼠抗人RANTES单抗和SDF-1单抗的微孔内加入50μl的RANTES、SDF-1标准品或检测血清、按1:3稀释的关节滑液,将96孔板盖上薄膜置于室温中孵育2 h,孵育后洗涤3次。
别离加入50μl酶联复合物,显色,全自动酶标仪别离读取RANTES及SDF-1浓度,标本均行复孔检测,均值为终浓度。
il-8生物活性的检测

基本原理: 基本原理
IL-8是典型的 是典型的CXC家族趋化因子,对嗜中性粒细胞和 淋巴细胞有趋化 家族趋化因子, 是典型的 家族趋化因子 对嗜中性粒细胞和T淋巴细胞有趋化 作用。 的趋化作用没有种属特异性, 作用。IL-8的趋化作用没有种属特异性,因此,可以用豚鼠嗜中性粒细 的趋化作用没有种属特异性 因此, 胞代替人嗜中性粒细胞对其进行活性检测。 胞代替人嗜中性粒细胞对其进行活性检测
100µl
100µl
100µl
100µl(弃去100µl)
(载体对照稀释同上)
三.准备底层小室,加样: 准备底层小室,加样:
1)将趋化小室底层板放水平台上,NP标记位于右下方。 )将趋化小室底层板放水平台上, 标记位于右下方 标记位于右下方。 2)将稀释好后预温的样品加入孔中,使液面微微隆起, )将稀释好后预温的样品加入孔中,使液面微微隆起, 每孔27µl, 国产板每孔25µl),每个样品 个复孔。 ),每个样品 个复孔。 每孔 , (国产板每孔 ),每个样品3个复孔 为防止样品过度蒸发,整个加样过程应不超过5分钟 分钟。 为防止样品过度蒸发,整个加样过程应不超过 分钟。 3)将适当孔径的滤膜取出,在滤膜的一角剪去1mm的小 )将适当孔径的滤膜取出,在滤膜的一角剪去 的小 标记, 角,缺角对 着NP标记,分别用镊子夹住滤膜两端,水平 标记 分别用镊子夹住滤膜两端, 下降,中间部位最先接触小室液面, 下降,中间部位最先接触小室液面,将膜平放在加完样的 底层板上。 底层板上。 4)铺上硅胶垫,装上上层板,硅胶垫的缺角及上层板的 )铺上硅胶垫,装上上层板, NP标记位于右下方。装上螺丝,拧紧装置。 标记位于右下方。 标记位于右下方 装上螺丝,拧紧装置。
实验程序:
western测组织中的趋化因子

western测组织中的趋化因子西方测组织中的趋化因子是细胞分子信号,它们能够影响细胞的运动和方向性,从而调控细胞的趋化行为。
趋化因子在生物体内发挥着重要的生理和病理作用。
本文将从趋化因子的定义、分类、作用机制和应用等方面进行阐述。
1.趋化因子的定义和分类趋化因子是一类能够引导细胞朝向或远离梯度浓度的化学物质,通过与细胞表面的受体结合,触发细胞信号转导通路,从而改变细胞的形态和方向性。
根据细胞对趋化因子的反应方式,趋化因子可以分为吸引性趋化因子和抑制性趋化因子。
2.趋化因子的作用机制趋化因子通过与细胞膜上的特定受体结合,激活下游信号转导通路,最终导致细胞的变形、膜骨架重排和运动。
趋化因子通过细胞内的信号传导级联反应,如蛋白激酶C、磷脂酰肌醇3-激酶和小受体GTP 酶等,调控细胞的黏附、收缩和成骨等功能,实现细胞的趋向性迁移。
3.趋化因子的作用方式趋化因子可以通过局部分泌、膜蛋白和胞外基质的定向分布等方式来发挥作用。
其中,细胞间的局部分泌是一种重要的趋化因子产生和释放机制。
人体内的细胞,如白细胞、纤溶酶原细胞和巨噬细胞等,可以通过分泌趋化因子,来招募其他细胞到特定区域,参与免疫反应和组织修复等生理过程。
4.趋化因子的应用趋化因子在研究细胞迁移和分化、肿瘤转移、免疫调节和组织工程等领域具有重要的应用价值。
例如,通过研究趋化因子与其受体的相互作用和信号转导机制,可以揭示细胞迁移和转化的分子基础,有助于开发新的抗癌药物和治疗手段。
此外,趋化因子还可以在组织工程中起到引导和促进细胞迁移定向分化的作用,有望解决一些组织修复和再生难题。
5.趋化因子研究的前景趋化因子的研究在人类健康和疾病治疗中具有重要意义。
随着研究的深入,越来越多的趋化因子及其相关信号通路被发现。
未来的研究将进一步聚焦于趋化因子和肿瘤转移、免疫调节以及神经再生等领域的深入探索,有望为疾病的诊断和治疗提供新的思路和方法。
总之,趋化因子在细胞迁移、分化、肿瘤转移、免疫调节等多个领域起着重要的调控作用。
趋化因子生物活性的测定

趋化因子生物活性的测定趋化因子生物活性的测定1.基本原理:趋化因子的趋化作用没有种属特异性,趋化因子的靶细胞主要有中性粒细胞、单核细胞、淋巴细胞、嗜酸性粒细胞、嗜碱性粒细胞、树突状细胞和成纤维细胞等。
(以IL-8为例)IL-8是典型的CXC家族趋化因子,对嗜中性粒细胞和T淋巴细胞有趋化作用。
由于它的趋化作用没有种属特异性,因此,可以用豚鼠嗜中性粒细胞代替人嗜中性粒细胞对其进行活性检测。
趋化因子诱导的细胞移动方式有两类:化学增活现象,指增强细胞的随机运动,琼脂糖小滴化学动力实验是检测这种活性的比较简易,快速,重复性好的方法。
趋化性,指诱导细胞向趋化因子化学浓度高的方向移动。
琼脂糖中的趋化实验和微孔小室中的趋化实验则是常用的测定细胞因子趋化活性的方法。
微孔小室中的趋化实验:微孔小室中的趋化实验是根据靶细胞(单核巨噬细胞,中性粒细胞或淋巴细胞等)能够趋化性主动迁移,穿过一定孔径的滤膜而设计的。
滤膜将小室分隔成上下两部分。
靶细胞在上面,趋化因子在下面,趋化因子通过滤膜形成梯度,细胞则沿着梯度穿过膜孔,黏附在膜的下面,染色并计数滤膜下表面的细胞数即可测出趋化因子的趋化能力。
趋化材料和趋化时间的选择:趋化滤膜的材料和孔径需根据靶细胞的大小选择;中性粒细胞用3μm孔径的PVPF聚碳酸膜( Polycarbonate membranes), 趋化时间为30分钟;单核细胞用8μm孔径的PVPF聚碳酸膜,趋化时间为90分钟;粘附力弱的淋巴细胞则用下表面复以明胶或纤粘素的5μm或8μmPVPF聚碳酸膜,以免淋巴细胞穿过膜后落入下室,趋化时间为180分钟。
趋化因子浓度的确定:由于趋化因子的特异活性非常高,某些趋化因子在较高浓度时促进细胞趋化的作用反而降低,所以待测样品常需连续稀释(5倍或10倍系列稀释)以获得最适剂量的趋化结果。
每次实验都需设好对照,因为不同来源或不同活力靶细胞的趋化能力差异很大。
趋化因子活性的表达方式有三种,其中最常用的是用趋化指数表示,趋化指数(chemotactic index,CI)是指细胞迁移到待测样品液的数目和迁移到对照液的数目的比值。
ABC-ELISA定量测定红细胞趋化因子受体及其意义

ABC-ELISA定量测定红细胞趋化因子受体及其意义[ 06-07-03 09:31:00 ] 编辑:studa20作者:张乐之,卢晓丹,龚燕芳,郭峰【摘要】目的建立ABC-ELISA定量测定红细胞趋化因子受体(ECKR)的方法并探讨其临床意义。
方法分离一定数量红细胞与IL-8结合,离心后取上清液用ABC-ELISA法检测IL-8含量,通过公式计算红细胞趋化因子受体结合活性;对该法检测IL-8的灵敏度、精密度、准确度进行了探讨,并对31例正常人,25例恶性肿瘤患者和33例银屑病患者的ECKR进行了测定。
结果该法检测IL-8的灵敏度为15.6pg/ml。
精密度批内平均CV 4.69%;批间平均CV9.79%,准确度平均回收率为97%。
31例正常人ECKR为(52.96±10.45)%;25例恶性肿瘤ECKR为(46.07±13.33)%;33例银屑病人ECKR为(46.87±10.28)%。
经统计,恶性肿瘤患者和银屑病患者ECKR均比正常人ECKR 要低(P<0.05)。
结论该法是一种简便的定量测定ECKR的新方法,对研究红细胞免疫、趋化因子及其受体在疾病防治和发病机理中的作用有一定价值。
【关键词】红细胞趋化因子受体;链霉亲和素生物素-ELISA;白介素-8;红细胞免疫【Abstract】 Objective To develop a quantitative ABC-ELISA and to investigate the clinical significance for human erythrocyte chemokine receptor.Methods Isolated erythrocytes bound to IL-8. After centrifuge IL-8 levels were measured with ABC-ELISA in the supernatant. Activity of erythrocyte chemokine receptor were calculated by formula.Results The minimum detectable limit was15.6pg/ml. Precision: The mean coefficients of variation were 4.69% for inter-assay and 9.79% for intra-assay, respectively. Accuracy:The mean recovery rate was 97%. In 31 normal adults, the ECKR binding activity (±s%) was 52.96±10.45. In 25 tumors, 33 psoriasises,it was 46.07±13.33, 46.87±10.28 respectively. The ECKR binding activity of the tumors and the psoriasises decreased significantly (P<0.05) compares with normal control group by statistics.Conclusion A quantitative ABC-ELISA for erythrocyte chemokine receptor is a simple and new method. The detection of the ECKR binding activity has a value to study RBC immune, chemokine and its receptor in preventing, treating and the pathogenesis of the disease.【Key words】 erythrocyte chemokine receptor;ABC-ELISA;interleukin-8;erythrocyte immune1982年郭峰[1]在国内首先建立了测定红细胞免疫粘附功能的方法,并证明红细胞的免疫粘附功能主要是通过CR1实现的。
免疫活性物质知识点总结

免疫活性物质知识点总结一、免疫活性物质的分类免疫活性物质根据其来源、结构和功能可以分为几类,主要包括细胞因子、细胞调节因子、趋化因子、炎症介质等。
1. 细胞因子细胞因子是一类由免疫细胞产生的生物活性蛋白质,包括淋巴细胞因子、单核细胞因子、巨噬细胞因子和其他免疫细胞因子等。
它们可以促进或抑制其他免疫细胞的活性,通过细胞间相互作用来调节和协调免疫应答。
2. 细胞调节因子细胞调节因子主要是调节T淋巴细胞功能的蛋白质,包括促进T淋巴细胞活化和增殖的T 细胞辅助因子(T细胞协同因子)、促进T淋巴细胞增殖和分化的T细胞生长因子、调节T淋巴细胞增殖和活化的T淋巴细胞抑制因子等。
3. 趋化因子趋化因子是一类具有趋化作用的蛋白质,主要包括促进炎性细胞趋化和定向迁移的趋化因子,如白细胞介素-8(IL-8)、单核细胞趋化蛋白-1(MCP-1)等。
它们在炎症和感染时能够吸引炎性细胞向受损组织迁移,参与局部炎症反应的发生和发展。
4. 炎症介质炎症介质是一类在炎症反应中产生并参与调节炎症过程的生物活性分子,包括炎症介质因子、补体蛋白、凝血因子等。
它们能够介导炎症细胞的活化、炎症病理过程的发生,并参与调节局部和全身炎症反应的发展。
二、免疫活性物质的功能免疫活性物质通过与免疫细胞表面受体结合,以及通过细胞因子网络相互作用来调节和协调免疫应答,发挥着重要的免疫调节功能。
1. 促进免疫应答的发生和发展免疫活性物质能够促进免疫细胞的活化、增殖和分化,调节淋巴细胞亚群的平衡,以及增强免疫细胞对抗原的识别和清除能力,从而参与调节和协调免疫应答的发生和发展。
2. 调节免疫平衡免疫活性物质能够调节T淋巴细胞的活化和分化、调节细胞因子的产生和释放、调节炎性细胞的趋化和活化,以及调节免疫细胞功能的平衡,从而维持机体免疫系统的平衡状态。
3. 参与炎症和免疫相关疾病的发生和发展免疫活性物质在炎症、感染、肿瘤和自身免疫等疾病的发生发展中发挥着重要作用,通过参与调节和介导炎症反应、免疫应答和免疫损伤等病理过程,影响疾病的发生和发展。
趋化因子(1)

趋化因子(1)六、趋化因子由组织细胞和微生物产生的趋化剂(chemoattractants)对白细胞的趋化作用(chemotaxis)是炎症发生过程中重要的起始步骤,也是机体防御和清除入侵病原体等异物先天性免疫功能的一个重要方面。
1986年以前,“经典”的(classical)白细胞趋化物质主要有补体片段C5 a、白三烯B4(leukotrinin B4,LTB4)、血小板激活因子(platelet-a ctivating factor,PAF)和fMLP(N-formylmethionyl-leucyl-phenyl-alanine,N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸),这些趋化物质的受体同属于G蛋白偶联受体(Gprotein-coupled receptor)。
(一)趋化因子的种类1.趋化因子的命名1986年以来,陆续发一现了一类主要由免疫细胞产生的、具有趋化白细胞作用的细胞因子(chemoattractant cyt okines或chemotactic cytokines)。
在1992年第3届国际趋化因子研讨会上,绝大多数学者建议把chemoattractant(chemotactic)cytokine简称为chemokines,本书暂译名为趋化因子。
趋化因子又称可诱导的小分子蛋白(small-inducible protein,SIP)、间分泌(intercrine)、细胞因子PE-4超家族(PF-4superfamily of common an-cestral cyto kines)或PF-4样细胞因子(PF-4 like cytokine)等。
2.趋化因子亚族及其成员通过基因克隆和cDNA、氨基酸序列分析,人的趋化因子超家族目前至少发现有19个成员,它们具有以下共同的特点。
(1)来自同一个祖先基因(com-mon ancestral gene)。
(2)成熟分子为分子量8~10kDa的小分子多肽。
第五部分非特异性免疫功能测定一、中性粒细胞趋化功能

正常参考值:外周血NBT阳性百分率7%~15%
4
临床意义: (1) NBT阳性率 :慢性肉芽肿病 (2) 慢性发热原因鉴别:
细菌感染:NBT阳性率 病毒感染:不增高,或增高不明显
5
三、中性粒细胞吞噬功能测定 2 : —— 金葡菌吞噬试验
步骤:无菌采血加金葡菌悬液孵育涂片染色 油镜计数 吞噬细菌的细胞数(X个)
第五部分 非特异性免疫功能测定
一、中性粒细胞趋化功能:
——琼脂糖凝胶板法
原理:中性粒细胞在琼脂糖凝胶内向有趋化因子存 在的方向移动,通过测定其移动距离,判定中性 粒细胞趋化功能。
试剂:趋化因子(酵母多糖活化人血清),白细胞 悬液,培养基(RPMI1640培养基),15.0g/L琼脂 糖。
方法:1.制备琼脂糖凝胶板;2.打孔;3,中央孔加 白细胞悬液,左侧孔加趋化因子,右测孔加阴性 对照;4.孵育;5.固定、染色;6.镜检。
吞噬率 = 计数的细胞总数(200个) X 100
正常参考值:吞噬率为91±5.7%
6
四、巨噬细胞功能: 溶菌酶测定
溶菌酶(lysozyme , LSZ),能与细菌牢固结合, 并使其裂解,主要由单核巨噬细胞释放。
步骤: 1 融化琼脂,和靶细菌混匀,浇注于无菌平皿内 2 打孔,加待检样品和LSZ 3 孵育 4 测量溶菌环直径,制作标准曲线求值 参考值: 血清LSZ:1~2mg/L,尿:1~3mg/L 唾液中:30~70mg/L
原理:中性粒细胞代谢中产生的氢与吞噬的硝基蓝四 氮唑(nitroblue tetrazolium,NBT)反应,生 成蓝黑色甲攒(formazan)颗粒,沉积胞浆,计 数一定数量的中性粒细胞和含甲攒颗粒细胞 (NBT细胞)所占的百分率。
人胸腺活化调节趋化因子(TARCCCL17)ELISA检测试剂盒说明书
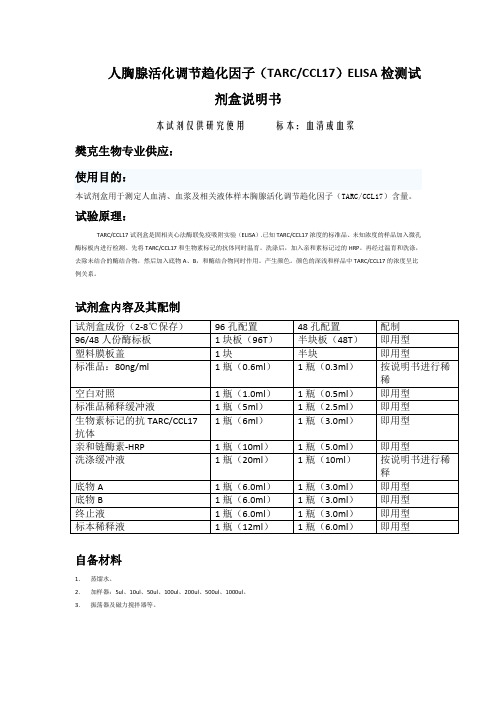
人胸腺活化调节趋化因子(TARC/CCL17)ELISA检测试剂盒说明书本试剂仅供研究使用标本:血清或血浆樊克生物专业供应:使用目的:本试剂盒用于测定人血清、血浆及相关液体样本胸腺活化调节趋化因子(TARC/CCL17)含量。
试验原理:TARC/CCL17试剂盒是固相夹心法酶联免疫吸附实验(ELISA).已知TARC/CCL17浓度的标准品、未知浓度的样品加入微孔酶标板内进行检测。
先将TARC/CCL17和生物素标记的抗体同时温育。
洗涤后,加入亲和素标记过的HRP。
再经过温育和洗涤,去除未结合的酶结合物,然后加入底物A、B,和酶结合物同时作用。
产生颜色。
颜色的深浅和样品中TARC/CCL17的浓度呈比例关系。
试剂盒内容及其配制试剂盒成份(2-8℃保存)96孔配置48孔配置配制96/48人份酶标板1块板(96T)半块板(48T)即用型塑料膜板盖1块半块即用型标准品:80ng/ml 1瓶(0.6ml)1瓶(0.3ml)按说明书进行稀稀空白对照1瓶(1.0ml)1瓶(0.5ml)即用型标准品稀释缓冲液1瓶(5ml)1瓶(2.5ml)即用型1瓶(6ml)1瓶(3.0ml)即用型生物素标记的抗TARC/CCL17抗体亲和链酶素-HRP 1瓶(10ml)1瓶(5.0ml)即用型洗涤缓冲液1瓶(20ml)1瓶(10ml)按说明书进行稀释底物A 1瓶(6.0ml)1瓶(3.0ml)即用型底物B 1瓶(6.0ml)1瓶(3.0ml)即用型终止液1瓶(6.0ml)1瓶(3.0ml)即用型标本稀释液1瓶(12ml)1瓶(6.0ml)即用型自备材料1.蒸馏水。
2.加样器:5ul、10ul、50ul、100ul、200ul、500ul、1000ul。
3.振荡器及磁力搅拌器等。
安全性1.避免直接接触终止液和底物A、B。
一旦接触到这些液体,请尽快用水冲洗。
2.实验中不要吃喝、抽烟或使用化妆品。
3.不要用嘴吸取试剂盒里的任何成份。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
趋化因子生物活性的测定
1.基本原理:
趋化因子的趋化作用没有种属特异性,趋化因子的靶细胞主要有中性粒细胞、单核细胞、淋巴细胞、嗜酸性粒细胞、嗜碱性粒细胞、树突状细胞和成纤维细胞等。
(以IL-8为例)IL-8是典型的CXC家族趋化因子,对嗜中性粒细胞和T淋巴细胞有趋化作用。
由于它的趋化作用没有种属特异性,因此,可以用豚鼠嗜中性粒细胞代替人嗜中性粒细胞对其进行活性检测。
趋化因子诱导的细胞移动方式有两类:
化学增活现象,指增强细胞的随机运动,琼脂糖小滴化学动力实验是检测这种活性的比较简易,快速,重复性好的方法。
趋化性,指诱导细胞向趋化因子化学浓度高的方向移动。
琼脂糖中的趋化实验和微孔小室中的趋化实验则是常用的测定细胞因子趋化活性的方法。
微孔小室中的趋化实验:
微孔小室中的趋化实验是根据靶细胞(单核巨噬细胞,中性粒细胞或淋巴细胞等)能够趋化性主动迁移,穿过一定孔径的滤膜而设计的。
滤膜将小室分隔成上下两部分。
靶细胞在上面,趋化因子在下面,趋化因子通过滤膜形成梯度,细胞则沿着梯度穿过膜孔,黏附在膜的下面,染色并计数滤膜下表面的细胞数即可测出趋化因子的趋化能力。
趋化材料和趋化时间的选择:
趋化滤膜的材料和孔径需根据靶细胞的大小选择;中性粒细胞用3μm孔径的PVPF聚碳酸膜(Polycarbonate membranes), 趋化时间为30分钟;单核细胞用8µm孔径的PVPF 聚碳酸膜,趋化时间为90分钟;粘附力弱的淋巴细胞则用下表面复以明胶或纤粘素的5μm 或8μmPVPF聚碳酸膜,以免淋巴细胞穿过膜后落入下室,趋化时间为180分钟。
趋化因子浓度的确定:
由于趋化因子的特异活性非常高,某些趋化因子在较高浓度时促进细胞趋化的作用反而降低,所以待测样品常需连续稀释(5倍或10倍系列稀释)以获得最适剂量的趋化结果。
每次实验都需设好对照,因为不同来源或不同活力靶细胞的趋化能力差异很大。
趋化因子活性的表达方式有三种,其中最常用的是用趋化指数表示,趋化指数(chemotactic index,CI)是指细胞迁移到待测样品液的数目和迁移到对照液的数目的比值。
2.试剂和材料:
纯化的IL-8 注射器,离心管,移液器,Tip头
0.17% D(+)-糖原/生理盐水解剖器械(剪刀,镊子,止血钳)
17%D(+)-Glycogen 趋化小室,趋化滤膜,细胞刮子
计数板,显微镜,玻璃片红细胞裂解液:
0.17M Tris0.16M NH4CL
将10ml 0.17M Tris加至90ml 0.16M NH4Cl中,调至PH7.2
甲醇,Gimsa染色液Hank,s使用液RPMI1640
豚鼠中性粒细胞
3.实验程序:
一.豚鼠嗜中性粒细胞的制备:
1)取成年豚鼠1只,腹腔注射含0.17%糖原的生理盐水,13小时后,用PBS缓冲液冲洗腹腔,收集腹腔液,1500rpm/min 10min,弃上清。
2)轻轻弹起沉淀,用3-5ml PH 7.2的37o C预温的(Tris-NH4CL)红细胞溶解液,充分吹散,作用3-5分钟,立即加入10-15ml serum-free RPMI1640,吹打均匀,1500rpm/min 5min,弃上清,再加入serum-free RPMI1640,离洗两次。
得到豚鼠嗜中性粒细胞,纯度可达97%以上。
3)将纯化后的嗜中性粒细胞溶在serum-free RPMI 1640中,细胞计数,调整细胞浓度为5×105/ml,备用。
二.样品的准备:
1)将纯化的IL-8用PBS分别稀释为1000ng/ml,100ng/ml,10ng/ml,1ng/ml,0.1ng/ml。
同时用稀释IL-8的PBS作阴性对照。
(样品加入小室前最好放入室温平衡或37o C培养箱中预温,以免加样时出气泡)。
三.准备底层小室,加样:
1)将趋化小室底层板放水平台上,NP标记位于右下方。
2)将稀释好后预温的样品加入孔中,使液面微微隆起,每孔27µl,(国产板每孔25µl),每个样品3个复孔。
为防止样品过度蒸发,整个加样过程应不超过5分钟。
3)将适当孔径的滤膜取出,在滤膜的一角剪去1mm的小角,缺角对着NP标记,分别用镊子夹住滤膜两端,水平下降,中间部位最先接触小室液面,将膜平放在加完样的底层板上。
4)铺上硅胶垫,装上上层板,硅胶垫的缺角及上层板的NP标记位于右下方。
装上螺丝,拧紧装置。
四.加入细胞:
1)将已稀释好的细胞悬液加入上层小孔中,每孔50µl,加样时微量加样器Tip贴着小孔壁,Tip末端恰好位于滤膜稍上方垂直快速加样,避免孔底滞留气泡,(注意这一步加样过程中一定不要有气泡形成)。
2)检查上层液体中是否有气泡,一个比较简便的方法是观察小孔凸的反射光,如果小孔上方有一个异常大的凸液面,通常表明有滞留气泡。
解决的办法是用Tip将孔中的液体吸干净,重新加样。
五.孵育:
将趋化小室放入37o C 5%CO2孵箱中,孵育30分钟。
六.取出滤膜,清洗,染色:
1)取出滤膜,拧下螺帽,将整个小室倒置,托着上层板的四角,将小室慢慢地水平放在纸巾上,卸下下层板。
2)清洗,迁移细胞现位于滤膜朝上的一面,此面称为细胞面,另一面为非细胞面,用镊子夹起滤膜的一角,然后用大塑料夹夹住滤膜这一端距边缘1mm的宽度,拎起滤
膜,迅速用塑料夹夹住滤膜另一端。
在盛有PBS缓冲液的平皿中沾湿非细胞面,注
意细胞面不要接触到PBS。
3)在细胞刮上刮去非细胞面上的细胞,靠近大夹子处的滤膜先接触细胞刮,在与细胞刮成30度角方向轻轻上拉,该过程重复两次。
4)固定,小心将滤膜浸入甲醇中,室温3分钟,将滤膜取出,用塑料夹夹住,自然干燥。
5)染色,将固定后的滤膜在Gimsa染色液中染色30分钟,自来水冲洗,置于玻片上,显微镜下观察。
6)计数,在高倍镜下,每孔随机选取5个视野,累积细胞数,算出三个复孔的平均值。
作为该稀释度的迁移细胞数。
IL-8组趋化的细胞数与缓冲液对照组中趋化细胞数的比值即为趋化指数,趋化指
数大于2有意义。
七.技术要点:
1)分离纯化嗜中性粒细胞时,要仔细认真,保证细胞活力。
2)每次做实验均要设阴性对照,用真核细胞转染上清做趋化实验时,要设空载体转染上清做阴性对照。
3)向趋化小室下孔中加样品时,上样量要适中,使之能够形成稍微隆起的液面,既能防止气泡形成,又可以防止样品发生交叉污染。
4)每个样品要做三个复孔。
5)放膜时,要对准位置,否则,过多调整位置时易发生样品间的交叉污染。
6)洗膜时,注意不要把细胞面与非细胞面弄反。
7)不同趋化因子的趋化谱不同,用不同细胞做趋化反应时,应选用不同孔径的滤膜、不同的细胞浓度和不同的趋化时间。
8)做实验前要把小室处理干净。
