11.阿司匹林片工规程
阿司匹林肠溶片标准操作规程

阿司匹林肠溶片检验标准操作规程1. 目的建立阿司匹林肠溶片检验标准操作规程,规范阿司匹林肠溶片检验操作。
2. 范围适用于阿司匹林肠溶片的检验。
3. 依据《中国药典》2010版二部4. 职责4.1起草:QC 审核:QA 批准人:质量负责人。
4.2QC实施本规程。
4.3 QA监督本规程的实施。
5.内容本品含阿司匹林(C9H8O4)应为标示量的93.0-107.0%。
5.1性状本品为肠溶包衣片,除去包衣后显白色。
5.2鉴别5.2.1仪器及试液一般实验仪器和高效液相色谱仪。
三氯化铁试液:三氯化铁9g,加水使溶解成100ml,即得。
5.2.2分析步骤5.2.2.1取本品的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴,观察现象,溶液显紫堇色。
5.2.2.2在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.3检查5.3.1游离水杨酸5.3.1.1 仪器及试液一般实验仪器、十万分之一天平和高效液相色谱仪。
1%冰醋酸甲醇溶液:取1ml冰醋酸加甲醇稀释至100ml,即得。
5.3.1.2 分析步骤除检测波长改为303nm外,照含量测定项下的色谱条件试验。
精密称取细粉适量(约相当于阿司匹林0.1g),置100ml量瓶中,用1%冰醋酸甲醇溶液振摇溶解,并稀释至刻度,摇匀,用有机相滤膜(孔径:0.45μ)滤过,立即精密量取续滤液10μl,注入液相色谱仪,记录色谱图;另取水杨酸对照品约15mg,精密称定,置50ml量瓶中,用1%冰醋酸甲醇溶液溶解,并稀释至刻度,摇匀,精密量取5ml,置100ml量瓶中,用1%冰醋酸甲醇溶液稀释至刻度,摇匀,同法测定。
按外标法以峰面积计算,含水杨酸不得过阿司匹林标示量的1.5%。
含量% = A样×W对/50×5/100×平均片重A对×W样/100×0.1×100% ………………公式①式中A样----样品的峰面积W对----水杨酸对照品称样量A对----水杨酸对照品的峰面积W样----样品的称样量0.1----标示量5.3.2释放度5.3.2.1试液及仪器一般实验仪器、十万分之一天平、高效液相色谱仪和ZRC-8L智能溶出度测试仪。
阿司匹林片剂的制备资料

【注释】
加淀粉浆制粒时以温浆为宜: 因温度太高不利于药物的稳定,太低不易于分散。
制粒后迅速干燥: 干燥温度不宜过高,以避免加速药物水解。
【质量检查】
硬度 片重差异 溶出度的测定
【质量检查】
重量差异检查
随机抽取药片20片,精密称定总重量,求得平均片重 后,再分别精密称定各片的重量,按下式计算片重差异限
是临床应用最广泛的剂型之一,具有剂量准确、质 量稳定、服用方便、成本低等优点。
片剂的制备方法:湿法制粒压片、干法制粒压片和 直接压片法。
1.主药及辅料的处理
制备片剂用的主药及辅料一般要先经粉碎、过筛、 混合操作。
当主药为难溶性药物时பைடு நூலகம்必须有足够的细度以保证 混合均匀及溶出度符合要求。
2.制湿颗粒
3.干燥、整粒
已制好的湿颗粒应根据主药和辅料的性质于适宜温度(一般 控制在50~60℃)尽快通风干燥。
干燥时应注意颗粒不要铺得太厚,以免干燥时间过长而破坏 药物,且干燥过程中要经常翻动。
干燥后的颗粒往往粘连结块,须再进行过筛整粒,整粒时筛 网孔径应与制粒用筛网孔径相同或略小。
整粒后加入润滑剂、崩解剂等辅料,混匀,计算片重后即可 压片。
粉约5g分散均匀,加热糊化(80~85℃)即得。
【制备】 湿法制粒压片法 湿颗粒的制备:
✓ 取处方量乙酰水杨酸与淀粉混合均匀(等量递加法) ✓ 加适量10%淀粉浆制软材,过16目筛制粒, ✓ 将湿颗粒于40~60℃干燥,过16目筛整粒, ✓ 称干颗粒重量,加入颗粒量的3%滑石粉混匀。
压片:将上述乙酰水杨酸颗粒在压片机下压片。
人有了知识,就会具备各种分析能力, 明辨是非的能力。 所以我们要勤恳读书,广泛阅读, 古人说“书中自有黄金屋。 ”通过阅读科技书籍,我们能丰富知识, 培养逻辑思维能力; 通过阅读文学作品,我们能提高文学鉴赏水平, 培养文学情趣; 通过阅读报刊,我们能增长见识,扩大自己的知识面。 有许多书籍还能培养我们的道德情操, 给我们巨大的精神力量, 鼓舞我们前进。
阿司匹林片药品标准草案及起草说明

阿司匹林片药品标准草案及起草说明目录一、质量标准草案二、质量标准草案起草说明一、阿司匹林片药品标准草案阿司匹林片Asipilin PianAspirin Tablets本品含阿司匹林(C9H8O4)应为标示量的95. 0% ~ 105. 0%。
【性状】本品为白色片。
【鉴别】(1)取本品的细粉适量(约相当于阿司匹林0.lg),加水10ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
⑵ 在含量测定项下记录的色谱图中,供试品溶液的主峰的保留时间与对照品溶液主峰的保留时间一致。
【检查】游离水杨酸取本品细粉适量(约相当于阿司匹林0. 5g),精密称定,置100ml量瓶中,用1%冰醋酸的甲醇溶液振摇使阿司匹林溶解,并稀释至刻度,摇匀,用滤膜滤过,取续滤液作为供试品溶液(临用新制);取水杨酸对照品约15mg,精密称定,置50ml量瓶中,加1%冰醋酸的甲醇溶液溶解并稀释至刻度,摇匀,精密量取5ml,置100ml量瓶中,用1%冰醋酸的甲醇溶液稀释至刻度,摇匀,作为对照品溶液。
照阿司匹林游离水杨酸项下的方法测定,按外标法以峰面积计算,不得过标示量的0.3%。
溶出度取本品,照溶出度测定法(中国药典附录X C第一法),以盐酸溶液(稀盐酸24ml加水至1000ml,即得)为溶出介质,转速为每分钟100转,依法操作,经30分钟时,取溶液10ml滤过,精密量取5ml,置50ml量瓶中,加0.4%氢氧化钠溶液5ml,置水浴中煮沸5min,放冷,加稀硫酸2.5ml,并加水稀释至刻度,摇匀。
照紫外-可见光分光光度法,在303nm的波长处测定吸光度。
按吸收系数为265计算,再乘以1.304后,计算每片溶出量。
限度为标示量的80%,应符合规定。
其他应符合片剂项下有关的各项规定(中国药典附录I B)。
【含量测定】照高效液相色谱法(中国药典附录V D)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以乙腈-四氢呋喃-冰醋酸-水(20 :5 :5 :70)为流动相;检测波长为276nm。
阿司匹林工艺流程

以文字注释;
②例: 阿司匹林工艺流程框图
阿司匹林工艺流程
阿司匹林工艺流程框图
醋酐 水杨酸
蒸汽、水 冷冻盐水
水
酰化
结晶
离心脱水
气流干燥
母液
阿司匹林
包装
过筛
阿司匹林工艺流程
旋风分离
2. 工艺流程示意图
定性图纸,内容比框图详细,不编入设计 文件。 ① 内容: Ⅰ、以几何图形表示设备示意图,设备之间 的竖向关系; Ⅱ、反映全部原料、中间体和三废的名称及 流向; ②例:阿司匹林工艺流程示意图
施工图设计阶段:带控制点工艺流程图 (又称:管道及仪表流程图)
(Piping &Instrumentation Diagram, PID)
阿司匹林工艺流程
1. 工艺流程框图
工艺路线和生产方法确定后,物料衡算前 绘制的一种定性图纸,不编入设计文件中, 主要为物料衡算计算方便。
① 主要内容: Ⅰ、以方框表示单元过程,圆框表示单元反
一、工艺流程的选择
• 一般制药生产过程包括三个阶段:
原料→预处理→化学反应→分离纯化→产品→制剂→药
生产同一种产品多数情况下可采用多种不同 的生产路线,即使采用相同的原料路线,具体 的工艺安排或操作指标也有差别,到底采用哪 种生产路线,必须对路线进行经济评价分析, 找到技术先进,产品成本低,收率高,投资少, 能耗低,同时又完全环保的工艺路线(即可对 各方案进行比较,找到经济安全环保生产工艺 路线)。
阿司匹林工艺流程
• C 设备标注 所有工艺设备都有一设备位号,设备位号 标注在设备轮廓内或设备附近,仅标注位 号,不注设备名称,并在图纸上面或下面 标注出位号及名称.如: R1203A、B 反应器
阿司匹林片的制备

阿司匹林片的制备一实验目的1.通过阿司匹林片的制备,熟悉片剂制备的基本工艺过程。
2.了解压片机的基本结构、使用和保养。
3.了解片剂薄膜衣的目的及优点。
4.熟悉薄膜衣料的组成。
5.掌握薄膜包衣的基本操作。
二实验原理1.颗粒形成的原理粉末间通过黏附和内聚作用而成颗粒。
湿法制粒而成的干燥颗粒由固体桥使粉体连接成颗粒状。
干法制备的颗粒主要是由分子间作用力和静电引力使粉体连接而成。
2.片剂压缩成型的原理借助压力把颗粒或细粉间距离缩小至产生足够的内聚力而紧密结合的过程。
3.滚转包衣的原理使物料作滚转运动,包衣材料一层层均匀黏附于片剂的表面。
三、实验步骤1.阿司匹林片的制备处方:乙酰水杨酸30g 淀粉3g 酒石酸0.2g 滑石粉1.5g 10%淀粉浆适量将0.2g酒石酸溶于蒸馏水供制10%淀粉浆。
取乙酰水杨酸细粉和淀粉混合,加适量淀粉浆制成软材,过16目筛制粒,颗粒于40~60℃干燥后,再经16目筛整粒,将此颗粒和滑石粉混匀后压片。
2.阿司匹林片的包衣(1)配制包衣溶液5%Ⅱ号丙烯酸树脂乙醇溶液 200ml 邻苯二甲酸二乙酯 2ml 蓖麻油6ml 吐温80 2 ml 二甲基硅油 2ml 柠檬黄适量二氧化钛(120目) 6g滑石粉(120目)(2)制法将实验制得的阿司匹林片置包衣锅内,开动电机使包衣锅旋转,通过包衣锅电热丝加热或电热风加热使片子维持温度约40~50℃。
将配置好的包衣溶液用喷枪连续喷雾于转动的片子表面,开始时喷速可快些,使片面尽量形成一层薄膜,避免片面磨损。
随时根据片子表面干湿情况,调控片子温度和喷雾速度,控制包衣溶液的喷雾速度和溶媒挥发速度相平衡,即以片面不太干也不太潮湿为度。
一旦发现片子较湿,即停止喷雾以防粘连,待片子干燥后再继续喷雾,直至包衣达到规定要求为止。
包好的薄膜衣片,置30~40℃干燥过夜。
四、.思考题1.片剂的制备有哪些方法?2.分析处方中各种辅料的作用?3.制备软材时,加入粘合剂的量应如何控制?4.压片时若出现粘冲、片重差异过大、崩解不合要求、顶裂等,其原因可能会是什么?应怎样解决?5.片剂包衣有什么意义?6.为什么有些药物的片剂(或胶囊剂)需测定溶出度?7.求出的溶解速率参数有何意义?。
阿司匹林片(片剂)工艺规程

阿司匹林片(片剂)工艺规程-标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII阿司匹林片工艺规程1.产品名称及剂型1.1产品名称:阿司匹林片1.2产品剂型:片剂2.产品概述2.1产品名称阿司匹林片汉语拼音名:Asipilin Pian英文名: Aspirin Tablets结构式:阿司匹林本品为2-(乙酰氧基)苯甲酸分子式:C9H8O4 分子量: 180.16本品含阿司匹林(C9H8O4)应为标示量的95.0%-105.0%2.2产品特点2.2.1性状本品为白色片2.2.2规格 0.5g。
2.2.3类别解热镇痛非甾体抗炎药,抗血小板聚集药。
2.2.4用法与用量口服。
成人一次1片,若发热或疼痛持续不缓解,可间隔4-一6个小时重复用药一次。
24小时内不超过4片。
儿童用量请咨询医师或药师。
2.2.5贮藏密封,在干燥处保存。
2.2.6有效期 3年。
3.处方和依据3.1批投料处方阿司匹林 60kg淀粉 5kg枸橼酸 0.6kg滑石粉 1.25kg制成 12万片3.2依据执行标准:《中国药典》2010年版二部3.3制法取阿司匹林、淀粉和枸橼酸置高效湿法制粒机中混合均匀,用淀粉浆制粒;干燥;压片;瓶内包装及外包装,制得。
4. 工艺流程图物料工序检验入库中间站注:虚线框内为十万级洁净区。
5.操作过程及工艺条件5.1备料5.1.1领料从库房领取合格原辅料,送入车间称量暂存间。
5.1.2粉碎过筛将以下物料依次粉碎过筛,过筛后再次称量,计算物料平衡,并严5.1.3配料5.2制粒5.2.1配浆称取纯化水1kg置配浆锅中,加入1kg淀粉,搅拌使均匀,在搅拌下冲入10kg 纯化水加热至糊化,配成10%的淀粉浆作为粘合剂。
5.2.2制粒将60kg阿司匹林粉、4kg淀粉和0.6kg枸橼酸粉投入高速制粒机中,干混4分钟后,加入上述淀粉浆混合5分钟,开机制粒。
5.2.3干燥将上述湿颗粒吸入沸腾制粒机中,将设定好工艺参数(进风温度120±5℃,温度75±5℃,进风温度30±5℃)的冷空气通过初效中高效过滤器进适入后部加热室,经过加热器加热至进风所需温度后进入物料室,在引风拉动下物料呈流化态干燥45分钟至水份为 3-4%时,停机出料。
阿司匹林标准操作规程

阿司匹林检验操作规程起草人日期20 年月日审核人日期20 年月日批准人日期20 年月日生效日期颁发部门质量部分发部门1.目的建立阿司匹林检验标准操作规程,规范操作。
2.范围适用于阿司匹林的检查3.依据中国药典2010版二部4.职责4.1 起草:QC ,审核:QA ,批准人:质量负责人4.2 QC实施本规程。
4.3 QA监督本规程的实施。
5.内容5.1 性状本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在氯仿或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠溶液或碳酸钠溶液中溶解,但同时分解。
5.2鉴别:5.2.1鉴别(1)5.2.1.1试液及仪器一般实验仪器三氯化铁试液:取三氯化铁9g,加水使溶解成100ml5.2.1.2 分析步骤取本品约0.1g,加水10ml,直火加热煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
5.2.2鉴别(2)5.2.2.1试液及仪器一般实验仪器和红外分光光度计5.2.2.2分析步骤取供试品约1mg,置玛瑙研钵中,加入干燥的溴化钾或氯化钾细粉约200mg,充分研磨混匀,移置于直径为13mm的压模中,使铺布均匀,压模与真空泵相连,抽气约2分钟后,加压,保持2-5分钟,除去真空,取出制成的供试片,用目视检查后均匀,无明显颗粒。
对空气作为背景扫描完后,立即放入供试片进行扫描,录制光谱图。
本品的红外光吸收图谱应与对照的图谱(光谱集209图)一致。
5.3.检查5.3.1溶液的澄清度5.3.1.1试液及仪器一般实验仪器碳酸钠试液:取一水合碳酸钠12.5g 或无水碳酸钠10.5g,加水使溶解成100ml,即得。
5.3.1.2分析步骤取本品0.50g,用10ml大肚移液管加温热至约45℃的碳酸钠试液10ml溶解后,溶液应澄清。
5.3.2游离水杨酸5.3.2.1试液及仪器一般实验仪器和高相液相色谱仪供试品溶液的制备取本品约100mg,精密称定,置10ml量瓶中,加1%冰醋酸甲醇溶液适量,振摇使溶解,并稀释至刻度,摇匀,即得(临用前新配)。
阿司匹林肠溶片标准操作规程

阿司匹林肠溶片检验标准操作规程1. 目的建立阿司匹林肠溶片检验标准操作规程,规范阿司匹林肠溶片检验操作。
2. 范围适用于阿司匹林肠溶片的检验。
3. 依据《中国药典》2010版二部4. 职责4.1起草:QC 审核:QA 批准人:质量负责人。
4.2QC实施本规程。
4.3 QA监督本规程的实施。
5.内容本品含阿司匹林(C9H8O4)应为标示量的93.0-107.0%。
5.1性状本品为肠溶包衣片,除去包衣后显白色。
5.2鉴别5.2.1仪器及试液一般实验仪器和高效液相色谱仪。
三氯化铁试液:三氯化铁9g,加水使溶解成100ml,即得。
5.2.2分析步骤5.2.2.1取本品的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴,观察现象,溶液显紫堇色。
5.2.2.2在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.3检查5.3.1游离水杨酸5.3.1.1 仪器及试液一般实验仪器、十万分之一天平和高效液相色谱仪。
1%冰醋酸甲醇溶液:取1ml冰醋酸加甲醇稀释至100ml,即得。
5.3.1.2 分析步骤除检测波长改为303nm外,照含量测定项下的色谱条件试验。
精密称取细粉适量(约相当于阿司匹林0.1g),置100ml量瓶中,用1%冰醋酸甲醇溶液振摇溶解,并稀释至刻度,摇匀,用有机相滤膜(孔径:0.45μ)滤过,立即精密量取续滤液10μl,注入液相色谱仪,记录色谱图;另取水杨酸对照品约15mg,精密称定,置50ml量瓶中,用1%冰醋酸甲醇溶液溶解,并稀释至刻度,摇匀,精密量取5ml,置100ml量瓶中,用1%冰醋酸甲醇溶液稀释至刻度,摇匀,同法测定。
按外标法以峰面积计算,含水杨酸不得过阿司匹林标示量的1.5%。
含量% = A样×W对/50×5/100×平均片重A对×W样/100×0.1×100% ………………公式①式中A样----样品的峰面积W对----水杨酸对照品称样量A对----水杨酸对照品的峰面积W样----样品的称样量0.1----标示量5.3.2释放度5.3.2.1试液及仪器一般实验仪器、十万分之一天平、高效液相色谱仪和ZRC-8L智能溶出度测试仪。
阿司匹林生产实习报告

阿司匹林生产实习报告尊敬的XXX公司领导:我是来自XXX大学药学专业的学生,在过去的三个月里,我有幸在贵公司进行了阿司匹林生产实习。
通过这次实习,我对阿司匹林的生产工艺和质量控制等方面有了更深入的了解,并且获得了宝贵的实践经验。
在此,我将就本次实习内容和所得体会进行详细的汇报和总结。
1. 阿司匹林生产工艺流程在实习期间,我首先了解了阿司匹林的生产工艺流程。
阿司匹林是一种非处方药,可以用于缓解疼痛、退烧和抗血栓等症状。
它的生产工艺主要包括以下几个步骤:原料准备、酯化反应、水解反应、中间体分离纯化、合成和成品包装。
每个步骤都需要严格控制各项参数,以确保生产出高质量的阿司匹林产品。
2. 阿司匹林生产中的质量控制在实习期间,我还了解了阿司匹林生产中的质量控制要点。
阿司匹林是一种药品,对质量的要求非常高。
为了确保产品的安全性和有效性,贵公司在生产过程中采取了多种质量控制措施。
比如,对原料进行全面的检验和分析,控制反应过程中的温度和压力,监测反应的进度和产率,通过HPLC等仪器对中间体和成品进行定量分析等。
这些措施都严格按照国家相关标准和公司的质量管理体系执行,以确保产品符合质量要求。
3. 实习工作与收获在阿司匹林生产实习期间,我参与了许多实际工作。
我负责了一些实验室的日常管理和样品的测试分析工作。
通过这些工作,我不仅加深了对阿司匹林生产过程的理解,还学到了实验室仪器的使用技巧和实验操作的规范性要求。
此外,我还参与了一些生产线上的工作,亲身体验了阿司匹林的大规模生产过程。
通过这次实习,我提高了自己的实践能力和团队合作意识。
4. 实习总结与展望通过这次阿司匹林生产实习,我对药品生产工艺和质量控制有了更深入的了解。
我学到了很多课堂上所学知识的应用技巧,并且充分感受到了实践带来的成就感。
这次实习也让我更加明确了我未来的职业目标,我希望能够在制药行业中从事相关的工作,并为人们的健康做出自己的贡献。
感谢贵公司给予我这次实习的机会,感谢实习期间各位导师和同事的耐心指导和帮助。
阿司匹林缓释片的制备

阿司匹林缓释片的研制处方:缓释部分每片用量阿司匹林0.08g阻滞剂1 Q.S.阻滞剂2 Q.S.5%乙基纤维素0.04ml速释部分每片用量阿司匹林0.08g10%淀粉浆0.03ml淀粉0.04ml滑石粉Q.S.制备:1、将阻滞剂1、2于适宜容器中80℃左右焙化完全, 搅匀加入5%乙基纤维素醇液, 混匀, 冷至70℃左右, 缓加入阿司匹林细粉, 不断搅拌至固体析出, 制成软材, 过16目尼龙筛, 自然干燥5小时以上。
再过16目尼龙筛整粒。
2、速释部分:取阿司匹林细粉, 加入10%淀粉浆, 混匀, 制成软材, 过16目尼龙筛制粒, .40℃左右干燥约半小时, 再自然干燥适当时间, 过16目筛整粒。
3、压片:将缓释颗粒和速释颗粒充分混匀, 再加入淀粉, 混匀, 称重, 加入滑石粉(过80目筛)适量混匀, 压片。
二、片剂溶出速率测定1、人工胃液中阿司匹林的溶出速率测定方法1 比较A值的测定取样品20 片,精密称定, 算出平均片重(W), 研细, 再精密称取相当于W量粉末, 置500ml容量瓶中, 加入人工胃液适量, 振摇, .于37℃水浴上使其溶解, 冷至室温, 加人工胃液至刻度, 摇匀, 吸取5ml , 过滤。
精密吸取滤液1ml-10ml置容量瓶中, 加蒸馏水5ml, 用0.5NNaoh液调pH 至9-10 , 置水浴上煮沸5分钟, 取出放冷, 再用5%硝酸铁调Ph3-5, 加5滴5%硝酸铁试液, 再加蒸馏水至刻度, 摇匀。
以未加样品的人工胃液用同样方法得到的溶液作空白, 于721分光光度计540nm处测定吸收度A值。
2、样品溶出速率测定( 精密称取阿司匹林一片放入转篮中取人工胃液释放介质500ml , 加热到37℃装好转篮释放仪, 调节转速为100rpm同时开动电机和秒表, 然后按5、10、15、20、30、40、60、90、120分钟定时取样(取样位置固定在转篮的正中距壁不少于1cm处) 每次取样5ml,同时加入人工胃液5ml.过滤, 精密吸取滤液1ml.加蒸馏水5ml, 以下步骤同上。
阿司匹林标准操作程序
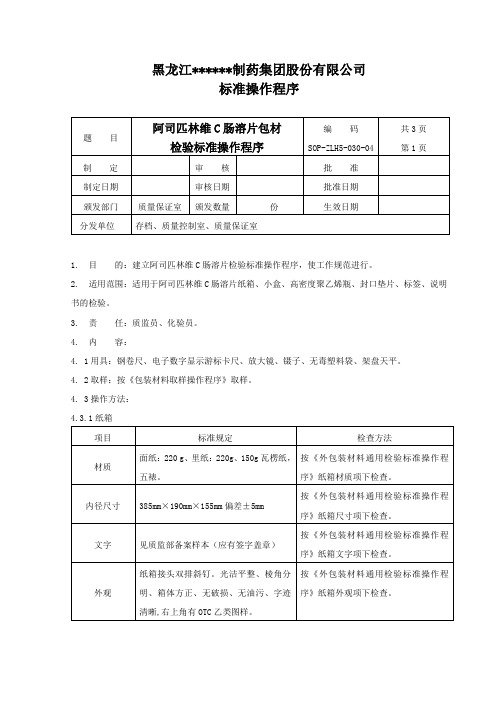
3.责任:质监员、化验员。
4.内容:
4. 1用具:钢卷尺、电子数字显示游标卡尺、放大镜、镊子、无毒塑料袋、架盘天平。
4. 2取样:按《包装材料取样操作程序》取样。
4. 3操作方:
4.3.1纸箱
项目
标准规定
4.3.4封口垫片
项目
标准规定
检查方法
材质
铝塑复合膜/纸板。
按《内包装材料通用检验标准操作程序》
封口垫片材质项下检查。
尺寸
直径:28.6mm,偏差±0.2 mm
厚度:0.64 mm,偏差:±0.02 mm
按《内包装材料通用检验标准操作程序》
封口垫片尺寸项下检查。
外观
表面应平整、洁净,不得有穿孔、异物、皱纹及污渍等;纸板表面应为白色或类白色;铝塑复合膜与纸板不得分离;字迹印刷清晰。
检查方法
材质
面纸:220 g、里纸:220g、150g瓦楞纸,五裱。
按《外包装材料通用检验标准操作程序》纸箱材质项下检查。
内径尺寸
385mm×190mm×155mm偏差±5mm
按《外包装材料通用检验标准操作程序》纸箱尺寸项下检查。
文字
见质监部备案样本(应有签字盖章)
按《外包装材料通用检验标准操作程序》纸箱文字项下检查。
按《内包装材料通用检验标准操作程序》
封口垫片外观项下检查。
微生物限度
细菌数不得过1000个/片,霉菌、酵母
菌数不得过100个/片,大肠埃希菌不得
检出。
按《内包装材料通用检验标准操作程序》
封口垫片微生物限度项下检查。
4.3.5说明书
实验七_阿司匹林片的制备 (1)

实验七片剂第一部分片剂制备与部分质量检查一实验目的1.通过阿司匹林片剂制备,掌握湿法制粒压片的工艺过程.2.了解单冲与11 冲压片机的基本构造,使用和保养.3.考察压片力及崩解剂等对片剂的硬度或崩解的影响.4.掌握片剂的质量检查方法.二实验原理片剂系指将药物与适宜的辅料通过制剂技术制成的片状制剂.片剂是应用最为广泛的药物剂型之一.片剂的制备方法有制颗粒压片(分为湿法制粒和干法制粒),粉末直接压片和结晶直接压片.其中,湿法制粒压片最为常见,除对湿,热不稳定的药物之外, 多数药物采用湿法制粒压片.图7-1 传统湿法制粒压片的生产工艺流程三仪器与试剂1.实验仪器乳钵( 中号), 烧杯(400mi ) , 普通天平,电子天平,电炉, 搪瓷盘(31 × 41cm), 尼龙筛(80目,14 目与16 目), 烘箱, 单冲压片机, 冲头(12mm 和9mm),水分测定仪,片剂四用仪, 溶出仪等.2.实验试剂乙酰水杨酸( 粒状结晶), 非那西丁, 咖啡因, 淀粉, 滑石粉, 硬脂酸镁,乙醇, 蒸馏水等.四实验内容1. 阿司匹林片的制备处方(100 片用量)乙酰水杨酸30.0g淀粉7.0g酒石酸0.2g滑石粉q.s淀粉浆(15% ) q.s100片(2)制法:乙酰水杨酸粉碎过筛:乙酰水杨酸适量置研钵中用力研磨成细粉,过80目筛得乙酰水杨酸细粉.15% 淀粉浆的制备:称取酒石酸0.2g 溶于少量蒸馏水中与15% 淀粉浆混匀.取乙酰水杨酸细粉与3g淀粉混匀, 加适量淀粉浆制成软材, 过16 目筛制粒, 颗粒于40~60 ℃干燥后, 再经14 目筛整粒, 将此颗粒与剩余的4g干淀粉和滑石粉(5%)混匀后压片( 用12mm 孤面冲头) .(3)用途: 解热镇痛药2.复方乙酰水杨酸片( 复方阿司匹林片) 的制备(1)处方每片用量(g) 300 片用量(g )乙酰水杨酸( 粒状结晶) 0.2268 68.04非那西丁( 细粉) 0.1620 48.6咖啡因( 细粉) 0.0350 10.5淀粉0.066 19.8淀粉浆(17% ) 0.088 约26.4滑石粉0.04 12.0(2)制法将非那西丁,咖啡因与7.8g 淀粉混匀, 加淀粉浆制成均匀的软材,通过l4~16 目筛制粒, 湿粒70 ℃干燥, 测定含水量, 干粒过14 自筛整粒.将此颗粒与乙酰水杨酸结晶混合,加剩余的12g 干淀粉和滑石粉后, 充分混匀, 压片( 用12mm 平面冲头) .(3)用途解热镇痛药.用于发热,头痛,神经痛,牙痛等.3.干颗粒含水量测定本实验用红外线水分快速测定仪测定复方乙酰水杨酸片的干颗粒含水量.颗粒含水量对片剂成形及质量均有很大影响,通常所含水分应在1-3%.4.压片按颗粒重量计算片重干颗粒重+ 压片前加入的辅料量片重=应压片数(4)压片圆形片剂直径5-12mm的糖衣片,素片,薄膜包衣片,斜边平片普通冲模.圆形片剂直径小于5或大于12mm的素片,薄膜包衣片,斜边平片特殊冲模.任意圆形片剂直径的单双面刻文字,图形,商标冲模.非圆形的几何形状片剂冲模(如椭圆形,囊形,菱形,心形,三角形,月牙形,动物形状,水果形状等).图7-4片剂冲模图7-5异形片剂冲模图7-5 各种形状片剂6.片剂质量检查本实验检查重量差异,硬度,脆碎度,崩解时限和溶出度.(1)重量差异检查法取药片20片,精密称定总重量,求得平均片重后,再分别精密称定各片的重量.每片重量与平均片重相比较(凡无含量测定的片剂,每片重量应与标示片重比较)超出重量差异限度(见表7-2)的药片不得多于2片,并不得有1片超出限度1倍.结果列于表1.表7-2 重量差异限度平均片重重量差异限度0.30g以下0.30g或0.30g以上±7.5%±5%(2)硬度检查法: 片剂应有适宜的硬度,以免在包装,运输过程中破碎或磨损,因此片剂硬度是反映片剂生产工艺水平,控制片剂质量的一项重要指标.正确反映和测试片剂硬度,对于片剂的生产和科研,保证临床用药的准确性等方面均具有不容忽视的实际指导意义.硬度检查采用破碎强度法,采用片剂智能硬度仪进行测定.方法如下:将药片径向固定在两横杆之间,其中的活动柱杆借助弹簧沿水平方向对片剂径向加压,当片剂破碎时,活动柱杆的弹簧停止加压,仪器刻度盘所指示的压力即为片的硬度.测定3~6片,取平均值.结果列于表2.图7-6 YD-20智能硬度仪YD-20智能硬度仪是用于测量片剂硬度的一种药检仪器,测量范围: 硬度10~200N;分辨率0.1N;精度±1.5%;直径2.0~25.0mm;分辨率0.01mm;精度±0.06mm;度量单位: 硬度N; Kgf(Kilopond,1Kgf=9.81N);Sc(Strocobb1Kgf=1.43Sc);测量方式: 手动单片/自动连续(测量片数最大为100片)(3)脆碎度检查法:取药片,按中国药典2000年版二部附录X G项下检查法,置片剂四用测定仪脆碎度检查槽内检查,记录检查结果.结果列于表3.检查方法及规定如下:片重为0.65g或以下者取若干片,使其总重量约为6.5g;片重大于0.65g者取10片.用吹风机吹去脱落的粉末,精密称重,置圆筒中,转动100次.取出,同法除去粉末,精密称重,减失重量不得过1%,且不得检出断裂,龟裂及粉碎的片. (4)崩解时限检查法:应用片剂崩解测定仪进行测定.测定装置崩解仪的主要结构为一能升降的金属支架和下端镶有金属筛网的吊篮,并附有的塑料挡板.吊篮内置 6 支玻璃管, 玻璃管长77.5mm, 内径21.5mm, 壁厚2.0mm筛孔内径2.0mn, 挡板直径为20.7mm, 厚9.5mm, 相对密度1.18~1.20 .采用吊篮法,方法如下:取药片6片,分别置于吊篮的玻璃管中,每管各加一片,开动仪器使吊篮浸入37±1.0℃的水中,按一定的频率(30-32次/min)和幅度(55±2mm)往复运动.从片剂置于玻璃管开始计时,至片剂破碎并全部固体粒子都通过玻璃管底部的筛网(Φ2mm)为止,该时间即为该片剂的崩解时间,应符合规定崩解时限(一般压制片为15min).结果列于表4.另有规定外, 取药片 6 片, 分置吊篮的 6 支玻璃管中, 启动升降机件, 各片均应l5分钟内全部溶化或崩解成碎粒, 并通过筛网.如残存有小颗粒不能全部通过筛网时, 应另取 6 片复试, 并在每管加入药片后随即加入挡板各一块, 依法检查,应符合规定.糖衣片,浸膏片或薄膜衣片的崩解时限, 按上述方法检查, 应在 1 小时内全部溶散崩解并通过筛网.如有l 片不能全部通过筛网, 应另取 6 片复试, 均应符合规定.图7-7 LB系列崩解时限测定仪LB系列崩解时限测定仪适用于固体制剂的片剂,糖衣片,薄膜衣片,肠溶衣片,浸膏片和胶囊等药物进行崩解时限试验.仪器采用了先进的电路设计,具有控温数字显示和娄显定时控制停机功能,恒温精度高,直观性好,是国内领先水平的药物崩解时限测定的标准.主要技术参数:恒温精度:37±0.5度; 温控显示:31/2位LED发光管数字显示; 时钟定时范围:24小时随意调节;定时精度:1分钟/24小时;吊篮上下移动距离:55±1mm;吊篮上升篮网至液面下面25mm;吊篮上下往复次数:30~32次/分;吊篮下降篮网至杯底25mm;过热保护温度:60±5度五思考(一)预习要求1.熟悉制颗粒压片和粉末直接压片等制备片剂的方法.2.了解制湿颗粒的操作要点和对颗粒的质量要求.3.复习液体药物加入的方法和片重的计算方法.4.了解单冲压片机的主要构造与装拆过程,压力和片重调节器的使用方法以及保养方法.5.参考实验讲义及操作要点写出实验步骤.(二)操作要点和注意事项1.乙酰水杨酸在湿热条件下易水解成水杨酸和醋酸,增加对胃肠粘膜的刺激,严重者可发生溃疡和出血等症状.故在淀粉浆中加入酒石酸,以形成酸性环境,减少乙酰水杨酸的降解.2.粘合剂用量要适当,使软材达到以手握之可成团块,手指轻压时又能散裂而不成粉状为度.再将软材挤压过筛,制成所需大小的颗粒,颗粒应以无长条,块状和过多的细粉为宜.(三)思考题1.制备阿司匹林片,如何避免乙酰水杨酸的水解,其原理是什么2.滑石粉在处方中起什么作用在一些药物片剂中为什么不能代替硬脂酸镁使用3.制备APC 片剂过程中,怎样避免乙酰水杨酸分解4.压制APC 片时,应选用何种润滑剂。
18复方乙酰水杨酸片工艺规程20页word

复方乙酰水杨酸片工艺规程山西信谊制药有限公司质量保证部二OO二年目录1、产品概况2、处方和依据3、生产工艺流程图4、操作过程及工艺条件5、设备一览表及主要设备生产能力6、工艺(环境)卫生、技术安全及劳动保护7、原辅料消耗定额、技经指标及计算方法8、包装要求、说明书、贮藏方法9、原辅料、中间产品及成品的质量标准和技术参数10、劳动组织与岗位定员11、支持文件12、附页复方阿斯匹林片工艺规程1.产品概况:1.1产品名称:复方阿斯匹林片(复方乙酰水杨酸片)汉语拼音:Fufang Asipilin Pian英文名称:Compound Aspirin Tablets1.2规格:0.405g,即每片含乙酰水杨酸0.22g,非那西丁0.15 g,咖啡因0.035 g。
1.3执行标准:卫生部药品标准:WS-65(B)-89剂型:片剂1.4含量限度: 乙酰水杨酸、非那西丁为标示量的95-105%;咖啡因为标示量的90.0-110.0%1.5性状: 本品为白色片1.6有效期:二年2.处方和依据:2.1 处方: 原辅料名称用量原辅料处理乙酰水杨酸 2200.0g 过80目筛非那西丁 1500.0g 过80目筛咖啡因 350.0g 过16目筛淀粉 300.0g 过100目筛15%淀粉浆 1000.0g (淀粉150g)枸椽酸 11.0g 溶于打糊水中搅匀用淀粉(外加) 100.0g 过100目筛滑石粉 50.0g 过40目筛制成 10000片2.2每片成份及含量2.3制粒处方:2.4 依据:卫生部药品标准WSı-65(B)-893.生产工艺流程图:3.1 生产工艺流程总图:(另附)3.2 制粒生产工艺流程图(10万片/锅):4.1.3淀粉浆配成15.0%备用。
4.1.4分锅配料4.2混合制粒(搅拌制粒、沸腾干燥工艺):4.2.1按制粒SOP执行。
4.2.2干制粒:4.2.2.1按工艺处方将22.0kg乙酰水杨酸和1.5kg的淀粉加入槽形混料器中,干混10分钟。
阿司匹林的正确使用方法

阿司匹林的正确使用方法阿司匹林是一种常见的非处方药,被广泛应用于缓解疼痛、退烧和抗血栓等方面。
然而,由于阿司匹林是药物,其正确的使用方法非常重要。
本文将介绍阿司匹林的正确使用方法,以帮助读者正确使用该药物。
一、阿司匹林的适应症阿司匹林主要用于以下几种情况:1.缓解轻度到中度的头痛、牙痛、关节痛、肌肉痛等疼痛症状;2.降低体温,退烧作用;3.预防心脏病发作和中风,抗血栓作用。
二、使用方法1.剂量和频率阿司匹林的剂量和频率取决于疾病的类型和个体的特点。
一般情况下,成人每次服用阿司匹林的剂量为325毫克至1000毫克,每次间隔4至6小时。
然而,如果您有其他药物或慢性疾病,请先咨询医生以确定正确的剂量和频率。
2.服用时间阿司匹林可在餐前或餐后服用,根据个人喜好和身体反应来决定。
餐前服用可能会加快药物的吸收,而餐后服用可能会减少对胃黏膜的刺激。
3.口服方式和注意事项阿司匹林应与温水一同服用,以确保药物迅速进入胃部。
此外,应遵循以下注意事项:- 不要咀嚼、压碎或打碎阿司匹林片剂。
这样做可能会导致药物释放过快,刺激口腔和食道黏膜。
- 阿司匹林有一定的刺激性,请勿在空腹时服用,以减少对胃黏膜的刺激。
- 阿司匹林可引起胃肠道不适,如果您有胃溃疡、胃出血倾向、哮喘或其他过敏反应,请咨询医生。
三、禁忌和注意事项在使用阿司匹林之前,需要了解一些禁忌和注意事项:1.避免使用阿司匹林与其他非甾体消炎药(NSAIDs)同时使用。
这些药物可以增加胃肠道出血的风险。
2.如果您有哮喘,或对阿司匹林或其他非甾体消炎药过敏,应避免使用阿司匹林。
3.对于孕妇和哺乳期妇女,以及12岁以下的儿童,应在医生指导下使用阿司匹林。
四、存储和保质期阿司匹林应存放在阴凉干燥的地方,远离儿童的触及。
过期的药物应丢弃,不应再使用。
结论阿司匹林是一种常见的非处方药,具有止痛、退烧和抗血栓等多种作用。
尽管阿司匹林易于使用,但正确的使用方法至关重要。
本文介绍了阿司匹林的适应症、正确的剂量和频率、服药时间、注意事项以及禁忌症,旨在帮助读者正确使用该药物。
制备阿司匹林颗粒的车间操作流程

制备阿司匹林颗粒的车间操作流程一、原料准备。
咱要制备阿司匹林颗粒呀,那原料可得准备好。
阿司匹林原料得是符合质量标准的,就像挑水果得挑新鲜的一样。
这原料的纯度呀,得够格。
还有那些辅料,像填充剂啦、润滑剂之类的,那也是一个都不能少。
比如说填充剂,就像是盖房子的砖头,给阿司匹林颗粒一个支撑的作用。
这时候就得小心谨慎地把它们从仓库里取出来,按照配方上的量称好。
称的时候可不能马虎,多一点少一点可能都会影响最后的成品呢。
就像做菜放盐,放多放少味道就不一样啦。
二、混合环节。
原料和辅料都准备好了,那就开始混合呗。
把阿司匹林原料和那些辅料一股脑儿地倒进混合设备里。
这就像把不同颜色的彩笔混在一起,要让它们均匀地分布。
这个混合的过程可不能着急,要慢慢地来,让它们充分地接触。
设备得调整到合适的转速,转速太快了,可能会把原料给弄“晕头转向”,不均匀;转速太慢呢,又混合不好。
就像跳舞一样,得找到合适的节奏,这样混合出来的东西才会均匀好看,就像彩虹糖一样,每一颗都有相同的味道。
三、制粒操作。
混合好之后就到制粒这一步啦。
制粒就像是把一团散沙捏成一个个小团子。
通过制粒设备,把混合好的物料变成一粒粒的小颗粒。
这个时候要注意设备的压力和温度哦。
压力太大了,颗粒可能就被压得太紧实了,就像被捏得太紧的小泥球,不好看也不好用;压力太小呢,颗粒又容易散掉。
温度也是个关键因素,不合适的温度可能会让物料的性质发生变化,就像烤蛋糕温度不对就烤糊或者没烤熟一样。
要把这些参数调整到最佳状态,这样制出来的颗粒才会大小均匀,形状好看。
四、干燥处理。
制好的颗粒还是湿湿的呢,这可不行,得把它们弄干。
干燥就像是给小颗粒们晒太阳。
把颗粒放在干燥设备里,设置好合适的温度和时间。
温度不能太高,不然颗粒可能会被烤焦了,那就成废品啦。
时间也不能太长或者太短,太长了可能会让颗粒变得太干,容易碎掉;太短了又干不透。
就像晒衣服,晒太久衣服会变硬,晒太短又还是湿的。
所以要恰到好处,这样干燥后的颗粒就会有合适的含水量,摸起来手感也好,就像刚做好的小点心一样。
11.阿司匹林片工规程

TS-MF-1011-00 阿司匹林片工艺规程信谊制药质量保证部二OO二年目录1、产品概况2、处方和依据3、生产工艺流程图4、操作过程及工艺条件5、设备一览表及主要设备生产能力6、工艺(环境)卫生、技术安全及劳动保护7、原辅料消耗定额、技经指标及计算方法8、包装要求、说明书、贮藏方法9、原辅料、中间产品及成品的质量标准和技术参数10、劳动组织与岗位定员11、支持文件12、附页阿司匹林片工艺规程1.产品概况1.1产品名称:阿司匹林片汉语拼音:Asipilin Pian英文名:Aspirin Tablets1.2规格: 0.3g1.3执行标准:中国药典2000年版二部剂型:片剂1.4含量限度:含阿司匹林应为标示量的95.0~105.0%1.5性状:本品为白色片。
1.6有效期:二年。
2.处方和依据2.1 处方:原辅料名称用量(g)原材料处理阿司匹林 3000.0 过80目筛;淀粉 150.0 过100目筛15%淀粉浆 450.0 (折干淀粉67.5g)枸檬酸 15.0淀粉(外加) 90.0 过100目筛滑石粉 30. 0 过100目筛制成 10000片2.2 每片成份及含量:2.3 依据:《中国药典》2000年版二部2.4制粒处方:3. 生产工艺流程图3.1 生产工艺总流程图(另附)3.2 制粒生产工艺流程图(20万片/锅)(见下页)阿司匹林淀粉枸椽酸 15%淀粉浆4. 操作过程及工艺条件4.1 原辅料处理4.1.1 按前处理的SOP执行。
4.1.2阿司匹林过筛80目、淀粉和滑石粉过100目筛后使用。
4.1.3淀粉浆配成15.0%用。
4.1.4分锅配料。
4.2配料4.2.1按配料SOP操作。
4.2.2按处方正确计算每锅(20万片)用的原辅料量,双人复核,准确配料。
4.2.3配料结束,及时结算用料、余料,如有出入停止下一步操作,尽快查出原因。
4.3粘合剂的配制4.3.1粘合剂配比4.3.2粘合剂配制将过筛后的淀粉全量投入可倾式搅拌配料锅中,加入少许常温纯水搅匀,再加入余下的煮沸纯水,边加入边搅拌,使成15.0%淀粉浆。
阿司匹林片工艺规程

2.2.5贮藏密封,在干燥处保存。
2.2.6有效期3年。
2.3.处方和依据
3.操作过程及工艺条件
3.1备料
3.1.1领料从库房领取合格原辅料,送入车间称量暂存间。
-阿司匹林片工艺规程
———————————————————————————————— 作者:
———————————————————————————————— 日期:
ﻩ
阿司匹林片生产工艺规程
生效日期:2017年10月30日 第1页,共11页
颁发部门:生产部
分发单位:质管部、生产车间
编号:TS-SC-001-00
淀粉
5kg
枸橼酸
0.6kg
滑石粉
1.25kg
3.2制粒
3.2.1配浆称取纯化水1kg置配浆锅中,加入1kg淀粉,搅拌使均匀,在搅拌下冲入10kg纯化水加热至糊化,配成10%的淀粉浆作为粘合剂。
3.2.2制粒将60kg阿司匹林粉、4kg淀粉和0.6kg枸橼酸粉投入高速制粒机中,干混4分钟后,加入上述淀粉浆混合5分钟,开机制粒。
9.4劳动组织定员定岗ﻩ8
10.技术经济指标的计算及原料、辅料、包装材料的消耗定额ﻩ8
10.1单耗ﻩ8
10.2原辅包材的消耗定额及技术经济指标8
10.3偏差处理ﻩ9
11.附录:常用理化常数、换算表ﻩ9
1.产品名称及剂型
1.1产品名称:阿司匹林片
1.2产品剂型:片剂
2.产品概述
2.1产品名称
阿司匹林片
5.4制法取阿司匹林、淀粉和枸橼酸置高效湿法制粒机中混合均匀,用淀粉浆制粒;干燥;压片;瓶内包装及外包装,制得。
阿司匹林肠溶片标准操作规程

阿司匹林肠溶片检验标准操作规程1. 目的建立阿司匹林肠溶片检验标准操作规程,规范阿司匹林肠溶片检验操作。
2. 范围适用于阿司匹林肠溶片的检验。
3. 依据《中国药典》2010版二部4. 职责4.1起草:QC 审核:QA 批准人:质量负责人。
4.2QC实施本规程。
4.3 QA监督本规程的实施。
5.内容本品含阿司匹林(C9H8O4)应为标示量的93.0-107.0%。
5.1性状本品为肠溶包衣片,除去包衣后显白色。
5.2鉴别5.2.1仪器及试液一般实验仪器和高效液相色谱仪。
三氯化铁试液:三氯化铁9g,加水使溶解成100ml,即得。
5.2.2分析步骤5.2.2.1取本品的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴,观察现象,溶液显紫堇色。
5.2.2.2在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.3检查5.3.1游离水杨酸5.3.1.1 仪器及试液一般实验仪器、十万分之一天平和高效液相色谱仪。
1%冰醋酸甲醇溶液:取1ml冰醋酸加甲醇稀释至100ml,即得。
5.3.1.2 分析步骤除检测波长改为303nm外,照含量测定项下的色谱条件试验。
精密称取细粉适量(约相当于阿司匹林0.1g),置100ml量瓶中,用1%冰醋酸甲醇溶液振摇溶解,并稀释至刻度,摇匀,用有机相滤膜(孔径:0.45μ)滤过,立即精密量取续滤液10μl,注入液相色谱仪,记录色谱图;另取水杨酸对照品约15mg,精密称定,置50ml量瓶中,用1%冰醋酸甲醇溶液溶解,并稀释至刻度,摇匀,精密量取5ml,置100ml量瓶中,用1%冰醋酸甲醇溶液稀释至刻度,摇匀,同法测定。
按外标法以峰面积计算,含水杨酸不得过阿司匹林标示量的1.5%。
含量% = A样×W对/50×5/100×平均片重A对×W样/100×0.1×100% ………………公式①式中A样----样品的峰面积W对----水杨酸对照品称样量A对----水杨酸对照品的峰面积W样----样品的称样量0.1----标示量5.3.2释放度5.3.2.1试液及仪器一般实验仪器、十万分之一天平、高效液相色谱仪和ZRC-8L智能溶出度测试仪。
阿司匹林生产时的安全守则

阿司匹林生产时的安全守则阿司匹林是一种广泛使用的非处方药和治疗药物,但在其生产过程中,需要遵守一系列的安全守则以确保生产的质量和安全。
以下是阿司匹林生产时的安全守则,以便确保工人和消费者的安全和利益。
1. 工艺安全:严格遵守阿司匹林生产的工艺流程和标准操作程序,并确保在每个生产步骤中都采取适当的安全措施。
操作人员必须受过严格的培训,并熟悉所有相关的安全操作规程。
2. 人身安全:为了确保工人的人身安全,必须提供适当的个人防护装备,如安全帽、防护眼镜、耳塞、手套和防护服。
工人必须在进入生产区域之前接受必要的安全培训,并遵守相关的安全规定。
3. 设备安全:所有阿司匹林生产过程中使用的设备必须经过定期的检修和维护,以确保其正常运行和安全性能。
同时,必须对设备进行定期的安全检查,并确保其符合相关的安全标准和法规。
4. 化学品安全:阿司匹林生产中使用的化学品,如原料和溶剂,必须储存和处理在符合安全要求的区域。
工人必须接受相关的化学品安全培训,了解化学品的危险性和正确的处理方法,以避免发生意外和污染。
5. 废物处理:所有生产过程中产生的废物必须根据相关的环保法规进行正确处理和处置。
废物应储存在安全的容器中,并交由受训合格的人员进行处理。
同时,必须建立合适的废物处理系统,以确保废物不会对环境和健康造成任何危害。
6. 灭火安全:为了防止火灾发生,并确保在发生火灾时及时进行有效的灭火,必须在生产区域内设置适当的灭火设备,如灭火器、消防栓和自动灭火系统。
工人必须接受适当的灭火培训,并了解如何正确使用和处理灭火设备。
7. 紧急情况应急预案:针对可能发生的紧急情况,如火灾、泄漏或事故,必须建立详细的应急预案。
工人必须接受相关的应急培训,并了解应急预案的内容和执行程序。
同时,必须定期进行演习和测试,以确保应急预案的有效性和可行性。
8. 健康监测:为了确保工人的健康和预防职业病,必须进行定期的健康监测和体检。
工人必须接受相关的健康培训,并了解如何避免潜在的健康风险和职业病。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
TS-MF-1011-00 阿司匹林片工艺规程信谊制药质量保证部二OO二年目录1、产品概况2、处方和依据3、生产工艺流程图4、操作过程及工艺条件5、设备一览表及主要设备生产能力6、工艺(环境)卫生、技术安全及劳动保护7、原辅料消耗定额、技经指标及计算方法8、包装要求、说明书、贮藏方法9、原辅料、中间产品及成品的质量标准和技术参数10、劳动组织与岗位定员11、支持文件12、附页阿司匹林片工艺规程1.产品概况1.1产品名称:阿司匹林片汉语拼音:Asipilin Pian英文名:Aspirin Tablets1.2规格: 0.3g1.3执行标准:中国药典2000年版二部剂型:片剂1.4含量限度:含阿司匹林应为标示量的95.0~105.0%1.5性状:本品为白色片。
1.6有效期:二年。
2.处方和依据2.1 处方:原辅料名称用量(g)原材料处理阿司匹林 3000.0 过80目筛;淀粉 150.0 过100目筛15%淀粉浆 450.0 (折干淀粉67.5g)枸檬酸 15.0淀粉(外加) 90.0 过100目筛滑石粉 30. 0 过100目筛制成 10000片2.2 每片成份及含量:2.3 依据:《中国药典》2000年版二部2.4制粒处方:3. 生产工艺流程图3.1 生产工艺总流程图(另附)3.2 制粒生产工艺流程图(20万片/锅)(见下页)阿司匹林淀粉枸椽酸 15%淀粉浆4. 操作过程及工艺条件4.1 原辅料处理4.1.1 按前处理的SOP执行。
4.1.2阿司匹林过筛80目、淀粉和滑石粉过100目筛后使用。
4.1.3淀粉浆配成15.0%用。
4.1.4分锅配料。
4.2配料4.2.1按配料SOP操作。
4.2.2按处方正确计算每锅(20万片)用的原辅料量,双人复核,准确配料。
4.2.3配料结束,及时结算用料、余料,如有出入停止下一步操作,尽快查出原因。
4.3粘合剂的配制4.3.1粘合剂配比4.3.2粘合剂配制将过筛后的淀粉全量投入可倾式搅拌配料锅中,加入少许常温纯水搅匀,再加入余下的煮沸纯水,边加入边搅拌,使成15.0%淀粉浆。
4.4制粒4.4.1按制粒SOP执行。
4.4.2按工艺处方将称量好的60.0kg阿司匹林、6.15kg淀粉加入高效湿法混合制粒机中,搅拌干混10分钟。
4.4.3加入9.0kg15%淀粉浆(将0.3kg枸椽酸,溶入淀粉浆水中),继续搅拌湿混10分钟。
即做好了软材。
4.4.4起动制粒器,快速搅拌切碎、制粒,功率达12.0-14.0kw,维时约10-15分钟,停机放料。
4.4.5需要的话,将颗粒过16目筛进行整粒。
4.4.6干燥:将湿颗粒放入沸腾干燥器进行干燥。
控制进风温度在70℃±,物料达40℃即可出料。
4.4.7制粒工艺参数及注意事项4.4.7.1 工艺参数4.4.7.2注意事项:干燥时进风温度不可过量,以免因局部过热造成阿司匹林分解,外加辅料不能用硬脂酸镁,因具碱性,促使原料分解。
4.4.8整粒将1.8kg干淀粉和0.6kg滑石粉均匀加入干颗粒中,边加边过快速整粒机,进行整粒。
4.4.9总混将整粒后的干颗粒(第一、二锅)吸入三维运动混合器中,混合30分钟,交中间站QA抽样送验。
4.4.10 颗粒质量标准含量:87.0-91.0%;水份:1.0-2.0%;外观:白色颗粒。
4.5 压片(工艺参数及工艺要求)4.5.1根据颗粒含量和本批颗粒总重量,计算出应压片重和应压万片数。
4.5.2冲头规格:直径为10.0mm平面圆冲。
4.5.3片芯脆碎度:≥2kg。
4.5.4片芯外观:白色。
4.5.5溶出度:30分钟溶出标示量的80.0%。
4.5.6平均片重:0.335g±5%。
4.5.7片重差异:±6%。
4.5.8含量:按阿司匹林计算标示量应在96.0-104.0%之间。
4.5.9片芯要符合外观质量要求标准。
4.5.10开机试压,按规定进行片重、片重差、外观等检查。
4.5.11符合要求后,正式开机生产,每30分检查一次片重及外观。
4.6 包装4.6.1包装材料见包装卡4.6.2按包装SOP执行。
4.6.3按塑瓶包装机操作规程操作。
4.6.4包装规格:100片/瓶(60ml)4.6.5包装质量要求:应符合片剂外观包装等级标准通则(附件)5. 设备一览表及主要设备生产能力:(见下页)6、工艺(环境)卫生、技术安全及劳动保护(各不包衣产品相同,另附)7. 原辅料消耗定额、技经指标及其计算方法: 7.1原辅料消耗定额:7.2技经指标及其计算方法:8. 包装要求、说明书、贮藏方法: 8.1包装要求8.1.1 用塑瓶包装机包装,100片/瓶(60ml )。
8.1.2 片子装瓶、塞纸、旋盖、盖子旋紧、不松动。
8.1.3 标鉴贴正.8.1.4 每10瓶装一中盒,并放入相应数量的说明书。
8.1.5 每20中盒装入一个纸箱,并放入产品合格证。
8.1.6 包装箱口用印有商标和厂名的封箱带封口。
8.2 包装材料规格、尺寸、型号参照包装材料卡。
8.3 说明书等容应与国家药监局统一下发的一致。
8.4 贮藏方法:密封、在干燥处保存。
8.5有效期:二年。
9.原辅料、中间产品及成品的质量标准及技术参数:9.1原辅料的质量标准:(见下页)9.1.1辅料控制项目:9.2中间产品质量标准9.2.1前处理的质量标准9.2.2制粒质量标准9.2.3片芯的质量标准:9.3半成品的检查方法9.3.1前处理9.3.1.1QA在抽取原辅料样品时,目测鉴定原辅料外观质量应符合质量标准:无异物、杂黑色符标。
9.3.1.2平板法:称取样品20g,置白色背景下,铺成10cm2用洁净的玻璃压平,在光亮处观察,如有杂黑点就拣出,然后翻动样品再压平,如此检查三次,累计拣出的杂黑点≤6点。
9.3.1.3检查原辅料的细度,应符合标准。
9.3.2 制粒9.3.2.1目测:粒径分布均匀、松密度、色泽合适(包括杂黑点)9.3.2.2QC分析:含量、水份、理论片重、压片重量、应符合标准。
9.3.3 片芯的检查9.3.3.1随时抽取正常运转中的压片机左右路轨各20片。
9.3.3.2用已核对“O”点的扭力天平称量,检查片芯的重量是否在标准围。
9.3.3.3目测片芯的外观(参照附件,片剂外观包装等级标准通则)。
9.3.3.4控制片芯的硬度≥2kg(以硬度计测试)控制片芯的溶出度: 30分钟溶出80.0%以上。
9.4过程控制(附技术标准、质量标准)QA根据阿司匹林片的技术标准和质量标准及每道工序的SOP进行检查,负责生产全过程的监控。
9.4.1 前处理9.4.1.1检查清包SOP的执行情况。
9.4.1.2检查清场SOP的执行情况。
9.4.1.3检查筛圈,筛目是否符合要求。
9.4.2配料9.4.2.1检查岗位SOP执行情况。
9.4.2.2检查清场SOP执行情况。
9.4.2.3检查计量器具的有效期、校零工作。
9.4.2.4检查原辅料的称量、配比等的准确性。
9.4.2.5检查批生产记录,要求完整、正确、整洁。
9.4.3制粒:9.4.3.1检查岗位SOP执行情况。
9.4.3.2检查清场SOP执行。
9.4.3.3检查工艺装备SOP执行情况。
9.4.3.4检查工艺装备清场SOP执行情况。
9.4.3.5检查批生产记录、复核制度执行情况。
9.4.3.6检查分锅配料、混合、糖浆等的配制情况。
9.4.3.7检查工艺参数是否符合要求。
9.4.3.8检查房间的状态标志是否与批生产记录一致。
9.4.3.9混合后,抽样送检。
9.4.4 压片:9.4.4.1 以QC化验(记录)结果合格为依据,黄牌翻绿牌。
9.4.4.2 检查岗位SOP执行情况。
9.4.4.3 检查清场SOP执行情况。
9.4.4.4 检查工艺装备SOP执行情况。
9.4.4.5 检查工艺装备清场SOP执行情况。
9.4.4.6 检查复核制度、状态标志及批生产记录填写情况。
9.4.4.7 开车检查:9.4.4.7.1 确认片重、硬度、崩解度。
9.4.4.7.2 确认外观标准(附件:片剂外观包装等级标准通则)。
9.4.4.7.3 确认车速。
9.4.4.8 正常生产中的检查:9.4.4.8.1 检查开车时的各项容。
9.4.4.8.2 QA每班循回检查二次(不稳定时不定时抽查)。
9.4.4.9 该批结束前抽样送验。
9.4.5包装(附件:包装材料卡):9.4.5.1以QC化验结果合格为依据,黄牌翻绿牌。
9.4.5.2检查岗位SOP执行情况。
9.4.5.3检查清场SOP执行情况。
9.4.5.4检查工艺装备SOP执行情况。
9.4.5.5检查工艺装备清场SOP执行情况。
9.4.5.6检查复核制度、状态标志、批生产记录填写情况。
9.4.5.7开车检查,确认塑料瓶包装的包装质量(参照附件:片剂外观包装等级标准通则)。
9.4.5.8正常生产检查:9.4.5.8.1检查开车时的各项容。
9.4.5.8.2QA每班循回检查二次(不稳定时不定时抽查)。
9.4.5.9 外包装:9.4.5.9.1 核对品名、规格、批号、有效期,检查装量是否正确,不允许装量不足。
9.4.5.9.2 检查批号、生产日期、有效期代号章的正确与清晰。
9.4.5.9.3 检查外包装的包装质量(参照附件:片剂外观包装等级标准通则)。
9.4.5.9.4 留样。
9.4.6 装箱:9.4.6.1 检查岗位SOP执行情况。
9.4.6.2 检查装箱工作记录。
9.4.6.3 检查外包装是否一致、装量是否正确。
9.4.6.4 检查箱是否有产品合格证、装箱代号。
9.4.6.5 检查印刷容是否正确,要求字迹清楚、整齐、封箱牢固。
9.5片剂质量控制点:9.6成品的质量标准:此略见附件10.劳动组织与岗位定员(见下页)11、支持文件11.1支持文件文件1:岗位SOP文件2:清场SOP文件3:工艺装备操作SOP文件3:工艺装备清场SOP11.2附件附件1:批生产记录附件2:包装材料卡附件3:片剂外观包装等级标准通则附件4:技术标准,质量标准。
附件5:固体制剂QA控制流程图。
附件6:批件。
