电位分析法新PPT课件
合集下载
仪器分析学习课件 第3章 电位分析法

+ 0 .2 8 2 8
+ 0 .2 4 3 8
温度校正,对于SCE,t ℃ 时的电极电位为:
Et= 0.2438- 7.6×10-4(t-25) (V)
银-氯化银电极:
银丝镀上一层AgCl沉淀,浸在一定浓度 的KCl溶液中即构成了银-氯化银电极。
电极反应:AgCl + e- == Ag + Cl-
电极内溶液的Cl-活度 一定,甘汞电极电位固定。
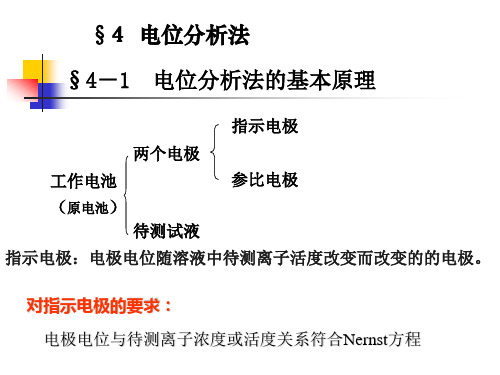
参比电极
表 甘汞电极的电极电位( 25℃)
0 .1 m o l/L 甘 汞 电 极标 准 甘 汞 电 极 (N C E ) 饱 和 甘 汞 电 极 (S C E )
K C l浓 度
0 .1m o l/L
1 .0m o l/L
饱 和 溶 液
电 极 电 位 ( V ) + 0 .3 3 6 5
参比电极
甘汞电极 电极反应:Hg2Cl2 + 2e- = 2Hg + 2 Cl半电池符号:Hg,Hg2Cl2(固)KCl 电极电位(25℃):
EH2gCl/H gEH O22gCl/H g0.025l9ga2(aH (H)g2agC 2(2C l)l) EH2gCl/H gEH O22gCl/H 0 g.05lg 9a(Cl)
第二类电分析化学法是以电物理量的突变作为滴定分 析中终点的指示,所以又称为电容量分析法。属于这类分 析方法的有:电位滴定,电导滴定,电流滴定等。
第三类电分析化学法是将试液中某一个待测组分通过 电极反应转化为固相,然后由工作电极上析出物的质量来 确定该组分的量。称为电重量分析法(电子做“沉淀剂” ),即电解分析法。
1、直接电位法: 零电流条件下测量指示电极相 对于参比电极的电位,据电位 与浓度的关系计算被测物含量。
电位分析法

第四章 电位分析法
对金属电极: Mn+/M = 0Mn+/M +(RT/nF) ㏑aMn+
E = + - - + L RT Mn+/M + ㏑aMn+ - 参比+ L nF 25℃,条件一定时 0.059 K+ ㏒ aMn+ n ●能斯特方程式的本质是:电池的电动势E与被 测物质的活度a的对数成正比。
●MCE-摩尔甘汞电极:以1mol/L的KCl溶液
为盐桥而构成的甘汞电极。其值在25℃, 101325Pa时为0.2828V。
第四章 电位分析法
●甘汞电极的构造
导线 绝缘帽 橡皮帽 内部电极 饱和KCl盐桥
多 孔 物 质
导线 铂丝 汞 甘汞
内部电极
多孔物质 下橡皮帽
第四章 电位分析法
●使用甘汞电极注意的问题
●思考:玻璃电极内参比液的活度与被测溶 液的pH值有无关系,为什么?
第四章 电位分析法
2.玻璃电极的膜电位 ●用水浸泡的玻璃膜表面形成溶涨层/水 和硅胶层/水化玻璃层,简称水化层 H+(l)+Na+Gl-(s) ═ Na+(l)+ HGl(s)
第四章 电位分析法
内部 缓冲液 (H+活 度a2) 内相界 电位内 内水 化层 干玻 璃层 外水 化层 外部 缓冲液
第四章 电位分析法
(2)可逆性要好:要求在整个电动势测
量过程中,电极反应、能量转变是可 逆的。 (3)重现性要好:电极本身的电位值基 本不随被测溶液的温度、浓度及介质
条件的改变而发生变化。
第四章 电位分析法
2.常用的参比电极
(1)标准氢电极 SHE-标准氢电极
第九章--电位分析法(2014)PPT课件

H水 合层 H溶 液
E内K内0.059lgaaHH内 内 参 水比 化溶 层液 E外K外0.059lgaaH H外 外 部 水溶 化液 层
.
13/6193
E内K内0.059lgaaHH内 内 参 水比 化溶 层液 E外K外0.059lgaaH H外 外 部 水溶 化液 层
同一玻璃电极,膜内外表面性质可以看成是相同 的,所以常数K内=K外;
属于非晶体膜电极。 最早使用的离子选择性电极。 核心部分是玻璃膜。
.
6/696
玻璃膜的不同组成可制成对不同 阳离子响应的玻璃电极。
pH玻璃膜电极的敏感膜是在SiO2 基质中加入Na2O、Li2O和CaO烧 结而成的特殊玻璃膜。厚度约为 100 mm左右。
原理:玻璃膜产生的膜电位与待 测溶液的pH值有关。
.
19/6199
3.3 pH值的测定
pHlogH[] pH loagH
饱和甘汞电极为参比电 极 , 玻 璃 电 极 作 为 H+ 活 度 指 示电极,两者插入溶液中组 成电池:
A A g ,0 . g 1 m C L 1 H ol 玻 lC 试 l 璃 K ( 饱 液 C ) 膜 ,H 2 C l 和 2 H g l
.
34/6394
二氧化碳气敏电极
电极浸入待测液,试液中 待测CO2通过透气膜扩散 ,直到透气膜内外CO2的 分压相等。
CO2引起的内电解质溶液 pH变化用pH玻璃电极指 示,由此测定试液中CO2 的浓度。
.
35/6395
气敏电极一览表:
.
36/6396
7. 酶电极
将 生物酶 涂剂:二癸基磷酸钙+苯基磷酸二辛酯溶液。
.
32/6392
精选电位分析法讲义.(ppt)

3.第三类电极
4. 惰性金属电极
金属与两种具有共同阴离子的难溶盐或难离解的配离子
组成的电极,涉及三相平衡,平衡速度慢,故很少应用。
如钙电极:Ag|Ag2C2O4(s),CaC2O4, Ca 2+(ɑ)
氧化还原电极或零类电极
氢电极:2H++2e=H2
Pt|H2(P)|H+(ɑ)
EH+/ H2 =E0H+/ H2+(RT/nF)ln(ɑ(H+)/(PH2/P0))
氧化钙6.4%、氧化硅72.2%。
(1) 玻璃膜结构特点
气敏电极
常用6离.7子常选用择离性子电选极简择介电极
• 酶敏电极结构
实例:氟标准溶液的测定结果
C(mg/L)
lgC
E(mV)
2
0.30103
279
4
0.60206
262
8
0.90309
245
12
1.079181
235
20
1.30103
5. 膜电极
具有敏感膜且能产生膜电位的电极。 用作为指示电极,也叫离子选择电极(ISE)。 (ISE:ion selective electrode )
指示电极:在工作状态下可以反映被测离子浓度,而溶液主体浓度恒定的电极 (工作时仅有微小电流或零电流通过)。
工作电极:工作状态下可以反映离子浓度,但主体溶液浓度发生显著改变的电极。 电解法和库仑法中所用电极(工作时有较大电流通过)。
3. 对于整个膜电极 EISE=E内参比+E膜 =E内参比+K’’±(RT/nF)lnɑ(M±)
=K’±(RT/nF)lnɑ(M±)
6.2 膜电极简介
《分析化学》课件——9 电位分析法

9
甘汞电极(calomel electrode)
Hg,Hg2Cl2(s) KCl
2
1
2
1
3
3
4
4
1
Pt
7
Hg Hg2Cl2
5
5
6
6
8 6
6
(a)
(b)
(c)
(a)232型甘汞电极; (b)内部电极结构; (c)217型甘汞电极。 1.导线; 2.绝缘帽; 3.加液口; 4.内部电极; 5.饱和氯化钾溶液; 6.多孔性物质; 7.可卸盐桥磨口; 8. 可卸盐桥液接溶液
33
标准曲线法
配制一系列含不同浓度的待测离子标液; 插入ISE和参比电极,测定各电池电动势E; 半对数坐标纸上绘制E-lgc曲线; 用同一对电极测定待测溶液的电动势Ex ; 从标准曲线上查出相应的浓度cx。
34
标准曲线法
注意 标液和试液皆要加入同 样量的TISAB。 E-lgc关系曲线需经常重 新测定和绘制。
10
甘汞电极
Hg2Cl2 +2e- → 2Hg + 2Cl-
Hg 2 Cl2 /Hg
θ Hg 2 Cl2 /Hg
- 0.059 lg aCl-
温度一定时,随溶液中的aCl-变化而变化 固定KCl浓度,电极电位为一定值
使用条件:≤80 ℃
使用饱和KCl溶液,称为饱和甘汞电极 (Sturated Calomel Electrode ,SCE) ,25℃时为0.2438V 。
pH标准溶液
配制方法 pH(25℃)
(g·L-1水)
0.05 mol·L-1 KHP
10.12
4.004
0.025 mol·L-1磷酸二氢钾 0.025 mol·L-1磷酸氢二钠
甘汞电极(calomel electrode)
Hg,Hg2Cl2(s) KCl
2
1
2
1
3
3
4
4
1
Pt
7
Hg Hg2Cl2
5
5
6
6
8 6
6
(a)
(b)
(c)
(a)232型甘汞电极; (b)内部电极结构; (c)217型甘汞电极。 1.导线; 2.绝缘帽; 3.加液口; 4.内部电极; 5.饱和氯化钾溶液; 6.多孔性物质; 7.可卸盐桥磨口; 8. 可卸盐桥液接溶液
33
标准曲线法
配制一系列含不同浓度的待测离子标液; 插入ISE和参比电极,测定各电池电动势E; 半对数坐标纸上绘制E-lgc曲线; 用同一对电极测定待测溶液的电动势Ex ; 从标准曲线上查出相应的浓度cx。
34
标准曲线法
注意 标液和试液皆要加入同 样量的TISAB。 E-lgc关系曲线需经常重 新测定和绘制。
10
甘汞电极
Hg2Cl2 +2e- → 2Hg + 2Cl-
Hg 2 Cl2 /Hg
θ Hg 2 Cl2 /Hg
- 0.059 lg aCl-
温度一定时,随溶液中的aCl-变化而变化 固定KCl浓度,电极电位为一定值
使用条件:≤80 ℃
使用饱和KCl溶液,称为饱和甘汞电极 (Sturated Calomel Electrode ,SCE) ,25℃时为0.2438V 。
pH标准溶液
配制方法 pH(25℃)
(g·L-1水)
0.05 mol·L-1 KHP
10.12
4.004
0.025 mol·L-1磷酸二氢钾 0.025 mol·L-1磷酸氢二钠
电化学分析 课件4 电位分析法

lgKij
Ej
Ei S
(等活度法)
以上假定主要离子和干扰离子的相应斜率相同。
h
46
2.混合溶液法
混合溶液法是在被测离子与干扰离子共 存时,固定其中一个的活度,绘制电势响 应曲线(E---lga), 求出选择性系数.它包 括固定干扰法和固定主响应离子法.
h
47
固定干扰法:
先配制一系列含固定活度的干扰离子 j 和不同活度的主响应离子i 的标准混 合溶液,再分别测定电位值,然后将 电位值E 对pαi 作图.
E 玻 - 璃 E Ag/ AE g M C 2 l.3F R 0l3 T a g a H H , ,内 = 试 K 2F .3l0 a g H , 3R 试
原因: aH+,内为常数
用玻璃电极作指示电极,饱和甘汞电极(SCE)为参比电极,组 成电池
Ag|AgCl,0.1mol·L-1HCl|玻璃膜|试液||KCl(饱和),Hg2Cl2|Hg
15
• 由于单个的指示电极电位无法测定,故需 将它与参比电极组成电化学电池,在零电流 条件下测定电池的电动势.
• 电池电动势E电池为:指示电极电位E指与参 比电极电位E参之差,另加不可忽略的液接电 位E接即 E电池=E指-E参+E接
h
16
• E电池=E0
0.05 n
9 lgaMn
–E参+E接
0.059 • E电池=E常数 n lgaMn
h
电极校准曲线
37
响应斜率偏离能斯特理论值 的主要影响因素:
• 共存离子
• 电极膜的制备方法和溶解度
• 试剂空白对待测离子的贡献
h
38
(二)选择性系数
离子选择电极除对某特定离子有 响应外,溶液中共存离子对电极 电位也有贡献.这时,电极电位 可写成
电位分析方法ppt课件

电极电位:
00.0 25 lg a 9 a H H 22 2gg 00.0 25 lg a 9 H2 2g00.05 lg K (9a sC ,p H 2 )lC 2 g 2l
0 ' 0.05 lg a9 Cl
可见,电极电位与Cl-的活度或浓度有关。当Cl-浓度不同时,可得到具有不 同电极电位的参比电极。(注意:饱和甘汞电极指 KCl 浓度为4.6M)
构 成:同甘汞电极,只是将甘汞电极内管中的(Hg,Hg2Cl2+饱和KCl) 换成涂有AgCl的银丝即可。
特 点:
a) 可在高于60oC的温度下使用; b) 较少与其它离子反应(但可与蛋白质作用并导致与待测物界面的堵塞)
三、参比电极使用注意事项 1)电极内部溶液的液面应始终高于试样溶液液面!(防止试样对内部
1 sp,Ag2C2O4 2
c2O42
a Ka C2O42
sp,CaC2O4 Ca2
代入前式得: 00.0 25l9 g K K ss2 ,p ,A p C2C g 2 a 2 O O 4 4 C0.0 25l9 g aC2 2 a
求出待测物质含量的方法。 电位滴定法:向试液中滴加可与被测物发生氧化还原反应的试剂, 以 电极电位的变化来确定滴定终点,根据滴定试剂的消耗量间接计算待 测物含量的方法。
11.1 参比电极及其构成 定义:与被测物质无关、电位已知且稳定,提供测量电位参考的电极,称为参
比电极。前述标准氢电极可用作测量标准电极电位的参比电极。但因该
较常用的金属基电极有:Ag/Ag+、Hg/Hg22+(中性溶液);Cu/Cu2+、 Zn/Zn2+、Cd/Cd2+、Bi/Bi3+、Tl/Tl+、Pb/Pb2+(溶液要作脱气处理)。
仪器分析 电位分析法(新)
玻璃膜内、外表面的性质基本相同
,则
k1=k2
,a
'
H
+
,
试
=
a
'
H
+
,
内
DEM
=
RT F
㏑a H + , 试
a H
+,
内
图4-4
E外
++++-
← H+ ← H+ ← H+ ← H+
由于内参比溶液中的H+活度 a H + , 内 是固定的,则:
DEM
=
K+
2.303RT
F
lg aH +
=
K 2.303RT F
≡SiO-Na+(表面)+ H+(溶液)=≡SiO- H+(表面)+ Na+(溶液)
△EM
外水化层与膜外溶液相界电位
E外 = k 1 +
RT㏑ F
aH+, 试
a
'
H
+
,
试
内水化层与膜内溶液相界电位
E内 = k 2 +
RT㏑ F
aH+, 内
a
'
H
+
,
内
E内
H+ -→+
H+ -→+
H+ -→+
H+ -→+
软质球状玻璃膜:含Na2O、CaO和SiO2, 厚度小于0.1mm 内部溶液:0.1 mol/L 的HCL内参比溶液 内参比电极:Ag-AgCL电极
玻璃电极
电位分析法

扩散电位
相互接触但浓度不同的溶液,如HCl, 由于浓度差异产生扩散,同时由于离子 迁移速率的差异,导致溶液界面的电荷 分布不均,产生电位梯度 出现电位差。 相同电荷的溶液与离子间,存在静电排 斥,使扩散达到平衡,溶液界面有稳定 的界面电位,即液接电位。
液接电位不仅出现在液-液界,也出现在 固-液界面
• The relationship between the ionic concentration (activity) and the electrode potential is given by the Nernst equation:
• 离子选择性电极主要包括(1)敏感膜, 是最关键部分(2)内参溶液,含有与膜 及内参电极响应的离子(3)内参电极, 一般用Ag|AgCl
离 子 选 择 性 电 极 构 造 示 意 图
BASIC THEORY OF ISE MEASUREMENTS.
Ion-Selective Electrodes are part of a group of relatively simple and inexpensive analytical tools which are commonly referred to as Sensors. The pH electrode is the most well known and simplest member of this group and can be used to illustrate the basic principles of ISEs.
0 0.55 0.75
Rel.Vol, %
S2-2 14.41 5.90 34.90 16.60 24.33 3.38 0.47
第三章 电位分析法 第一节PPT课件

电位分析法的特点:
1、选择性好 不用分离,直接测定; 2、灵敏度高 直接电位法检出限
10-5-10-8 mol·L-1; 3、设备简单,操作方便,分析快速; 4、测定范围宽; 5、易于实现分析自动化。
2020/12/5
电位分析法的理论基础
理论基础:能斯特方程(电极电位与溶液中待测离子间 的定量关系)。
外参比电极‖被测溶液( ai未知)∣ 内充溶液( ai一定)∣ 内参比电极(Ag-AgCl)
内1 外参 液比接电极的(电敏位感值膜 固 定m ),且内充溶液中离子2 的活度也一
定,则电池电动势为:
E 1 2 m 液 接 E R nlF T a n i
2020/12/5
1.晶体膜电极(氟电极)
结构:右图 敏感膜:(氟化镧单晶) 掺有EuF2 的LaF3单晶切片; 内参比电极:Ag-AgCl电极(管内)。
第三章 电位分析法
第一节 电位分析法的 基本原理
第二节 离子选择性电 极
第三节 离子选择性电 极的特性
2020/12/5
第一节 电位分析法的基本原理
电位分析是通过在零电流条件下测 定两电极间的电位差(电池电动势)所 进行的分析测定。
ΔE = E+ - E- + E液接电位 装置:参比电极、指示电极、电位
2020/12/5
离子选择性电极的原理与结构
离子选择性电极又称膜电极。 特点:仅对溶液中特定离子有选择性响应。 膜电极的关键:是一个称为选择膜的敏感元件。 敏感元件:单晶、混晶、液膜、功能膜及生物膜等构成。 膜电位:膜内外被测离子活度的不同而产生电位差。 将膜电极和参比电极一起插到被测溶液中,则电池结构为:
当氟电极插入到F-溶液中时,F-在 晶体膜表面进行交换。25℃时:
1、选择性好 不用分离,直接测定; 2、灵敏度高 直接电位法检出限
10-5-10-8 mol·L-1; 3、设备简单,操作方便,分析快速; 4、测定范围宽; 5、易于实现分析自动化。
2020/12/5
电位分析法的理论基础
理论基础:能斯特方程(电极电位与溶液中待测离子间 的定量关系)。
外参比电极‖被测溶液( ai未知)∣ 内充溶液( ai一定)∣ 内参比电极(Ag-AgCl)
内1 外参 液比接电极的(电敏位感值膜 固 定m ),且内充溶液中离子2 的活度也一
定,则电池电动势为:
E 1 2 m 液 接 E R nlF T a n i
2020/12/5
1.晶体膜电极(氟电极)
结构:右图 敏感膜:(氟化镧单晶) 掺有EuF2 的LaF3单晶切片; 内参比电极:Ag-AgCl电极(管内)。
第三章 电位分析法
第一节 电位分析法的 基本原理
第二节 离子选择性电 极
第三节 离子选择性电 极的特性
2020/12/5
第一节 电位分析法的基本原理
电位分析是通过在零电流条件下测 定两电极间的电位差(电池电动势)所 进行的分析测定。
ΔE = E+ - E- + E液接电位 装置:参比电极、指示电极、电位
2020/12/5
离子选择性电极的原理与结构
离子选择性电极又称膜电极。 特点:仅对溶液中特定离子有选择性响应。 膜电极的关键:是一个称为选择膜的敏感元件。 敏感元件:单晶、混晶、液膜、功能膜及生物膜等构成。 膜电位:膜内外被测离子活度的不同而产生电位差。 将膜电极和参比电极一起插到被测溶液中,则电池结构为:
当氟电极插入到F-溶液中时,F-在 晶体膜表面进行交换。25℃时:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1976年IUPAC基于膜的特征,推荐将其分为以下几类: 原电极(primary electrodes) 晶体膜电极(crystalline membrane electrodes) 均相膜电极(homogeneous membrane electrodes) 多相膜电极(heterogeneous membrane electrodes) 非晶体膜电极( non-crystalline membrane electrodes) 固定基体电极(rigid matrix electrodes) 流动载体电极(electrodes with a mobile carrier) 敏化电极(sensitized electrodes) 气敏电极(gas sensing electrodes) 酶电极(enzyme electrodes)
理论基础:能斯特方程(电极电位与溶液中待测离
子间的定量关系)。
对于氧化还原体系: Ox + ne- = Red
EEO Ox/RedR nFTlnaaR Oedx
R = 8.314 J/mol C F = 96500 C/mol
对于金属电极(还原态为金属,活度定为1):
EEM On/MR nF TlnaMn
20世纪70年代,测定卤素的离子选择性电极问世。
现在各种气体电极,酶电极,蛋白质电极有上百种,该 方向成为分析化学家研究的热点问题之一。
离子选择性电极的种类、原理与结构
Type , Principle and Structure of Ion Selective Electrode
离子选择性电极(又称膜电极)
1.676
3.998
9.226
1.680
3.559
4.003
9.182
1.684
3.551
4.010
9.142
1.688
3.547
4.019
9.105
1.694
3.547
4.029
9.072
25℃ Ca(OH)2 13.011 12.820 12.637
12.460
12.292 12.130 11.975
(一)pH的操作定义
Operational definition of the pH Scale
标准缓冲溶液求出电池2pHs 未知溶液:Ex = b - 0.0592pHx pHx = pHs + (Ex- Es)/0.0592 由于用pH玻璃电极测定溶液的pH时是与标准缓冲溶液的 pH相比较确定的,因此为了减少相对误差。所选用的标 准缓冲溶液的pH应与被测溶液的pH相近,并应使标定和 测定时的环境条件相同。
以玻璃电极为正极,饱和甘汞电极为负极,则组成电 池的电动势(pH玻璃电极的电位)与被测试液的pH值符合 下列关系:
E = b + RT/nF lnH+ = b – 0.0592pH b 在一定条件下是个固定值,但是无法通过理论计算求得, 所以应用pH玻璃电极测定某一体系的pH值时,须采用相 对比较的方法。
(二)pH玻璃电极的响应机理
Response mechanism of Glass Electrode
玻璃膜结构
O
O
O Si O Si O
O
O
SiO2石英玻璃结构
O O Si O Na+
O
掺杂碱金属或碱土金 属的石英玻璃结构
(二)pH玻璃电极的响应机理
Response mechanism of Glass Electrode
(一)pH的操作定义
Operational definition of the pH Scale
温度 t℃ 10 15 20
25
30
35 40
0.05M 草酸 25℃饱和酒 0.05M 邻 苯 0.01mol/L
三氢钾
石酸氢钾 二甲酸氢钾 硼 砂
1.671
3.996
9.330
1.673
3.996
9.276
直接电位法:离子选择性电极法,利用膜电极把被测
离子的活度表现为电极电位。
直接电位法:测定的只是某种型体离子的平衡浓度。 电位滴定法:利用电极电位的突变来指示滴定终点的
滴定分析法,是电位测量方法在容量分析中的应用。
电位滴定法:测定的是某种参与滴定反应物质总浓度。
一、概 述
Generalization
四、玻璃电极
Structure of Glass electrode
•玻璃电极的结构示意图
(一)pH的操作定义
Operational definition of the pH Scale
Hg | Hg2Cl2(s) KCl(饱和) ||待测液 | 玻璃膜 | HCl(0.1mol/L) , AgCl(S) | Ag
指示电极:在电位分析中,将电极电位随被测电活性物
质活度变化的电极称为指示电极。
参比电极:与被测物质无关的、电位比较稳定的、提供
测量电位参考的电极称为参比电极。 去极化电极:电化学测量过程中,电极电位始终保持不变, 这样的去极化电极。 极化电极:电极电位随着外加电压而改变的电极。
二、基本原理
(Principle of Potentiometry Analysis)
电位分析法
(Potentiometry)
一、概 述
Generalization
定义:电位分析法是利用电极电位与电解质溶 液中某种组分浓度的对应关系,而实现定量测 定的电化学分析方法。 实质:在零电流条件下,测定相应原电池的电 动势。 分类:(1)直接电位法;(2)电位滴定法
一、概 述
Generalization
三、离子选择性电极
(Ion Selective Electrode, ISE)
定义: 是一类电化学传感器,它的电极电位与溶液中
相应离子的活度的对数值呈线性关系,作为一种指示 电极,它指示的电极电位与溶液中响应离子的活度的 关系符合能斯特方程。
特点:由于电极表面敏感膜对所要测定的物质具有
选择性响应而产生的。电极电位不是由于电子的交换 所形成的,不同于包含氧化还原反应的体系。
三、离子选择性电极
(Ion Selective Electrode, ISE)
1906年,M Cremer 发现玻璃膜至于两种组成不同的水 溶液之间,会产生电位差,且差值受溶液中氢离子浓度 的影响。
1929年, D A McInnes等人制作出具有实用价值的pH 玻璃电极。
20世纪50年代,碱金属离子的玻璃电极问世。
理论基础:能斯特方程(电极电位与溶液中待测离
子间的定量关系)。
对于氧化还原体系: Ox + ne- = Red
EEO Ox/RedR nFTlnaaR Oedx
R = 8.314 J/mol C F = 96500 C/mol
对于金属电极(还原态为金属,活度定为1):
EEM On/MR nF TlnaMn
20世纪70年代,测定卤素的离子选择性电极问世。
现在各种气体电极,酶电极,蛋白质电极有上百种,该 方向成为分析化学家研究的热点问题之一。
离子选择性电极的种类、原理与结构
Type , Principle and Structure of Ion Selective Electrode
离子选择性电极(又称膜电极)
1.676
3.998
9.226
1.680
3.559
4.003
9.182
1.684
3.551
4.010
9.142
1.688
3.547
4.019
9.105
1.694
3.547
4.029
9.072
25℃ Ca(OH)2 13.011 12.820 12.637
12.460
12.292 12.130 11.975
(一)pH的操作定义
Operational definition of the pH Scale
标准缓冲溶液求出电池2pHs 未知溶液:Ex = b - 0.0592pHx pHx = pHs + (Ex- Es)/0.0592 由于用pH玻璃电极测定溶液的pH时是与标准缓冲溶液的 pH相比较确定的,因此为了减少相对误差。所选用的标 准缓冲溶液的pH应与被测溶液的pH相近,并应使标定和 测定时的环境条件相同。
以玻璃电极为正极,饱和甘汞电极为负极,则组成电 池的电动势(pH玻璃电极的电位)与被测试液的pH值符合 下列关系:
E = b + RT/nF lnH+ = b – 0.0592pH b 在一定条件下是个固定值,但是无法通过理论计算求得, 所以应用pH玻璃电极测定某一体系的pH值时,须采用相 对比较的方法。
(二)pH玻璃电极的响应机理
Response mechanism of Glass Electrode
玻璃膜结构
O
O
O Si O Si O
O
O
SiO2石英玻璃结构
O O Si O Na+
O
掺杂碱金属或碱土金 属的石英玻璃结构
(二)pH玻璃电极的响应机理
Response mechanism of Glass Electrode
(一)pH的操作定义
Operational definition of the pH Scale
温度 t℃ 10 15 20
25
30
35 40
0.05M 草酸 25℃饱和酒 0.05M 邻 苯 0.01mol/L
三氢钾
石酸氢钾 二甲酸氢钾 硼 砂
1.671
3.996
9.330
1.673
3.996
9.276
直接电位法:离子选择性电极法,利用膜电极把被测
离子的活度表现为电极电位。
直接电位法:测定的只是某种型体离子的平衡浓度。 电位滴定法:利用电极电位的突变来指示滴定终点的
滴定分析法,是电位测量方法在容量分析中的应用。
电位滴定法:测定的是某种参与滴定反应物质总浓度。
一、概 述
Generalization
四、玻璃电极
Structure of Glass electrode
•玻璃电极的结构示意图
(一)pH的操作定义
Operational definition of the pH Scale
Hg | Hg2Cl2(s) KCl(饱和) ||待测液 | 玻璃膜 | HCl(0.1mol/L) , AgCl(S) | Ag
指示电极:在电位分析中,将电极电位随被测电活性物
质活度变化的电极称为指示电极。
参比电极:与被测物质无关的、电位比较稳定的、提供
测量电位参考的电极称为参比电极。 去极化电极:电化学测量过程中,电极电位始终保持不变, 这样的去极化电极。 极化电极:电极电位随着外加电压而改变的电极。
二、基本原理
(Principle of Potentiometry Analysis)
电位分析法
(Potentiometry)
一、概 述
Generalization
定义:电位分析法是利用电极电位与电解质溶 液中某种组分浓度的对应关系,而实现定量测 定的电化学分析方法。 实质:在零电流条件下,测定相应原电池的电 动势。 分类:(1)直接电位法;(2)电位滴定法
一、概 述
Generalization
三、离子选择性电极
(Ion Selective Electrode, ISE)
定义: 是一类电化学传感器,它的电极电位与溶液中
相应离子的活度的对数值呈线性关系,作为一种指示 电极,它指示的电极电位与溶液中响应离子的活度的 关系符合能斯特方程。
特点:由于电极表面敏感膜对所要测定的物质具有
选择性响应而产生的。电极电位不是由于电子的交换 所形成的,不同于包含氧化还原反应的体系。
三、离子选择性电极
(Ion Selective Electrode, ISE)
1906年,M Cremer 发现玻璃膜至于两种组成不同的水 溶液之间,会产生电位差,且差值受溶液中氢离子浓度 的影响。
1929年, D A McInnes等人制作出具有实用价值的pH 玻璃电极。
20世纪50年代,碱金属离子的玻璃电极问世。
