氮的氧化物
氮的氧化物

Prize citation: "for their discoveries concerning nitric oxide as a signalling molecule in the cardiovascular system"
授奖致辞: 表彰他们 关于一氧化氮在心血管组织中作为信号分子的发现" 表彰他们)关于一氧化氮在心血管组织中作为信号分子的发现 授奖致辞 “(表彰他们 关于一氧化氮在心血管组织中作为信号分子的发现
物理性质
二氧化硫
无色、有刺激性气味、有毒、 无色、有刺激性气味、有毒、易 液化、比空气重、 液化、比空气重、易溶于水 1、与水反应生成酸 、 SO2 + H2O H2SO3 2、与碱反应生成盐和水 、 SO2 + 2 NaOH=Na2SO3 + H2O
化学性质
3、既有氧化性,又有还原性 、既有氧化性,
•随着手机越来越普及,一些高分贝的个性化手机铃声逐渐成为人 随着手机越来越普及, 随着手机越来越普及 们的新宠,然而专家指出,如果手机铃声不加以控制, 们的新宠,然而专家指出,如果手机铃声不加以控制,就很可能成 为新的污染源。 为新的污染源。 •手机的铃声音量均可达80分贝以上,而经积分级器测试,距1米处, 手机的铃声音量均可达80分贝以上,而经积分级器测试, 手机的铃声音量均可达80分贝以上 米处, 手机铃声平均为76分贝, 76分贝 米仍有60分贝, 60分贝 手机铃声平均为76分贝,距5米仍有60分贝,如果把手机放在耳边 时可达129分贝;如果2部手机同时响起距1米可达80分贝, 129分贝 80分贝 时可达129分贝;如果2部手机同时响起距1米可达80分贝,由此可 手机铃声的确很“ 见,手机铃声的确很“吵” 据专家介绍,噪声一般来说,对于睡眠的理想值是30分贝, 据专家介绍,噪声一般来说,对于睡眠的理想值是30分贝,而脑 30分贝 力劳动是40分贝,体力劳动理想值是70分贝,一个声音超过80 40分贝 70分贝 80、 力劳动是40分贝,体力劳动理想值是70分贝,一个声音超过80、90 分贝的时候就会对人的生活造成一定的影响, 分贝的时候就会对人的生活造成一定的影响,比如降低人的工作效 增加人的烦恼度, 它还容易引发工作场所的事故。 率,增加人的烦恼度, 它还容易引发工作场所的事故。 •专家说,手机铃声在公共场所频繁响动,对人们的工作、休息和 专家说,手机铃声在公共场所频繁响动,对人们的工作、 专家说 交流都会造成一定干扰。为了防止手机铃声成为新的污染源, 交流都会造成一定干扰。为了防止手机铃声成为新的污染源,专家 提醒人们不要把手机铃声音量调得过大, 提醒人们不要把手机铃声音量调得过大,即使在公共场所使用手机 时,也要注意不要影响他人
氮氧化物相关知识

氮氧化物(nitrogen o*ides)包括多种化合物,如一氧化二氮(N2O)、一氧化氮(NO)、二氧化氮(NO2)、三氧化二氮(N2O3)、四氧化二氮(N2O4)和五氧化二氮(N2O5)等。
除二氧化氮以外,其他氮氧化物均极不稳定,遇光、湿或热变成二氧化氮及一氧化氮,一氧化氮又变为二氧化氮。
造成大气污染的氮氧化物主要是一氧化氮(NO)和二氧化氮(NO2),因此,环境学中的氮氧化物一般就指这两者的总称。
氮氧化物具有不同程度的危害。
氮氧化物与空气中的水结合最终会转化成硝酸和硝酸盐,硝酸是酸雨的成因之一;它与其他污染物在一定条件下能产生光化学烟雾污染。
大气中氮氧化物浓度增长,造成了氮沉降量的增加。
根据酸雨监测数据,降水中NO3-与SO42-当量浓度比值1999年以来呈现上升趋势。
NO3-与SO42-当量浓度比值增大,说明氮氧化物对酸性降水的奉献在增大,我国酸雨正在由硫酸型酸雨向硫酸/硝酸复合型过渡。
同时,氮沉降产生更多的硝酸根和氮的氧化物,使土壤酸化,使水酸化和富营养化。
氮氧化物的持续增加,还会加速细微颗粒物和二次气溶胶的形成。
氮氧化物是光化学污染的前体物之一。
在阳光照射下,NO2和VOCs(挥发性有机化合物)经由一连串的光化学反响生成O3和甲醛、乙醛等多种二次污染物,导致大气氧化性增强,并形成光化学烟雾,对大气环境和人体安康造成危害。
在我国一些人口密集、经济兴旺和机动车保有量大的城市,已经发现发生光化学污染的趋势,尤其是在、、**等特大城市已经监测到了光化学污染的发生。
因此,减少大气中的氮氧化物对于保护生态、保持人们身体安康起到重要作用。
而减排氮氧化物就是保护环境、改善民生的重大举措。
二氧化硫的硫主要来自燃料,而氮氧化物的氮来源是燃料和空气,既与燃烧温度有关,也与混合气体在高温区停留的时间有关。
烟气中氮氧化物浓度的变化范围较大,准确测算不容易。
随着燃料使用量和机动车保有量的增加,氮氧化物也会随之增加。
20161220氮的氧化物(高一化学)

二、二氧化氮和一氧化氮
NO2
1、NO2和NO的物理性质
NO NO2
无色气体 红棕色气体 色、态 味 刺激性气味 比空气重 比空气略重 密度 水中溶解性 不溶于水 易溶于水(与水反应) 熔沸点很低 易液化 熔沸点
分析:NO和NO2的化学性质
从物质的 NO 和NO2均是非金属氧化物,但 分类来看: 是它们二者均不是酸性氧化物。 从化合价的 角度来看:
讨论:当我们把NO和O2同时通入水中时,会 发生什么反应呢?
2NO + O2 = 2NO2
①
3NO2 + H2O = 2HNO3 + NO ①×3 + ②×2得
4NO + 3O2 + 2H2O = 4HNO3
②
例2:在标准状况下,将O2与NO按3∶4的体 积比充满一个干燥烧瓶,将烧瓶倒置于水中, 瓶内液面逐渐上升后,最后烧瓶内溶液的物 质的量浓度为 B A.0.045mol· L-1 B.0.036mol· L-1 C.0.026mol· L-1 D.0.030mol· L-1
(3)NO2可以制N2O4,N2O4可以 用作火箭发射的氧化剂
注意:当然NO、 NO2有毒性,对自然环境有危害。
小结:
主要学习了NO、NO2的性质。我们要在性质、 用途、收集方法之间建立联系。 对于氮的氧化物化学性质的学习,我们关注了 物质的类别,考虑了元素的化合价的变化。
在实验方面,我们要关注NO2与水反应的实验, SO2与水反应的实验,它们之间有何联系。
(2) 往试管中 (3) 继续通
入氧气
无色气体变成红棕 2NO+O2=2NO2 色;水位继续上升, 红棕色又消失
水逐渐几乎 充满试管
氮氧化物的性质

氮氧化物的性质氮氧化物,是指由氮和氧元素组成的化合物。
常见的氮氧化物有氮氧化物(NO)、二氧化氮(NO2)和氮氧化氮(N2O)等。
氮氧化物在环境中存在并且对人类健康和大气质量产生严重影响。
首先,氮氧化物是大气中的主要污染物之一。
来源于工业排放、交通尾气和农业活动等。
这些氮氧化物进入大气后,会与其他大气成分发生复杂的化学反应,形成二次污染物,如臭氧和细颗粒物。
这些污染物对人体健康造成很大威胁,特别是对儿童、老年人和患有呼吸系统疾病的人群。
此外,氮氧化物还会造成酸雨的生成,对土壤、水体等生态系统产生负面影响。
其次,氮氧化物对大气环境也产生很大的影响。
二氧化氮是一种有害的大气污染物,容易被光解为一氧化氮和氧气。
一氧化氮参与了大气中的光化学反应,会进一步参与臭氧的形成,造成大气中臭氧层的破坏。
臭氧层的破坏会导致紫外线辐射的增加,对人类的健康和生态系统的平衡产生不利影响。
因此,控制氮氧化物的排放是保护大气环境和臭氧层的重要举措之一。
此外,氮氧化物还会对植物和农作物产生负面影响。
氮氧化物作为氮元素的一种形式,能够为植物提供养分,但过量的氮氧化物会对植物的生长和发育产生抑制作用。
一方面,氮氧化物会破坏植物叶片的叶绿素,导致光合作用受到抑制;另一方面,氮氧化物会与植物体内的其他养分发生反应,影响植物的营养吸收。
这些都会导致农作物的产量下降和质量降低,给农业生产带来一定的损失。
然而,虽然氮氧化物对环境和健康造成不良影响,我们仍然可以采取一些措施来减少氮氧化物的排放。
首先,政府应加强对工业企业和交通尾气的排放标准和监管。
通过强制执行严格的排放标准,可以减少大气中氮氧化物的排放量。
其次,需要加强环保意识的宣传和教育,提高公众对氮氧化物污染的认识,倡导低碳、环保的生活方式。
此外,农业生产中可以采用科学合理的施肥措施,减少氮肥的使用量,从而减少氮氧化物的排放。
总之,氮氧化物作为一种常见的大气污染物,对环境和人类健康产生重要影响。
氮的氧化物

【牛刀小试】:
例1 、把盛有48mlNO和NO2的混合气体的 容器倒立于水槽中(保持同温同压),液面 稳定后,容器内气体的体积为24ml, (1).原混合气体中NO和NO2的体积各是多少?
NO2:36ml NO:12ml (2).若在剩余的24ml气体中通入6mlO2,液 面稳定后,容器内剩余的气体是?体积又为 多少毫升?
3.消除氮的氧化物危害的方法
1.碱吸法 NO2 + NO + 2NaOH == 2NaNO2 + H2O
2NO2 + 2NaOH == NaNO3 + NaNO2 + H2O
2.还原法
NOx +
NH3
N2 + H 2 O
返回
二、有关NO、NO2的计算
2NO + O2 == 2NO2 3NO2 + H2O == 2HNO3 + NO (1)×3 + (2)×2 得: (1) (2)
余下气体为:NO
NO:16ml
(3).若在剩余的24ml气体中通入24mlO2,液 面稳定后,容器内剩余的气体是?体积又为 多少毫升?
余下气体为:O2
6ml
(4).若在剩余的24ml气体中通入多少mlO2,充 分反应后,容器内剩余4ml气体。
若余下气体为O2
若余下气体为NO
22ml
15ml
例2、足量的Cu与一定量的浓HNO3 充分反应后,得到Cu(NO3)2和NO、 NO2、N2O4的混合气体,这些气体 与1.68L O2 (标准状况)混合后通入水 中,得到的气体完全被水吸收生成 HNO3,若向所得到的Cu(NO3)2溶液 中加入5mol.L-1 NaOH溶液至Cu2+恰 好完全反应则消耗的NaOH溶液的体 积是?
氮的氧化物

二氧化氮和氧气混合气体: 二氧化氮和氧气的混合气体溶于水时涉及什么反应
根据特殊现象找突破口 1) 有颜色的气体, 2) 有漂白作用的气体 3) 在空气中迅速有无色变成红棕色的气体 4) 能与盐酸作用产生无色无味的气体, 且将气体通入澄清石灰水中能产生白色 沉淀的物质必然含碳酸根离子和 碳酸氢根离子
从得失氧 的角度
得到氧的物质发生氧化反应, 失去氧的物质发生还原反应, 过程中有 得失氧的反应叫做氧化还原反应。 从电子转移的角度 物质失去电子的反应较氧化反应, 物质得到电子的反应叫还原反应,
反应中凡有电子转移的反应叫做氧化还原反应。
氮气 物理性质: 无色 无味 难溶于水, 密度与空气相近, 越占空气体积的4/5
化学性质: 通常情况下, 比较稳定 与其他物质不反应 放电或高温下 能与氧气反应生成一氧化氮
化学性质: 常温下, 一氧化氮不稳定, 溶于与氧气化合 2) 二氧化氮溶于水时能与水发生反应: 化学方式是为:
氮的氧化物溶于水的三种类型 1) 二氧化氮气体 , 二氧化氮气体溶于水时 涉及的反应时
氮的氧化物

对环境的污染:
危害 光化学烟雾 酸雨
污染源
石油产品和煤燃烧的产物 汽车尾气 制硝酸的工厂
处理:NO+NO2+2NaOH == 2NaNO2+H2O 2NO2+2NaOH == NaNO3+NaNO2+H2O
NO 色态
NO2
毒性 与水反应
与O2反 应
无色气体 有毒
红棕色气体 有毒
3NO2 + H2O = 2HNO3 + NO
[例3] 40mLNO和NO2的混合气体与20mLO2同时通 入水中(混合气体事先装入体积为60mL的试管中) 充分反应后,试管里还剩5mL气体(气体体积均已 换算成标准状况下的体积),求原混合气的组成。 解:设NO的体积为x ,NO2的体积为y ⑴ 若O2剩余 4NO + 3O2 + 2H2O = 4HNO3
4NO + 3O2 + 2H2O = 4HNO3
V(NO):V(O2) = 4:3 时,完全反应,无气体剩余 V(NO):V(O2) < 4:3 时,O2过量,剩余气体为O2
V(NO):V(O2) > 4:3 时,NO过量,剩余气体为NO
NO2 和 O2 混和气体溶于水的反应 3NO2 + H2O = 2HNO3 + NO 2NO + O2 = 2NO2 ② ① ×2 + ② 4NO2 + O2 + 2H2O = 4HNO3
•答案:(1)A是NO;B是O2。(2)20mL。(3)20<V<60。
容积为50mL的量筒内充满NO2和 O2的混合气体,倒置量筒在盛满 水的水槽里,足够时间后,量筒 里剩余气体体积为5mL。则混合 气体中NO2和O2体积比可能 是 。
化学——氮的氧化物

考点1 氮的氧化物1.氮元素有+1、+2、+3、+4、+5等五种正价态,五种正价对应六种氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5。
其中N2O3和N2O5分别是HNO2和HNO3的酸酐。
NO是一种无色还原性较强的气体,易被O2氧化生成NO2,NO2是一种红棕色的易溶于水且与水反应的气体,氧化性强,能氧化SO2,能使湿润的KI-淀粉试纸变蓝。
2.NO、NO2都是大气污染物,空气中NO、NO2主要来自石油产品和煤燃烧、汽车尾气以及制硝酸工厂的废气。
其中空气中的NO2是造成光化学烟雾的主要因素。
3.NO、NO2的制法(1)NO的实验室制法①原理:3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O②装置:铁架台、铁夹、铁圈、烧瓶、分液漏斗、胶塞、导管、酒精灯等③收集:排水集气法④检验:无色气体和空气接触立即变红棕色(2)NO2的实验室制法①原理:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O②装置:锥形瓶(或烧瓶)、分液漏斗、带导管胶塞221.氨的物理性质氨气为无色、有刺激性气味的气体,比空气轻,易液化,极易溶于水,氨水的密度小于水的密度,氨水的浓度越大,密度越小。
2.氨的化学性质;(1)与水反应,溶液呈碱性:NH3+H2O NH3·H2O NH4++OH-氨水中所含有微粒:NH3、H2O、NH3·H2O、NH4+、OH-、H+,氨水中溶质通常看作为NH3,而不是NH3·H2O。
(2)与酸反应NH3+HNO3NH4NO3HCl+NH3NH4ClH2SO4+2NH3(NH4)2SO4氨气与氯化氢相遇便产生白烟,可用于NH3与HCl的相互检验。
(3)还原性NH3分子中氮元素呈-3价,具有还原性,能在一定条件下与O2、Cl2、CuO等反应,被它们氧化:2NH3+3Cl2N2+6HCl2NH3+3CuO3Cu+N2+3H2O3.氨气的实验室制法(1)原理:固态铵盐与碱加热反应:2NH4Cl+Ca(OH) 2CaCl2+2NH3↑+2H2O (2)发生装置:固+固+加热型,与制备O2气体相似;(3)收集:向下排空气法。
氮的氧化物对应的水化物

氮的氧化物对应的水化物1氮的氧化物对应的水化物是什么氮的氧化物是指一类有氮的化合物,主要包括一氧化氮(NO)、二氧化氮(NO2)、氮气(N2O)和氮氧化合物(NOX)等。
氮的氧化物是大气中主要的污染物之一,它们能够对大气、水环境和人类健康产生极大的危害。
而氮的氧化物在空气中和水中一旦遇到水分,就容易水解、氧化,生成一些水合物,这些水合物是氮的氧化物在自然界中最常见的化合物之一。
2NO的水合物:亚硝酸一氧化氮(NO)水解后产生的水合物就是亚硝酸(HNO2)。
亚硝酸是一种弱酸,在水中可以自然分解并释放出NO,同时也可以氧化为硝酸,这对大气和水体环境的质量都有很大的影响。
亚硝酸还是一种很好的还原剂,能够被用于化学分析和医学领域等。
3NO2的水合物:亚硝酸根二氧化氮(NO2)分解生成的水合物是亚硝酸根(NO2-)。
亚硝酸根是一种很稳定的离子,它存在于自然界中的过程中,会被微生物和植物还原为NH4+,从而对生态系统的氮循环产生影响。
此外,NO2-还能被用于金属氧化还原反应和环境领域的催化反应等。
4N2O的水合物:亚氮酸根氧化亚氮(N2O)水解后会生成亚氮酸根(N2O3-)。
亚氮酸根在水中很容易被水分解为NO2-和NO3-,同时也可以被还原成N2O或N2,并且还能与其他离子形成络合物。
亚氮酸根的存在极大的加强了氮氧化物的化学反应和与其它化合物的相互作用。
5NOX的水合物:硝酸根氮氧化物(NOX)同样会产生水合物,在水中它们的主要形式为硝酸根(NO3-)。
硝酸根是一种很普遍的离子,存在于自然界中的过程中很容易与其他离子发生反应。
硝酸在土壤中的存在会对植物生长产生影响,而硝酸盐在水体中也会对水质造成很大的影响。
6结论在自然界中,氮的氧化物是影响人类生态环境和健康的主要污染物之一。
而它们与水分子结合后形成的水合物,也产生了很多的影响,其中最常见的就是亚硝酸、亚硝酸根、亚氮酸根和硝酸根等。
这些水合物的存在和化学反应,都对于大气和水体环境产生了不可忽视的影响。
氮的氧化物-硝酸和氨

②在放电时与O2反应:
③与H2反应:
④与Mg等ⅡA族元素的反应:
N2+O2==2NO
放电
N2+3H2=====2NH3
催化剂
高温高压
N2+3Mg===Mg3N2
二、氮的氧化物
2、NO:
氮元素的常见正价有+1、+2、+3、+4、+5 所以氮的氧化物种类较多 ,如N2O、NO、N2O3、NO2、N2O5
与含S2- 、SO32- 、Fe2+ 、I-等的化合物反应。
浅绿色的Fe(NO3)2溶液中存在如下平衡: Fe2++2H2O Fe(OH)2+2H+,若向该溶液中滴加稀盐酸,则溶液的颜色( ) A、变黄 B、绿色变深 C、绿色变浅 D、无变化
光或 △
浓HNO3应避光保存在棕色瓶中。浓硝酸分解产生的NO2溶于HNO3而显黄色
浓HNO3 、AgNO3 、氯水、溴水等。
常见的需要放在棕色瓶中的溶液有哪些?
③强氧化性
要点一、HNO3 不管浓稀都具有强氧化 性,且氧化性浓HNO3 > 稀HNO3
要点二、 HNO3的强氧化性的具体体现:
1、利用电子得失守恒计算。
V1+V2=11·2L
32·64g/64g·mol-1×2=V1/22·4L·mol-1×3+V2/22·4L·mol-1×1
5·8
5·4
2、利用N元素守恒计算。
(aV×10-3+0·5)/0·14
3、整个变化中N元素的化合价不变, 利用氧化还原反应中得失电子数目相等。
含氮化合物
2010.09
氮氧化物自分解

氮氧化物自分解
氮氧化物是一类由氮和氧元素组成的化合物,常见的有一氧化氮(NO)、二氧化氮(NO2)和氮氧化物(N2O)。
在大气中,氮氧化物是一种重要的污染物,对环境和人类健康产生负面影响。
氮氧化物的自分解是指它们在特定条件下分解为氮气和氧气的过程。
这个过程主要发生在大气中,但也可以在其他环境中发生。
在大气中,光照、温度和存在其他化合物的存在会影响氮氧化物的自分解速率。
当太阳光照射到大气中的氮氧化物时,它们会吸收光能并发生分解反应。
一氧化氮可以通过以下反应自分解为氮气和氧气:
2NO → N2 + O2
而二氧化氮可以通过以下反应自分解为一氧化氮和氧气:
2NO2 → 2NO + O2
这些反应是通过光解来实现的,即光照提供了所需的能量来打破氮氧化物分子中的化学键。
分解过程中产生的氮气和氧气是大气中的常见成分,对环境没有负面影响。
值得注意的是,氮氧化物的自分解速率受到温度的影响。
在较高的温度下,氮氧化物的自分解速率更快。
因此,在暖季节或温暖地区,氮氧化物的自分解速率可能更高。
氮氧化物的自分解也受到其他化合物的影响。
一氧化氮和二氧化氮可以与其他化合物发生反应,形成新的化合物。
这些反应可能会影响氮氧化物的自分解速率和路径。
氮氧化物的自分解是一个重要的过程,有助于维持大气中的氮气和氧气平衡。
了解氮氧化物的自分解过程对于研究大气污染和环境保护具有重要意义。
我们需要采取措施减少氮氧化物的排放,以保护环境和人类健康。
氮氧化物成分

氮氧化物成分一、前言氮氧化物是大气中的一种污染物,对环境和人类健康都有很大的危害。
因此,研究氮氧化物的成分和来源对于减少空气污染具有重要意义。
本文将详细介绍氮氧化物的成分。
二、什么是氮氧化物1. 概念氮氧化物(NOx)是指由氮和氧元素组成的一类化合物,包括一氧化氮(NO)、二氧化氮(NO2)、亚硝酸盐(NOx-)和硝酸盐(NO3-)等。
2. 物理性质一般情况下,NOx呈无色或淡黄色的有刺激性臭味的烟雾状气体。
在常温下,NOx具有较高的反应活性,易于与其他物质发生反应。
三、主要成分及来源1. 一氧化氮(NO)一氧化氮是最简单的一种NOx,也是最常见的一种。
它主要来自于燃料燃烧过程中空气中的N2与O2反应生成。
此外,在闪电过程中也会产生少量的NO。
2. 二氧化氮(NO2)二氧化氮是一种有毒的红棕色烟雾状气体。
它主要来源于一氧化氮和空气中的O3反应生成。
此外,在高温燃烧过程中也会产生少量的NO2。
3. 亚硝酸盐(NOx-)亚硝酸盐是指一些含有亚硝基(-NO)的化合物,如亚硝酸、亚硝酸钠等。
它们主要来自于工业废水、农业污染和大气沉降等。
4. 硝酸盐(NO3-)硝酸盐是指一些含有硝基(-NO2)的化合物,如硝酸、硝酸钠等。
它们主要来自于工业排放、汽车尾气和农业污染等。
四、影响因素1. 温度在高温下,燃料燃烧反应速率加快,生成的NOx也会增加。
2. 空气比空气比越高,生成的NOx就越多。
3. 氧浓度在充足的O2存在下,生成的NOx也会增加。
4. 燃料类型不同的燃料生成NOx的量也不同。
例如,石油和天然气中的NOx含量较低,而煤中的NOx含量较高。
五、总结通过以上介绍,我们可以了解到氮氧化物是由多种化合物组成的一类污染物。
它们主要来自于工业排放、汽车尾气和农业污染等。
此外,温度、空气比、氧浓度和燃料类型等因素也会影响NOx的生成量。
为了减少空气污染,我们需要采取相应措施来降低NOx的排放量。
氮气及其氧化物
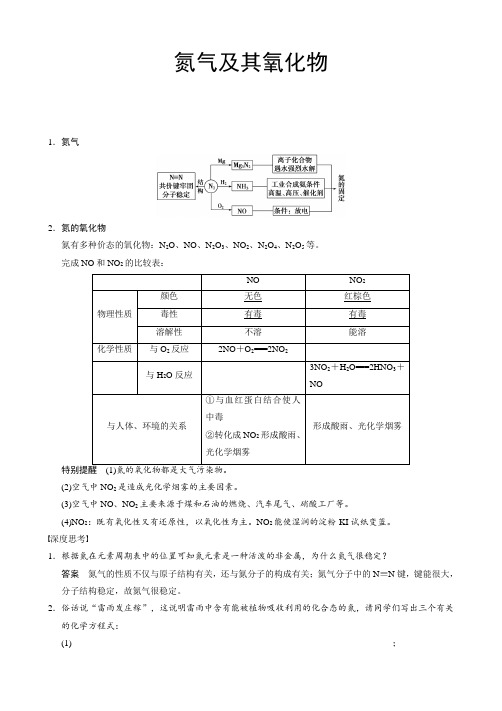
氮气及其氧化物1.氮气2.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。
完成NO和NO2的比较表:NO NO 2物理性质颜色无色红棕色毒性有毒有毒溶解性不溶能溶化学性质与O2反应2NO+O2===2NO2与H2O反应3NO2+H2O===2HNO3+NO与人体、环境的关系①与血红蛋白结合使人中毒②转化成NO2形成酸雨、光化学烟雾形成酸雨、光化学烟雾(2)空气中NO2是造成光化学烟雾的主要因素。
(3)空气中NO、NO2主要来源于煤和石油的燃烧、汽车尾气、硝酸工厂等。
(4)NO2:既有氧化性又有还原性,以氧化性为主。
NO2能使湿润的淀粉-KI试纸变蓝。
深度思考1.根据氮在元素周期表中的位置可知氮元素是一种活泼的非金属,为什么氮气很稳定?答案氮气的性质不仅与原子结构有关,还与氮分子的构成有关;氮气分子中的N≡N键,键能很大,分子结构稳定,故氮气很稳定。
2.俗话说“雷雨发庄稼”,这说明雷雨中含有能被植物吸收利用的化合态的氮,请同学们写出三个有关的化学方程式:(1)________________________________________________________________________;(2)________________________________________________________________________; (3)________________________________________________________________________。
答案 (1)N 2+O 2=====放电或高温2NO (2)2NO +O 2===2NO 2(3)3NO 2+H 2O===2HNO 3+NO 3.如何鉴别NO 2与溴蒸气?答案 由于NO 2和Br 2在性质上有不少相似性:①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。
7.氮氧化物

• 二氧化氮和一氧化氮
二、NO、NO2
N的氧化物的种类
+1 +2 +3 +4 +4 +5
N2O、NO、N2O3、NO2、N2O4、N2O5六种,
它们都有毒,是大气污染物。 (1)NO、NO2 ①物理性质: NO:无色、无味、难溶于水的气体 NO2:红棕色、有刺激性气味、易溶于水、易液化的气体
思 ? 考
方 案!
煤中含有S,燃烧时会产生 SO2排放到空气中去污染空气, 请利用今天学过的知识设计一个 合理方案来减少煤燃烧时SO2的 排放量,并写出有关方程式? 往煤中加石灰—Ca(OH)2,煤燃烧 产生的SO2和石灰产生反应生成 CaSO3, CaSO3再被氧化成CaSO4, 从而减少了SO2排放量,主要反应为: SO2 + Ca(OH)2 = CaSO3 + H2O 2CaSO3 + O2 =2 CaSO4
• 例题2:某烧瓶中盛满NO2和N2混合气(两 者体积比3:1),现将烧瓶倒立于水槽中, 待充分反应后,剩余气体的成分是什么? 体积比为多少?
NO和N2 1:1
1.NO2(或和NO、N2混合)气体溶于水
• 练习:某烧瓶中盛满NO2和NO混合气(两 者体积比3:2),现将烧瓶倒立于水槽中, 待充分反应后,剩余气体的成分是什么? 剩余气体与原混合气的体积比为多少? NO 3:5
分析反应原理: 2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO 总反应式:4NO + 3O2 + 2H2O = 4HNO3
V(NO):V(O2)=4:3 恰好反应,无气体剩余
结论: V(NO):V(O2)<4:3 O2过量,剩余O2
氮氧化物的形成原因

氮氧化物的形成原因
氮氧化物(NOx)的形成主要有两种方式:
1.空气中的氮气和氧气在高温条件下相互作用形成。
这种过程通常发生在高温燃烧或工业过程中,例如汽车发动机、燃煤发电站和化工厂。
在这些过程中,高温条件会导致氮气和氧气分子分裂成单个原子,然后重新结合成氮氧化物。
2.燃料中含有氮元素,在其燃烧过程中与氧气发生反应,从而生产氮氧化物。
然而,选择和燃烧温度来决定氮氧化物产生的高低。
例如:煤和天然气产生的氮氧化物会有所不同,同样的燃料,在不同温度燃烧,产生的氮氧化物也不同,燃烧温度越高,氮氧化物产生量也就越多。
因此,控制燃料中氮元素的含量以及燃烧过程中的温度都可以有效降低氮氧化物的排放。
氮氧化物

性质
主要包括一氧化氮、二氧化氮和硝酸雾,以二氧化氮为主。一氧化氮是无色、无刺激气味的不活泼气体,可 被氧化成二氧化氮。二氧化氮是棕红色有刺激性臭味的气体。
五氧化二氮为硝酸的酸酐,与水化合形成硝酸。 三氧化氮不稳定,是五氧化二氮气相分解的中间产物,存在时间很短。
危害
氮氧化物可刺激肺部,使人较难抵抗感冒之类的呼吸系统疾病,呼吸系统有问题的人士如哮喘病患者,会较 易受二氧化氮影响。对儿童来说,氮氧化物可能会造成肺部发育受损。研究指出长期吸入氮氧化物可能会导致肺 部构造改变,但仍未可确定导致这种后果的氮氧化物含量及吸入气体时间。
氮氧化物
只由氮、氧两种元素组成的化合物
01 主要种类
03 侵入途径 05 临床表现
目录
02 理化性质 04 毒理学 06 大气污染问题
07 性质
09 处理方法
目录
08 危害
氮氧化物指的是只由氮、氧两种元素组成的化合物,包括多种化合物,如一氧化二氮(N2O)、一氧化氮 (NO)、二氧化氮(NO2)、三氧化二氮(N2O3)、四氧化二氮(N2O4)和五氧化二氮(N2O5)等。除一氧化二 氮及二氧化氮以外,其他氮氧化物均不稳定,遇光、湿或热变成二氧化氮及一氧化氮,一氧化氮又变为二氧化氮。 因此,职业环境中接触的是几种气体混合物常称为硝烟 (气),主要为一氧化氮和二氧化氮,并以二氧化氮为主。 氮氧化物都具有不同程度的毒性。
谢谢观看
ቤተ መጻሕፍቲ ባይዱ
主要种类
常见的氮氧化物有一氧化氮(NO,无色)、二氧化氮(NO2,红棕色)、一氧化二氮(N2O)、五氧化二氮 (N2O5)等,其中除五氧化二氮常态下呈固体外,其他氮氧化物常态下都呈气态。作为空气污染物的氮氧化物 (NOx)常指NO和NO2。
氮的氧化物相关知识点总结

氮的氧化物相关知识点总结一、氮的氧化物的种类1. 氮氧化物氮氧化物主要包括一氧化氮(NO)、二氧化氮(NO2)和氧化亚氮(N2O)三种。
其中,一氧化氮可由氮气和氧气在高温下反应得到。
二氧化氮是一种二元酸性氧化物,它可由一氧化氮和氧气在空气中发生反应而成。
氧化亚氮是一种重要的温室气体,它主要由微生物在分解有机物过程中产生。
2. 氮氧化铵氮氧化铵是指含有氮、氧和铵离子的化合物,通常为硝酸盐和亚硝酸盐。
硝酸盐和亚硝酸盐在土壤中起着重要的作用,可提供植物生长所需的氮元素。
此外,氮氧化铵还有着重要的工业应用,可用于生产肥料和爆破剂等。
二、氮的氧化物的性质1. 化学性质氮氧化物在化学性质上有着各自的特点。
一氧化氮是一种不稳定的化合物,易于氧化成为二氧化氮。
二氧化氮则是一种有害的有毒气体,对人体和环境有害。
氧化亚氮是一种重要的温室气体,对气候变化有着重要的影响。
2. 生物活性氮氧化物在生物活性上有着重要的作用。
一氧化氮在生物体内起着重要的信号分子的作用,参与调节血管张力和炎症反应等生理过程。
另外,氧化亚氮是一种重要的温室气体,对气候变化有着重要的影响。
3. 环境影响氮氧化物对环境有着重要的影响。
一氧化氮和二氧化氮是空气污染物,对人类健康和环境造成危害。
氧化亚氮是一种重要的温室气体,对气候变化有着重要的影响。
三、氮的氧化物的应用1. 工业生产氮的氧化物在工业生产中有着广泛的应用。
一氧化氮可用于生产硝酸盐和硝酸铵等化工产品。
二氧化氮可用于生产硝酸盐和硝酸铵等化工产品。
氧化亚氮可用于生产氮气和硝酸等化工产品。
2. 农业生产氮的氧化物在农业生产中有着广泛的应用。
硝酸盐和亚硝酸盐是植物生长所需的氮元素来源,可用于生产肥料。
此外,氮的氧化物还可用于灭菌和杀虫等农业生产中的应用。
3. 其他应用氮的氧化物还有着一些其他的应用。
一氧化氮可用于医学上的一些应用,如在心血管疾病和性功能障碍等方面有着重要的作用。
此外,氮的氧化物还可用于燃料电池、光电子技术、电子工业等领域的应用。
含氮的氧化物

含氮的氧化物
含氮的氧化物是指分子中含有氮元素和氧元素的化合物。
这类化合物在自然界中广泛存在,包括大气中的氮氧化物、土壤中的硝酸盐和有机氮化合物等。
氮氧化物是大气中的主要污染物之一,包括氮气、一氧化氮和二氧化氮等。
它们主要来源于燃烧过程和工业活动,对人类健康和环境造成严重影响。
氮氧化物的排放会导致酸雨、光化学烟雾和温室效应等环境问题。
硝酸盐是土壤中的一种重要氮源,它们可以通过化学反应或生物转化形成。
硝酸盐的含量对土壤肥力和植物生长有重要影响。
但是过量的硝酸盐会导致水体富营养化和地下水污染等问题。
有机氮化合物是含有氮元素的有机化合物,包括氨、氨基酸、蛋白质等。
它们在生物体内起着重要的生理作用,但是过量的有机氮化合物会导致水体富营养化和氮肥过量使用等问题。
含氮的氧化物在自然界中具有重要的生态和环境作用,但是过量的排放和使用会对人类健康和环境造成严重影响。
因此,我们应该采取有效的措施减少其排放和使用,保护生态环境和人类健康。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例4:将40mLNO和NO2的混合气体跟20mL O2同时通入装满水倒立于水槽中的量 筒中,发现有5mL气体剩余,问原NO 和NO2混合气体的体积组成为什么? 1、若剩余气体为O2,则无NO和NO2剩余, 设原有NO2体积为x, 则NO的体积为(40-x)
3NO2+H2O=====2HNO3+NO 3 1 x/3 x 4NO+3O2+2H2O=====4HNO3 4 3 40-x+x/3 (20-5) X=30mL 故原气体组成为:VNO=10mL VNO =30mL
2
2、若剩余气体为NO,无O2、NO2剩余 设原NO体积为y,则NO2体积为(40-y) 3NO2+H2O=====2HNO3+NO 3 1 (40-y)/3 40-y 4NO+3O2+2H2O=====4HNO3 4 3 y+(40-y)/3-5 20 y=27.5mL,则NO2体积为12.5mL
; / 彩票群
wrf17xuz
真做,慕容凌娢说了一大长串感谢的话,就要离开。“姑娘且慢!”又怎么了!慕容凌娢不情愿的回过头。有种不好的 预感,看来今天晚上真的是很难全身而退啊。“方才听姑娘弹了一曲,极为精妙,只是不知曲名是什么,忘姑娘告知。” 那人还算客气,始终跟慕容凌娢保持着一米的距离。极为精妙,这是在夸我吗?居然用了“精妙”这个词,慕容凌娢就 算再自恋,也会被他说得不好意思了。说实话,她的琴技非常一般,更谈不上什么精妙,也许只是单纯的曲子新鲜,才 会被注意到。但不论是什么原因,受到别人赞赏,总该有所答复。“只是不出名的小曲子,怎经得起公子如此赞扬。” 慕容凌娢怎么会把曲子的名字说出来呢。“我说的不单单只是曲子,还有你的琴技,姑娘方才在弹琴时非常投入,又似 乎是若有所思,可是想起了什么往事?”“只是单纯的喜欢而已。”古代人都这么感性吗?听首曲子都能脑补出这种感 慨,总算知道为什么古人那么爱写诗了……“喜欢也绝不会是毫无原因吧,在下也略晓音律,似乎从姑娘的曲子中听出 了一丝落寞,可是想起了什么往事?”他的话语波澜不惊,慕容凌娢的心中却是激起了千层浪花。他莫非真的以为自己 像歌词中写得那样,是个有“故事”的人吗?可她是因为喜欢这对CP,才如此喜欢这首歌的,如果非要说什么往事,也 就只是怀念21世纪的一切了……“是有一些特殊的含义……”慕容凌娢竭尽全力装出了一副娇羞的样子。既然有人都把 话说得那么直白了,如果全盘否定实在是太打脸了。人家刚刚有恩于自己,还是不要戳破他的幻想比较好。“在下想与 姑娘私谈,不知姑娘可否赏脸?”“公子如此诚邀,白绫怎会拒绝。”就当是慰问演出了,反正人长得这么养眼,自己 浪费点时间也不吃亏。慕容凌娢努力发挥出自己颜控的一面,抱着古琴跟他走进的大厅外的一个房间。刚一走进房间, 慕容凌娢就后悔了,这房间的隔音效果比自己想象的要好得多,大厅里的声音在这里居然一点都听不见,这寂静的环境 也太尴尬了。没办法,自己作的死,哭着也要作完。慕容凌娢咬了咬嘴唇,率先问道,“谈人生还是谈理想?”“嗯?” 那人没料到慕容凌娢会问这么奇怪的问题,先是一怔,然后就笑出了声,“不谈人生也不谈理想,弹高山流水可好?” 第054章 《高山流水》刚一走进房间,慕容凌娢就后悔了,这房间的隔音效果比自己想象的要好得多,大厅里的声音在 这里居然一点都听不见,这寂静的环境也太尴尬了。没办法,自己作的死,哭着也要作完。慕容凌娢咬了咬嘴唇,率先 问道,“谈人生还是谈理想?”“嗯?”那人没料到慕容凌娢会问这么奇怪的问题,先是一怔,然后就笑出了声,“不 谈人生也不谈理想,弹高山流水可好?”高山
例2:在标况下,把一个50mL量筒装满水 倒置于水槽中,先通入10mLN: 4NO+3O2+2H2O=====4HNO3 4mL 3mL 10mL x X=7.5mL 现有氧气20mL,所以O2过量, 应根据NO的体积计算,剩余氧气有12.5mL.
关于NO2、NO、O2混合气体 溶于水的计算
2NO+O2=====2NO2 3NO2+H2O=====2HNO3+NO
由② ╳ 2与①叠加得
① ②
4NO2+O2+2H2O=====4HNO3 由① ╳ 3与 ② ╳ 2叠加得 4NO+3O2+2H2O=====4HNO3
叠加法: 1、只有各化学反应方程式间有内在 联系时,才可用叠加法; 2、用叠加后的方程式时仍应写出原来 方程式。
一般NO2、NO、O2与H2O反应,可归纳成 四种情况: (1)NO(或N2)和NO2混合溶于水 只要考虑NO2溶于水即可,剩余气体为NO (2) NO和O2混合溶于水 根据叠加后的方程式进行过量计算 ①若O2过量,则根据NO计算剩余气体为O2 ②若NO过量,则应根据O2计算剩余气体为NO
(3)NO2和O2混合溶于水 应根据叠加后的方程式进行过量计算讨论 ①若O2过量,则根据NO2计算, 剩余气体为O2 ② 若NO2过量,则先根据O2计算, 计算出NO2剩余多少,再使NO2与水反应, 剩余气体为NO (4)NO、NO2和O2混合溶于水 则宜先将NO2与H2O反应生成NO, 再根据NO和O2混合气体的情况进行讨论
例1、将12mLNO2和NO的混合气体, 通入倒立在水槽中盛满水的量筒里, 最后量筒中有6mL 气体,则原混合 气体中NO和NO2的体积分别为多少? 分析:只要考虑NO2溶于水即可, 剩余气体为NO 解:根据差量法 3NO2+H2O=====2HNO3+NO ΔV 3mL 1mL 2mL x 12-6=6mL
例3:将12mLNO2与O2混合气体被水充分 吸收后,发现剩余2mL气体 ,问 原混合气体体积各为多少?
讨论:(1)若剩余气体为O2,则
4NO2+O2+2H2O=====4HNO3 ΔV 4mL 1mL 5mL x 12-2=10mL
X=4 ╳10/5=8mL 所以有O24mL
(2)若剩余气体是NO,则 3NO2+H2O=====2HNO3+NO 6mL 2mL 4NO2+O2+2H2O=====4HNO3 4mL 1mL 4x x 4x+x+6=12 X=1.2mL 所以有NO2:6+4 ╳ 1.2=10.8mL
