最新初中常见化合价
初中常用元素化合价表

对于化合价的口诀,方便大家记忆:氢+1, 氧-2,银锂钠钾 +l 价,锌镁钙钡 +2 价,铝+3, 硅+4.只遇金属或是氢 ,氮磷 -3 硫-2,氟氯溴碘总 -1. 可变价 , 不行怕 , 详细判断 " 和为零 ".单质为零要记清 ." 亚铜 " +1" 铜" +2," 亚铁 " +2" 铁" +3,置换反应铁 +2,复分解市价不变 .对于化合价要正确记住金属元素化合价和原子团的化合价。
一般非金属元素化合价是让你求的,因此只要要你认识非金属元素一般显负价,当含氧时显正价就能够了。
详细是几不需要。
金属元素化合价口诀正一氢银和钠钾,正二钙钡镁锌汞,铜是一二,铁二三,铝的价态是正三。
原子团化合价口诀OH氢氧根 -1 价,NO3硝酸根 -1 价SO4硫酸根 -2 价CO3碳酸根 -2 价PO4磷酸根 -3 价NH4铵根 +1 价这类原子团化合价的记法便于掌握原子团的构成、名称、化合价。
我们的学生一般都背这个。
一价钾钠氯〔 -1 〕氢银,二钾氧 (-2) 钙钡镁锌三铝四硅五价磷二三铁,二四炭,二四六硫都齐备铜汞二价最常有一价高锰、氯、硝酸根二价锰、硫、碳酸根三价磷酸根元素化合价常用口诀表〔金属显正价,非金属显负价〕一价钾钠氯氢银,二价氧钙钡镁锌,三铝四硅、五价磷,二三铁、二四碳,二四六硫都齐备,铜汞二价最常有,单质价数都为零。
一价氢氟钾钠银,二价氧钙钡镁锌,三价铝,四价硅,三五价为磷,一二汞铜,二三铁,四七锰,二四碳,二四六硫三五氮,一五七氯经常有,单质零价永不变。
Fe3o4由于此中的 Fe 有两种化合价。
三个 Fe 中有一个 Fe 是 +2 价的,有两个 Fe 的是 +3 价的,你这样算的话化合价就是零价了。
其真切的原由是 Fe3O4 是一个铁酸铁,它是由一份 Fe2O3〔三氧化二铁〕和一份 FeO〔氧化亚铁〕构成。
初中化学化合价

初中化学化合价初三二轮复习冲刺:初中化学化合价详细讲解!初中化学中最常见的很多都是需要背诵的知识,这些知识给大家总结了一下,希望能帮助到各位初中生。
一、常见元素及原子团的化合价:钾K 钠Na 氢H 银Ag +1价,氟F 氯Cl 溴Br 碘I -1价钙Ca 镁Mg 钡Ba 锌Zn +2价,+1、+2铜Cu,+2、+3铁Fe铝Al+3 硅Si+4 氧O-2常见带电离子团:硫酸根SO42+,硝酸根NO3-,氢氧根OH-,氯酸根ClO3-,碳酸根CO32-铵根NH4+,高锰酸根MnO4- 锰酸根MnO42-,磷酸根PO43- 注意:标原子团的化合价时,应标在原子团的上方,如:书写离子符号时,应在原子团右上角标明带电荷数,如硫酸根离子:SO42-一个亚铁离子Fe2+,一个铁离子Fe3+。
二、初中化学物质的检验(一)、气体的检验1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.(二)、离子的检验.6、氢离子:滴加紫色石蕊试液/加入锌粒7、氢氧根离子:酚酞试液/硫酸铜溶液8、碳酸根离子:稀盐酸和澄清的石灰水9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子(三)、相关例题14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。
化学常用元素化合价口诀

化学常用元素化合价口诀初中常见化合价口诀钾钠银氢正一价,钡锌钙镁正二价,一二铜,二三铁,亚铜亚铁是低价,铝是正三氧负二,氯是负一最常见,硫有负二正四六,正二正三铁可变,二三铁,二四碳,单质零价永不变。
负一硝酸氢氧根,负二硫酸碳酸根,负三记住磷酸根,正一价的是铵根,其他元素有变价,先死后活来计算。
一价氯氢钾钠银,二价氧钡钙镁锌。
三铝四硅五价磷,二四碳,三五氮。
二四六硫铁二三,铜汞一二是变价。
单质零价永不变。
正一钾钠银氢氨,正二钙铜镁钡锌,铝三硅四磷正五,氯常负一氧负二,铁变二三碳二四,氢氧硝酸根负一,碳酸硫酸根负二,二四六硫均齐全。
正一氢锂钾钠银,正二钙镁钡锌汞。
正三铝,负二氧。
氟氯溴碘负一价。
可变价,也不难。
正一亚铜,正二铜。
正二亚铁,正三铁。
负一氢氧硝酸根,负二硫酸碳酸根,正一价的是铵根。
一价氢氯钠钾银,二价氧镁钙钡锌;三价元素铀鎶铝,四价碳酸五价磷。
常用化学元素口诀钾、钠、银、氢正一价,钙、镁、钡、锌正二价,氟、氯、溴、碘负一价,通常氧是负二价,铜正二、铝正三,铁有正二和正三,碳有正二和正四,硫有负二正四和正六,常见元素的主要化合价二,氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二钡钙镁和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰有正二四六七;碳的二四要牢记。
非金属负主正不齐;氯有负一正一五七。
氮磷都有负三正五;不同磷三氮二四。
二四六硫都齐全;边记边用就会熟。
化学根价口诀负一硝酸氢氧根,负二硫酸碳酸根,负三价的磷酸根。
正一价是铵根钾钠氢银+1价,钙镁钡锌+2价铝是+3,氧-2,氯-1价最常见,+2+3铁,+2+4碳,铜汞2价最常见,硫有-2+4+6,单质零价永不变。
简单元素化合价口诀钾、钠、氢、银、铵正一,铜、钙、钡、镁、锌正二,铝三、硅四、磷正五,亚铁正二、铁正三,碳有正二、正四价,氢氧、硝酸根负一,氯化物中氯负一,碳酸、硫酸根负二,硫化物中硫负二,氧为负二要牢记。
初中常见化合价化学式及化学方程式
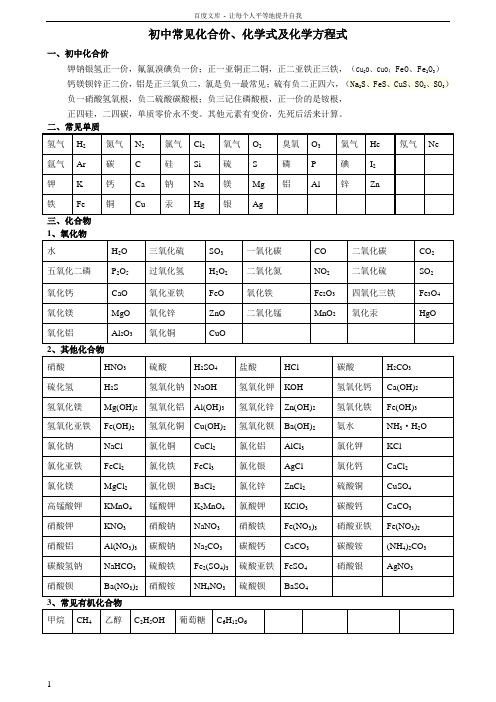
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
初三化学化合价表

初三化学化合价表化合价是化学中用来表示元素与其他元素结合的能力或价电子数的概念。
它是化学反应和化学方程式中的重要指标之一。
化合价的大小决定了元素与其他元素形成化合物时的电子转移或共用情况,进而影响化合物的性质和稳定性。
化合价表是一张记录元素化合价的表格,它依据元素的电子结构和化学性质,列出了常见元素的化合价范围。
下面我们将逐一介绍常见元素的化合价。
1. 氢(H):氢原子只含有一个电子,其化合价为+1。
2. 氧(O):氧原子含有六个电子,主要倾向于接受两个电子,其化合价为-2。
3. 碳(C):碳原子含有四个电子,主要倾向于共用四个电子,其化合价为+4。
4. 氮(N):氮原子含有七个电子,主要倾向于接受三个电子,其化合价为-3。
5. 硫(S):硫原子含有十六个电子,主要倾向于接受两个电子,其化合价为-2。
6. 氯(Cl):氯原子含有十七个电子,主要倾向于接受一个电子,其化合价为-1。
7. 钠(Na):钠原子含有十一个电子,主要倾向于失去一个电子,其化合价为+1。
8. 铁(Fe):铁原子含有二十六个电子,其化合价可以是+2或+3。
9. 铜(Cu):铜原子含有二十九个电子,其化合价可以是+1或+2。
10. 氟(F):氟原子只含有七个电子,其化合价为-1。
11. 锌(Zn):锌原子含有三十个电子,其化合价为+2。
12. 铝(Al):铝原子含有十三个电子,其化合价可以是+3。
13. 硅(Si):硅原子含有十四个电子,主要倾向于共用四个电子,其化合价为+4。
14. 磷(P):磷原子含有十五个电子,主要倾向于接受三个电子,其化合价为-3。
15. 锰(Mn):锰原子含有二十五个电子,其化合价可以是+2、+4、+7。
以上是初三化学化合价表中常见元素的化合价。
需要注意的是,化合价并不是固定不变的,它受到许多因素的影响,如元素的电子结构、电负性以及化合物的性质等。
因此,在具体的化学反应中,元素的化合价可能会有一定的变化。
初中化学元素化合价完整版

一、常见元素化合价
元素名称
元素符号
常见化合价
元素名称
元素符号
常见化合价
钾
K
+1
氢
H
+1
钠
Na
+1
氯
Cl
-1+5+7
银
Ag
+1
溴
Br
-1
钙
Ca
+2
碘
I
-1
镁
Mg
+2
氧
O
-2
硫
S
-2+4+6
钡
Ba
+2
碳
C
+2+4
锌
Zn
+2
硅
Si
+4
铜
Cu
+2-1
氮
N
-3+2+4+5
铝
Al
+3
磷
P
+5
铁
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
—
Cu2+
不
溶
溶
溶
不
Ag+
—
溶
不
微
不
Fe
+2+3
二、常见原子团化合价原子团
名称原子团
名称
原子团
符号
原子团
化合价
原子团
名称原子团Fra bibliotek符号原子团
化合价
氢氧根
八年级化学化合价表

八年级化学化合价表在人教版八年级化学中,常见元素化合价如下:一、一价元素。
1. 氢(H)- 通常显 +1价,例如在氯化氢(HCl)中,氢元素为+1价。
2. 钾(K)- 钾元素在化合物中通常显 +1价,如氯化钾(KCl)。
3. 钠(Na)- 钠元素在化合物中一般为+1价,像氯化钠(NaCl)。
4. 银(Ag)- 银元素常见化合价为 +1价,例如硝酸银(AgNO₃)。
二、二价元素。
1. 钙(Ca)- 在化合物中钙元素常显+2价,如碳酸钙(CaCO₃)。
2. 镁(Mg)- 镁元素在化合物里通常为+2价,像氧化镁(MgO)。
3. 钡(Ba)- 钡元素一般显+2价,例如硫酸钡(BaSO₄)。
4. 锌(Zn)- 锌元素常见化合价为+2价,如硫酸锌(ZnSO₄)。
5. 铜(Cu)- 铜元素有+2价,例如氧化铜(CuO);也有 +1价(亚铜离子),如氧化亚铜(Cu₂O)。
三、三价元素。
1. 铝(Al)- 铝元素在化合物中通常显+3价,如氧化铝(Al₂O₃)。
四、变价元素(铁元素)1. 铁(Fe)- 有+2价(亚铁离子),如氯化亚铁(FeCl₂);- 还有+3价(铁离子),例如氯化铁(FeCl₃)。
五、特殊元素化合价。
1. 氧(O)- 在化合物中通常显 - 2价,如二氧化碳(CO₂)。
但在过氧化物(如过氧化氢H₂O₂)中氧元素为 - 1价。
2. 氯(Cl)- 通常显 - 1价,如氯化钠(NaCl);但在氯酸钾(KClO₃)中氯元素为+5价,在高氯酸(HClO₄)中为+7价等。
3. 氮(N)- 化合价比较复杂,有 - 3价(如氨气NH₃)、+2价(一氧化氮NO)、+4价(二氧化氮NO₂)、+5价(硝酸HNO₃)等。
4. 碳(C)- 有 +2价(如一氧化碳CO)、+4价(如二氧化碳CO₂)等。
常见元素主要化合价口诀

常见元素主要化合价口诀初中常用元素价位口诀
一价氯氢钾钠银,二价氧钙钡镁锌,
硫二铝三硅为四,铜汞为二铁二三。
初中化合价
钾钠银氢正一价,钡锌钙镁正二价,
一二铜,二三铁,亚铜亚铁是低价,
铝是正三氧负二,氯是负一最常见,
硫有负二正四六,正二正三铁可变,
二三铁,二四碳,单质零价永不变。
[1] 负一硝酸氢氧根,负二硫酸碳酸根,
负三记住磷酸根,正一价的是铵根,
其他元素有变价,先死后活来计算。
一价氯氢钾钠银,二价氧钡钙镁锌。
三铝四硅五价磷,二四碳,三五氮。
二四六硫铁二三,铜汞一二是变价。
正一钾钠银氢氨,正二钙铜镁钡锌,
铝三硅四磷正五,氯常负一氧负二,
铁变二三碳二四,氢氧硝酸根负一,
碳酸硫酸根负二,二四六硫均齐全。
正一氢锂钾钠银,正二钙镁钡锌汞。
正三铝,负二氧。
氟氯溴碘负一价。
可变价,也不难。
正一亚铜,正二铜。
正二亚铁,正三铁。
负一氢氧硝酸根,负二硫酸碳酸根,正一价的是铵根。
一价氢氯钠钾银,
二价氧镁钙钡锌;
三价元素铀鎶铝,
四价碳酸五价磷。
最新初中化学化合价口诀

速记口诀
化合价口诀一:
一价氢氯钾钠银,二价氧钙钡镁锌;
+1 +1 +1 +1 +1 +2 +2 +2 +2 +2
H、Cl、K、Na、Ag O、Ca、Ba、Mg、Zn
三铝四硅五价磷,二三铁、二四碳;
+3 +4 +5 +2 +3 +2 +4
Al、Si、P、Fe、Fe、C、C
二四六价硫齐全,铜汞二价最常见;
+2 +4 +6 +2 +2
S、S、S、Cu、Hg
单质零价永不变。
0 0
如:O2、H2
化合价口诀二:
负一硝酸氢氧根,负二硫酸碳酸根;
-1 -1 -2 -2
NO3、OH、SO4、CO3
还有负三磷酸根,只有正一是铵根。
-3 +1
PO4、NH4
速记口诀
化合价口诀一:
一价氢氯钾钠银,二价氧钙钡镁锌;
+1 +1 +1 +1 +1 +2 +2 +2 +2 +2
H、Cl、K、Na、Ag O、Ca、Ba、Mg、Zn
三铝四硅五价磷,二三铁、二四碳;
+3 +4 +5 +2 +3 +2 +4
Al、Si、P、Fe、Fe、C、C
二四六价硫齐全,铜汞二价最常见;
+2 +4 +6 +2 +2
S、S、S、Cu、Hg
单质零价永不变。
0 0
如:O2、H2
化合价口诀二:
负一硝酸氢氧根,负二硫酸碳酸根;
-1 -1 -2 -2
NO3、OH、SO4、CO3
还有负三磷酸根,只有正一是铵根。
-3 +1
PO4、NH4。
化学中化合价口诀

化学中化合价口诀
初中常用1:
一价氯氢钾钠银
二价氧钙钡镁锌
三铝四硅三五磷
二三铁,二四碳
二四六硫要记全
铜汞二价最常见
锰有二四六七价
常用元素铭记心
一价氢氧铵原子团二硫碳根
初中常用2:
一价氯氢钾钠银
二价氧镁钙钡锌
亚铁二铝铁三
铜汞二价最常见
一价氢氧硝酸根
二价硫酸碳酸根
只有正一是铵根
初中的3
一价钾钠氯氢银(氯是负一价)
二价钙镁氧钡锌(氧是负二价)
三铝四硅五氮磷
二三铁二四碳
二四六硫要记清
铜汞二价最常见
锰有四价二四六七
负一还有氟溴碘
4
一价氯氢钾钠银
二价氧钙钡镁锌
三铝四硅三五磷
二三铁,二四碳
二四六硫要记全
铜汞二价最常见
锰有二四六七价
常用元素铭记心
一价氢氧铵原子团二硫碳根
5.
我的不用记正负价
一价钾钠氯银,
二价钡镁钙锌,
三铝四硅五价磷,
六硫七锰八为零,
一铜二铁加亚名,
单质为零,
氢正一,氧负二,
氢氧优先,不变价优先,
遇正必负。
绝对有效,分给我吧,我也在学,用了这个口诀很轻松,轻松上98。
初中化学元素及化合价

初中化学元素及化合价1、氢化合物:
(1)氢:质子1,化合价+1
(2)氧化物:质子2,化合价-2
(3)氯化物:质子1,化合价-1
(4)硫酸盐:质子2,化合价-2
2、碱金属:
(1)钠:质子1,化合价+1
(2)钙:质子2,化合价+2
(3)铝:质子3,化合价+3
(4)锂:质子1,化合价+1
3、非金属:
(1)氟:质子1,化合价-1
(2)氖:质子0,化合价0
(3)氮:质子3,化合价-3
(4)磷:质子3,化合价-3
(5)硫:质子2,化合价-2
4、有机元素:
(1)甲烷:质子4,化合价-4
(2)乙烷:质子2,化合价-2
(3)丙烷:质子6,化合价-6
(4)烯烃:质子2,化合价-2
(5)芳香烃:质子4,化合价-4
二、常见元素的定义
1、氢:氢是一种无色、无臭、无味的无机元素,其在自然界中最多,但是在地壳中只占质量的0.14%,其原子量为1,处于无机元素周期表的
最左边。
2、氧:氧是一种常见的元素,它是地球上最常见的元素,其原子量
为16,是一种有机物,它可以与其他元素如氢、碳等进行化学反应,形
成氧化物。
3、氯:氯是一种常见的元素,原子量为35.5。
初中化学“化合价口诀+方程式”

初中化学“化合价口诀+全部方程式”化合价口诀 (熟记)(正价)氢钠钾银正一价,钙镁钡锌正二价,铝三硅四氮磷五,二四六硫二四碳,铜汞二一,铁二三(负价), 氟氯溴碘负一价,氧硫常显负二价;氮磷均有负三价;单质化合价为零。
• 一价钾钠氯氢银:钾(K )钠(Na )在化合物中通常显 +1 价;氯(Cl )在氯化物中一般显 -1 价(如氯化钠 NaCl );氢(H )在化合物中常为 +1 价;银(Ag )在化合物中通常显 +1 价。
• 二价氧钙钡镁锌:氧(O )在化合物中一般显 -2 价(除过氧化物等特殊情况);钙(Ca )、钡(Ba )、镁(Mg )、锌(Zn )在化合物中常显 +2 价。
• 三铝四硅五价磷:铝(Al )在化合物中通常显 +3 价;硅(Si )常见化合价为 +4 价; 磷(P )有 +5 价等多种化合价,这里主要强调常见的 +5 价。
• 二三铁,二四碳:铁(Fe )有 +2 价(亚铁离子)和 +3 价(铁离子);碳(C )有 +2 价(如一氧化碳 CO )和 +4 价(如二氧化碳 CO₂)。
• 二四六硫都齐全:硫(S )有 -2 价(如硫化氢 H₂S )、+4 价(如二氧化硫 SO₂)和 +6 价(如三氧化硫 SO₃)。
• 铜汞二价最常见:铜(Cu )和汞(Hg )在化合物中通常显 +2 价,但铜也有 +1 价(如氧化亚铜 Cu₂O )。
• 氢一氧二要记清:再次强调氢一般为 +1 价,氧一般为 -2 价。
• 单质元素价为零:任何单质中元素的化合价都为 0 价,比如氧气(O₂)、铁(Fe )等单质中 氧元素和铁元素化合价均为 0 。
常见原子团的化合价负一硝酸NO 3-氢氧根 OH -负二碳酸 CO 32- 硫酸 SO 42-锰酸根 MnO 42-负三只有磷酸根 PO 43-,正一价的是氨根 NH 4+可溶物与不溶物的记忆口诀 口诀一钾钠铵盐均可溶;硝盐入水影无踪 硫酸盐中钡不溶;氯化盐中银不溶 碳酸盐中只溶钾、钠、铵; 碱只溶钾、钠、钙、钡、铵 口诀二钾钠铵盐硝酸盐,完全溶解不困难。
初中化学元素化合价总结

初中化学元素化合价总结化学元素的化合价是指元素在化合物中所具有的价数,它可以简单地理解为元素与其他元素形成化合物时的价电子数。
对于初中化学学习来说,掌握元素的化合价是非常重要的,它是理解元素周期表和化学反应的基础知识之一。
下面我将对常见的元素的化合价进行总结。
1. 碱金属元素:碱金属元素位于元素周期表第一族,包括锂、钠、钾等。
它们在化合物中的化合价一般为+1。
例如,氯化钠的化学式为NaCl,其中钠的化合价为+1,氯的化合价为-1。
2. 碱土金属元素:碱土金属元素位于元素周期表第二族,包括镁、钙、锶等。
它们在化合物中的化合价一般为+2。
例如,氢氧化镁的化学式为Mg(OH)2,其中镁的化合价为+2,氢和氧的化合价分别为+1和-2。
3. 铝和锌:铝的化合价一般为+3,例如,氧化铝的化学式为Al2O3,其中铝的化合价为+3,氧的化合价为-2。
锌的化合价一般为+2,例如,氧化锌的化学式为ZnO,其中锌的化合价为+2,氧的化合价为-2。
4. 氧:氧的化合价一般为-2,例如,一氧化碳的化学式为CO,其中碳的化合价为+2,氧的化合价为-2。
需要注意的是,氧化物中氧的化合价一般为-2,但是在过氧化物(例如过氧化氢)中氧的化合价为-1。
5. 卤素元素:卤素元素位于元素周期表第七族,包括氟、氯、溴等。
它们在化合物中的化合价一般为-1。
例如,氯化钠的化学式为NaCl,其中钠的化合价为+1,氯的化合价为-1。
6. 氢:氢的化合价一般为+1,例如,氯化氢的化学式为HCl,其中氢的化合价为+1,氯的化合价为-1。
7. 氮和磷:氮的化合价一般为-3,例如,氨的化学式为NH3,其中氮的化合价为-3,氢的化合价为+1。
磷的化合价一般为-3,例如,磷化氢的化学式为PH3,其中磷的化合价为-3,氢的化合价为+1。
需要注意的是,以上是常见元素的化合价总结,并不包括所有元素。
对于其他元素的化合价,可以通过元素周期表和化学实验进行研究和探索。
初中常用元素化合价表

初中常用元素化合价表钾K +1 氯Cl -1,+1,+5,+7钠Na +1 氧O -2,-1银Ag +1 硫S -2,+4,+6钙Ca +2 碳C +2,+4镁Mg +2 硅Si +4钡Ba +2 氮N -3,+2,+3,+4,+5锌Zn +2 磷P -3,+3,+5铜Cu +1,+2 硫酸根SO4 -2铁Fe +2,+3,碳酸根CO3 -2铝Al +3 硝酸根NO3 -1锰Mn +2,+4,+6,+7 氢氧根OH -1氢H +1 铵根NH4 +1氟F -1 磷酸根PO4 -3氯酸根ClO3 -1(Cl +5价)关于化合价的口诀,方便大家记忆:氢+1,氧-2,银锂钠钾+l价,锌镁钙钡+2价,铝+3,硅+4.只遇金属或是氢,氮磷-3硫-2,氟氯溴碘总-1.可变价,不可怕,具体判断"和为零".单质为零要记清."亚铜" +1"铜" +2,"亚铁" +2"铁" +3,置换反应铁+2,复分解时价不变.关于化合价要准确记着金属元素化合价和原子团的化合价。
一般非金属元素化合价是让你求的,所以只需要你了解非金属元素一般显负价,当含氧时显正价就可以了。
具体是几不需要。
金属元素化合价口诀正一氢银和钠钾,正二钙钡镁锌汞,铜是一二,铁二三,铝的价态是正三。
原子团化合价口诀OH氢氧根-1价,NO3硝酸根-1价SO4硫酸根-2价CO3碳酸根-2价PO4磷酸根-3价NH4铵根+1价这种原子团化合价的记法便于掌握原子团的组成、名称、化合价。
我们的学生一般都背这个。
一价钾钠氯(-1)氢银,二钾氧(-2)钙钡镁锌三铝四硅五价磷二三铁,二四炭,二四六硫都齐全铜汞二价最常见一价高锰、氯、硝酸根二价锰、硫、碳酸根三价磷酸根元素化合价常用口诀表(金属显正价,非金属显负价)一价钾钠氯氢银,二价氧钙钡镁锌,三铝四硅、五价磷,二三铁、二四碳,二四六硫都齐全,铜汞二价最常见,单质价数都为零。
初中化学元素_化合价(可编辑修改word版)

一、常见元素化合价
元素名称 元素符号
钾
K
钠
Na
银
Ag
钙
Ca
镁
Mg
硫
S
碳
C
硅
Si
氮
N
磷
P
常见化合价 +1 +1 +1 +2 +2
-2+4+6 +2+4 +4
-3+2+4+5 +5
元素名称 元素符号
氢
H
氯
Cl
溴
Br
碘
I
氧
O
钡
Ba锌Biblioteka Zn铜Cu
铝
Al
铁
Fe
常见化合价 +1
-1+5+7 -1 -1 -2 +2 +2
根
NO3 CH3COO
MnO4 PO4 H2PO4
-1
铵根
NH4
-1
氯酸根
ClO3
-2
高锰酸根
MnO4
-3
磷酸氢根
HPO4
-1
溶解度表
OH-
H+
NH4+ K+
溶,挥 溶
Na+ 溶
Ba2+ 溶
Ca2+ 微
Mg2+ 不
Al3+?? 不
Mn2+ 不
Zn2+ 不
Fe2+ 不
Fe3+ 不
Cu2+ 不
NO3溶,挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
Cl溶,挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
初中常见原子团化合价

初中常见原子团化合价
哎呀呀,你说这初中常见原子团化合价,可真是让我头疼过一阵子呢!
先来说说那氢氧根(OH⁻)吧,它的化合价是-1 价。
这就好像是在一场拔河比赛中,氢氧根这边少了一个力量,所以整体就偏向了负数那边。
你想想,要是没有搞清楚它是-1 价,那在写化学方程式的时候,不就乱套啦?
再看看硝酸根(NO₃⁻),也是-1 价。
这硝酸根就像是一个团结的小队伍,它们紧紧抱在一起,展现出-1 价的力量。
还有硫酸根(SO₄²⁻),化合价为-2 价。
这好比是在天平上,硫酸根这边要重一些,所以就偏向了-2 价那一边。
碳酸根(CO₃²⁻)也是-2 价哟!它就像一个调皮的小家伙,总是在化学变化中起着重要的作用。
铵根(NH₄⁺)则是+1 价,它就像是一个勇敢的小战士,带着正一价的力量冲锋在前。
哎呀,我就问问你,要是不把这些原子团的化合价记住,那化学作业还能做得好吗?能考出好成绩吗?肯定不能啊!
所以说,这初中常见原子团化合价,咱们可得牢牢记住,这就像是记住好朋友的名字一样重要。
在做化学题的时候,它们就是我们的得力助手,要是记错了,那可就像是在战场上认错了战友,会出大问题的!
我的观点就是,一定要把这些常见原子团化合价刻在脑子里,这样才能在化学的世界里畅游无阻!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子序数
元素
氢
1
碳
6
氮
7
氧
8
氟
9
钠
11
镁
12
铝
13
硅
14
磷
15
硫
16
氯
17
钾
19
钙
20
锰
25
铁
26
铜
29
溴
35
氢氧根
硝酸根
高锰酸根
元素符号
H C N O F Na Mg Al Si P S Cl K Ca Mn Fe Cu Br OH NO3 MnO4
化合价
相对原 子质量
1
+1
12 +2 +4
-1
CH3COO
-1
CO3
-2
HCO3
-1
SO4
-2
HSO4
-1
SO3
-2
PO4
-3
HPO4
-2
常见化合物举例 NH4Cl KNO3 NaOH KMnO4 K2MnO4 KClO3 CH3COOH Na2CO3 NaHCO3 CuSO4 NaHSO4 Na2SO3 H3PO4
(NH4) 2HPO4
精品文档
14
-3 、+2、 +3、+4、+5
16 -2
19 -1
23 +1
24 +2
27 +3
28 +4
31
-3 、+3、 +5
32
-2 、+4、 +6
35.5 -1 、+1、 +5、+7
39 +1
40 +2
55
+2、+4、 +6、+7
56
+2、+3
63.5 +1、+2
80 -1
-1
-1
-1
精品文档
精品文档
精品文档
磷酸二氢根
H2PO4
-1
Ca(H2PO4) 2
精品文档
氯酸根
ClO3
-1
硫酸根
SO4
-2
碳酸根
CO3
-2
铵根
NH4
+1
初中化学常见的原子团(根)及其化合价
根的名称 铵根 硝酸根 氢氧根
高锰酸根 锰酸根 氯酸根 醋酸根 碳酸根
碳酸氢根 硫酸根
硫酸氢根 亚硫酸根
磷酸根 磷酸氢根
根的符号 常见化合价
NH4
+1
NO3
-1
OH
-1
MnO4
-1
MnO4
-2
ClO3
