(教师参考)高中化学 1.2.2 常见物质的检验课件2 苏教版必修1
合集下载
苏教版高中化学必修一课件1.2.2常见物质的检验
容易做到。 (3)排除干扰物的影响:需要检验的物质中如果有干扰物存 在,则需要选择试剂对干扰物进行排除;要注意加入不同 的鉴别试剂进行检验时,要排除前次加入试剂可能引起的 干扰。
探究:
1.向溶液中加入Ba(NO3)2溶液,产生白色沉淀,能否说明
溶液中一定有SO42-?试分析检验SO42-时应如何操作? 提示:不能。检验SO42-时,加入Ba(NO3)2溶液,CO32-也能 与Ba2+结合生成白色沉淀,故应先加入盐酸排除 CO32-存在的 可能。
稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42D.向待测液里加入过量的硝酸无现象,再加入硝酸银溶液, 若产生白色沉淀,则表明待测液中肯定含有Cl-
【解析】选D。钠元素的焰色反应为黄色,故用铂丝蘸取待 测液在火焰上灼烧,若火焰呈黄色,则表明待测液中肯定 含有Na+,A错;向待测液里加入过量的盐酸,若产生能使 澄清石灰水变浑浊的无色无味的气体为CO2,则表明待测液 中可能含有CO32-或HCO3-,B错;向待测液里加入BaCl2溶液, 若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,该
后其现象为:有气体放出;无变化;生成白色沉淀;生成红
褐色沉淀;先生成白色沉淀后溶解。
3.(2011·上海高一检测)鉴定NaCl的最佳方法是()
A.焰色反应呈黄色,加HNO3酸化的AgNO3有白色沉淀
B.焰色反应呈紫色,加盐酸酸化的AgNO3有白色沉淀 C.焰色反应呈黄色,加盐酸酸化的AgNO3有白色沉淀 D.焰色反应呈紫色,加HNO3酸化的AgNO3有白色沉淀 【解析】选A。钠的焰色反应呈黄色,氯离子的检验应用硝 酸酸化的AgNO3,AgNO3溶液不能用盐酸酸化,用盐酸酸化 会产生沉淀,无法用于Cl-的检验。
D.焰色反应是某些金属离子的性质
探究:
1.向溶液中加入Ba(NO3)2溶液,产生白色沉淀,能否说明
溶液中一定有SO42-?试分析检验SO42-时应如何操作? 提示:不能。检验SO42-时,加入Ba(NO3)2溶液,CO32-也能 与Ba2+结合生成白色沉淀,故应先加入盐酸排除 CO32-存在的 可能。
稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42D.向待测液里加入过量的硝酸无现象,再加入硝酸银溶液, 若产生白色沉淀,则表明待测液中肯定含有Cl-
【解析】选D。钠元素的焰色反应为黄色,故用铂丝蘸取待 测液在火焰上灼烧,若火焰呈黄色,则表明待测液中肯定 含有Na+,A错;向待测液里加入过量的盐酸,若产生能使 澄清石灰水变浑浊的无色无味的气体为CO2,则表明待测液 中可能含有CO32-或HCO3-,B错;向待测液里加入BaCl2溶液, 若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,该
后其现象为:有气体放出;无变化;生成白色沉淀;生成红
褐色沉淀;先生成白色沉淀后溶解。
3.(2011·上海高一检测)鉴定NaCl的最佳方法是()
A.焰色反应呈黄色,加HNO3酸化的AgNO3有白色沉淀
B.焰色反应呈紫色,加盐酸酸化的AgNO3有白色沉淀 C.焰色反应呈黄色,加盐酸酸化的AgNO3有白色沉淀 D.焰色反应呈紫色,加HNO3酸化的AgNO3有白色沉淀 【解析】选A。钠的焰色反应呈黄色,氯离子的检验应用硝 酸酸化的AgNO3,AgNO3溶液不能用盐酸酸化,用盐酸酸化 会产生沉淀,无法用于Cl-的检验。
D.焰色反应是某些金属离子的性质
原创基础课件-1.2.2 常见物质的检验(化学必修1)

(➁7)将N蘸H有3 浓➀放盐在将酸容粘的器有玻口湿璃,润棒变红放蓝色在石NH容蕊3+器试H口纸Cl,的=产玻_N生_璃H_4白_棒C_烟l__
4 、物质检验的一般步骤: (答题书写)
(1) 对试样进行外观观察:色、态、气味
(2)取少量试样于试管中:(不许原瓶操作)
固体则少量溶解,液体直接取少量
(3) (5)
3.常用检验: (1)H2 点燃有爆鸣声
(2) (3) (4) (5)
O2 H2O CO2 SO2
带火星的木条放入集气瓶,复燃
遇白色无水CuSO4变蓝(CuSO4 •5H2O)
通入澄清石灰水变浑浊的无味气体
a,通入澄清石灰水变浑浊的刺激性气味气体 b,使品红溶液褪色的气体
(6)丝绸,毛(蛋白质) 灼烧 有烧焦羽毛的气味
②醋酸铅或硫酸铜 产生黑色沉淀
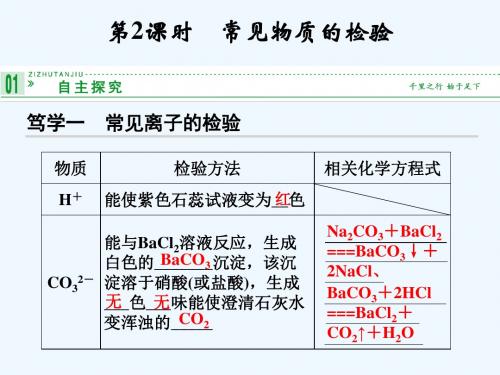
四.阳离子检验: 1.H+ ①紫色石蕊试剂或PH试纸 变红 2.Ag+ 加盐酸和稀HNO3 生成白色沉淀 3.Na+ 焰色反应 黄色火焰
K+ 焰色反应 紫色火焰(透过蓝色钴玻璃)
4.NH4+ 加NaOH溶液并加热,产生使湿润红色石蕊 试纸变蓝的刺激性气味气体
(NH4)2SO4 + 2NaOH == 2NH3 + Na2SO4 + 2H2O
5,Ba2+ 稀硫酸 产生白色沉淀 6,Mg2+ NaOH溶液 产生白色沉淀 7,Cu2+ 溶液蓝色,加NaOH溶液 蓝色絮状沉淀 8.Fe3+ NaOH溶液 生成红褐色沉淀Fe(OH)3
含有苏丹红
1.2.2 常见物质的检验
2004雅典奥运会匈牙利男子铁饼冠军法泽卡斯被取消金牌
1、酸碱指示剂 酸色
苏教版高中化学必修一课件1-2-2常见物质的检验

结论:取两支试管分别加入1mL 未知溶液,再各 加入1mL NaOH溶液,加热试管,将湿润的红色 石蕊试纸靠近试管口 ,能使红色石蕊试纸变蓝的 是(NH4)2SO4溶液,则另一瓶为K2SO4 溶液。
思考:如何鉴别Na2SO4和 K2SO4?
【实验4】取一根铂丝,放在酒精灯火焰上灼 烧至无色,用铂丝蘸取少量NaCl置于火焰上灼 烧,透过钴玻璃观察火焰的颜色。
•肯德基含苏丹红 新奥尔 良烤翅和烤鸡腿堡停售
我国30家企业88种食品被检出
含有苏丹红
1-2-2 常见物质的检验 一、常见物质的检验方法
1、物理方法:依据特殊的物理性质(如颜色、 气味、溶解性、溶解时的热效应等)进行观察、 分析、判断,得出结论。
2、化 学方法:一般包括取样、操作、现象、结 论四部分。
有NH4+。
【实验2】取两支试管分别
加入1mL NH4Cl、KCl溶液, 各滴加 3 滴AgNO3溶液和稀硝酸,观察实验现象。
实验现象:试管内有生白成色,沉再淀滴入几滴稀硝酸
后。
白色沉淀不溶解
反应方程式:
检验方法:取少量试样,滴加 几 滴AgNO3溶液, 产生不溶于稀硝酸的白色沉淀,即有Cl-。
【实验3】取两支试管分别加
加热
使湿润的红色石蕊试纸变蓝
盐酸、澄清 放出无色、无味的气体,且能
石灰水
使澄清石灰水变浑浊。
H+ OH- Na+
K+
紫色石蕊试液
变红
酚酞试液
变红
用铂丝蘸取样品在 酒精灯火焰上灼烧
同上,要透过 蓝色钴玻璃
火焰呈黄色 火焰呈紫色
入1mL (NH4)2SO4、K2SO4溶液,各滴加3滴 BaCl2溶液和稀盐酸,观察实验现象 。
思考:如何鉴别Na2SO4和 K2SO4?
【实验4】取一根铂丝,放在酒精灯火焰上灼 烧至无色,用铂丝蘸取少量NaCl置于火焰上灼 烧,透过钴玻璃观察火焰的颜色。
•肯德基含苏丹红 新奥尔 良烤翅和烤鸡腿堡停售
我国30家企业88种食品被检出
含有苏丹红
1-2-2 常见物质的检验 一、常见物质的检验方法
1、物理方法:依据特殊的物理性质(如颜色、 气味、溶解性、溶解时的热效应等)进行观察、 分析、判断,得出结论。
2、化 学方法:一般包括取样、操作、现象、结 论四部分。
有NH4+。
【实验2】取两支试管分别
加入1mL NH4Cl、KCl溶液, 各滴加 3 滴AgNO3溶液和稀硝酸,观察实验现象。
实验现象:试管内有生白成色,沉再淀滴入几滴稀硝酸
后。
白色沉淀不溶解
反应方程式:
检验方法:取少量试样,滴加 几 滴AgNO3溶液, 产生不溶于稀硝酸的白色沉淀,即有Cl-。
【实验3】取两支试管分别加
加热
使湿润的红色石蕊试纸变蓝
盐酸、澄清 放出无色、无味的气体,且能
石灰水
使澄清石灰水变浑浊。
H+ OH- Na+
K+
紫色石蕊试液
变红
酚酞试液
变红
用铂丝蘸取样品在 酒精灯火焰上灼烧
同上,要透过 蓝色钴玻璃
火焰呈黄色 火焰呈紫色
入1mL (NH4)2SO4、K2SO4溶液,各滴加3滴 BaCl2溶液和稀盐酸,观察实验现象 。
(教师参考)高中化学 1.2.2 常见物质的检验课件1 苏教版必修1

实验 取少量试液于NO试3管中,向试管加入稀HNO3,无现象,再加入AgNO3溶液,若生 步骤 成白色沉淀,证明该试样中含有Cl- 。
实验 反应生成不溶于稀硝酸的白色沉淀
现象
实验 NH4Cl和KCl中含有Cl-
结论
NH4Cl + AgNO3 = NH4NO3 + AgCl
实验
精选ppt
6
讨论与思考
红色石蕊试纸变蓝的气体,证明原溶液中含NH4+
精选ppt
11
现有四瓶失去标签的溶液,分别为NH4Cl溶液、 (NH4)2SO4溶液、KCl溶液、K2SO4溶液四种, 请设计实验方案加以鉴别。
若把NH4Cl溶液换成NaCl溶液,其他溶液不变, 又如何鉴别?
精选ppt
12
实验4 焰色反应 许多金属或他们的化合物在灼烧时都会使火 焰呈现特殊的颜色
(2)取少量废水倒入试管中,加入少量碳酸钠溶液,
振荡试管,若有无色气体生成,证明有酸。
精选ppt
2
鉴定离子
H+ 酸 性 溶 液
所用试剂 ①紫色石蕊试液
或蓝色石蕊试纸 ②pH试纸 ③活泼金属 ④碳酸盐
……
现象 ①变红
②pH<7 ③产生气体 ④产生能使澄清石灰 水变浑浊的无味气体
精选ppt
3
【活动与探究】
专题1 化学家眼中的物质世界 第二单元 研究物质的实验方法
第2课时 常见物质的检验
精选ppt
1
2006年3月,某中学初三年级的几位同学检测到某工 厂向横阳之江里排放的无色废水中含有酸。请你根据酸 的不同性质设计两个实验,检验上述废水经过处理后是 否还含有酸(每个实验要回答所用试剂及现象)。
(1)取少量废水倒入试管中,滴入几滴紫色石蕊试 液,振荡试管,若溶液显红色,证明有酸。
实验 反应生成不溶于稀硝酸的白色沉淀
现象
实验 NH4Cl和KCl中含有Cl-
结论
NH4Cl + AgNO3 = NH4NO3 + AgCl
实验
精选ppt
6
讨论与思考
红色石蕊试纸变蓝的气体,证明原溶液中含NH4+
精选ppt
11
现有四瓶失去标签的溶液,分别为NH4Cl溶液、 (NH4)2SO4溶液、KCl溶液、K2SO4溶液四种, 请设计实验方案加以鉴别。
若把NH4Cl溶液换成NaCl溶液,其他溶液不变, 又如何鉴别?
精选ppt
12
实验4 焰色反应 许多金属或他们的化合物在灼烧时都会使火 焰呈现特殊的颜色
(2)取少量废水倒入试管中,加入少量碳酸钠溶液,
振荡试管,若有无色气体生成,证明有酸。
精选ppt
2
鉴定离子
H+ 酸 性 溶 液
所用试剂 ①紫色石蕊试液
或蓝色石蕊试纸 ②pH试纸 ③活泼金属 ④碳酸盐
……
现象 ①变红
②pH<7 ③产生气体 ④产生能使澄清石灰 水变浑浊的无味气体
精选ppt
3
【活动与探究】
专题1 化学家眼中的物质世界 第二单元 研究物质的实验方法
第2课时 常见物质的检验
精选ppt
1
2006年3月,某中学初三年级的几位同学检测到某工 厂向横阳之江里排放的无色废水中含有酸。请你根据酸 的不同性质设计两个实验,检验上述废水经过处理后是 否还含有酸(每个实验要回答所用试剂及现象)。
(1)取少量废水倒入试管中,滴入几滴紫色石蕊试 液,振荡试管,若溶液显红色,证明有酸。
高一化学苏教版必修一1-2-2常见物质的检验.ppt
________________________________________________。
解析
CaCO3和BaCO3通常都是白色固体,难溶于水,易
溶于稀HNO3并放出CO2气体。步骤②的溶液中含有Ba2+ 和Cl-,还有稀HNO3。BaSO4和AgCl通常都是白色沉 淀,既不溶于水,也不溶于稀硝酸。
NH4
+
【体验 1】下列说法正确的是(
)。
A.某溶液与 NaOH 溶液共热,产生使湿润的蓝色石蕊试纸 变红色的气体,说明原溶液中存在 NH4
+
B.某溶液中加入 AgNO3 溶液时,产生白色沉淀,说明原溶 液中含有 Cl- C.某溶液中滴加稀硝酸无明显现象,再滴加 Ba(NO3)2 溶液
2- 出现白色沉淀,说明原溶液中有 SO4
【慎思1】 某溶液与氯化钡溶液反应,生成不溶于稀盐酸的白
色沉淀,则盐溶液中一定含有硫酸根离子吗?
提示 不一定。还可能为银离子。
【慎思2】 焰色反应是物理变化还是化学变化?在做钾及其化
合物的焰色反应的实验时,需要注意什么问题? 提示 焰色反应是物理变化;需要透过蓝色钴玻璃观察。
【慎思3】 实验室里有两瓶失去标签的试剂,它们分别是硫酸
KCl+AgNO3===AgCl↓+KNO3
K2CO3,现做如下实验:
①将部分粉末加入水中,振荡有白色沉淀生成。 ②向①的悬浊液中加入过量稀HNO3,白色沉淀消失,并 有气泡产生。 ③取少量②的溶液滴入稀硫酸,有白色沉淀生成。 ④另取少量②的溶液滴入稀AgN色粉末的组成成分(写名
称)_____________________________________________。 (2)写出实验步骤①②和③中有关化学反应的方程式 ________________________________________________, ________________________________________________, ________________________________________________, ________________________________________________, ________________________________________________,
2013-2014学年高一化学苏教版必修一:1.2.2 常见物质的检验 PPT课件1

后又做了如下分析,以确定这些离子是否大量存在。
①用pH试纸检测溶液的酸碱性,结果pH试纸显红色。 ②取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。 ③对②中所得的混合物充分静置后,取其澄清的液体用AgNO3溶液和稀 硝酸进行检验,结果又生成了白色沉淀。 请回答下列问题: (1)溶液中一定存在的离子是______________,一定不存在的离子是 ______________。 (2)上述实验操作中,有错误的操作是(填写序号)________。改正该错误 的方法是(要作较详细的说明)______________________________。
如果某溶液中同时存在SO42-和Cl-,应如何检验? [学生交流] 【提示】 (1)取少量溶液,向其中加入过量Ba(NO3)2。如果有白色沉淀, 说明溶液中含有SO42-。 (2)将上述体系过滤,得到滤液。 (3)再向滤液中滴入AgNO3溶液,有不溶于稀HNO3的白色沉淀生成,证明溶液 中有Cl-。 总之,一般先检验SO42-,然后除去SO42-,进一步检验验证溶液中Cl-的存 在。
【提示】 焰色反应的实验步骤可归纳为三烧:“灼烧―→蘸烧―→
洗烧”,其含义分别为: (1)灼烧:将铂丝放在酒精灯火焰里灼烧,直到与原来火焰颜色相同为 止。 (2)蘸烧:用铂丝蘸取欲检测的试液或试样,放在酒精灯外焰上灼烧, 观察火焰的颜色。 (3)洗烧:测试完毕,将铂丝用稀盐酸洗净,在外焰上灼烧到没有颜色 为止,以备下次再用。
为确定某溶液的离子组成,进行如下实验: 1. ①取少量溶液滴加BaCl2溶液,产生白色沉淀。 ②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水
变浑浊的气体;白色沉淀部分溶解。
③取上层清液继续滴加BaCl2溶液至无沉淀时,再滴加AgNO3溶液,产生白 色沉淀。 根据实验,以下推测不正确的是( A.一定有SO42-离 C.不能确定Cl-离子是否存 ) B.一定有CO32-离子 D.不能确定SO42-离子是否存在
苏教版高中化学必修一1.2.2 常见物质的检验

与盐酸反应,产生气体通入 有气体产生,澄清石灰
澄清石灰水
水变浑浊
硫酸盐(SO42-)
先加稀盐酸, 再加入 BaCl2溶液
氯化物 (Cl-) 稀HNO3酸化的AgNO3
生成白色沉淀,说明有 SO42-
生成不溶于稀硝酸的白色 沉淀
铵盐 (NH4+)
与碱混合加热用湿润的红色 石蕊试纸检验
若试纸变蓝,说明 含有NH4+
化学 · 必修1
1.2.2 常见物质的检验
常见物质的检验
如何鉴别真真假元宝?
创设情第景2 页
假元宝
真元宝
常见物质的检验
问题导第学3 页
据反映,滨海化工园区某工厂向周边一小河里排放的无色废水中含有 酸。请你根据酸的不同性质设计两个实验,检验上述废水经过处理后是 否还含有酸(每个实验要回答所用试剂及现象)。
交流讨第 1论0 页
常见物质的检验
观察实第验11 页
常见物质的检验
第 12 页
实验
SO42- (硫酸实盐验)3 的检验方法
取步少骤量试液于(N试H管4)2中SO,4和向K试2管SO内4溶加液稀各盐少酸量,,无各沉滴淀几生滴成稀,盐再酸加,入再各
BaCl2溶液,滴若几生滴成B白a色Cl沉2溶淀液,证明该试样中含有SO42-
常见物质的检验
观察实第验14 页
常见物质的检验
第 15 页
实验4 焰色反应 许多金属或他们的化合物在灼烧时都会使火焰呈现特殊的颜 色
钾 的 焰 色 反 应
常见物质的检验
焰色反应
第 16 页
常见物质的检验
焰色反应
第 17 页
实验操作:
除杂
一根铂丝,将铂丝在稀盐酸中蘸一下,然后在酒精灯火焰上灼烧至无色。 用灼烧后的铂丝蘸取少许待测物,火焰中灼烧观察到不同颜色的火焰 (K的焰色要透过钴玻璃观察)。
高一化学苏教版必修一1-2-2常见物质的检验 PPT课件 图文

自主探究
精要解读
实验探究
要点一 | 物质的检验
1.原则 物质的检验“三个原则”,即一看(颜色、状态)、二嗅(气 味)、三实验(加试剂)。
2.分类 根据实验时生成物所表现的现象不同,检验离子的方法可 归纳为三类: (1)生成气体,如NH4+、CO32-等离子的检验; (2)生成沉淀,如Cl-、SO42-等离子的检验;
实验探究
要点二 | 焰色反应
1.金属丝在使用前要清洗干净,一般用稀盐酸来清洗, 而不用稀硫酸来清洗,因为一般金属的硫酸盐熔沸点 比较高,难以使其挥发,容易对实验造成干扰。
2.观察钾元素的焰色要透过蓝色钴玻璃来观察,因为钾 盐中常混有钠离子而造成干扰。
自主探究
精要解读
实验探究
【例2】► 某物质灼烧时,焰色反应为黄色,下列判断正确的是
( )。
A.该物质一定是钠的化合物 B.该物质一定含钠元素
C.该物质一定是金属钠
D.该物质中不含钾元素
解析 焰色反应是某些金属元素的性质,焰色反应为黄色,
说明该物质中一定含钠元素,既可能是金属钠,也可能是钠
的化合物。但钾的焰色必须透过蓝色钴玻璃滤去黄光后才能
观察到,所以不能确定该物质中是否含有钾元素。
自主探究
精要解读
实验探究
解析 A 项中某溶液与 NaOH 溶液反应不可能产生使湿润的蓝 色石蕊试纸变红的气体(酸性气体);B 项中与 AgNO3 溶液反应 能产生白色沉淀的离子有 Cl-、CO23-、SO32-等多种;C 项中原 溶液中也可能有 SO32-、HSO-3 。 答案 D
自主探究
精要解读
2.操作步骤:将一根_铂__丝__,在酒精灯火焰上灼烧,若火焰 有颜色,可将铂丝在_稀__盐__酸__中蘸一下,再灼烧至无色。 用灼烧后的铂丝蘸取少许待测物,然后再在火焰中灼烧, 可观察到火焰的颜色。流程如下: 铂丝―灼―烧→与原来火焰颜色相同―蘸―取→样品―灼―烧→观察焰色
高一化学苏教版必修1(浙江专用)课件:专题1 化学家眼

(2)向(1)的滤液中加入足量的 NaOH 溶液,加热,产生能使湿润的红色石 蕊试纸变蓝的气体 1.12 L(已换算成标准状况,假定产生的气体全部逸出), 由此可以得出关于原溶液组成的正确结论是( )
实验现象
加入 BaCl2 溶液后 生成白色沉淀,沉淀 溶于稀盐酸,并放出 无色、无味气体
化学方程式(举一例) (1)BaCl2+Na2CO3
BaCO3↓+2NaCl
(2)BaCO3+2HCl BaCl2 +CO2↑+H2O
SO42-
BaCl2 溶 液、稀盐
酸
取少许溶液于试 管中,向其中加 入稀盐酸,再加 入 BaCl2 溶液
(2)检验 SO42-:向第二支试管中滴入几滴用盐酸酸化的 BaCl2 溶液。有 白色沉淀生成,说明成分中含有 SO42-。
如果被检验的物质可溶于水,一般要先配成溶液。另外,进行
检验的文字说明时,要按照实验操作→实验现象→实验结论的顺序来记录。
探究点一 探究点二
探究点二 离子存在的综合推断 1.从颜色推断。溶液如果是无色,则一定不存在有颜色的离子,如 Cu2+(蓝色)、MnO4- (紫色)等。 2.有阳必有阴。如题给信息规定的几种离子中,当推断出几种阳离子能 大量存在,那么该溶液中至少存在一种能大量存在的阴离子;同理,当推断溶 液中一定存在几种阴离子时,那么该溶液中至少存在一种能大量存在的阳 离子。 3.阴、阳离子必须能大量共存。某种离子如一定大量存在,则与之反应 的离子则一定不能大量存在。 4.电解质溶液中离子电荷守恒。即阳离子所带的正电荷之和等于阴离 子所带的负电荷之和。
探究点一 探究点二
【例题 2】某溶液中可能含有下列 6 种离子中的某几种:Cl-、SO42-、CO32-、 NH4+、Na+、K+。为确认溶液组成进行如下实验:
实验现象
加入 BaCl2 溶液后 生成白色沉淀,沉淀 溶于稀盐酸,并放出 无色、无味气体
化学方程式(举一例) (1)BaCl2+Na2CO3
BaCO3↓+2NaCl
(2)BaCO3+2HCl BaCl2 +CO2↑+H2O
SO42-
BaCl2 溶 液、稀盐
酸
取少许溶液于试 管中,向其中加 入稀盐酸,再加 入 BaCl2 溶液
(2)检验 SO42-:向第二支试管中滴入几滴用盐酸酸化的 BaCl2 溶液。有 白色沉淀生成,说明成分中含有 SO42-。
如果被检验的物质可溶于水,一般要先配成溶液。另外,进行
检验的文字说明时,要按照实验操作→实验现象→实验结论的顺序来记录。
探究点一 探究点二
探究点二 离子存在的综合推断 1.从颜色推断。溶液如果是无色,则一定不存在有颜色的离子,如 Cu2+(蓝色)、MnO4- (紫色)等。 2.有阳必有阴。如题给信息规定的几种离子中,当推断出几种阳离子能 大量存在,那么该溶液中至少存在一种能大量存在的阴离子;同理,当推断溶 液中一定存在几种阴离子时,那么该溶液中至少存在一种能大量存在的阳 离子。 3.阴、阳离子必须能大量共存。某种离子如一定大量存在,则与之反应 的离子则一定不能大量存在。 4.电解质溶液中离子电荷守恒。即阳离子所带的正电荷之和等于阴离 子所带的负电荷之和。
探究点一 探究点二
【例题 2】某溶液中可能含有下列 6 种离子中的某几种:Cl-、SO42-、CO32-、 NH4+、Na+、K+。为确认溶液组成进行如下实验:
高中化学 1_2_2 常见物质的检验课件 苏教版必修1 (2)

解析: B 项,试液滴加到红色的石蕊试纸,说明该溶液显碱性,不能说 明该溶液中含有 NH+4 ,验证 NH+4 是否存在的正确方法是将试液和 NaOH 溶液混 合加热,然后检验是否有能使湿润的红色石蕊试纸变蓝的气体产生,错误;C 项,如果溶液中含有 SO24-,也会产生相同的现象;D 选项中不能排除 SO32-的干 扰。
[自我诊断] 如何证明某溶液是NaHCO3溶液而不是Na2CO3溶液?
答案: 取溶液少许于试管中,加入 BaCl2 溶液无明显现象,再加入稀盐 酸,产生无色无味气体,该气体能使澄清的石灰水变浑浊,证明原溶液是
NaHCO3 溶液。
几种常见离子的检验
被检验的离子
所用试剂
实验操作或现象
NH+4
______N__a_O__H、溶红色液石蕊试纸 与 NaOH 溶液共热,产生能使湿 润的红色石蕊试纸_____的气体
变
Cl-
______A__g_N__O、3稀溶硝液酸 滴加 AgNO3 溶液,产生不溶于稀
硝酸的白色沉淀
SO24-
BaCl2
溶液、_________ 稀盐滴加酸BaCl2
溶液,产生不溶于稀盐
白色沉淀
酸的___________
[微点拨] (1)一种试剂可能与几种不同的离子反应产生相同的现象,检验离子时应注 意采取措施排除其他离子的干扰。 (2)能与碱反应产生使红色石蕊试纸变蓝的气体的离子只有 NH+4 。
3.实例:钠的焰色为黄色,钾的焰色为紫色(透过蓝色钴玻璃)。
[微点拨] (1)焰色反应属于物理现象,不属于化学变化。 (2)观察钾的颜色时必须要透过蓝色钴玻璃观察,因为钠的黄色火焰能够掩 盖钾的紫色火焰,蓝色玻璃可以滤掉黄光。
[自我诊断] 判断下列说法正误(正确的打“√”,错误的打“×”)。
苏教版高中化学必修1 1.2.2 常见物质的检验28(共28张PPT)

2- 3
、OH-均
可生成沉淀,Ba2+只与CO23-生成沉淀,故试剂的加入顺序为④①③,B正确。
【答案】 B
上一页
返回首页
下一页
2.下列关于物质检验的说法不正确的是 ( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有
SO24- B.观察钾元素焰色反应的操作是将铂丝放在稀盐酸中洗涤后灼烧至无色,
上一页
返回首页
下一页
【答案】(1)5种固体全部溶解,4支试管中得到无色溶液,1支试管中得到蓝 色溶液 CuSO4
(2)BaCl2+CuSO4===BaSO4↓+CuCl2 2NaOH+CuSO4===Cu(OH)2↓+Na2SO4 BaCl2 NaOH (3)分别另取少量未检出的溶液,向其中加入NaOH溶液并加热,若产生刺激 性气味的气体,说明该物质中是(NH4)2SO4,另一瓶为Na2SO4。
知
识
点
一
学
业
分
层
第 2 课时 常见物质的检验
测 评
知 识 点 二
上一页
返回首页
下一页
1.学会Cl-、SO24-、CO23-、NH+ 4 等离子的检验方法。(重点) 2.会用焰色反应检验金属或金属离子的存在。 3.能设计简单的实验方案,确定常见物质的组成成分。(重难点)
上一页
返回首页
下一页
物质检验的方法
【答案】 A
上一页
返回首页
下一页
2.有 5 瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水 硫酸铜。现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请填写下列空白:
(1)取适量固体试剂,分别加入 5 支试管中,加入适量蒸馏水,振荡试管,观察 到的现象是________________________________________________________,
2018-2019学年高中化学必修一(苏教版)课件:1.2.2常见物质的检验

目标导航
预习引导
一、探究离子检验法 活动与探究1 活动探究一 ①取两支试管,分别加入2 mL的NH4Cl和(NH4)2SO4溶液。 ②再各加入2 mL NaOH溶液。 ③分别加热两支试管,并将湿润的红色石蕊试纸靠近试管口,观察 试纸的颜色变化。 (1)实验现象: 。 (2)实验结论: 。 (3)实验原理:铵盐与强碱溶液在加热时发生下列反应: NH4Cl+NaOH—— (NH4)2SO4+2NaOH——
22-
目标导航
预习引导
解析:
证明三种离子的存在时,要利用三种离子的特征反应,如 CO3 能 够与 H+反应生成 CO2 气体,SO4 能够与 Ba2+反应生成不溶于酸的白 色沉淀 BaSO4,Cl-能够与 Ag+反应生成不溶于酸的白色沉淀 AgCl。 同时要注意由于用 Ag+检验 Cl-时,SO4 会干扰检验现象,故应先检验 SO 4 。
加入 NaOH 溶液,加热试 + + NaOH N H +OH 4 NH4 管,产生使湿润的红色 溶液 NH3↑+H2O 石蕊试纸变蓝的气体 BaCl2 加入稀盐酸,无现象,再 2SO4 溶液、 加入 BaCl2 溶液,生成白 稀盐酸 色沉淀 Ba2++SO4 BaSO4↓
2-
目标导航
预习引导
续表
22-
(3)Ba2+ SO4 BaSO4 (4)(NH4)2SO4+BaCl2 BaSO4↓+2NH4Cl K2SO4+BaCl2 BaSO4↓+2KCl
目标导航
预习引导
思考与交流 ①从以上三个活动探究的反应产物的角度考虑,我们可以把离 子的检验方法归纳为哪几种方法? 答案: 气体法和沉淀法。 ②离子检验的具体步骤是哪些?(解答步骤) 答案: 第一步:对样品外观进行观察,即观察被检验物质的状态、 颜色、气味等,初步判断物质可能含有的离子。 第二步:取少量试样(如果试样是固体,一般先配成溶液)放入容 器(如试管)中,根据要求在试样中加入已知成分和性质的试剂,观察 所发生的现象。 第三步:根据所观察到的现象进行分析、判断、作出结论。
1.2.2常见物质的检验课件(苏教版必修1)

察不到明显变化。试回答下列问题。
(1)A的化学式为______,G的化学式为______,判断理
由是___________________。
(2)写出其余几种物质的化学式。 B________,C_______,D________,E________, F_________。
【解析】由表格可知,A只和G反应而与其余物质均不反 应,七种物质中只有KCl满足此条件,所以A为KCl,则G 为AgNO3。G与E不反应,所以E为Ca(NO3)2;E与A、C、G 均不反应,可知C为MgCl2;MgCl2与A、B、E均不反应, 所以B为Na2SO4;B与E、F、G反应生成沉淀,所以F为
【解析】选B。A项点燃的木条在氧气中燃烧更旺,但在 N2、CO2中均会熄灭;B羊毛纤维灼烧时有烧焦羽毛的臭
味,而涤纶灼烧后的灰烬为黑色小颗粒,棉纤维灼烧几
乎没有灰烬残留;C项氯化钠、氯化铵中加入硝酸银溶 液均会产生白色沉淀,无法鉴别;D项食盐、白糖、味 精均能溶于水,所以用此法无法鉴别。
2.(2010·涪陵高一检测)某溶液中含有Ba2+、Cu2+、
4.为检验试管中少量白色晶体是否为铵盐,下列四位同 学分别设计了四种方案,其中最好的方案是( )
A.加入1 mL NaOH溶液,将湿润的蓝色石蕊试纸靠近试 管口
B.加入1 mL NaOH溶液,将干燥的红色石蕊试纸靠近试
管口 C.加入1 mL NaOH溶液,加热试管,将蓝色石蕊试纸靠 近试管口 D.加入1 mL NaOH溶液,加热试管,将湿润的pH试纸靠
近试管口
【解析】选D。检验NH4+要注意两点,一为加碱加热,二 为湿润的红色石蕊试纸变蓝。题中没有出现湿润的红色
石蕊试纸,所以用pH试纸也可以。
(1)A的化学式为______,G的化学式为______,判断理
由是___________________。
(2)写出其余几种物质的化学式。 B________,C_______,D________,E________, F_________。
【解析】由表格可知,A只和G反应而与其余物质均不反 应,七种物质中只有KCl满足此条件,所以A为KCl,则G 为AgNO3。G与E不反应,所以E为Ca(NO3)2;E与A、C、G 均不反应,可知C为MgCl2;MgCl2与A、B、E均不反应, 所以B为Na2SO4;B与E、F、G反应生成沉淀,所以F为
【解析】选B。A项点燃的木条在氧气中燃烧更旺,但在 N2、CO2中均会熄灭;B羊毛纤维灼烧时有烧焦羽毛的臭
味,而涤纶灼烧后的灰烬为黑色小颗粒,棉纤维灼烧几
乎没有灰烬残留;C项氯化钠、氯化铵中加入硝酸银溶 液均会产生白色沉淀,无法鉴别;D项食盐、白糖、味 精均能溶于水,所以用此法无法鉴别。
2.(2010·涪陵高一检测)某溶液中含有Ba2+、Cu2+、
4.为检验试管中少量白色晶体是否为铵盐,下列四位同 学分别设计了四种方案,其中最好的方案是( )
A.加入1 mL NaOH溶液,将湿润的蓝色石蕊试纸靠近试 管口
B.加入1 mL NaOH溶液,将干燥的红色石蕊试纸靠近试
管口 C.加入1 mL NaOH溶液,加热试管,将蓝色石蕊试纸靠 近试管口 D.加入1 mL NaOH溶液,加热试管,将湿润的pH试纸靠
近试管口
【解析】选D。检验NH4+要注意两点,一为加碱加热,二 为湿润的红色石蕊试纸变蓝。题中没有出现湿润的红色
石蕊试纸,所以用pH试纸也可以。
高中化学 1.2.2 常见物质的检验课件 苏教版必修1
的组成。 元素(yuán sù)分析仪
(1)用
测定物质中是否含C、H、O、N、S、Cl、Br
等元素; 红外光谱仪
(2)用
确定物质是否含有某些有机原子团;
原子(yuánzǐ)吸收光谱
(3)用
确定物质中含有哪些金属元素等。
第十一页,共35页。
1.检验 NH+ 4 时,能否用干燥的红色石蕊试纸? 答案:不能。NH3 遇水产生 OH-,才能使石蕊试纸变蓝。
4.用铂丝蘸取某溶液在酒精灯上灼烧,焰色反应为黄色,该 溶液一定不含钾元素吗? 答案:不一定。没有透过蓝色钴玻璃观察火焰颜色,不 能确定钾元素(yuán sù)的存在。
第十三页,共35页。
第十四页,共35页。
1.离子检验的方法分类 (1)生成沉淀。如中学实验室里检验 Cl-时,可加入用硝 酸酸化的硝酸银溶液,产生白色沉淀。 (2)生成气体。如检验 NH+ 4 、CO32-时,都采用此法。 (3)显示特殊颜色。如用酚酞试液检验 OH-。 (4)焰色反应。
第三十一页,共35页。
第三十二页,共35页。
点击此图片进入 课堂10分钟练习
第三十三页,共35页。
待检物质 或元素
检验方法
与CaCl2或BaCl2溶液反应产生沉淀;与稀 碳酸盐 盐酸反应,产生使澄清石灰水变浑浊的无
色、无味的气体
铵盐
与强碱(NaOH等)溶液混合加热,产生使湿 润的红色石蕊试纸变蓝色的气体
第三十四页,共35页。待检物质 或Fra bibliotek素检验方法
硫酸盐 先加足量稀盐酸无现象,再加BaCl2溶液产生 白色沉淀
氯化物 与AgNO3溶液反应,生成不溶于稀HNO3的白 色沉淀
钠元素 焰色反应——黄色
高中化学 1.2.2常见物质的检验课件 苏教版必修1

2.焰色反应 (1)原理:许多金属或它们的化合物在火焰上灼烧时都会使火焰
呈现 特殊的颜色。
(2)实例:钠元素的焰色为黄色;钾元素的焰色(透过蓝色钴玻 璃观察)为紫色。
(3)应用:检验 金属或金属离子 的存在。
3.仪器分析法
(1)概念:借助一些仪器来分析化学物质的组成。
(2)用元素分析仪测定物质中是否含有C、H、O、N、S、Br等
生成不溶于稀硝酸
的白 色沉淀
NH+ 4 NaOH 溶液(浓)
向未知溶液中加入 NaOH 浓溶液并加 热
生 成 有 刺激性 气
味、使湿润的红色
石蕊试纸变 蓝的气
体
设计三 做一做 明辨正误
1.用铂丝取待测物在酒精灯火焰上灼烧,鉴定钾元素存在。(×)
分析:观察钾的焰色反应必须透过蓝色的钴玻璃片。
2.每次焰色反应完毕,将铂丝用稀 H2SO4 洗净。( × ) 分析:每次焰色反应完毕,将铂丝用稀 HCl 洗净。
(2)实验证明,废液中确实存在上述三种离子。为回收 Cu、Ag 两种金属,实验时可以分别加入过量的________和________(填物质 名称),充分反应后,经过________(填实验操作名称),可得到 Cu 和 Ag。经过上述处理后的废液,进一步处理后即可以排放。
【解析】 (1)利用 Ag+和 Cl-反应生成不溶于硝酸或盐酸的 AgCl 白色沉淀来检验 Ag+。(2)回收 Cu、Ag 两种金属的流程如下:
3.能用焰色反应法、离子检验法设计简单实验方案,探究某 些常见物质的组成成分。
4.了解红外光谱等检验化学物质元素、组成的分析方法。
设计二 填一填 自主学习
一、物质检验的一般方法
1.依据
通常根据不同物质某些物理性质的特征将物质粗略地区分开 来,但更多的是根据不同 原子、分子或离子 的某些特征反应对
呈现 特殊的颜色。
(2)实例:钠元素的焰色为黄色;钾元素的焰色(透过蓝色钴玻 璃观察)为紫色。
(3)应用:检验 金属或金属离子 的存在。
3.仪器分析法
(1)概念:借助一些仪器来分析化学物质的组成。
(2)用元素分析仪测定物质中是否含有C、H、O、N、S、Br等
生成不溶于稀硝酸
的白 色沉淀
NH+ 4 NaOH 溶液(浓)
向未知溶液中加入 NaOH 浓溶液并加 热
生 成 有 刺激性 气
味、使湿润的红色
石蕊试纸变 蓝的气
体
设计三 做一做 明辨正误
1.用铂丝取待测物在酒精灯火焰上灼烧,鉴定钾元素存在。(×)
分析:观察钾的焰色反应必须透过蓝色的钴玻璃片。
2.每次焰色反应完毕,将铂丝用稀 H2SO4 洗净。( × ) 分析:每次焰色反应完毕,将铂丝用稀 HCl 洗净。
(2)实验证明,废液中确实存在上述三种离子。为回收 Cu、Ag 两种金属,实验时可以分别加入过量的________和________(填物质 名称),充分反应后,经过________(填实验操作名称),可得到 Cu 和 Ag。经过上述处理后的废液,进一步处理后即可以排放。
【解析】 (1)利用 Ag+和 Cl-反应生成不溶于硝酸或盐酸的 AgCl 白色沉淀来检验 Ag+。(2)回收 Cu、Ag 两种金属的流程如下:
3.能用焰色反应法、离子检验法设计简单实验方案,探究某 些常见物质的组成成分。
4.了解红外光谱等检验化学物质元素、组成的分析方法。
设计二 填一填 自主学习
一、物质检验的一般方法
1.依据
通常根据不同物质某些物理性质的特征将物质粗略地区分开 来,但更多的是根据不同 原子、分子或离子 的某些特征反应对
高中化学1.2.2《常见物质的检验》教案(苏教版必修1)

SO42—:滴加BaCl2溶液和稀盐酸,生成不溶于稀盐酸的白色沉淀。
[讨论]在完成相关实验时,都有一些值得注意的问题。请结合实验过程及相关元素化合物知识,分析下列问题:
实验1:试纸为何要润湿?实验2:为何要加稀硝酸?实验3:为什么要加稀盐酸?
[补充实验]碳酸钾、碳酸钠分别与硝酸银、氯化钡溶液反应,并分别滴加酸溶液。
年级高一科目____化学___主备教师__备课组长审核
课题内容
2-2-2常见物质的检验
时间
教学
资源
分析
课程标准
考试说明
省标:.学会Cl-、SO42-、CO32-、NH4+等离子检验的实验技能,能用焰色反应法、离子检验法设计简单的实验方案探究某些常见物质的组成成分。
说明:能对常见的物质进行检验和分析。初步了解常见物质的组成和结构的检测方法,并初步掌握其操作技能。
[实验]完成课本“活动与探究”栏目中的实验1-4
离子
试剂
现象
实验1
NH4+
实验2
Cl—
实验3
SO42—
各个实验中,依次观察到什么现象?出现这些现象的根本原因是什么?
个性化设计与改进
(明确NH4+、Cl—、SO42—等离子的检验所采用的试剂和方法等:
NH4+:加浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体;Cl—:滴加硝酸银溶液和稀硝酸,生成不溶于稀硝酸的白色沉淀;
教材分析
化学研究中,人们经常根据某些特征性质、特征反应、特征现象和特征条件对物质进行检验,以确定物质的组成。学生已经掌握了一定的物质检验知识,但不够系统化,需进一步化学研究中,总结和提炼。本节课选择Cl-、SO42-、CO32-、NH4+等常见离子作为检验对象,复习总结初中化学知识,学习常见物质的检验方法,介绍现代分析测试方法,从而让学生了解物质检验方法的多样性,进一步认识到物质检验过程中防止干扰的设计、多种物质检验方案的设计及操作技能。
[讨论]在完成相关实验时,都有一些值得注意的问题。请结合实验过程及相关元素化合物知识,分析下列问题:
实验1:试纸为何要润湿?实验2:为何要加稀硝酸?实验3:为什么要加稀盐酸?
[补充实验]碳酸钾、碳酸钠分别与硝酸银、氯化钡溶液反应,并分别滴加酸溶液。
年级高一科目____化学___主备教师__备课组长审核
课题内容
2-2-2常见物质的检验
时间
教学
资源
分析
课程标准
考试说明
省标:.学会Cl-、SO42-、CO32-、NH4+等离子检验的实验技能,能用焰色反应法、离子检验法设计简单的实验方案探究某些常见物质的组成成分。
说明:能对常见的物质进行检验和分析。初步了解常见物质的组成和结构的检测方法,并初步掌握其操作技能。
[实验]完成课本“活动与探究”栏目中的实验1-4
离子
试剂
现象
实验1
NH4+
实验2
Cl—
实验3
SO42—
各个实验中,依次观察到什么现象?出现这些现象的根本原因是什么?
个性化设计与改进
(明确NH4+、Cl—、SO42—等离子的检验所采用的试剂和方法等:
NH4+:加浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体;Cl—:滴加硝酸银溶液和稀硝酸,生成不溶于稀硝酸的白色沉淀;
教材分析
化学研究中,人们经常根据某些特征性质、特征反应、特征现象和特征条件对物质进行检验,以确定物质的组成。学生已经掌握了一定的物质检验知识,但不够系统化,需进一步化学研究中,总结和提炼。本节课选择Cl-、SO42-、CO32-、NH4+等常见离子作为检验对象,复习总结初中化学知识,学习常见物质的检验方法,介绍现代分析测试方法,从而让学生了解物质检验方法的多样性,进一步认识到物质检验过程中防止干扰的设计、多种物质检验方案的设计及操作技能。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 实验药品: (NH4)2SO4、K2SO4、稀HCl 和BaCl2
实验现象: 反应生成不溶于稀盐酸的白色沉淀
实验结论: 硫酸铵、硫酸钾中含有SO42-
化学方程式为(NH4)2SO4 + BaCl2==BaSO4 + 2NH4Cl
问题
稀盐酸的作用是什么?除杂不用稀硝酸
排除CO32-和SO32-的干扰
石蕊试纸
红石蕊试纸:遇碱性物质变蓝色 蓝石蕊试纸:遇酸性物质变红
淀粉试纸 碘 淀粉 蓝
(检验气体需先湿润)
精选ppt
5
实验1. 实验药品: NH4Cl、 (NH4)2SO4 、NaOH 实验现象: 有刺激性气味气体产生,且该气
体能使湿润的红石蕊试纸变蓝 实验结论: NH4Cl和(NH4)2SO4中含有NH4+ 原理(NH4)2SO4+2NaOH==Na2SO4+H2O+NH3
精选ppt
18
4、对下列实验过程的评价,正确的是
A.某固体中加入稀盐酸,产生了无色气体,证明该固 体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一 定含有SO42C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定 是酸溶液
√D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH,再加入AgNO3溶液,有白色沉淀,证明含Cl-
(CO32- )
产生气体通 入澄清石灰
水
灰水变浑浊
酸 用紫色石 紫色石蕊变红;PH试
(H+) 蕊试液; 用PH试纸
纸变色PH<7
碱 用紫色石 紫色石蕊变蓝;PH试
(OH-) 蕊试液; 纸变色PH>7
用PH试纸精选ppt
15
5. 仪器分析法:
• 用元素分析仪测定:物质中是否含C、H、O 、N、S等元素
精选ppt
19
课堂训练
• 以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
• A、先加入BaClC2溶液,再加入足量的HNO3溶液,产生了白色沉淀, 溶液中一定含有大量SO
• B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量
的CO
22-
4
• C、加入足量浓NaOH溶液,产生了3 带有强烈刺激性气味的气体。溶
• 实验方法:
取一根铂丝,放在酒精灯的火焰上灼烧
,若火焰有颜色,可将铂丝在稀盐酸中蘸一
下,再灼烧至无色。用灼烧后的铂丝蘸取少
许待测物,放入火焰中灼烧,就会观察到不
同颜色的火焰
除杂
记 Na 为黄色 K为紫色
精选ppt
12
精选ppt
13
精选ppt
14
一些物质的检验
待检物质 检验方法
现象
碳酸盐 与盐酸反应, 有气体产生,澄清石
专题1 化学家眼中的物质世界 第二单元 研究物质的实验方法
第2课时 常见物质的检验
精选ppt
1
请同学们:规范操作、注意安全
1、注意本桌、邻桌的易打玻璃仪器
2、不要用手接触药品,也不要随意 丢弃,更不能拿出实验室
3、酒精灯只能用火柴点燃,用灯帽 盖灭,不能拿、移燃着的酒精灯
4、对液体加热时,先均匀加热,且
用红外光谱仪来确定:物质中是否 含有某些有机基团
用原子吸收光谱确定:物质中是否含有哪些金 属元素
精选ppt
16
练习
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( B )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸
2、在允许加热的条件下,只用一种试剂就可以鉴别 硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是
精选ppt
6
NH4+的检验(铵盐)
取样(少量放在试管中)与碱混合加热,若 有刺激性气味的气体产生,且该气使湿润的红 色石蕊试纸变蓝,证明该试样中含有NH4+。
实验原理: NH4Cl+NaOH==Na Cl +H2O +NH3
NH3 使湿润的红石蕊试纸变__蓝___
精选ppt
7
实验2
• 实验
NH4Cl、KCl、稀HNO3和Ag NO 3
( A)
A.NaOH
B.Na2CO3
C.AgNO3
D.BaCl2
精选ppt
Hale Waihona Puke 173、某溶液中含有大量的Cl-、SO42-、OH-三种离子, 如果只取一次就能够将3种阴离子依次检验出来,
下列实验操作顺序正确的是:
① 滴加Mg(NO3)2溶液 ③ 滴加Ba(NO3)2
② 过滤 ④滴加AgNO3
①②③②④ 或 ③②①②④
试管口不能对着人。
精选ppt
2
警察在检查司机是否酒后开车
酒中的乙醇分 子可以使橙红 色的重铬酸钾 (k2Cr2O7)变 为绿色的硫酸 铬[Cr2(SO4)3]
精选ppt
3
常用的离子检验方法:
• 生成沉淀 ¨生成气体 ¨显现特殊颜色
精选ppt
4
常见试纸: PH试纸:即广范试纸。检 润验(定液量体时时)不能先湿
液中一定含有大量的NH
• D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉 淀。溶液中一定含有大量的Cl-
+
4
精选ppt
20
SO32-
硝酸 精选ppt
SO42-
10
SO42-的检验(硫酸盐)
取样并向内加稀HCl、BaCl2溶液,若生 成白色沉淀,证明该试样中含有SO42- 。
不能用稀硝酸,也不能用Ba(NO3)2
思考:
某白色晶体可能是硫酸铵,怎样证明?
精选ppt
11
4.焰色反应
根据焰色反应所呈现的特征焰色,可
检验金属或金属离子的存在
药品 实验现象:: 反应生成不溶于稀硝酸的白色沉淀
实验结论: NH4Cl和KCl中含有Cl-
问
稀硝酸的作用是什么?
题
排除CO32-的干扰
精选ppt
8
Cl-的检验(盐酸盐或称氯化物)
方法
取样并向内加稀HNO3和AgNO3溶液, 若生成白色沉淀,证明该试样中含有 Cl- 。
实验原理?
精选ppt
9
实验3
实验现象: 反应生成不溶于稀盐酸的白色沉淀
实验结论: 硫酸铵、硫酸钾中含有SO42-
化学方程式为(NH4)2SO4 + BaCl2==BaSO4 + 2NH4Cl
问题
稀盐酸的作用是什么?除杂不用稀硝酸
排除CO32-和SO32-的干扰
石蕊试纸
红石蕊试纸:遇碱性物质变蓝色 蓝石蕊试纸:遇酸性物质变红
淀粉试纸 碘 淀粉 蓝
(检验气体需先湿润)
精选ppt
5
实验1. 实验药品: NH4Cl、 (NH4)2SO4 、NaOH 实验现象: 有刺激性气味气体产生,且该气
体能使湿润的红石蕊试纸变蓝 实验结论: NH4Cl和(NH4)2SO4中含有NH4+ 原理(NH4)2SO4+2NaOH==Na2SO4+H2O+NH3
精选ppt
18
4、对下列实验过程的评价,正确的是
A.某固体中加入稀盐酸,产生了无色气体,证明该固 体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一 定含有SO42C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定 是酸溶液
√D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH,再加入AgNO3溶液,有白色沉淀,证明含Cl-
(CO32- )
产生气体通 入澄清石灰
水
灰水变浑浊
酸 用紫色石 紫色石蕊变红;PH试
(H+) 蕊试液; 用PH试纸
纸变色PH<7
碱 用紫色石 紫色石蕊变蓝;PH试
(OH-) 蕊试液; 纸变色PH>7
用PH试纸精选ppt
15
5. 仪器分析法:
• 用元素分析仪测定:物质中是否含C、H、O 、N、S等元素
精选ppt
19
课堂训练
• 以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
• A、先加入BaClC2溶液,再加入足量的HNO3溶液,产生了白色沉淀, 溶液中一定含有大量SO
• B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量
的CO
22-
4
• C、加入足量浓NaOH溶液,产生了3 带有强烈刺激性气味的气体。溶
• 实验方法:
取一根铂丝,放在酒精灯的火焰上灼烧
,若火焰有颜色,可将铂丝在稀盐酸中蘸一
下,再灼烧至无色。用灼烧后的铂丝蘸取少
许待测物,放入火焰中灼烧,就会观察到不
同颜色的火焰
除杂
记 Na 为黄色 K为紫色
精选ppt
12
精选ppt
13
精选ppt
14
一些物质的检验
待检物质 检验方法
现象
碳酸盐 与盐酸反应, 有气体产生,澄清石
专题1 化学家眼中的物质世界 第二单元 研究物质的实验方法
第2课时 常见物质的检验
精选ppt
1
请同学们:规范操作、注意安全
1、注意本桌、邻桌的易打玻璃仪器
2、不要用手接触药品,也不要随意 丢弃,更不能拿出实验室
3、酒精灯只能用火柴点燃,用灯帽 盖灭,不能拿、移燃着的酒精灯
4、对液体加热时,先均匀加热,且
用红外光谱仪来确定:物质中是否 含有某些有机基团
用原子吸收光谱确定:物质中是否含有哪些金 属元素
精选ppt
16
练习
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( B )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸
2、在允许加热的条件下,只用一种试剂就可以鉴别 硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是
精选ppt
6
NH4+的检验(铵盐)
取样(少量放在试管中)与碱混合加热,若 有刺激性气味的气体产生,且该气使湿润的红 色石蕊试纸变蓝,证明该试样中含有NH4+。
实验原理: NH4Cl+NaOH==Na Cl +H2O +NH3
NH3 使湿润的红石蕊试纸变__蓝___
精选ppt
7
实验2
• 实验
NH4Cl、KCl、稀HNO3和Ag NO 3
( A)
A.NaOH
B.Na2CO3
C.AgNO3
D.BaCl2
精选ppt
Hale Waihona Puke 173、某溶液中含有大量的Cl-、SO42-、OH-三种离子, 如果只取一次就能够将3种阴离子依次检验出来,
下列实验操作顺序正确的是:
① 滴加Mg(NO3)2溶液 ③ 滴加Ba(NO3)2
② 过滤 ④滴加AgNO3
①②③②④ 或 ③②①②④
试管口不能对着人。
精选ppt
2
警察在检查司机是否酒后开车
酒中的乙醇分 子可以使橙红 色的重铬酸钾 (k2Cr2O7)变 为绿色的硫酸 铬[Cr2(SO4)3]
精选ppt
3
常用的离子检验方法:
• 生成沉淀 ¨生成气体 ¨显现特殊颜色
精选ppt
4
常见试纸: PH试纸:即广范试纸。检 润验(定液量体时时)不能先湿
液中一定含有大量的NH
• D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉 淀。溶液中一定含有大量的Cl-
+
4
精选ppt
20
SO32-
硝酸 精选ppt
SO42-
10
SO42-的检验(硫酸盐)
取样并向内加稀HCl、BaCl2溶液,若生 成白色沉淀,证明该试样中含有SO42- 。
不能用稀硝酸,也不能用Ba(NO3)2
思考:
某白色晶体可能是硫酸铵,怎样证明?
精选ppt
11
4.焰色反应
根据焰色反应所呈现的特征焰色,可
检验金属或金属离子的存在
药品 实验现象:: 反应生成不溶于稀硝酸的白色沉淀
实验结论: NH4Cl和KCl中含有Cl-
问
稀硝酸的作用是什么?
题
排除CO32-的干扰
精选ppt
8
Cl-的检验(盐酸盐或称氯化物)
方法
取样并向内加稀HNO3和AgNO3溶液, 若生成白色沉淀,证明该试样中含有 Cl- 。
实验原理?
精选ppt
9
实验3
