幽门螺杆菌细胞毒素的鉴定方法
幽门螺杆菌鉴定操作步骤
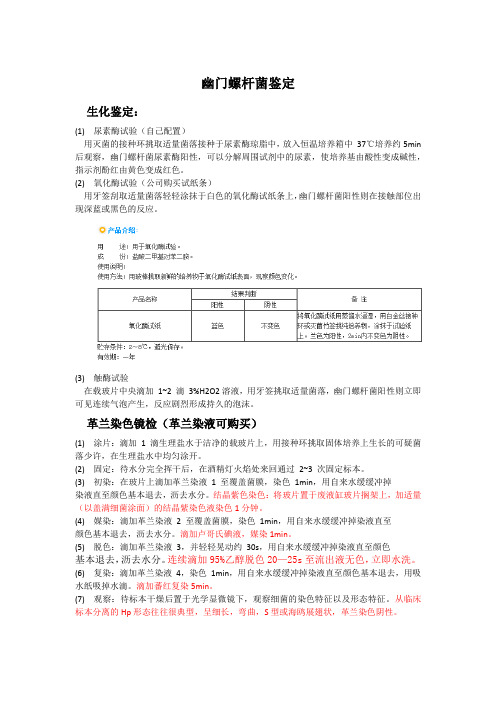
幽门螺杆菌鉴定生化鉴定:(1) 尿素酶试验(自己配置)用灭菌的接种环挑取适量菌落接种于尿素酶琼脂中,放入恒温培养箱中37℃培养约5min 后观察,幽门螺杆菌尿素酶阳性,可以分解周围试剂中的尿素,使培养基由酸性变成碱性,指示剂酚红由黄色变成红色。
(2) 氧化酶试验(公司购买试纸条)用牙签刮取适量菌落轻轻涂抹于白色的氧化酶试纸条上,幽门螺杆菌阳性则在接触部位出现深蓝或黑色的反应。
(3) 触酶试验在载玻片中央滴加1~2 滴3%H2O2溶液,用牙签挑取适量菌落,幽门螺杆菌阳性则立即可见连续气泡产生,反应剧烈形成持久的泡沫。
革兰染色镜检(革兰染液可购买)(1) 涂片:滴加1 滴生理盐水于洁净的载玻片上,用接种环挑取固体培养上生长的可疑菌落少许,在生理盐水中均匀涂开。
(2) 固定:待水分完全挥干后,在酒精灯火焰处来回通过2~3 次固定标本。
(3) 初染:在玻片上滴加革兰染液1 至覆盖菌膜,染色1min,用自来水缓缓冲掉染液直至颜色基本退去,沥去水分。
结晶紫色染色:将玻片置于废液缸玻片搁架上,加适量(以盖满细菌涂面)的结晶紫染色液染色1分钟。
(4) 媒染:滴加革兰染液2 至覆盖菌膜,染色1min,用自来水缓缓冲掉染液直至颜色基本退去,沥去水分。
滴加卢哥氏碘液,媒染1min。
(5) 脱色:滴加革兰染液3,并轻轻晃动约30s,用自来水缓缓冲掉染液直至颜色基本退去,沥去水分。
连续滴加95%乙醇脱色20—25s至流出液无色,立即水洗。
(6) 复染:滴加革兰染液4,染色1min,用自来水缓缓冲掉染液直至颜色基本退去,用吸水纸吸掉水滴。
滴加蕃红复染5min。
(7) 观察:待标本干燥后置于光学显微镜下,观察细菌的染色特征以及形态特征。
从临床标本分离的Hp形态往往很典型,呈细长,弯曲,S型或海鸥展翅状,革兰染色阴性。
研究认为当菌液的OD660=1 时,此时幽门螺杆菌菌液浓度约为108cfu/ml[19],测得实验所用原菌液OD660=1.12,粗略推算原菌液菌液浓度≈1.12×108 cfu/ml。
免疫印迹法检测幽门螺杆菌及其分型临床应用论文

中图分类号:R295.3 文献标识码:B
文章编号:1006-0979(2012)09-0076-02
幽门螺杆菌(Helicobacter Pylori Hp)是多种胃、十二指肠疾病 感染者血清中针对 Hp 特异抗原的抗体进行检测。我们应用免
的常见病因之一。因此,寻找具备致病性的 Hp 类型,并为临床 疫 印 迹 技 术 一 次 性 检 测 血 清 中 Hp 的 VacA 和 CagA 抗 体 谱 ,
72
B 亚单位等),用聚丙烯酰胺凝胶电泳按分子量大小依次分开,
胃溃疡(GU)
30
再将其转移至硝酸纤维膜上,与待检者血清反应,如果被检血清 中含有 Hp 抗体,会与印迹膜上相应 Hp 抗原结合,加入酶联第 二抗体和显色剂,Hp 抗原位置即出现显色带,与 Hp 抗体标准 区带比较,即可判断出何种 Hp 感染。
率明显高于Ⅱ型患者 (P<0.05);I 型在胃癌组中感染率高于慢性 较严重的消化道疾病。而 II 型 HP 可能多数引起慢性胃炎,很少
胃炎组(P<0.05)。
引起严重的消化道疾病。
3讨 论
Hp 感染率较高,但临床表现差异各异,其原因主要为 Hp 致
免疫分型是指采用免疫学方法,利用抗原抗体反映检测 Hp 病因子存在差异。近年来对 Hp 生物学特性、分型和致病作用等
* 西双版纳州人民医院(666100) 2012 年 3 月 20 日收稿
选择性根除 Hp 治疗提供理论依据。我们应用免疫印迹技术对 显示血清中其免疫活性蛋白区带,细胞毒素相关蛋白(CagA)与
患者进行 Hp 抗体谱检测,并依此对 Hp 进行免疫分型,探讨不 128、116 和 110KD 区带有关,空泡毒素 (VacA) 蛋白与 95 和
抗幽门螺杆菌细胞空泡毒素纳米抗体的制备及鉴定

Vol.7 No.1Feb. 2021生物化工Biological Chemical Engineering第 7 卷 第 1 期2021 年 2 月抗幽门螺杆菌细胞空泡毒素纳米抗体的制备及鉴定刘晓芳1,刘琼2,黄云祥1,钟引凤1,何庆华3,李燕萍3,涂追4,付金衡3*(1.南昌大学 生命科学学院,江西南昌 330031;2.中德联合研究院,江西南昌 330047; 3.食品科学与技术国家重点实验室,江西南昌 330047;4.南昌大学基础医学院,江西南昌 330031)摘 要:目的:获取抗幽门螺杆菌(Helicobacter pylori ,Hp)细胞空泡毒素纳米抗体并鉴定其结合和抑制幽门螺杆菌的能力。
方法:用灭活的幽门螺杆菌免疫羊驼,以重组蛋白VacA 为靶点,从噬菌体展示文库中筛选与幽门螺杆菌特异性结合的纳米抗体,间接phage-ELISA 鉴定结合重组蛋白VacA 能力并诱导其进行原核表达,鉴定其与Hp 的结合力。
结果:获得5×107库容的噬菌体文库,将筛选的OD 450值较高的纳米抗体HV2-36表达,经鉴定为可溶性蛋白且表达量为102.8 mg/L;所制备纳米抗体能特异性结合Hp 菌体蛋白,并对Hp 具有体外抑制作用。
结论:本研究成功获得抗幽门螺杆菌VacA 的纳米抗体。
关键词:VacA;幽门螺杆菌;纳米抗体;phage-ELISA 中图分类号:Q78 文献标识码:APreparation and Identification of Anti-VacA of Helicobacter pylori NanobodyLIU Xiaofang 1, LIU Qiong 2,HUANG Yunxiang 1, ZHONG Yinfeng 1, HE Qinghua 3, LI Yanping 3, TU Zhui 4, FU Jinheng 3*(1.Institute of Life Sciences, Nanchang University, Jiangxi Nanchang 330031;2.Sino-Germany Joint Research Institute,Nanchang University, Jiangxi Nanchang 330047;3.State Key Laboratory of Food Science and Technology, Nanchang University, Jiangxi Nanchang 330047;4.Department of Medical Microbiology, School of Medicine, Nanchang University, Jiangxi Nanchang 330031)Abstract: Objective: Obtained anti-Helicobacter pylori cell vacuolating toxin nanobody and identified the ability to bind and inhibit Helicobacter pylori. Methods: The alpaca was immunized with the lysate of inactivated Hp. Using the recombinant protein VacA as target molecule, nanobodies that can specifically recognize recombinant protein VacA were screened from phage displayed immune libraries. Indirect phage-ELISA identifies the ability to bind recombinant protein VacA and induces the expression of prokaryotic by IPTG, and indirect ELISA identifies the binding ability to Hp. Result: A 5×107 phage display library is obtained. The screened nanobodies HV2-36 with high OD 450 in phage-ELISA was recombinantly expressed. SDS-PAGE analysis showed that the production was soluble and the production yield was 102.8 mg/L. ELISA showed that production which was recombinantly expressed could bind to the lysate of Hp. The production could inhibit Hp in vitro. Conclusion: nanobodies against VacA of Helicobacter pylori are successfully obtained.Keywords: VacA; Helicobacter pylori ; nanobody; phage-ELISA幽门螺杆菌(Helicobacter pylori ,Hp)是一种慢性感染的病原菌,世界卫生组织将其定为Ⅰ类致 癌原[1],细胞空泡毒素(Vacuolating cytotoxin,Vac A)是Hp 产生并经自转运蛋白途径分泌到胞外的蛋白,在体外能使宿主细胞产生空泡变性,VacA 还可引起线粒体膜通透性改变,抑制细胞凋亡[2]、诱导肿瘤细胞自噬[3]、促进HCO 3-释放并降低胃酸分泌[4]等。
幽门螺杆菌的微生物学鉴定方法

幽门螺杆菌的微生物学鉴定方法
幽门螺杆菌的微生物学鉴定方法主要包括以下几种:
1. 直接染色镜检:通过快速尿素酶试验或组织切片染色等方法,观察幽门螺杆菌的存在和形态。
2. 分离培养:通过胃黏膜活检或粪便样本进行幽门螺杆菌的分离培养,以确定其存在和生长特性。
3. 尿素酶试验:通过检测尿素酶活性,判断是否存在幽门螺杆菌。
4. 血清学检测:通过检测患者血清中的幽门螺杆菌抗体,判断是否存在幽门螺杆菌感染。
5. 基因检测:通过检测幽门螺杆菌的特异性基因,如脲酶基因、空泡毒素基因等,判断是否存在幽门螺杆菌感染。
这些方法各有优缺点,需要根据具体情况选择适合的方法进行鉴定。
同时,在进行幽门螺杆菌鉴定时,还需要注意排除其他类似病原体的干扰,以保证结果的准确性和可靠性。
幽门螺旋杆菌感染4种检测方法的评价

幽门螺旋杆菌感染4种检测方法的评价幽门螺旋杆菌(Helicobacter pylori)是一种常见的胃炎和胃溃疡的致病菌。
准确诊断幽门螺旋杆菌感染对于选择合适的治疗方法非常重要。
目前常用的幽门螺旋杆菌感染的检测方法主要有尿素呼气试验、血清抗体检测、尿素酶联免疫吸附法(ELISA)和组织生物学检测方法。
以下是对这四种方法进行评价的1200字以上的论述。
尿素呼气试验是一种常用的非侵入性检测方法,它通过测定患者呼出的气体中的尿素分解产物(碳13标记的二氧化碳)来判断幽门螺旋杆菌感染。
尿素呼气试验的优点是方便、简单、无创伤,并且准确率较高。
尿素呼气试验也可以用于检测治疗后的幽门螺旋杆菌感染的复发情况。
然而,尿素呼气试验的缺点是费用较高,需要专门的设备,并且需要患者具备呼气能力,适用性有一定限制。
血清抗体检测是一种常用的血清学检测方法,通过检测患者血液中的幽门螺旋杆菌特异性抗体(如IgG、IgM、IgA)来判断感染情况。
血清抗体检测的优点是操作简单,样本采集方便,并且可以同时检测多种感染标志物。
同时,血清抗体检测也具有较好的经济性,可以广泛应用于各种医疗机构。
然而,血清抗体检测的缺点是检测结果受到感染时间的影响,在治疗后的一段时间内,血清抗体水平可能仍然高于正常范围,因此不适合用于评估治疗的效果。
尿素酶联免疫吸附法(ELISA)是一种常用的组织学检测方法,通过检测患者尿液样本中的幽门螺旋杆菌尿素酶(urease)的活性来判断感染情况。
尿素ELISA的优点是准确率高,敏感性和特异性较好,同时具有较好的经济性。
尿素ELISA还可以应用于监测治疗效果和判断幽门螺旋杆菌感染的恢复情况。
然而,尿素ELISA的缺点是需要患者具备尿液收集的能力,并且在一些特殊情况下,尿素ELISA的结果可能会受到其他物质的干扰。
组织生物学检测方法是一种常用的侵入性检测方法,通过对消化道黏膜组织取样进行组织学检查或者病原学培养来判断感染情况。
幽门螺杆菌感染的诊断方法及评价

幽门螺杆菌感染的诊断方法及评价徐采朴一、幽门螺杆菌的分离培养方法自从Marshall及Warren 1982年首先由人胃粘膜分离培养幽门螺杆菌(Hp)以来,因其结果呆靠,已被认为是诊断Hp的“金标准”,用以评估其他诊断方法及体外试验。
1.标本收集与转送胃镜活检胃窦粘膜后应立即在培养平板上划线分离或置于转送基内,及早(最好小时内)进行分离培养。
2.将2-3块胃粘膜组织放在灭菌河沙中,加菌水研磨,以1000r/min离心3分钟,取上液再以35r/min离心20分钟,除上液,取沉淀物接种于含脑心的改良 SKirrow血琼脂平板上,置微氧环境(5%O2,80%N2,8%CO2,7%H2),湿度较充分的玻缸中,370C培养3-4天。
对可疑菌落(0.5-1.0mm大小的扁平菌落)作涂片染色和4种生化试验。
凡革兰染色阴性、菌形典型、且角酶、氧化酶、尿素酶等试验吴现阳性,而马尿酸钠水解试验吴阴性者,确诊为Hp。
凡7天培养仍无可疑菌落生长者为阴性。
3.Hp分离培养法是诊断研究的一基基本技术,但由于技术要求高、操作繁琐,时间长且阳性率不很高,敏感性70-92%,特异性100%,有胃镜取材之苦,故不列为临床诊断常规,而作为评价新的诊断方法、药物根除效果及体外筛检抗菌药物之用(体外药物敏感试验)。
二、组织学检查方法组织学检查亦被认为是诊断Hp的“金标准”,其敏感性93-99%,特异性96-99%,常用方法有:1.Warthin Starry 银染色法被认为是经典的方法,Hp呈黄色,菌体由于有银沉着而显增大,容易识别,敏感性及特异性均高,达95%左右,但技术度要求高,操作繁琐,价格刘而费时,有被取代之趋。
2.改良Giemsa染色法组织切片脱蜡,充分复水后,直接入2%Giemsa染液中30分钟后洗去染液,用100%乙醇脱水。
Hp呈紫红色,形态清晰易于辨认,效果与银染相似,甚至更好,并且操作简便,价廉省时,易于一般医院普及。
幽门螺旋杆菌金标法

幽门螺旋杆菌金标法一、幽门螺旋杆菌简介幽门螺旋杆菌(Helicobacter pylori,HP)是一种革兰氏阴性菌,属于螺旋菌科。
它存在于人类胃黏膜表面,并与慢性胃炎、消化性溃疡、胃癌等多种胃部疾病有着密切的关系。
二、金标法原理金标法是一种常用的HP检测方法,也被称为尿素酶快速测定法(urease rapid test)。
其原理是基于HP细菌特有的尿素酶,该酶可以将尿素分解为二氧化碳和氨。
金标试剂中含有一种指示剂,当尿素被分解后产生的氨使指示剂变色,从而可以判断样本中是否存在HP 细菌。
三、金标法操作步骤1. 准备样本:取得患者的胃黏膜组织或呼出空气样本。
2. 打开试剂盒:将试剂盒从密封袋中取出,打开包装。
3. 取样:使用采样棒或吸管等工具取得样本。
4. 滴加样本:将采集的样本滴在试剂盒上。
5. 等待反应:等待约10分钟,观察试剂盒上的指示剂是否变色。
6. 判断结果:根据指示剂颜色变化判断样本中是否存在HP细菌。
四、金标法优缺点1. 优点:(1)操作简便,快速方便;(2)对患者无创伤,不需要进行胃镜检查;(3)准确率较高,可作为初步筛查方法。
2. 缺点:(1)金标法只能检测到HP的存在与否,不能确定感染程度;(2)可能会出现假阴性或假阳性结果;(3)金标试剂需要保存在低温下,否则易失效。
五、金标法应用范围金标法适用于初步筛查HP感染患者,特别是对于不能进行胃镜检查的患者。
同时,该方法也可以用于评估治疗效果和复发情况。
六、注意事项1. 采样前应告知患者相关注意事项,并征得其同意。
2. 采集样本时要避免污染和误差。
3. 操作过程中要遵守严格的消毒规范。
4. 金标试剂要保存在低温下,不要暴露在阳光下和高温环境中。
七、总结金标法是一种简便快速的HP检测方法,可以作为初步筛查方法。
但该方法也存在一定的局限性,如不能确定感染程度和可能出现假阴性或假阳性结果等。
因此,在使用该方法时需要注意操作规范,同时结合其他检测手段进行综合分析和诊断。
三种检测幽门螺杆菌感染的方法对比分析

三种检测幽门螺杆菌感染的方法对比分析目的:比较分析13C-尿素呼气试验(13C-UBT)、快速尿素酶试验(RUT)和病理组织学检测幽门螺杆菌感染的效果,探讨13C-尿素呼气试验诊断幽门螺杆菌感染的临床应用价值。
方法:对256例胃镜检查证实为消化性溃疡患者同时行13C-尿素呼气试验、快速尿素酶试验和病理组织学三种方法进行幽门螺杆菌感染情况检测。
分别计算其特异性和敏感性。
结果:与13C-尿素呼气试验比较,快速尿素酶试验的敏感性及特异性分别为95%、75%,病理组织学的敏感性为95%,特异性为75%。
各组间比较,差异无统计学意义(P>0.05)。
结论:13C-尿素呼气试验敏感性、特异性均高,具有无侵袭性、无创伤、无痛苦、简便快速等优点,可作为诊断Hp感染及评估Hp治疗效果的首选方法。
尤其适合孕妇、儿童及不宜胃镜活检患者,有较好的临床应用价值。
标签:幽门螺杆菌;13C-尿素呼气试验;快速尿素酶试验;病理组织学幽门螺杆菌(licobacter pylori,Hp)是一种微需氧、螺旋状、有鞭毛、嗜银染色革兰氏阴性杆菌,是慢性胃炎、消化性溃疡重要病因,可致萎缩性胃炎甚至胃癌。
被世界卫生组织列为一类生物致癌因子[1]。
选择一种患者易接受的简便方法检测Hp感染,观察Hp根治效果,以更好地指导临床治疗,减少与Hp 相关性疾病的发生、发展,显得尤为重要。
2011年10月笔者所在科室引进13C-尿素呼气试验的相关设备、技术,并开始应用于临床诊断。
2012年10月-2014年2月对256例因上腹不适等症状来笔者所在医院就诊行胃镜检查证实为消化性溃疡患者同时进行了13C-UBT、RUT和病理组织学检测Hp,对三种方法检测Hp的特异性和敏感性进行分析,探讨13C-UBT在诊断幽门螺杆感染临床应用价值如下。
现报道如下。
1 资料与方法1.1 一般资料选取2012年10月-2014年2月因上腹不适等症状来笔者所在医院就诊行胃镜检查证实为消化性溃疡患者256例。
幽门螺杆菌的实验室检查方法及优缺点

幽门螺杆菌的实验室检查方法及优缺点要检测病人胃内存在的幽门螺杆菌,一般常采用抽血采样、胃镜采样和呼气采样三种检测方法。
1.抽血采样检测:即采用抽血的方法检测血清中幽门螺杆菌的抗体水平。
因为受到幽门螺杆菌感染后,可在人体内产生相应的抗体,使检测结果呈现阳性,但是一般需要数月半载才呈阳性,因而幽门螺杆菌感染初期作该项检测时,检测结果常常会出现假阴性,从而使患者失去治疗的最佳时机。
此外,由于幽门螺杆菌即使被根除。
但该抗体下降缓慢,患者往往需要1—2年才能转阴,这样必然使治愈者长期背着“阳性”的黑锅而接受着多余的治疗。
2.胃镜采样检测:可在患者需做胃镜检查时“搭车” 采样,在活检采样时一起作检查。
检测是否有幽门螺杆菌。
如果为阳性,即可确诊幽门螺杆菌感染阳性。
为了给患者制定合适的治疗方案,有时还可加做培养和药物敏感试验。
胃镜下采样后还可采用聚合酶链反应严CR)检测,这种方法灵敏度较高,结果也比较可靠;也可做快速尿素酶检测,该方法简便快速,但由于观察时间过短或某些因素的影响导致结果不够可靠。
胃镜采样还存在下列问题:患者需要经受插镜之苦,若幽门螺杆菌呈灶性分布易导致漏诊(漏诊率达10%左右)。
但凭借医生丰富的操作经验和正确采样,可降低其漏诊率。
3.呼气采样检测:即尿素[14C]呼气试验,14C-呼气试验是近年发展起来的非侵入性的HP重要检查方法。
HP具有高活性的尿素酶可分解尿素产生NH3和CO2,当口服一定量的14C -尿素后,如胃有HP感染,示踪剂尿素被HP 所产生的尿素酶分解,14C以14CO2形式通过呼气排除,14CO2可被液闪仪探测到,从而可诊断有无HP感染。
敏感性和特异性在95%以上,被国内外学者公认为诊断和追踪HP效果的非创伤性可靠标准。
14C -呼气试验方法简单,口服14C-尿素胶囊15分钟后,对准呼气卡吹气约2分钟,检测呼吸卡计数即可得出结果。
计数/分钟>100即为阳性。
14C-呼气试验检测的敏感性为98.04%,准确性为97.78%,特异性为100%。
幽门螺旋杆菌的鉴定依据

幽门螺旋杆菌的鉴定依据
幽门螺旋杆菌(Helicobacter pylori,Hp)的鉴定主要依据以下几个方面:
1. 形态学特征:幽门螺旋杆菌是一种革兰氏阴性螺旋形细菌,具有特殊的形态学特征。
在显微镜下,它们呈现出螺旋状的外观。
2. 培养特性:幽门螺旋杆菌可以在特定的培养基上进行培养。
常用的培养基包括含有抗生素的选择性培养基,如哥伦比亚琼脂或Skirrow 琼脂。
这些培养基可以抑制其他细菌的生长,而幽门螺旋杆菌可以在其中生长。
3. 生化反应:幽门螺旋杆菌具有一些特定的生化特性。
例如,它们可以产生尿素酶,将尿素分解为氨和二氧化碳。
这一特性可以通过尿素呼气试验或尿素酶试验进行检测。
4. 分子生物学技术:现代分子生物学技术如 PCR(聚合酶链式反应)和核酸测序可以用于鉴定幽门螺旋杆菌。
这些技术可以检测和分析幽门螺旋杆菌特有的基因序列,从而确认其存在。
5. 免疫学检测:通过检测血液中的幽门螺旋杆菌抗体,可以间接判断是否感染了幽门螺旋杆菌。
这种方法通常用于大规模筛查或流行病学研究。
综合使用以上方法可以对幽门螺旋杆菌进行准确的鉴定。
其中,培养和分子生物学技术是确诊幽门螺旋杆菌感染的金标准。
需要注意的是,幽门螺旋杆菌的鉴定应该由专业的医疗机构或实验室进行,以确保准确性和可靠性。
如果有相关症状或怀疑感染了幽门螺旋杆菌,建议及时咨询医生并接受专业的检查和诊断。
幽门螺旋杆菌检测方法和治疗

幽门螺旋杆菌检测方法和治疗幽门螺旋杆菌(Helicobacter pylori)是一种常见的细菌,在人类胃部定居并感染,被认为是引起许多胃疾病的主要原因之一,如慢性胃炎、消化性溃疡和胃癌。
因此,检测和治疗幽门螺旋杆菌感染至关重要。
1.尿素呼气试验(UBT):这是一种常用的检测方法。
它通过让患者饮用含有尿素的溶液,并在呼气中检测碳14或碳13来评估是否存在幽门螺旋杆菌感染。
如果幽门螺旋杆菌存在,它会分解尿素并产生CO2,因此可以检测到呼气中的标记物。
2.血清学检测:这是通过检测患者血液中的特定抗体来评估是否感染幽门螺旋杆菌。
这种方法虽然简单,但无法区分当前感染和已经治愈的旧感染。
3.粪便检测:这种方法通过检测粪便中的幽门螺旋杆菌抗原来评估感染情况。
粪便样本可以在家中收集,然后送到实验室进行检测。
这种方法的优势在于非侵入性,不需要胃镜检查。
4.组织生物学检测:这种检测方法通常需要通过胃镜获取胃组织样本,并在实验室中进行细菌培养或组织学检测,以确定是否存在幽门螺旋杆菌感染。
虽然这种方法比较准确,但它是一种侵入性的检测方式,因此具有一定的风险和不便。
一旦确诊了幽门螺旋杆菌感染,即可采取相应的治疗方法。
目前,常用的治疗方案通常包括抗生素和质子泵抑制剂(PPI)的联合使用,以消灭幽门螺旋杆菌感染并减轻相关症状。
常见的抗生素用于治疗幽门螺旋杆菌感染的药物包括克拉霉素、阿莫西林、甲硝唑和四环素等。
质子泵抑制剂通常用于减少胃酸分泌,以提高抗生素的疗效。
治疗时间通常为7到14天不等,具体应根据医生的建议来确定。
尽管联合治疗方案被广泛使用,但由于幽门螺旋杆菌对抗生素的耐药性的增加,治疗的成功率正在下降。
因此,治疗幽门螺旋杆菌感染的个体化方案变得越来越重要。
根据患者的个体情况和耐药性,医生可能需要根据具体情况调整治疗方案。
总之,及早检测和治疗幽门螺旋杆菌感染对预防和治疗相关胃疾病至关重要。
选择合适的检测方法,并根据医生的指导进行个体化的治疗,可以帮助患者彻底清除幽门螺旋杆菌,并降低相关胃疾病的风险。
幽门螺杆菌抗体测定金标法

金标法(Gold标准)通常用于评估一种新的诊断方法的准确性。
在幽门螺杆菌抗体测定中,金标准法可能指的是胃镜检查结合组织活检以确认是否感染了幽门螺杆菌。
这是因为目前认为胃镜检查结合组织活检是检测幽门螺杆菌感染最可靠的方法。
具体来说,金标准法在幽门螺杆菌感染检测中的应用可能如下:
1. 胃镜检查:通过胃镜可以直接观察胃黏膜情况,并进行组织活检以获取组织标本。
在胃镜检查时,医生可以获取胃黏膜组织标本,用于后续的幽门螺杆菌检测。
2. 组织活检:通过对胃黏膜组织标本的病理学检查,可以确定是否存在幽门螺杆菌感染。
这种方法被认为是检测幽门螺杆菌感染最为可靠的手段,因此可以作为金标准法来评估其他检测方法的准确性。
在进行幽门螺杆菌抗体测定时,可以将其结果与胃镜检查结合组织活检结果进行比对,以评估抗体测定方法的准确性和可靠性。
若抗体测定方法的结果与组织活检结果一致,则说明该抗体测定方法具有较高的准确性,可以作为一种替代或辅助的检测手段。
幽门螺杆菌以及临床检验方法

幽门螺杆菌以及临床检验方法幽门螺杆菌,简称Hp,是一种单极、多鞭毛、末端钝圆、螺旋形弯曲的细菌。
长2.5~4.0μm,宽0.5~1.0μm。
在胃粘膜上皮细胞表面常呈典型的螺旋状或弧形。
被幽门螺杆菌感染的患者常出现下列症状:反酸、烧心以及胃痛、口臭,或者引起慢性胃炎。
本研究即和大家探讨一下幽门螺杆菌以及其临床检验方法。
标签:幽门螺杆菌临床检验自1983年分离出幽门螺杆菌(Hp )以来,目前认为Hp 与消化性溃疡、慢性胃炎、胃癌及粘膜相关淋巴组织淋巴瘤的发生密切相关。
所以Hp 感染的准确诊断在临床工作中显得尤其重要。
目前Hp 感染的诊断方法分为内窥镜依赖性检查方法和非内窥镜依赖性检查方法,但每种检查方法各有优点及不足。
1 幽门螺杆菌的介绍电子显微镜下,菌体的一端可伸出2~6条带鞘的鞭毛。
在分裂时,两端均可见鞭毛。
鞭毛长约为菌体1~1.5倍。
粗约为30nm。
鞭毛的顶端有时可见一球状物,实为鞘的延伸物。
每一鞭毛根部均可见一个圆球状根基伸入菌体顶端细胞壁内侧。
在其内侧尚有一电子密度降低区域。
鞭毛在运动中起推进器作用,在定居过程中起抛锚作用。
许多固体培养基可作幽门螺杆菌分离培养的基础培养基,布氏琼脂使用较多,但需加用适量全血或胎牛血清作为补充物方能生长。
在胃粘膜上皮细胞表面常呈典型的螺旋状或弧形。
在固体培养基上生长时,除典型的形态外,有时可出现杆状或圆球状。
Hp是微需氧菌,环境氧要求5~8%,在大气或绝对厌氧环境下不能生长。
许多固体培养基可作Hp分离培养的基础培养基,布氏琼脂使用较多,但需加用适量全血或胎牛血清作为补充物方能生长。
常以万古霉素、TMP、两性霉素B等组成抑菌剂防止杂菌生长。
2 幽门螺杆菌的检验方法幽门螺旋杆菌感染的检查方法很多,主要包括细菌的直接检查、尿毒酶活性测定、免疫学检测等方法。
2.1.直接检查细菌指通过胃镜检查钳取胃粘膜(多为胃窦粘膜)作直接涂片、染色,组织切片染色及细菌培养来检测幽门螺旋杆菌。
幽门螺旋杆菌 干化学法

幽门螺旋杆菌干化学法幽门螺旋杆菌(Helicobacter pylori)是一种以幽门为主要定植部位的革兰氏阴性螺旋状菌。
它广泛存在于人类胃黏膜中,被认为是导致胃炎、胃溃疡和胃癌的主要病因之一。
幽门螺旋杆菌的检测和治疗一直是临床上的重要问题。
在幽门螺旋杆菌的检测方法中,干化学法是一种常用且可靠的方法。
干化学法是一种利用化学试剂直接与幽门螺旋杆菌产生反应的检测方法。
这种方法主要基于幽门螺旋杆菌内的尿素酶活性。
幽门螺旋杆菌内的尿素酶可以将尿素分解为氨和二氧化碳。
干化学法通过检测氨的释放来判断是否存在幽门螺旋杆菌。
具体操作时,将含有尿素和指示剂的试纸片置于病人采集的呼气气体中,如果存在幽门螺旋杆菌,氨会与试纸片上的化学试剂发生反应,使试纸片变色。
干化学法的优点之一是操作简便,不需要复杂的设备和技术。
只需将试纸片放置在呼气气体中,即可进行检测。
另外,干化学法的结果可以在短时间内得到,通常只需几分钟即可判断是否存在幽门螺旋杆菌。
这对于临床诊断来说非常重要,可以提高检测效率和准确性。
干化学法的准确性也得到了广泛的验证和应用。
研究表明,干化学法的敏感性和特异性分别达到了90%以上。
这意味着在幽门螺旋杆菌感染的患者中,有90%以上的患者可以被正确地检测出来。
同时,干化学法对其他细菌的干扰较小,具有较高的特异性。
这使得干化学法成为一种可靠的幽门螺旋杆菌检测方法。
在临床上,干化学法被广泛应用于幽门螺旋杆菌感染的筛查和治疗效果的评估。
通过干化学法可以快速、准确地判断患者是否感染了幽门螺旋杆菌,并可在治疗过程中监测幽门螺旋杆菌的清除情况。
这对于选择合适的治疗方案和评估治疗效果具有重要意义。
然而,干化学法也存在一些局限性。
首先,干化学法只能判断幽门螺旋杆菌的存在与否,无法提供有关感染程度和病情严重程度的信息。
其次,干化学法对于未定植在幽门处的幽门螺旋杆菌的检测效果较差。
因此,在应用干化学法进行幽门螺旋杆菌检测时,需要结合临床症状和其他检测方法进行综合分析。
如何检测幽门螺杆菌的方法

如何检测幽门螺杆菌的方法幽门螺杆菌是一种常见的胃部细菌,它可以引起胃炎、胃溃疡甚至胃癌等疾病。
因此,及早检测并治疗幽门螺杆菌感染对于胃部健康至关重要。
那么,如何检测幽门螺杆菌呢?接下来,我们将介绍几种常见的检测方法。
首先,最常见的方法是呼气幽门螺杆菌检测。
这种方法通过让患者饮用一种特殊的标记物,然后在一定时间内呼出气体进行检测,从而判断是否感染了幽门螺杆菌。
这种方法简单、无创伤且准确度较高,因此被广泛应用于临床检测中。
其次,还有一种常见的方法是幽门螺杆菌抗体检测。
这种方法通过检测患者血液中的抗体水平来判断是否感染了幽门螺杆菌。
虽然这种方法简单易行,但是需要注意的是,抗体检测结果可能会受到其他因素的影响,因此在临床应用中需要综合考虑其他检测方法的结果。
此外,幽门螺杆菌的快速尿素酶试验也是一种常见的检测方法。
这种方法通过在患者胃内放置一种含有尿素和标记物的胶囊,然后通过检测呼出气体中的标记物来判断是否感染了幽门螺杆菌。
这种方法操作简单,结果快速,但是需要注意的是,患者需要在检测前一段时间内停止使用抗生素和胃药,以避免影响检测结果。
最后,还有一种常见的方法是胃镜检查。
这种方法通过在患者胃内放置一根细长的镜子,然后直接观察胃黏膜上是否存在幽门螺杆菌感染。
虽然这种方法准确度较高,但是需要进行内镜检查,对患者来说可能会有一定的不适感。
综上所述,幽门螺杆菌的检测方法有呼气幽门螺杆菌检测、幽门螺杆菌抗体检测、快速尿素酶试验和胃镜检查等几种常见方法。
在实际应用中,我们可以根据患者的具体情况和临床需要选择合适的检测方法。
通过及早检测幽门螺杆菌感染,可以帮助患者及时接受治疗,保护胃部健康。
希望本文介绍的方法能够对大家有所帮助。
幽门螺杆菌培养及鉴定标准操作规程
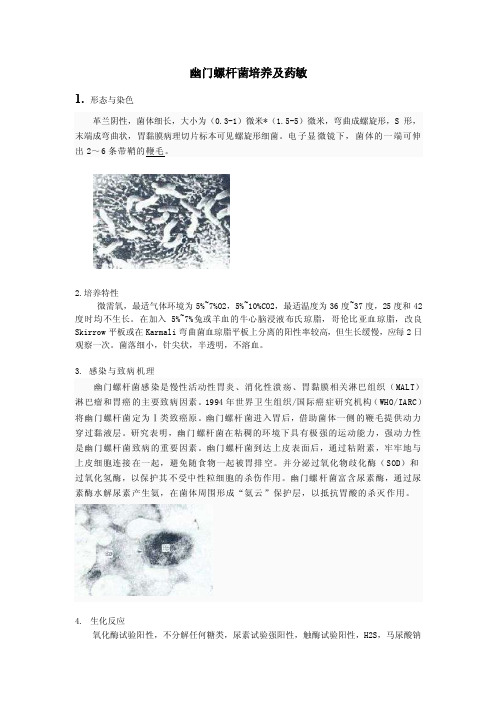
幽门螺杆菌培养及药敏1. 形态与染色革兰阴性,菌体细长,大小为(0.3-1)微米*(1.5-5)微米,弯曲成螺旋形,S形,末端成弯曲状,胃黏膜病理切片标本可见螺旋形细菌。
电子显微镜下,菌体的一端可伸出2~6条带鞘的鞭毛。
2.培养特性微需氧,最适气体环境为5%~7%O2,5%~10%CO2,最适温度为36度~37度,25度和42度时均不生长。
在加入5%~7%兔或羊血的牛心脑浸液布氏琼脂,哥伦比亚血琼脂,改良Skirrow平板或在Karmali弯曲菌血琼脂平板上分离的阳性率较高,但生长缓慢,应每2日观察一次。
菌落细小,针尖状,半透明,不溶血。
3.感染与致病机理幽门螺杆菌感染是慢性活动性胃炎、消化性溃疡、胃黏膜相关淋巴组织(MALT)淋巴瘤和胃癌的主要致病因素。
1994年世界卫生组织/国际癌症研究机构(WHO/IARC)将幽门螺杆菌定为Ⅰ类致癌原。
幽门螺杆菌进入胃后,借助菌体一侧的鞭毛提供动力穿过黏液层。
研究表明,幽门螺杆菌在粘稠的环境下具有极强的运动能力,强动力性是幽门螺杆菌致病的重要因素。
幽门螺杆菌到达上皮表面后,通过粘附素,牢牢地与上皮细胞连接在一起,避免随食物一起被胃排空。
并分泌过氧化物歧化酶(SOD)和过氧化氢酶,以保护其不受中性粒细胞的杀伤作用。
幽门螺杆菌富含尿素酶,通过尿素酶水解尿素产生氨,在菌体周围形成“氨云”保护层,以抵抗胃酸的杀灭作用。
4.生化反应氧化酶试验阳性,不分解任何糖类,尿素试验强阳性,触酶试验阳性,H2S,马尿酸钠和硝酸盐还原试验均阴性,25ºC和42ºC时均不生长,对奈啶酸耐药。
5. 本菌鉴定特征涂片(或胃黏膜活检标本)查见螺旋形或S形细菌:微需氧,生长缓慢,25ºC和42ºC 时均不生长;氧化酶,触酶试验阳性,尿素试验强阳性。
6.临床意义6.1 有门螺杆菌寄生于人的胃黏膜上,感染后可引起胃黏膜的急性炎症反应,临床表现为腹痛,消化不良等症状。
简述幽门螺旋杆菌的检测方法

简述幽门螺旋杆菌的检测方法幽门螺旋杆菌(Helicobacterpylori,简称H. pylori)是一种可导致消化系统疾病的细菌。
该菌体可引起胃病,如慢性胃炎、溃疡和胃癌。
H. pylori能够刺激胃癌的发生,并且可能与其他癌症的发生有关,如肠癌和胰腺癌。
由于H. pylori的发病率较高,所以检测幽门螺旋杆菌的方法变得越来越重要。
H. pylori的检测分为实验室检测和临床检测两类。
实验室检测包括消化道抹片检测、血清学试验、免疫学分析以及新生物学技术,如酶联免。
消化道抹片检测是一种常用的方法,它通过检测gbp底物来判断病毒感染。
血清学检测是检测病人血液中的H. pylori抗原的检测,它可以确定H. pylori的活菌感染情况。
免疫学分析通过检测抗H. pylori抗体的血清水平,以衡量抗原暴露的程度。
此外,新生物学技术如酶联免疫吸附试验也可用于检测H. pylori,该方法通过检测H. pylori抗原的血清水平来判定病毒感染情况。
临床检测也可用于检测H. pylori,但临床检测不能代替实验室检测。
它们可能没有足够的灵敏度来检测H. pylori,此外,还有很多因素可能会影响检测的准确性。
临床检测通常包括:胃镜,检查胃部的细菌;呼气检查,检查患者呼出的气体中的碳氢化合物;胃钡灌流,检查胃内的液体样品。
检测H. pylori的正确性是相当重要的。
因此,推出的检测方法应该既灵敏又试管容易,并且可以有效地检测到H. pylori。
临床检测不适合用于检测H. pylori,但它们也可以作为检测H. pylori的辅助方法。
重要的是,有必要将实验室检测与临床检测相结合,以确保检测H. pylori的准确性和可靠性。
总之,检测H. pylori是诊断消化系统疾病的重要步骤。
灵敏度高、实验简便且准确性较高的实验室检测方法和临床检测方法可以用于检测H. pylori,但实验室检测仍是优先考虑的检测方法。
幽门螺杆菌感染的诊断与治疗

幽门螺杆菌感染的诊断与治疗幽门螺杆菌(Helicobacter pylori,Hp)是一种革兰氏阴性杆菌,于1983 年首次由澳大利亚学者Barry J. Marshall 和J.Robin Warren从活动性胃炎患者的胃黏膜活检组织中分离获得,是目前已知唯一能够在胃中生存的生物种类。
马斯特里赫特V/佛罗伦萨共识将其定义为传染性疾病。
Hp 具有严重的致病性,其借助特有的毒力因子,能够适应高酸微环境,长期定植于宿主体内,诱发一系列HP相关性疾病。
研究表明Hp 感染不仅仅与胃炎、消化性溃疡、胃癌、胃MALT淋巴瘤等消化系统疾病关系密切,还与缺血性心脑血管疾病、脑出血、糖尿病、肝硬化等非消化系统疾病的进展和转归有关。
根除Hp 治疗可预防消化道恶性肿瘤的发生,使高危患者获益。
因此,Hp 的有效诊断和治疗是当前临床医学研究的热点。
一、幽门螺杆菌的概述(一)形态Hp 菌株的典型形态为S 形、螺旋形或海鸥状弯曲,但多次传代后也可呈微弯或笔直的杆状,在恶劣的环境下Hp 可变成球形,为一种自我保护的形态。
Hp 的螺旋形通过变形侵袭机制有效地促进细菌定植于黏液层,若Hp 出现细胞形状的改变,那么它的定植力会减弱。
研究显示Hp 的形态和它的游走速度密切相关,对于单个个体而言形态影响不大,但对于总体的定植影响较大。
(二)黏附素黏附素是Hp 表达的外膜蛋白,可以使Hp 粘附于胃上皮细胞,从而引发慢性感染。
它通过识别黏液层上的受体和上皮细胞的表面受体,与基底膜的蛋白结合而牢固的粘附于上皮细胞。
为了在强酸性的胃中成长和建立慢性感染,Hp 利用一种特定的黏附素蛋白BabA 附着到保护性的pH 值中性的胃黏膜上。
近来研究阐述了BabA 的一种pH 值反应性机制,当Hp 感受到附近的胃酸酸性增加带来的威胁时,这种反应性机制允许细菌从脱落的胃细胞上释放下来,游回到保护性的胃黏膜中,使得Hp 进行胃部循环感染,从而在这种极端酸性环境中茁壮成长。
幽门螺杆菌的研究进展及检测方法

幽门螺杆菌的研究进展及检测方法摘要】幽门螺杆菌(Helicobacterpylori,H.pylori)是许多慢性消化道疾病发生发展的一个重要致病因子,快速、灵敏、特异的检查方法是诊断HP感染和临床疗效评价的关键。
本文就Hp的生物学特征、致病机制、流行病学特征、耐药性问题及检测方法等的研究进展作一综述。
【关键词】幽门螺杆菌检测方法研究进展幽门螺杆菌(Helicobacterpylori,Hp)是一种革兰阴性微需氧杆菌。
2005年的诺贝尔生理学和医学奖获得者Warren及Marshall在1979年从慢性胃炎病人的胃镜活检标本中分离出Hp以来,受到国内外医学界众多学者的高度关注。
Hp感染呈全球性分布,Hp和一些上消化道疾病发生有紧密联系[1],是慢性胃炎、胃十二指肠溃疡的重要致病因素,与胃癌、胃黏膜相关淋巴组织淋巴瘤发生密切相关,世界卫生组织已将其列为一类致病因子。
现就其研究进展做一综述。
1生物学特征[2]Hp是一种单极、多鞭毛、末端钝圆、螺旋形弯曲的细菌,有1~2个微小弯曲,菌体长2~4μm,宽0.5~1.0μm,只有一条环状染色体。
1997年底已成对Hp基因组全序列测定,其中约2/3的基因可以在基因数据库查到功能基因,并可推测其可能的生物学功能,1/5的基因功能未知,1/4的基因为Hp特有基因。
细菌常排列成S形或海鸥状、革兰染色阴性。
电子显微镜下菌体一端或两端可有多跟带鞘鞭毛,运动活泼,通常在黏液层下面,黏膜上皮表面,在胃小凹内及腺腔内,呈不均匀的集团状分布。
微需氧,生长时需二氧化碳,营养要求高,培养时需动物血清或血液,最适生长温度37℃,PH值为6~8时繁殖最为活跃,另外还需一定湿度(相对湿度98%),培养3~6天可见针尖状无色透明菌落。
过氧化氢酶和氧化酶阳性,尿素酶丰富,可迅速分解尿素释放氨,是鉴定该菌的主要依据之一。
2致病机制Hp感染率在不同人群中各不相同,Hp感染后临床结局的多样性提示了其致病机制的复杂性,Hp致病机制包括:Hp的定植、毒素引起的胃黏膜损害、宿主的免疫应答介导的胃黏膜损伤以及Hp感染后胃泌素和生长抑素调节失衡所致的胃酸分泌异常等[3],涉及炎症、免疫、泌酸、氧化等多方面,有毒力因子、细胞因子、自由基、毒力基因等多种Hp致病因子参与。
检测幽门螺杆菌的方法

检测幽门螺杆菌的方法
幽门螺杆菌是一种常见的细菌,可以引起胃溃疡和胃炎等胃病。
以下是几种常见的检测幽门螺杆菌的方法:
1. 乙酸蓝染色法:通过胃镜取得胃黏膜的组织标本,然后用乙酸蓝染色,观察组织标本下的细菌形态和数量来检测幽门螺杆菌。
2. 快速尿素酶试验(RUT):通过胃镜取得胃黏膜的组织标本,然后加入一种含尿素和pH指示剂的试剂,如果存在幽门螺杆菌,其产生的尿素酶会将尿素分解为氨和二氧化碳,导致试剂颜色变化。
3. 呼气试验:患者吸入一种含有标记碳的化合物,如果存在幽门螺杆菌,它会将这种化合物分解,产生标记碳的二氧化碳,然后患者在特定时间内通过呼出气体进行采样,检测呼出气体中是否有标记碳的二氧化碳。
4. 血清学检测:通过抽取患者的血液样本,检测其中是否存在幽门螺杆菌的特定抗体,比如免疫球蛋白G(IgG)抗体。
这种方法可以确定人体是否曾经感染过幽门螺杆菌。
5. 核酸检测:通过采集患者的胃黏膜标本或者口腔唾液样本,使用PCR(聚合酶链反应)等方法,检测其中是否存在幽门螺杆菌的核酸,以确认感染情况。
以上是几种常见的幽门螺杆菌检测方法,医生会根据具体情况选择合适的方法进行检测。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
幽门螺杆菌细胞毒素的鉴定方法The methods of identifying the cytotoxin in Helicobacter pyloriWANG Hua-Bing,DONG Xiu-Yun(Department of Gastroenterology,Peking University Third Hospital,Beijing100083,China)ABSTRACT Objective:To investigate the methods of identifying the cytotoxin in Helicobacter pylori (H.Pylori) clinical isolate.Methods:H.Pylori strain HB1 was isolated from the biopsy specimen of gastric mucosa and identified its cytotoxin by using the techniques of cell culture,PCR and Western blot.Results:HB1 strain induced vacuolation in HeLa cells.The cagA gene was detected by PCR in HB1 strain.The Western blot analysis showed there were two protein bands of 87×103 and 130×103 in H.pylori water extract.Conclusion:H.pylori clinical isolate HB1 was a VacA+CagA+strain.KEY WORDS Helicobacter pylori;Cytotoxin/VacA,CagA;Identify自1983年澳大利亚学者Marshall和Warren首次从人胃粘膜中成功地分离培养出幽门螺杆菌(Helicobacter pylori,Hp)以来,Hp已成为国内外许多专家、学者研究的对象。
最近Hp毒素在致病性中的重要作用引起人们广泛关注。
根据目前的研究,Hp毒素主要有两种,即空泡细胞毒素(Vacuolating cytotoxin A,VacA)和毒素相关基因A(Cytotoxin associated gene A,CagA)。
根据这两种蛋白可将Hp分为两种主要类型[1]:Ⅰ型菌株含有cagA基因,表达CagA蛋白,并产生空泡毒素;Ⅱ型菌株缺乏cagA基因,不表达CagA蛋白,不产生空泡毒素。
这两型菌株分别占研究总样本的56%和16%,其余28%属中间表型,仅表达CagA或VacA。
本实验利用已知毒素特性的Hp国际标准株NCTC 11637和NCTC 11639为参照,对临床分离株HB1进行细胞毒素鉴定,以求探索出一套有效的鉴定方法,以便对不同菌株作进一步研究。
1材料与方法1.1细菌来源NCTC 11637(VacA+,CagA+)和NCTC 11639(VacA-,CagA+)由中国预防医学科学院流行病学研究所提供;HB1从十二指肠球溃疡患者胃粘膜活检标本中分离。
1.2主要试剂cag A扩增产物为349 bp片段,引物由中国预防医学科学院流行病学研究所惠赠,序列如下:5′-GATAACAGGCAAGCTTTTGAGG-3′5′-CTGCAAAAGATTGTTTGCGAGA-3′100bp Ladder Marker由北京大学基础医学院病理学系提供。
高分子蛋白质分子质量标准为Promega公司产品。
第一抗体为混合病人血清,经Helico Blot试剂盒检测CagA抗体及VacA抗体均为阳性。
第二抗体(辣根过氧化物酶标记羊抗人IgG)为中山生物工程公司产品。
1.3HeLa细胞空泡变性实验将培养3~4d的Hp刮入盛有灭菌三蒸水的小离心管中,在涡旋振荡器上充分振荡后,放-20℃过夜。
取出融化后,再次振荡,12000r*min-1离心15min,TGL-16G台式高速离心机(上海医用分析仪器厂),取上清液用考马斯亮蓝法进行蛋白定量。
取对数生长期HeLa细胞,消化后制成细胞悬液,调细胞数后接种于六孔板中。
CO2恒温培养箱中孵育24h,更换培养液后分别加入各型Hp细胞毒素提取液共同孵育24h。
弃去培养液,以甲醇固定10min,晾干后加Giemsa染液作用20min,自来水冲洗。
镜下观察细胞内是否有空泡形成,若大于50%的细胞形成空泡,则认为该菌株有空泡变性能力。
1.4多聚酶链反应(PCR)检测cag A基因用接种环刮取1/3环细菌,悬于0.5 ml STE缓冲液中,洗涤一次,再以200μl TE重悬,100 ℃煮沸5 min,14 000 r*min-1离心10min,取上清进行扩增反应。
经15g*L-1琼脂糖凝胶电泳,紫外检测仪观察结果。
分子质量标准为100 bp Ladder Marker。
1.5Western blot分析配制80 g*L-1分离胶和40 g*L-1积层胶,加入电泳缓冲液。
据蛋白定量结果每孔加样50μg进行垂直电泳。
电泳结束后电转移至硝酸纤维素(NC)膜上。
经丽春红S染色,用针尖标出作为分子质量标准的参照蛋白的位置,然后进行抗原-抗体结合反应,DAB显色。
2结果2.1HeLa细胞空泡变性实验阳性对照NCTC 11637毒素提取液使HeLa细胞发生空泡变性;阴性对照NCTC 11639未使HeLa 细胞发生空泡变性;临床株HB1可使HeLa细胞发生空泡变性,提示HB1菌株为VacA+菌株(图1)。
Figure 1Vacuolating test×4002.2PCR检测PCR产物经琼脂糖凝胶电泳后,在紫外检测仪下观察可见:以NCTC 11637、NCTC 11639、HB1 3种菌株的裂解物为模板的扩增产物均出现一DNA带。
据DNA Ladder Marker计算约350 bp,提示为cag A。
说明3种菌株均属于cag A阳性菌株(图2)。
2.3Western blot分析经与蛋白质分子质量标准比较(已通过丽春红S染色标记条带位置),在130×103处,3种菌株均有条带,87×103处仅NCTC 11637及HB1有条带,NCTC 11639条带缺如(图3)。
3讨论十多年来,大量研究资料表明,Hp感染与胃十二指肠疾病关系密切[2]。
所有的Hp感染者在组织学上都有胃炎的表现,但大多数人并无症状,仅一小部分人发展成严重疾病(如消化性溃疡和胃癌)[3]。
目前人们对Hp的致病机制还不太清楚,但是导致临床结局不同的一个重要因素在于Hp菌株之间毒力的差异。
Hp的几种毒力因子(如鞭毛的动力、粘附因子、脂多糖的内毒素、尿素酶、蛋白水解酶、磷脂酶A和超氧离子歧化酶等)存在于所有的Hp菌株,因此用上述因素并不能完全解释为什么感染Hp者会出现不同的临床后果。
Figure 2PCR result for detecting cagA gene1,HB1;2,NCTC11637;3,NCTC11639.Figure 3Western blot analysisHp毒素VacA 和CagA只在大约50%~60%的Hp菌株中产生,并且与胃十二指肠疾病关系密切[4],编码二者的基因分别称之为vacA和cagA。
VacA 蛋白于1988年由Leunk等首先描述,1992年被提纯[5],在SDS-PAGE上表现为87×103成熟蛋白,可导致真核细胞发生空泡变性,其目标是晚期核内体膜上的Ⅴ型ATP酶[6]。
本研究临床分离株HB1经HeLa细胞空泡变性实验显示具有空泡变性能力,提示为VacA+。
所有Hp都具有vacA,但并非所有的Hp都有空泡毒素活性,对于这一现象的解释认为,两种Hp的vacA在DNA序列上有所不同,碱基组成上有64.8%的同源性。
Cover等[7]的研究显示,大约60%~70%的Hp菌株含有cagA基因,这些菌株均是CagA+,不产生CagA蛋白的Hp没有cagA基因[8]。
HB1经PCR检测具有cagA基因,由此推测亦CagA+。
cagA基因内部存在重复序列,所以cagA基因和蛋白的大小在Hp菌株间存在差异,CagA蛋白的相对分子质量变动于120×103~140×103。
Western blot结果显示,HB1在130×103处可见一杂交条带,相同位置NCTC11637和NCTC11639亦有条带,进一步支持PCR检测结果。
同时Western blot分析显示在87×103处,HB1、NCTC11637有杂交带,NCTC11639条带缺如,亦支持HeLa细胞空泡变性实验。
综上所述,本实验从功能到结构、从基因到蛋白质对Hp细胞毒素进行了双重鉴定:Hp临床分离株HB1为VacA+和CagA+菌株。
从而为HB1的深入研究准备了条件。
参考文献1,Xiang Z,Censini S,Bayeli PF,et al.Analysis of expression of CagA and VacA virulence factors in 43 strains of Helicobacter pylori reveals that clinical isolates can be divided into two major types and that CagA is not necessary for expression of the vacuolating cytotoxin[J].Infect & Immun,1995,63(1):94-982,Kuipers EJ,Meuwissen SGM.Helicobacter pylori and gastric carcinogenesis[J].Scand J Gastroenterol,1996,31 (218):103-1053,Correa P.Human gastric carcinogenesis:A multistep and multifactorial process-first American cancer society award lecture on cancer epidemiology and prevention[J].Cancer Res,1992,52:6735-67404,Weel JFL,van der Hulst RWM,Gerrits Y,et al.The interrelationship between cytotoxin-associated gene A,vacuolating cytotoxin,and Helicobacter pylori-related diseases[J].J Infect Dis,1996,173:1171-11755,Cover TL,Blaser MJ.Purification and characterization of the vacuolating toxin from Helicobacter pylori[J].J Biol Chem,1992,267(15):10570-105756,Papini E,Bernard MD,Milia E,et al.Cellular vacuoles induced by Helicobacter pylori originate from late endosomal compartments[J].Proc Natl Acad Sci USA,1994,91:9720-97247,Cover TL,Tummuru MKR,Cao P,et al.Divergence of genetic sequences for the vacuolating cytotoxin among Helicobacter pylori strains[J].J Biol Chem,1994,269(14):10566-105738,Covacci A,Censini S,Bugnoli M,et al.Molecular characterization of the 128-kDa immunodominant antigen of Helicobacter pylori associated with cytotoxicity and duodenal ulcer[J].Proc Natl Acad Sci USA,1993,90:5791-5795。
