医疗器械软件研究模板
医疗器械软件描述模板
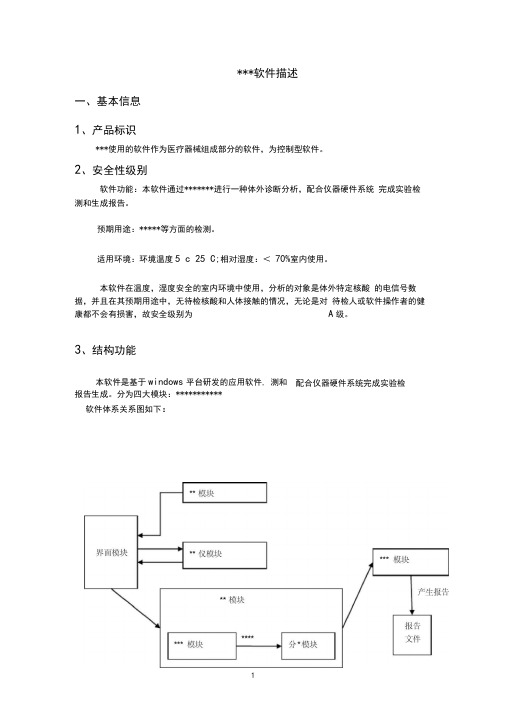
***软件描述一、基本信息1、产品标识***使用的软件作为医疗器械组成部分的软件,为控制型软件。
2、安全性级别软件功能:本软件通过*******进行一种体外诊断分析,配合仪器硬件系统完成实验检测和生成报告。
预期用途:*****等方面的检测。
适用环境:环境温度5 c 25 C;相对湿度:<70%室内使用。
本软件在温度,湿度安全的室内环境中使用,分析的对象是体外特定核酸的电信号数据,并且在其预期用途中,无待检核酸和人体接触的情况,无论是对待检人或软件操作者的健康都不会有损害,故安全级别为A级。
3、结构功能本软件是基于windows平台研发的应用软件, 测和配合仪器硬件系统完成实验检报告生成。
分为四大模块:***********软件体系关系图如下:4、 硬 件关系软件系统通过路由器连接PC 机和测试塔,将测试数据返回PC 机器,并通过路由 器进行实时通讯,通过PC 机控制测试塔进行相应操作。
5、 运 行环境Windows Xp sp3(32 位) Visual studio 2008 .Net framework 2.0 无 无 网络环境:以太6、 适 用范围本软件需与 *** 系统配套使用,主要用于分析设备仪器返回的数据并产生报 告。
7、 禁 忌症无。
8、 上 市历史经查询,目前市面上暂无同类产品(包含本软件组件)批准上市。
二、 实现过程1、 开 发综述开发语言: C#.net开发工具: 1)支持软件 Visual Studio 2008 ; 2)应用软件:无 开发方法: 面向对象生存周期模型: 瀑布模型开发人员数量: 1开发时间: 7 个月工作量: 7 月 / 人代码行总数: 40497控制文档总数:软件环境:1) 、系统软2、风险管理详见资料4《安全风险分析管理报告》。
3、需求规格详情见”D** 系统需求规格书.doc”。
4、生存周期本软件开发采用瀑布模型方式进行开发。
首先进行项目立项,经过调研分析,确认方案后,再进行开发设计,设计完成后进行配置测试和缺陷管理。
医疗器械软件研究计划书

医疗器械软件研究计划书英文回答:Medical Device Software Research Proposal.Introduction.Medical device software (MDS) plays a pivotal role in modern healthcare systems, enabling the development and deployment of innovative medical technologies that improve patient outcomes, enhance diagnostics, and streamline treatment processes. However, ensuring the safety, efficacy, and reliability of MDS presents unique challenges due toits complex and safety-critical nature. In this research proposal, we outline a comprehensive research agenda addressing key scientific and technical aspects of MDS development, evaluation, and regulation.Research Objectives.Our research objectives aim to advance the state-of-the-art in MDS research and contribute to the developmentof safe, effective, and reliable medical technologies. The specific objectives include:Developing novel methods and tools for MDS development: Exploring new approaches to software design, modeling, and verification to enhance the quality and reliability of MDS.Establishing rigorous evaluation techniques for MDS: Creating standardized frameworks and methodologies for evaluating the safety, efficacy, and performance of MDS.Investigating human factors and usability aspects of MDS: Evaluating the usability and acceptability of MDS from the user's perspective to improve the user experience and safety.Developing regulatory frameworks for MDS: Exploring regulatory best practices and standards to ensure thesafety and ethical use of MDS.Research Methods.We propose to utilize a combination of research methods to achieve our objectives. These methods include:Empirical research: Conducting experiments, surveys, and case studies to gather data on the development, evaluation, and use of MDS.Theoretical research: Developing mathematical models, algorithms, and design principles to address the challenges in MDS development and evaluation.Collaboration with industry and regulatory bodies: Partnering with medical device manufacturers, healthcare providers, and regulatory organizations to ensure the practical relevance and impact of our research.Expected Outcomes.The expected outcomes of this research include:Improved MDS development practices: New methods and tools to enhance the quality, reliability, and safety of MDS.Standardized evaluation frameworks: Established methodologies for evaluating the safety, efficacy, and performance of MDS.Enhanced user experience: Improved usability and acceptability of MDS through human factors research.Informed regulatory frameworks: Updated best practices and standards for regulating MDS to ensure patient safety and ethical use.Significance and Impact.This research has significant implications for the advancement of medical technologies and the improvement of patient care. By addressing the challenges in MDS development, evaluation, and regulation, we aim to contribute to the development of safer, more effective, andmore user-friendly medical devices that can enhance patient outcomes and transform healthcare delivery.中文回答:医疗器械软件研究计划书。
医疗工具软件研究报告模板

医疗工具软件研究报告模板1. 简介本报告旨在研究医疗工具软件的现状和发展趋势,为相关领域的研究人员和开发者提供参考和指导。
医疗工具软件是一种结合了医学知识和技术手段的应用软件,旨在辅助医务人员进行医疗诊断、治疗和管理工作。
本报告将重点探讨医疗工具软件的应用领域、功能特点和技术实现等方面的内容。
2. 应用领域医疗工具软件的应用领域广泛,涵盖了医疗诊断、治疗和管理等多个方面。
其中包括但不限于以下几个领域:- 医学影像处理和分析- 临床数据管理和分析- 医疗决策支持- 远程医疗和健康监测- 医学教育和培训等3. 功能特点医疗工具软件具有以下几个功能特点:- 数据处理和分析能力:医疗工具软件能够接收、处理和分析医学数据,提供对数据的可视化展示和分析结果的输出。
- 模型和算法应用能力:医疗工具软件应用医学模型和算法,辅助医务人员进行医疗决策、诊断和治疗。
- 用户界面友好易用:医疗工具软件的用户界面应简洁明了,操作友好,方便医务人员使用和了解软件功能。
- 数据安全性和隐私保护:医疗工具软件需具备对医疗数据的安全和隐私保护能力,确保医疗信息的机密性和完整性。
4. 技术实现医疗工具软件的技术实现主要涉及以下方面:- 数据存储和处理技术:医疗工具软件需要使用数据库和相关的数据处理技术,保证数据的有效存储和高效查询。
- 模型和算法开发:医疗工具软件需要开发和应用相应的模型和算法,以实现医疗决策、诊断和治疗等功能。
- 用户界面设计和开发:医疗工具软件需要进行用户界面的设计和开发,以提供简洁明了的操作界面。
- 数据安全和隐私保护技术:医疗工具软件需要采用加密技术、权限控制等手段,保护医疗数据的安全和隐私。
5. 发展趋势医疗工具软件将在未来继续发展和创新,主要趋势包括但不限于以下几个方面:- 人工智能和机器研究的应用:医疗工具软件将更多应用人工智能和机器研究的技术手段,提高医疗决策和治疗的准确性和效率。
- 移动端应用的增加:随着智能手机和平板电脑的普及,医疗工具软件将更多地面向移动端用户,提供便捷的操作和使用体验。
医疗器械软件确认报告模板

软件确认报告
编制/日期:_____________
审核/日期:_____________
批准/日期:_____________
一、引言
1.1 目的:
通过测试报告反馈及时解决由程序中的错误引发的问题。
适用于XX治疗仪,型号XX
1.2 背景:
软件系统的名称:
任务提出者:
开发者:
本系统包括XX治疗仪嵌入式软件系统。
1.3 参考资料:
1)软件需求说明书
2)软件详细设计说明
3)产品使用说明书
4)技术要求
5)软件验证报告
二、测试方法
参考《系统测试报告》
三、测试机构和人员
测试机构:
测试人员:
四、测试记录、分析统计
五、测试结果
六、评价
6.1 软件能力:
软件能力达到《软件需求说明书》规定的能力要求;
软件相关的产品性能符合技术要求。
6.2 缺陷和限制:
无明显缺陷
6.3 建议:
无
6.4 测试结论:
经测试,软件功能符合产品设计要求,判定合格。
医疗器械软件开发方案模板范文

医疗器械软件开发方案模板范文英文版Medical Device Software Development Proposal Template IntroductionIn today's healthcare landscape, medical device software has become an integral part of providing efficient and effective patient care. This document outlines a template for developing medical device software, focusing on key considerations and steps to ensure a successful implementation.1. Project OverviewProject Name: [Insert Project Name]Project Goals: [Describe the objectives and expected outcomes of the software development project]Target Users: [Identify the primary users of the software, such as doctors, nurses, patients, etc.]2. Software RequirementsFunctional Requirements: [List the core functionalities the software must have to meet the project goals]Non-Functional Requirements: [Outline any specific performance, security, or usability standards]3. Software Development ProcessPlanning: [Describe the project planning phase, including estimating time, resources, and risk assessment]Design: [Outline the software architecture, user interface, and data flow]Development: [Discuss the coding, testing, and debugging process]Deployment & Support: [Describe the software deployment plan and ongoing support services]4. Compliance & RegulationsRegulatory Compliance: [Ensure the software meets all relevant medical device regulations and standards]Data Privacy & Security: [Implement robust security measures to protect patient data]5. Training & EducationUser Training: [Provide training materials and sessions for target users]Technical Support: [Offer ongoing technical support to users]6. Project Timeline & BudgetTimeline: [Provide a detailed timeline for each phase of the project]Budget: [Outline the estimated costs for development, deployment, and support]ConclusionBy following this template, medical device software development teams can ensure a structured and comprehensive approach to developing software that meets the unique needs of healthcare providers and patients. Attention to detail, compliance with regulations, and a focus on user experience are crucial to the success of any medical device software project.中文版医疗器械软件开发方案模板范文介绍在当今的医疗保健领域,医疗器械软件已成为提供高效和有效患者护理不可或缺的一部分。
医疗器械研究资料模板

医疗器械研究资料模板
一、研究背景
本研究旨在探讨XYZ医疗器械(以下简称器械)的安全性和有效性。
XYZ器械是近年来许多医疗机构、机构和研究机构正在使用的一种重要器械,用于帮助治疗患者的其中一种疾病。
二、研究目的
研究的主要目的在于检测XYZ器械的安全性和有效性,以及用于治疗患者病症的可行性。
本研究想要收集有关使用XYZ器械治疗患者特定病症的患者的临床经验信息,以便评估器械的安全性和有效性,以及其用于治疗患者的病症的可行性。
三、研究方法
本研究采用定向实证法,主要考察使用XYZ器械治疗患者特定病症的患者的临床经验。
研究将针对XYZ器械使用患者本身的临床变化,治疗效果,器械操作过程中的安全性,以及使用器械治疗特定病症的可行性进行评价。
四、研究对象
本研究的研究对象是在使用XYZ器械治疗临床特定病症的患者。
五、研究样本
本研究将收集患者使用器械的情况,由全国范围内10家不同医疗机构提供,共计500名患者资料,包括年龄、性别、患者体征等都纳入研究对象。
六、数据收集和分析
本研究将使用调查问卷法收集患者使用XYZ器械的经验信息。
医疗器械软件研究模板

医疗器械软件研究模板一、引言介绍医疗器械软件的背景和意义,概述本次研究的目的和研究方法。
二、医疗器械软件的分类1.按功能分类:分析、监控、诊断、手术规划等;2.按使用对象分类:医生端、患者端、医院端等;3.按应用场景分类:门诊、急诊、手术室等。
三、医疗器械软件的研究方法1.文献调研法:查阅相关医学期刊和会议论文,了解最新的研究成果,归纳总结已有的研究方法和技术;2.实验研究法:设计实验,采集医疗器械软件使用者的使用数据,对比不同软件的性能差异,评估软件的效果和可行性;3.数据分析法:通过对大量的医疗数据进行统计和分析,挖掘其中隐藏的规律,提取有用的信息,优化医疗器械软件的算法和模型。
四、医疗器械软件的研究难点和挑战1.数据隐私保护:医疗数据具有敏感性,在研究过程中需要加密和保护;2.算法优化:医疗器械软件需要高效的算法来处理庞大的医疗数据,提高软件的运行速度和效果;3.人机交互设计:医疗器械软件需要便捷的用户界面和友好的交互方式,提高医生和患者的使用体验。
五、医疗器械软件的应用和发展前景1.辅助诊断:借助医疗器械软件,医生能够更准确地进行诊断,降低误诊率;2.手术辅助:医疗器械软件可以通过对患者数据的分析,提供手术规划和操作指导,提高手术的成功率;3.医疗大数据分析:通过对大量的医疗数据的挖掘和分析,医疗器械软件可以帮助医疗机构提高效益和管理水平;4.云端平台应用:医疗器械软件可以通过云端平台实现数据共享和远程诊断,提高医疗资源的利用效率。
六、结论总结本次研究的主要内容和成果,指出医疗器械软件研究的未来方向和发展前景。
列出本文中引用的相关文献和参考资料的清单。
以上是医疗器械软件研究模板,模板主要包括了医疗器械软件的分类、研究方法、研究难点和挑战、应用和发展前景等内容。
根据自己的研究实际情况,可以对相关内容进行添加、删除或修改,使其符合研究的需求。
医疗器械用软件设计模板

医疗器械用软件设计模板1. 引言本文档旨在提供医疗器械用软件设计的模板和指导,以确保设计的合规性和可靠性。
医疗器械软件的设计过程应参照相关法规和标准,以确保产品的安全性和有效性。
2. 软件需求分析在软件设计之前,需要进行充分的需求分析,确定软件的功能和性能要求。
需求分析应包括以下步骤:- 定义软件的用途和目标;- 确定用户需求和期望;- 确定适用的法规和标准;- 定义软件的功能和界面要求;- 确定性能和可靠性要求。
3. 系统架构设计系统架构设计是将软件分解为不同模块和组件的过程。
在医疗器械软件设计中,需考虑以下因素:- 系统的可扩展性和可维护性;- 分层架构设计,确保模块的独立性;- 实时性和响应性的要求。
4. 数据流图设计数据流图是描述系统流程和数据传输的图形工具。
在医疗器械软件设计中,数据流图需要考虑以下因素:- 合规性和隐私保护;- 数据的准确性和一致性;- 数据传输的安全性。
5. 界面设计用户界面是用户与软件进行交互的平台,设计良好的用户界面能提高用户体验。
在医疗器械软件设计中,界面设计应注重以下方面:- 易用性和易读性;- 考虑用户的特殊需求和能力;- 考虑界面的安全性。
6. 数据库设计数据库设计是为了存储和管理软件中的数据。
在医疗器械软件设计中,数据库设计需要考虑以下因素:- 数据的安全性和保密性;- 数据的完整性和可靠性;- 合规性要求。
7. 软件测试和验证软件测试和验证是确保软件的正确性和合规性的过程。
在医疗器械软件设计中,需要进行以下测试和验证:- 单元测试和集成测试;- 功能测试和性能测试;- 需求追踪和验证。
8. 结论本文档提供了一份医疗器械用软件设计的模板和指导,从需求分析到测试验证,完整了解了医疗器械软件设计的过程和关键要点。
在实际设计中,应参照相关法规和标准,并根据具体需求进行适当的调整和优化。
只有合规和可靠的软件设计才能确保医疗器械的安全和有效使用。
---Please let me know if you need any further assistance.。
医疗器械软件研究模板
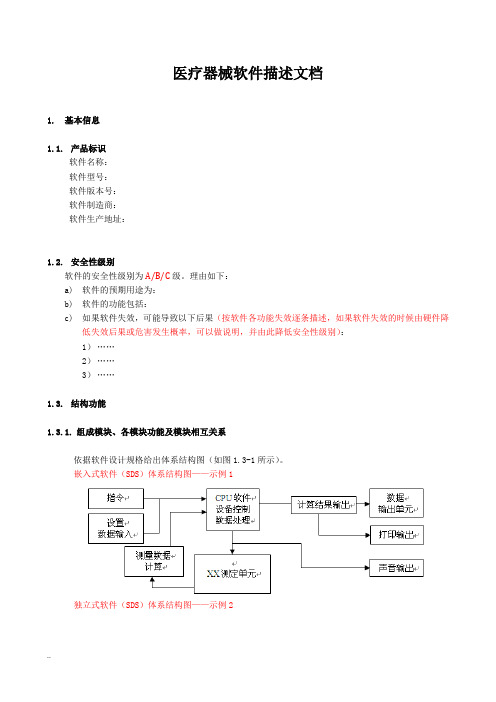
医疗器械软件描述文档1.基本信息1.1.产品标识软件名称:软件型号:软件版本号:软件制造商:软件生产地址:1.2.安全性级别软件的安全性级别为A/B/C级。
理由如下:a)软件的预期用途为:b)软件的功能包括:c)如果软件失效,可能导致以下后果(按软件各功能失效逐条描述,如果软件失效的时候由硬件降低失效后果或危害发生概率,可以做说明,并由此降低安全性级别):1)……2)……3)……1.3.结构功能1.3.1.组成模块、各模块功能及模块相互关系依据软件设计规格给出体系结构图(如图1.3-1所示)。
嵌入式软件(SDS)体系结构图——示例1独立式软件(SDS)体系结构图——示例2图1.3-1 XXX体系结构图1.3.2各模块功能说明注:1、每个软件模块一份表单。
2、软件功能项目列表需列出与测试相关的所有功能(包括各级子功能)。
3、功能说明栏目应填写:功能项目概述、边界值规定(数据有效性)、安全说明等信息。
4、功能列表上所列出来的功能必须是可以实现或演示的。
5、功能名称与软件、文档保持一致。
6、软件功能项目列表根据需要列出(可增加或删减子功能列)。
1.3.2.用户界面设计采用广泛应用的图形用户界面(GUI),即诸如窗口、菜单、对话框、滚动条等。
用户主界面见图1.3-2。
图1.3-2 XXX用户主界面1.3.3.外部接口XXX可使用VISUAL C++ 提供的对SQL SERVER 的接口,进行对数据库的所有访问。
XXX可使用SQL SERVER 的对数据库的备分命令,以做到对数据的保存。
在网络软件接口方面,使用一种无差错的传输协议,采用滑动窗口方式对数据进行网络传输及接收。
1.4.硬件关系1.4.1.物理拓扑图嵌入式软件物理拓扑关系表格形式——示例2独立式软件物理拓扑关系表格形式——示例3图1.4-1物理拓扑图1.4.2.连接关系描述与PC连接与医疗器械硬件连接1.5.运行环境1.5.1.硬件配置处理器:储存器外设器件输入/输出设备……1.5.2.软件环境系统软件:支持软件:必备软件:选配软件:杀毒软件:……1.5.3.网络条件网卡:网络类型:网络架构:1.6.适用范围独立软件:软件的适用范围和适用人群。
医疗器械计算机软件验证方案模板

医疗器械计算机软件验证方案模板一、引言(介绍验证方案重要性、目的和背景信息)二、系统描述(描述待验证的计算机软件系统,包括其功能、使用场景、操作流程等)三、验证目标(明确本次验证的具体目标和范围)四、验证策略1.验证方法(列出将使用的验证方法,如黑盒测试、白盒测试、冒烟测试等)2.验证环境(明确验证所需的硬件设备、软件工具、测试数据等)3.验证时间计划(制定详细的验证时间安排)五、验证过程1.验证准备a.设计验证用例(根据功能需求和预期效果,设计合适的验证用例)b.环境准备(准备好验证所需的硬件设备、软件工具、测试数据等)c.文档准备(准备验证所需的文档,如验证计划、测试用例等)2.验证执行a.执行验证用例(根据验证计划,逐个执行验证用例)b.记录测试结果(记录每个验证用例的执行结果、问题和改进建议)3.验证总结和报告a.验证总结(总结本次验证的结果,评估达到的目标和未达到的目标)b.编写验证报告(编写详细的验证报告,包括验证目标、执行情况、测试结果等)c.提出改进建议(根据验证结果,提出改进软件系统的建议)六、风险控制(列出可能的风险和应对措施,如备份数据、设备故障处理等)七、验证的限制和局限性(明确验证过程中的限制和局限性,如可用测试数据的有限性、验证时间的限制等)八、验证结果的评估(对验证结果进行评估,判断计算机软件系统是否符合预期要求)九、验证结果的验证(可根据需要,邀请相关专家对验证结果进行评审和验证)十、验证计划执行的控制(制定计划执行的控制措施,如定期评估进展、及时调整计划等)十一、验证方案的维护和更新(说明如何对验证方案进行维护和更新,以保证验证过程的准确性和实效性)(列出所参考的相关文件和资料的详细信息)以上是医疗器械计算机软件验证方案的一个模板,具体内容可以根据实际情况进行调整和补充。
请注意,验证方案的编写应遵循相关的法规和标准要求,并确保验证过程的安全性和可靠性。
医疗器械自研软件研究报告范文

医疗器械自研软件研究报告范文(中英文实用版)Title: Example Research Report on Self-developed Software for Medical DevicesAbstract: This research report aims to provide an in-depth analysis of the self-developed software for medical devices.With the rapid development of medical technology, the importance of software in medical devices has been increasingly recognized.This report covers various aspects of self-developed medical device software, including its role, challenges, and opportunities in the medical field.摘要:本研究报告旨在深入分析医疗器械自研软件。
随着医疗技术的快速发展,软件在医疗器械中的重要性日益得到认可。
本报告涵盖了自研医疗器械软件在医疗领域的角色、挑战和机遇等方面的内容。
Introduction: Medical device software plays a crucial role in the operation and functionality of medical devices.It is essential for healthcare professionals to have a deep understanding of the software to effectively utilize the devices.This section provides an overview of the importance and functionality of medical device software.引言:医疗器械软件在医疗器械的操作和功能中起着关键作用。
医疗器械软件设计研究模板

医疗器械软件设计研究模板
一、概述
1.1项目背景
随着新技术的不断发展,医疗设备的普及使得大多数病人可以在家里接受有效的治疗,因此设计一款适用于家庭医疗的医疗器械软件成为当前研究热点。
本研究项目旨在设计一款家庭医疗器械软件以帮助患者获得更好的治疗和护理。
1.2研究目的
本研究旨在设计一款家庭医疗器械软件,为患者提供更加有效的治疗和护理服务。
1.3研究内容
本研究将对家庭医疗器械软件的设计进行详细探索,包括:
(1)分析家庭医疗环境中患者的特点和需求;
(2)确定家庭医疗器械软件的功能构成;
(3)设计家庭医疗器械软件的结构及实现细节;
(4)组织家庭医疗器械软件的质量保证和安全检测;
(5)在正式使用前进行有效测试以验证系统的功能及可靠性。
二、实施方案
2.1调研
此项目开展前,需要开展家庭医疗环境中患者的需求调研,以便了解其需求特点,并基于该特征确定医疗器械软件的功能、界面设计等。
2.2设计
此项目将按照调研结果分析和确定的架构及功能结构,按照安全、高效和可靠等要求设计家庭医疗器械软件。
软件测试文档集模板(医疗器械)

XXXX医学科技有限公司产品名称:xxxx系统产品型号:XTM300软件版本:V1.0.0.0文档版本:A/0软件测试文档集文档制订:xxx文档审核:xxx测试执行:xxx文档签发:xxx发布日期:2016.3.1目录1. 测试过程概述1.1 测试任务 (3)1.2 参加测试人员 (3)1.3 测试时间 (3)1.4 测试环境 (3)1.4.1 硬件环境 (3)1.4.2 软件环境 (4)2.测试内容&测试计划2.1 测试内容 (4)2.2 通过-失败准则 (4)2.3 测试方案····································4-52.3 测试用例·····································5-83.测试异常情况报告 (8)4. 测试结论 (8)5.术语表····································8-91. 测试过程概述1.1 测试任务和目的本次测试主要是遵循GB/T25000.51-2010的要求,测试xxxxxxxx 系统与该标准的符合性。
医疗器械软件开发全套文档模板(含软件风险管理、软件测试等)

医疗器械-软件开发描述文档文档目录软件基本信息 (2)软件实现过程 (6)软件风险管理报告 (16)软件集成测试计划 (25)系统测试计划 (27)用户软件测试计划 (41)软件基本信息产品名称:1、产品标识:2、安全性级别××是一种××软件,所以随之而来的软件安全性问题也极为重要。
(a) ××软件是一种抽象的逻辑产品,其存在形式是虚拟和动态的……..(b) 软件质量的测度十分困难,其质量的控制重点在软件的需求分析和设计阶段,开发过程中产生错误的难以追踪;……;(c) 硬件有老化现象,失效曲线似浴盆,硬件的维护可通过纠错、修复或更换失效的系统重新恢复功能。
而软件的维护复杂,只有通过修改代码来排错。
同时软件可能在使用中随着缺陷的发现和消除,而使性能提高。
软件的修改看似比硬件容易,却比硬件更难于控制。
看上去无关紧要的软件代码修改会在软件的其他地方引起无法预测的、十分关键的问题;(d) 软件的失效防护困难。
对硬件可采用预防性维护技术预防故障,采用断开失效部件的办法诊断故障,而软件则不能采用这些技术;但软件的失效会毫无征兆的出现,会因执行一条未经验证的路径而出现故障;而同一软件的冗余不能提高可靠性。
(e) 软件的失效是系统性失效,其失效的条件有时比较复杂。
因此,可能会无法清晰地洞察其原因,而误归结其为系统中硬件的随机失效。
导致无法及时排除软件中的故障,造成隐患的长期存在。
以上论述了××软件的复杂性,以及出现问题无法预测性和软件的实效防护困难。
××软件一旦出现问题则很可能导致患者×××或者对患者造成严重的伤害,例如,×××软件一旦在运行过程中失效,机器停止工作则很可能导致患者由于××而变为×××,所以××软件安全性级别为××级。
医疗器械自研软件研究报告范文

医疗器械自研软件研究报告范文一、引言。
咱今天来唠唠医疗器械自研软件这个事儿。
在这个科技飞速发展的时代,医疗器械和软件就像一对好搭档,软件给医疗器械注入了新的活力,让它们变得更加智能、高效,就像给钢铁侠穿上了更先进的战甲一样酷。
二、研究背景。
1. 医疗需求推动。
咱都知道,现在的医疗行业要求越来越高了。
患者们希望得到更精准的诊断、更个性化的治疗,医生们也想提高工作效率,减少错误。
传统的医疗器械有点“傻愣愣”的,很多时候不能满足这些需求。
比如说,一个普通的X光机,它就只能拍出个片子,医生还得自己费劲巴拉地去看片子找问题。
这时候,自研软件就像是个超级助手,可以对X光片进行智能分析,快速指出可能的病变部位,这多方便啊!2. 技术发展助力。
随着计算机技术、人工智能、大数据等高科技的不断进步,给医疗器械自研软件提供了肥沃的土壤。
就好比有了各种高级的建筑材料和设计工具,就能盖出更酷炫的大楼一样。
现在的算法可以处理海量的数据,让软件能够从大量的病例中学习,变得越来越聪明。
三、研究目的。
1. 提高诊断准确性。
这个软件的一个重要目标就是帮助医生更准确地诊断疾病。
就像给医生戴上了一副能透视的眼镜,让他们能看穿病症的伪装。
比如说在肿瘤的早期筛查中,软件可以分析细胞的图像特征,比人眼更敏锐地发现那些微小的异常,提前揪出肿瘤这个小恶魔。
2. 优化治疗方案。
每个人的身体状况都不一样,同一种病可能需要不同的治疗方法。
自研软件可以根据患者的具体情况,像私人定制服装一样,为患者制定出最适合的治疗方案。
它可以考虑患者的年龄、性别、病史、基因等各种因素,然后给出最合理的药物剂量、治疗时间等建议。
四、软件功能与特点。
# (一)功能。
1. 图像分析功能。
这可是个很厉害的功能。
对于那些需要图像诊断的医疗器械,如CT、MRI等,软件可以对图像进行增强、分割、特征提取等操作。
就像给图像来了个魔法变身,原本模糊不清的地方变得清晰可见,医生能更清楚地看到身体内部的结构。
医疗器械自研软件研究报告范文

医疗器械自研软件研究报告范文英文版Research Report on Self-Developed Software for Medical DevicesIntroductionWith the rapid advancement of technology, medical devices have become increasingly reliant on software for their operation and functionality. Self-developed software for medical devices holds the potential to revolutionize healthcare delivery, improve patient outcomes, and enhance the efficiency of medical professionals. This report aims to explore the current landscape, challenges, and opportunities associated with self-developed software for medical devices.Current LandscapeThe global market for medical device software is growing rapidly, driven by factors such as increasing digitization in healthcare, rising demand for connected medical devices, andadvancements in artificial intelligence and machine learning. Self-developed software for medical devices is playing a pivotal role in this growth, as it allows for customized solutions that meet the specific needs of medical professionals and patients.ChallengesDespite the significant potential, the development of self-developed software for medical devices faces several challenges. One of the primary challenges is the compliance with strict regulatory frameworks, such as the FDA's guidance on medical software. Developers must ensure that their software meets the highest standards of safety, effectiveness, and reliability. Additionally, integrating software with existing medical devices can be technically challenging, requiring expertise in both software development and medical technology.OpportunitiesThe opportunities associated with self-developed software for medical devices are vast. With the increasing demand for connected medical devices and the integration of artificialintelligence into healthcare, there is a growing need for customized software solutions. This provides a significant market opportunity for developers to create innovative software that can improve the quality and efficiency of healthcare delivery.ConclusionSelf-developed software for medical devices holds the promise of transforming healthcare delivery, improving patient outcomes, and enhancing the efficiency of medical professionals. However, to capitalize on this opportunity, developers must address the challenges of compliance with regulatory frameworks and technical integration. By doing so, they can create innovative software solutions that meet the specific needs of the healthcare industry and drive positive changes in patient care.中文版医疗器械自研软件研究报告范文引言随着科技的迅速发展,医疗器械越来越依赖软件来实现其操作和功能。
医疗器具软件研究报告模板

医疗器具软件研究报告模板1. 研究背景在医疗领域,软件在医疗器具中的应用越来越广泛。
医疗器具软件的研究和发展对于提高医疗效率和质量至关重要。
本报告旨在对医疗器具软件进行研究,并提供相关的研究结果和结论。
2. 研究目的本研究的目的是深入了解医疗器具软件的现状和发展趋势,探讨其在医疗行业中的应用和影响,并为未来的研究和开发提供参考。
3. 研究方法* 文献综述:通过查阅相关文献资料,收集并分析医疗器具软件的研究现状和应用案例。
* 数据收集:通过调查问卷或访谈等方式,收集医疗行业相关人员对医疗器具软件的看法和需求。
* 数据分析:对收集的数据进行统计分析,揭示医疗器具软件的特点和优势。
4. 研究结果根据我们的研究,得出以下主要结果:* 医疗器具软件的应用范围广泛,包括但不限于医学影像处理、电子病历管理和医疗设备控制等方面。
* 医疗器具软件能够提高医疗效率和准确性,减少人为错误和误诊的风险。
* 医疗器具软件的开发需要专业知识和技能,同时也受到法律和监管要求的限制。
5. 结论与建议根据我们的研究结果,我们得出以下结论和建议:* 医疗器具软件的研究和发展具有重要意义,可以进一步推动医疗行业的发展。
* 在进行医疗器具软件的研发时,需要遵守相关的法律和法规,确保软件的安全性和合规性。
* 进一步研究医疗器具软件的应用效果和潜在风险,为医疗行业提供更好的软件解决方案。
6. 参考文献- [参考文献1]- [参考文献2]- [参考文献3]以上是医疗器具软件研究报告的模板,根据具体的研究内容和结果可进行适当的修改和补充。
医疗器械用软件确认模板

医疗器械用计算机软件确认报告1.1 软件描述软件名称: 软件版本: 软件厂商: 1.2 主要功能CRM 、供应链、生产创造、人力资源等。
本方案是为了确认软件安装的有效性、符合性,通过完整的安装、测试,以确认该系统的安装 后的各项性能符合相关要求。
本确认的范围是包含软件及其关联设备、设施。
4.2计划验证时间按照验证主计划,本系统计划验证时间为:文件名称 软件操作说明编码 26.1 GB/T19001—ISO9001 质量体系设计、开辟、生产、安装和服务质量保证模式 6.2 GB/T19000.3—ISO9000-3 软件开辟、供应和维护中的使用指南 6.3 GB8566—88 《计算机软件开辟规范》注释计算机控制系统验证设定值 实际值 印刷电路板缩写 CSV SV PV PCB验证职责负责对验证小组成员进行本方案的培训;负责本方案的实施,负责跟踪所有偏差缺陷均已整改;验证报告的生成、审核和批准,以便对该方案进行最终 批准。
负责起草验证方案和报告; 按验证方案实施验证, 采集、 整理验证数据,完成验证记录和报告。
执行前确认方案已批准,并经过培训;参预验证偏差的调查和处理,确认通过偏差修订和解决 方案;确认验证过程中的变更在实施前已经批准。
验证职务组长组员组员所在部门总经办技术部IT姓名8.1 培训方案审批后,由验证起草人员对方案实施过程中涉及人员进行培训,以保证方案顺利实施,并 做好培训记录,培训记录见附表表(一)。
8.2 安装确认程序 8.2.1 安装文件检查核对相应的安装说明书或者手册文件、使用说明书是否存在。
8.2.2 安装环境、条件确认依据说明书要求配置相关电源、主机、显示器、及其他附属设备设施。
8.3.3 安装确认执行说明书安装步骤,执行安装过程。
并注意过程中的排错记录。
9.1 偏差、漏项、变更说明对验证中的偏差、漏项、变更进行说明。
9.2 评价和建议根据验证结果进行评价和建议。
9.3 报告审核和批准对报告进行审核和批准输入/输出 人机界面 设计确认 安装确认 运行确认 性能确认 不间断电源I/O OIP DQ IQ OQ PQ UPS培训项目:软件确认方案培训培训内容:软件确认方案、软件的使用操作方法姓名部门及职务培训人培训结果编制人/日期:附件二:一、确认目的1 、确认软件安装的准确性;2 、确认安装条件是否符合要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗器械软件描述文档1.基本信息1.1.产品标识软件名称:软件型号:软件版本号:软件制造商:软件生产地址:1.2.安全性级别软件的安全性级别为A/B/C级。
理由如下:a)软件的预期用途为:b)软件的功能包括:c)如果软件失效,可能导致以下后果(按软件各功能失效逐条描述,如果软件失效的时候由硬件降低失效后果或危害发生概率,可以做说明,并由此降低安全性级别):1)……2)……3)……1.3.结构功能1.3.1.组成模块、各模块功能及模块相互关系依据软件设计规格给出体系结构图(如图1.3-1所示)。
嵌入式软件(SDS)体系结构图——示例1独立式软件(SDS)体系结构图——示例2图1.3-1 XXX体系结构图1.3.2各模块功能说明产品名称版本号模块名称软件功能项目功能说明一级功能二级功能三级功能模块名称软件功能项目功能说明一级功能二级功能三级功能注:1、每个软件模块一份表单。
2、软件功能项目列表需列出与测试相关的所有功能(包括各级子功能)。
3、功能说明栏目应填写:功能项目概述、边界值规定(数据有效性)、安全说明等信息。
4、功能列表上所列出来的功能必须是可以实现或演示的。
5、功能名称与软件、文档保持一致。
6、软件功能项目列表根据需要列出(可增加或删减子功能列)。
1.3.2.用户界面设计采用广泛应用的图形用户界面(GUI),即诸如窗口、菜单、对话框、滚动条等。
用户主界面见图1.3-2。
图1.3-2 XXX用户主界面1.3.3.外部接口XXX可使用VISUAL C++ 提供的对SQL SERVER 的接口,进行对数据库的所有访问。
XXX可使用SQL SERVER 的对数据库的备分命令,以做到对数据的保存。
在网络软件接口方面,使用一种无差错的传输协议,采用滑动窗口方式对数据进行网络传输及接收。
1.4.硬件关系1.4.1.物理拓扑图嵌入式软件物理拓扑关系表格形式——示例1硬件软件分类零件种类功能显示部分血压显示7工具LED 血压值显示最高血压・最低血压、脈拍を表示时刻显示7工具LED 時刻显示显示现在时刻压力单位显示LED mmHg / kPa 显示显示血压值以及压力值的单位开关部分开始/关闭开关开始/关闭开关读取控制开始测量血压测量时停止测量背面功能设定开关背面功能设定开关读取控制时刻的设定等、主机功能设定的更改打印部分打印切纸打印控制测量结果的打印、打印后切纸血压测量部分泵、电磁阀、压力传感器血压测定控制测量时加压、减压控制、脉搏信号处理以及测量值的确定安全监视用压力传感器压力安全检测控制压力监测、急排控制袖带驱动部分袖带驱动用马达袖带控制袖带的卷曲、固定、开放语音部分扬声器语音控制测量通知外部进出力部串行通信串行进出力测量结果出力、指令输入记忆存储U盘设定值记忆存储控制功能设定内容的保持嵌入式软件物理拓扑关系表格形式——示例2独立式软件物理拓扑关系表格形式——示例3图1.4-1物理拓扑图1.4.2.连接关系描述与PC连接与医疗器械硬件连接1.5.运行环境1.5.1.硬件配置处理器:储存器外设器件输入/输出设备……1.5.2.软件环境系统软件:支持软件:必备软件:选配软件:杀毒软件:……1.5.3.网络条件网卡:网络类型:网络架构:1.6.适用范围独立软件:软件的适用范围和适用人群。
软件组件:同医疗器械产品的适用范围和适用人群。
1.7.禁忌症独立软件:软件的禁忌症和不适用人群。
软件组件:同医疗器械产品的禁忌症和不适用人群。
1.8.上市历史(软件组件写医疗器械的上市历史)(表格形式)国产首次注册示例:该医疗器械,产品名称为XXXXX,据产品结构及预期用途,按《医疗器械分类目录》分为6870类软件,按照二/三类医疗器械进行首次注册。
进口(首次/重新)该医疗器械作为XXX的组件,在中国(首次/重新)申请上市。
依据产品结构及预期用途,按《医疗器械分类目录》分为68xx-xx类。
上市历史详情见下表:2.实现过程2.1 开发综述我司于XXXX年XX月开始XX软件的开发工作。
整个开发过程包括可行性研究和项目开发计划、需求分析、概要设计、详细设计、编码、集成、测试等6个阶段,并编制相应开发文档。
本软件开发采用XXXX模型。
在开发过程中,采用的语言、工具和方法分别为:a)语言:本软件开发采用XX语言;b)工具:—软件需求工具:XXXXX,版本:XXXXXX,来源(制造商):XXXXXX;—设计工具:—构造工具:—测试工具:—维护工具:—配制管理工具:—缺陷管理工具:—……c)开发方法:本软件采用XXXXX方法;在开发过程中,开发人员为XXX人,开发时间为XX月,工作量为XXXX人月。
代码行共XXXX行,控制文档XXXX个。
2.2 风险管理风险管理报告全文,见附件1。
XXX风险管理报告(文件号:xxx版本:xxx)2.3需求规格(SRS)《需求规格说明书》(SRS)全文,见附件2。
《需求规格说明书》(文件号:xxx版本:xxx)2.4生存周期《软件开发计划》(SDP)摘要见附件3。
《软件配制管理计划》(SCMP)摘要见附件4。
《软件维护计划》摘要见附件5。
《生存周期实施情况核查表》见附件6。
2.5验证与确认《软件验证与确认计划》见附件7。
在软件开发过程中,进行了以下测试:各测试文档详见附件82.6缺陷管理2.6.1缺陷管理的流程2.6.2缺陷总数和剩余数开发过程中发现缺陷xx个,上市后剩余缺陷数为xx个。
2.7修订历史软件版本的命名规则:软件的版本号为XX.XX.XXXXX的形式,版本号中,第一位是xx,代表:XXXX,第二位是xx,代表……。
2.8临床评价参考医疗器械软件描述文档附件9“《临床评价报告》(文件号:xxx版本号xxx)”。
——与注册资料7临床评价资料一致。
3核心算法概述算法类型:公认成熟算法:公开文献专利标准、原理简单明确、上市超过四年且无不良事件。
公认成熟算法列明名称、原理、用途,全新算法列明名称、原理、用途,并提供验证资料。
全新算法:源自科学研究和临床数据内容:实质首次注册:所有核心算法实质重新注册:新增核心算法XXX风险管理报告XXX需求规格说明书(SRS)1.引言1.1编写目的为了明确“XXXXX”项目的需求,为用户和分析设计人员之间的交流提供方便,更好地安排项目规划与进度,组织软件开发与测试,减少项目风险,撰写本需求规格规格说明书。
本需求规格说明书的读者为项目经理、分析设计人员、程序员、质量保证人员、维护人员以及客户方的相关人员。
1.2项目背景1.3定义GB/T 11457所列术语和下列定义适用于本指南。
合同:指XXXX共同签署的关于本项目的合同。
客户:指XXXX公司。
语言:是指具有语法和语义的通信工具,包括一组表达式、惯例和传递信息的有关规则。
编程语言:是指用于编写源程序的高级语言和汇编语言。
用户:XXXXXX……1.4参考资料a)GB/T 11457 软件工程术语b)GB 8566 计算机软件开发规范c)GB 8567 计算机软件产品开发文件编制指南d)GB/T 12504 计算机软件质量保证计划规范e)GB/T 12505 计算机软件配置管理计划规范f)GB/T 19001 质量管理体系g)ISO9001 质量管理体系h)ISO9000-3质量管理体系i)ISO/IEC 12207软件生命周期过程标准j)ISO/IEC TR 15504软件过程评估标准k)IEEE1058.1软件项目管理计划标准l)CMM 2.0 能力成熟度模型m)PMBOK项目管理知识体系n)项目计划任务书o)项目开发计划p)设备用户手册……2.总体描述2.1目标2.1.1开发意图、应用目标a)开发意图:XXXX。
b)应用目标:XXXX2.1.2产品描述(描述产品的基本要求、主要部分、外部接口等可使用框图展示较大系统的主要部分、相互关系、外部接口等))2.1.2.1软件系统总体结构图采用基于采用MVC 模式架构的开发方式,实现的系统具有界面美观、操作简单、开发系统容易升级、系统开发周期短、成本低等优点。
在项目的研发中,从体系结构上将本系统设计为4层结构:系统结构图(结构图说明)2.1.2.2软件系统总体数据流图(图示及说明)2.1.2.3系统功能的总体用况图(图示及说明)2.1.2.4约束:a)系统接口;(列出每个系统接口,识别完成系统需求的软件功能以及与系统匹配的接口描述。
)b)用户界面;(如要求的屏幕显示格式、页面、版式、报告内容、菜单内容等)c)硬件接口;(如支持的设备,采用的协议等)d)软件接口;(与其他软件的接口,软件应提供名称、助记符、规格说明编号、版本号、来源,接口软件的目的等)e)通信接口;(如局域网协议等)f)内存约束;(对主存、辅存的任何使用特征和限制)g)运行;(如用户引发的操作、交互操作的周期、无人值守操作的周期、数据处理支持能力、备份和回复操作)h)现场适应性需求(给定现场、任务和运行模式的需求)2.2产品功能描述软件的将执行主要功能的概要。
(可用文本或图示的方法,显示不同功能及其之间的关系,显示变量之间的逻辑关系)2.3用户的特点a)管理员:。
b)用户1:c)用户2:2.4约束条件经费限制:时间限制:硬件局限:方法、技术、环境:法规:标准:并行操作:审核功能:……3.具体需求3.1外部接口各接口描述包括以下内容:a)项的名称;b)目的描述;c)输入源和输出目的地;d)有效范围、准确度和容限;e)测量单位;f)定时;g)与其他输入/输出的关系;h)屏显格式;i)窗口格式;j)数据格式;k)命令格式;l)结束消息。
3.1.1.1用户接口3.1.1.2硬件接口3.1.1.3软件接口3.1.1.4通信接口3.2功能需求3.2.1用户注册功能系统应能完成用户注册功能➢主参加者:用户➢环境目标:➢前置条件:数据库有足够的空间。
➢触发器:用户进入注册界面。
➢场景:a)用户进入注册界面。
b)用户输入会员名。
c)用户输入登录密码。
d)用户输入确认密码。
e)用户输入其他个人基本信息。
f)用户输入验证码。
g)点击确认按钮,提交注册信息。
➢异常:a)用户注册的会员名已在系统中存在时,给出提示信息,让其更改所输入的会员名。
b)用户输入的确认密码与登录密码不一致时,给出提示信息,让其重新输入密码。
c)用户输入的验证码错误时,给出提示信息,随机更换验证码的图片后,让其重新输入验证码。
➢优先级:必须被实现。
➢何时可用:首次开发。
➢使用频率:每天多次。
➢后置条件:用户完成操作后显示注册成功信息。
➢活动图3.2.2…………3.3性能需求3.3.1支持的终端数:3.3.2支持同时运行的用户数量;3.3.3要处理的信息量和类型:3.3.4精度3.3.5速度:3.3.6人身和环境安全性需求3.4数据库逻辑需求(规定将置于数据库的任何信息的逻辑需求,可包括:)a)不同功能使用的信息类型;b)使用频度;c)访问能力;d)数据实体及其之间的关系;e)完整性约束;f)数据保存要求3.5设计约束(描述由可能由其他标准、硬件局限等引发的设计约束)3.6软件系统属性3.6.1可靠性3.6.2可用性3.6.3保密性需求a)对注册过的用户个人信息的严格保密,除用户自己以及管理员之外,其他人不能查阅用户信息。
