芦荟的组织培养
美国芦荟组织培养研究

1. .5继代 培养 。 2 将启动培养所获得 的嫩 芽剪下接种 于 增 殖 培 养 基 上 进 行 增 殖 培 养 。继 代 培 养 基 分 别 用
6 B . 、. , 1 m / 和 2 mg 与 N A 一A 0 m 5 1 mr . g 0  ̄、 5 L . / O L A
植物 不同品种芽的分化都有不 同程度 的影响 。 因此 , 以 MS为基本 培养基 ,采用 2因素 3 水平 方差试验设计 , 6B - A设 置 l g 、m /、r /3 水平 , A m/ 2 g 3 g 个 L L a L N A设 置为 00 m / 、. g 、. m / .5 g 01 / 01 g 3个水 平 。每种 培养 基接 L m L 5 L
较好地促 进美 国芦荟茎段 芽诱 导生长 。
表 1 不 同激素组合对启动 率的影响
保湿 1 , 周 并进行正 常的水分 管理 ,0 3d后统计 成活 率
可达 9 . 5 %。 3 3 结论
在 芦荟 的组织 培养过程 中 , MS为基本培 养基 , 以
在初代 培养 中添加 6 B m 和 N A0 5 g 一 A2 玑 A . m f 0 L能较 好 的促进茎 段芽诱导和提高启 动率 ;继代增殖 中添 加 6 B . gL和 N A 0 5 / 一 A1 m , 0 A . mg 0 L能较 好地 促进 芽苗 增 殖 ;在生根 培养 中用 I MS培养基添 加 N 05 g / 2 从 . m m 能较好促进 无根单 苗 生根 ,诱 导出的根 粗壮 而且 多 。
织培养 ,可在较短时间 内繁殖 出大量优质美国芦荟种 苗[1目前, 5。 . 4 有关美 国芦荟组织 培养方面的研究报道相
芦荟种苗繁育技术

芦荟种苗繁育技术摘要分株是将带有根系的幼苗进行移栽繁育的过程;扦插是利用枝条或无根分蘖、腋芽通过扦插培育种苗的技术;组织培养是利用培养基大量繁殖种苗。
特介绍利用分株、扦插和组织培养等繁育方法进行芦荟种苗繁育的技术关键。
关键词芦荟;繁育;分株;扦插;组织培养;技术关键芦荟由于雌雄花开放时间不一致,授粉不亲和,故而结籽少,发芽低,甚至不结籽,因而种子繁殖很困难且繁殖速度慢。
生产上常用分株、扦插和组织培养等方法进行繁殖。
1分株繁殖芦荟产生分芽或分蘖主要在春、夏、秋三季,最佳分株期是4~6月份。
一般待小苗长到2~3片叶时,就应及时进行分株移栽,分苗时注意不伤母株,小苗尽量多带土带根。
在分株繁殖过程中,具体操作技术可分2种。
1.1剥离幼株,移栽到苗圃或生产田将带有幼根的幼株直接从母体剥离下来,移栽到苗圃或生产田中。
刚移栽的幼苗,由于脱离了母株,营养供应来源发生了变化,自生根尚未扎入土壤,会出现一个营养不足的“饥饿时期”。
如受到烈日照射,苗色呈红褐色,外叶干缩,这是芦荟移栽后的“缓苗现象”。
此时的技术关键是采用适当遮荫,这样可缩短缓苗时间,促进芦荟恢复生长。
有些地区先将芦荟幼苗从母株上剥离出来,然后摊在地上,在通风处干燥数日,使其剥离伤口完全愈合后再作定植,这样可以促进植株发根和缓苗,缩短缓苗期,减少芦荟幼苗死株。
1.2幼株与母株分离但不分开用分株刀将母株萌发出的幼苗与母株分离,但不要拔出来,仍让幼苗留在原位,使其生长15d左右,形成独立的根系,达到完全自养状态,再将幼苗带根带土移栽,定植在大田中,及时浇一遍定植水。
此法基本上无缓苗期。
芦荟幼苗生长快,在春秋夏季都可以随时进行,但比较费工。
2扦插繁殖2.1茎穗扦插在芦荟生长期采用生长充实的主茎或侧枝,剪取顶端短茎10~15cm作为扦插材料,或用采收芦荟叶片后形成的“秃杆”老龄植株断茎后扦插。
为避免枝条切口被杂菌感染和促进生根,扦插枝条取下后,置于通风干燥处使伤口愈合收干,然后进行扦插,插入深度为6~8cm,扦条经过25d左右就会生根。
芦荟的组织培养快速繁殖技术

辽宁林业职业技术学院园林专业毕业论文芦荟的组织培养快速繁殖技术学生姓名:聂瑛磊学号:05050819指导教师:刘姗姗专业:园林年级:058 班2008年 3 月 19 日目录摘要 (1)关键词 (1)1引言 (1)2方法 (1)2.1材料与培养基 (1)2.1.1材料的选择 (1)2.1.2培养基的选择与配制 (2)2.1.3植物生长调节剂的使用 (2)2.2愈伤组织培养 (2)2.3继代培养 (3)2.4分化培养 (3)2.5生根培养及苗床假植 (3)2.6炼苗 (3)2.7移栽 (3)2.8脱水 (3)2.9栽植 (3)3影响芦荟组织培养效果的因素 (4)3.1不同外植体的接种效果 (4)3.2培养条件的影响 (4)3.3不同浓度细胞分裂素对芦荟分化的影响 (4)3.4温度对芦荟分化的影响 (5)3.5光照对芦荟分化的影响 (5)3.6无机盐对芦荟苗生根的影响 (5)3.7活性炭对芦荟生根的影响 (5)3.8不同栽培基质对芦荟组培秒生长的影响 (6)3.9不同栽培气候条件对芦荟组培苗生长的影响 (6)4芦荟组织培养中褐化与玻璃化的控制 (6)4.1褐化对芦荟组培的影响及控制 (6)4.2玻璃化对芦荟组培的影响和控制 (6)5结果与分析 (7)5.1芦荟外殖体的诱导的两种途径 (7)5.2快速增殖 (7)5.3细胞分裂素对分化的影响 (7)6结论 (7)致谢 (8)参考文献 (9)芦荟组织培养与快速繁殖技术研究摘要:芦荟(Aloe)是百合科芦荟属多年生常绿多肉质草本植物。
原产于非洲干燥地区,集药用、观赏、美容、保健于一身,全植株均可入药,具有清热、消炎、通便作用,可治疗冲叮、溃疡、支气管哮喘、热结便秘等,有极高的开发应用价值,有着“绿色黄金”之称。
在我国,随着人们生活水平不断提高和保健们意识的不断增强,芦荟作为保健食品逐渐受到人们的喜爱,生产上对芦荟种苗的需求也日益增加,芦荟产业发展开始走向规模化。
芦荟组培实验报告
1.2 培养基
愈伤组织诱导培养基(一)MS + ( 2. 5mg / 1) 6- BA+ ( 0. 15mg / 1) NAA, PH6. 2;
目前,芦荟广泛用于化妆品、食品、饮料、医药行业中。芦荟目前主要的繁殖方法是分株和扦插,繁殖速度较慢,因而限制了芦荟业的发展。分株和扦插的方法已经不能适应生产发展的要求,因此用组织培养快速繁殖的技术,可以提高产量,成本低,效益高。
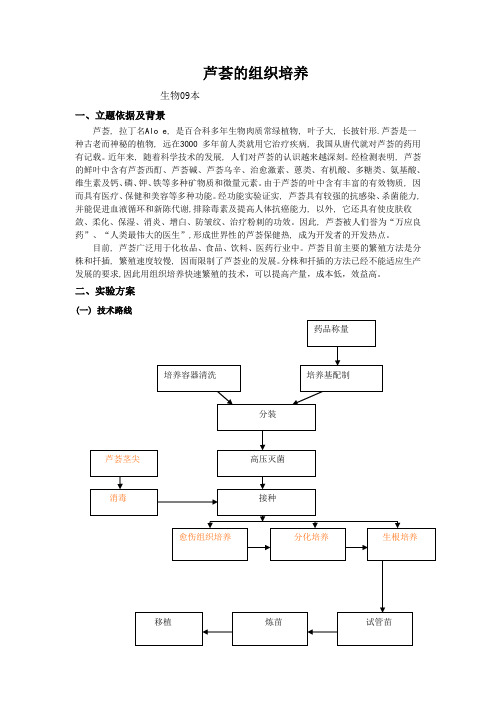
二、实验方案
(一) 技术路线
(二) 材料、方法与手段
1 材料
1.1 样品来源
2.2愈伤组织
在无菌条件下,将灭菌好的芦荟的茎尖接种到愈伤组织诱导培养基上,培养条件:温度( 27±1)℃,每天光照10hr—12hr后,光强2001x ,约15天后,试管中的外植体就可膨大形成愈伤组织周后,可将愈伤组织转管进行继代培养或分化培养。两种各培养基接15瓶,每瓶接3块组织。
2.3分化培养
培养基(二):M S + BA 4.5mg/L + NAA 0.2mg/L +0.25%活性炭上
2.方法与手段
2.1外植体获得
将准备好的芦荟幼苗,用自来水冲洗好后,洗净外表泥土,切除根部大部分叶片,取茎尖部分,先用75%乙醇浸泡60S,然后再用0. 1%升汞消毒15min,最后用无菌水洗4次—5次。
3天
6天
9天
12天
15天
2.分化培养
分化培养基1
分化培养基2
接种数
分化数
分化百分比
小苗情况
原因分析
3.增值生根培养
《芦荟的组织培养》课件

组织培养的基本原理
介绍组织培养的基本原理和作用机制。
组织培养的步骤
详细说明进行芦荟组织培养时的步骤和 操作方法。
芦荟组织培养的应用
芦荟提取物 取物在医学和工业领域中的应用。
探讨芦荟在药物研究和治疗方面 的潜力。
工业领域的应用
讨论芦荟在工业生产中的用途和 应用领域。
芦荟的组织分化
通过培养芦荟的不同组织部 位,促进其分化和生长。
芦荟的快速繁殖
利用组织培养的技术,快速 繁殖大量芦荟植株。
芦荟的体细胞胚胎培养
通过体细胞胚胎培养技术, 培养出芦荟的胚胎组织。
芦荟的组织培养技术
1
组织培养所需的条件
2
讲解进行组织培养时所需的培养基和环
境条件。
3
组织培养注意事项
4
提醒注意进行组织培养时需要特别注意 的事项和技巧。
[参考文献列表]
鸣谢
感谢支持和协助本课件制作的各方。
《芦荟的组织培养》PPT 课件
编者:[您的姓名]
日期:[日期]
本PPT课件将全面介绍芦荟的组织培养,包括基本原理、方法、技术和应用领 域,以及未来的发展趋势和研究方向。
简介
芦荟是一种常见的多年生植物,其组织培养是一项重要的研究领域。本节将介绍芦荟的概述、组织培养的定义 以及芦荟组织培养的重要性。
芦荟的组织培养方法
研究展望
1 芦荟组织培养的发展趋势
展望芦荟组织培养研究的未来发展方向。
2 未来的研究方向
提出关于芦荟组织培养的未来研究方向和可 能的创新。
结束语
1 芦荟组织培养对于我们的意义
总结芦荟组织培养对于科学研究和实际应用 的重要意义。
2 芦荟组织培养的未来前景
芦荟、紫苏组织培养实验报告

芦荟、紫苏组织培养实验报告一、实验目的与实验要求1、学习MS培养基母液的配制方法。
2、学习用母液法配制培养基以及掌握培养基灭菌的方法。
3、初步掌握外植体芦荟、紫苏等植物材料消毒、接种的无菌操作技术以及外植体初代培养的方法。
4、认识植物组织培养技术在生产实践中起的作用,尤其在于保存珍贵物种和生产研究方面的应用。
5、体验开放式实验教学,培养生物实验意识,提高学习的主动性、获取实验知识的能力和撰写实验报告水平。
二、实验方案1、实验仪器冰箱,分析天平,烧杯(50mL,100mL,500mL,1000mL),量筒(1000mL,100mL,25mL),容量瓶(1000mL,500mL,100mL),磨口试剂瓶(500mL,1000mL),药勺、称量纸、精密pH试纸,滴管、玻璃棒、电炉,微波炉、移液管(10mL,5mL,2mL,1mL,0.5mL),吸耳球,滴瓶,锥形瓶、纱布,耐热橡皮筋,线绳,高压灭菌锅,标签纸,记号笔、解剖工具、托盘、棉花、超净工作台2、实验药品NH4NO3, KNO3, CaCl2•2H2O, MgSO4•7H2O, KH2PO4, KI, H2BO3,MnSO4•4H2O,ZnSO4•7H2O, Na2•MoO4•2H2O, CuSO4•5H2O, CoCl2•6H2O, Na2•EDTA•2H2O,FeSO4•7H2O,烟酸,甘氨酸, 维生素B1,维生素B6 ,肌醇, 蒸馏水, 琼脂,蔗糖,NAA,6-BA,1mol/LHCl,1mol/LNaOH, 升汞,吐温-803、实验原理(1)母液法配制培养基原理在实验中常用的培养基,可将其中的各种成分配成10倍、100倍的母液,放入冰箱中保存,用时可按比例稀释。
配制母液有2点好处:一是可减少每次配制称量药品的麻烦,二是减少极微量药品在每次称量时造成的误差。
母液可以配单一化合物母液,但一般都配成以下四种不同混合母液。
应注意以下几个方面:A.药品称量应准确,尤其微量元素化合物应精确到0.0001克,大量元素可精确到0.01克。
芦荟组培实验报告

一、实验简介实验名称:芦荟组织培养实验实验目的:了解芦荟组织培养的基本原理和方法,掌握植物组织培养技术,探索芦荟快速繁殖和优良品种选育的新途径。
实验时间:2023年X月X日至2023年X月X日实验地点:XX大学植物组织培养实验室二、实验材料与仪器1. 实验材料:- 芦荟植株:新鲜、无病虫害的健康芦荟植株- 诱导培养基:MS培养基(改良Skoog和Lisense培养基)- 细胞分裂素:6-苄基腺嘌呤(BAP)- 脱分化培养基:1/2MS培养基- 生根培养基:1/2MS培养基+IAA(吲哚乙酸)- 营养液:1/2MS培养基+植物激素- 灭菌剂:70%酒精、0.1%氯化汞2. 实验仪器:- 恒温培养箱- 离心机- 超净工作台- 剪刀、解剖刀、镊子、剪刀等三、实验方法1. 材料处理- 将芦荟植株洗净,用70%酒精消毒后,用0.1%氯化汞浸泡5分钟,再用无菌水冲洗3次。
- 将消毒后的芦荟植株切成小块,每块含有1-2个腋芽。
2. 芦荟组织培养- 将芦荟小块接种于诱导培养基上,置于恒温培养箱中,培养温度为25℃,光照时间为12小时/天。
- 在诱导培养基中,细胞分裂素浓度为0.5mg/L,培养7天后,观察愈伤组织的形成情况。
3. 愈伤组织分化- 将愈伤组织接种于脱分化培养基上,继续培养,观察愈伤组织分化成丛生芽的情况。
- 在脱分化培养基中,细胞分裂素浓度为0.1mg/L,生长素浓度为0.1mg/L,培养14天后,观察丛生芽的形成情况。
4. 丛生芽生根- 将丛生芽接种于生根培养基上,置于恒温培养箱中,培养温度为25℃,光照时间为12小时/天。
- 在生根培养基中,生长素浓度为0.5mg/L,培养10天后,观察生根情况。
5. 炼苗与移栽- 将生根后的芦荟幼苗移栽到土壤中,进行炼苗。
- 注意保持土壤湿润,适当遮荫,促进幼苗生长。
四、实验结果与分析1. 芦荟愈伤组织形成- 在诱导培养基中,芦荟愈伤组织形成较为良好,愈伤组织呈白色,质地柔软。
中华芦荟特性与组织培养技术

水 曲柳 (rx u adhfa是东北 地 区 Fai sm nsu c) n i 主要 的用材林树种 , 是优 良的绿化树 种 , 也 因此 备受人们的喜爱m 。现代城市发展方向是生态健 全、 环境优美 、 自 和谐共存 的园林城市。 人与 然 北 方的大树移植研究的很多 黑龙江省海林林业 局为 了响应 省政府 关于用三年时间绿 化全省大 地 的精神 ,于 20 年在局址的海林市奋斗路北 08 段 , 了水曲柳 大树进 城 , 行道树 绿化的 进行 实施 移植工 作 , 共移植 了 28 , 8 株 成活率达到 10 0%。 对此 , 我们探讨 了水 曲柳 大树 移植过程 中 , 确保 高成活率的主要关键性技术 , 以便为 日后的移植 工作 , 提供技术上 的建议。 1移植 的原理 根据树势平衡原理 , 移植大树时 , 其根 根据 系分 布的情况 , 对地上部分进行 修剪 , 上部 使地
范围内。 2 . 曲柳大树的质量要求 .2水 1 根据大树移植的要求 , 我们也相应的确定 了 水 曲柳 的质量标准 。水 曲柳应生长在 向阳的南
坡, 林分应 是中壮林 , 生长旺盛 , 树体 树干通直 , 树高在 2m 1m, 3 -5 胸径在 1c -5m之间, 2m 1c 无病 虫害的。 2- l 3选树与定向 在林 内郁 闭度为 0 3的地块中,按照大树的 质量要求进行选树 , 选完树后 , 挂上标签 , 确定为 已选的绿化用树。把已经选好 的水 曲柳大树 , 采 用手罗盘定向后 , 根据已经测得的方向确定在南 向做标记, 为定植时的定 向依据。 Z .起树时间与方法 1 4
( 转 2 8页 ) 下 2
中国新技术新产 品
一2— 27
植物的组织培养教学设计-芦荟

植物的组织培养教学设计-芦荟组织添加物的影响。
活性炭对多数芦荟种类组培有促进生根作用,在加有活性炭的培养基中,活性炭可以吸收根基有害物质,促进生根作用。
但活性炭的浓度不宜太高,过高则会吸附外源生长素,进而抑制生根作用。
通常认为,1mg活性炭大约能吸附100μg生长调节物质,在不同的培养基中,活性炭的吸附能力也有所不同。
此外,向培养基中添加一定浓度的腐殖酸、香蕉汁和苹果汁等,可使腋芽提早萌动,提高腋芽的出芽率和增殖系数,促进组培苗的根系发育和叶片生长。
组培条件的选择。
在芦荟的组织培养中,培养条件不同也会产生很大的影响。
尤其要重视pH培育基的作用。
在培养条件中,以pH最为重要。
培养基的pH一方面对离体器官的形成和发育起着重要的作用,另一方面对芽的生长、分化以及培养基的硬度有很大的影响。
通常情况下,在偏酸性条件下(pH6.2)比较有利于分化形成愈伤组织,并进一步形成不定芽;在中性至偏酸环境(pH6.2—7.0)下,比较有利于不定芽的分化增殖。
培养条件中,另一个重要的因素是光照,包括光照强度和光照时间。
光照对外植体的褐变有一定影响。
通常条件下,芦荟的组织培养一般在黑暗或弱光照的条件下进行即可,光照过强,则外植体容易发生褐变。
温度也是影响芦荟组织培养的一个重要因素,芦荟的组织培养通常在25℃条件下进行,温度过高或过低均易导致褐变的发生。
还要注意抑制剂和吸附剂的应用。
在芦荟的组织培养中,最常见的问题是外植体发生褐变。
褐变是由于多酚氧化酶(PPO)被氧化成醌类物质所致,呈红褐色,并抑制许多酶的活性,影响植物材料的正常生长,严重时导致培养物死亡。
褐变受多种因素的影响,包括外植体的选择、激素的种类和浓度、培养温度、光照时间和强度、培养基种类及pH等。
通常在组织培养过程中加入抑制剂和吸附剂来减轻或避免褐变的产生。
常用的抑制剂有Vc、半胱氨酸、硝酸银等,其中硝酸银的抗褐变效果较好,当硝酸银浓度为15mg/L时,抗褐变效果最佳。
芦荟体外组织培养

实验设计班级:生物技术111 学号:7010711024姓名:付梦云芦荟体外组织培养芦荟为百合科芦荟属多年生常绿多肉质草本植物,叶簇生,呈莲座状或生于茎顶,叶长披针形或叶短宽,边缘有尖齿状刺。
它含有许多对人体有益的物质,如芦荟索、多糖、蛋白质、氨基酸、维生素、活性酶及微量元素等70多种有效成分,它具有催泄、健胃、通便、消炎、抗菌、抗肿瘤等药理作用,对胃肠病、肝病、糖尿病、心脏病、高血压等都有不同程度的疗效,尤其对各种灼伤、烫伤、晒伤及皮肤病有明显疗效,并具有较高的观赏价值,是集药用、食用、美容及观赏等于一身的热带植物,所以芦荟是一种很有开发应用前景的经济作物。
芦荟植株要生长数年后才开花结实,加之雌雄花开放时间不一致,故种子很少。
芦荟种子很细小,存放一年发芽率即降低,一般是采后及时播种。
但是,用种子育苗手续繁杂,生产上多用插枝法或分株法繁殖,这些方法繁殖速度很慢,而且容易积累病菌,影响生长,甚至造成退化。
利用组织培养技术,通过试管繁殖可达到复壮、快繁的目的。
一.材料:芦荟茎二.培养基:1.基本培养基:培养基为MS培养基(见附表),外加蔗糖30g/l,琼脂5g/l,6-BA1.0~2.0mg/l,NAA0.1~0.2mg/l.2.根生培养基:1/2MS培养基,外加0.1~0.2mg/l NAA.三.培养条件:外植体培养在25℃±2℃恒温,1600~2000lux光照下,每天光照不少于10小时。
四.步骤:1.丛生芽的诱导:取新鲜芦荟,剥去外层较老的叶片,并切掉里面较长的叶片,保留基部4~5cm,于自来水下冲洗干净。
在无菌条件下,将芦荟茎用70%的酒精消毒2~3s,再用2%次氯酸纳浸泡消毒5~10min,无菌水漂洗2~3次,切成0.5cm切段,分别接种于预先灭菌的三角瓶的培养基上。
在接种时,为了减少出现杂菌,将切割的外植体用酒精灭菌法灭菌后接种。
PS:接种后15天左右,顶芽开始生长,腋芽萌动长出小芽,同时,外植体切口部位,长出多个白色突起,小突起逐渐长成绿色的丛生芽。
芦荟组织培养

实验十、芦荟的组织培养(自选实验)前言:芦荟属(学名:Aloe)通称芦荟,原产于地中海、非洲,为独尾草科多年生草本植物,据考证的野生芦荟品种300多种,主要分布于非洲等地。
这种植物颇受大众喜爱,主要因其易于栽种,为花叶兼备的观赏植物。
因此芦荟具有积极重要的经济价值。
摘要:本实验以芦荟的芽为外植体进行组织培养,通过不定芽萌发途径再生植株。
诱导培养基:MS+ BA2.0mg/L+NAA0.2mg/L;(4)继代培养基:MS+ BA2.0mg/L+NAA0.2mg/L;生根培养基:1/2MS+NAA0.1mg/L;关键词:芦荟茎段外植体诱导培养1、实验目的芦荟的常规繁殖同许多植物一样有有性繁殖和无性繁殖两种。
由于芦荟雌雄花开放时间不一致,授粉不亲和,故而结实少,并且种子细小,再加上芦荟有些品种只开花不结果,因而有性繁殖速度慢,因而无法满足芦荟种植业发展和开发芦荟资源对种苗的要求。
芦荟的组织培养不仅可在短期内繁殖大量规格一致、种性稳定的芦荟种苗,还具有可以保持芦荟资源的永续利用。
2、材料和步骤:2.1材料1、芦荟幼嫩茎段2、诱导培养基:MS+ BA2.0mg/L+NAA0.2mg/L+30g/L白糖+8.5g/L卡拉胶3、继代培养基:MS+ BA2.0mg/L+NAA0.2mg/L+30g/L白糖+8.5g/L卡拉胶4、生根培养基:1/2MS+NAA0.1mg/L+30g/L白糖+8.5g/L卡拉胶5、PH: 5.8-62.2步骤2.2.1外植体消毒方法用自来水冲洗芦荟茎段表面的泥土,用干净的手将幼嫩芦荟苗的叶片大部分摘除,只留下约1cm左右的叶段。
将芦荟茎段切成1cm长,用70%酒精消毒15-30 s,用灭菌水冲洗1次后,放入0.15%升汞消毒约10min,灭菌水冲洗3-4次,滤干水分,准备接种。
2.2.2诱导培养将芦荟茎段放到无菌工作台的无菌纸上,用消毒刀剥去几层外裹的叶片,然后切成两半,按生长极性方向植入诱导培养基。
芦荟组织培养研究进展

芦荟组织培养研究进展由继红(东北师范大学生命科学学院 长春 130024) 摘 要 本文首先对芦荟植物做了简单介绍,之后对芦荟的组织培养状况进行了概述,最后提出了对芦荟组织培养的一点看法。
关键词 芦荟;组织培养;愈伤组织1 芦荟简介一般所说的芦荟为芦荟属(A loe L.)植物的统称,属于单子叶植物百合科(Liliaceae)。
全世界约有300多种,为多年生常绿植物,叶片多肉质,大部分分布于热带和亚热带地区。
芦荟植株要生长数年后才开花结实,雌雄花开花期不同,导致种子很少,加之芦荟种子很小,采后存放一年发芽率明显降低。
一般采种后应及时播种,但用种子育苗手续繁杂。
所以,一般多用扦插法或分枝法繁殖。
可是,用这些方法繁殖芦荟的速度都很慢[1,2]。
芦荟是一类用途很广的药用植物。
现已证明,芦荟具有160多种化学成分,其中药用成分约80种,有消炎、促进伤口愈合、抗肿瘤、保健、美容等作用。
国内外不断出现“芦荟热”并形成产业[3,4]。
国外以美国芦荟产业最发达,年销售量达2亿美元,北美、欧洲、日本、韩国等国家的芦荟市场开发已成规模,且还在扩大。
国内几乎各省都有单位或个人在搞芦荟产业开发,并成立了芦荟产业联系会。
2 芦荟组织培养状况2.1 组织培养成功的芦荟品种Groenewald,E.G.等[5](1974)首先对普勒多利亚芦荟(A loe pretoriensis Evans.)进行组织培养并获得成功,之后,人们对其他品种的芦荟也进行了组培方面的研究,已经培养成功的其他品种芦荟有:库拉索芦荟(A.vera L.),中华芦荟(A.vera L.var. chi nensis(Haw.)Breg),木立芦荟(A.arborescens Mill.),刚健芦荟(A.nobilis),巴巴芦荟(A.bar2 badensis Mill.)等。
2.2 外植体及灭菌芦荟组织培养所用外植体有顶芽、茎段、叶片、叶鞘,芦荟试管苗无论在遗传稳定性,还是繁殖系数方面,都以顶芽的组织培养效果最好。
芦荟的组织培养及快速繁殖

・3 5・
ห้องสมุดไป่ตู้
芦荟 的组织培 养及快速繁殖
刘 文 婷 ( 湖南省邵东县第一中学, 湖南 邵 东 4 2 2 8 0 0 )
摘 要: 针对库拉 索芦荟进行 了组织培养的研 究, 以期通过试管繁殖达到快繁的 目的。 关键词 : 芦荟; 培养; 快速繁殖 2 . 2 腋芽苗的快速繁殖 。 将诱导出的芽再转接到( 1 ) 、 ( 2 ) 、 ( 3 ) 三种培 芦荟( A l o e ) 是百合科芦荟属的多年生常绿 胜肉质多浆植物, 种类繁 多, 世界同属植物约 3 l 0种以上 , 在众多的芦荟中 , 药用 的品种所 占的 养基上 , 继代培养 2 5天后发现 , ( 2 ) 号培养基 上芽增殖率最高 , 达4 ~ 6 比例很小, 库拉索芦荟就是其中之一, 它因产于南美洲北岸附近的库拉 倍 ; ( 3 ) 号培养基上芽增殖率较高, 达3 — 4 倍; ( 1 ) 号培养基增殖率最低 , 索等地而得名。 2 0 世纪 9 0 年代库拉索芦荟引种我国, 它是一种集药用、 为3 左右。 这说 明( 2 ) 号培 养基 ( 即 6 - B A1 +N A A 0 . 2 ) 是快速 繁殖 的最 观赏 、 美容和保健于一身的植物, 因此 , 具有较高的开发应用前景。 近年 好培 养基 。 将 形成 的高 1 ~ 2 c m 的小苗 切下再 继续 转入 ( 2 ) 号培养 基上 , 来, 世界兴 起 了“ 芦 荟热 ” , 国人对 芦荟 产 品 的兴趣 也 日益 兴盛 起来 。 目 2 5 天 后义 可获得 许多 小苗 , 此 过 程反 复进 行 即可获 得大 量的试 管苗 。 I j 订 , 我国引种的库拉索芦荟一般都采取分株育苗和扦插育苗 , 但这些方 2 3试管苗的生根与移栽。 将高 2 - 3 c m的小苗转人生根培养基( 5 ) 、 6 ) 、 ( 7 ) , 1 5 -2 0天后 均 能 生 根 ,但 以 ( 6 )号 培 养 基 ( 即N A A 0 . 1 + 法I 六 I 受良种基数限制 , 繁殖 系数低 , 繁殖速度慢 , 而且容易积 累病菌 , 影 ( 响生长 , 甚至造成了退化 。因此 , 如何快速繁殖库拉索芦荟已成为生产 P , , 0 . 1 ) 最好 , 生根率可达 8 0 %以上 , 每株平均根数为 2~ 3条。3 O天 中急需解决的一个 问题。本文作者在老师的指导下对库拉索芦荟进行 后, 将生长健壮 、 根系发达的试管苗从试管中取出, 洗去根部琼脂, 然后 移栽到营养土中, 浇透水, 空气温度不要太高。 移栽后发现, 试管苗不宜 r _ 组织培养的研究 . 以期通过试管繁殖达到快繁的目的。 1材 料 与方 法 浇水( 或营养液) 太勤 , 否则将烂根, 影响成活率 。若等土十后再浇 , 则成 1 . 1 材料: 试验材料为库托索芦荟 。 活率较高, 可达 9 0 %以上。 1 . 2 方法 : 取 整株 芦 荟 , 去除 外 层 老 叶 , 用 刀切 去较 长的叶 片 , 仅 留 3 意义 下基部 3 5 c m长的茎段 , 用 自来水冲洗 , 然后在超净工作台上用 7 0 % 库拉索芦荟是众多芦荟中有效成份高 、药理性状好的一个优 良品 每1 0 0 g 鲜叶中含芦荟大黄素 4 6 m g , 叶肉的蛋白质粘液素富有保湿 的酒精消毒 3 0 a r i n , 冉用 0 . 1 %的 Hg ( = l 2消毒 1 0 m i n , 无菌水冲洗 8 ~1 0 种 , 次, 将材料切成带腋芽的茎段 , 接种于培养基上。无菌体系的建立及 决 性 , 对皮肤有显著的收敛作用 . 在预防皮肤皱裂和抗衰老方面显著优于 因而成为国际化妆品市场上的佼佼者 , 欧美化妆品中标 含芦 速繁殖采用的激素组合为 : ( 1 ) 6 - B A O . 5 +N A A 0 _ 2 ; ( 2 ) 6 - B A1 +NA A 0 I 2 ; 其它品种, ( 3 ) 6 一 B A 2 +N A A 0 I 2 ; ( 4 ) 6 - B A 3 +N A A 0 . 2 。 生根培养基为: ( 5 ) P ” 0 . 1; 荟的 8 0 % 以上为 库拦索 芦荟 。 目前 , 库拉 索芦 荟仍是 世界性 药用 芦荟 良 ( 6 ) N A A O . 1 +P P 0 . 1; ( 7 ) N AA 0 . 1 +P P 0 . 1。 所有培 养基 均 以 M S为基 种 , 也是我国引种开发规模最大的品种 , 因此 , 选用库拉索芦荟进行快 本培养基 ,蔗糖浓度为 3 O ,琼脂浓度为 4 . 3 5 % e ,调 P H值为 5 . 8 , 在 速 繁殖具 有重 要 的意义 。 I 2 1 ℃, 1 . 1 K g / , ・ m 的压力下灭菌 2 0 m i n 。培养室温度为 2 5 ± 2 , 每天光 本研究成果 , 为库拉索芦荟快速繁殖提供 了一 条有效途径, 如果按 繁 殖系 数为 4 , 3 0天为 一个 周期 来计 算 , 那么 一年 中从一 个 芦荟 苗可 以 照 l 4 h , 光强 为 2 0 0 0 1 x 。移栽 在实 验室 进行 。 2 结 果与 分析 繁殖几万 ~几百万株芦荟苗 , 因此, 与常规繁殖方法相 比, 组织培养法 2 . 1 无 菌体 系 的建 立 。 将 带腋 芽 的茎段 分别 接种 在( 1 ) 、 ( 2 ) 、 ( 3 ) 、 ( 4 ) 具有繁殖系数高 , 繁殖速度快之优点 , 用很少的母本繁殖材料就可在短 四种培养基上 , l 0天后( 3 ) 号培养基上腋芽首先开始萌动, 1 5 天后 , ( 2 ) 、 期内培育出大量的芦荟试管苗。 ( 4 ) 培养基 【 腋芽也开始萌动 , 2 0天左右 , ( 1 ) 培养基也开始萌动。经 3 0 本研究成果为库拉索芦荟进一步的工厂化生产 .并在我国的广大 天培养后观察 发现 , ( 3 ) 号培养基( 即6 - B A 2 +N A A O . 2 )  ̄ 寸 腋芽的诱导效 地 区迅 速推广 种植 奠定 了基础 。
芦荟的养殖方法

芦荟的分株繁殖是一种常见的繁殖方式,通过将芦荟的幼苗从母株上分离出来 ,然后种植在新的土壤中,经过一定时间的生长,即可长出新的芦荟。
组织培养
组织培养的意义
组织培养是一种利用植物组织进行快速繁殖的技术,通过将芦荟的组织或细胞放在人工控 制的条件下进行培养,从而获得大量的芦荟幼苗。
组织培养的过程
预防措施
采取适当的预防措施,如定期修剪、保持通风、清洁土壤等,可以 降低病虫害的发生率。
使用生物防治
使用生物防治方法来控制病虫害是非常有效的。例如,可以引入天 敌来控制蚜虫的数量,或者使用生物农药来防治病虫害。
04
芦荟的繁殖技术
自然繁殖
种子繁殖
芦荟的种子繁殖是一种自然繁殖方式,通过授粉产生种子,然后播种在适宜的 土壤中,经过一定时间的生长,即可长出新的芦荟。
芦荟可以用于制作面膜、洗发水、沐浴露等美容护肤品,具有很好的滋润、美白 、除皱等效果。
其他应用价值
芦荟还可以用于制作食品、饮料等,如芦荟酸奶、芦荟果汁 等,具有很好的口感和营养价值。
芦荟还可以用于环境保护领域,如净化空气、减少噪音等。
THANK S感谢观看
在干燥的环境下,应经常 向芦荟叶面喷水,以保持 叶面湿润,防止叶面壤
芦荟需要排水良好、透气性强的 土壤,如砂质土壤或腐殖质丰富
的土壤。
添加有机肥
在种植芦荟时,可以添加适量的 有机肥,以提供充足的养分。
定期松土
定期松土可以改善土壤的透气性 ,有利于芦荟根部的呼吸和生长
。
02
扦插方法
选取健康、无病虫害的芦荟叶片,保留部分叶柄和少量根系,然后 插入土壤中。
养护管理
保持土壤湿润,避免过度浇水,以免影响芦荟的生长。同时要避免 阳光直射,以免造成叶片枯萎。
芦荟的叶片组织培养

0
10
50
1
2
1
10
50
2
4
2
10
48
4
813
3
10
47
14
30
4
10
50
21
42
5
10
50
10
20
6
10
48
5
10
基本培养基:M S
3 讨论
在本实验条件下, 以芦荟叶片为外植体 直接诱导不定芽的产生, 最适宜的培养基为: 诱导培养基M S+ BA 4m g L + 香蕉汁 10% ; 增 殖 培 养 基 M S + BA 3m g L ; 生 根 培 养 基 M S+ NAA 015m g L + M ET 1m g L 或M S+ IBA 1m g L + M ET 1m g L。 香蕉汁和 BA 对 芦荟叶片不定芽的形成都有重要的作用, 若 二者缺一, 则不定芽的诱导率都低。
近年来被利用于一些植物的组织培养, 有壮 苗和促进生根的作用。在芦荟组培过程中, 一 般只用生长素类物质诱导生根时, 形成的根 数不多而且根很细长, 在培养基中加入M ET 后, 植株发根多, 根粗壮, 可以明显提高小苗 的移栽成活率。
IBA 1m g L 两处理的效果最好, 当在这两种 培养基中加入多效唑 (M ET ) 1m g L 时, 生根 的效果更好 (表 2) , 跟无M ET 组的植株比 较, 加入M ET 后, 根及叶片的伸长生长虽受 抑制, 但植株的根数增多, 根粗明显增大, 平 均每株根鲜重增加。移栽结果表明, 无M ET 的两组小苗移栽成活率为 80% , 而加M ET 两组的成活率达 95% 以上。 移栽后 1 个月,
芦荟的组织培养

三、生根培养
• 芦荟增殖芽数长到一定高度就可以转入生 根培养基,生根培养基采用 KC+IBA0.5mg/L+蔗糖3%+琼脂0.7%+活性 炭0.3%比较适宜。
四、壮苗培养
• 为了使植株健壮,使之能够在移栽后保证 较高的成活率,当在生根培养基上形成了 完整植株后,就可以转接到 1/2MS+IBA2mg/L+AC0.3%+蔗糖3%+琼脂 0.7%的壮苗培养基上进行壮苗培养。此阶 段可将光照强度增至2000LX,经过20d左 右培养,平均每个试管植株长出四五条粗 壮的侧根,叶色浓绿。此时即可移栽。
培养基的配制: 在芦荟的初代培养及诱导侧芽分化的过程 中,采用MS为培养基,附加蔗糖3%、琼 脂0.7%以BA3mg/L 、NAA0.2mg/L, PH5.8的培养基效果最为理想。 接种40d,统计在该培养基上平均每个外植 体诱导侧芽数为4个,且侧芽粗壮浓绿。
二、继代培养
• 在初代培养基上培养了40D左右时,侧芽转 接到成分为MS+BA3mg/L+NAA0.2mg/L+ 蔗糖3%+琼脂0.7%的培养基上培养,25d 后,每个芽周围又可长出4~6个侧芽,形成 芽丛,此时即可切下来再进行继代培养。 以后每25天可以培养一次。在第一至第五 次继代培养繁殖过程中,随着继代数的的 增加,每个芽丛平均新增殖芽数也明显增 多。
谢 谢
主要步骤
• • • • • 初代培养 继代培养 生根培养 壮苗培养 移栽与管理
一、材料与培养基
• 材料:取盆芦荟植株的上端或新芽,将材 料中心部分(生长点及附近组织)切成拇 指大小,置于自来水下冲洗干净。然后用 90%酒精消毒1min,立即用0.15%升汞灭 菌10min;再用无菌水冲洗四五遍,沥干水 分后,用于接种。 • 芦荟试管快繁的整个过程中温度均可控制 在(26±3)℃;白天以日光灯照明11h左 右,光照1000~1500lx,晚间黑暗。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
学年论文(设计)(本科)学院生命科学学院专业生物科学年级2007级生科2班姓名刘琼论文(设计)题目芦荟的组织培养指导教师远凌威职称讲师成绩2009年6月6日目录摘要 (1)关键词 (1)Abstract (1)Key Words (1)引言 (1)1材料和方法 (2)1.1材料 (2)1.2培养基 (2)1.3方法 (2)2结果与讨论 (2)2.1愈伤组织的诱导 (2)2.2诱导不定芽 (3)2.3生根 (4)2.4试管苗移栽 (4)3结论 (4)4意义与进展 (4)参考文献 (4)芦荟的组织培养姓名:刘琼学号:20075070083生命科学学院生物科学指导教师:远凌威职称:讲师摘要:针对芦荟自然繁殖率低下的情况,探讨了利用组织培养方法解决生产中繁殖的问题。
在叶和茎两种外植体中,嫩茎的出愈率最高,是理想的快速繁殖材料,较适宜的诱导愈伤组织的激素组合是BA 2.0 mg·L-1+IBA 0.2 mg·L-1,诱导不定芽的适宜激素组合是BA 3.0 mg·L-1+NAA 1.0 mg·L-1,而根的诱导则是在1/2 MS+NAA 1.0 mg·L-1+庶糖1.5%+活性碳3%培养基上进行。
关键词:芦荟;组织培养;愈伤组织;不定芽Abstract:Because the fruiting rate and germinative percentage of Aloe vera L. are lower, tissue culture was explored to solve the propagating problem in the production. The results show that the bud is the best material in speeding propagation among the two explants (stem, leaf) as it has the biggest inductivity, the best growth and it is easy to be inducted adventitious buds. The suitable phytohormone compositions to induct callus, adventitious buds and roots are respectively BA 2.0 mg·L -1 +IBA 0.2 mg·L-1 Induction of adventitious buds of appropriate hormone combinations BA 3.0 mg • L-1 + NAA 1.0 mg • L-1, and the root is in the induction of 1 / 2 MS + NAA 1.0 mg • L-1 + Shu-sugar 1.5% + activated carbon 3% on the medium.Key Words:Aloe vera L.; tissue culture; callus; adventitious bu;引言芦荟(Aloe veraL.)为百合科(Liliaceae)芦荟属多年生常绿多肉质草本植物,叶簇生,呈莲座状或生于茎顶,叶长披针形或叶短宽,边缘有尖齿状刺;花序有伞形、总状、穗状、圆锥形,花呈桔红色、黄色或具赤色斑点,花被的基部多连合成筒状;果实蒴果,种子多数]1[。
无论是从古代丰富的民间医疗实践,还是现代科学技术对芦荟的深入研究和开发利用,都证明了芦荟确实是一种普遍的、多效的、无毒的、无副作用的药用植物,能解决现代医学中的许多疑难问题]2[。
随着芦荟本身神奇的效能一再被人们发现,到目前它已成为集食用、药用、观赏于一身的保健植物新星。
由于芦荟不能自花授粉结实,因而用种子繁殖很困难,为此,可以利用组织培养技术对其进行快速繁殖。
芦荟品种间的形状和性质差异很大。
本文采用在药用、食用等方面具有代表性的日本木立芦荟(A.arborescensMill)为研究材料,结合前人所作的工作]3[,对芦荟的组培快繁进行了深入的探讨。
1材料和方法1.1材料取木立芦荟老茎段(不带芽)、叶片及幼嫩茎尖作外植体进行组织培养,取材时最好用手将材料从母株上掰下,不用刀剪等工具切割,因为掰下的材料在培养时分泌产生相对少的酚类化合物,对以后的培养过程中防止褐化有帮助,而切割的材料容易产生过多酚类化合物,在以后的培养过程中易发生褐化]4[。
1.2培养基基本培养基为MS,按不同处理方案添加不同类型的植物激素,诱导愈伤组织的最适激素组合是BA 2.0 mg·L-1+IBA 0.2 mg·L-1,诱导不定芽的适宜激素组合是BA 3.0 mg·L-1+NAA 1.0 mg·L-1,而根的诱导则是在1/2 MS+NAA 1.0 mg·L-1+庶糖1.5%+活性碳3%培养基上进行。
用0.1 N NaOH和0.1 N HCL调节pH值为5.8~6.0,在高压灭菌锅中高温(121℃)灭菌20 min。
1.3方法晴天取老茎段、叶及幼嫩茎尖为外植体,按下列程序进行消毒:取材→自来水粗洗→5%洗衣粉水溶液漂洗5 min→自来水冲洗30min→75%乙醇擦洗表面→0.1%升汞溶液中消毒5 min→2%次氯酸钠溶液中消毒20 min→无菌水冲洗4~6次,然后在无菌工作台中将外植体切成0.5~1.0 cm长的小段接种于诱导培养基上;将培养出来的愈伤组织切成小块接种于增殖培养基上;最后将形成不定芽的块段转移至生根培养基上,以培育出完整的小植株。
以6 d为一周期,观察记录不同处理的生长状况。
2结果与讨论2.1愈伤组织的诱导木立芦荟的老茎段、叶和幼嫩茎尖形成愈伤组织的能力不一样。
经多种植物激素组合试验(表1),结果表明:愈伤组织的诱导以幼嫩茎尖为最好,老茎段次之,而叶片形成愈伤组织的能力最差,虽经改变多种激素组合来调节叶愈伤组织的出愈率,仍无法诱导出愈伤组织。
表1 不同激素组合对诱导愈伤组织的影响Table1. Effect of different phytohormone composition on the callus induction激素组合/mg·Lˉ1 phytohormone composition茎Stem茎尖Shoot-tip叶Leaf出愈率/% 生长量Inductivity Growthamount出愈率/% 生长量Inductivity Growthamount出愈率/% 生长量Inductivity GrowthamountBA 0.5+IBA 1.0 80 大 70 小 0 0BA 1.0+IBA 0.5 80 小 90 中 0 0BA 1.5+IBA 0.5 85 小 90 中 0 0BA 2.0+IBA 0.5 100 小 100 大 0 0BA 3.0+IBA 0.05 100 小 90 大 0 0BA 2.0+IBA 0.2 100 大 100 大 0 0BA 3.0+IBA 0.5 90 中 100 中 0 0从表1中可以看出,形成愈伤组织的最佳激素配合为BA 2.0 mg·L-1左右,IBA则为0.2 mg·L-1左右。
该组合下诱导的愈伤组织出愈率高,生长快。
茎尖是一种较好的外植体,很多植物的组织培养都是以它作为外植体]85[ 。
与红芽大戟相似]9[,芦荟的茎尖在培养过程中既能形愈伤组织,又能分化出一些不定芽,形成芽丛。
愈伤组织和不定芽的形成与IBA的浓度有关在BA定值下,IBA浓度越高,不定芽越多,而愈伤组织越少;IBA浓度越低,不定芽越少,而愈伤组织则越多。
2.2诱导不定芽将诱导出来的愈伤组织及芽丛转到新培养基上进行继代培养,不同激素组合对其生长状况影响较大(表2)。
在BA低浓度培养基中生长量较小,但不定根分化率较高;在BA高浓度培养基中生长量较大,但不定根的分化率较低。
最佳的激素组合为BA 3.0 mg·L-1,NAA 1.0 mg·L-1,在此组合的培养基中,生长量和增殖率均大,而几乎不产生不定根,这十分有利于继代培养。
表2 不同激素组合对愈伤组织幼苗分化的影响Table2Effect of different phytohormone composition on seeding of callus 激素组合/mg· L-1 芽丛诱导率/% 不定根诱导率/%phytohormone frequency of root frequency of budcomposition induction clump inductionBA 1.0+NAA 0.1 29.5 57.5BA 2.0+NAA 0.5 56 23.5BA 3.0+NAA 1.0 100 0BA 3.0+NAA 1.5 91.3 46.8BA 3.0+NAA 0.05 79.2 13.82.3生根培养出来的不定芽转入生根培养基(1/2 MS+NAA 1.0mg·L-1+庶糖1.5%+活性碳3%)中进行培养,15天后不定根的诱导率达95%以上,平均每株生根数达3.8条。
2.4试管苗移栽取出不定根诱导出来的试管苗,小心洗尽残余培养基,不碰伤根和叶子。
用清水洗净后在普通纸上稍微晾一下(不要在太阳下暴晒)便可移栽到生长基质中。
芦荟喜欢砂性基质,所以可用2~3份细砂+2~3份腐殖土+1份田土配制成生长基质。
移栽入生长基质后,用洗瓶装自来水,在每株小苗的周围冲洗一下,以便使小苗根部与生长基质紧密接触。
然后,将小花盆转到温室中,最初几天注意遮阳,更重要的是保持空气湿度在90%左右,这是新移栽的组培苗能否顺利存活的关键。
约过3周左右,新根即可从移栽苗上长出,成活基本有了保证,再过2周,即可将苗移到大田或温室栽种]1[。
3结论木立芦荟的茎尖、老茎段和叶在不同激素组合的培养基中愈伤组织的出愈率不一样。
以茎尖的愈伤组织最好,而叶最难诱导。
诱导愈伤组织最好的激素组合是BA 2.0 mg·L-1+IBA 0.2mg·L-1。
在继代培养中,木立芦荟的增殖率是极高的,生长量也较大。
在培养中有一明显现象,即芽丛基部愈伤组织处有大量黑色分泌物,但并不影响芽丛及愈伤组织的生长,是否为“酚中毒”还有待于进一步研究。
4意义与进展芦荟属百合科的多年生肉质植物,中华芦荟属其中一种,粘胶汁多,适合外用,具有极高的药用、食用价值。
现代科学证明医疗效用更高,对胃溃疡。
