D6053 BamHI使用说明书
欧姆迪电子产品说明书
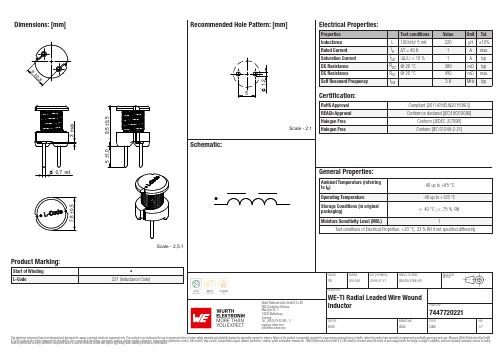
Dimensions: [mm]Scale - 2,5:17447720221A74477202217447720221T e m p e r a t u r eT T T 7447720221Cautions and Warnings:The following conditions apply to all goods within the product series of WE-TI of Würth Elektronik eiSos GmbH & Co. KG:General:•This electronic component was designed and manufactured for use in general electronic equipment.•Würth Elektronik must be asked for written approval (following the PPAP procedure) before incorporating the components into any equipment in fields such as military, aerospace, aviation, nuclear control, submarine, transportation (automotive control, train control, ship control), transportation signal, disaster prevention, medical, public information network, etc. where higher safety and reliability are especially required and/or if there is the possibility of direct damage or human injury.•Electronic components that will be used in safety-critical or high-reliability applications, should be pre-evaluated by the customer. •The component is designed and manufactured to be used within the datasheet specified values. If the usage and operation conditions specified in the datasheet are not met, the wire insulation may be damaged or dissolved.•Do not drop or impact the components, the component may be damaged.•Würth Elektronik products are qualified according to international standards, which are listed in each product reliability report. Würth Elektronik does not warrant any customer qualified product characteristics beyond Würth Elektroniks’ specifications, for its validity and sustainability over time.•The customer is responsible for the functionality of their own products. All technical specifications for standard products also apply to customer specific products.Product specific:Soldering:•The solder profile must comply with the technical product specifications. All other profiles will void the warranty.•All other soldering methods are at the customers’ own risk.Cleaning and Washing:•Washing agents used during the production to clean the customer application might damage or change the characteristics of the wire insulation, marking or plating. Washing agents may have a negative effect on the long-term functionality of the product. Potting:•If the product is potted in the costumer application, the potting material might shrink or expand during and after hardening. Shrinking could lead to an incomplete seal, allowing contaminants into the core. Expansion could damage the components. We recommend a manual inspection after potting to avoid these effects. Storage Conditions:• A storage of Würth Elektronik products for longer than 12 months is not recommended. Within other effects, the terminals may suffer degradation, resulting in bad solderability. Therefore, all products shall be used within the period of 12 months based on the day of shipment.•Do not expose the components to direct sunlight.•The storage conditions in the original packaging are defined according to DIN EN 61760-2.•The storage conditions stated in the original packaging apply to the storage time and not to the transportation time of the components. Packaging:•The packaging specifications apply only to purchase orders comprising whole packaging units. If the ordered quantity exceeds or is lower than the specified packaging unit, packaging in accordance with the packaging specifications cannot be ensured. Handling:•Violation of the technical product specifications such as exceeding the nominal rated current will void the warranty.•Applying currents with audio-frequency signals might result in audible noise due to the magnetostrictive material properties. •Due to heavy weight of the components, strong forces and high accelerations might have the effect to damage the electrical connection or to harm the circuit board and will void the warranty.•Please be aware that products provided in bulk packaging may get bent and might lead to derivations from the mechanical manufacturing tolerances mentioned in our datasheet, which is not considered to be a material defect.•The temperature rise of the component must be taken into consideration. The operating temperature is comprised of ambient temperature and temperature rise of the component.The operating temperature of the component shall not exceed the maximum temperature specified.These cautions and warnings comply with the state of the scientific and technical knowledge and are believed to be accurate and reliable.However, no responsibility is assumed for inaccuracies or incompleteness.Würth Elektronik eiSos GmbH & Co. KGEMC & Inductive SolutionsMax-Eyth-Str. 174638 WaldenburgGermanyCHECKED REVISION DATE (YYYY-MM-DD)GENERAL TOLERANCE PROJECTIONMETHODTRi001.0012019-07-17DIN ISO 2768-1mDESCRIPTIONWE-TI Radial Leaded Wire WoundInductor ORDER CODE7447720221SIZE/TYPE BUSINESS UNIT STATUS PAGEImportant NotesThe following conditions apply to all goods within the product range of Würth Elektronik eiSos GmbH & Co. KG:1. General Customer ResponsibilitySome goods within the product range of Würth Elektronik eiSos GmbH & Co. KG contain statements regarding general suitability for certain application areas. These statements about suitability are based on our knowledge and experience of typical requirements concerning the areas, serve as general guidance and cannot be estimated as binding statements about the suitability for a customer application. The responsibility for the applicability and use in a particular customer design is always solely within the authority of the customer. Due to this fact it is up to the customer to evaluate, where appropriate to investigate and decide whether the device with the specific product characteristics described in the product specification is valid and suitable for the respective customer application or not.2. Customer Responsibility related to Specific, in particular Safety-Relevant ApplicationsIt has to be clearly pointed out that the possibility of a malfunction of electronic components or failure before the end of the usual lifetime cannot be completely eliminated in the current state of the art, even if the products are operated within the range of the specifications.In certain customer applications requiring a very high level of safety and especially in customer applications in which the malfunction or failure of an electronic component could endanger human life or health it must be ensured by most advanced technological aid of suitable design of the customer application that no injury or damage is caused to third parties in the event of malfunction or failure of an electronic component. Therefore, customer is cautioned to verify that data sheets are current before placing orders. The current data sheets can be downloaded at .3. Best Care and AttentionAny product-specific notes, cautions and warnings must be strictly observed. Any disregard will result in the loss of warranty.4. Customer Support for Product SpecificationsSome products within the product range may contain substances which are subject to restrictions in certain jurisdictions in order to serve specific technical requirements. Necessary information is available on request. In this case the field sales engineer or the internal sales person in charge should be contacted who will be happy to support in this matter.5. Product R&DDue to constant product improvement product specifications may change from time to time. As a standard reporting procedure of the Product Change Notification (PCN) according to the JEDEC-Standard inform about minor and major changes. In case of further queries regarding the PCN, the field sales engineer or the internal sales person in charge should be contacted. The basic responsibility of the customer as per Section 1 and 2 remains unaffected.6. Product Life CycleDue to technical progress and economical evaluation we also reserve the right to discontinue production and delivery of products. As a standard reporting procedure of the Product Termination Notification (PTN) according to the JEDEC-Standard we will inform at an early stage about inevitable product discontinuance. According to this we cannot guarantee that all products within our product range will always be available. Therefore it needs to be verified with the field sales engineer or the internal sales person in charge about the current product availability expectancy before or when the product for application design-in disposal is considered. The approach named above does not apply in the case of individual agreements deviating from the foregoing for customer-specific products.7. Property RightsAll the rights for contractual products produced by Würth Elektronik eiSos GmbH & Co. KG on the basis of ideas, development contracts as well as models or templates that are subject to copyright, patent or commercial protection supplied to the customer will remain with Würth Elektronik eiSos GmbH & Co. KG. Würth Elektronik eiSos GmbH & Co. KG does not warrant or represent that any license, either expressed or implied, is granted under any patent right, copyright, mask work right, or other intellectual property right relating to any combination, application, or process in which Würth Elektronik eiSos GmbH & Co. KG components or services are used.8. General Terms and ConditionsUnless otherwise agreed in individual contracts, all orders are subject to the current version of the “General Terms and Conditions of Würth Elektronik eiSos Group”, last version available at .Würth Elektronik eiSos GmbH & Co. KGEMC & Inductive SolutionsMax-Eyth-Str. 174638 WaldenburgGermanyCHECKED REVISION DATE (YYYY-MM-DD)GENERAL TOLERANCE PROJECTIONMETHODTRi001.0012019-07-17DIN ISO 2768-1mDESCRIPTIONWE-TI Radial Leaded Wire WoundInductor ORDER CODE7447720221SIZE/TYPE BUSINESS UNIT STATUS PAGE。
多功能数显表使用说明书

..' 多功能电力监测仪使用手册版本:3.0杭州正普科技有限公司使用前必读在您使用本产品之前,请务必仔细阅读此使用手册内容,正确按照用户手册指导操作,这会有助于您更好地使用本产品,并有助于解决现场出现的各种问题。
1、监测仪在施加工作电源之前,务必确保工作电源在仪表规定范围之内;2、现场安装使用时,电流输入端子严禁开路,电压输入端子严禁短路;3、通讯端子(RS485)严禁施加高压;4、使用时仪表接线方式务必与内部系统设置方式一致;5、与后台通讯时,仪表通讯参数务必与后台一致;不能带电拔插通信接口;6、本手册中的信息如有变动,恕不另行通知;我公司自始至终本着“质量第一服务第一”的宗旨,将以优质的产品、优良的服务奉献给国内外用户!●使用前请仔细阅读本用户使用手册●请注意妥善保存目录一、概述-------------------------------------------------- 1二、型号定义---------------------------------------------- 1三、尺寸对照表-------------------------------------------- 1四、型号与功能对照表-------------------------------------- 2五、技术指标---------------------------------------------- 3六、外形及安装尺寸---------------------------------------- 4七、接线图------------------------------------------------ 6八、操作说明---------------------------- 7(RS485通讯规约、CT/PT设置、开关量操作、变送输出操作)..'一、概述多功能电力监测仪具有对电网中电流、电压、频率、有功功率、无功功率、视在功率、电能、功率因数等进行同时测量的功能。
贡德冰箱 三件套版说明书

4
存放........................................................................ 16
4.1 存放提示......................................................................... 16
5.3.6
设置菜单访问安全性 .................................................20
5.3.7
访问码..........................................................................21
5.3.20 传感器校准 ................................................................ 26
5.3.21 温度警报 .................................................................... 26
1.2 冰箱和装备一览............................................................. 3
1.3 特殊装备......................................................................... 3
5.3.8
维护间隔提醒..............................................................22
5.3.9
语言 ............................................................................ 22
海洛斯操作手册(说明书)

HIROSS恒温恒湿机房精密空调操作手册HIMOD系列北京****科技有限公司技术部2009年01月01日目录第一章HIMOD系列海洛斯空调概述 (2)型号多 (3)控制技术先进 (3)制冷系统 (3)送风系统 (3)加湿系统 (3)加热系统 (4)1.7其它 (4)第二章HIMOD系列海洛斯空调型号含义 (4)第三章有关空调的一些资料 (5)气流组织方式(详见下图) (5)盖板纽开启方式(详见下图) (5)空调重量(单位:Kg) (5)机组尺寸及维护空间 (6)第四章制冷循环管路示意图 (7)风冷却(A型) (7)水冷却(W型) (8)双冷源(D型) (9)单系统(C型) (10)双系统(C型) (10)第五章调速风机调速接线示意图 (11)第六章MICROF ACE概述 (12)概述 (12)面板简介液晶显示屏 (13)液晶显示屏介绍 (13)第七章MICROF ACE面板的操作 (13)第八章控制器的使用 (14)控制器(HIROMATIC)概述 (14)控制器的操作 (15)菜单结构 (17)第九章日常维护及特殊维护 (18)日常维护 (18)特殊维护 (19)第十章常见报警及处理 (20)低压报警 (20)高压报警 (21)加湿报警 (21)失风报警 (21)电加热过热报警 (22)显示器发黑 (22)空调不制冷 (22)附录1:参数列表 (22)附录2:报警内容列表 (26)附录3:各菜单项含义: (28)第一章HIMOD系列海洛斯空调概述HIMOD系列海洛斯空调(HIMOD空调)是当今世界上最先进的机房专用恒温恒湿机房专用精密空调。
随着IT业的突飞猛进的发展,各种布局、面积差别很大的机房如雨后春笋般纷纷出现了,使用环境也不一而同。
为适应各种不同要求的机房,新开发的海洛斯HIMOD系列空调应运而生。
她是在保留她的前一代产品HIRANGE系列机房空调的优点,又应用了当今世界上提高了的制冷技术及制冷部件制造工艺,使用当今最先进的模块化设计理念生产出来的高科技机房空调产品。
海南曼姆全系产品介绍说明书

Heinemann®GJ1P Series Circuit BreakersDESCRIPTIONOptional Low-Voltage Shunt for Current MeteringEaton Corporation’s Cutler-Hammer series of Heinemann GJ1P breakers offer high quality circuit protection for DC applications from 100 to 1200 Amperes.Their precisely tailored time delays and ability to interrupt high currents makes them ideally suited for critical applications. On overloads exceeding 1000 – 1400% of rating, there is no intentional time delay and the breaker interrupts currents of as much as 25,000 A at 65V DC.An optional shunt (25 or 50millivolt full scale) permits metering of current. Since the shunt output is low voltage,light-gauge wiring can be used from shunt to meter.Indication may be displayed inpercent, watts, safe/danger or other dial calibrations. In addition, the busbar is available in two versions:Standard Size and Reduced Size. Contact your Eaton Sales Representative for more information.Precision Current Equalization (PCE) Circuit BreakersGJ1P breakers rated 250 to1200 A are built in parallel construction. Conventional parallel pole breakers can experience uneven current distribution because of variations in internalresistances. This condition can result in nuisance tripping since the higher current in one parallel branch has the same effect as an overload on the sensing element in that branch. Proprietary Precision Current Equalization (PCE)circuit breakers, on the other hand, allow for differences in internal resistances byautomatically distributing the current equally through the parallel current sensing elements, minimizing the danger of nuisance tripping.The UL listed series GJ1P (UL489) models are available in a choice of fast, medium or slow response times to accurately match load conditions. They can be ordered in “series trip ”, “mid-trip ” and “switch only ”constructions and are available front- or back-mounted, front- or back-connected, with optional auxiliary switches for signaling.HYDRAULIC-MAGNETIC BENEFITSThe magnetic/hydraulic load-sensing and time delaymechanisms used in GJ1P breakers are insensitive to changes in ambient or enclosure temperature.Therefore, GJ1P circuitbreakers are suited for service conditions encountered in telecommunications,transportation, air conditioning and other outdoor or “heat-loaded ” equipment.SPECIFICATIONSStandard Current Ratings:100, 125, 150, 175, 200, 225,250, 300, 350, 400, 450, 500,600, 700, 800, 900, 1000,1100, 1200 A.Standard Maximum Voltages:160V DC up to 700A65V DC from 701 to 1200A Breakers will be labeled with standard maximum (UL) voltage unless otherwise specified.Special Current Ratings:Any integral rating between 100and 1200 A DC. Consult factory for ordering information and metering shunt restrictions.Interrupting Capacities:UL Listed:10,000 A @ 160V DC 25,000 A @ 65V DC Non-UL:14,000 A @ 160V DC.Operating Temperature Range:-40°C to +85°C.Approximate Weight:1-pole (100-225A) 1.13kg (2.5lbs)2-pole (250-400A) 2.27kg (5lbs)3-pole (450-700A) 3.40kg (7.5lbs)4-pole (701-800A) 4.54kg (10lbs)5-pole (801-1000A) 5.67kg (12.5lbs)6-pole (1001-1200A) 6.80kg (15lbs)Weight may vary based on shunt and busbar.APPROVALSUL Listing:GJ1P breakers are UL listed per UL489. For CSA certification,consult application engineering.Description . . . . . . . . . . . . . .2Specifications . . . . . . . . . . . .2Approvals . . . . . . . . . . . . . . .2Time Delay Characteristics . . .3Dimensions . . . . . . . . . . . .4-5How to Order . . . . . . . . . . .6-7Additional Products. . . . . . . . .8TABLE OF CONTENTS PageHEINEMANN ®CIRCUIT BREAKERSGJ1P Series Circuit Breakers(100-1200 Amperes DC)2Heinemann is a registered trademark of the Eaton Corporation, Commercial Controls Business Unit.100150.01.001.1110100100010,000200300400500600700800900100011001200125C u rv e 1C u rv e 2C u rv e 3Current – Percent of Ampere RatingT r i p T i m e – S e c o n d sDC CURVES100150.01.001.1110100100010,000200300400500600700800900100011001200125Current – Percent of Ampere RatingT r i p T i m e – S e c o n d sINSTANT DELAY DC CURVE PPERCENT OF RATED CURRENT VS. TRIP DELAY AT 25ºCTIME DELAYCHARACTERISTICSTime delay, in all models,is inversely proportional to the magnitude of the overload, adjusting automatically to limit transient power to the load. On overloads exceeding 1,000 –1,400%, the circuit breaker trips without any deliberately imposed delay.Curve 1.Standard time delayis furnished unlessanother optional delay is specified. It is thepreferred characteristic for use where the load is composed of both resistive and inductive components.Curve 2.Medium time delayis for general usein mixed (inductive and resistive) circuits where the breaker rating is matched to the current carrying capacity of the mains.Curve 3.Short time delaypermits a very brief delay period before tripping.Curve P .Non-time delay breakersare available forapplications which cannot tolerate even brief transient overloads.These breakers have no time delay mechanism other than that imposed by the coil self-inductance and the inertia of the mechanism.Tripping specificationsThe time delay curves depict breaker response time vs. percent of rated load with no preloading.The function is plotted at an ambient temperature of 77°F (25°C) with the breaker in a vertical or wall-mounted position.Series GJ1P circuitbreakers will carry 100%of rated load continuously.Both time delay and non-time delay breakers may trip between 101%and 125% of rated load,and must trip at 125%and above.3% (sec)Delay 100%125%200%400%600%800%1000%Delay Max.1no trip 1100150206 1.7.065Delay Min.1no trip 110224 1.1.01.008Delay Max.2no trip 110153.8.28.055Delay Min.2no trip 12 2.5.5.18.01.008Delay Max.3no trip 10.8.19.08.047.038Delay Min.3no trip.44.13.03.015.01.008STANDARD FRONT-CONNECTED CONSTRUCTIONWire Range #6 to 250 MCM74.59(2.938)76.20(3.000)Aux. Terminals, Male Type Molex 02-09-2101, Model 1190-T(See Illustrations for Combinations)Shunt Terminals, Female TypeMolex 02-09-1101, Model 1189-T37.69(1.484)42.84(1.687)0.99 (0.390)71.42(2.812)#10-32 Inserts (4 Places)38.10(1.500)19.05(0.750)19.05(0.750)6.35 ± 0.38(0.250 ± 0.156)6.35 ± 0.38(0.250 ± 0.156)Panel Mounting Hole Distance for #10-32LINELOAD 75.38(2.968)5.53(0.218)59.91(2.359)32.13(1.266)5.53(0.219)“D ” Type Terminals as Shown180.97(7.125)41.27(1.625)4.74(0.188)58.67(2.313)41.27(1.625)41.27(1.625)263.52(10.375)29.36(1.156)7.14(0.281)78.56(3.094)59.13(2.328)28°±5°32°±5°ONOFFSee Optional Terminal ConfigurationWire Range #6to 250 MCM41.27(1.625)36.49(1.437)38.10(1.500)100 – 22 A250 – 400Width dimensions are as follows:100 – 225 38.1 (1.5)250 – 400 A 76.2 (3.0)450 – 700 A 114.3 (4.5)701 – 800A 142.4 (6.0)801 – 1000A 190.5 (7.5)1001 – 1200A228.6 (9.0)28.95(1.141)46.40(1.828)22.22(0.875)Fastener Mounted ThisSide of Bus Plate,Terminals are Front-Connected and Unit is Rear-Mounted.Fastener Mounted This Side of Bus Plate, Terminalsare Back-Connected and Unit is Panel-Mounted.60.32(2.375)7.92(0.312)3/8-16UNC -2B (4 per Unit)38.10(1.500)225.43 (8.875)Center to CenterOptional Terminal ConfigurationsHEINEMANN ®CIRCUIT BREAKERSGJ1P Series Circuit BreakersDIMENSIONSDimensions are given here only as a preliminary guide to specifying. Final engineeringdrawings should be made from the latest Heinemann drawings. Contact Customer Service Center.Tolerance:±0.79 (0.031) except where noted. For metric threads, contact Customer Service Center.DIMENSIONS APPROXIMATE IN MM (INCHES)431.75(1.250) Min.41.65(1.641) Max.19.05(0.750)7.51(0.297)7.51(0.297)7.51(0.297)16.66(0.656)Typ.29.36(1.156)29.36(1.156)48.41(1.906)48.41(1.906)67.46(2.656)67.46(2.656)38.10(1.500)38.10(1.500)38.10(1.500)38.10(1.500)19.05(0.750)19.05(0.750)19.05(0.750)22.23(0.875) Min.321.31(12.65) Max.78.96(3.109)Min. Typ.5.15(0.203)Dia. Typ.C100 – 225 A Ratings 226 – 400 A Ratings401 – 700 150A RatingsBA106.75(4.203)Typ.C LC L C L FRONT MOUNTING PANEL AND SUPPORT BRACKET115.08(4.531)76.98(3.031)38.1(1.500)38.1(1.500)71.42(2.912)5.94(0.234)Ref.5.15(0.203)Typ. Dia.65.02(2.562)59.13(2.328)(3-Pole)3PoleC L C L C L Holes Required When Breaker Is Front-Mounted2Pole1PoleAB C (2-Pole)(1-Pole)38.88(1.531)19.43(0.765)Mounting kits containing clips, brackets and necessary hardware and instructions are available (consult factory).009-18234 100 – 225 A 1.5 (1-pole wide)009-18235 250 – 400 A 3 (2-pole wide)009-18232 450 – 700 A 4.5 (3-pole wide)For 701-1200A devices, contact your Eaton Sales Representative for mounting kit part numbers.See Step (2)See Step (5)BACK MOUNTING CIRCUIT BREAKERBack mounting circuit breaker mounting instructions 1. Position circuit breaker to support brackets.2. Place mounting bracket in recess on front top portion of circuit breaker.3. Install four (4) #10-32 by 3-1/4" long screws through holes in mounting bracket and support structure.4. Install lock washer and nut on each of the screws and tighten.5. Place mounting bracket on front lower portion of circuit breaker.6. Install two (2) #10-32 by 5/8" screws through holes in mounting bracket and support structure.7. Repeat step 4.5DIMENSIONS APPROXIMATE IN MM (INCHES)NOTE: Standard size busbar is shown above. For the reduced size busbar, contact your Eaton Sales Representative for mounting dimensions.Series PrefixGJ1PSwitch (No Coil)Series Trip w/SPDT Aux. SwitchSeries Trip Series Trip and Mid-Trip Series Trip, Mid-Trip and SPST Alarm SwitchTerminal Location Back FrontInternal Circuit Metering ShuntNo Shunts Metering Shunt Metering ShuntB HCodeLocationInternal CircuitCodeDescriptionShuntCode—25mV 50mVP M N0-2-3-98-99-Series Prefix GJ1PTerminal LocationBInternal Circuit3-Metering ShuntPAdd each appropriate Number or Letter …HEINEMANN ®CIRCUIT BREAKERSGJ1P Series Circuit BreakersHOW TO ORDER — Series GJ1PTo determine your Complete Catalog Number , you must start with appropriate Series Prefix and add the appropriate Code Letters and/or Numbers as in the example below:SELECTION TABLE61Multi-pole construction – Consult factory.An auxiliary switch, if supplied, will be located in the right pole space. If the auxiliary switch is supplied in a breaker which has a metering shunt, it will be single-pole single throw (SPST). The single-pole double throw (SPDT) auxiliary switch can be supplied only in a breaker without a metering shunt.2Cannot be used on breaker containing metering shunt.3Only for breakers rated in excess of 250 A. Breakers up to 250 A without meteringshunt are available as standard GJ1 type breakers. Please consult Series GJ catalog.MarketUL-489TerminalsSolderless Connector Bus Bar ConnectionStandard Current Ratings 1AmpereTrip Curve 1123P0 – 1200(Add 0 before amp rating if less than 1000A.Example: 0700)-01-02-03-0PDescriptionCodeDEDUStandardCodeCurveCodeComplete Catalog Number: GJ1PB3-PEDU0700-02Terminal ConfigurationEUS/European ApprovalDUStandard Current Ratings 10700Trip Curves 1-024Add 0 before amp rating if less than 1000. For example: a 700A rating would bedesignated as 0700.The width of the breaker is determined by the current rating:100 – 225 A 1.5” (1-pole wide)250 – 400 A 3” (2-pole wide)450 – 700 A 4.5” (3-pole wide)701 – 800A 6” (4-pole wide)801 – 1000A 7.5” (5-pole wide)1001 – 1200A 9” (6-pole wide)5See page 3 for time delay characteristics and trip curve information.7© 2001 Eaton Corporation All Rights Reserved Printed in USAForm No. BR5401SE0002A / CSS 65322June 2001Commercial ControlsFor the Widest Selection of Circuit Protection, from 0.01 to 1200 Amperes, Look to Eaton.。
半导体指纹识别仪 DW-FP3-M 系列 使用说明书

半导体指纹识别仪DW-FP3-M系列使用说明书型号:DW-FP3-M系列版本:V2.9深圳丽泽智能科技有限公司总机:400-700-6188地址:深圳市龙岗区布吉南湾街道布澜路南侧宝福李朗产业园C区7B楼网站:重要声明未经本公司书面许可,不得复制或抄袭传播本手册的任何部分;产品请以实物为准,说明书仅供参考。
产品实时更新,如有升级不再另行通知。
最新程序及补充说明文档敬请与公司客服部联系。
产品说明中有疑问或争议的,以公司最终解释为准使用过程指纹模块人为被刮花或损坏一概由用户负责。
警示:安装使用时必须保持传感器表面干净清洁,防止砂石、粉尘颗粒及其它硬物致使传感器损伤导致传感器失效!(此类损坏不属于保修范围)。
如有污迹可用脱脂棉花擦拭清洁。
版权所有,保留所有权利指纹仪有完善的用户权限管理。
但为了避免拥有管理权限的用户不在场,而客户又急需设置本系统,本系统特设了一个复位密码。
拥有复位密码的人可以进入系统将设备恢复到出厂时的设置。
特别注意事项:1、出厂时所有的指纹仪的复位密码均为888888888,客户在成功安装后,正式使用前,需自行修改此复位密码。
复位密码的长度为6~9位。
2、复位密码是在客户不得已的情况下才使用的。
若使用复位密码恢复出厂设置,则该系统中原有的用户数据将全部丢失,参数设置也将恢复成出厂时的设置。
需重新登记用户才可使用。
3、若遗忘了复位密码则只能回厂重新更新为缺省密码,但所有的数据将全部丢失。
*注:这里所说的脱机使用是指通电后在指纹处理器上即可完成用户数据的登记与存储、系统信息的查询与设置、指纹数据的验证、日志信息的记录与存储、提示信息的显示等,这些工作不需要与PC联网就能完成.处理器输出维根信号,配合维根控制器可控制门锁的开合。
1概述 (1)1.1指纹门禁系统构成 (1)1.2指纹仪接线说明 (1)1.3名词解释 (2)2功能概述 (3)2.1系统复位功能 (3)2.2设备管理功能 (3)2.2.1用户管理 (3)2.2.1.1注册新用户 (4)2.2.1.2修改用户 (4)2.2.1.3删除用户 (4)2.2.1.4查看用户信息 (4)2.2.1.5查看用户容量 (4)2.2.2系统日志 (4)2.2.3系统参数 (5)2.2.3.1系统时段 (5)2.2.3.2日期时间 (5)2.2.3.3按键声音 (5)2.2.3.4亮度调节 (5)2.2.3.5屏保功能 (5)2.2.3.6门铃功能 (6)2.2.3.7服务端口 (6)2.2.3.8验证提示 (6)2.2.3.9语音音量 (6)2.2.3.10用户信息显示 (6)2.2.3.11系统重启 (6)2.2.4安全设置 (6)2.2.4.1刷卡功能 (6)2.2.4.2验证模式 (6)2.2.4.3安全等级 (7)2.2.4.4报警韦根 (7)2.2.4.5断线检测 (7)2.2.4.7韦根区域码开/关和韦根区域码 (7)2.2.4.8韦根重试 (7)2.2.5通信设置 (7)2.3开门验证功能 (8)2.3.1开门方式 (8)2.3.1.1指纹开门 (8)2.3.1.2指纹或密码开门 (8)2.3.1.3指纹+密码开门 (8)2.3.1.4指纹或密码或刷卡开门 (8)2.3.1.5指纹+刷卡开门 (8)2.3.1.6指纹或(卡加密码)开门 (8)2.4日志功能 (8)2.4.1验证日志(最多432000条) (8)2.4.2系统操作日志(最多30000条) (8)3功能特性 (9)3.1功能模块一:指纹仪模块 (9)4操作说明 (9)4.1传感器的使用 (9)4.2设备版本查询 (10)4.3待机状态 (10)4.4空机状态下的超管登记 (11)4.5管理员进入管理菜单 (14)4.6恢复出厂设置功能 (15)4.6.1复位指纹模块 (15)4.6.2重启系统 (16)4.6.3修改复位密码 (16)4.6.4恢复出厂状态 (16)4.7设备管理 (17)4.7.1用户管理菜单 (17)4.7.1.1注册新用户 (17)4.7.1.2修改用户信息 (18)4.7.1.3删除用户 (19)4.7.1.4查看用户信息 (19)4.7.1.5查询用户容量 (20)4.7.2日志查询菜单 (20)4.7.3安全设置菜单 (22)4.7.3.1刷卡功能 (22)4.7.3.2验证模式 (23)4.7.3.3安全等级 (23)4.7.3.4报警韦根 (24)4.7.3.5断线检测 (24)4.7.3.6韦根输出方式 (24)4.7.3.7韦根区域码开关 (24)4.7.3.8韦根区域码 (24)4.7.3.9韦根重试 (25)4.7.4通信设置 (25)4.7.5系统参数菜单 (26)4.7.5.1系统时段 (26)4.7.5.2日期时间 (27)4.7.5.3按键声音 (27)4.7.5.4屏幕亮度调节 (27)4.7.5.5屏保亮度调节 (27)4.7.5.6屏保功能 (28)4.7.5.7门铃功能 (28)4.7.5.8服务端口 (28)4.7.5.9验证提示 (29)4.7.5.10语音音量 (29)4.7.5.11用户信息显示 (29)4.7.5.12系统运行信息 (30)4.7.5.13系统重启 (30)4.8使用指纹进行开门验证 (30)4.9使用密码进行开门验证 (32)5安装说明...................................................................................错误!未定义书签。
欧米达温度记录仪产品说明书

R EGISTRADORES DED ATOSU S e conecta directamente al puerto USB para una fácil configuración y descarga de datos, no se requiere cable USB U A cepta termopares de tipo J, K o T U 2 umbrales de alarma programables por el usuarioU I ndicación de LED rojo, verde y naranja brillantes U A dvertencia de batería bajaEl registrador de datos OM-EL-USB-TC mide y almacena más de 32.000 lecturas de temperatura de un termopar tipo J, tipo K o tipo T que se conecta a un receptáculo miniatura hembra para termopar en la base de la unidad. El usuario puede establecer fácilmente los parámetros de registro de datos iniciales, incluido tipo de termopar, velocidad de registro, hora de inicio, configuraciones de alarma alta/baja, modo de registro y unidades de temperatura deseadas(°C o °F) y también descargar los datos almacenados conectando el módulo en el puerto USB de un ordenador y ejecutando el software para Windows fácil de usar.Posteriormente, los datos se pueden mostrar en un gráfico, imprimirse y exportarse a otras aplicaciones como Excel. El registrador de datos se proporciona con una batería de litio de larga duración. El estado del registrador de datos se indica por medio del parpadeo de luces LED rojas, verdes y naranjas. Especificaciones Variación de medición de temperatura:T ipo J: -130 a 900 °C (-202 a 1.652 °F) Tipo K: -200 a 1.300 °C (-328 a 2.372 °F) Tipo T: -200 a 350 °C (-328 a 662 °F)Resolución: 0,5 °C (1 °F)Precisión: ±1,0 °C (±2,0 °F)Conexión del termopar: Conector subminiatura h embra para termopar Unidades de temperatura: °C o °F seleccionable en software Memoria: 32.000 lecturas Intervalo de registro: 1 seg., 10 seg., 1 min., 5 min., 30 min., 1 hora, 6 horas, 12 horas (seleccionable en software)Alarmas altas/bajas: Seleccionable en software Hora/fecha de inicio: Seleccionable en software Rango de temperatura de funcionamiento: -10 a 40 °C (-14 a 104 °F)Indicadores visuales (LED): 2 LED: el primer LED parpadea en color naranja para indicar un problema con el registrador de datos, por ejemplo batería baja; el seg-undo LED indica estado de alarma y parpadea en color verde (temperatura dentro de los límites) o en color rojo (temperatura fuera de los límites).Software: Windows ® 2000/XP/VIST A/7 (32 y 64 bits)Potencia: 1⁄2 batería de litio AA de 3,6 V (incluido)Vida útil de la batería: 6 meses (a 25 °C e intervalo de registro de 1 minuto)Peso: 43 g (1,5 onzas)Dimensiones: Vea la ilustración arriba, a la derecha Registrador de datos de termopar con interfaz USB configuración del software para Windows Soporte de bolsillo (incluido)Tapa de protección (incluido)operador en CD-ROM, tapa de protección, sujetador para bolsillo, termopar tipo K y batería de litio de 3,6 V .Ejemplo de pedido: OM-EL-USB-TC, registrador de datos de termopar con interfaz USB y OM-EL-BATT , batería de reemplazo.Incluye un termopar tipo K de alambre rebordeado aislado de 1 m (40") gratuito con conector subminiatura y soporte de carrete para alambre. Solicite un recambio Modelo Nº SC-GG-K-30-36.Se incluye termopar GRATUITO。
Haenim HN-04L 座檯式 UV LED 消毒烘乾機使用說明書说明书

0分鐘 10分鐘
8
產品使用說明
烘乾模式
只需烘乾的模式,可選擇烘乾1/烘乾 2/烘乾3模式。
按下烘乾按鈕一次: 烘乾30分鐘(同時吹風30分鐘) 總共運作30分鐘
按下烘乾按鈕二次: 烘乾50分鐘(同時吹風50分鐘) 總共運作50分鐘
切勿將本產品浸入水中,也 不要嘗試拆卸零件。
請勿在產品運作途中拔除電 源線。 這可能會導致觸電或起火。
定期清潔時請勿使用氯化物 的清潔產品( 例如漂白劑), 因為它會腐蝕不銹鋼部件。
建議每月用水清洗隔塵網, 並在瀝乾後安裝回去。
建議每月清潔不銹鋼內部。
請勿在門打開的情況下強行開 着UV LED。 強烈的UV光會對眼睛有害。
8) 不銹鋼內膽 9) 上層不銹鋼架
10-1) 不鏽鋼盛水盤 10) 下層不銹鋼架
............. ....................
...................... ......................
12) 紫外線LED ...................... ...............................................
...........................................................
6) 風機入口 7) 吹風出口 11) 紅外線LED燈
附屬零件
........................................................... ....................................................
海尔液晶电子双层烘烤机NBS533BB0B 产品说明书

Series 4, Built-under double ovenNBS533BB0BOptional accessoriesHEZ317000 Pizza pan, enamelled, HEZ327000 Pizza stone,HEZ530000 Half tray, HEZ531000 Baking tray, enamelled,HEZ531010 Baking tray, non-stick ceramic coated, HEZ532000 Multipurpose pan, enamelled, HEZ532010 Universal pan, non-stick ceramic coated, HEZ538000 1fold telescopic rail, level independent, HEZ625071 Grill tray, anthracite enamelled, HEZ634000 Baking and roasting grid (standard), HEZ636000 Glass pan, HEZ638000 Full ext rails, level independent, HEZ664000 Baking and roasting grid (steam), HEZ915003 Glass roasting dish, 5,4 L The built-in double compact oven with 3D hot air: achieve perfect baking and roasting results on multiple levels simultaneously.• Red LED display control: easy-to-use thanks to the time functions.• Pop-out controls: Make the front of the oven easy to clean and give it a sleek look.• EcoClean Direct: less cleaning effort thanks to a special coating which covers the rear wall of the lower oven.• 2 universal pans, slim size: optimized for smaller amounts of different dishes.Technical DataInstallation type: ......................................................................Built-in Integrated Cleaning system: ...........................................................No Dimensions: ........................................................717 x 594 x 550 mm Dimensions of the packed product (HxWxD): .....790 x 660 x 690 mm Control Panel Material: ..............................................................Glass Door Material: ............................................................................Glass Net weight: ..............................................................................47.8 kg Usable volume of cavity: ...............................................................47 l Cooking method: Full width grill, Hotair gentle, Hot Air, Conventional heat, Hot air grillingOven control: ....................................................................mechanical Number of interior lights: .. (1)EAN code: (4242005034611)Energy efficiency rating: ....................................................................A Energy consumption per cycle conventional (2010/30/EC): ........0.84 kWh/cycleEnergy consumption per cycle forced air convection (2010/30/EC):0.71 kWh/cycleEnergy efficiency class (2010/30/EC) - cavity 2: ...............................B Energy consumption per cycle conventional - cavity 2 (2010/30/EC):0.83 kWh/cycleEnergy efficiency index (2010/30/EC): .....................................94.7 % Energy efficiency index cavity 2 (2010/30/EC): ......................120.3 % Connection rating: ..................................................................5300 W Fuse protection: ...........................................................................25 A Voltage: ...............................................................................220-240 V Frequency: .................................................................................50 Hz Plug type: ..........no plug (electrical connection by electrician), fixed connectionIncluded accessories: .....2 x combination grid, 1 x universal pan, 2 x Universal pan, slim sizeSeries 4, Built-under double ovenNBS533BB0BThe built-in double compact oven with 3D hot air: achieve perfect baking and roasting results on multiple levels simultaneously.Design- LED-Display Control (Red)- Rotary dial, Retractable control dials, round- Straight bar handle- Interior halogen lightFeatures- Control panel lock- Electronic clock timer- Automatic start- Heating-up indicatorTop oven additional features- Cavity volume: 34 litre capacity- Full glass inner door- 3 shelf positions- Cavity (inner surface) top: Enamel grey- Door hinge small cavity: Drop down oven doorTop oven- Oven with 3 heating methods: conventional top/bottom heat, Large-area grill, Small area grill- Temperature range 50 °C - 275 °CMain oven additional features- Cavity volume: 47 litre capacity- EcoClean Direct : back panel- Full glass inner door- Door hinge big cavity: Drop down doorMain oven- Oven with 5 heating methods: 3D Hotair, conventional top and bottom heat, Hotair grilling, full width variable grill, Hotair gentle - Temperature range 50 °C - 275 °C- Fast pre-heating functionAccessories- 2 x combination grid, 1 x universal pan, 2 x Universal pan, slim size Performance/technical information- Energy efficiency rating (acc. EU Nr. 65/2014): B(at a range of energy efficiency classes from A+++ to D)- Energy consumption per cycle in conventional mode:0.83 kwh- Number of cavities: Top Cavity Heat source: electrical- Energy efficiency rating (acc. EU Nr. 65/2014): B(at a range of energy efficiency classes from A+++ to D)- Energy consumption per cycle in conventional mode:0.83 kWh- Energy consumption per cycle in fan-forced convection mode:0.71 kwh- Number of cavities: Main Cavity Heat source: electrical- Total connected load electric: 5.3 KW- Nominal voltage: 220 - 240 V - Niche dimension (hxwxd): 720 mm - 720 mm x 560 mm - 568 mm x 550 mm- Appliance dimension (hxwxd): 717 mm x 594 mm x 550 mm- Please refer to the dimensions provided in the installation manualSeries 4, Built-under double oven NBS533BB0B。
三相交流智能数显表使用说明书

· 传 递 成 功 感 知 卓 越
隔离耐压:电源/输入/输出间≥DC2.5KV/min.1mA 电源端雷击浪涌 2500V 电源端脉冲群 1800V 绝缘电阻:≥100MΩ 工作温度:-10℃~+50℃ 储藏条件:-40℃~+70℃
五、参考接线图(功能组合不同,接线会有变化,使用时以产品上接线图为准)
二、型号说明
三、安装说明:
安装方式:面盘安装,背后接线 外形尺寸:96×96×110mm 安装 精度等级: 电压/电流:0.2 级;功率、功率因数、频率:0.5 级 最大显示:9999 最大分辨率:电压:0.1V 电流:0.001A 输入:AC 500V*5A 标准模拟变送量输出(可选):电压输出:0-5V,1-5V;电流输出:0-20mA,4-20mA; 变送输出负载能力:电压≥2KΩ; 电流<300Ω; 通讯接口(可选):RS485(波特率:9600bps;数据格式;起始位 1 位,数据位 8 位,停止位 1 位,校验位
2
读/写
0xFFFFFFFF~0x7FFFFFFF
(2)、继电器输出控制寄存器
寄存器地址(Hex) 寄存器内容 寄存器个数 寄存器状态
数据范围
0x0028
继电器控制
1
写
0x00FF(代表继电器吸合)
深圳圣斯尔电子技术有限公司
TEL:0755-83766901~5(5 线) FAX:0755-83762478
Addr PArI
1-255 N.8.1;O.8.1;E.8.1
1 N.8.1
产品的地址编号 设置奇偶校验,初始为无校验
不保存退出
7
无无
(菜单显示:E)
保存退出(菜
8
无无
晶玛电子产品说明书

1||2P H O T O V O L T A I C F U S EL I N K SF U S E HO L D E R S & B A S E S P A G E 02 | g P V 10x 38 & 14x 51 600 &1000V /1100 D C F U S E L I N K S P A GE 05 | P M X 10x 38 & 14x 51 1000V D CF U S E H O L D E R S P A GE 06 | P M L 10/14x 85 1500V D C F U S E H O L D E R S P A GE 08 | C L I P C O N T A C TF O R φ10 F U S E L I N K S P A GE09|S T N H 1, N H 2 & N H 3 1000V D C F U S E B A S E S P A G E 03 | g P V 10x 85 1200 & 1500V D C F U S E L I N K S P A GE 04| g P V N H 1, N H 2 & N H 3 1000V D C F U S E L I N K S|2gPVFUSE-LINKS FOR PHOTOVOLTAIC APPLICATIONSPV fuse-links for photovoltaic installations from DF Electric have been developed to offer a compact, safety and economic protection so-lution in photovoltaic installations where, due to the increase of the power and technologic evolution, no-load voltages above 800V DC are reached. Also meet the requirements for instruments (multimeters) and traction equipment auxiliary circuits. The range comprises 10x38 & 14x51 fuse-links with rated currents between 1A and 20A. Rated voltage is 600 V DC or 1000V DC (direct current). Provide protection against overloads as well as short-circuits. Made with ceramic tube with high withstand to internal pressure and thermal shock, that allowsa high breaking capacity in a reduced physical space. Contacts are made of silver plated copper and melting elements are made of pure silverin order to avoid the aging and thus keep unalterable the electric characteristics. For these fuse-links we recommend the utilization of PMX 1000V fuse holders in single pole version or two-pole version.I n REFERENCE BREAKING CAPACITY PACKING(A)(kA)Uni./BOXFUSE-LINKS PHOTOVOLTAICCOMPATIBLEPV FUSE HOLDERS FORPHOTOVOLTAICAPPLICATIONSPAGE05COMPATIBLECLIP CONTACT FOR φ10FUSE-LINKSPAGE07TECHNICALt-I CHARACTERISTICSPAGE09STANDARDSIEC 60269-1IEC 60269-6UL 2579TECHNICALAMBIENT TEMPERATUREDERATING FACTORPAGE12AØBC20492235104/2425492240104/242492202104/244492205104/246492210104/248492215104/2410492220104/2412492225104/2415492229104/2416492230104/24STANDARDSIEC 60269-1IEC 60269-6UL 2579FUSE-LINKS PHOTOVOLTAICI n REFERENCE BREAKING CAPACITY PACKING(A)(kA)Uni./BOXCOMPATIBLECLIP CONTACT FOR φ10FUSE-LINKSPAGE07TECHNICALt-I CHARACTERISTICSPAGE10TECHNICALAMBIENT TEMPERATUREDERATING FACTORPAGE123||4gPV NH 373245NH1NH3NH2373350FUSE-LINKS FOR PHOTOVOLTAIC APPLICATIONSFUSE-LINKS FOR PHOTOVOLTAIC APPLICATIONSNH gPV 1000V DC fuse-links for photovoltaic installations have been developed to offer a compact, safety and economic pro-tection solution in second level panels of photovoltaic installations. The range comprises NH1 fuse-links with rated currentsbetween 25A and 200A, NH2 with rated currents between 200A and 250A and NH3 fuse-links with rated currents between200A and 400 A. Rated voltage is 1000V DC (direct current). They provide protection against overloads as well as short-circuits (gPV class according to IEC 60269 Standard), with a minimum fusing current of 1,35·In. Made with ceramic body with highwithstand to internal pressure and thermal shock. Contacts are made of silver plated copper or brass and melting elements are made of pure silver in order to avoid the aging and thus keep unalterable the electric characteristics. For these fuse-links werecommend the utilization of 1000V NH ST fuse bases.COMPATIBLENH FUSE BASES FOR PHOTOVOLTAIC APPLICATIONSPAGE08TECHNICALt-I CHARACTERISTICSPAGE11TECHNICALAMBIENT TEMPERATURE DERATING FACTORPAGE12STANDARDS IEC 60269-1IEC 60269-6UL 2579I nREFERENCEBREAKING CAPACITYPACKING(A)(kA)Uni./BOX5|485152PHOTOVOLTAICFUSE HOLDERS FOR PHOTOVOLTAIC APPLICATIONSThe first feature that PV Modular fuse holders offers, is the 1000V DC or 1100V DC rated voltages. They have been developedto offer a compact, safety and economic protection solution in photovoltaic installations where due to the increase of the power and technologic evolution, no-load voltages above 800V DC can be achieved. Modular fuse holders for 10x38 & 14x51 gPV fuses according IEC/EN 60269 standard. Compact design, with reduced distances. Manufactured with a high quality materials: Silver plated copper contacts and plastic materials with high temperature resistance and selfextinguishable. All the materials are according to the European Directive RoHS (Restriction of the use of certain hazardous substances in electrical material). UL certification (File E359201).POLES MODULES REFERENCE DESCRIPTION I nUPACKING(A)(V DC)Uni./BOX48515048515148515248515300COMPATIBLEgPV FUSE-LINKS FOR PHOTOVOLTAIC APPLICATIONSPAGE02STANDARDS IEC 60269-1IEC 60269-2EN 60269-1EN 60269-2UL4248-18APPROVALSCOMPATIBLE CONNECTION ACCESSORIES:PHASE BUSBARS AND ACCESSORIESSEECYLINDRICALWITHINDICA TORWITHINDICA TOR65x20PML1500VDCFUSE HOLDERS FOR PHOTOVOLTAIC APPLICATIONS 1500 VDC▶ Fuse holder for cylindrical fuse link size 10x85 gVP and 10/14x85 gPV.▶ Modern compact design.▶ Ventilation zones optimized for a better heat dissipation.▶ Manufactured with a high quality materials.· Silver plated copper contacts.· Plastic materials with high temperature resistance and self-extinguishable.· All the materials are according to the European Directive RoHS (Restriction of the use of certain hazardous substances in electrical material) and also halogen free.POLES MODULE REFERENCE DESCRIPTION I n U PACKING (mm)(A)(V DC)Uni./BOXFUSE HOLDERS PHOTOVOLTAICSTANDARDSIEC/EN 60269-1IEC/EN 60269-2UL4248-1UL4248-19UL486ECOMPATIBLEgPV FUSE-LINKS FORPHOTOVOLTAICAPPLICATIONSPAGE02COMPATIBLECONNECTIONACCESSORIES:PHASE BUSBARS ANDACCESSORIESSEECYLINDRICAL|7|FUSE HOLDERSPHOTOVOLTAICFUSE HOLDERS FOR PHOTOVOLTAIC APPLICATIONS 1500 VDCFUSE-LINK SIZE SELECTORTECHNICALPMLPOSITION 10x85POSITION 10/14x85Moving part allows the use of 10x85 and 10/14x85 fuselinks Handle tie System lock that avoids the unauthorized use of the fuseholder.Sealed by wire Free space for labeling For flexible wire section ≤6mm For solid wire section ≤10mm Manual assembly Assembly pin8482002482001 FUSE BASES PHOTOVOLTAICClip contact for φ10 cylindrical fuse links. Screw fixation and PCB versions. Manufactured in tinned bronze. All the materials are accordingto the European Directive RoHS (Restriction of the use of certain hazardous substances in electrical material).CLIP CONTACT FOR φ10 FUSE-LINKSREFERENCE DESCRIPTION I n P d max PACKING(A)(W)Uni./BOXφ3,5φ3,5SIZE L(mm)10x383210x8579,60,710102φ2,5LSIZE L(mm)10x384210x8589,6φ10 CLIP CONTACT FOR PCB|9|ST1000V DCNH1250A 354175FUSE BASESPHOTOVOLTAICNH FUSE BASES FOR PHOTOVOLTAIC APPLICATIONSFuse bases for NH fuse-links. Available in sizes NH1(250 A), NH2(400 A) and NH3(500 A). Manufactured with a high quality materials. Silver plated copper contacts. Plastic materials with high temperature resistance and self-extinguishable. All the materials are according to the European Directive RoHS. For DIN rail mounting or with screw fixing. Single-phase type. Connec-tion by screws. Contacts with double spring in order to obtain an optimum operation. Wide range of accessories that enables IP20 protection index: contact covers, fuse link covers and partition walls. Multi-pole units can be made with connection acces-sories. Manufactured according IEC, VDE and DIN standards. UL certification (File E359201).DESCRIPTIONREFERENCEUPACKING(V DC)SINGLE POLEDIN RAIL-SCREW FIXING / SCREW CONNECTION 35417210001NH2400A DIN RAIL-SCREW FIXING / SCREW CONNECTION 35417510001NH3500ADIN RAIL-SCREW FIXING / SCREW CONNECTION 35418010001STANDARDSIEC 60269-1IEC 60269-2EN 60269-1EN 60269-2UL4248STANDARDSVDE 0636DIN 43620COMPATIBLE gPV NH1 & NH3 FUSE-LINKS FOR PHOTOVOLTAIC APPLICATIONSPAGE04COMPATIBLETERMINAL COVERS, FUSE-LINKS COVERS AND IP20 PROTECTION KITSSEE NHNH1NH2NH3357010NH FUSE BASES ACCESSORIESMICROSWITCHES FOR NH LINKSREFERENCE DESCRIPTION PACKINGUni./BOX357010MICROSWITCH FOR NH1 & NH3 FUSE LINKS1/12REFERENCE POWER DISSIPATION POWER DISSIPATION PREARCING I2t(W @ 0,7 In)(W @ In)(A2s)1000V600VDC 1000VDC600VDC1000VDC600VDC1000VDC600VDC4916014919010,310,310,760,760,350,35Prospective current (A rms)*1100V DC|1011|4922021,283,420,84922051,162,91134922101,102,6565P r e a r c i n g t i m e (s )Prospective current (A rms)REFERENCE POWER DISSIPATIONPOWER DISSIPATIONPREARCING I 2t(W @ 0,7 In)(W @ In)(A 2s)|P r e a r c i n g t i m e (s )Prospective current (A)REFERENCEPOWER DISSIPATIONPOWER DISSIPATIONPREARCING I 2t(W @ 0,7 In)(W @ In)(A 2s)1000V DC1000V DC 1000V DC 1000V DC 3732105,212,5623732156,315,51223732256,716,63023732307,5185623732358,220121014x51NH1NH2NH3t a A1(ºC)400,92450,90500,87550,8513|ELECTRONIC CYLINDRICAL PHOTOVOL T AICRAPIDPLUS NH SPECIAL FUSESDOMESTIC D & DO TRANSFORMERS17|HEAD OFFICE & FACTORYSILICI, 67-6908940 CORNELLA DE LLOBREGAT BARCELONA SPAINTel. +34 93 377 85 85Fax +34 93 377 82 82EXPORT SALESTel. +34 93 475 08 64Fax +34 93 480 07 75***************NATIONAL SALESTel. 93 475 08 64Fax 93 480 07 76******************www.df-sa.esN H 1 g P V 100V D C。
臭氧发生设备 OZONFILT 型号 OZMa 1 - 6 A O 操作说明书

教师⾃查⾃纠报告范⽂(通⽤10篇)教师⾃查⾃纠报告范⽂(通⽤10篇) 忙碌⽽⼜充实的⼯作在时间的催促下告⼀段落了,回看这段时间的⼯作,有着⼀些问题,是时候认真地做好⾃查报告了。
我们该怎么去写⾃查报告呢?下⾯是⼩编为⼤家收集的教师⾃查⾃纠报告范⽂(通⽤10篇),欢迎阅读,希望⼤家能够喜欢。
教师⾃查⾃纠报告篇1 孔⼦曾说过:“其⾝正,不令⽽⾏,其⾝不正,虽令不从。
”作为⼀名幼⼉教师的我在⽇常的教育教学中⼀定要注意⾃⼰的⾔⾏举⽌,为孩⼦做个表率。
以⾼尚的⼈格感染孩⼦,以博⼤的胸怀去包容孩⼦,这样孩⼦才会“亲其师,信其道”。
作为⼀名从教多年的幼⼉教师,通过上次的学习后,我决定从以下⼏个⽅⾯来⾃查⾃纠。
⼀、思想认识 教师是⼈类灵魂的⼯程师,我清楚地明⽩要成为⼀名合格的幼⼉教师,就要不断地提⾼思想认识,提⾼⾃⾝的修养和素质,更要不断地学习提⾼⾃⼰的专业知识。
要勤于学习,勇于创新,⽤⾃⼰的⾟勤努⼒培养出更出⾊的⼈才。
⼆、教书育⼈ 作为⼀名教师,我要不断加强学习,吸收新的教育思想和先进的教育理念和教育⽅法,只有这样才能在业务上登上新的台阶。
我热爱我的事业,不论在什么时候我都以我的学校为荣。
我热爱我的孩⼦,坚持“⼀切为了孩⼦,为了孩⼦的⼀切”。
对孩⼦做到关⼼、耐⼼、细⼼,让孩⼦们快乐地成长。
三、存在的不⾜ 在⼯作中,我发现⾃⼰的责任⼼还不够强,有时会把⾃⼰的情绪带到⼯作中。
对孩⼦有时还少⼀点耐⼼,显得有点浮躁。
在⾯对新的机遇和挑战时,时常感到茫然和困惑,衡量学⽣的标准有点⽼套。
不能坚定⾃⼰的信念,会不停地动摇⾃⼰学习的观念。
还会轻视政治理论学习、缺乏理想信念、不注重道德修养,不能坚持⾃⼰的⼈⽣观和价值观。
四、整改措施 在今后的⼯作中,我要尊重幼⼉、关⼼幼⼉、热爱幼⼉,杜绝⼀切不良⾏为。
树⽴终⾝学习的观念,不断地充实⾃⼰。
师德师风常抓不懈,落实到实处。
教研组的活动,要认真参加,教学反思探究,找到新的教学⽅向。
阿尔托·沙姆电动烤箱说明书

500-E/DeluxeD e l i v e r yThis Alto-Shaam appliance has been thoroughly tested and inspected to ensure only the highest quality unit is provided. Upon receipt, check for any possible shipping damage and report it at once to the delivering carrier. See Transportation Damage and Claims section located in this manual.This appliance, complete with unattached items and accessories, may have been deliveredin one or more packages. Check to ensure that all standard items and options have been received with each model as ordered.Save all the information and instructions packed with the appliance. Complete and return the warranty card to the factory as soon as possible to ensure prompt service in the event of a warranty parts and labor claim.This manual must be read and understoodby all people using or installing the equipment model. Contact the Alto-Shaam Tech Team Service Department if you have any questions concerning installation, operation, or maintenance.nOte:All claims for warranty must include the full model number and serial number ofthe unit.U nP a c K i ng1. Carefully remove theappliance from thecarton or crate.nOte: D o not discard thecarton and otherpackaging materialuntil you haveinspected the unitfor hidden damageand tested it forproper operation.2. Read all instructions in this manual carefullybefore initiating the installation of this appliance.DO NOT DISCARD THIS MANUAL.This manual is considered to be part of theappliance and is to be provided to the owneror manager of the business or to the personresponsible for training operators. Additional manuals are available from the Alto-ShaamTech Team Service Department.3. Remove all protective plastic film, packagingmaterials, and accessories from the appliancebefore connecting electrical power. Store any accessories in a convenient place for future use.1. This appliance is intended to cook, hold or process foods for the purpose of humanconsumption. No other use for this appliance is authorized or recommended.2. This appliance is intended for use in commercial establishments where all operators arefamiliar with the purpose, limitations, andassociated hazards of this appliance. Operating instructions and warnings must be read and understood by all operators and users.3. Any troubleshooting guides, component views, and parts lists included in this manual are for general reference only and are intended for use by qualified technical personnel.4. This manual should be considered a permanent part of this appliance. This manual and all supplied instructions, diagrams, schematics, parts lists, notices, and labels must remain with the appliance if the item is sold or moved to another location.nO t e :U sed to notify personnel ofinstallation, operation, or maintenance information that is important but not hazard related.Safety PrOceDUreS anD PrecaUtiOnSKnowledge of proper procedures is essential to the safe operation of electrically and/or gas energized equipment. In accordance with generally accepted product safety labeling guidelines for potential hazards, the following signal words and symbolsmay be used throughout this manual.StacKingCabinets can be stacked in multiples. There are four (4) 3/16" (5mm) rounded projections on the top and bottom of each cabinet to permit stacking A center support stacking hardware kit (E-5091) must be used to stack the deluxe cabinets.500-E/HD stacked height: 38-1/8" (968mm)500-E /Deluxe stacked height: 40-1/16" (1018mm)Wire diagrams are located inside the bonnet of the unit.STANDARD OPTIONAL6: #1220 PAN SLIDES4: #1220 PAN SLIDES2: #11002 PAN SLIDESFood fl avor and aroma are usually so closely related that it is diffi cult, if not impossible, to separate them. There is also an important, inseparable relationship between cleanliness and food fl avor. Cleanliness, top operating effi ciency, and appearance of equipment contributeconsiderably to savory, appetizing foods. Good equipment that is kept clean, works better and lasts longer.Most food imparts its own particular aroma and many foods also absorb existing odors. Unfortunately, during this absorption there is not distinction between GOOD and BAD odors The majority of objectionable fl avors and odors troubling food service operations are caused by bacteria growth. Sourness, rancidity, mustiness, stale or other OFF fl avors are usually the result of germ activity.The easiest way to insure full, natural food fl avor is through comprehensive cleanliness. This means good control of both visible soil (dirt) and invisible soil(germs). A through approach to sanitation will provide essential cleanliness. It will assure an attractiveappearance of equipment, along with maximum effi ciency and utility. More importantly, a good sanitation program provides one of the key elements in the prevention of food-borne illnesses.A controlled holding environment for prepared foods is just one of the important factors involved in the prevention of food-borne illnesses. Temperature monitoring and control during receiving, storage, preparation, and the service of foods are of equal importance.The most accurate method of measuring safe temperatures of both hot and cold foods is by internal producttemperature. A quality thermometer is an effective tool for this purpose, and should be routinely used on all products that require holding at a specifi c temperature.A comprehensive sanitation program should focus on the training of staff in basic sanitation procedures. This includes personal hygiene, proper handling of raw foods, cooking to a safe internal product temperature, nd theroutine monitoring of internal temperatures from receiving through service.Most food-borne illnesses can be prevented through proper temperature control and a comprehensiveprogram of sanitation. Both these factors are important to build quality service as the foundation of customer satisfaction. Safe food handling practices to prevent food-borne illness is of critical importance to the health and safety of your customers.HACCP , an acronym for Hazard Analysis (at) Critical Control Points, is a quality control program of operating procedures to assure food integrity, quality, and safety. Taking steps necessary to augment food safety practices is both cost effective and relatively simple. While HACCP guidelines go far beyond the scope of this manual, additional information is available by contacting:CeNTeR FOR FOOD SAFeTY AND APPlIeD NuTRITION FOOD AND DRuG ADMINISTRATION1-888-SAFeFOOD√√ therMOStat & inDicatOr light SeQUenceWhenever the thermostat is turned “ON,” the indicator light will indicate the power ON/OFF condition of the heating cable, and consequently, the cycling of the cabinet as it maintains the dialed cavity temperature. If this light does not illuminate after normal start-up, the main power source,thermostat, and/or indicator light must be checked. If the warming cabinet does not hold the temperature as dialed, the calibration of the thermostat must be checked. If the warmingcabinet fails to heat or heats continuously with the thermostat “OFF,” the thermostat must be initially checked for proper operation. If these items are checked and found to be in order, a continuity and resistance check of the heating cable should be made. SEE CIRCUIT DIAGRAM.therMOStat caliBratiOnThe thermostat is precision calibrated at thefactory. Normally, no adjustment or recalibration is necessary unless the thermostat has been mishandled in transit, changed or abused while in service. Athermostat with a sensing bulb operates on hydraulic pressure, consequently, any bending of the bulb results in a change in its volume, and alters the accuracy of the thermostat calibration.A thermostat should be checked or recalibrated by placing a quality, thermal indicator at the center of an empty holding cavity. DO NOT CALIBRATE WITH ANY FOOD PRODUCT IN THE CABINET. The thermostat should be set, and should beallowed to stabilize at that setting for a minimum of one hour. The center of the thermal swing of the air temperature within the cabinet shouldapproximately coincide with the thermostat setting.If calibration is necessary, the calibration screw should be adjusted with great care. The calibration screw of the thermostat is located in the thermostat dial shaft. With the shaft held stationary, aminute, clockwise motion of the calibration screw appreciably lowers the thermostat setting. Areverse, or counter-clockwise motion appreciably raises the thermostat setting. After achieving the desired cycling of the thermostat, the calibration screw must be sealed. Place a few drops of enamel sealant directly on the calibration screw.(Red nail polish or equivalent is acceptable.)a. no power. Display will not light.1. V erify that power is available at the outlet or junction box.2. V erify that the circuit breaker switch on the back of the unit is turned on.3. V erify that the power cord is not open. Check continuity with a VOM meter.4. I f none of the above steps help, call a qualified service technician or refer to the Service Manual forthis particular oven.trOUBle ShOOting internal electrical cOMPOnentS√trOUBle ShOOtingto test probe and air sensor:Tes t probe and air sensor by placing sensor in ice water bath and using an ohmmeter set on the ohm scale. The reading should be 100 ohms resistance. If it is more than 2 ohms higher or lower, sensor needs to be replaced.M a n U a l c O n t r O lPart numbers and drawings are subject to change without notice.heat caBle rePlaceMent Service KitSfgbDeScriPtiOnPart nO.Qty iteM DeScriPtiOnPE-2546418CASINGHG-201529DOOR HANDLE STRIKER ONLY Part numbers and drawings are subject to change without notice.exterior viewPart numbers and drawings are subject to change without notice.top rear viewBack of cabinetcabinet frontelectrical componentsPart numbers and drawings are subject to change without notice.1. Make an immediate inspection while the equipment is still in the truck or immediately after it is moved to the receiving area.Do not wait until after the material is moved to a storage area.2. Do not sign a delivery receipt or a freight bill until you have made a proper count and inspection of all merchandise received.3. Note all damage to packages directly on the carrier’s delivery receipt.4. Make certain the driver signs this receipt. If he refuses to sign, make a notation of this refusal on the receipt.5. If the driver refuses to allow inspection, write the following on the delivery receipt:Driver refuses to allow inspection of containers for visible damage.6. Telephone the carrier’s office immediately upon finding damage, and request an inspection. Mail a written confirmation of thetime, date, and the person called.7. Save any packages and packing material for further inspection by the carrier.8. Promptly file a written claim with the carrier and attach copies of all supporting paperwork.We will continue our policy of assisting our customers in collecting claims which have been properly filed and actively pursued.We cannot, however, file any damage claims for you, assume the responsibility of any claims, or accept deductions in paymentfor such claims.LIMITED WARRANTYAlto-Shaam, Inc. warrants to the original purchaser only that any original part that is found to be defective in material or workmanship will, at Alto-Shaam's option, subject to provisions hereinafter stated, be replaced with a new or rebuilt part.The parts warranty period is as follows:For the refrigeration compressor on Alto-Shaam Quickchillers™, five (5) years from the date of installation.For the heating element on Halo Heat® cook/hold ovens, as long as the original purchaser owns the oven.For all other parts, one (1) year from the date of installation or fifteen (15) months from the shipping date, whichever occurs first.The labor warranty period is one (1) year from the date of installation or fifteen (15) months from the shipping date, whichever occurs first.Alto-Shaam will bear normal labor charges performed during standard business hours, excluding overtime, holiday rates or anyadditional fees.To be valid, a warranty claim must be asserted during the applicable warranty period. This warranty is not transferable.THIS WARRANTY DOES NOT APPLY TO:1. Calibration.2. Replacement of light bulbs, door gaskets, and/or the replacement of glass due to damage of any kind.3. Equipment damage caused by accident, shipping, improper installation or alteration.4. Equipment used under conditions of abuse, misuse, carelessness or abnormal conditions, including but not limited to, equipmentsubjected to harsh or inappropriate chemicals, including but not limited to, compounds containing chloride or quaternary salts, poor water quality, or equipment with missing or altered serial numbers.5. Damage incurred as a direct result of poor water quality, inadequate maintenance of steam generators and/or surfaces affected by waterquality. Water quality and required maintenance of steam generating equipment is the responsibility of the owner/operator.6. Damage caused by use of any cleaning agent other than Alto-Shaam's Combitherm® Cleaner, including but not limited to damage due tochlorine or other harmful chemicals. Use of Alto-Shaam's Combitherm® Cleaner on Combitherm® ovens is highly recommended.7. Any losses or damage resulting from malfunction, including loss of product or consequential or incidental damages of any kind.8. Equipment modified in any manner from original model, substitution of parts other than factory authorized parts, removal of any partsincluding legs, or addition of any parts.This warranty is exclusive and is in lieu of all other warranties, express or implied, including the implied warranties of merchantability and fitness for a particular purpose. In no event shall Alto-Shaam be liable for loss of use, loss of revenue or profit, or loss of product, or for any indirect, special, incidental, or consequential damages. No person except an officer of Alto-Shaam, Inc. is authorized to modify this warranty or to incur on behalf of Alto-Shaam any other obligation or liability in connection with Alto-Shaam equipment.Effective 09/10RECORD THE MODEL AND SERIAL NUMBER OF THE APPLIANCE FOR EASY REFERENCE.ALWAYS REFER TO BOTH MODEL AND SERIAL NUMBER IN ANY CONTACT WITH ALTO-SHAAM REGARDING THIS APPLIANCE. Model: ______________________________________________ D ate Installed: ______________________________________________________ Voltage: ______________________________________________ Purchased From: ___________________________________________ Serial Number: _____________________________________________________________________________________________________________ W164N9221W a t e r S t r e e t P.O.B o x450M e n o m o n e e F a l l s,W i s c o n s i n53052-0450U.S.A.PHONE: 262.251.3800 • 800.558-8744 USA/CANADA FAX: 262.251.7067 • 800.329.8744 U.S.A. ONLYP R I N T E D I N U.S.A.。
电器品牌_电干机型号_操作手册说明书

Dryeren Usage andTable of contentsUsage InstructionYour new dryer (4)Notes on disposal (5)Disposing of packaging (5)Disposing of old dryers (5)Safety notes (6)Using the dryer correctly (6)Before using the dryer (6)Drying your laundry (7)Observe at the end of the program (7)Notes on protecting the dryer (7)Environmental protection/ notes on economy (8)Drying in an economical and environmentally-aware manner (8)Dryer description (9)Brief instructions (9)Door operation (9)Appliance design (10)Control panel (11)Notes on laundry (12)Labelling of fabrics (12)Tips on drying (13)First use (14)Drying (14)Selecting a program (15)Selecting (15)2Programme sequence (15)Standard programmes (16)Timed programme (17)Additional function (17)Low Heat button (17)Buzzer button (17)Cleaning and care (18)Cleaning the dryer (18)Fluff filter (18)Troubleshooting (19)After-sales service (21)Technical data (22)Installation InstructionSetting up and connecting (23)Safety notes (23)Setting up the dryer (24)Washer-dryer stack connection set (25)Assembling the exhaust air hose (25)Electrical connection (26)3Your new dryerWith the purchase of your new dryer, you havechosen a modern, high-quality domestic appliance.A distinctive feature of your dryer is its low energyconsumption.Every dryer which leaves our factory is carefullychecked to ensure that it functions correctly andis in perfect condition. Our after-sales service isavailable should you have any questions,particularly on how to set up your dryer.You will find further information and a selection ofour products on our website:http://www.bosch-hausgeraete.deRead this instruction manual and all otheraccompanying information for your dryer andfollow the advice you find there.Keep all the documents in a safe place for futurereference or to pass on to the next owner.45Notes on disposalDisposing ofpackagingThere is a risk of suffocation from the cardboard box and plastic film.Do not allow children to play with the packaging. All our packaging materials are environmentallyfriendly and recyclable. Please dispose of thepackaging in an environmentally-responsiblemanner.Any retailer or your local authority will be able toadvise you on the disposal methods currentlyavailable.Disposing ofold dryersDanger of death from electrocution or suffocation. Your old dryer:Disconnect it from the mains.Cut through the mains cable and discard alongwith the plug.Break the door lock. This prevents childrenfrom locking themselves in the dryer.Environmentally-friendly disposal conservesvaluable raw materials.Any retailer or your local authority will be able toadvise you on the disposal methods currentlyavailable.European directive 2002/96/EC on WasteElectrical and Electronic Equipment (WEEE).This guideline is the frame of a European-widevalidity of return and recycling on WasteElectrical and Electronic Equipment.Safety notesUsing the dryer correctly Only for domestic use.Only for drying fabrics which have been washed in water.Do not leave children unsupervised near the dryer –Solvent hazard.Do not use the dryer if:the laundry has been treated with a solvent or has been colour-treated (e.g. stain remover,petroleum ether).Dust hazard.Do not use the dryer if:the laundry contains dust, e.g. coal dust or flour. the laundry contains foam/rubber.the laundry contains traces of hairspray, nail varnish remover or similar substances.Before using the dryer Install the dryer in accordance with theinstallation instructions (see page 23).Do not connect the dryer if it has visible signs of damage. If in doubt, contact a specialist retailer.67Drying yourlaundryDo not leave children unsupervised near the dryer. Keep pets away from the dryer. Remove all objects from pockets. Look out forlighters in particular –Observe atthe end ofthe programSwitch off the dryer when the program has ended. Notes onprotectingthe dryerDo not climb onto the dryer. Do not lean or sit on the door – Do not lift the dryer by any protruding components.Do not use detergent boosters containing solvents or dirt and stain removers in the dryer. These substances may damage the dryer. Empty the dryer completely when it is to be transported or stored. Do not set up your dryer in a room that is exposed to frost.Environmental protection/ notes on economyDrying in an economical and environmentally-aware manner Spin the laundry thoroughly before drying.Spin the laundry thoroughly in the washingmachine before drying. The higher the spinspeed, the shorter the drying time and the lower the energy consumption. You should also spineasy-care laundry.Fill to full capacityFill the dryer to its maximum recommendedcapacities. Do not exceed the capacities:White and coloureds max. 5.0 kgEasy-care fabrics max. 2.5 kgEnsure sufficient room ventilationOpen a window or door while drying laundry.Clean the fluff filterClean the filter after each drying cycle (seepage 18).Do not obstruct the cooling air supply Do not position or affix anything over the coolair inlet on the rear of the dryer.89Dryer description BriefinstructionsBefore drying Open the door. Place the laundry in the drum. Close the door.Select a programme using the programme selector (see the table of programmes from page 16 onwards).Set additional functions if required (see page 17). Press the Start button.Adding laundryOpen the door.The drying cycle is halted.Add or remove laundry.Close the door.Select another programme if necessary usingthe programme selector (see the table of programmes from page 16 onwards). Press the Start button.After dryingOpen the door.Remove the laundry. Turn the programme selectorto Off . Clean the fluff filter (see page 18).Door operationPress the door to open.Close the door (you will hear a clicking noise).10Control panelNotes on laundryLabellingof fabricsDo not tumble-dry the following fabrics:Impermeable fabrics (e.g. rubber-coatedfabrics).Delicate materials (silk, curtains made fromsynthetic material) – they may creaseDripping-wet laundry – high energyconsumptionWool or fabrics containing wool.Observe the manufacturer's instructions.Tips on drying Important for all drying cycles:To obtain a uniform drying result: sort thelaundry by fabric type and drying program.Fasten zips, hooks and eyes. Tie loose belts,apron strings etc., together.Do not over-dry easy-care laundry: Risk ofcreasing. Allow laundry to finish drying in the air.Do not over-dry laundry.Do not iron laundry immediately after drying.Leave laundry folded up for a short while. Thishelps the residual moisture to distribute evenly.Knitted fabrics (e.g. T-shirts, jerseys) oftenshrink slightly the first time they are tumble-dried. Do not use the Extra Dry programme.First usePlease read this instruction manual before using the dryer for the first time:1. Open the door.2. Place the laundry into the empty drum.Ensure that the drum contains only laundry.3. Close the door.4. Select a programme using the programmeselector.5. Set additional functions if required (see page 17).6. Press the Start button.NoteYou can interrupt the drying program by opening the door.Close the door.Press the Start button.It is possible to change the drying programme during drying.1. Turn programme selector to Off (cancels theprogramme).2. Select the new programme you require usingthe programme selector.3. Press the Start button.Selecting a programSelectingYour dryer offers different programmes and the additional Low Heat function for optimum drying (see page 17).Our drying programs are designed to protect your laundry with minimum energy consumption. Your laundry will feel damper than it really is because of the residual warmth after drying.If the degree of laundry drying still does not meet your expectations after the laundry has cooled down, please use the next-higher drying program or the timer program.Programme sequence During the Standard programmes, the dryer uses an electronic sensor system which constantly monitors how wet the laundry is. The drying cycle automatically stops as soon as the levelof dryness set has been reached. The indicator lamps (LEDs) display the programme status.Standard programmesCottons, coloured and linens 3-5 kg.Press the Low Heat button when drying heat-sensitive fabrics.Standard programme Cottons/ linensBed linen, table linen and towels For laundry:which needs to bepressed Iron dryBed linen, table linen, towels, T-shirts, polo shirts, work clothes which needs to beironedIron dryT-shirts, polo shirts, dresses, trousers, work clothes, underwear which should only belightly ironed or not atallCupboard dryTerry towels, tea towels and hand towels, bed linen, underwear, cotton socks which do not need to beironed with thick ormulti-layered partsDry plusTowelling dressing gowns and bed linenNo underwear or socks which is particularlythick or multi-layeredExtra dryEasy-care (no-iron) laundry made from synthetic and mixed fibres, cotton e.g. viscose, cupro, modal, polyester, up to 2.5 kg Timed programme Easy-careTrousers, dresses, skirts and shirts For laundry:which needs to beironedIron dryTrousers, dresses, skirts, shirts, blouses, corsetry, leggings, sportswear with a high synthetic content which should only belightly ironed or not atallLightly dryShirts, blouses and sportswear which does not need tobe ironedCupboard dryBed linen and table linen, tracksuits, anoraks, blankets, cotton socks which does not need tobe ironed – thick,quilted fabricsVery dryTimed programmeAdditional functionLow Heat button Press the Low Heat button for temperaturesensitive fabrics (e.g. acrylics).Observe the fabric care instructions .The temperature is reduced and the drying timeincreased.The function remains active until the buttonis pressed again.Buzzer button The buzzer is switched off by pressing the button. Fabrics which have already been pre-dried and are slightlydamp, individual laundry items such as bath towels, swim wear,dishcloths and quilted fabrics made of acrylic.Press the Low Heat button when drying heat-sensitive fabrics.Warm(adjustable in 10minute incrementsup to 60 minutes) For freshening and airing items of clothing which are not wornvery often.For all types of fabrics.Cold(adjustable to10 minutes)Cleaning and careCleaning the dryerRisk of explosionThere is a risk of explosion from solvents.Never use solvents for cleaning.The dryer may be damaged if it is not cleaned correctly. Do not spray the dryer with a water jet. Do not use abrasive agents or general-purpose cleaners.Clean the housing and the control panel with a mild detergent and a soft cloth.Fluff filterClean the fluff filter after each drying cycle.Bobbling (fluff) occurs when fabrics become worn. These bobbles come off during the drying cycle and collect in the fluff filter.A clogged filter results in longer drying times and higher energy consumption.1. Open the door.2. Pull the filter out towards the top.3. Remove the fluff (by drawing your hand acrossthe filter).4. Replace the filter (it can only be inserted oneway round).5. Close the door.Troubleshooting...Troubleshooting... CauseSolution The dryer is not pluggedin.Plug in the dryer. No drying programme has been set. Select the programme you require using the programme selector. The On indicator lamp does not light up. The circuit breaker hastripped. Reset/replace the fuse. Start button has not been pressed. Press the button.No drying programme has been set. Select the programme you require using the programme selector. The door is not shut.Close the door. The dryer does not start.The ambient tempera-ture is below 5 °C.Warm up the room. The humidity inthe room has increased significantly. The room is notsufficiently ventilated. Ensure sufficient ventilation. The door opens by itself.The locking pin is not engaged.Push the door closed until you hear the locking pin click into place. Drying is notsatisfactory or the drying time is too long.The filter is blocked.Clean the filter (page 18).Risk of electrocutionRepairs must only be carried out by the after-sales service or an authorised expert.If you cannot rectify a fault yourself or a repair is necessary:Turn the programme selector to Off . Remove the plug from the socket.Contact the aftersales service (see page 21).Troubleshooting...Cause Solution Ambient temperature is above 30 °C. Ensure that there is sufficient ventilation. The wrong programme was selected. Set the drying programme using the programme information (from page 16). Power cut for more than two hours. Restart the program by pressing the Start button again.Drying is notsatisfactory The laundry feels damper than it really is. Reset the drying time if thelaundry is not sufficiently dryafter cooling down.Laundry is not dried evenly There was - too much laundry. - only large items of laundry. - items of laundry with different fibre constructions. Dry - small amounts of laundry. - large and small items together. - items according to their fibre construction. Condensation in the exhaust air hose. The exhaust air hose is too long. Arrange the dryer so that the exhaust air hose is no morethan 2 m long.After-sales serviceBefore you contact the after-sales service, pleasecheck that you cannot rectify the malfunctionyourself. (see page 19 onwards)If you contact the after-sales service, even withinthe warranty period, you will be liable for labourcosts.Please inform the after-sales service of theproduct number (E-Nr.) and the manufacturenumber (FD) of the appliance.You will find this information in the thick-borderedarea of the rating plate on the door frame (visiblewhen the door is open).Product number Manufacture numberNote the numbers for your appliance here.Please help us to avoid unnecessary journeysby quoting the product and manufacture numbers.This will also save you the related additional costs.Further information can be found on our website:http://www.bosch-hausgeraete.deorat our aftersales service centres.You can still use our after-sales service evenafter your warranty has expired if no other repairworkshops are available to you.21Technical dataSize Load Height 85 cm (adjustable)Width 60cm Depth 59cm Weight approximately 45 kgNominal capacity 5 kgA.C. voltage, connected load, fuse see the rating plateConsumption rates Spin speed in rpm(residual moisture) Energy consumptionin kWhCottons + linens 5 kgCupboard dry 8001,0001,2001,4001,600 (approx. 70%)(approx. 62%)(approx. 55%)(approx. 50%)(approx. 47%)3.353.002.702.352.30The information shown represents average values under standard conditions only. Deviations of up to 10% are possible.2223Setting up and connectingSafety notesThe dryer is very heavy.Do not attempt to lift it on your own.Do not lift the dryer by any of the projecting parts (e.g. the door) – they may break off .There is a risk of tripping due to cables or hoses hanging down.Secure loose cables or hoses.Check the dryer for damage caused during transportation. Do not connect the dryer if it has visible signs of damage. If in doubt, contact a specialist retailer.Empty the dryer completely before transporting.24Setting up the dryerlockable door, a sliding door or a door with the hinge on the opposing side to the appliance.the tumble dryer can be opened unimpeded.into a flue which is used for exhausting fumes from appliances burning gas or other fuels.The dryer must be positioned so it is level on the floor. Use a spirit level to ensure that this is the case. The height of the feet can be adjusted. If necessary, use these to line the dryer up, as described below: Loosen the counter nuts.Turn the feet so that they compensate for theheight of the machine.Retighten the counter nuts.Do not trap the mains cable between thedryer and the wall.Leave a minimum distance of 10 cm betweenthe ventilation support and the wall.times to the earth contact socket.cannot be assembled anddisassembled.Washer-dryer stack connec-tion setOrder no.: WTZ 1250The dryer can be placed on top of a Bosch washing machine of the same dimensions to save space.Risk of injuryFor reasons of safety, the dryer must be installed by an expert. Always use aconnection set to secure the dryer to thewashing machine.Assembling the exhaust air hose There are exhaust air outlets in the left side wall and the rear panel of the dryer.Select the most suitable exhaust air outletafter installing the dryer.Cover the other outlet with the accompanying fascia cover – turn it in a clockwise direction.1 Plastic cover2 Exhaust air hosePlace the end of the exhaust air hose in the open air without bending the hose. Theexhaust air hose should only be positionedhorizontally or vertically and never left to sag. The exhaust air hose should not be more than 2 m long.Position the exhaust air hose so that there is no counterpressure (e.g. from wind) on theexhaust outlet.25Electrical connection Only connect the dryer to an earthed outlet installed in accordance with regulations.Make sure that the voltage details on the rating plate (visible when the door is open)correspond with the mains voltage where the appliance is set up. The connected load and the fuse or miniature circuit breaker are also specified on the rating plate.Make sure that the plug and the socket match, the cross section of the cable issufficient and the earthing system has beeninstalled in accordance with regulations.Do not use multiple plugs/adapters or an extension cable.Only pull the mains plug out of the socket using the grip on the plug. Do not connectthe appliance to the mains with wet hands.Only have the mains cable replaced by the after-sales service.If the mains cable for the dryer is damaged, have it replaced by the manufacturer or itsafter-sales service.26ROBERT BOSCH HAUSGERÄTE GMBH WTA4107/9000182406141693/en (04-06)。
博实乐数显电压电流表使用说明书

智能电压电流表使用说明书特点:1、安装的注意事项1/12页1、一台仪表具有最多三个输入量程选择2、具有测量显示、报警输出、变送输出、通信等功能3、两个DI输入,两个DO输出功能可供选择4、本产品使用于工业机械、机床及相关设备中的电压或电流监测5、交流直流有效值测量,当直流测量时可选择极性显示6、经济实用,操作简便a、为了不使热量饱和,请开足够的通风空间。
b、请考虑到配线、保养环境等,请确保本产品上下方有50mm以上的空间。
c、请避免安装在发热量大的机器(如:加热器、变压器、半导体操作器、大容量的电阻)的正上方。
d、周围环境50℃以上时,请用强制风扇或冷却机等冷却,但是不要让冷却了的空气直接吹到本产品。
e、为了提高抗干扰性能和安全性,请尽量远离高压机器、动力机器进行安装。
f、高压机器与本产品不要在同一个盘内安装。
g、本产品与动力线距离应大于200mm以上。
h、动力机器请尽量拉开距离安装。
2)在全部配线完成之前,请不要接通电源。
否则可能导致触电、火灾、故障。
3)不要在产品记载规格要求范围之外使用。
否则可能导致火灾、故障。
4)不要使用在有易燃、易爆气体的场所。
5)上电后不要触摸电源端子等高电压部位。
否则有触电的危险。
6)不要拆卸、修理及改造本产品。
否则可能导致触电、火灾、故障。
1)本产品使用于以下环境标准:(IEC61010-1)[过电压分类Ⅱ、污染等级2]2)请在以下产品周围环境、温度、湿度及环境条件的范围内使用:温度:0~50℃;湿度:45~85%RH;环境条件:室内保用,海拔高度小于2000m。
3)请避免使用在以下场所:a、因温度变化激剧,有可能结露的场所b、产生腐蚀性气体、可燃性气体的场所c、直接振动或有可能冲击本产品的场所d、有水、油、化学品、烟雾、蒸气的场所e、尘埃、盐分、金属粉末多的场所f、杂波干扰大,容易发生静电、磁场、噪声的场所g、空调或暖气的气流直接吹到的场所h、阳光直接照射的场所i、由于辐射等有可能产生热积累的场所1)本产品不得使用在原子能设备以及与人命相关的医疗器械等方面。
USB-DMP605使用手册要点

USB-DMP605使用手册☐USB2.0总线AD数据采集控制模块☐32位ARM内核主控系统☐16路单端12位AD,内部时钟触发连续采样☐内置程控增益控制,三档在程可控变档☐板载FIFO存储系统,存储深度42K☐二路12位DA输出☐开关量:16路可程控输入、输出I/O☐一路16位计数器、频率计☐一路程控脉冲发生器☐模拟正弦波、三角波、锯齿波发生器☐二路基频可程控脉宽调制(PWM)发生器Sdjn3k济南三科2010/6 V1.1注意:请在开始使用模块前仔细阅读本使用手册检查打开包装请查验如下:✧USB-DMP605数据采集卡✧光盘。
✧USB电缆。
✧DB25插头, 26Pin排线插头。
安装关掉PC机电源,将采集卡USB电缆插入主机的任何一个USB插槽中并将外部的输入、输出线连好。
如果主机有多套USB采集卡,请每次只安装一个采集卡。
软件启动安装请参看第3章说明。
保修本产品自售出之日起一年内,用户遵守储存、运输和使用要求,而产品质量不合要求,免费维修。
因违反操作规定和要求而造成损坏的,需缴纳器件费和维修费及相应的运输费用,如果板卡有明显烧毁、烧糊情况原则上不予维修。
注意:1、如使用外接电源,请一定先检查确认电源极性及电压符合技术要求(5V±5%),并使用合格电源(如某些电源在开关时易产生强感应电压而击穿板卡),否则将造成无法修复的损毁,而且与电脑连接时有烧毁电脑的可能。
2、所有与板卡连接的输入、输出信号端都不能超过技术要求的电压幅度及包含有强感应脉冲电压,以免造成板卡损坏。
3、不可带电焊接板卡任何接线端及带电插拔接线接口器。
目录一、模块说明◆USB-DMP605采集卡简介◆主要特点及性能二、原理◆简介◆模拟输入及AD数据计算1、模块输入2、AD转换数据的计算◆DA部分原理及数据计算◆开关量输入/输出部分的原理◆计数器、频率计◆脉冲及模拟波形发生器◆PWM三、安装与连接◆安装◆信号连接注意事项◆连接器插座的定义1、J1的定义2、J2的定义3、电源插口4、USB插座◆常用信号的连接与处理四、软件◆软件的安装及说明◆操作函数说明1、设备操作函数2、AD操作函数3、DA操作函数4、开关量输入/输出操作函数5、计数器操作函数◆应用程序编程说明五、附录◆USB-DMP605模块示意图一、USB-DMP605说明DMP605采集卡简介DMP605是一款USB2.0总线12位AD数据采集卡,具有16路单端模拟输入,内置程控增益控制,板载FIFO存储系统,可进行设定点数或循环采集的内部时钟触发高速连续采样(最高采样时钟达600KHz),全部工作在软件设置模式、二路12位DA输出、开关量16路输入/输出全程控并可位设置及位读取、一路16位计数器及频率计、一路程控宽频率范围(550Hz-65KHz)的脉冲及各种模拟波形输出、二路程控可调基频脉宽调制(PWM)器。
锂盐电池驱动式洗衣机设置手册说明书
Cause and troubleshooting
Supply hose is kinked. ▶ Install the supply hose without kinks.
Water tap is turned off. ▶ Turn on the water tap.
Water tap is jammed or furred up. ▶ Turn on the water tap.
Setting the water softening sys-
H02
tem
H03
1. Press .
H04
2. To open the basic settings, press
H05
for 3 seconds.
H06
a The display shows Hxx.
H07
a The display shows .
ply hose
6. Clean the filter. 7. Re-insert the filter in the supply hose. 8. Screw the water connection back on. 9. Check the water connection for leaks. 10.Restore the power supply. 11.Switch the appliance on.
bile device and follow the instructions.
2. Scan the QR code with the Home Connect app.
Overview of water hardness settings
You can find an overview of the water hardness values that can be selected here. A table of country-specific units can be found in the instruction manual.
BamHI内切酶 说明书

37℃
80℃ 20min**
无
*,Star activity,当酶量5倍或以上过量时会产生星号活性,即产生非特异性酶活性。
**,该条件下仅能失活部分BamHI酶。
¾ 酶储存液组成为:10mM Tris-HCl (pH7.4 at 25℃),200mM NaCl,1mM DTT,0.1mM EDTA,0.15% Triton X-100,
¾ 1X Buffer Y组成为:33mM Tris-acetate (pH7.9 at 37℃),10mM magnesium acetate,66mM potassium acetate,0.1mg/ml
BSA。
¾ 酶切和连接效率:50倍过量的本内切酶消化1小时,>95%被酶切的片段可以被连接并被重新酶切(recut)。
0.2mg/ml BSA and 50% glycerol。
¾ 1X Buffer BamHI 组 成 为 : 10mM Tris-HCl (pH8.0 at 37 ℃ ) , 5mM MgCl2 , 100mM KCl , 1mM 2-mercaptoethanol , 0.02%Triton X-100,0.1mg/ml BSA。
切。 ¾ 为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 单酶切时可以参考如下反应体系进行: 待酶切DNA
不超过1µg
双蒸水或MilliQ水
适量
10X Buffer BamHI
2µl
BamHI
0.5-1µl
总体积
20µl
37℃孵育1小时或更长时间 说明:请注意把Buffer和水等充分混匀后再加入内切酶,加入内切酶后可以用枪吹打或轻轻Vortex混匀。通常参考上述条 件孵育1小时已经足够,但多孵育数小时甚至孵育过夜也不会产生负面影响。如果酶切较长时间甚至酶切过夜,可以使用 更少量的酶。待酶切DNA量较大时,可以适当延长酶切时间或按比例放大酶切体系。 2. 双酶切或多酶切时,需选择适当的可以兼容两个或多个内切酶的缓冲液,然后参考上表设置反应体系。如果没有合适的
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0.2mg/ml BSA and 50% glycerol。
¾ 1X Buffer BamHI 组 成 为 : 10mM Tris-HCl (pH8.0 at 37 ℃ ) , 5mM MgCl2 , 100mM KCl , 1mM 2-mercaptoethanol , 0.02%Triton X-100,0.1mg/ml BSA。
切。 ¾ 为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 单酶切时可以参考如下反应体系进行: 待酶切DNA
不超过1µg
双蒸水或MilliQ水
适量
10X Buffer BamHI
2µl
BamHI
0.5-1µl
总体积
20µl
37℃孵育1小时或更长时间 说明:请注意把Buffer和水等充分混匀后再加入内切酶,加入内切酶后可以用枪吹打或轻轻Vortex混匀。通常参考上述条 件孵育1小时已经足够,但多孵育数小时甚至孵育过夜也不会产生负面影响。如果酶切较长时间甚至酶切过夜,可以使用 更少量的酶。待酶切DNA量较大时,可以适当延长酶切时间或按比例放大酶切体系。 2. 双酶切或多酶切时,需选择适当的可以兼容两个或多个内切酶的缓冲液,然后参考上表设置反应体系。如果没有合适的
产品编号 D6053
BamHI
产品名称 BamHI
包装 2000U
产品简介:
¾ BamHI内切酶为进口分装,基本信息如下:
识别序列
缓冲液兼容性(%)
酶切温度 失活条件 甲基化干扰?
G^GATCC 1X BamHI 1X B 1X G 1X O 1X R 1X Y 2X Y
CCTAG^G
100 20-50* 100 20-50 50-100* 100* 50-100
¾ 活性单位定义:在37℃,50微升反应体系中反应1小时,将1微克的λ DNA完全分解的酶量定义为1个活性单位,即1U。
包装清单:
产品编号 D6053-1 D6053-2 D6010Y
-
产品名称 BamHI (10U/µl) 10X Buffer BamHI
10X Buffer Y 说明书
包装 2000U 0.3ml
¾ 1X Buffer Y组成为:33mM Tris-acetate (pH7.9 at 37℃),10mM magnesium acetate,66mM potassium acetate,0.1mg/ml
BSA。
¾ 酶切和连接效率:50倍过量的本内切酶消化1小时,>95%被酶切的片段可以被连接并被重新酶切(recut)。
37℃ activity,当酶量5倍或以上过量时会产生星号活性,即产生非特异性酶活性。
**,该条件下仅能失活部分BamHI酶。
¾ 酶储存液组成为:10mM Tris-HCl (pH7.4 at 25℃),200mM NaCl,1mM DTT,0.1mM EDTA,0.15% Triton X-100,
缓冲液可以选择,可以在一种酶消化完毕后进行纯化,纯化完毕后再进行另外一种酶切反应。
1ml 1份
保存条件:
-20℃保存。
注意事项:
¾ 内切酶使用时宜存放在冰盒内或冰浴上,使用完毕后宜立即放置于-20℃保存。 ¾ 如果发现预期的酶切位点不能切开,请确认是否存在甲基化干扰问题。 ¾ 特别注意:甘油含量大于5%,低盐浓度,pH >8.0或酶大大过量(约20倍以上)可能会导致星号活性,即产生非特异性酶
