医疗器械相关标准汇总表
医疗器械企业ISO表格清单汇总

医疗器械企业ISO表格清单汇总1、受控文件清单(1.质量文件)2、受控文件清单(2.管理文件)3、受控文件清单(3.技术文件)4、受控文件清单(4.外来文件)5、文件发放回收记录表6、文件借阅、复制记录表7、文件更改申请单8、文件销毁申请单9、文件留用申请10、外来文件留用申请11、文件更改、销毁、留用记录表12、文件归档清单13、部门质量记录清单14、公司质量记录清单15、法律法规文件阅读记录16、年度培训计划17、员工培训考核记录表18、培训申请表19、培训合格率汇总表20、培训记录21、员工培训档案22、设备购置申请表23、设备验收单24、设备保养(检修)计划25、月设备保养记录表26、设备台帐27、设备检修单28、设备报废单29、生产环境检查记录30、顾客来电记录表31、执行合同交付记录32、合同台帐33、经销商台帐34、特殊销售合同评审记录表35、来电订货记录表36、顾客档案37、交付安装表38、售后服务记录表39、客户培训记录40、合同更改通知单41、顾客需求、投诉、报怨处理记录42、顾客投诉调查处理记录43、设计和开发任务书44、设计开发实施进度表45、设计开发输入清单46、设计开发输入评审单47、设计开发输出清单48、设计和开发评审记录表49、设计和开发评审意见表50、设计和开发评审记录表51、设计存在问题及解决措施一览表52、采购合同台帐(档案)53、供方调查表54、供方业绩评定记录表55、合格供方名录56、月采购计划57、紧急采购单58、(供货)采购合同59、原辅材料外协分类明细表60、生产工序流程记录卡61、生产工序流程记录卡62、工序能力确认表63、可追溯性零件产品记录表64、返回产品登记表65、成品包装入库记录表66、监视测量设备台帐67、监视测量设备周期检定计划表68、监视测量设备台帐69、监视测量设备周期检定计划表70、监视测量设备借用台帐71、内校设备记录72、顾客满意程度调查表73、顾客满意度调查表发放记录74、顾客信息反馈单75、年度内部质量体系审核计划76、内审实施计划表77、审核组长任命书78、会议签到表79、内部质量体系审核检查表80、不合格报告81、内部质量体系审核报告82、成品检验记录83、工序巡检记录表84、常温老化记录85、整机台帐86、机号发放记录87、外购元器件、部件、整件和外协件质量检验记录88、进货检验台帐89、成品一次交验合格率汇总表90、不合格品记录91、不合格评审记录92、改进和纠正预防措施处理单93、改进、纠正和预防措施实施情况一览表94、改进计划95、产品交付监控统计表。
II类医疗器械产品分类汇总表
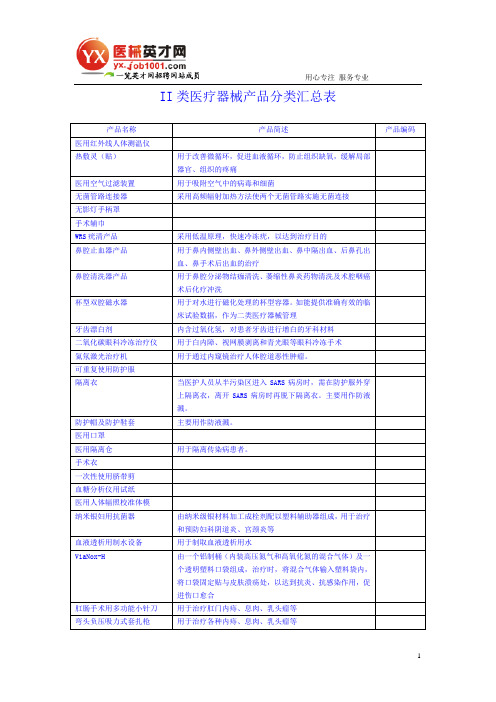
用心专注服务专业II类医疗器械产品分类汇总表产品名称产品简述产品编码医用红外线人体测温仪热敷灵(贴)用于改善微循环,促进血液循环,防止组织缺氧,缓解局部器官、组织的疼痛医用空气过滤装置用于吸附空气中的病毒和细菌无菌管路连接器采用高频辐射加热方法使两个无菌管路实施无菌连接无影灯手柄罩手术辅巾WRS疣清产品采用低温原理,快速冷冻疣,以达到治疗目的鼻腔止血器产品用于鼻内侧壁出血、鼻外侧壁出血、鼻中隔出血、后鼻孔出血、鼻手术后出血的治疗鼻腔清洗器产品用于鼻腔分泌物结痂清洗、萎缩性鼻炎药物清洗及术腔咽癌术后化疗冲洗杯型双腔磁水器用于对水进行磁化处理的杯型容器。
如能提供准确有效的临床试验数据,作为二类医疗器械管理牙齿漂白剂内含过氧化氢,对患者牙齿进行增白的牙科材料二氧化碳眼科冷冻治疗仪用于白内障、视网膜剥离和青光眼等眼科冷冻手术氦氖激光治疗机用于通过内窥镜治疗人体腔道恶性肿瘤。
可重复使用防护服隔离衣当医护人员从半污染区进入SARS病房时,需在防护服外穿上隔离衣,离开SARS病房时再脱下隔离衣。
主要用作防液溅。
防护帽及防护鞋套主要用作防液溅。
医用口罩医用隔离仓用于隔离传染病患者。
手术衣一次性使用脐带剪血糖分析仪用试纸医用人体辐照校准体模纳米银妇用抗菌器由纳米级银材料加工成栓剂配以塑料辅助器组成,用于治疗和预防妇科阴道炎、宫颈炎等血液透析用制水设备用于制取血液透析用水ViaNox-H 由一个铝制桶(内装高压氮气和高氧化氮的混合气体)及一个透明塑料口袋组成,治疗时,将混合气体输入塑料袋内,将口袋固定贴与皮肤溃疡处,以达到抗炎、抗感染作用,促进伤口愈合肛肠手术用多功能小针刀用于治疗肛门内痔、息肉、乳头瘤等弯头负压吸力式套扎枪用于治疗各种内痔、息肉、乳头瘤等多体位治疗床用于对病人进行特殊体位的手术治疗宫颈扩张棒血糖试纸用于半定量血糖浓度的测定壳聚糖宫颈抗菌膜用于敷贴在子宫颈溃疡面,起到抗菌消炎、促进溃疡愈光子嫩肤仪用于治疗色斑、雀斑、日光损伤、毛细血管扩张等骨接合用金属钛缝线用于手术时骨折断端连接妊娠诊断试纸(早早孕检测试纸)单人无菌室用于防止病人术后感染电动轮椅车、手动轮椅车微生物诊断鉴定培养基用于医院化验室培养细菌尿沉渣计数板戒毒治疗仪血浆融化仪用于快速融化冰冻血浆配合腔镜输送蛋白胶组份滴加于创面一次性使用蛋白胶腔镜配合管气囊导管自动牵拉器与导尿管相连,起报警作用,防止导尿管脱落人体脂肪测量计食道、肠道吻合器牙根管塞尖用于牙根管封闭用于治疗四肢浮肿、下肢静脉曲张等四肢血液循环顺序压缩治疗装置医疗压力带用于治疗下肢静脉曲张等一次性使用无菌溶药器(针)用于溶解药品尿十项检测试纸体外场效应热疗系统用于体外加热治疗肿瘤等尿钙目测试纸非植入式止鼾器光鼻器用于治疗过敏性鼻炎排龈线:用于退缩牙龈组织及牙龈毛细血管止血和口腔组织出血时的止血。
医疗器械质量记录(全套表格)

医疗器械质量记录(全套表格)医疗器械质量管理记录表格包括以下内容:1.文件修订申请表这个表格记录了对文件进行修订的申请。
在这个表格中,可以记录申请的原因、修订的内容以及修订的日期等信息。
这个表格可以帮助管理者追踪文件修订的历史和原因。
2.文件发放记录表这个表格记录了向哪些人员发放了文件。
在这个表格中,可以记录发放的日期、发放的人员、发放的文件名称等信息。
这个表格可以帮助管理者追踪文件的流向和发放情况。
3.文件回收记录表这个表格记录了哪些文件被回收了。
在这个表格中,可以记录回收的日期、回收的人员、回收的文件名称等信息。
这个表格可以帮助管理者追踪文件的回收情况。
4.文件销毁申请表这个表格记录了对哪些文件进行销毁的申请。
在这个表格中,可以记录申请的原因、销毁的文件名称、销毁的日期等信息。
这个表格可以帮助管理者追踪文件销毁的历史和原因。
5.文件销毁记录表这个表格记录了哪些文件被销毁了。
在这个表格中,可以记录销毁的日期、销毁的人员、销毁的文件名称等信息。
这个表格可以帮助管理者追踪文件的销毁情况。
6.质量管理体系问题改进和措施跟踪记录这个表格记录了质量管理体系中出现的问题和采取的措施。
在这个表格中,可以记录问题的描述、解决方案、实施时间等信息。
这个表格可以帮助管理者追踪质量管理体系中的问题和解决情况。
13、员工健康档案表员工健康档案表是一份重要的文档,它记录了员工的健康状况和医疗史。
在这个表格中,我们需要填写员工的个人信息、体检记录、病史、药物过敏史等内容。
这些信息对于企业管理者来说非常重要,因为它们可以帮助我们更好地了解员工的身体状况,为员工提供更好的保健服务。
14、员工健康检查汇总表员工健康检查汇总表是一份汇总员工体检结果的文档。
在这个表格中,我们需要记录员工的体检项目、检查结果、医生建议等内容。
这些信息可以帮助企业管理者更好地了解员工的身体状况,及时发现健康问题,采取措施预防疾病,保障员工的身体健康。
20160822强制性医药标准YY汇总
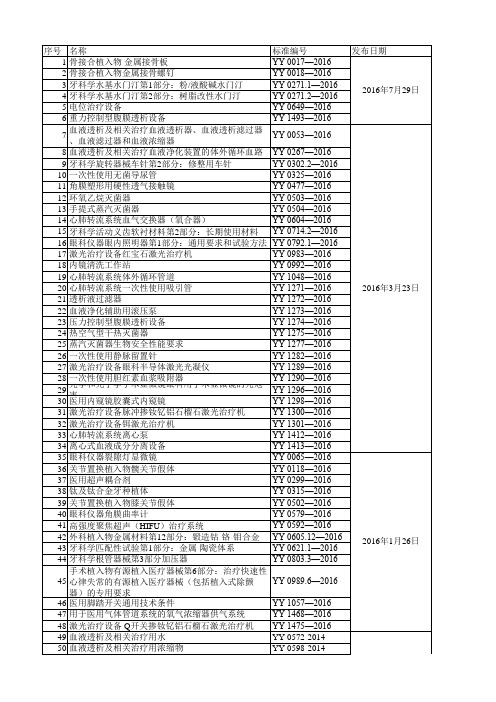
YY 0599-2014 YY 0603-2014 YY 0605.9-2014 YY 0831.2-2014 YY 0832.2-2014 YY 0945.2-2014 YY 0948-2014 YY 0950-2014 YY 0951-2014 YY 0952-2014 YY 0953-2014 YY 0954-2014 2015年3月2日
YY 0006-2013 YY 0045-2013 YY 0091-2013 YY 0092-2013 YY 0109-2013 YY 0154-2013 YY YY 0570-2013
YY 0571-2013 YY 0600.4-2013 YY 0635.1-2013 YY 0637-2013 YY 0875-2013 YY 0876-2013 YY 0877-2013 YY 0881-2013 YY 0885-2013 YY 0893-2013 YY 0896-2013 YY 0897-2013 YY 0898-2013 YY 0899-2013 YY 0900-2013 YY 0901-2013 YY 0902-2013 YY 0903-2013 YY 0904-2013 YY 0970-2013 YY 1023-2013 YY 1024-2013 YY 1139-2013 YY 0054-2010 YY 0290.9-2010
YY 0302.1-2010 YY 0333-2010 YY 0451-2010 YY 0573.4-2010 YY 0719.6-2010 YY 0773-2010 YY 0774-2010 YY 0775-2010 YY 0776-2010 YY 0777-2010 YY 0778-2010 YY 0780-2010 YY 0781-2010 YY 0782-2010 YY 0783-2010 2010年12月27日 YY 0784-2010 YY 0785-2010 YY 0786-2010 YY 0787-2010 YY 0788-2010 YY 0789-2010 YY 0790-2010 YY 0791-2010 YY 0792.2-2010 YY 0793.1-2010 YY 0801.1-2010 YY 0801.2-2010 YY 0803.1-2010 YY 0804-2010 YY 1007-2010 YY 1045.2-2010 YY 1116-2010 YY 0068.4-2009 YY 0069-2009 YY 0304-2009 YY 0322-2009 YY 0341 -2009 YY 0585.4-2009 YY 0601-2009 2009年12月30日
最新医疗器械分类界定汇总表

材料已注册
体外诊断试剂分类规定前
分类编码
说明
实施日期
文号 国药监械 [2003]53号
发文日期 2003.02.09
2 手套处理机 3 显示器 序号 产品名称 1 2 3 自动盖片机 体外用碎骨机 磨片机
盛装抗凝剂及标本,用于全自动血沉分析仪配套用试管。 用于手术手套在含有清洗剂的清水和专用粉中清洗和上粉(非 消毒)。 用于摄像机输出的视频信号的显示。 分类编码 说明 用于将极薄的盖玻片封盖在承载染色组织切片的玻片上。 用于在骨科手术中,将人体的组织或碎骨进行粉碎。 用于眼镜店或眼镜工厂打磨镜片。 用于对各种镜片度数进行精确、快速检测,并对累进焦点和 多焦点镜片进行测量图形显示。 用于对太阳镜进行紫外线透过率检查。 分类编码 说明
实施日期 2004.毒 用于改善微循环,促进血液循环,防止组织缺氧,缓解局部 器官、组织的疼痛
废止 废止
5 6 7 8 9 10 11 12 13 14 15 16 序号
文号 国食药监械 [2003]220号 文号 国食药监械 [2003]310号
发文日期
11 隐形眼镜润滑液 12 13 14 15 16 17 一次性使用脐带剪 血糖分析仪用试纸 一次性介入治疗仪探头 医用人体辐照标准体模 塑形针 Y形连接器
18 扭转器 19 氧气流量计
在体外用于将不同形状的导引钢丝塑型为直型。 体外用于帮助导引钢丝进入人体 在体外固定在导引钢丝的末端,便于医生扭转导引钢丝进入 人体。
12 超声图文网络工作站 Ⅱ 13 输液用空气净化设备 Ⅱ 一次性使用冷冻管、培养皿 14 、试管、培养板 非器械 非器械 15 临床检验用样品处理器 非器械 16 可调式摇摆称
17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 序号 1 序号
医疗器械经营质量管理规范现场检查指导原则记录汇总表

28
售后服务人员技术培训记录
3.13
29
委托贮存、配送服务协议及相关记录
4.18/5.40
30
零售存放医疗器械的检查记录
4.26.1
31
质量可疑医疗器械处置记录
※4.26.2
32
基础设施设备定期检查清洁和维护记录
4.27
33
质量报告记录
5.32.2/*8.63
34
收货记录
5.36.1
35
冷链管理记录
11
销毁记录
※2.8.1
12
停止经营和通知记录
※2.8.1
13
医疗器械召回记录
※2.8.1
14
设施设备维护及验证和校准记录
※2.8.1
15
培训记录
※2.8.1/3.1416来自质量事故调查记录※2.8.1
17
质量处理报告记录
※2.8.1
18
质量管理制度执行情况检查和考核记录
2.8.1/※2.8.2/2.9.1
19
运输记录
2.9.1
20
售后服务记录
2.9.1/8.56.1
21
质量查询、投诉、抽查情况记录
2.9.1
22
退货记录
2.9.1/8.57
23
不合格品处置相关记录
2.9.1/5.38.3
24
仓库温、湿度监控记录
2.9.1
25
运输冷链/保温监测记录
2.9.1
26
计量器具使用、检定记录
2.9.1
27
不良事件监测报告记录
*5.39/*7.53
36
近(超)效期医疗器械处置记录
内审表(医疗器械规范)汇总

内审表(医疗器械规范)汇总一、概述医疗器械行业是关系到人民生命健康的重要产业,我国政府高度重视医疗器械行业的发展。
为了保障医疗器械产品的安全有效,我国制定了一系列的医疗器械规范,对医疗器械的设计、生产、销售、使用等环节进行了严格的规定。
内审表是医疗器械企业在进行内部审核时使用的一种表格,用于记录审核过程中的相关信息。
本文将对内审表(医疗器械规范)进行汇总,以帮助医疗器械企业更好地进行内部审核。
二、内审表(医疗器械规范)的主要内容1. 产品质量审核产品质量审核是内审表(医疗器械规范)的核心内容之一,主要包括以下几个方面:(1) 产品设计审核:审核产品设计是否符合医疗器械规范的要求,包括产品的安全性、有效性、可靠性等方面的审核。
(2) 生产过程审核:审核生产过程是否符合医疗器械规范的要求,包括生产设备、生产环境、生产工艺等方面的审核。
包括产品质量标准、检验方法、检验记录等方面的审核。
2. 体系审核体系审核是内审表(医疗器械规范)的重要内容之一,主要包括以下几个方面:(1) 质量管理体系审核:审核企业质量管理体系是否符合医疗器械规范的要求,包括质量手册、程序文件、作业指导书等方面的审核。
(2) 环境管理体系审核:审核企业环境管理体系是否符合医疗器械规范的要求,包括环境管理体系文件、环境管理体系实施情况等方面的审核。
(3) 职业健康安全管理体系审核:审核企业职业健康安全管理体系是否符合医疗器械规范的要求,包括职业健康安全管理体系文件、职业健康安全管理体系实施情况等方面的审核。
3. 文件审核文件审核是内审表(医疗器械规范)的重要内容之一,主要包括以下几个方面:(1) 设计文件审核:审核产品设计文件是否符合医疗器械规范的要求,包括设计图纸、设计说明书、设计计算书等方面的审核。
包括生产工艺规程、生产作业指导书、生产记录等方面的审核。
(3) 检验文件审核:审核检验文件是否符合医疗器械规范的要求,包括检验规程、检验记录、检验报告等方面的审核。
II类医疗器械产品分类汇总表[1]
![II类医疗器械产品分类汇总表[1]](https://img.taocdn.com/s3/m/6ff78d7c842458fb770bf78a6529647d27283404.png)
主要成分为甲基丙烯酸甲酯、聚甲基丙烯酸甲酯、自凝聚甲基丙烯酸甲酯.用于人体眼球摘除后放置于眼结膜内,起填充、支撑、美容作用.
空气流动床
通过空气流通使医疗用微细陶瓷球流动,依照患者形体提供支持的装置.预防及治疗皮肤组织的压力损伤;排除外部摩擦及植皮的偏位等原因,防止破坏皮肤组织;防止皮肤浸软,消除恶臭,促进睡眠.
医用弹力袜
用于支撑、纠正、防止腿部畸形,以及用于腿部功能改善的袜形弹力支撑带
肠道水疗机
用于对肠道进行冲洗
一次性牙科冲洗针
用于清洗口腔中杂物
脂类检测试剂盒甘油三脂检测试剂盒、总胆固醇检测试剂盒、高密度脂蛋白胆固醇检测试剂盒、低密度脂蛋白胆固醇检测试剂盒、脂蛋白检测试剂盒、载脂蛋白检测试剂盒
用于测定人血清或血浆中脂类含量
肌酸激酶检测试剂盒、肌酸激酶同工酶检测试剂盒、乳酸脱氢酶检测试剂盒、a-羟丁酸检测试剂盒
鼻泪道阻塞引流包
由鼻泪管、空心泪道探针、鼻泪道扩张器外套、鼻泪道扩张器芯杆、鼻泪道推送器、导丝、导丝钩、鼻泪管装载器、鼻泪道造影针部件组成.使用期限在30日之内.用于治疗鼻泪道阻塞,使泪液引流畅通.
呼吸同步控制器
利用特制传感器控制电磁阀开关,达到供氧时与病人的呼吸生理节律一致.
电子听诊器
把心脏、肺脏、动脉等其它身体内器官生理活动的声音,以电子的方式加以过滤放大,用于辅助医生诊断使用.
腕式防打鼾器;背部护理系统;自动眼操仪;水凝胶乳垫不含药;视频眼震观察系统;封闭式血液冷藏周转箱;开放式血液冷藏周转箱;传染病防护罩;体外矫形器;医用防护鞋.
鼻腔导管
软硅胶管.在鼻腔出血时,用注射器通过气阀给气囊注射消毒液,使之膨胀,从而起到抑制鼻腔出血,防止鼻腔粘膜粘连的作用.
医疗器械分类界定汇总表

医疗器械分类界定汇总表医疗器械是医疗行业中非常重要的一部分,对于人们的生命健康具有重要意义。
它们根据使用目的、功能、特征等不同方面进行分类界定,以便更好地管理和监管。
在这篇文章中,我们将对医疗器械的分类界定进行汇总,让读者更好地了解和认识医疗器械。
一、按使用目的分类1. 诊断类器械:这类器械主要用于医生对患者进行诊断的工具或设备。
例如X光机、CT机、磁共振设备等。
它们帮助医生观察和分析患者的内部结构和病变情况,为正确的诊断提供有力的依据。
2. 治疗类器械:这类器械主要用于治疗疾病和护理患者。
例如手术刀、治疗仪器等。
它们通过各种技术手段和方法,促进患者的康复和病情的改善。
3. 监测类器械:这类器械主要用于监测患者的身体参数和生理状况。
例如血压计、心电图仪等。
它们帮助医生实时监测患者的体征变化,及时发现异常情况并进行处理。
4. 手术辅助类器械:这类器械主要用于辅助医生进行手术操作。
例如手术显微镜、激光刀等。
它们通过提供更好的视野或精确的操作功能,降低手术风险并提高手术效果。
二、按功能分类1. 切割类器械:这类器械主要用于切割组织或物质。
例如手术刀、剪刀等。
它们通过锋利的刀片或刃口,帮助医生进行手术切除、分离等操作,以达到治疗的目的。
2. 排出类器械:这类器械主要用于排出体内积聚的液体或物质。
例如导尿管、引流管等。
它们通过通道的建立,将体内的积液或排泄物排除,减缓病情进展或提供清晰的手术操作场景。
3. 植入类器械:这类器械主要用于在体内植入或固定组织或物质。
例如骨板、螺钉等。
它们通过安装在患者体内的材料,提供支持、修复或替代功能,促进体内组织的恢复和功能的改善。
4. 测量类器械:这类器械主要用于测量和记录身体参数或物质的浓度等。
例如血糖仪、体温计等。
它们通过传感器或电子装置,将目标参数转化为可读或可记录的数据,为医生提供判断和决策的依据。
三、按特征分类1. 电气类器械:这类器械主要使用电气能量进行工作。
医疗器械分类界定汇总表

医疗器械分类界定汇总表对医疗器械的分类界定对于医疗监管和市场监管都具有重要意义。
本文将针对医疗器械进行分类界定,并提供医疗器械分类界定汇总表。
通过该表,读者可以清晰地了解不同类型的医疗器械,并更好地理解其功能和用途。
一、体外诊断医疗器械体外诊断医疗器械是指用于检测、检验或监测人体组织、体液、细胞或其他样本,以获得有关健康状况或疾病诊断、预防、监测和治疗的信息的设备、仪器、试剂、装置和耗材。
1. 体外诊断试剂体外诊断试剂是用于测定人类或动物体内理化指标,以获得健康状况或疾病诊断、预防、监测和治疗等信息的试剂。
a. 化学试剂类化学试剂类体外诊断试剂是指通过化学原理,测定人体组织、体液、细胞或其他样本中的化学成分,以达到诊断、预防、监测和治疗的目的。
b. 免疫试剂类免疫试剂类体外诊断试剂是指通过测定人体组织、体液、细胞或其他样本中的免疫反应,以达到诊断、预防、监测和治疗的目的。
2. 体外诊断仪器和装置体外诊断仪器和装置是指用于测定人体组织、体液、细胞或其他样本中的指标,以获得健康状况或疾病诊断、预防、监测和治疗等信息的设备和仪器。
a. 化学分析仪器类化学分析仪器类体外诊断仪器和装置是指通过化学分析方法,对人体组织、体液、细胞或其他样本中的化学成分进行定量或定性测定的仪器和装置。
b. 免疫分析仪器类免疫分析仪器类体外诊断仪器和装置是指通过免疫分析方法,对人体组织、体液、细胞或其他样本中的免疫反应进行定量或定性测定的仪器和装置。
二、治疗性医疗器械治疗性医疗器械是指通过物理、化学、生物、机械等手段,用于预防、诊断、治疗、矫正、控制或减轻疾病的医疗器械。
1. 介入治疗器械介入治疗器械是指通过刺入人体组织、腔道或器官进行治疗的器械。
如导管、导丝、支架等。
2. 外科医疗器械外科医疗器械是指在医疗和外科手术过程中使用的器械。
如手术刀、吸引器、缝合线等。
三、监测医疗器械监测医疗器械是指用于监测人体生理参数、病理参数或治疗参数的医疗器械。
医疗器械相关标准汇总表

2011年6月1日 2011年6月1日 2011年6月1日 2011年6月1日 2011年6月1日 2011年6月1日 2011年6月1日 2011年6月1日 2011年6月1日 2011年6月1日 2011年6月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日 2010年12月1日
ห้องสมุดไป่ตู้
激光治疗设备 脉冲二氧化碳激光治疗机 激光治疗设备 半导体激光光动力治疗机 激光治疗设备 掺钬钇铝石榴石激光治疗机 医用内窥镜 内窥镜器械 取石网篮 眼科高频超声诊断仪 一次性使用无菌手术膜 全面非织造布外科敷料性能要求 第1部分:敷料生产用非织 造布 全面非织造布外科敷料性能要求 第2部分:成品敷料 心脏射频消融治疗设备 眼科光学 眼用粘弹剂 眼科光学 眼内填充物 神经核肌肉刺激器用电极 牙科学-聚和物基修复材料 内镜器械 第2部分:腹腔镜用剪 医用内窥镜 内窥镜功能供给装置 冷光源 血液透析装置 眼科光学 人工晶状体 第9部分:多焦人工晶状体 牙科旋转器械 车针 第1部分:钢质和硬质合金车针 软组织扩张器 一次性使用便携式输注泵 非电驱动 一次性使用无菌注射器 第4部分:防止重复使用注射器 眼科光学 接触镜护理产品 第6部分:有效期测定指南 眼科B型超声诊断仪通用技术条件 超声骨密度仪 远距离放射治疗计划系统 高能X(γ )射束剂量计算准确性要 求和试验方法 肝脏射频消融治疗设备 射频热疗设备 射频消融导管 电针治疗仪 血压传感器 医用电气设备 第2-51部分:记录和分析型单道和多道心电图 机安全和基本性能专用要求
医疗器械相关法律法规汇总表

医疗器械检测机构资格认可办法(试行)
2003年8月1日起施行
医疗器械临床试验规定
2004年1月17日国家食品药品监督管理局令第5号发布
自2004年4月1日起施行
医疗器械新产品审批规定(试行)
2000年4月10日国家药品监督管理局令第17号发布
自2000年4月20日起施行
一次性使用无菌医疗器械监督管理办法(暂行)
医疗器械相关法律法规汇总表
法律法规名称
发布日期
执行日期
备注
医疗器械分类规则
2000年4月5日国家药品监督管理局令第15号发布
2000年4月10日
医疗器械监督管理条例
2000年1月4日国务院令第276号发布
2000年4月1日
医疗器械标准管理办法(试行)
2002年1月4日国家药品监督管理局令第31号发布
2000年10月13日国家药品监督管理局令第24号发布
2000年10月13日起施行
医疗器械生产监督管理办法
2004年7月20日国家食品药品监督管理局令第12号公布
自公布之日起施行
医疗器械生产企业质量体系考核办法
2000年5月22日国家药品监督管理局令第22号发布
自2000年7月1日
2004年8月9日国家食品药品监督管理局令第16号公布
自公布之日起施行
医疗器械经营企业许可证管理办法
2004年8月9日国家食品药品监督管理局令第15号公布
自公布之日起施行
医疗器械说明书、标签和包装标识管理规定(局令第10号)
2004年7月8日国家食品药品监督管理局令第10号公布
医疗器械质量记录(全套表格)(2020年整理).pptx

1、文件修订申请表................................................................................................................................................... 3 2、文件发放记录表................................................................................................................................................... 4 3、文件回收记录表................................................................................................................................................... 5 4、文件销毁申请表................................................................................................................................................... 6 5、文件销毁记录表................................................................................................................................................... 7 6
医疗器械质量检验记录表格汇总

医疗器械质量检验记录表格汇总1. 背景介绍医疗器械的质量检验是确保其安全有效的重要环节。
为了统计和分析医疗器械的质量检验结果,制作一份质量检验记录表格汇总是必要的。
2. 表格设计思路在设计医疗器械质量检验记录表格汇总时,需要考虑以下几个要点:2.1 表格结构表格应该包含以下列:- 序号:用于标识每个检验记录的唯一编号,便于追溯和管理;- 医疗器械名称:记录被检验的医疗器械的名称或型号;- 检验日期:记录质量检验的日期;- 检验结果:记录医疗器械的检验结果,通常采用合格/不合格或符合/不符合等分类;- 检验单位:记录进行质量检验的单位或部门。
2.2 数据填写方式表格中的数据应该由进行质量检验的单位或部门填写,确保数据的准确性和可信度。
2.3 表格使用方式质量检验记录表格应该经过统一编号和归档,以方便日后的查询和分析。
同时,可以根据需要制作汇总报告或统计图表,进一步分析医疗器械质量的状况和趋势。
3. 使用建议为了有效地使用医疗器械质量检验记录表格汇总,建议以下几点:3.1 建立规范制定医疗器械质量检验记录表格使用的规范和标准操作流程,包括填写要求、存档管理等方面。
3.2 定期更新和维护定期对质量检验记录表格进行更新和维护,确保表格中的数据准确、完整和及时。
3.3 分析和应用根据质量检验记录表格汇总的数据,进行统计分析,及时发现医疗器械质量问题,并采取相应的改进措施,以提高医疗器械质量。
4. 总结医疗器械质量检验记录表格汇总是管理和分析医疗器械质量的有效工具。
通过正确使用和分析表格中的数据,能够提高医疗器械的质量水平,确保医疗器械的安全和有效性。
医疗器械临床评价相关法规汇总

医疗器械临床评价相关法规汇总为了便于大家对医疗器械临床评价进行系统的学习,我们对医疗器械临床评价相关的法规进行了汇总,详情如下,供广大企业参考:图1. 医疗器械临床评价相关法规汇总表《医疗器械注册管理法规解读之五》(2015年11月19日)“关于医疗器械临床评价数据授权要求《医疗器械临床评价技术指导原则》对于通过同品种医疗器械临床试验或临床使用获得的12数据进行分析评价要求中,明确数据应是合法获得的相应数据。
《食品药品监管总局关于执行 医疗器械和体外诊断试剂注册管理办法有关问题的通知》(食药监械管…2015‟247号)第六条基于合法数据要求的基础上,对于拟使用的同品种医疗器械非公开数据等提出授权要求,以保证数据来源的合法性。
使用公开发表的数据,如公开发表的文献、数据、信息等,不需取得授权。
”《食品药品监管总局关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知》食药监械管〔2015〕247号(2015年11月04日) “六、关于医疗器械临床评价资料提交依据《医疗器械临床评价技术指导原则》第六条开展临床评价的,如使用了同品种医疗器械的生产工艺、临床数据等资料,申请人应提交同品种医疗器械生产工艺、临床数据等资料的使用授权书。
”图2 医疗器械临床评价相关法规的上下级关系。
图2 医疗器械临床评价相关法规的上下级关系。
注:《医疗器械监督管理条例》属于“法律层面”,是医疗器械领域的上位法;《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》地位仅次于《条例》;《医疗器械临床评价技术指导原则》和《医疗器械临床试验质量管理规范(征求意见稿)》仅针对除体外诊断试剂之外的医疗器械,而《体外诊断试剂临床试验技术指导原则》只针对体外诊断试剂。
处于第三梯队的三个目录:《需进行临床试验审批的第三类医疗器械目录》、《免于进行临床试验的第二类医疗器械目录》和《免于进行临床试验的第三类医疗器械目录》都是针对除体外诊断试剂外的医疗器械。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GB23101.4 2008 外科植入物 羟基磷灰石 第4部分:涂层粘结强度的 测定
GB23102 2008 外科植入物 金属材料 Ti-6Al-7Nb合金加工材
GB23719 2008 眼科光学和仪器 光学助视器
GB9706.5
2008
医用电气设备 第2部分 用安全要求
能量为1MeV至50Mபைடு நூலகம்V电子加速器
GB9706.26 2005 医用电气设备第2部分:脑电图机安全专用要求
GB9706.27 2005 医用电气设备第2-24部分:输液泵和输液控制器安全专用要求
GB8368
2005 一次性使用输液器 重力输液器
GB8369
2005 一次性使用输血器
GB18458.3 2005 专用输液器第3部分:一次性使用避光输液器
GB9706.18
2006
医用电气设备 第2部分:X射线计算机体层摄影设备安全专用 要求(附修改单)
GB3156
2006 OCu宫内节育器
GB8662
2006 手术刀片和手术刀柄的配合尺寸
GB9706.28 2006 医用电气设备 第2部分: 呼吸机安全专用要求 治疗呼吸机
GB9706.29 2006 医用电气设备 第2部分:麻醉系统的安全和基本性能专用要求
GB11243 2008 医用电气设备第2部分:婴儿培养箱安全专用要求
GB18671 2009 一次性使用静脉输液针
GB19082 2009 医用一次性防护服技术要求
GB23101.1 2008 外科植入物 羟基磷灰石 第1部分:羟基磷灰石陶瓷
GB23101.2 2008 外科植入物 羟基磷灰石 第2部分:羟基磷灰石涂层
GB9706.23 2005 医用电气设备第2-43部分:介入操作X射线设备安全专用要求
GB16362 2010 远距治疗患者放射防护与质量保证要求
GB50591 2010 洁净室施工及验收规范
GB9706.17 2009 医用电气设备 第2部分:γ射束治疗设备安全专用要求
GB10152 2009 B型超声诊断设备
GB18282.3
2009
医疗保健产品灭菌 化学指示物 第3部分:用于BD类蒸汽渗 透测试的二类指示物系统
GB18282.4
2009
医疗保健产品灭菌 化学指示物 第4部分:用于替代性BD类蒸 汽渗透测试的二类指示物
GB24627 2009 医疗器械和外科植入物用镍-钛形状记忆合金加工材
GB7544
2009 天然胶乳橡胶避孕套 技术要求与试验方法
GB24786 2009 一次性使用聚氯乙烯医用检查手套
GB24787 2009 一次性使用非灭菌橡胶外科手套
GB12279 2008 心血管植入物 人工心脏瓣膜
GB24436 2009 康复训练器械 安全通用要求
GB14724 2009 硬质假眼
GB4793.2
2008
测量、控制和实验室用电气设备的安全要求 第2部分:电工测 量和试验用手持和手操电流传感器的特殊要求
GB4793.3
2008
测量、控制和实验室用电气设备的安全要求 第3部分:实验室 用混合和搅拌设备的特殊要求
标准编号 年号
标准名称
GB14232.3
2011
人体血液及血液成分袋式塑料容器 第3部分:带特殊组件的血 袋系统
GB18143 2011 眼科仪器 试镜架
GB19083 2010 医用防护口罩技术要求
外科植入物 羟基磷灰石 第3部分:结晶度和相纯度的化学分
GB23101.3 2010 析和表征
GB16348 2010 医用X射线诊断受检者放射卫生防护标准
GB24788 2009 医用手套表面残余粉末、水抽提蛋白质限量
GB10010 2009 医用软聚氯乙烯管材
GB8982
2009 医用及航空呼吸用氧
GB9706.4 2009 医用电气设备 第2-2部分:高频手术设备安全专用要求
GB9706.8 2009 医用电气设备 第2-4部分 心脏除颤器安全专用要求
GB10810.2 2006 眼镜镜片 第2部分:渐变焦镜片
GB11234 2006 宫腔形宫内节育器
GB11235 2006 VCu宫内节育器
GB11236 2006 TCu宫内节育器
GB20812 2006 角膜接触镜附属用品
GB2626
2006 呼吸防护用品――自吸过滤式防颗粒物呼吸器
GB7543
GB19489 2008 实验室 生物安全通用要求
GB50457 2008 医药工业洁净厂房设计规范
测量、控制和试验室用电气设备的安全要求 第2-042部分:使
GB4793.8 2008 用有毒气体处理医用材料及供试验室用的压力灭菌器和灭菌器
的专用要求
GB9706.7 2008 医用电气设备 第2-5部分:超声理疗设备专用安全要求
2006 一次性使用灭菌橡胶外科手套
GB10213 2006 一次性使用医用橡胶检查手套
GB12995 2006 机动轮椅车
GB10810.3 2006 眼镜镜片及相关眼镜产品 透射比规范及测量方法
GB10035 2006 气囊式体外反搏装置
GB9706.25 2005 医用电气设备 第2-27部分:心电监护设备安全专用要求
专
GB9706.13
2008
医用电气设备 第2部分:自动控制式近距离治疗后装设备安全 专用要求
GB9706.15
2008
医用电气设备 第1-1部分:安全通用要求 并列标准:医用电 气系统安全要求
GB9706.39 2008 医用电气设备 第2-39部分:腹膜透析设备的安全专用要求
GB8599
2008 大型蒸汽灭菌器技术要求 自动控制型
GB16895.24
2005
建筑物电气装置 第7-710部分:特殊装置或场所的要求-医疗 场所
GB11244 2005 医用内窥镜及附件通用要求
GB19815 2005 离心机 安全要求
GB4234
2003 外科植入物用不锈钢
GB12260 2005 人工心肺机 滚压式血泵
GB12263 2005 人工心肺机 热交换水箱
GB9706.9
2008
医用电气设备 第2-37部分医用超声诊断和监护设备安全专用 要求
GB9706.1 2007 医用电气设备 第一部分:安全通用要求
GB9706.6 2007 医用电气设备 微波治疗设备专用安全要求
GB4793.1
2007
测量、控制和实验室用电气设备的安全要求 要求
第1部分:通用
