液氢沸点来历计算
氢气的物化性质

氢气的物化性质氢气的物理性质之一:通常状况下,氢气是没有颜色、没有气味的气体。
盛满氢气的集气瓶瓶口应朝下放置,这是因为氢气比空气轻。
标准状况下,氢气的密度为0.0899g/L,是所有气体中密度最小的。
在压强为1.01×105Pa时,无色液态氢的沸点为-252.80℃(20.2K),雪状固态氢的熔点为-259.14℃(13.86K)。
氢气难溶于水。
标准状况下,1L水中仅能溶解20mL的氢气。
氢气的物理性质之二:氢气在通常条件下为无色、无臭、无味气体;气体分子由双原子组成;熔点-259.14℃,沸点-252.8℃,临界温度33.19K,临界压力12.98大气压,气体密度0.0899g/L;水中溶解度21.4cm3/1000g水(0℃),稍溶于有机溶剂。
氢气的物理性质之三:通常情况下,氢气是一种无色、无臭、无味的气体,熔点-259.14℃,沸点-252.8℃。
在标准状况下(0℃,大气压强为1.013×105),气体的密度为0.0899g/L,跟同体积的空气相比,约为空气质量的1/14,是最轻的气体。
难溶于水,0℃、氢气压强为1.013×105Pa时,1体积水中能溶解0.0214体积的氢气。
在大气压强为1.013×105Pa,温度为-252.8℃时,氢气液化为无色液体。
在-259.14℃,能变为雪状固体。
液态氢通常称为“液氢”,有超导性质。
氢气的化学性质之一 :在常温下,氢气的化学性质是稳定的。
在点燃或加热的条件下,氢气很容易和多种物质发生化学反应。
纯净的氢气在点燃时,可安静燃烧,发出淡蓝色火焰,放出热量,有水生成。
若在火焰上罩一干冷的烧杯,可以烧杯壁上见到水珠。
2H2+O22H2O把点燃氢气的导管伸入盛满氯气的集气瓶中,氢气继续燃烧,发出苍白色火焰,放出热量,生成无色有刺激性气味的气体。
该气体遇空气中的水蒸气呈雾状,溶于水得盐酸。
H2+Cl22HCl 在点燃氢气之前,一定要先检验氢气的纯度,因为不纯的氢气点燃时可能发生爆炸。
物质沸点与压力的关系

物质沸点与压力的关系
液体的沸点与外界施加于液体表面的压力有关,随着外界施加于液体表面的压力的降低,液体沸点下降。
沸点与压力的关系可近似地用下式表示:
lgP=A+B/T
式中P——液体表面的蒸气压;
T——溶液沸腾时的热力学温度;A,B——常数。
如果用lgP为纵坐标,1/T为横坐标,可近似得到一条直线。
从二元组分已知的压力和温度,可算出A和B的数值,再将所选择的压力代入上式,即可求出液体在这个压力下的沸点。
但实际上许多物质的沸点变化是由分子在液体中的缔合程度决定的。
有时在文献中查不到与减压蒸馏选择的压力相应的沸点。
因此,在实际操作中经常使用图3–8来估计某种化合物在某一压力下的沸点。
例如,一化合物常压时沸点200℃,欲减压至4.0KPa(30mmHg),它相应的沸点应是多少?我们可以先在图3–8中间的直线上找出其常压时的沸点200℃,然后将此点与右边直线上的30mmHg处的点连接成一直线,延长此直线与左边的直线相交,交点100℃即表示该物质在 4.0KPa(30mmHg)时的近似沸点。
利用此图也可以反过来估计常压下的沸点和减压时要求的压力。
(1mmHg=133.3Pa)。
氢(化学元素)详细资料大全

氢(化学元素)详细资料大全氢是一种化学元素,在元素周期表中位于第一位。
氢通常的单质形态是氢气。
它是无色无味无臭,极易燃烧的由双原子分子组成的气体,氢气是最轻的气体。
医学上用氢气来治疗疾病。
氢气的爆炸极限:4.0~74.2%(氢气的体积占混合气总体积比)。
基本介绍•中文名:氢•英文名:Hydrogen•别称:拉丁文名:Hydrogenium•分子量:1.00794•CAS登录号:1333-74-0•EINECS登录号:215-605-7•熔点:-259ºC•沸点:-253ºC•水溶性:0.00017G/100ML•密度:0.08342kg/m3,液体密度70.78kg/m3(-252.9℃,101.3kPa)•外观:无色、无臭、可燃气体。
它是已知的最轻气体。
•套用:用作合成氨、合成甲醇、合成盐酸的原料,冶金用还原剂等•安全性描述:S16/33:远离火源,采取防护措施防止静电发生。
•危险性符号:F+:很易燃物质•危险性描述:R12:极端易燃。
•危险品运输编号:UN1049/1966/2034/2600•顺序排位:第1个•化合价:-1、0、+1•元素符号:H历史发展,含量分布,物化属性,元素简介,基本属性,原子属性,具体性质,同位素,图表,氢气生物学效应,制取方法,工业制法,元素纯化,贮存方法,作用用途,工业生产,医学用途,天然气,太阳能,氢能,氢能简介,风力,生物燃油,煤矿,历史发展早在十六世纪,瑞士的一名医生就发现了氢气。
他说:“把铁屑投到硫酸里,就会产生气泡,像旋风一样腾空而起。
”他还发现这种气体可以燃烧。
然而他是一位著名的医生,病人很多,没有时间去做进一步的研究。
十七世纪时又有一位医生发现了氢气。
但那时人们认为不管什么气体都不能单独存在,既不能收集,也不能进行测量。
这位医生认为氢气与空气没有什么不同,很快就放弃了研究。
最先把氢气收集起来并进行认真研究的是在1766年英国的一位化学家卡文迪什。
液态氢 比重

液态氢比重全文共四篇示例,供读者参考第一篇示例:液态氢是目前研究领域中备受关注的一个新兴领域,其比重是指其相对于空气的密度比值。
液态氢是氢气冷却到超低温度下形成的液态状态,在常温下非常稀薄,因此具有非常低的密度,比重也相对较小。
接下来我们将深入探讨液态氢的比重以及与其他物质的对比。
让我们来了解一下液态氢的密度和比重。
液态氢的密度大约为0.07克/厘米³,而在常温下的氢气的密度为0.09克/厘米³。
液态氢的比重约为0.07/1.21=0.057,即它的密度是空气的大约1/20。
这意味着液态氢比空气轻,有很强的浮力。
在实际应用中,液态氢可以被用作轻型气体,例如在气球中用作气体,因为它比空气轻,可以提供浮力。
液态氢的比重还对于氢气的储存和运输有着重要的意义。
由于氢气的密度很低,需要将其压缩或液化才能有效地保存和运输。
在液态氢的制备过程中,需要将氢气冷却到极低的温度(-253°C)才能形成液态氢。
液态氢的比重直接影响了氢气的储存和运输效率。
液态氢的比重还对于其在能源应用中的效率有着重要的影响。
目前,液态氢被广泛研究用于燃料电池技术中,通过将氢气经过燃料电池反应产生电能。
由于液态氢比重较小,可以提供更高的能量密度和储存效率,从而推动燃料电池技术的发展。
液态氢的比重是一个非常重要的物理性质,对于其在航空航天、能源应用和氢能源产业中有着重要的影响。
通过深入理解液态氢的比重,可以更好地发掘其在各个领域的潜力,推动液态氢技术的发展和创新。
希望未来液态氢比重的研究能够为相关领域的发展提供更多的启示和帮助。
第二篇示例:液态氢是一种非常有趣的物质,具有许多独特的性质和应用。
其中一个重要的特性就是液态氢的比重,也就是它的密度。
在本文中,我们将深入探讨液态氢的比重以及与之相关的各种知识。
让我们来介绍一下液态氢的基本信息。
液态氢是氢气在极低温下(-252.87°C)的形态,其温度远低于氢气的气化点。
液态氢 比重

液态氢比重全文共四篇示例,供读者参考第一篇示例:液态氢是一种非常特殊且有趣的物质,它是氢气在极低温度下凝结而成的液体形式。
液态氢不仅具有许多独特的物理性质,而且在科学研究和工业应用中都具有重要的作用。
其中一个重要的物理性质就是液态氢的比重。
液态氢的比重是指其密度与空气密度的比值,通常用于描述液态氢在各种环境下的重量与体积的关系。
液态氢的比重通常是以空气为标准单位,即液态氢的比重等于1时表示其密度与空气密度相等,而比重大于1时表示其密度大于空气密度,反之则小于空气密度。
液态氢的比重受到温度和压力等因素的影响,一般来说,液态氢在常温下的比重约为0.07,这意味着其密度只有空气的约1/14,因此液态氢比空气轻很多,非常容易飘向空中。
当液态氢被冷却到极低温度时,比重会随着密度的增加而增加,从而使其在空气中的比重变大,变得更加稠密。
由于液态氢的比重非常小,因此在科学研究和工业应用中常常用作轻型气体的替代品,例如用作火箭推进剂、气球的充填气体等。
由于液态氢的比重较小,其能够很容易地通过管道输送和储存,提高了其在工业生产中的应用效率和便利性。
液态氢的比重是一个非常重要的物理性质,它影响了液态氢在各种环境和应用中的表现和性能。
通过对液态氢的比重进行研究和了解,我们可以更好地利用液态氢这种特殊物质,为科学研究和工业生产提供更多可能性和机遇。
希望未来能够进一步加深对液态氢比重的研究,推动液态氢在各个领域的应用和发展。
【液态氢比重】。
第二篇示例:液态氢是一种在极低温下冷凝成液态的氢气,它的比重是相对于空气而言的。
液态氢是一种非常珍贵的资源,通常用于航天飞行器的推进剂和实验室的实验研究。
在自然界中,液态氢并不常见,因为氢气在常温下是气态的,只有在极低温度下才能凝结成液态。
本文将着重介绍液态氢的比重及其相关知识。
液态氢的比重是指其密度相对于空气的比值。
在常温下,氢气的密度比空气小,因此液态氢的比重也比空气小,通常为0.071。
氢气的物理性质

氢气的物理性质在通常情况下,氢气是一种无色、无臭、无味的气体,熔点-259.14℃,沸点-252.8℃。
在标准状况下(0℃,大气压强为1.013×105),气体的密度为0.0899g/L,跟同体积的空气相比,约为空气质量的1/14,是最轻的气体。
难溶于水,0℃、氢气压强为1.013×105Pa时,1体积水中能溶解0.0214体积的氢气。
在大气压强为1.013×105Pa,温度为-252.8℃时,氢气液化为无色液体。
在-259.14℃,能变为雪状固体。
液态氢通常称为“液氢”,有超导性质。
氢气的化学性质1.稳定性:氢气在常温下化学性质稳定,不易与其他物质反应.2.氢气的可燃性:注意使用氢气时要注意安全,点燃氢气前,一定要检验氢气纯度.检验的方法:用小试管收集一管氢气,用拇指堵住试管口,试管口向下移近酒精灯火焰,松开拇指点火,如果听到尖锐的爆鸣声,就说明氢气不纯.如果听到很小声音,说明氢气已经纯净.反应现象不仅取决于反应物的性质,还取决于反应条件、反应物浓度、与反应物接触面积等多方面因素,所以现象和后果可能不同.氢气的爆炸极限是在空气中含有氢气的体积占总体积的4%~74.2%,只有在这个范围内点火,才会发生爆炸,否则就不会爆炸.3.氢气的还原性氢的物理性质:1、氢是一种无色、无嗅、无味的气体,在标准状态下,(温度为0℃,压力为101.325kPa),密度是0.08987g/L,是空气的2/29。
2、氢的分子运动速度最快,故具有最大的扩散度和很高的导热性,其导热能力是空气的七倍。
3、氢的沸点为-252.78℃,熔点为-259.24℃。
4、液态氢是无色透明的液体,比重是0.070g/cm³(-252℃),固态氢是雪状固体,比重是0.0807g/cm³(-262℃)。
氢的化学性质:1、氢气的燃点较高,为574℃,但其着火能很小,所以很容易着火,在微小的静电火花下也容易着火。
沪科版《第十一章_从水之旅谈起》知识点

初三第十一章从水之旅谈起第一节科学探究--熔点与沸点1、水存在三种状态:固态(冰),液态(水),气态(水蒸气)。
水的三态之间在一定条件下可以相互转化。
2、自然界的水循环:太阳照射地面时地面温度升高,含有水蒸气的热空气快速上升。
在上升中,水蒸气凝结成小水滴或小冰晶,形成云。
当云层中的小水滴合并成大水滴时,雨便产生了。
假如上空的温度较低,水还能与雪或冰雹的形式降到地面。
3、晶体与非晶体:晶体内部的原子核按一定规律排列,有确定的熔点;非晶体内部原子的排列无规则,没有熔点。
4、熔点和沸点:晶体开始熔化时的温度称为熔点;液体沸腾时的温度称为沸点。
冰,钻石,铜,水晶等都属于晶体,有确定的熔点;玻璃,塑料等属于非晶体,没有熔点。
5、熔化和汽化:物质从固态变液态的过程称为熔化;物质从液态变为气态的过程称为汽化。
汽化有2中方式:沸腾和蒸发。
6、沸腾和蒸发的区别:沸腾是要达到沸点才能发生的,而蒸发式任何时候都在发生的;沸腾是在内部和外部的同时发生的剧烈活动,而蒸发只是物质表面发生的情况。
影响液体蒸发快慢的因素:(1)液体温度;(2)液体表面积;(3)液面上方空气流动快慢。
注意:一:这边说晶体是有确定的熔点,而不是说有固定的熔点。
这是因为在不同的条件下,晶体的熔点是不一样的。
比如由于杂质的存在或外界压强的变化都会引起熔点的变化。
如:在烧杯中的冰块上放些盐并搅动,这时冰的熔点低于0摄氏度,北方下大雪的时候为了清理冰冻的路面时候就是用的这种方法。
二:物质的沸点在不同的条件下也会变化,外界压强不同,沸点不同。
如:在海拔高的地方气压低,则水的沸点低,不易煮熟食物,所以去海拔高的地方带的都是干粮。
三:在一个标准大气压的前提下,冰的熔点是0摄氏度,水的沸点是100摄氏度。
顺便记忆酒精的沸点是78摄氏度比水的低,煤油的沸点是150摄氏度比水的高。
四:晶体在熔化时是三态共存的,固态,液态,固液共存态。
晶体熔化时的温度是保持在熔点的,不可能高于或者低于熔点,特别注意熔化时还要持续加热。
水的沸点计算

水的沸点计算
水的沸点是指水在常压下从液态变为气态所需要的温度。
具体来说,水的沸点约为100℃。
然而,实际上水的沸点会受到多种因素的影响,如大气压力、盐度、溶质浓度等。
在高海拔地区,由于大气压力较低,水的沸点会降低,因此在烹饪时需要相应地延长烹饪时间。
同时,加入盐或其他溶质也会使水的沸点升高或降低,这也会对烹饪产生影响。
计算水的沸点可以采用公式:沸点=100+0.01*压强差,其中压强差指的是相对于标准大气压的差值。
例如,在海拔2000米的地方,大气压力约为70%的标准大气压,那么水的沸点就会降低约20℃,变为约80℃左右。
因此,要计算水的沸点需要考虑多种因素,并采用相应的公式进行计算。
这对于烹饪和化学实验等领域都有一定的重要性。
- 1 -。
液氢(LH2)技术的简单科普

液氨(1H2)技术的简单科普典型的氢气液化过程分为四个部分:常温压缩、环境温度预冷至80k 、80〜30k 的低温制冷、和由压力降低到环境压力而产生的液化。
液化系统中的H2温度应降低到沸点温度(20用。
图1描绘了克劳德(QaUde )单一过程中不同温度下的H2液化循环示意图。
图1:克劳德(C1aUde )单一过程中不同温度下的氢气液化系统示意图。
通过焦耳・汤姆逊。
・T )阀,通过膨胀器,并使用外部辅助流体,当焰不变时,气体的压强减小时,可以降低在J ・T 系统中的温度。
节流阀排出气体的温度差取决于JT 系数。
该系数(PjT=(δT∕δP )h )表示恒定焰过程中温度变化到气压变化的过程。
如果初始气体温度低于最高转化温度(μjτ=θ),则由于窒息过程导致温度下降。
除氮、H2和Ne 外,其他气体的峰值转化温度均高于环境温度。
因此,为了使用JT 工艺降低H2温度,必须首先将其温度冷却到低于H2转化温度(205K ),因此,仅使用JT 工艺不能在环境温度下液化H2气体,必须进行预冷过程,下图2显示了几种不同气体及其反转点的J-T 图。
Ortho-H?toPara-H j(Nota1waysrequired)W%P∙t∙∙H? HydrogenF∙∙dCompressionPre*coo 1ing99.99%H 2 to2-βMPa to80K CryogenicC oo1ingto<30K Expansion to20-30KSeparationandQJgMPaInversioncurveμ<0(heating)N.Uppertewmiofi NitrogenX. temperature200* M^r**x **^ ∖1owerinversion 于) temperatureHydrogen OhIiII 0 200 400Pressure (atm ) .?受断见图2∙几种不同气体的焦耳-汤姆逊图及其反转点。
液态氢的温度

液态氢的温度液态氢是一种非常特殊的物质,它的温度是非常低的。
液态氢的温度是多少呢?我们来一起探讨一下。
一、液态氢的温度液态氢的温度非常低,它的沸点是-252.87℃,也就是说,只有在这个温度以下,氢气才能变成液态。
而液态氢的凝固点则更低,只有-259.2℃。
这个温度对于我们来说是非常难以想象的,因为我们生活在一个温暖的环境中,很难想象有这么低的温度存在。
二、液态氢的应用液态氢虽然温度非常低,但是它却有着广泛的应用。
首先,液态氢是一种非常好的燃料,它可以被用作火箭的燃料。
因为液态氢的分子量非常小,所以它的推进力非常大,可以让火箭飞得更高更远。
此外,液态氢还可以被用作制冷剂,因为它的温度非常低,可以将其他物质冷却到非常低的温度。
液态氢还可以被用作氢能源的储存介质,因为它的密度非常小,可以将氢气储存得更加紧凑。
三、液态氢的制备液态氢的制备非常困难,需要采用一些特殊的方法。
首先,需要将氢气压缩到非常高的压力,然后将其冷却到非常低的温度,才能将其变成液态。
这个过程需要非常高的技术水平和设备,因此液态氢的制备成本非常高。
四、液态氢的安全性液态氢虽然有着广泛的应用,但是它的安全性也是一个非常重要的问题。
液态氢非常易燃,一旦泄漏,就会引起爆炸。
因此,在液态氢的使用过程中,需要采取一系列的安全措施,以确保人们的安全。
总之,液态氢的温度虽然非常低,但是它却有着广泛的应用。
液态氢的制备非常困难,但是它的推进力和制冷效果都非常好,因此在航天、制冷和氢能源等领域都有着广泛的应用。
在使用液态氢的过程中,我们需要注意安全问题,以确保人们的生命财产安全。
沸点字母表示

沸点字母表示
沸点字母表示是指通过字母的排列顺序来表示物质的沸点。
在化学中,每个元素都有自己的原子序数,这个原子序数可以表示元素中原子的数量。
而元素的沸点则受到多种因素影响,比如压力、温度等等。
因此,为了方便表示元素的沸点,化学家们便想到了使用字母顺序的方法。
在这个方法中,化学家们将元素的沸点按照字典序排列,然后将字典序靠前的元素的首字母放在前面,紧接着是字典序稍大的元素的首字母,以此类推。
例如,氢的沸点是-252.87℃,而氟的沸点是
-188.1℃,因此,氢的沸点字母表示为“Hf”,而氟的沸点字母表示为“Fh”。
沸点字母表示法的好处是可以方便地对元素进行排序和比较。
同时,这个方法也能够让人们更加容易地理解元素之间的关系,因为字母的排列顺序可以反映出元素之间的相对大小或者相似程度。
不过,这个方法并不是所有人都能够轻松掌握的,因为它需要对元素的沸点和字典序有一定的了解才能使用。
- 1 -。
同位素气体之间的沸点变化 -回复

同位素气体之间的沸点变化-回复同位素气体是由同一种元素的不同同位素组成的气体。
同位素是指元素的原子核中的质子数不变,但中子数不同的一类原子核。
同位素气体在物理和化学性质上与其它气体类似,但由于同位素的质量不同,因此它们的沸点也会有所不同。
在讨论同位素气体的沸点变化之前,我们首先需要了解沸点的概念。
沸点是指物质在一定气压下从液态到气态的转变温度。
通常情况下,同位素气体的沸点和其对应的元素气体的沸点是有关系的。
下面我们以氢同位素气体为例,一步一步来回答同位素气体之间的沸点变化。
首先我们需要了解氢的同位素。
氢有两个稳定同位素,分别是氢-1和氘氢。
氢-1的原子核只有一个质子和一个电子,不含中子,是一种非常稳定的同位素。
而氘氢则含有一个质子、一个电子和一个中子,比氢-1重一倍。
由于氢-1和氘氢的质量不同,因此它们的沸点也会有所不同。
下面我们来比较氢-1和氘氢的沸点。
一般情况下,同一种元素的同位素之间的沸点差异较小,主要是由于同位素的质量差异引起的。
在氢同位素中,氘氢的质量比氢-1重一倍,因此根据动能定理和能量守恒定律,氘氢的气体分子在相同温度下具有更高的平均动能和更大的平均速率。
这使得氘氢气体比氢-1气体更容易脱离液态进入气态,因此氘氢的沸点要高于氢-1。
实际上,氘氢的沸点约为20.3K(-252.8),而氢-1的沸点约为20.27K (-252.88)。
我们可以看到,尽管氘氢的沸点相对于氢-1有所增加,但差异非常小,只有0.03K(0.08)。
这是因为氘氢和氢-1之间的核电荷和电子云结构几乎相同,所以它们之间的化学性质和沸点差异非常小。
除氢同位素外,其他元素的同位素也存在沸点差异。
例如,氮气的同位素有氮-14和氮-15。
氮-15相对于氮-14更重,因此氮-15的沸点要高于氮-14。
实际上,氮-14的沸点约为77K(-196),而氮-15的沸点约为76K (-197)。
尽管氮-15的沸点相对于氮-14有所减小,但差异也非常小,只有1K(1)。
元素漫谈(一)氢

元素漫谈(一)氢氢,原子序数1,宇宙中最丰富的元素。
氢有7种同位素,最常见的同位素不携带中子,只有一个质子。
氢是结构上最简单的原子,大部分量子力学的教科书中都有关于氢原子的介绍,因为它的薛定谔方程可以严格求解。
碳水化合物含有氢,所以氢在我们的日常生活中无处不在。
氢与氧、氮等元素可以形成氢键,它与离子性结合和共价键不同。
离子性结合形成的离子晶体中,结合的单位为失去电子或者获得电子的原子(正、负离子)而不是原子本身;正负离子相间排列,靠库伦作用构成固体。
共价键中,两个原子共享一对电子,这两个电子的波函数交叠。
而氢键中,既有库伦作用力,又有部分共价键的作用。
氢键不仅能在分子内形成,还能在分子间形成。
例如,水分子间的主要结合力就是氢键。
氢键的结构灵活,键长键角都是可以变化的,如果具备氢键形成的条件,固液气中都会尽可能多地形成氢键。
尽管氢原子本身量子力学可解、氢键的概念已被提出了超过100年,如今关于理解氢键的科研工作还在继续。
两个氢可以组成双原子分子H2,它室温下以气态形式存在,因此称为氢气。
氢分子由共价键组成,共价键的现代理论开始于对氢分子的量子力学研究。
氢气是一种清洁能源,它与氧气结合可以放出大量热量。
同等质量下,氢气燃烧放出的热量是煤炭的四倍以上,并且它的反应产物是水,对环境无害。
氢气可以来自天然气的裂解或者直接由水的电解产生。
如何高效利用太阳能和催化剂将水分解为氢气和氧气是一个重要的前沿研究课题。
同等质量的氢比煤炭燃烧时放出的能量多,可是常温时氢是气体,同等体积下的氢气存储能量的能力远低于碳,另外,氢气在空气中可能爆炸,所以如何安全高效地存储氢气也是一个重要的问题。
高效存储的方法之一是利用能吸附氢气的材料,称为储氢材料。
早期的储氢材料能存氢到大气中氢气密度的千倍,现在储氢材料的种类越来越多,实用存储效率也越来越高。
美国能源部关于储氢电池的一个目标是,在空间、价格、安全等方面能与现有市场竞争的情况下,单次存储能量满足500公里以上的汽车行驶需要。
液氢沸点来历的计算

液氢沸点来历的计算作者:田江南来源:《读与写·教育教学版》2011年第08期摘要:本文中,笔者对氢元素由液态转为气态的临界状态的物理机制进行了分析,计算出了液氢沸点,并指出,液氢状态时原子之间是由磁场力吸引在一起。
关键词:原子结团玻尔模型磁场势能液氢原子分离右边原子中图分类号:0571.51 文献标识码: C 文章编号:1672-1578(2011)08-0199-011 初步分析笔者实验测得,氢元素的沸点是零下252.77度,转化成热力学温度,是:T=20.36开(1)对于这个数据,它的来历是怎么回事,或者说为什么氢的沸点是这么多,我们可由微观结构和运动算出来。
以下,我们就推导这一过程。
从逻辑上推断,氢原子呈电中性,而液氢原子是聚合在一起的,因而,液氢原子之间不可能靠电场力而吸引。
但是,液氢原子之间是有磁场力的,它们可由磁场力结合。
因为根据玻尔氢原子模型,电子在绕核运动,其存在电流I,且I=e/t。
其中e 是元电量,t 是周期。
这个电流要产生磁场,因而两氢原子之间会发生磁力作用。
我们又知道,两块磁铁靠近作用,总会转到吸引状态,且是最大吸引状态,因此,两氢原子也一样,它们的磁作用总是相互吸引的。
又液态时原子是紧挨在一起的,而气态时原子是分离的。
因此,氢由液态转为气态,就可看成在外加能量的情况下,克服磁引力势能做功,原子由吸引而分离的过程。
这一过程的能量是多少,我们可以计算。
2 计算过程首先,两氢原子紧挨在一起时,其磁场势能是E,有E=■·■这里,?滋0是真空磁导率,?咨是电流长度,r为氢原子半径。
由于两氢原子靠在一起,又两氢原子半径一样大,因此,这里距离取2r。
此式运用了微积分的结论。
当然,这里仍把氢原子看作球体,I?咨相当于电荷,?滋0替换了真空介电常数ε0,因此,此式表达式类似于点电荷电势能公式。
又由于?咨=2?仔r,I=e/t,故I?咨=ev,v为氢原子基态平均轨道速度。
氢气性质

(液体,平衡态,-252.8℃):0.040mPa·s
表面张力(平衡态,-252.8℃):3.72mN/m
导热系数(气体101.325kPa,0℃):0.1289w/(m·K)
(液体,-252.8℃):1264W/(m·K)
折射系数nv(101.325kPa,25℃):1.0001265
氢气性质
沸点:-252.77℃(20.38K)
熔点:-259.2℃
相对分子质量:2.016
液体密度(平衡状态,-252.8℃):169kg/m3
气体密度(101.325kPa,0℃):0.0899kg/m3
热值:1.4*10^8J/kg
空气中的燃烧界限:5%~75%(体积)
生产方法:电解水(2H2O=通电=2H2↑+O2↑分解反应)、裂解、煤制气等
58.48
13968
56.49
13493
硫化氢
25.35
6054
23.37
5581
LPG
92.1-121.4
煤气
16.72
天然气LNG
38.5
氢气热值:
名称
高热值
低热值
(MJ/Nm3)
(Kcal/Nm3)
(MJ/Kg)
(Kcal/Kg)
(MJ/Nm3)
(Kcal/Nm3)
(MJ/Kg)
(Kcal/Kg)
氢气
12.74
3044
143
34160
10.79
2576
120
28667
燃气热值表:
名称
高热值
低热值
(MJ/Nm3)
液体沸点与海拔高度关系式的推导
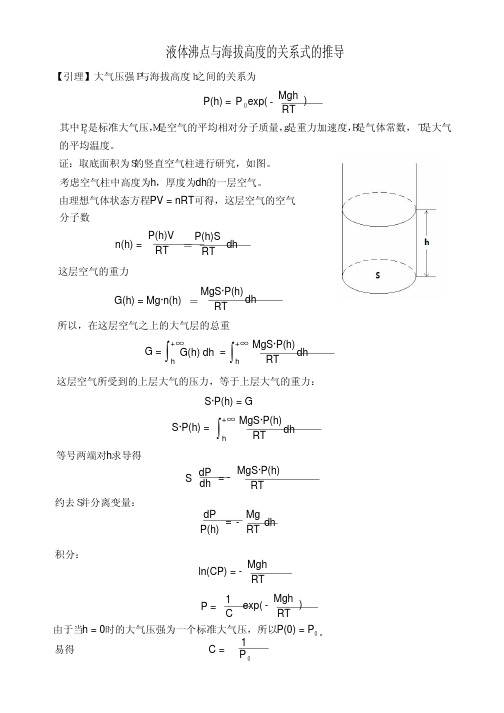
液体沸点与海拔高度的关系式的推导【引理】大气压强P与海拔高度h之间的关系为其中P0是标准大气压,M是空气的平均相对分子质量,g是重力加速度,R是气体常数,T是大气的平均温度。
证:取底面积为S的竖直空气柱进行研究,如图。
考虑空气柱中高度为h ,厚度为dh 的一层空气。
由理想气体状态方程PV = nRT 可得,这层空气的空气分子数n(h) = P(h)V RT -=P(h)S RT-dh 这层空气的重力G(h) = Mg·n(h)=MgS·P(h)RT-dh 所以,在这层空气之上的大气层的总重G = ∫h +∞G(h) dh =∫h +∞MgS·P(h)RT-dh 这层空气所受到的上层大气的压力,等于上层大气的重力:S·P(h) = GS·P(h) =∫h +∞MgS·P(h)RT-dh 等号两端对h 求导得S dP dh -= -MgS·P(h)RT-约去S并分离变量:P(h)-dP Mg RT--dh =积分:ln(CP) = -Mgh RT-P = 1C-exp(Mgh RT --)由于当h = 0时的大气压强为一个标准大气压,所以P(0) = P 。
0C = 易得P 0-1 exp(Mgh RT--)P 0P(h) =所以大气压强与海拔高度的关系为exp(Mgh RT--)P 0P(h) = 引理证毕下面推导液体沸点与海拔高度的关系式根据Clausius-Clapeyron 方程式,液体的饱和蒸汽压与温度T 之间的关系为ln P`P - = △vap H m θ-R()T`-1T -1-其中△vap H m θ是液体的摩尔蒸发潜热。
若令T`等于液体在一个标准大气压P 下的沸点 T ,则有θ0ln P P - = △vap H m θ-R()T -1T -1-θ0P = P 0exp []△vap H m θ-R ()T -1T -1-θ当液体的饱和蒸汽压等于海拔h处的大气压时,液体就会沸腾。
水的沸点计算

水的沸点计算
水的沸点是指水从液态状态转变成气态状态所需的温度。
水的沸点是受环境条件的影响的,包括环境压强和水的纯度等因素。
在标准大气压(约为101.325千帕)下,水的沸点为100摄氏度。
但如果环境压强低于标准大气压,水的沸点将会降低,反之亦然。
例如,在高海拔山区,水的沸点通常会降低。
此外,水的纯度也会影响水的沸点。
纯度较高的水,其沸点会比纯度较低的水高一些。
计算水的沸点需要考虑环境压强和水的纯度等因素。
通过基本物理公式,可以通过环境压强和水的纯度计算出水的沸点。
在实际应用中,可以使用水的沸点表或者计算机模拟软件辅助计算水的沸点。
水的沸点是一项重要的物理参数,它不仅在科学实验和工业生产中有广泛的应用,也在日常生活中扮演着不可替代的角色。
了解水的沸点的计算方法,有助于更好地理解和应用这一物理参数。
- 1 -。
液氢管道直径

液氢管道直径液氢管道直径是指液氢输送管道的横截面直径,它是液氢输送系统中一个重要的参数。
液氢是一种常见的燃料,具有高能量密度和零污染的特点,在航天、航空和能源等领域有广泛的应用。
液氢管道直径的选择对于液氢输送系统的安全可靠运行至关重要。
液氢管道直径的选择需要考虑多个因素。
首先,液氢的低温特性需要在管道设计中得到充分考虑。
液氢的沸点为-253℃,处于低温状态下,因此管道材料需要具备良好的低温性能,以确保管道不会因温度变化而受到损坏。
其次,液氢的高能量密度要求管道具备足够的强度和耐压能力,以承受液氢在管道内部的高压力。
此外,液氢管道还需要具备良好的密封性能,以防止液氢泄漏。
液氢管道直径的选择也受到输送量和输送距离的影响。
一般来说,输送量越大,管道直径就需要越大,以满足液氢的流量要求。
此外,输送距离的远近也会对管道直径的选择产生影响。
较长的输送距离可能需要更大直径的管道,以减小液氢在输送过程中的压力损失。
除了上述因素,液氢管道直径的选择还需要考虑输送系统的安全性和经济性。
管道直径过大会增加建设和维护成本,而管道直径过小则可能导致液氢输送效率低下或者安全隐患。
因此,需要在安全和经济之间寻找平衡点,选择合适的管道直径。
在实际应用中,液氢管道直径的选择通常需要进行详细的工程计算和分析。
液氢输送系统的设计工程师需要考虑到各种因素的综合影响,以确定最佳的管道直径。
他们通常会借助计算软件和模拟工具来进行管道直径的优化设计,以确保液氢输送系统的安全可靠运行。
液氢管道直径是液氢输送系统中一个重要的参数,它的选择需要考虑液氢的低温特性、高能量密度、输送量、输送距离以及安全和经济等多个因素。
通过合理选择管道直径,可以保证液氢输送系统的安全可靠运行,满足液氢在航天、航空和能源等领域的广泛应用需求。
h2o、h2s、h2se、h2te 及 hf、hcl、hbr、hi 的熔沸点顺序。

h2o、h2s、h2se、h2te 及hf、hcl、hbr、hi 的熔沸点顺序。
首先,我们需要了解这些物质的结构和性质。
H₂O、H₂S、H₂Se、H₂Te:这些都是氢化物,其熔沸点主要取决于它们分子间的相互作用力。
由于水分子间存在氢键,其熔点较高,约为0°C。
硫化氢和硒化氢的分子间作用力较弱,熔点较低,分别为-89°C和-41°C。
而碲化氢的熔点是三者中最低的,约为-203°C。
HF、HCl、HBr、HI:这些都是氢卤酸,其熔沸点主要取决于它们分子间的范德华力。
范德华力的大小与分子间的距离有关,距离越近,范德华力越大。
因此,随着原子序数的增加,分子间的距离逐渐减小,范德华力增大,熔沸点也随之升高。
所以熔沸点顺序为:HF < HCl < HBr < HI。
综合以上分析,我们可以得出以下熔沸点顺序:
H₂O(由于氢键的存在,熔沸点最高)、H₂Se、H₂Te、H₂S、HF、HCl、HBr、HI、。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
液氢沸点来历的计算
摘要:本文中,笔者对氢元素由液态转为气态的临界状态的物理机制进行了分析,计算出了液氢沸点,并指出,液氢状态时原子之间是由磁场力吸引在一起。
关键词:原子结团玻尔模型磁场势能液氢原子分离右边原子
中图分类号:0571.51 文献标识码: c 文章编号:1672-1578(2011)08-0199-01
1 初步分析
笔者实验测得,氢元素的沸点是零下252.77度,转化成热力学温度,是:
t=20.36开(1)
对于这个数据,它的来历是怎么回事,或者说为什么氢的沸点是这么多,我们可由微观结构和运动算出来。
以下,我们就推导这一过程。
从逻辑上推断,氢原子呈电中性,而液氢原子是聚合在一起的,因而,液氢原子之间不可能靠电场力而吸引。
但是,液氢原子之间是有磁场力的,它们可由磁场力结合。
因为根据玻尔氢原子模型,电子在绕核运动,其存在电流i,且i=e/t。
其中e 是元电量,t是周期。
这个电流要产生磁场,因而两氢原子之间会发生磁力作用。
我们又知道,两块磁铁靠近作用,总会转到吸引状态,且是最大吸引状态,因此,两氢原子也一样,
它们的磁作用总是相互吸引的。
又液态时原子是紧挨在一起的,而气态时原子是分离的。
因此,氢由液态转为气态,就可看成在外加能量的情况下,克服磁引力势能做功,原子由吸引而分离的过程。
这一过程的能量是多少,我们可以计算。
2 计算过程
首先,两氢原子紧挨在一起时,其磁场势能是e,有
e=■·■
这里,?滋0是真空磁导率,?咨是电流长度,r为氢原子半径。
由于两氢原子靠在一起,又两氢原子半径一样大,因此,这里距离取2r。
此式运用了微积分的结论。
当然,这里仍把氢原子看作球体,i?咨相当于电荷,?滋0替换了真空介电常数ε0,因此,此式表达式类似于点电荷电势能公式。
又由于?咨=2?仔r,i=e/t,故i?咨=ev,v为氢原子基态平均轨道速度。
因而,此式可化为
e=■·■(2)
我们又知道,一左一右两氢原子紧靠在一起时,并不十分对称、平衡、稳定,还得有一上,一下,一前,一后的四个氢原子加进来,紧靠在一起,才能完全对称、稳定。
我们把这六个紧靠在一起的氢原子叫做氢原子结团,它可看成液氢的组成单元。
那么,结团中,某个氢原子要脱离这个结团中其它原子对它的磁引力束缚,跑到无穷远处去,需要能量,这个能量是多少?如右边的氢原子要跑到无穷远处,首先得克服左边氢原子对它吸引能e,
这个e我们可按(2)式计算。
同时,它也受到上、下、前、后的氢原子的引力,而且,上、下、前、后的氢原子对右边原子的引力势能是相等的(根据对称分析得出)。
那么,如上边氢原子对右边氢原子的磁引力势能e0是多少?根据几何知识和受力分解,我们可算出e0=ecos45°/2
这里,为什么要除以2,是因为上边原子中电子绕核运动平面要与右边原子中电子绕核运动平面垂直(上边原子电子运动平面要与下边原子电子运动平面平行,且电子运动同向,同相,读者可画图分析),因而两原子中电子运动有一半的时间平行,一半的时候垂直,对磁引力势的贡献只有一半,所以除以2。
那么,上、下、前、后对右边原子的引力势一样大,故右边氢原子脱离原子结团向右运动到无穷远处所需能量为e+4e0,即
e+4e0=■(1+4×cos45°/2)
把?滋0/4?仔=10-7,r=0.529×10-10,e=1.602×10-19,v=2.19×106,
cos45°=0.707代进去,得
e+4e0=■(1+4×0.707/2)
=2.80844×10-22j
把这个能量换算成热力学温度只需除以玻尔兹曼常数k,得■=
■=20.34 开
与前面实验值比较,理论值与它相符合,说明我们推导的正确性。
3 结语
以上推算也说明液态原子间结合靠磁场提供引力,但是,可能有人会问,氢原子结团以外的氢原子为何不对右边氢原子施加磁影响,为什么不计算结团以外的氢原子的磁场势,笔者的回答是:固体中原子和原子结团规则排列,对称而有序,就像晶体那样。
而液体有流动性,根据布朗运动,说明液体中原子结团是无序的、混乱的,因而其它原子结团对以上分析的某个原子结团的能量影响是对称的,它们进行了抵消,所以可不计算其它原子结团对右边氢原子的影响。
就像玻尔计算氢的电离能,不会考虑其它原子的影响一样。
总的来说,本文计算过程说得还不够详细,尤其没作图说明,希望读者谅解。
读者可仔细分析,便能了解这一过程。
