物理化学上册的答案_第五版高等教育出版社
傅献彩《物理化学》第五版课件及习题答案_10电解与极化作用
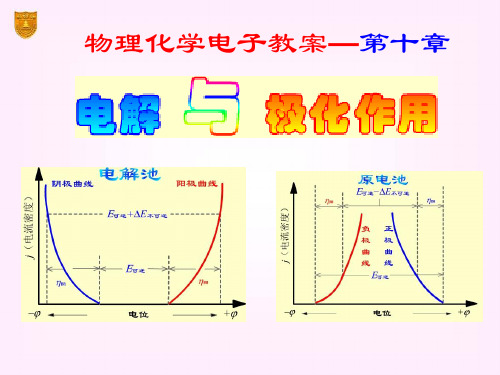
§10.2 极化作用
例如电解一定浓度的硝酸银溶液 阴极反应
Ag + (mAg+ ) e Ag(s)
可逆
电解时
RT 1 Ag |Ag ln F aAg+
阴
可逆 > 不可逆 阳极上有类似的情况,但 可逆 < 不可逆
动势达极大值 Eb,max。
电 流 I
3
再增加电压,使I 迅速增 加。将直线外延至I = 0 处, 得E(分解)值,这是使电解
2 1
池不断工作所必需外加的 最小电压,称为分解电压。
E分解
电压E
测定分解电压时的电流-电压曲线
实际分解电压
要使电解池顺利地进行连续反应,除了克服作
为原电池时的可逆电动势外,还要克服由于极化在
生消耗氧的还原反应:
O2 (g)+4H+ 4e 2H2O
(O2 |H2O,H+ )
RT 1 ln 4 4F aO2 aH +
1.229 V
设 aO2 1, aH+ 107 , 则 (O2 |H2O,H+ ) 0.816V
这时与 E(Fe2+ |Fe) (-0.617V)阳极组成原电池的电动 势为 1.433 V 显然耗氧腐蚀比析氢腐蚀严重得多。
所以铁很快腐蚀形成铁锈。
CO2 SO2
Fe2+
H 2或 H 2O
O2
O2
H
Cu
+
H2 O
Fe
2e-
H2 O
H+
Cu
电化学腐蚀示意图
《物理化学》第五版-(傅献彩主编)复习题答案(全)

第一章气体1.两种不同的理想气体,如果它们的平均平动能相同,密度也相同,则它们的压力是否相同?为什么?答:由于两种气体均为理想气体,根据理想气体的状态方程式pV=nRT式中n是物质的量,p是压力,V是气体的体积,T是热力学温度,R是摩尔气体常数.又因为"=崙=聳式中川为气体的质量,M为气体分子的摩尔质量,p为气体的密岌pV^RT两边同除以V,则得p=常我们已知气体分子的平均动能是温度的函数,即Et=*hBT所以气体分子的平均平动能仅与温度有关.由题目中已知两种不同的理想气体,平均平动平动能相同,因此它们的温度相同,又因为它们的密度相同.则通过上式力=醫可知压力力仅与M有关.因此得出结论,两种不同的理想气体在它们具有相同的平均平动能,相同密度的条件下,它们的压力不同.压力与M成反比,M越大则p越小.2.在两个体积相等、密封、绝热的容器中,装有压力相等的某理想气体,试问这两个容器中温度是否相等?答:根据理想气体的状态方程式pV^nRT假设在第一个容器中某种理想气体符合向则在第二个容器中存在p2V2^mRT2. 又因为两容器的体积相等,装有的理想气体的压力也相等所以pif Vi=V2则得niRTi =厄夫丁2,两边同除以R则得n\ Ti —«2 T?若两容器中装有相同物质的量的该理想气体,则两个容器中温度相等;否则,两容器中温度不相等.3.Dalton分压定律能否用于实际气体?为什么?答:根据气体分子动理论所导出的基本方程式pV^mNu2式中P是N个分子与器壁碰撞后所产生的总效应,它具有统计平均的意义.平均压力是一个定值,是一个宏观可测的物理量.对于一定量的气体,当温度和体积一定时,它具有稳定的数值.因为通过气体分子动理论所导岀的Dalton分压定律学=直或%=心是摩尔分数)适用于实际气体,经得起实验的考验.4.在273 K时,有三种气体,H Z,O2和CQ,试判别哪种气体的根均方速率最大?哪种气体的最概然速率最小?答:根据:根均方程率"=弟呼或最概然速率Vm或可推知根均方速率、最概然速率与质量的平方根成反比因此,在相同温度273 K的条件下,M HJ= 2X10_3kg • mol-1 =32X10_3kg • mol-1 =44X10~3kg • mol-1H2的根均方速率最大;CO Z的最概然速率最小•5.最概然速率、根均方速度和数学平均速率,三者的大小关系如何?各有什么用处?答:在Maxwell速率分布曲线上有一最高点,该点表示具有这种速率的分子所占的分数最大,这个最高点所对应的速率称之为最概然速率(編或缶分子的数学平均速率(q)为所有分子速率的数学平均值根均方速率(Q是一个统计平均值,它与各个分子的速率有关,但又不等于任务单个分子的速率.三种速率之比在三者中,最概然速率最小,根均方速率最大,数学平均速率居中.6. 气体在重力场中分布的情况如何?用什么公式可以计算地球上某一高度的压力?这样的压力差能 否用来发电?答:在重力场中,气体分子受到两种互相相反的作用.无规则热运动将使气体分子均匀分布于它们所能达到的空间,而重力的作用则要使重的气体分子向下 聚集.由于这两种相反的作用,达到平衡时,气体分子在空间中并排均匀的分布,密度随高度的增加而减少•假定在。
物理化学第五版课后习题答案解析

第五章 化学平衡5-1.在某恒定的温度和压力下,取n 0﹦1mol 的A (g )进行如下化学反应:A (g )B (g )若0B μ﹦0A μ,试证明,当反应进度﹦0.5mol 时,系统的吉布斯函数G 值为最小,这时A ,B 间达到化学平衡。
解: 设反应进度为变量A (g )B (g )t ﹦0 n A , 0﹦n 0 0 0﹦0t ﹦t 平 n A n B﹦BBn ν n B ﹦B,n A ﹦n 0-n B ﹦n 0-B,n ﹦n A +n B ﹦n 0气体的组成为:y A ﹦A n n ﹦00B n n νξ-﹦01n ξ-,y B ﹦B nn﹦0n ξ各气体的分压为:p A ﹦py A ﹦0(1)p n ξ-,p B ﹦py B ﹦p n ξ各气体的化学势与的关系为:0000ln ln (1)A A AA p p RT RT p p n ξμμμ=+=+- 0000lnln B B B B p p RT RT p p n ξμμμ=+=+⋅ 由 G =n AA+n BB=(n A 0A μ+n B 0B μ)+00ln(1)A p n RT p n ξ-+00ln B p n RT p n ξ⋅ =[n 0-A μ+0B μ]+n 00lnpRT p +00()ln(1)n RT n ξξ--+0ln RT n ξξ 因为 0B μ﹦0A μ,则G =n 0(0A μ+0lnpRT p )+00()ln(1)n RT n ξξ--+0ln RT n ξξ ,0()ln T p G RT n ξξξ∂=∂- 20,20()()T p n RT Gn ξξξ∂=-∂-<0 令 ,()0T p Gξ∂=∂011n ξξξξ==-- ﹦0.5 此时系统的G 值最小。
5-2.已知四氧化二氮的分解反应 N 2O 4 (g) 2 NO 2(g )在298.15 K 时,0r m G ∆=4.75kJ ·mol -1。
第五版物理化学第三章习题答案

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载第五版物理化学第三章习题答案地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容第三章热力学第二定律3.1 卡诺热机在的高温热源和的低温热源间工作。
求(1)热机效率;(2)当向环境作功时,系统从高温热源吸收的热及向低温热源放出的热。
解:卡诺热机的效率为根据定义3.2 卡诺热机在的高温热源和的低温热源间工作,求:(1)热机效率;(2)当从高温热源吸热时,系统对环境作的功及向低温热源放出的热解:(1) 由卡诺循环的热机效率得出(2)3.3 卡诺热机在的高温热源和的低温热源间工作,求(1)热机效率;(2)当向低温热源放热时,系统从高温热源吸热及对环境所作的功。
解:(1)(2)3.4 试说明:在高温热源和低温热源间工作的不可逆热机与卡诺机联合操作时,若令卡诺热机得到的功等于不可逆热机作出的功-W。
假设不可逆热机的热机效率大于卡诺热机效率,其结果必然是有热量从低温热源流向高温热源,而违反势热力学第二定律的克劳修斯说法。
证:(反证法)设不可逆热机从高温热源吸热,向低温热源放热,对环境作功则逆向卡诺热机从环境得功从低温热源吸热向高温热源放热则若使逆向卡诺热机向高温热源放出的热不可逆热机从高温热源吸收的热相等,即总的结果是:得自单一低温热源的热,变成了环境作功,违背了热力学第二定律的开尔文说法,同样也就违背了克劳修斯说法。
3.5 高温热源温度,低温热源温度,今有120KJ的热直接从高温热源传给低温热源,求此过程。
解:将热源看作无限大,因此,传热过程对热源来说是可逆过程3.6 不同的热机中作于的高温热源及的低温热源之间。
求下列三种情况下,当热机从高温热源吸热时,两热源的总熵变。
《物理化学》高等教育出版(第五版)第八章

《物理化学》高等教育出版(第五版)第八章-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN第八章化学动力学(2)练习题一、判断题:1.碰撞理论成功处之一,是从微观上揭示了质量作用定律的本质。
2.确切地说:“温度升高,分子碰撞次数增大,反应速度也增大”。
3.过渡状态理论成功之处,只要知道活化络合物的结构,就可以计算出速率常数k。
4.选择一种催化剂,可以使Δr G m> 0的反应得以进行。
5.多相催化一般都在界面上进行。
6.光化学反应的初级阶段A + hv-→P的速率与反应物浓度无关。
7.酸碱催化的特征是反应中有酸或碱存在。
8.催化剂在反应前后所有性质都不改变。
9.按照光化当量定律,在整个光化学反应过程中,一个光子只能活化一个分子,因此只能使一个分子发生反应。
10.光化学反应可以使Δr G m> 0 的反应自发进行。
二、单选题:1.微观可逆性原则不适用的反应是:(A) H2 + I2 = 2HI ; (B) Cl· + Cl· = Cl2;(C) 蔗糖 + H2O = C6H12O6(果糖) + C6H12O6(葡萄糖) ;(D) CH3COOC2H5 + OH-=CH3COO-+ C2H5OH 。
2.双分子气相反应A + B = D,其阈能为40 kJ·mol-1,有效碰撞分数是6 × 10-4,该反应进行的温度是:(A) 649K ;(B) 921K ;(C) 268K ;(D) 1202K 。
3.双分子气相反应A + B = D,其阈能为50.0 kJ·mol-1,反应在400K时进行,该反应的活化焓≠∆mrH为:(A) 46.674 kJ·mol-1;(B) 48.337 kJ·mol-1;(C) 45.012 kJ·mol-1;(D) 43.349 kJ·mol-1。
第五版物理化学第一章习题答案

第一章气体的pVT关系1.1 物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.2 气柜内贮有121.6 kPa,27℃的氯乙烯(C2H3Cl)气体300 m3,若以每小时90 kg的流量输往使用车间,试问贮存的气体能用多少小时?解:假设气柜内所贮存的气体可全部送往使用车间。
1.3 0℃,101.325kPa的条件常称为气体的标准状况,试求甲烷在标准状况下的密度?解:将甲烷(M w=16g/mol)看成理想气体:PV=nRT , PV =mRT/ M w甲烷在标准状况下的密度为=m/V= PM w/RT=101.325⨯16/8.314⨯273.15(kg/m3)=0.714 kg/m31.4 一抽成真空的球形容器,质量为25.0000g充以4℃水之后,总质量为125.0000g。
若改充以25℃,13.33 kPa的某碳氢化合物气体,则总质量为25.0163g。
试估算该气体的摩尔质量。
水的密度1g·cm3计算。
解:球形容器的体积为V=(125-25)g/1 g.cm-3=100 cm3将某碳氢化合物看成理想气体:PV=nRT , PV =mRT/ M wM w= mRT/ PV=(25.0163-25.0000)⨯8.314⨯300.15/(13330⨯100⨯10-6)M w =30.51(g/mol)1.5 两个容积均为V 的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到 100℃,另一个球则维持 0℃,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.6 0℃时氯甲烷(CH 3Cl )气体的密度ρ随压力的变化如下。
试作p p-ρ图,用外推法求氯甲烷的相对分子质量。
1.7 今有20℃的乙烷-丁烷混合气体,充入一抽成真空的200 cm3容器中,直至压力达101.325 kPa,测得容器中混合气体的质量为0.3897 g。
《物理化学(第五版)》第九章复习题答案
复习题
8.有哪些求算标准电动势EΘ的方法?在公式E zF ln K 中,EΘ是否是电池反应达平衡时的电动势?KΘ是否是
zE F K exp RT
a
复习题
(8).醋酸的解离平衡常数。 电池:Pt|H2(pΘ)|HAc(mHAc),Ac-(mAc-),Cl-(aCl)|AgCl(s)|Ag(s) 净反应:AgCl(s)+H2(pΘ)→H+(aH+)+Cl-(aCl-) +Ag(s
1.可逆电极有哪些主要类型?每种类型试举一例,并写 出该电极的还原反应。对于气体电极和氧化还原电极 在书写电极表示式时应注意什么问题? 答:可逆电极有三种类型: (1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s) (2)金属难溶盐和金属难溶氧化物电极 如: Ag(s)|AgCl(s)|Cl-(m) AgCl(s)+ e- = Ag(s)+Cl-(m) (3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2) 对于气体电极和氧化还原电极,在书写时要标明电极 反应所依附的惰性金属。
RT a H aCl E E ln zF a 1 2 H2 E RT ln m zF m
复习题
(6)Ag2O(s)的标准摩尔生成焓ΔfHmΘ 和分解压。 电池:Ag(s)+Ag2O(s)|OH-(aOH-)|O2(pΘ )|Pt 净反应:Ag2O(s)→1/2O2(pΘ )+2Ag(s) E r H m zE F zFT T p
物理化学答案_上册_高教_第五版[1]
![物理化学答案_上册_高教_第五版[1]](https://img.taocdn.com/s3/m/756e882a453610661ed9f454.png)
A的 为系统,求经可逆膨胀到 解:过程图示如下
。 始态温度 时,系统的
,压力 及过程的
。 今以气体 B 。
将 A 和 B 共同看作系统,则该过程为绝热可逆过程。作以下假设( 1)固体 B 的体积不随温度变化;(2)对固体 B ,则
从而
对于气体 B
2.26 已知水(H2O, l)在 100 °C 的饱和蒸气压 尔蒸发焓 结成液体水时的
(2)气体 B 得到的功 (3)气体 A 的末态温度
。 。 。
(4)气体 A 从电热丝得到的热 解:过程图示如下
由于加热缓慢,B 可看作经历了一个绝热可逆过程,因此
功用热力学第一定律求解
气体 A 的末态温度可用理想气体状态方程直接求解,
将 A 与 B 的看作整体,W = 0,因此
2.25 在带活塞的绝热容器中有 4.25 mol 的某固态物质 A 及 5 mol 某单原子理想气体 B,物质
因此,
1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想 气体。
(1)
保持容器内温度恒定时抽去隔板,且隔板本 身的体积可忽略不计,试 求两种气体混合后的压力。 (2) 隔板抽取前后,H2 及 N2 的 摩尔体积是否相同? (3) 隔板抽取后,混合气体中 H2 及 N2 的 分压立之比以及它们的分体积各为若干? 解: (1)等温混合后
要确定
,只需对第二步应用绝热状态方程
,
对
双
原
子
气
体
因此
由于理想气体的 U 和 H 只是温度的函数,
整个过程由于第二步为绝热,计算热是方便的。而第一步为恒温可逆
2.24 求证在理想气体 p-V 图上任 一点处,绝热可逆线的斜率的绝对值大于恒温可逆线的绝 对值。
物理化学第五版(傅献彩)课后习题答案第十一章

第^一章化学动力学基础(一)1.298 K时NaJg)—Ma (g) + *O⅛Q,该分解反应的半衰期皿=5” 7 h・此值与N心G的起始浓度无关.试求,(1)该反应的速率常数*C2)N2(⅜Cg)转化掉90%所需的时间.解r(l>V^反应的半衰期与起始浓度无关二该反应为一级反应对于一级反应⑴严晋Λ⅛1=⅛?^-^-= O t1216 h^ΛIIf r I D I tn(2)对于一级反应t =⅛ln⅛⅛= 0.1216 h^, X bl I -90⅝= is* 94 IL2.某物质A分解反应为二级反应"当反应进行到A消耗了 1/3时,所需时间为2 rnim若继续反应掉同样这些ft的仏应需第怏时间?解:对于二级反应占=怂花当$=寺时加=2 min2_T—^■ = 8 HJin^=^/a-A∕ι = 8 min —2 min=6 InirL3.有反应A一P.实验测得是+级反应•试证明土证明:(1)⅛M v≡对上式作定积分当y=y时ci)ΓAjy≈-ΓAiιz≈—kdt得[A"2-[A严=*MZ=* {[AM_ (呼「2}=亨(血_1)凶評.⑵∙∙∙[AW-[A 严=*竝・・・尸∙∣([A UA严)4•在298 K时•用旋光仪测定蔗糖的转化速率•在不同时间所测得的旋光度α如下:z/min0102040801803008α,∕(°)6∙ 60 6.17 5. 79 5. 00 ∙ 3.71 1.40-0. 24 1. 98试求该反应的速率常数&值・解:蔗糖水解为一级反应•且届=^ln些二匹tα~α×>代入数据•列于下表中t/min0102040801803008 a,∕(°) 6. 60 6.175∙ 79 5.00 3.71 1.40-0. 24-1.98 "(10 TminT)— 5.142 4. 958 5.1605∙134 5.175 5. 318—取其平均值Λ = 5. 148×10^3min'12.5.在298 K时,测定乙酸乙酯皂化反应速率.反应开始时•溶液中酯与碱的浓度都为0. 01 mol・dm'3, 毎隔一定时间•用标准酸溶液滴定其中的碱含量•实验所得结果如下:t/min35710152125Γ()H^ ]∕(10^3 mol ∙7. 40 6. 34 5. 50 4.64 3. 63■ 2.88 2. 54dr∏τ)1证明该反应为二级反应•求出速率常数怡值;2若酯与碱的浓度都为0. 002 mol・dm'3,试计算该反应完成95%时所需的时间及该反应的半衰期.解:(】)若该反应是二级反应・以土对t作图应得一宜线,或根据二级反应速率公式的定积分式一一丄=怂仁计算出的虹是一常数.a~x a作图法:土与/值分别列于表中,以土对(作图(图略)得一直线(或依据数据用Origin作图)该直线的斜率为弟=11. 78 moΓ'・dm3∙ min^,计算法:⅛2 = y(-z--t a X a代入数据,计算结果列于表中可见上值为一常数,其平均值为11. 67 ≡r1∙ dm3∙ min-∖t/min 35710152125 [OH^]∕(10^3mol ・ dm^3)7. 40 6. 345∙ 504∙ 64 3. 63 2. 88 2. 54—/(moL1∙ dm3) a~Λ135.1157.7181.8215.5275.5347.2393.2Z∕(mol一:∙ dm3∙ min"1 )11. 7011.5411.6811.5511. 7011. 7711. 73(2)对于二级反应γ±y≈k2ta_ 1_ J y __ ___________________ 1 _ _ ___ XZ—kta∖~y 11. 67 mol~l∙ dm3∙ min^l×0. 002 mol ∙ dm~ 1一•"'2 一 1]. 67 mol^^,∙ dm3∙ min~1×0. 002 mol ∙ dm-3 " " min.6.含有相同物质的量的A,B溶液,等体积相混合,发生反应A+B—* C,在反应过1.0h后・A已消耗 T 75%;当反应时间为2. 0 h时,在下列情况下,A还有多少未反应?(1)当该反应对A为一级,对B为零级;(2)当对A,B均为一级;(3)当对A,B均为零级.解:(1)此时反应为一级反应lnγ^=⅛1f当y≈75 %时U=LOhM =⅛ ln⅛=1⅛×lnτ⅛ = 2 In2 0当t≈2. Oh时In 亠=2 In 2 h",×2.0 h1一,IP= 6. 25 %即A还有6. 25%未反应•(2)此时该反应为a≈b的二级反应≈k2ta当y≈75%时M=I∙0 h1 丿=1 乂 75% = 3 hIa l~y 1. 0 h×a 1 一75% a当t=2. Oh时τ-iL-= —h"1×2∙0 h×αIp al-y=14. 28%.(3)此时该反应为零级反应X-= kot 当H=75% d 时M=I.0 h ・•・屁=手=警£=0. 75 a h~,t 1.0 n .当¢=2.0 h时95%-^ = 814 min对于二级反应x=kot≈Q. 75 a h"1 X2. 0 h=l. 5 a吟也=一0・5表示A已反应完毕a设A刚好反应完时的时间为/L I=I• 33 KΛo 0. 75 a h7.298 K时,NaOH和CH3CCXrH3皂化作用的速率常数k2与NaOH和CH3COOC2H5皂化作用的速率常数矗的关系为弟=2. 8 k2.试计算在相同的实验条件下,当有90%的CH3COOCH3被分解时, CH3COOC2Fk的分解分数(设碱与酯的浓度均相等)•解:对于二级反应匸==怂加当 y=90% 时-⅛×⅛=⅛°; t=t'=2∙ 8 k2JL2. 8 •嚴° “解得 y'= 76. 27%.8.设有一W级反应(Λ≠1).若反应物的起始浓度为α,证明其半衰期表示式为(式中k为速率常ty2^(n→)a n^γk 证朋:守=-⅜r - ≈kdt α-* Rat 对上式作定积分K(⅛r =Jo^ 得怂=心上f -数): 2"7]2π"1-lk(n-l) (n~l)a n^1k99.对反应2NO(g)+2H2(g)-N2(g)+2H2O⑴进行了研究,起始时NO(g)与巴@)的物质的量相等•采用不同的起始压力R ,相应地有不同的半衰期•实验数据如下:A)/kPa50. 9045. 403& 4C33. 4626. 93b/2/min81102140180224试求该反应的级数.解:・・・加不同导致Gz不同・•・该反应不可能为一级反应,即n≠↑ 由〃级反应的半衰期公式1— 1l∏Zι∕2 = lnA÷ (I-Zt)Ina以IM/2对Ina作图•得一斜率为1-n的直线,求得n≈3. 或由InZ ι∕2 = InA+ (1 —zz)Iml∏Zι∕2 = InA÷(l-n)Ina Z代入各组数据求〃值用~3∙10.已知某反应速率方程可表示为厂=<AKB]吒Cp,请根霑下列实验数据•分别确定该反应对各反应物的级数α∕*的值和计算速率常数厂/(10一5mol ∙ dm 3∙s~1 )5.0 5.0 2.514. 1[A]o∕(mol ∙ dm ')0.0100.0100.0100. 020[B]o∕(mol ∙ dm~3)0.0050. 0050.0100. 005[C]o∕(mol ∙ dm~3)0.0100∙0150.0100.010解:根据1,2组实验数据,保持[A]。
[物理化学[上册]完整习题的答案解析]第五版高等教育出版社
![[物理化学[上册]完整习题的答案解析]第五版高等教育出版社](https://img.taocdn.com/s3/m/e8ac5f6ab52acfc789ebc9d3.png)
第一章 气体pVT 性质1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下:1 1TT p V p V V T V V ⎪⎪⎭⎫⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂=κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT111 )/(11-=⋅=⋅=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=T TVV p nR V T p nRT V T V V p p V α 1211 )/(11-=⋅=⋅=⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂-=p p V V pnRT V p p nRT V p V V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为mol RT pV n 623.1461815.300314.8300106.1213=⨯⨯⨯== 每小时90kg 的流量折合p 摩尔数为13353.144145.621090109032-⋅=⨯=⨯=h mol M v Cl H C n/v=(14618.623÷1441.153)=10.144小时1-3 0℃、101.325kPa 的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:33714.015.273314.81016101325444--⋅=⨯⨯⨯=⋅=⋅=m kg M RT p M V n CH CH CHρ 1-4 一抽成真空的球形容器,质量为25.0000g 。
充以4℃水之后,总质量为125.0000g 。
若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。
试估算该气体的摩尔质量。
解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρn=m/M=pV/RTmol g pV RTm M ⋅=⨯-⨯⨯==-31.301013330)0000.250163.25(15.298314.841-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。
物理化学第五版上册习题答案

物理化学第五版上册习题答案10-1 请回答下列问题:(1) 常见的亚稳定状态有哪些?为什么产生亚稳态?如何防止亚稳态的产生?(2) 在一个封闭的钟罩内,有大小不等的两个球形液滴,问长时间放置后,会出现什么现象?(3) 下雨时,液滴落在水面上形成一个大气泡,试说明气泡的形状和理由? (4) 物理吸附与化学吸附最本质的区别是什么?(5) 在一定温度、压力下,为什么物理吸附都是放热过程?答: (1) 常见的亚稳态有:过饱和蒸汽、过热液体、过冷液体、过饱和溶液。
产生这些状态的原因就是新相难以生成,要想防止这些亚稳状态的产生,只需向体系中预先加入新相的种子。
(2) 一断时间后,大液滴会越来越大,小液滴会越来越小,最终大液滴将小液滴“吃掉”,根据开尔文公式,对于半径大于零的小液滴而言,半径愈小,相对应的饱和蒸汽压愈大,反之亦然,所以当大液滴蒸发达到饱和时,小液滴仍未达到饱和,继续蒸发,所以液滴会愈来愈小,而蒸汽会在大液滴上凝结,最终出现“大的愈大,小的愈小”的情况。
(3) 气泡为半球形,因为雨滴在降落的过程中,可以看作是恒温恒压过程,为了达到稳定状态而存在,小气泡就会使表面吉布斯函数处于最低,而此时只有通过减小表面积达到,球形的表面积最小,所以最终呈现为球形。
(4) 最本质区别是分子之间的作用力不同。
物理吸附是固体表面分子与气体分子间的作用力为范德华力,而化学吸附是固体表面分子与气体分子的作用力为化学键。
43331432r133r2r13a1222r2-r12)(1?10)1?10?9?33-10-6)2?r2?r4?r=2?58.91?100.1?10 ?6?32?58.91?100.1?10 ?6?34?58.91?100.1?10 ?6?3----2?r=2?22.3?105?10 ?5?3=892 pa?3h=2?cos?r?g=2?22.3?105?10 ?5?1?789.4?9.8=0.1153 m-时,计算(1) 开始形成水滴的半径;(2) 每个水滴中所含水分子的个数。
物理化学第五版课后习题答案

第七章 电化学7-1.用铂电极电解CuCl 2溶液。
通过的电流为20 A ,经过15 min 后,问:(1)在阴极上能析出多少质量的Cu ? (2) 在阳阴极上能析出多少体积的27℃, 100 kPa 下的Cl 2(g )? 解:(1) m Cu =201560635462.F⨯⨯⨯=5.527 g n Cu =2015602F⨯⨯=0.09328 mol(2) 2C l n =2015602F⨯⨯=0.09328 mol 2C l V =00932830015100.R .⨯⨯=2.328 dm 37-2.用Pb (s )电极电解Pb (NO 3) 2溶液,已知溶液浓度为1g 水中含有Pb (NO 3) 21.66×10-2g 。
通电一段时间,测得与电解池串联的银库仑计中有0.1658g 的银沉积。
阳极区溶液质量为62.50g ,其中含有Pb (NO 3) 21.151g ,计算Pb 2+的迁移数。
解: M [Pb (NO 3) 2]=331.2098考虑Pb 2+:n 迁=n 前-n 后+n e=262501151166103312098(..)..--⨯⨯-11513312098..+0165821078682..⨯=3.0748×10-3-3.4751×10-3+7.6853×10-4 =3.6823×10-4 mol t +(Pb 2+)=4436823107685310..--⨯⨯=0.4791考虑3N O -: n 迁=n 后-n 前=11513312098..-262501151166103312098(..)..--⨯⨯=4.0030×10-3 molt -(3N O -)=4440030107658310..--⨯⨯=0.52097-3.用银电极电解AgNO 3溶液。
通电一段时间后,阴极上有0.078 g 的Ag 析出,阳极区溶液溶液质量为23.376g ,其中含AgNO 3 0.236 g 。
【物理化学上册完整习题答案】第五版

物理化学上册完整习题答案第五版第一章热力学基础习题一(a)热容量定义为物体单位质量或单位物质量的温度升高所需的热量。
它的单位是J/(g·°C)。
(b)热容量可以用以下公式来计算:Q = mcΔT,其中Q表示热量,m表示物体的质量,c表示物质的比热容,ΔT表示温度变化。
(c)水的比热容是4.18 J/(g·°C)。
(a)焓的定义是在恒定压力下,物体单位质量的温度升高所需的热量。
焓可以用以下公式来计算:H =Q/m,其中H表示焓,Q表示热量,m表示物体的质量。
(b)焓变是指在化学反应或物理过程中,物体单位质量的焓的变化。
1.辅助函数的作用是简化热力学计算过程。
它可以帮助我们计算焓、熵和自由能等。
习题二1.当物体从低温区域向高温区域传递热量时,热量会按照热流从高温区域传递到低温区域。
这个现象符合热力学第一定律,即能量守恒定律。
2.传送速率可以通过热传导定律来计算。
热传导定律可以用以下公式表示:Q = kA(ΔT/Δx),其中Q是传输的热量,k是热传导系数,A是传输的面积,ΔT是温度差,Δx是传输的距离。
3.传热的三种途径是热传导、热对流和热辐射。
习题三1.升华是指固体直接从固体相转变为气体相的过程,而不经过液体相。
凝华是指气体直接从气体相转变为固体相的过程。
2.溶解度是指溶质在溶剂中溶解所达到的最大浓度。
溶解度可以受到温度、压力和溶剂性质等因素的影响。
3.相变是指物质在一定条件下从一个相态转变为另一个相态的过程。
常见的相变包括融化、凝固、汽化、液化、升华和凝华。
第二章热力学函数习题一(a)熵是描述系统无序程度的物理量。
它的单位是J/(mol·K)。
(b)熵的变化可以通过以下公式计算:ΔS = Q/T,其中ΔS表示熵的变化,Q表示热量,T表示温度。
(a)熵增定律是指在孤立系统中,系统熵总是增加或至少保持不变。
(b)熵增定律可以用以下公式表示:ΔStotal =ΔSsystem + ΔSsurroundings ≥ 0,其中ΔStotal表示系统和周围环境的总熵变化,ΔSsystem表示系统的熵变化,ΔSsurroundings表示周围环境的熵变化。
物理化学第五版课后习题答案解析

第五章 化学平衡5-1.在某恒定的温度和压力下,取n 0﹦1mol 的A (g )进行如下化学反应:A (g )垐?噲? B (g ) 若0B μ﹦0A μ,试证明,当反应进度﹦时,系统的吉布斯函数G 值为最小,这时A ,B 间达到化学平衡。
解: 设反应进度为变量A (g )垐?噲?B (g )t ﹦0 n A , 0﹦n 0 0 0﹦0 t ﹦t 平 n A n B ﹦BBn ν n B ﹦B ,n A ﹦n 0-n B ﹦n 0-B ,n ﹦n A +n B ﹦n 0气体的组成为:y A ﹦A n n ﹦00B n n νξ-﹦01n ξ-,y B ﹦B nn﹦0n ξ各气体的分压为:p A ﹦py A ﹦0(1)p n ξ-,p B ﹦py B ﹦p n ξ各气体的化学势与的关系为:0000ln ln (1)A A AA p p RT RT p p n ξμμμ=+=+- 0000lnln B B B B p p RT RT p p n ξμμμ=+=+⋅ 由 G =n AA +n BB =(n A 0A μ+n B 0B μ)+00ln(1)A p n RT p n ξ-+00ln B p n RT p n ξ⋅ =[n 0-0A μ+0B μ]+n 00lnpRT p +00()ln(1)n RT n ξξ--+0ln RT n ξξ 因为 0B μ﹦0A μ,则G =n 0(0A μ+0lnpRT p)+00()ln(1)n RT n ξξ--+0ln RT n ξξ ,0()ln T p G RT n ξξξ∂=∂- 20,20()()T p n RT Gn ξξξ∂=-∂-<0 令 ,()0T p Gξ∂=∂011n ξξξξ==-- ﹦ 此时系统的G 值最小。
5-2.已知四氧化二氮的分解反应 N 2O 4 (g )垐?噲? 2 NO 2(g )在 K 时,0r m G ∆=·mol -1。
《物理化学》高等教育出版(第五版)第十三章胶体与大分子溶液练习题

第十三章胶体与大分子溶液练习题一、判断题:1.溶胶在热力学和动力学上都是稳定系统。
2.溶胶与真溶液一样是均相系统。
3.能产生丁达尔效应的分散系统是溶胶。
4.通过超显微镜可以看到胶体粒子的形状和大小。
5.ξ 电位的绝对值总是大于热力学电位φ的绝对值.。
6.加入电解质可以使胶体稳定,加入电解质也可以使胶体聚沉;二者是矛盾的。
7.晴朗的天空是蓝色,是白色太阳光被大气散射的结果。
8.旋光仪除了用黄光外,也可以用蓝光。
9.大分子溶液与溶胶一样是多相不稳定体系。
10.将大分子电解质NaR的水溶液与纯水用半透膜隔开,达到Donnan平衡后,膜外水的pH值将大于7。
二、单选题:1.雾属于分散体系,其分散介质是:(A) 液体;(B) 气体;(C) 固体;(D) 气体或固体。
2.将高分子溶液作为胶体体系来研究,因为它:(A) 是多相体系;(B) 热力学不稳定体系;(C) 对电解质很敏感;(D) 粒子大小在胶体范围内。
3.溶胶的基本特性之一是:(A) 热力学上和动力学上皆属于稳定体系;(B) 热力学上和动力学上皆属不稳定体系;(C) 热力学上不稳定而动力学上稳定体系;(D) 热力学上稳定而动力学上不稳定体系。
4.溶胶与大分子溶液的区别主要在于:(A) 粒子大小不同;(B) 渗透压不同;(C) 带电多少不同;(D) 相状态和热力学稳定性不同。
5.大分子溶液和普通小分子非电解质溶液的主要区分是大分子溶液的:(A) 渗透压大;(B) 丁铎尔效应显著;(C) 不能透过半透膜;(D) 对电解质敏感。
6.以下说法中正确的是:(A) 溶胶在热力学和动力学上都是稳定系统;(B) 溶胶与真溶液一样是均相系统;(C) 能产生丁达尔效应的分散系统是溶胶;(D) 通过超显微镜能看到胶体粒子的形状和大小。
7.对由各种方法制备的溶胶进行半透膜渗析或电渗析的目的是:(A) 除去杂质,提高纯度 ;(B) 除去小胶粒,提高均匀性 ;(C) 除去过多的电解质离子,提高稳定性 ;(D) 除去过多的溶剂,提高浓度 。
物理化学第五版课后习题答案

第十二章胶体化学12-1 如何定义胶体系统?总结胶体系统的主要特征。
答:(1) 胶体定义:胶体系统的主要研究对象是粒子直径d至少在某个方向上在1-100nm之间的分散系统。
(2) 胶体系统的主要特征:溶胶系统中的胶粒有布朗运动,胶粒多数带电,具有高度分散性,溶胶具有明显的丁达尔效应。
胶体粒子不能透过半透膜。
[注] 溶胶系统中的胶粒的布朗运动不是粒子的热运动,且只有溶胶才具有明显的丁达尔效应。
12-2 丁铎尔效应的实质及产生的条件是什么?答:丁铎尔现象的实质是光的散射作用。
丁铎尔效应产生的条件是分散相粒子的直径小于入射光波长、分散相与分散介质的直射率相差较大。
12-3 简述斯特恩双电层模型的要点,指出热力学电势、斯特恩(Stern)电势和ζ电势的区别。
答:斯特恩认为离子是有一定大小的,而且离子与质点表面除了静电作用外还有范德华力。
(1) 在靠近质点表面1~2个分子厚的区域内,反离子受到强烈地吸引而牢固地结合在质点表面,形成一个紧密地吸附层-斯特恩层,(2) 在斯特恩层,非离子的电性中心将形成一假想面-斯特恩面。
在斯特恩面内电势呈直线下降的变化趋势,即由质点表面的ϕ0直线下降至处的ϕs,ϕs称为斯特恩电势;(3) 其余的反离子扩散地分布在溶液中,构成双电层的扩散层部分。
在扩散层中,电势由ϕs降至零。
因此斯特恩双电层由斯特恩层和扩散层构成;(4) 当固、液两相发生相对运动时,紧密层中吸附在质点表面的反离子、溶剂分子与质点作为一个整体一起运动,滑动面与溶液本体之间的电势差,称为ζ电势。
热力学电势ϕ0是质点表面与液体内部的总的电位差,即固液两相之间双电层的总电势。
它与电极∕溶液界面的双电层总电势相似,为系统的热力学性质,在定温定压下,至于质点吸附的(或电离产生的)离子在溶液中活度有关,而与其它离子的存在与否无关。
斯特恩电势ϕs是斯特恩面与容液本体的电势差,其值与集中在斯特恩层里的正负离子的电荷总数有关,即与双电层的结构状态有关。
物理化学第五版课后习题答案

第十章 界面现象10-1 请回答下列问题:(1) 常见的亚稳定状态有哪些为什么产生亚稳态如何防止亚稳态的产生(2) 在一个封闭的钟罩内,有大小不等的两个球形液滴,问长时间放置后,会出现什么现象(3) 下雨时,液滴落在水面上形成一个大气泡,试说明气泡的形状和理由 (4) 物理吸附与化学吸附最本质的区别是什么(5) 在一定温度、压力下,为什么物理吸附都是放热过程答: (1) 常见的亚稳态有:过饱和蒸汽、过热液体、过冷液体、过饱和溶液。
产生这些状态的原因就是新相难以生成,要想防止这些亚稳状态的产生,只需向体系中预先加入新相的种子。
(2) 一断时间后,大液滴会越来越大,小液滴会越来越小,最终大液滴将小液滴“吃掉”, 根据开尔文公式,对于半径大于零的小液滴而言,半径愈小,相对应的饱和蒸汽压愈大,反之亦然,所以当大液滴蒸发达到饱和时,小液滴仍未达到饱和,继续蒸发,所以液滴会愈来愈小,而蒸汽会在大液滴上凝结,最终出现“大的愈大,小的愈小”的情况。
(3) 气泡为半球形,因为雨滴在降落的过程中,可以看作是恒温恒压过程,为了达到稳定状态而存在,小气泡就会使表面吉布斯函数处于最低,而此时只有通过减小表面积达到,球形的表面积最小,所以最终呈现为球形。
(4) 最本质区别是分子之间的作用力不同。
物理吸附是固体表面分子与气体分子间的作用力为范德华力,而化学吸附是固体表面分子与气体分子的作用力为化学键。
(5) 由于物理吸附过程是自发进行的,所以ΔG <0,而ΔS <0,由ΔG =ΔH -T ΔS ,得 ΔH <0,即反应为放热反应。
10-2 在及下,把半径为1×10-3m 的汞滴分散成半径为1×10-9m 的汞滴,试求此过程系统表面吉布斯函数变(ΔG )为多少已知时汞的表面张力为 N ·m -1。
解: 3143r π=N×3243r π N =3132r rΔG =21A A dA γ⎰=(A 2-A 1)=4·( N 22r -21r )=4·(312r r -21r )=4××(339 (110)110--⨯⨯-10-6)=J10-3 计算时时,下列情况下弯曲液面承受的附加压力。
天津大学高等教育出版社第五版《物理化学》课后习题答案第四章

天津⼤学⾼等教育出版社第五版《物理化学》课后习题答案第四章4.1有溶剂A与溶质B形成⼀定组成的溶液。
此溶液中B的浓度为c B,质量摩尔浓度为b B,此溶液的密度为。
以M A,M B分别代表溶剂和溶质的摩尔质量,若溶液的组成⽤B的摩尔分数x B表⽰时,试导出x B与c B,x B与b B之间的关系。
解:根据各组成表⽰的定义4.2D-果糖溶于⽔(A)中形成的某溶液,质量分数,此溶液在20℃时的密度。
求:此溶液中D-果糖的(1)摩尔分数;(2)浓度;(3)质量摩尔浓度。
解:质量分数的定义为4.3在25℃,1 kg⽔(A)中溶有醋酸(B),当醋酸的质量摩尔浓度b B介于和之间时,溶液的总体积求:(1)把⽔(A )和醋酸(B )的偏摩尔体积分别表⽰成b B 的函数关系。
(2)时⽔和醋酸的偏摩尔体积。
解:根据定义当时4.460℃时甲醇的饱和蒸⽓压是84.4 kPa ,⼄醇的饱和蒸⽓压是47.0 kPa 。
⼆者可形成理想液态混合物。
若混合物的组成为⼆者的质量分数各50 %,求60℃时此混合物的平衡蒸⽓组成,以摩尔分数表⽰。
解:甲醇的摩尔分数为58980049465004232500423250....x B =+=4.580℃时纯苯的蒸⽓压为100 kPa ,纯甲苯的蒸⽓压为38.7 kPa 。
两液体可形成理想液态混合物。
若有苯-甲苯的⽓-液平衡混合物,80℃时⽓相中苯的摩尔分数,求液相的组成。
解:4.6在18℃,⽓体压⼒101.352 kPa下,1 dm3的⽔中能溶解O2 0.045 g,能溶解N2 0.02 g。
现将 1 dm3被202.65 kPa空⽓所饱和了的⽔溶液加热⾄沸腾,赶出所溶解的O2和N2,并⼲燥之,求此⼲燥⽓体在101.325 kPa,18℃下的体积及其组成。
设空⽓为理想⽓体混合物。
其组成体积分数为:,解:显然问题的关键是求出O2和N2的亨利常数。
4.7 20℃下HCl 溶于苯中达平衡,⽓相中HCl 的分压为101.325 kPa 时,溶液中HCl 的摩尔分数为0.0425。
